无机化学p区元素(一)
- 格式:ppt
- 大小:13.34 MB
- 文档页数:75

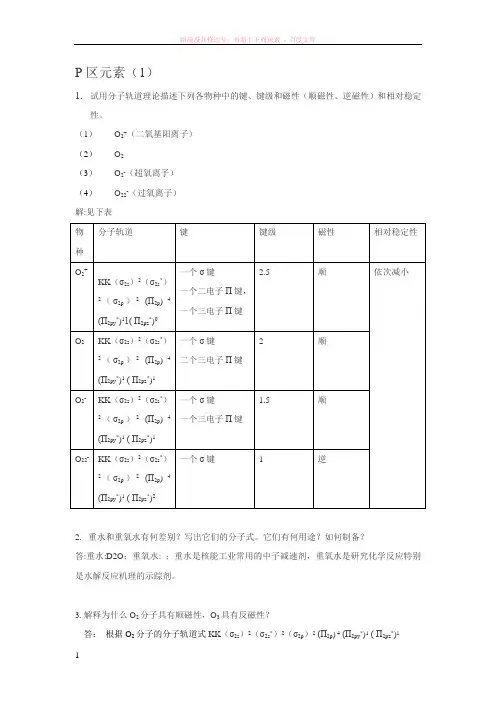
P区元素(1)1.试用分子轨道理论描述下列各物种中的键、键级和磁性(顺磁性、逆磁性)和相对稳定性。
(1)O2+(二氧基阳离子)(2)O2(3)O2-(超氧离子)(4)O22-(过氧离子)解:见下表物种分子轨道键键级磁性相对稳定性O2+KK(σ2s)2(σ2s*)2(σ2p)2(П2p)4(П2py*)11( П2pz*)0一个σ键一个二电子П键,一个三电子П键2.5 顺依次减小O2KK(σ2s)2(σ2s*)2(σ2p)2(П2p)4(П2py*)1( П2pz*)1一个σ键二个三电子П键2 顺O2-KK(σ2s)2(σ2s*)2(σ2p)2(П2p)4(П2py*)1( П2pz*)1一个σ键一个三电子П键1.5 顺O22-KK(σ2s)2(σ2s*)2(σ2p)2(П2p)4(П2py*)1( П2pz*)2一个σ键 1 逆2. 重水和重氧水有何差别?写出它们的分子式。
它们有何用途?如何制备?答:重水:D2O;重氧水: ;重水是核能工业常用的中子减速剂,重氧水是研究化学反应特别是水解反应机理的示踪剂。
3. 解释为什么O2分子具有顺磁性,O3具有反磁性?答:根据O2分子的分子轨道式KK(σ2s)2(σ2s*)2(σ2p)2(П2p) 4(П2py*)1( П2pz*)1分子中两个П2p反键轨道各有一单电子,因此它具有顺磁性。
在O3分子中,每个氧原子各用一个P轨道组成一个成键П轨道,一个反键П轨道,一个非键П轨道,其中4各P电子,两个进入成键П轨道,两个进入非键П轨道,П键键级为一,分子没有成单电子,所以分子具有反磁性。
4.在实验室怎样制备O3?它有什么重要性?5.答:在实验室里制备臭氧主要靠紫外光(<185nm)照射氧或使氧通过静电放电装置而获得臭氧与氧的混合物,含臭氧可达10%。
臭氧发生器的示意图见图13-10。
它是两根玻璃套管所组成的,中间玻璃管内壁镶有锡锚,外管外壁绕有铜线,当锡箔与铜线间接上高电压时,两管的管壁之间发生无声放电(没有火花的放电),02就部分转变成了036.7.油画放置久后为什么会发暗、发黑?为什么可用H2O2来处理?写出反应方程式。


第13章 p 区元素(一)一、选择题1.下列酸中属于一元酸的是( )。
【答案】A【解析】H 3BO 3在水中电离的方程式为:H 3BO 3 + H 2O = B (OH )4- + H +,而B (OH )4-不再电离,所以H 3BO 3为一元酸。
2.有三种氧化物,其中能与浓盐酸反应放出可以使淀粉碘化钾试纸变蓝的黄绿色气体,在硫酸介质中与溶液反应,使溶液变成紫红色,则该氧化物是( )。
【答案】D【解析】使淀粉碘化钾试纸变蓝的黄绿色气体为Cl 2;在硫酸介质中与溶液反应,使溶液变成紫红色,是因为反应生成了MnO 7-。
上述过程中,发生以下反应:PbO 2+4HCl (浓)=PbCl 2+Cl 2+2H 2O5PbO 2+2Mn 2++4H +=5Pb 2++2MnO 4-+2H 2O 3.下列氧化物酸性强弱次序中,错误的是( )。
【解析】氧化物的酸性强弱与电负性有关,电负性越大,酸性越弱。
4. ()不是CO的等电子体。
A.NOB.NO+C.N2一【答案】A【解析】等电子体是指价电子数和原子数(氢等轻原子不计在内)相同的分子、离子或基团。
5.下列无机酸中能溶解的是()。
A.HClC.HF【答案】C【解析】SiO2能与HF酸发生反应,反应方程为SiO2+4HF→SiF4+2H2O。
6.配SnCl2溶液,常在溶液中放入少量固体Sn粒。
其理由是()。
A.防止Sn2+被氧化B.防止Sn2+水解C.防止SnCl2溶液产生沉淀D.防止Sn2+溶液挥发【解析】加入Sn 粒,溶液中即使有Sn 4+生成,也能被Sn 还原。
反应式为Sn 4++ Sn = 2Sn 2+。
7.下列化合物不属子缺电子化合物的是( )。
A .BCl 3B .HBF 4C .B 2H 6D .Al (OH )3【答案】B【解析】缺电子化合物是由价电子数少于价层轨道的缺电子原子形成的化合物。
A 项和D 项是由缺电子原子与多电子原子化合物形成的配键化合物;C 项为缺电子原子与等电子原子化合形成的缺电子分子。

13.1 复习笔记一、p区元素概述1.p区元素包括了除氢以外的所有非金属元素和部分金属元素。
与s区元素相似,p区元素的原子半径在同一族中自上而下逐渐增大,它们获得电子的能力逐渐减弱,元素的非金属性也逐渐减弱,金属性逐渐增强。
除第ⅦA族和稀有气体外,p区各族元素都由明显的非金属元素过渡到明显的金属元素。
2.p区元素特征(1)各族元素性质由上到下呈现二次周期性①第二周期元素具有反常性(只有2s,2p轨道);第二周期元素单键键能小于第三周期元素单键键能。
②第四周期元素表现出异样性(d区插入),例如:溴酸、高溴酸氧化性分别比其他卤酸(HClO3,HIO3)、高卤酸(HClO4,H5IO6)强。
③最后三个元素性质缓慢地递变(d区、f区插入)。
(2)多种氧化值①p区元素的价电子构型为n s2n p1-6,具有多种氧化态。
例如:氯的氧化值有+1,+3,+5,+7,-1,0等。
②惰性电子对效应:同族元素从上到下,低氧化值化合物比高氧化值化合物变得更稳定。
(3)电负性大,形成共价化合物。
二、硼族元素1.硼族元素概述硼族元素包括B,Al,Ga,In,Tl五种元素,其价电子构型为n s2n p1,因此他们一般形成氧化值为+3的化合物。
随着原子序数的增加,形成低氧化值+1化合物的趋势逐渐增强。
硼的原子半径较小,电负性较大,所以硼的化合物都是共价型的,在水溶液中也不存在B3+。
在硼族元素化合物中形成共价键的趋势自上而下依次减弱。
(1)缺电子元素硼族元素原子的价电子轨道数为4,而其价电子只有3个,这种价电子数小于价键轨道数的原子称为缺电子元素。
它们所形成的化合物有些为缺电子化合物。
缺电子化合物的特点:易形成配位化合物HBF4;易形成双聚物Al2Cl6。
(2)硼族元素的一般性质①B是非金属单质,Al、Ga、In、Tl是金属单质;②B,Al,Ga的氧化态是+3,In的氧化态是是+1和+3,Tl的氧化态是+1;③B的最大配位数是4,Al、Ga、In、Tl 的最大配位数是6。



北师⼤考研⽆机化学复习题第⼗三章第13 章p 区元素(⼀)⼀、教学基本要求1. 了解p区元素的特点;2. 了解p区元素的存在、制备及⽤途;3. 掌握重点元素硼、铝、碳、硅、氮和磷的单质及其化合物的性质,会⽤结构理论和热⼒学解释它们的某些化学现象;4. 从⼄硼烷的结构了解缺电⼦键和硼烷结构;5. 了解⼀些⽆机材料的制备和⽤途;6.了解惰性电⼦对效应概念及其应⽤。
⼆、要点1.缺电⼦化合物 (Electron-deficient compound)具有共价性的原⼦,若其价电⼦数少于价层轨道数时,这种原⼦称为缺电⼦原⼦。
缺电⼦原⼦以共价键所形成的不具有⼋隅体结构的化合物称作缺电⼦化合物。
如:B原⼦最外层电⼦排布为:2s22p1,有3个价电⼦,但它有四个价层轨道(⼀个3s,三个3p),是缺电⼦原⼦。
当它和卤素原⼦形成BX3时,在中⼼B原⼦外围只能形成三个共⽤电⼦对(6个电⼦),它不是⼋隅结构,这类化合物就是缺电⼦化合物。
2.⾜电⼦化合物 (Electron-precise compound)指所有价电⼦都与中⼼原⼦形成化学键,并满⾜了路易斯结构要求的⼀类化合物。
第14族元素形成⾜电⼦化合物,例如甲烷分⼦CH4 , 分⼦中的键电⼦对数恰好等于形成的化学键数。
3.富电⼦化合物 (Electron-rich compound)指价电⼦对的数⽬多于化学键数⽬的⼀类化合物。
第15族⾄第17族元素形成富电⼦化合物,例如氨分⼦NH3, 4个原⼦结合只⽤了3对价电⼦,多出的两个电⼦以孤对形式存在。
4.稀散元素 (Rare element)⾃然界中不能形成独⽴矿床⽽以杂质状态分散于其他矿物中的元素,如硒、碲、锗、铟、铊等。
可由冶⾦、化⼯作业的各种粉尘、残渣或中间产品中提取。
这些元素在电⼦⼯业、原⼦能⼯业、合⾦材料、电光原材料及催化剂等⽅⾯有重要的⽤途。
5.三中⼼两电⼦键 (Three center two electron bond)它是多中⼼共价键中的⼀种,指三个原⼦共⽤两个电⼦的化学键,中⼼原⼦常为缺电⼦原⼦,例如,硼烷中就存在3e-2c的氢桥键。


转无机化学实验习题答案实验习题p区非金属元素(卤素、氧、硫)1.氯能从含碘离子的溶液中取代碘,碘又能从氯酸钾溶液中取代氯,这两个反应有无矛盾?为什么?答:这两个反应无矛盾。
因为氯的氧化性强于碘,而碘的氧化性又强于氯酸钾。
2.根据实验结果比较:①S2O82-与MnO4-氧化性的强弱;②S2O32-与I-还原性的强弱。
答:因为S2O82-可以将Mn2+氧化为MnO4-,所以S2O82-的氧化性强于MnO4-,S2O32-能将I2还原为I-,S2O32-和还原性强于I-。
3.硫代硫酸钠溶液与硝酸银溶液反应时,为何有时为硫化银沉淀,有时又为[Ag(S2O3)2]3-配离子?答:这与溶液的浓度和酸碱性有关,当酸性强时,会生成硫化银沉淀,而在中性条件下就会生成[Ag(S2O3)2]3-配离子。
4.如何区别:①次氯酸钠和氯酸钠;②三种酸性气体:氯化氢、二氧化硫、硫化氢;③硫酸钠、亚硫酸钠、硫代硫酸钠、硫化钠。
答:①分别取少量两种固体,放入试管中,然后分别往试管中加入适量水,使固体全部溶解,再分别向两支试管中滴入两滴品红溶液,使品红溶液褪色的试管中放入的固体为次氯酸钠,剩下的一种为氯酸钠。
②将三种气体分别通入品红溶液中,使品红褪色的是二氧化硫,然后将剩余的两种气体分别通入盛有KMnO4溶液的试管中,产生淡蓝色沉淀的是H2S,剩下的一种气体是氯化氢。
③分别取四种溶液放入四支试管中,然后向四支试管中分别加入适量等量的H2SO4溶液,有刺激性气味气体产生的是亚硫酸钠,产生臭鸡蛋气味气体是的硫化钠,既有刺激性气味气体产生,又有黄色沉淀产生的是硫代硫酸钠,无明显现象的是硫酸钠。
5.设计一张硫的各种氧化态转化关系图。
6.在氯酸钾和次氯酸钠的制备实验中,如果没有二氧化锰,可改用哪些药品代替地二氧化锰?答:可用高锰酸钾代替二氧化锰。
7.用碘化钾淀粉试纸检验氯气时,试纸先呈蓝色,当在氯气中放置时间较长时,蓝色褪去,为什么?答:因为2KI+Cl2=2KCl+I2,I2遇淀粉变蓝,因此试纸呈蓝色,但氯气有氧化性,可生成HClO,可以将蓝色漂白,所以在氯气中放置时间较长时,蓝色褪去。
实验名称:P区非金属元素(一)(卤素,氧,硫)实验目的:温度:气压:一、实验目的1.试验并掌握bu用氧化态氮的化合物的主要性质;2.试验磷酸盐的酸碱性和溶解性;3.掌握硅酸盐,硼酸及硼砂的主要性质;4.练习硼砂珠的有关实验操作。
二、基本操作1.试管操作1)普通试管可以直接加热装溶液时不超过试管容量的1/2,加热时不超过试管的1/3,加热时必须用试管夹夹,夹在接近试管口部位。
加热时先使试管均匀受热,然后在试管底部加热,并不断移动试管。
这时应将试管倾斜约45度,管口不要对着有人的方向。
2)主要用途①盛取液体或固体②加热少量液体或固体③制取少量气体反应器④收集少量气体用⑤溶解少量气体,液体或固体等溶质3)使用注意事项①盛取液体时容积不超过其容积的1/3②加热使用试管夹,试管口不能对着人,加热盛有固体的试管时,试管口稍向下倾斜45度③受热要均匀,以免暴沸或试管炸裂④加热后不能骤冷,防止破裂⑤加热时要预热,防止试管骤热而爆裂⑥加热时要保持试管外壁没有水珠,防止受热不均匀而爆裂⑦加热后不能在试管未冷却至室温时就洗涤试管2.硼砂珠实验(详见实验内容)三、实验内容1.铵盐的热分解(思考:为何试管可以垂直固定加热呢?)2.硝酸盐和亚硝酸盐1)亚硝酸的生成和分解2)亚硝酸的氧化性和还原性3.硝酸和硝酸盐1)硝酸的氧化性(这个方法是检验NH4+离子的一个重要方法,后面还会介绍到一种试剂:乃斯勒试剂----[HgI4]2-和OH-,若有NH4+离子,会出现红棕色沉淀)气室法检验NH4+:向装有溶液的表面皿中加入一滴40%浓碱,迅速将贴有试纸的表面皿倒扣其上,并且放在热水浴上加热。
观察红色石蕊试纸是否变为蓝色。
2)硝酸盐的热分解4.磷酸盐的性质1)酸碱性2)溶解性3)配位性5.硅酸和硅酸盐1)硅酸水凝胶的生成2)微溶性硅酸盐的生成(通过这个实验原理可让我们看到“水中花园”的现象)6.硼酸及硼酸的焰色鉴定反应1)硼酸的性质(缺电子原子是指某原子的价电子数目少于价电子轨道数)2)硼酸的鉴定反应7.硼砂珠试验1)硼砂珠的制备用盐酸清洗铂丝,然后将其置于氧化焰中灼烧片刻取出,再侵入酸中,如此反复,直至铂丝在氧化焰中灼烧不再产生例子特征的颜色,表示已经洗干净。
无机化学 p区元素p区元素是周期表中第13至18列元素,也被称为主族元素或气族元素。
它们的化学性质在同一周期内呈现出明显的变化,但在同一族内则有着相似的性质。
本文将从p区元素的发现、物理性质、化学性质和应用方面进行介绍。
一、发现历史p区元素包括第13至18列的元素,是一组很有特殊性质的元素。
人们在测定原子量和密度时陆续发现了这些元素。
在18世纪前,人们对许多p区元素的存在还没有足够的证据。
因此,这些元素也成为了化学家们探索的一个难题。
1830年代, Jons Berzelius 以三个十二面体化合物来系统地描述元素。
这些化合物即由氧、碳、氮、硫和磷的元素统一构成的,在此基础上,他将元素分成了四个区,包括酸基金属、上碲族、下碲族和稀有元素。
但当时的化学学家认为,有更多的元素应该属于上述因素中的某一组,于是 stas 和sebaste 花了 20 年时间,最终找到了人类认识的所有元素。
这一时期p区元素的最后发现是在1898年,由法国科学家Pierre Curie 发现的钋和镭。
二、物理性质1、电子配置p区元素的电子构型为 ns2np1-6(除氦He外,另有例外,即不是ns2np5,如氧O)。
其中,ns和np是主量子数。
p区元素的外层电子结构十分稳定,p区元素代表元素外层电子的数目是非常有限的,它们在化学之间的交互作用直接影响每个元素的化学适用性。
p区元素的数量相对比较少,但却具有十分丰富的化学反应性。
2、原子尺寸和电负性p区元素原子尺寸相比于同周期的s区或d区元素会比较小,但相比于前一个周期,p区元素的原子尺寸又会更加大一些。
这些原子尺寸的变化和电负性的变化有关。
氧、氮、碳等元素的电子云很大程度上影响着元素化学性质的表现。
一般来说,p区元素的电负性很高,因为它们具有较高的电子亲和能力和较高的电负性。
氨等化合物是p区元素高电负性的体现。
三、化学性质p区元素对于化学反应性的调节十分显著,同一页上的元素之间往往会显示出相似的化学性质。
P区元素习题目录一判断题;二选择题;三填空题;四完成方程式;五计算并回答问题一判断题 (返回目录)1 硼在自然界主要以含氧化合物的形式存在。
()2 在硼与氢形成的一系列共价型氢化物中,最简单的是BH3。
()3 硼酸是三元酸。
()4 硼是非金属元素,但它的电负性比氢小。
()5 由于B-O键键能大,所以硼的含氧化合物很稳定。
()6 硼砂的化学式为Na2B2O7。
()7 B2H6为平面形分子。
()8 硼是缺电子原子,在乙硼烷中含有配位键。
()9 三卤化硼熔点的高低次序为BF3<BCl3<BBr3<BI3。
()10 三卤化硼沸点的高低次序为BF3>BCl3>BBr3>BI3。
()11 地壳中丰度最大的金属元素是铝。
()12 Al2O3是两性氧化物,因而各种晶型的Al2O3既可溶于酸,又可溶于碱。
()13 只有在强酸性溶液中才有Al(H2O)63+存在。
()14 在气相中三氯化铝以双聚分子Al2Cl6的形式存在。
()15 AlX3都是共价型化合物。
()16 KAl(SO4)2·12H2O与KCr(SO4)2·12H2O属于同分异构体。
()17 在氯化氢气流中加热金属铝可制得无水AlCl3。
()19 因AlCl3分子中Al为缺电子原子,所以AlCl3中有多中心键。
()20 碳酸盐的溶解度均比酸式碳酸盐的溶解度小。
()21 Na2CO3比NaHCO3的溶解度大,同理,CaCO3比Ca(HCO3)2的溶解度也大。
()22 硅在地壳中的含量仅次于氧。
()23 分子筛是人工合成的硅铝酸盐,具有吸附和催化作用。
()24 活性炭具有吸附作用,它是颗粒状的石墨。
()25 金刚石比石墨更稳定,即使在纯氧气中,金刚石也不能燃烧。
()26 一般情况下,CO2不能助燃,但是镁在二氧化碳气体中能燃烧。
()27 高纯度的硅和锗是良好的半导体。
()28 金刚石与石墨是同素异形体,由金刚石转变为石墨的△r H>0。