丙酮碘化反应数据处理
- 格式:doc
- 大小:151.00 KB
- 文档页数:7

丙酮碘化反应速率方程的测定数据处理
丙酮碘化反应速率方程的测定数据处理可以通过以下
步骤进行:
1. 实验操作:在实验过程中,需要记录不同时间点下丙酮碘化反应的浓度变化。
可以使用紫外可见光谱法、高效液相色谱法等手段来测定浓度。
2. 数据处理:将实验数据整理成浓度-时间曲线图,并观察曲线的变化趋势。
可以发现,随着时间的推移,丙酮碘化反应的浓度逐渐降低。
3. 方程拟合:利用曲线图,可以采用多种拟合方式来得到丙酮碘化反应的速率方程。
常用的拟合方式包括线性拟合、多项式拟合、指数拟合等。
4. 方程验证:将得到的速率方程进行验证,可以通过将已知的丙酮碘化反应数据代入方程中,与实验数据进行比较,来验证方程的准确性和可靠性。
5. 应用拓展:通过得到的丙酮碘化反应速率方程,可以进一步研究该反应的动力学特性,如反应速率常数、活化能等参数,为相关领域的研究和应用提供理论支持。
需要注意的是,在进行数据处理时,应该采用适当的统计方法来分析数据,如最小二乘法、线性回归分析等。
同时,为了得到准确的结果,应该尽量减少实验误差和操作失误,
提高实验的可重复性和可操作性。


丙酮碘化数据处理在丙酮碘化反应中,丙酮和碘作为反应物,通过化学反应生成甲基碘化物和甲酸。
这个反应可以用以下方程式表示:CH3-CO-CH3 + I2 -> CH3-CO-CH2-I + HCOOH一、实验原理丙酮碘化反应是一种常见的有机化学反应,其实验原理主要基于丙酮和碘之间的相互作用。
由于丙酮分子中的碳氧双键与碘的活性较高,当丙酮与碘在酸性条件下混合时,会发生加成反应并产生甲基碘化物和甲酸。
通过控制实验条件,可以优化反应的收率和选择性。
二、实验步骤1.实验准备在实验前,需要准备好所有试剂和设备。
无水丙酮、碘、盐酸和醋酸汞等试剂需经纯化处理。
实验设备包括分液漏斗、烧杯、磁力搅拌器、砂芯漏斗、浓缩瓶等。
2.实验过程首先,将50ml无水丙酮加入烧杯中,再加入适量的碘,保持搅拌条件下滴加预先配制好的盐酸醋酸汞溶液。
然后,将反应混合物转移至砂芯漏斗中,过滤除去沉淀物。
将滤液倒入浓缩瓶中,用旋转蒸发仪蒸出丙酮和水,收集甲基碘化物和甲酸的混合物。
3.分析方法采用高效液相色谱法(HPLC)测定甲基碘化物和甲酸的含量。
色谱柱采用C18柱,流动相为甲醇-水(90:10),流速为1.0ml/min,检测波长为210nm。
通过对比标准品色谱图,可以得到样品中甲基碘化物和甲酸的含量。
三、数据处理1.数据记录在实验过程中,需要记录每个步骤的数据,包括反应时间、温度、物质的量比、产物的产量等。
这些数据对于分析实验结果和优化实验条件非常重要。
2.数据处理方法根据高效液相色谱法得到的数据,可以使用Excel或Origin等软件进行数据处理。
首先,将色谱图中的峰面积与标准品峰面积进行对比,计算出样品中甲基碘化物和甲酸的含量。
然后,根据产物的产量和投料比计算实验的收率和选择性。
3.数据处理结果通过数据处理,可以得出以下结果:a. 甲基碘化物和甲酸在样品中的含量;b. 实验的收率和选择性;c. 不同条件对实验结果的影响;d. 优化实验条件的范围等。

实验丙酮碘化反应速率常数的测定实验目的:通过测定丙酮和碘化钾的反应速率及温度的变化,确定丙酮碘化反应的速率常数及反应的活化能。
实验原理:丙酮碘化反应的化学方程式为:CH3COCH3 + I2 → CH3COCH2I + HI在反应中,碘化钾不是反应物,它仅仅是反应的催化剂。
反应过程中,丙酮作为亲核试剂参与反应,碘作为电子受体参与反应。
反应速率服从于速率方程式:v = k[CH3COCH3][I2]式中,v为反应速率,k为反应速率常数,[CH3COCH3]和[I2]为反应物的浓度。
由速率方程式可得到反应的速率常数:实验材料:1. 丙酮2. 纯净碘化钾晶体3. 磷酸铵铵水溶液4. 密闭反应瓶5. 外接冷却器6. 烧杯7. 温度计8. 支架、夹子等实验步骤:1. 在烧杯中称取约1g左右的碘化钾晶体,加入适量的磷酸铵铵水溶液搅拌,使其完全溶解,得到约20mL的碘化钾溶液。
2. 在密闭反应瓶中分别加入1mL的丙酮和8mL的碘化钾溶液,并密闭反应瓶。
3. 快速倒置反应瓶数次,将反应物充分混合,然后立即测量反应开始时的温度,并记录。
4. 在恒定的温度下反应,观察反应中溶液的颜色变化,当反应结束时,停止加热,记录反应结束时的温度。
5. 取出反应瓶,立即倒置,用冷水冷却,直到瓶壁不感觉到热度。
然后打开瓶盖,加入适量的富燃料酒精,用火焰特别小心地加热至反应彻底结束。
6. 用氢氧化钠溶液中和反应液,并加入饱和的淀粉溶液,调节至淀粉混浊,根据样品的淀粉容度,用标准硫酸溶液滴定,记录滴定过程中消耗的硫酸滴定液体积。
7. 重复以上步骤,每次改变温度,取三次数据,以平均值作为实验数据。
并制作温度与反应速率的图表。
实验结果:反应温度 t(℃) 20 30 40 50 60滴定体积 V(ml) 第一次实验 8.0 7.5 5.5 4.4 1.8第二次实验 8.1 7.8 5.7 4.5 1.5第三次实验 8.2 7.9 5.6 4.6 1.6平均值 V(ml) 8.1 7.7 5.6 4.5 1.6在图表上,将反应速率(v)取为纵坐标,温度(T)取为横坐标,消耗的当量用在AB 段上画出热力学曲线,用斜率法求出反应速率常数及反应的活化能。


实验:丙酮碘化反应的速率方程一、 目的要求1. 掌握用孤立法确定反应级数的方法2. 测定酸催化作用下丙酮碘化反应的速率常数3. 通过本实验加深对复杂反应特征的理解4. 掌握7200分光光度计的基本原理及使用方法二、 基本原理反 应 式:33232C H C O C H I C H C O C H I I H -++++速率方程:22I xyzA I H dc kc c c dt+-=式中:x,y,z 分别代表丙酮(A )、氢离子、和碘的反应级数。
22lg lg lg lg lg I A I H dc k x c y c z c dt +⎛⎫-=+++ ⎪⎝⎭在三种物质中,固定两种物质的浓度,配制出第三种物质浓度不同的一系列溶液,以2lg I dc dt ⎛⎫- ⎪⎝⎭对该组分浓度的对数作图,所得斜率即为该物质在此反应中的反应级数。
碘在可见光区有一个很宽的吸收带。
可用分光光度计测定浓度随时间的变化关系。
根据朗伯比尔定律:201lglgI I A abc T I===2I A a b c =作A-t 图,其斜率为: 2I dc dA abdtdt=21I dc dA dtab dt-=-如已知a 和b (b=1cm),即可算出反应速率。
若2A I H c c c +≈ ,发现A-t 图为一条直线,说明反应速率与碘的浓度无关,z=0,同时,可认为反应过程中A c 和H c +保持不变,对速率方程积分得:()212221x yI I AH c c kc c t t +-=-122111x y A H A A k t t ab c c +⎛⎫-= ⎪-⎝⎭ 或11x yA H dA k dt ab c c +⎛⎫=- ⎪⎝⎭ 三、 实验步骤实验温度:室温27℃1. 调试分光光度计 2. 测定吸光系数 配制0.001mol .L -1I 2-H 2O 溶液2222.547.50.0250ml ml M I H O H O ml A -−−−−−→−−−→−−−→比色皿测量容量瓶定容 由公式:2I A abc =,计算a ,其中:1b cm =3.反应溶液的配制及测定丙酮浓度不同的反应溶液:22255252.000.0210min 2.00 2.55.0507.510.0ml ml M HC l M I H O H O M m lm l ml A m lm l-−−−−→−−−−−→−−−→−−−−→−−−−→−−−→恒温水浴分别加入比色皿丙酮测量容量瓶定容氢离子浓度不同的反应溶液:2250.02 2.00 2.002.55.0507.510.0ml M I H O M HC l O M m lm l ml A m lm l-−−−−−→−−−−→−−−→−−−−→−−−−→−−−→2分别加入25ml 恒温水浴5ml 比色皿H 10min 丙酮测量容量瓶定容四、 数据处理1. 计算吸光系数由测定已知浓度碘溶液的吸光度值,计算吸光系数(2I a A =)。

实验五 丙酮碘化反应的速率方程一. 实验目的1.掌握用孤立法确定反应级数的方法;2. 测定酸催化作用下丙酮碘化反应的速率常数; 3.通过本实验加深对复杂反应特征的理解。
二. 实验原理孤立法,即设计一系列溶液,其中只有某一种物质的浓度不同,而其他物质的浓度均相同,借此可以求得反应对该物质的级数。
同样亦可得到各种作用物的级数,从而确立速率方程。
丙酮碘化是一个复杂反应,其反应式为 设丙酮碘化反应速率方程式为:zI y HCL x COCH CH I C C kC dtdC 2332⋅⋅=-(1) 式中k 为反应速率常数,指数x 、y 、z 分别为丙酮,酸和碘的反应级数。
将该式取对数后可得:2332lg lg lg lg lg I HCL OCH CH I C z C y C x k dtdC +++=⎪⎪⎭⎫⎝⎛- (2) 在上述三种物质中,固定其中两种物质的浓度,配置第三种物质浓度不同的一系列溶液,则反应速率只是该物质浓度的函数。
以lg(-dC 碘/dt)对该组分浓度的对数作图,所得直线即为该物质在此反应中的反应级数。
同理,可得其他两个物质的反应级数。
碘在可见光区有很宽的吸收带,可用分光光度计测定反应过程中碘浓度随时间变化 的关系。
按照比尔定律可得:20lg lg A I abC I I T =⎪⎪⎭⎫⎝⎛-=-= (3) 式中A 为吸光度,T 为透光率,I 和I 0分别为某一特定波长的光线通过待测溶液和空白溶液后的光强,a 为吸光系数,b 为样品池光径长度,以A 对时间t 作图,斜率为ab(-dC 碘/dt).测得a 和b ,可算出反应速率。
若C 丙酮≈C HCl ﹥﹥C 碘 ,发现A 对t 作图后得一直线。
显然只有在(-dC 碘/dt)不随时间改变时才成立,意味着反应速率与碘的浓度无关,从而得知该反应对碘的级数为零。
当控制碘为变量时,反应过程中可认为丙酮和盐酸的浓度不变,又因为z 为0,则由(2)积分可得: 将(3)代入后可得:三. 仪器与试剂722分光光度计 1套 丙酮标准液 (2.mol ·dm -3)超级恒温槽 1套 HCl 标准液 (1.9355mol ·dm -3)秒表 1块 I 2标准液 (0.01 mol ·dm -3)容量瓶(25ml) 7个刻度移液管(5 ml)各3支四.实验步骤1.打开分光光度计,将波长调至470nm处;2.用蒸馏水作为参比溶液,反复将分光光度计调整0T、100T;3.用分光光度计测量ab的数值以便于算出反应速率;即测0.001mol/l碘液的吸光度;加入一半碘液时开始按下秒表计时,1#、3#大约每隔1min记一组数据,其他组每隔30s 记一组数据。
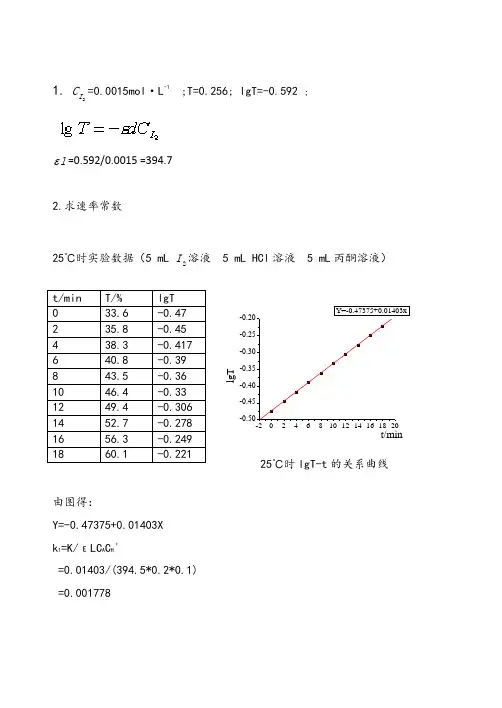
1. 2I C =0.0015mol ·L -1 ;T=0.256; lgT=-0.592 ;l =0.592/0.0015 =394.72.求速率常数25℃时实验数据(5 mL 2I 溶液 5 mL HCl 溶液 5 mL 丙酮溶液)l g Tt/min25℃时lgT-t 的关系曲线由图得:Y=-0.47375+0.01403X k 1=K/εLC A C H ﹢=0.01403/(394.5*0.2*0.1) =0.00177830℃时实验数据(5 mL 2I 溶液 5 mL HCl 溶液 5 mL 丙酮溶液)l g Tt/min30℃时lgT-t 的关系曲线(由于第一组数据偏差啊较大,故计算时舍去)由图得:Y=-0.56496+0.02477X k 2=K/εLC A C H ﹢=0.02477/(394.5*0.2*0.1) =0.0031393.活化能的计算:T1=25.0℃=298K T2=30.0℃=303KR=8.314 J/(K*mol)k1=0.001778k2=0.003139综上带入数据得=[8.314 x 298 x 303/(303-298)] ln(0.03139/0.01778)=85342.3 J4.反应级数的测定I溶液 5 mL HCl溶液 5 mL丙酮溶液)所测实实验一:25℃(5 mL2验数据列表l n Tt/min根据上述数据画得lnT-t 的关系曲线由图得:Y=-1.09047+0.03223Xr 1=0.03223实验二: 25℃ (5 mL 2I 溶液5 mL HCl 溶液 10 mL 丙酮溶液)所测实验数据列表L n Tt/min根据上述数据画得lnT-t 的关系曲线 由图得:Y=-0.81913+0.06279X r 2=0.06279实验三: 25℃ (5 mL 2I 溶液 10 mL HCl 溶液 5 mL 丙酮溶液)所测实验数据列表l n Tt/min根据上述数据画得lnT-t 的关系曲线 由图得:Y=-1.04953+0.06205X r 3=0.062058实验四: 30℃(5 mL 2I 溶液 5 mL HCl 溶液 5 mL 丙酮溶液)所测实验数据列表L n Tt/min根据上述数据画得lnT-t 的关系曲线由图得:Y=-1.26449+0.05231Xr4=0.05231m=( ln r2 /r1) /lnc a (2)/c a(1)=ln(0.06279/0.03223) / ln(0.4/0.2)=1x=( ln r3 /r1) / lnc H﹢(3)/c H﹢(1)=ln(0.062058/0.03223) / ln(0.2/0.1)=1根据实验三的数据,且r=kc m(CH3COCH3)c n(I2)c x(H+) 解之得n=-1。
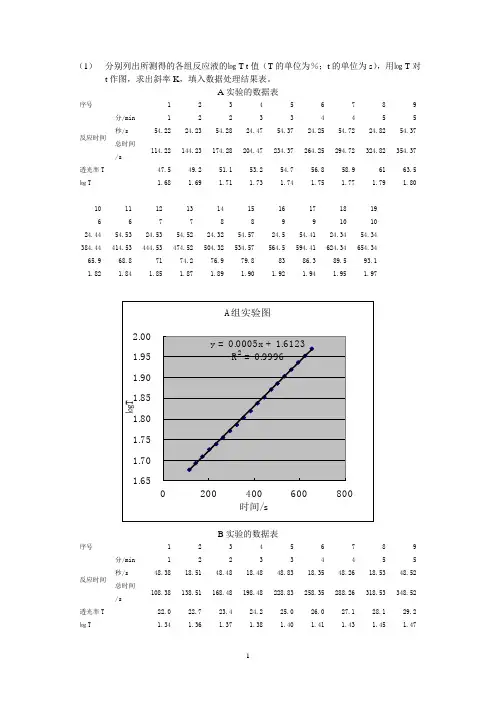
(1)分别列出所测得的各组反应液的㏒T-t值(T的单位为%;t的单位为s),用㏒T对t作图,求出斜率K,填入数据处理结果表。
A实验的数据表序号 1 2 3 4 5 6 7 8 9反应时间分/min 1 2 2 3 3 4 4 5 5 秒/s 54.22 24.23 54.28 24.47 54.37 24.25 54.72 24.82 54.37 总时间/s114.22 144.23 174.28 204.47 234.37 264.25 294.72 324.82 354.37透光率T 47.5 49.2 51.1 53.2 54.7 56.8 58.9 61 63.5 ㏒T 1.68 1.69 1.71 1.73 1.74 1.75 1.77 1.79 1.8010 11 12 13 14 15 16 17 18 196 67 78 89 9 10 1024.44 54.53 24.53 54.52 24.32 54.57 24.5 54.41 24.34 54.34384.44 414.53 444.53 474.52 504.32 534.57 564.5 594.41 624.34 654.3465.9 68.8 71 74.2 76.9 79.8 83 86.3 89.5 93.11.82 1.84 1.85 1.87 1.89 1.90 1.92 1.94 1.95 1.97B实验的数据表序号 1 2 3 4 5 6 7 8 9反应时间分/min 1 2 2 3 3 4 4 5 5 秒/s 48.38 18.51 48.48 18.48 48.83 18.35 48.26 18.53 48.52 总时间/s108.38 138.51 168.48 198.48 228.83 258.35 288.26 318.53 348.52透光率T 22.0 22.7 23.4 24.2 25.0 26.0 27.1 28.1 29.2 ㏒T 1.34 1.36 1.37 1.38 1.40 1.41 1.43 1.45 1.4710 11 12 13 14 15 16 17 18 19 206 67 78 89 9 10 10 1118.53 48.45 18.51 48.45 18.32 48.54 18.35 48.49 18.24 48.32 18.67378.53 408.45 438.51 468.45 498.32 528.54 558.35 588.49 618.24 648.32 678.6730.1 30.9 32.0 33.1 34.4 35.7 37.0 38.4 39.7 41.3 42.91.48 1.49 1.51 1.52 1.54 1.55 1.57 1.58 1.60 1.62 1.6321 22 23 24 25 26 27 28 29 30 3111 12 12 13 13 14 14 15 15 16 1648.32 18.45 48.51 18.52 48.45 18.52 48.52 18.42 48.51 18.52 48.05708.32 738.45 768.51 798.52 828.45 858.52 888.52 918.42 948.51 978.52 1008.0544.5 46.3 47.9 49.8 51.6 53.4 55.3 57.6 59.6 61.4 63.81.65 1.67 1.68 1.70 1.71 1.73 1.74 1.76 1.78 1.79 1.8032 33 34 35 36 37 38 39 40 41 4217 17 18 18 19 19 20 20 21 21 2218.23 48.29 18.32 48.32 18.29 48.29 18.3 48.35 18.37 48.43 18.3 1038.23 1068.29 1098.32 1128.32 1158.29 1188.29 1218.3 1248.35 1278.37 1308.43 1338.366.0 68.6 70.7 73.4 75.9 78.3 81.0 83.7 86.5 89.4 92.31.82 1.84 1.85 1.87 1.88 1.89 1.91 1.92 1.94 1.95 1.97C实验的数据表序号 1 2 3 4 5 6 7 8 9反应时间分/min 1 2 2 3 3 4 4 5 5 秒/s 50.20 20.30 50.42 20.32 50.15 20.27 50.37 20.43 50.30 总时间/s110.2 140.3 170.42 200.32 230.15 260.27 290.37 320.43 350.3透光率T 11.0 11.3 11.7 12.1 12.5 12.8 13.1 13.7 14.2 ㏒T 1.04 1.05 1.07 1.08 1.10 1.11 1.12 1.14 1.1510 11 12 13 14 15 16 17 18 19 206 67 78 89 9 10 10 11 20.59 50.40 20.40 50.24 20.37 50.33 20.43 50.37 20.33 50.24 20.33 380.59 410.4 440.4 470.24 500.37 530.33 560.43 590.37 620.33 650.24 680.3314.7 15.3 15.9 16.3 17.0 17.6 18.3 18.8 19.6 20.4 21.31.17 1.18 1.20 1.21 1.23 1.25 1.26 1.27 1.29 1.31 1.3321 22 23 24 25 26 27 28 29 30 3111 12 12 13 13 14 14 15 15 16 16 50.40 20.06 50.37 20.40 50.30 20.32 50.47 20.33 50.68 20.40 50.21 710.4 740.06 770.37 800.4 830.3 860.32 890.47 920.33 950.68 980.4 1010.2122.0 22.9 23.5 24.8 25.7 26.7 27.6 28.8 29.9 31.0 32.21.34 1.36 1.37 1.39 1.41 1.43 1.44 1.46 1.48 1.49 1.5132 33 34 35 36 37 38 39 40 4117 17 18 18 19 19 20 20 21 2120.30 50.03 20.30 50.40 23.30 50.12 20.33 50.30 20.33 50.30 1040.3 1070.03 1100.3 1130.4 1163.3 1190.12 1220.33 1250.3 1280.33 1310.333.2 34.3 35.4 36.5 37.8 39.2 40.5 41.9 43.2 44.61.52 1.54 1.55 1.56 1.58 1.59 1.61 1.62 1.64 1.6542 43 44 45 46 47 48 49 50 5122 22 23 23 24 24 25 25 26 2620.37 50.71 20.33 50.53 20.40 50.30 20.09 50.30 20.93 50.33 1340.37 1370.71 1400.33 1430.53 1460.4 1490.3 1520.09 1550.3 1580.93 1610.3346.4 47.6 49.3 51.0 52.3 53.8 54.4 57.4 59.5 61.71.67 1.68 1.69 1.71 1.72 1.73 1.74 1.76 1.77 1.7952 53 54 55 56 57 5827 27 28 28 29 29 3020.37 50.30 20.37 50.33 20.33 50.30 20.301640.37 1670.3 1700.37 1730.33 1760.33 1790.3 1820.363.2 64.9 66.5 68.9 70.6 73.0 75.01.80 1.81 1.82 1.84 1.85 1.86 1.88D实验的数据表序号 1 2 3 4 5 6 7 8 9反应时间分/min 1 2 2 3 3 4 4 5 5 秒/s 40.21 10.34 40.31 10.31 40.53 10.44 40.37 10.47 40.31 总时间/s100.21 130.34 160.31 190.31 220.53 250.44 280.37 310.47 340.31透光率T 20.2 20.7 21.0 21.5 22.0 22.5 22.7 22.9 23.4 ㏒T 1.31 1.32 1.32 1.33 1.34 1.35 1.36 1.36 1.3710 11 12 13 14 15 16 17 18 196 67 78 89 9 10 1010.31 40.34 10.31 40.31 10.25 40.31 10.28 40.34 10.31 40.28370.31 400.34 430.31 460.31 490.25 520.31 550.28 580.34 610.31 640.2823.8 24.2 24.7 25.3 25.7 26.3 26.8 27.3 27.8 28.41.38 1.38 1.39 1.40 1.41 1.42 1.43 1.44 1.44 1.4520 21 22 23 24 25 26 27 28 2911 11 12 12 13 13 14 14 15 1510.37 40.31 10.34 40.34 10.38 40.31 10.22 40.34 10.47 40.31670.37 700.31 730.34 760.34 790.38 820.31 850.22 880.34 910.47 940.3128.9 29.5 30.1 30.7 31.2 31.9 32.5 33.1 33.7 34.41.46 1.47 1.48 1.49 1.49 1.50 1.51 1.52 1.53 1.5430 31 32 33 34 35 36 37 38 3916 16 17 17 18 18 19 19 20 20 10.31 40.28 10.16 40.34 10.31 40.44 10.28 40.31 10.28 40.28 970.31 1000.28 1030.16 1060.34 1090.31 1120.44 1150.28 1180.31 1210.28 1240.2835.1 35.8 36.6 37.3 38.1 38.8 39.6 40.5 41.3 42.21.55 1.55 1.56 1.57 1.58 1.59 1.60 1.61 1.62 1.6340 41 42 43 44 45 46 47 48 4921 21 22 22 23 23 24 24 25 2510.57 40.16 10.37 40.41 10.37 40.34 10.44 40.34 10.31 40.41 1270.57 1300.16 1330.37 1360.41 1390.37 1420.34 1450.44 1480.34 1510.31 1540.4143.0 44.0 44.8 45.9 46.7 47.7 48.8 49.7 50.7 51.71.63 1.64 1.65 1.66 1.67 1.68 1.69 1.70 1.71 1.7150 51 52 53 54 55 56 57 5826 26 27 27 28 28 29 29 3010.34 40.31 10.28 40.66 10.31 40.31 10.47 40.34 10.301570.34 1600.31 1630.28 1660.66 1690.31 1720.31 1750.47 1780.34 1810.352.7 53.6 54.8 55.7 56.7 57.8 59.2 60.0 60.91.72 1.73 1.74 1.75 1.75 1.76 1.77 1.78 1.78E实验的数据表序号 1 2 3 4 5 6 7 8 9反应时间分/min 1 2 2 3 3 4 4 5 5 秒/s 44.20 14.64 44.27 14.64 44.34 14.52 44.55 14.33 44.33 总时间/s104.20 134.64 164.27 194.64 224.34 254.52 284.55 314.33 344.33透光率T 23.6 24.9 26.3 27.5 28.9 30.4 32.1 33.9 35.6 ㏒T 1.37 1.40 1.42 1.44 1.46 1.48 1.51 1.53 1.5510 11 12 13 14 15 16 17 18 19 206 67 78 89 9 10 10 11 14.29 44.83 14.33 44.52 14.29 44.33 14.29 44.52 14.46 44.58 14.43 374.29 404.83 434.33 464.52 494.29 524.33 554.29 584.52 614.46 644.58 674.4337.7 39.8 42.0 44.4 46.9 49.4 52.2 55.0 58.0 61.1 64.61.58 1.60 1.62 1.65 1.67 1.69 1.72 1.74 1.76 1.79 1.8121 22 23 24 25 26 2711 12 12 13 13 14 1444.33 14.36 44.43 14.36 44.52 14.52 44.50704.33 734.36 764.43 794.36 824.52 854.52 884.5067.8 71.8 75.4 79.9 83.3 87.7 92.01.83 1.86 1.88 1.90 1.92 1.94 1.96F实验的数据表序号 1 2 3 4 5 6 7 8 9反应时间分/min 1 2 2 3 3 4 4 5 5 秒/s 42.45 12.20 42.30 12.42 42.30 12.29 42.35 12.23 42.42 总时间/s102.45 132.20 162.30 192.42 222.30 252.29 282.35 312.23 342.42透光率T 19.6 20.1 20.6 20.9 21.3 21.6 22.0 22.4 22.8 ㏒T 1.29 1.30 1.31 1.32 1.33 1.33 1.34 1.35 1.3610 11 12 13 14 15 16 17 18 19 206 67 78 89 9 10 10 11 12.48 42.31 12.30 42.42 12.23 42.30 12.30 42.35 12.32 42.38 12.83 372.48 402.31 432.30 462.42 492.23 522.30 552.30 582.35 612.32 642.38 672.8323.4 23.8 24.4 24.8 25.2 25.8 26.4 27.0 27.9 28.5 28.8 1.37 1.38 1.39 1.39 1.40 1.41 1.42 1.43 1.45 1.45 1.4621 22 23 24 25 26 27 28 29 3011 12 12 13 13 14 14 15 15 1642.89 12.95 42.26 12.67 42.45 12.35 42.95 12.98 42.80 12.38702.89 732.95 762.26 792.67 822.45 852.35 882.95 912.98 942.80 972.3829.2 29.9 30.5 31.2 32.0 32.6 33.3 34.0 34.9 35.91.47 1.48 1.48 1.49 1.51 1.51 1.52 1.53 1.54 1.5631 32 33 34 35 36 37 38 39 4016 17 17 18 18 19 19 20 20 2142.38 12.70 42.29 12.35 42.89 12.95 42.45 12.42 42.29 12.38 1002.38 1032.70 1062.29 1092.35 1122.89 1152.95 1182.45 1212.42 1242.29 1272.3836.7 37.2 37.8 38.5 39.2 39.9 40.9 41.7 42.5 43.61.56 1.57 1.58 1.59 1.59 1.60 1.61 1.62 1.63 1.6441 42 43 44 45 46 47 48 4921 22 22 23 23 24 24 25 2542.42 12.29 42.48 12.69 42.42 12.42 42.42 12.76 42.131302.42 1332.29 1362.48 1392.69 1422.42 1452.42 1482.42 1512.76 1542.1344.4 45.0 45.6 46.7 47.5 48.5 49.2 50.3 50.91.65 1.65 1.66 1.67 1.68 1.69 1.69 1.70 1.7150 51 52 53 54 55 56 57 5826 26 27 27 28 28 29 29 3012.38 42.35 12.54 42.17 12.57 42.07 12.32 42.67 12.351572.38 1602.35 1632.54 1662.17 1692.57 1722.07 1752.32 1782.67 1812.3552.2 52.9 53.7 54.7 55.4 56.3 57.3 58.7 59.61.72 1.72 1.73 1.74 1.74 1.75 1.76 1.77 1.78G实验的数据表序号 1 2 3 4 5 6 7 8 9反应时间分/min 1 2 2 3 3 4 4 5 5 秒/s 37.31 7.35 37.35 7.63 37.29 2.29 37.29 7.26 37.38 总时间/s97.31 127.35 157.35 187.63 217.29 242.29 277.29 307.26 337.38透光率T 24.1 25.4 26.7 28.1 29.7 31.2 32.9 34.7 36.8 ㏒T 1.38 1.40 1.43 1.45 1.47 1.49 1.52 1.54 1.5710 11 12 13 14 15 16 17 18 196 67 78 89 9 10 107.38 37.26 7.29 37.60 7.29 37.63 7.35 37.29 7.86 37.29367.38 397.26 427.29 457.60 487.29 517.63 547.35 577.29 607.86 637.2938.6 40.6 42.9 45.4 47.7 50.5 52.9 55.9 59.4 62.41.59 1.61 1.63 1.66 1.68 1.70 1.72 1.75 1.77 1.8020 21 22 23 24 25 26 2711 11 12 12 13 13 14 147.54 37.35 7.87 37.30 7.50 37.52 7.50 37.50667.54 697.35 727.87 757.30 787.50 817.52 847.50 877.5065.8 69.3 72.9 76.8 80.7 85.1 89.2 93.61.82 1.84 1.86 1.89 1.91 1.93 1.95 1.97数据处理结果表编码 A B C D E F GK/s–¹0.0005 0.0005 0.0005 0.0003 0.0008 0.0003 0.0008㏒K -3.301029996 -3.301 -3.301 -3.5229-3.0969-3.5229-3.0969c丙/(mol·L–¹) 0.2 0.2 0.2 0.1 0.3 0.2 0.2㏒c丙-0.698970004 -0.699 -0.699 -1 -0.5229-0.699 -0.699c酸/(mol·L–¹) 0.2 0.2 0.2 0.2 0.2 0.1 0.3㏒c酸-0.698970004 -0.699 -0.699 -0.699 -0.699 -1 -0.5229c碘/(mol·L–¹) 0.001 0.002 0.003 0.002 0.002 0.002 0.002㏒c碘-3 -2.699 -2.5229-2.699 -2.699 -2.699 -2.699k/(mol–¹·Ls–¹)k j 2.53116E-062.5E-062.5E-061.1E-065.2E-061.1E-065.2E-06 平均2.89394E-06(2)以斜率对浓度作双对数图,从其斜率可求得反应对各物质的反应级数x、y、z.11浓度mol/L 0.002时间/min透光度T 吸光度Aξ b5 18.1 0.742 10 18.2 0.740 15 18.4 0.735 平均18.20.740 369.964物质种类 反应级数 丙酮 0.876 酸 0.876碘。

丙酮碘化反应一、实验目的(1)通过实验加深对复杂反应特征的理解。
(2)测定酸催化时丙酮碘化反应的速率常数。
(3)掌握72光栅分光光度计的使用方法。
二、实验原理不同的化学反应其反应机理是不相同的。
按反应机理的复杂程度之不同可以将反应分为基元反应(简单反应)和复杂反应两种类型。
简单反应是由反应物粒子经碰撞一步就直接生成产物的反应。
复杂反应不是经过简单的一步就能完成的,而是要通过生成中间产物的许多步骤来完成的,其中每一步都是一个基元反应。
常见的复杂反应有对峙反应(或称可逆反应,与热力学中的可逆过程的含义完全不同)。
平行反应和连续反应等。
丙酮碘化反应是一复杂反应,反应方程式为:H+是催化剂,由于反应本身能生成H+,所以,这是一个自动催化反应。
一般认为该反应的反应机理包括下列两步:这是一个连续反应。
反应(1)是丙酮的烯醇化反应,它是一个可逆反应,进行得很慢。
反应(2)是烯醇的碘化反应,它是一个快速且能进行到底的反应。
由于反应(1)速率很慢,而反应(2)的速率又很快,中间产物烯醇一旦生成又马上消耗掉了。
根据连续反应的特点,该反应的总反应速率由反应(1)所决定,其反应的速率方程可表示为:式中CA为丙酮的浓度;C D为产物碘化丙酮的浓度;CH+为氢离子的浓度;K为丙酮碘化反应的总的速率常数。
由反应(2)可知,如果测得反应过程中各时间碘的浓度,就可以求出。
由于碘在可见光区有一个比较宽的吸收带,所以本实验可采用分光光度法来测定不同时刻反应物的浓度。
若在反应过程中,丙酮的浓度为0.1~0.6mol·dm-3,酸的浓度为0.05~0.5mol·dm-3时,可视丙酮与酸的浓度为常数。
将(3)式积分得:按朗怕-比耳定律,若指定波长的光通过碘溶液后光强为I,通过蒸馏水后的光强为I0,则透光率可表示为:并且透光率与碘的浓度有如下关系:式中,l为比色皿光径长度;K',是取10为底的对数时的吸收系数。
又因,积分后可得:将式(5)、(6)代入式(4)中整理后得:或:式中,K'l“可通过测定一已知浓度的碘溶液的透光率T代入式(5)而求得。
实验报告: 丙酮碘化实验刘祯科 2003012316 生物32同组实验者姓名 程磊实验日期:2005年10月22日 提交报告日期:2005年11月5日1. 引言大多数化学反应是由若干个基元反应组成的复合反应,其反应速率与反应物浓度的关系不遵循质量作用定律。
这些反应的速率方程需要在一定条件下通过实验测定。
对于反应物单一的反应,可以通过测量反应物或产物浓度随时间的变化来得到反应速率,从而进一步确定反应的级数。
对于反应物不单一的反应,可以保持其他反应物浓度不变,测量某一反应物在不同初始浓度下的反应速率,从而确定反应对该物质的反应级数。
如此类推,可以依次确定其他物质的反应级数,从而确定反应速率方程。
本实验采用分光光度法测定丙酮碘化反应的级数、速率系数和活化能。
通过实验加深对复合反应特征的理解,并掌握722S 型分光光度计的原理和使用方法。
具体实验原理请参见预习报告的实验原理部分。
2. 实验部分2.1实验药品与仪器: 实验药品:0.02486mol/L 碘溶液 1.061mol/L 盐酸溶液 3.381mol/L 丙酮溶液 去离子水 实验仪器: 表. 1 实验仪器2.2实验条件:室温:17.7℃ 大气压:103.5kPa2.3实验操作:请参见预习报告的实验步骤部分。
3. 结果与讨论仪 器 名 称 规 格 生产厂家 数 量 722S 型分光光度计 上海精密科学仪器有限公司 1 SL-1恒温槽 清华大学化学实验中心1 计算机 1 镊子 1 洗瓶1 刻度移液管 10ml 1 刻度移液管 5ml 3 移液管 5ml 1 容量瓶25ml13.1原始数据以及数据处理、结果3.1.1碘标准液的光密度0.02486mol/L碘溶液取2.5ml于25ml容量瓶中配得:0.02486mol/L的碘标准液,即C(I2)= 0.002486mol/L由分光光度计测得碘标准液的光密度为:D=0.355根据碘标准液的浓度和光密度,利用εL=D/C(I2)公式计算得到εL=142.8L/mol3.1.2五组实验不同的条件:在25℃下测4组不同浓度配比反应液的反应速率,在35℃下测定1组浓度配比与前4组之一相同的反应液的反应速率。
物理化学实验报告实验名称:丙酮碘化反应******学号:***********班级:10级制药班序号:20同组者:杨柳一、实验目的1.掌握微分法测定反应级数及速率常数的方法、原理。
2.加深对复杂反应特征的理解。
3.熟悉分光光度计的使用方法。
二、基本原理丙酮在酸性溶液中的碘化反应如下:CH3COCH3 + I2——> CH3COCH2I + I2(1)实验证明,该反应是复杂反应,反应速率除了与反应物浓度有关外,还与H+浓度有关。
设反应的动力学方程为:r = —dC I2dt= kCαCH3COCH3C HCIβC I2γ(2)式(2)中, r为反应的速率;[CH3COCH3] 、[I2] 和[H+]分别为丙酮、碘和氢离子在时间t时的浓度;α、β和γ分别为丙酮、碘和氢离子的反应级数;k为反应的速率常数。
实验研究表明,除非在很高的酸度下,丙酮碘化反应的速率才与碘的浓度有关。
在一般的酸度条件下,反应的速率与碘的浓度无关,即β0,此时,式(2)可以简化成:r = —d[I2]dt= K[CH3COCH3] α[H+]γ(3)式(2)、式(3)是假设丙酮仅发生一元碘化(如反应式1)而得到的。
事实上,丙酮不仅可以发生一元碘化反应,而且还可以发生更深的碘化反应,致使反应过程趋于复杂。
为了避免这一现象的发生,可以控制碘的浓度远远小于丙酮和H+离子的浓度,由于碘的浓度小,更深的碘化反应就基本上可以避免。
同时在反应进行的全过程中,丙酮和H +离子的浓度变化很小,可以忽略不计。
根据朗伯——比尔定律,碘溶液对单色光的吸收遵循下列关系:lgT = lg II 0= —εbc = —A (4)式中:T 为透光率;A 为吸光度;I 和I0分别为某一定波长的光线通过待测溶液和空白溶液后的光强;ε为摩尔吸收系数;b 为比色皿光径长度。
在一定条件下,ε和b 为常数,保持丙酮和酸的溶度不变,由(1)得:C I2= kC αCH3COCH3C HCI βt + B (5)将(4)带入(5)得:lgT = k εC αCH3COCH3C HCI βt + B (6)以lgT 对t 作图,其斜率为k εC αCH3COCH3C HCI β,εb 可通过测定一已知溶度的碘溶液的透光率求得,当C CH3COCH3C HCI 已知时,则可以算出反应的总速率常数K 。
丙酮碘化反应速率常数的测定在化学领域里,丙酮碘化反应速率常数的测定是一个重要而且常见的实验。
该实验通常通过测定反应物消耗或生成物浓度的变化来确定反应速率常数。
在本文中,我们将探讨丙酮碘化反应速率常数的测定方法,以及其在化学研究和工业生产中的重要性。
一、实验原理丙酮和碘化钾在酸性条件下发生反应,生成碘化丙酮和碘。
该反应可以用下面的化学方程式表示:CH3COCH3 + I2 -> CH3COCH2I + HI实验中,通常使用淀粉指示剂来检测碘的生成。
碘和淀粉形成的深蓝色络合物可以很容易地观察到。
通过测定深蓝色络合物的消失时间或者测定反应物和生成物浓度随时间的变化,可以确定丙酮碘化反应的速率常数。
二、实验步骤1. 首先准备好所需的试剂和设备,包括丙酮、碘化钾、稀盐酸、淀粉溶液、试管等。
2. 将一定量的丙酮、碘化钾和盐酸混合在试管中,同时加入少量的淀粉溶液作为指示剂。
3. 记录深蓝色络合物的生成的时间,或者记录反应物和生成物的浓度随时间的变化。
4. 根据实验数据,利用反应速率的定义来计算丙酮碘化反应的速率常数。
三、实验数据处理在实验中测得的数据要经过一些处理才能得到反应速率常数。
可以使用不同的方法,比如线性拟合、曲线拟合等,来处理数据以求得较为准确的速率常数。
四、实验应用丙酮碘化反应速率常数的测定不仅可以帮助我们理解化学反应动力学,还可以在工业生产中有重要的应用。
比如在医药制备、化工生产等领域,对反应速率常数的准确测定可以帮助优化生产工艺,提高产品质量和产量。
五、个人观点从事化学研究多年,我深知丙酮碘化反应速率常数的测定对于了解化学反应动力学以及在工业生产中的重要性。
在日常实验和工作中,我一直都非常重视丙酮碘化反应速率常数的准确定量测定,以便更好地理解和应用化学知识。
总结回顾通过本文的介绍,我们了解了丙酮碘化反应速率常数的测定方法及其在化学研究和工业生产中的重要性。
我们还讨论了实验原理、步骤、数据处理和应用,以及个人观点。
丙酮碘化反应动力学测定——光度法一、实验目的1、 通过本实验加深对复杂反应特征的理解;2、 掌握用孤立法确定反应级数的方法;3、 学会用分光光度计测定酸催化作用下丙酮碘化反应的速率常数;4、 掌握TU-1810型分光光度计的使用和校正方法,实验数据的作图处理方法;二、实验原理丙酮碘化的方程式为:+-33232CH COCH +I CH COCH I+H +I →该反应是以+H 作为催化剂,同时反应自身会生成+H ,所以此反应是一个自动催化反应,并且为一个复杂反应,分两步进行:+3332CH COCH +H CH COH=CH → (1)+-32232CH COH=CH I CH COCH I+H +I +→ (2)(1)式为丙酮的烯醇化反应,反应可逆并进行的很慢,是一个速控步,决定反应的总速率;(2)式为烯醇的碘化反应,反应快速并能进行到底。
总反应的速率方程为:2+I A H d d c kc c t-=如果丙酮和酸相对于碘是过量的,则可认为在反应过程中丙酮和酸的浓度基本保持不变,同时,在酸的浓度不太大时,丙酮碘化反应对碘是零级反应。
对上式进行积分得:+2I A H B c kc c t -=+因为碘在可见光区有宽的吸收带,而在此吸收带中,盐酸,丙酮,碘化丙酮和碘化钾溶液均没有明显的吸收,所以可以采用分光光度法直接测量碘浓度的变化。
由朗伯—比尔定律A Lc ε=,得+A H A B k Lc c t ε=--上式中的L ε可通过测定一定浓度的碘溶液的吸光度A 带入式中求得。
做A-t 图,直线的斜率可求出丙酮碘化反应速率常数k 值。
有两个以上温度下的速率常数就可以根据阿仑尼乌斯公式211211R T T a E k k ⎛⎫=- ⎪⎝⎭即可估算出反应的活化能E a 的值。
三、仪器与试剂TU-1810光度计和计算机1台比色管(50mL) 3只恒温槽1套比色皿1只移液管4只0.050 mol/L、0.0050 mol/L碘溶液(含4%KI) 2 mol/L标准盐酸溶液2 mol/L标准丙酮溶液四、实验步骤1.准备工作(1)开启恒温水浴,控制温度为30℃(或35℃)。
丙酮碘化反应
物理化学实验报告2010-05-09 18:29:22 阅读70 评论0 字号:大中小订阅
一、实验目的
1.利用分光光度计测定酸催化时丙酮碘化反应的反应级数、速度常数;
2.掌握分光光度计的使用方法;
二、实验原理
丙酮碘化反应是一复杂反应,反应方程式为:
H+是反应的催化剂,因丙酮碘化反应本身有H+生成,所以,这是一个自动催化反应,又因为反应并不停留在生成一元碘化丙酮上,反应还继续下去。
所以应选择适当的反应条件,测定初始阶段的反应。
因碘溶液在可见光区有宽的吸收带,而在此吸收带中盐酸、丙酮、碘化丙酮和碘化钾溶液则没有明显的吸收,所以可采用分光光度计法直接观察碘浓度的变化,从而测量反应的进程。
根据公式:al=(lg100-lgT)/CI2 求得比色皿的al值
该反应的速率方程可表示为:
v=dC E /dt = -dC A/dt = -dC I 2/dt = kC p A C q I 2 C r H+
式中CE,CA,CI2,CH+ 分别为碘化丙酮,丙酮,碘,盐酸的浓度;k为速度常数;指数p,q,r分别为丙酮,碘和氢离子的反应
级数。
实验证实在本实验条件下,丙酮碘化反应对碘是零级反应,即q为零。
所以,
v= dC E /dt = kC p A C r H+
对上式积分后可得:
C E = kC p A C r H+ t + C
又由于dC E /dt = -dC A/dt = -dC I 2/dt
A = alC I2( 比尔-兰伯定理:A为吸光度;T为透光度)
A = -lg T
al=(lg100-lgT)/C I2
得:lg T = k(al) C p A C r H+ t + B
由lgT对t做图,通过其斜率m可求得反应速度,即:m=k(al) C p A C r H+
又有:v =m/(al)
为了确定反应级数P,至少进行两次实验,用脚注数字分别表示各次实验。
当丙酮初始浓度不同,而氢离子、碘的初始浓度
分别相同时,即:
c A2= u c A1,c H+2= c H+1,C I22= C I21
则有:v2/v1=kc p A2 c r H+2 c q I2 2/kc p A1c r H+1 c q I2 1=u p
lg(v2/v1)=plgu
p=lg(v2/v1)/lgu=(lgm2/m1)/lgu
同理:当丙酮、碘的初始浓度分别相同,而酸的浓度不同时,即:
c A3= c A1 c I2 3= c I21c H+3= ωc H+1
这样便可得出:r=(lgv3/v1)/lgω
又因为:c A4 = c A1c H+4 = c H+1c I2 4= xc I21
则有:q=(lgv4v1)/lgx
从而做四次实验,可求得反应级数p、r、q。
三、实验仪器及药品
仪器:unico 2000型分光光度计、秒表、6个容量瓶(50ml)、移液管(5ml、10ml)药品:标准碘溶液(0.01095mol·L-1)、标准盐酸溶液(1.0254mol·L-1)、标准丙酮溶液(2mol·L-1)
四、实验步骤
1.将分光光度计的波长调到520纳米处。
用蒸馏水调节分光光度计,使其处于透光率“100”的位置上。
2.求al值。
取5ml 标准碘溶液(0.01095mol.L-1)在50ml的容量瓶中配制0.001095mol.L-1 碘溶液,测其透光率,更换
碘溶液再重复测两次,取其平均值,求al值。
3.丙酮碘化反应的速度常数的测定。
用移液管分别吸取标准碘溶液(0.01095mol.L-1)10ml、10ml、10ml、5ml,注入1到4号的4只干燥的50ml容量瓶中,另取一只移液管分别向1到4号容量瓶中加入标准盐酸溶液(1.0254mol.L-1)5ml、5ml、10ml、5ml。
往1号瓶中加入标准丙酮溶液(2mol.L-1)10ml,当丙酮溶液加入一半时开始计时,然后加入蒸馏水迅速定容到50ml ,摇匀,用其中的溶液清洗比色皿二次,测其透光率,每隔一分钟记录一次数据,直到取10到12个数据为止。
分别向2、3、4号瓶中加入5ml、10ml、10ml,用同样的方法测定不同时间的透光率。
五、思考题
1.动力学实验中,正确计算时间是很重要的实验关键。
本实验中,从反应物开始混合,到开始读数,中间有一段不很短的
操作时间,这对实验结果有无影响?
答:无影响。
因为测得的透光率仍是该时刻本来的透光率,作出的曲线仍与原来曲线斜率一样,所以这样做对实验结果无影
响。
2.影响本实验结果精确度的主要因素有哪些?
答:主要因素有:
(1)准确量取和配制溶液;
(2)测量之前混合液要充分地摇匀;
(3)保持比色皿的清洁;
(4)在测定过程中用蒸馏水多次校正透光率“0”点和“100”点;
(5)读数时要迅速准确。
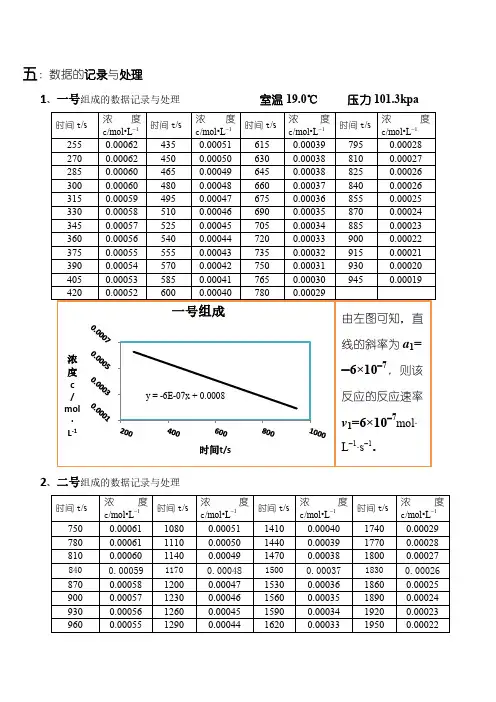
六、数据处理
1.求al
CI2=0.002000mol/L al=(lg100-lgT)/CI2
2.混合溶液的时间-透光率温度:22.2℃
3.混合溶液的丙酮、盐酸、碘的浓度
4.用表中数据,以lgT对t作图,求出斜率m。
1号:lgT与t的关系曲线图:拟合曲线:y = 0.02855x + 1.39375
2号:lgT与t的关系曲线图:拟合曲线:y = 0.01553x + 1.25896 3号:lgT与t的关系曲线图:拟合曲线:y = 0.06049x + 1.4654
4号:lgT与t的关系曲线图:拟合曲线:y = 0.0324x + 1.60162
由上得出它们的斜率分别为:
1号:y = 0.02855x + 1.39375 m1=0.02855
2号:y = 0.01753x + 1.25896 m2=0.01753
3号:y = 0.06049x + 1.4654 m3=0.06049
4号:y = 0.0324x + 1.60162 m4=0.0324
5.计算反应级数(p,r,q)
①因为:v =m/(al) 所以:ν2/ν1= m2 /m1
又因为:u c A1= c A2
所以:u = c A2 /c A1 = 0.2000/0.4000=0.500
lgu = lg0.500 = -0.301
而lg(ν2/ν1)=lg(m2 /m1)=lg(0.01753/0.02855)= -0.212 由于lg(ν2/ν1)=plgu ,p=lg(ν2/ν1)/lgu = -0.212/(-0.301)=0.704≈1
②因为:c H+3= ωc H+1ω=c H+3/c H+1 =0.39914/0.19957=2.00
而lg(ν3/ν1)=lg(m3 /m1)=lg(0.06049/0.02855)= 0.326
r=(lgν3/ν1)/lgω=0.326/lg2.00=1.083≈1
③因为:c I2 4= xc I21X = c I2 4/c I21 =0.00200/0.00400=0.500
而lg(ν4/ν1)=lg(m4 /m1)=lg(0.0324/0.02855)=0.0549
q=(lgν4/ν1)/lgx=0.0549/lg0.5=-0.1825≈0
6、计算速度常数k值(令p=r=1,q=0)(测量时温度:22.2℃)[mol.L-1]-1[min]-1
因为:m=k(al)c p A c r H+所以,k = m/(al)C A C H+
k1=m1/(al)c A1c H+1 =0.02855/(183.27*0.4*0.19957)=1.951*10-3 [mol.L-1]-1[min]-1 k2=m2/(al)c A2c H+2 =0.01753/(183.27*0.2*0.19957)= 2.396*10-3 [mol.L-1]-1[min]-1 k3=m3/(al)c A3c H+3 =0.06049/(183.27*0.4*0.39914)= 2.067*10-3 [mol.L-1]-1[min]-1 k4=m4/(al)c A4c H+4 =0.0324/(183.27*0.4*0.19957)= 2.215*10-3 [mol.L-1]-1[min]-1 k=1/4(k1+k2+k3+k4)=1/4*(1.951+2.396+2.067+2.215)*10-3
=2.157*10-3 [mol·L-1]-1[min]-1。