第一节元素周期表2
- 格式:doc
- 大小:134.00 KB
- 文档页数:4



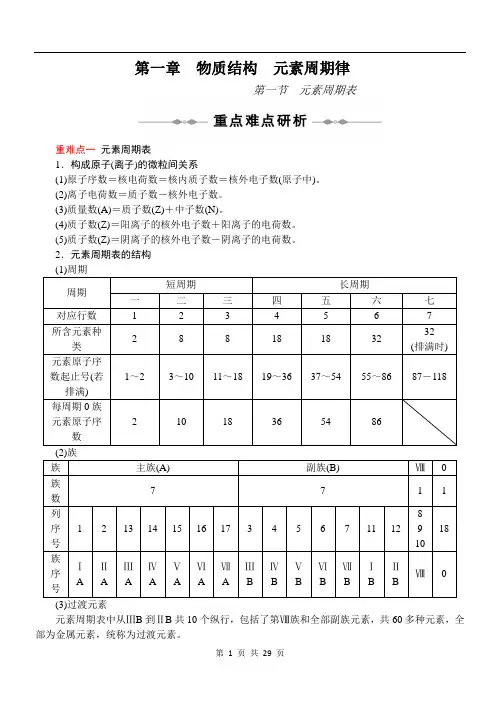
第一章 物质结构 元素周期律第一节元素周期表重难点一 元素周期表1.构成原子(离子)的微粒间关系(1)原子序数=核电荷数=核内质子数=核外电子数(原子中)。
(2)离子电荷数=质子数-核外电子数。
(3)质量数(A)=质子数(Z)+中子数(N)。
(4)质子数(Z)=阳离子的核外电子数+阳离子的电荷数。
(5)质子数(Z)=阴离子的核外电子数-阴离子的电荷数。
2.元素周期表的结构 (1)周期 周期 短周期长周期一 二 三 四 五 六 七 对应行数 1 2 3 4 5 6 7 所含元素种类 28818183232 (排满时) 元素原子序数起止号(若排满) 1~2 3~10 11~18 19~36 37~54 55~8687-118每周期0族元素原子序数 2 10 18 36 54 86(2)族 族 主族(A) 副族(B) Ⅷ 0 族数 771 1列序号 1213 14 15 16 17 3 4 5 6 7 11 12 8 9 10 18族序号ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA ⅢB ⅣB ⅤB ⅥB ⅦB ⅠB ⅡBⅧ(3)过渡元素元素周期表中从ⅢB 到ⅡB 共10个纵行,包括了第Ⅷ族和全部副族元素,共60多种元素,全部为金属元素,统称为过渡元素。
特别提醒 族序数为Ⅱ、Ⅲ的地方是主族和副族的分界线,第一次分界时主族在副族的前面,第二次分界时副族在主族的前面。
“第一次”指ⅠA ⅡA ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ依次排列。
“第二次”指ⅠB ⅡB ⅢA ⅣA ⅤA ⅥA ⅦA 0依次排列。
重难点二 零族定位法确定元素的位置 1.明确各周期零族元素的原子序数周期 一 二 三 四 五 六 七 原子序数210183654861182.比大小定周期比较该元素的原子序数与0族元素的原子序数大小,找出与其相邻近的两种0族元素,那么该元素就和序数大的0族元素处于同一周期。
3.求差值定族数(1)若某元素原子序数比相应的0族元素多1或2,则该元素应处在该0族元素所在周期的下一个周期的ⅠA 族或ⅡA 族。



第2课时 元素周期表 核素必备知识基础练进阶训练第一层1.下列关于元素周期表的叙述正确的是( )A.在元素周期表中共有18个纵行,18个族B.同族元素的最外层电子数一定相同C.同周期元素的电子层数相同D.元素周期表有7个周期,8个主族2.下列说法正确的是( )A.最外层电子数大于4的一定是非金属元素B.元素周期表有18纵列,7横行,故有18个族,7个周期C.第ⅠA族就是碱金属D.某第ⅡA族元素的原子序数为a,则和其同周期第ⅢA的元素的原子序数可能为a +113.锶的原子序数为38,它在元素周期表中的位置是( )A.第五周期第ⅣA族 B.第五周期第ⅡA族C.第四周期第ⅡA族 D.第五周期第ⅥA族4.根据叙述判断,下列各元素一定属于主族元素的是( )A.元素能形成+7价的含氧酸及其盐B.Y元素的原子最外层上有2个电子C.Z元素的阴离子与同一周期惰性气体元素原子的电子层结构相同D.R元素在化合物中无变价5.甲、乙是周期表中同一主族的两种元素,若甲的原子序数为x,则乙的原子序数不可能为( )A.x+2 B.x+4C.x+32 D.x+186.第ⅡA族某元素原子序数为n,则原子序数为(n+2)的元素的族序数一定不可能为( )A.ⅣA B.ⅣBC.ⅢB D.Ⅷ7.溴元素的原子结构示意图及其在元素周期表中的信息如图所示,下列说法中正确的是( )A.图中n的数值等于5B.原子序数与核电荷数都是35C.在化学反应中,溴原子获得电子形成Br+D.溴元素为金属元素8.我国拥有自主知识产权的硅衬底高光效氮化镓发光二极管(简称LED)技术,已广泛用于照明、显像等多个领域。
氮元素、镓元素的原子结构示意图及镓在元素周期表中的信息如图所示,下列说法不正确的是( )A.氮元素位于元素周期表的第二周期B.镓原子与镓离子质量几乎相等C.镓的相对原子质量为69.72D.一个Ga3+有34个电子9.下列各组微粒属于同位素的是( )A.H2O和 H2O B.K和 CaC.O2和O3D.Cl和 Cl10.下列叙述错误的是( )A.13C和 14C属于同种元素,它们互为同位素B.1H和 2H是不同的核素,它们的质子数相等C.14C和 14N的质量数相等,它们的中子数不等D.6Li和 7Li的电子数相等,中子数也相等11.同温同压下,等体积的两容器内分别充满14N16O和13C16O2气体,下列对两容器中气体的判断正确的是( )A.分子数相同 B.气体质量相同C.质子数相同 D.中子数相同12.氯的核电荷数为17,35Cl是氯的一种核素,下列说法正确的是( )A.35Cl2气体的摩尔质量为 70 gB. mol的1H35Cl分子所含中子数约为6.02 ×1023C.3.5 g 35Cl2气体的体积约为1.12 LD.Na35Cl中Cl-的结构示意图:13.日本政府于2021年4月13日召开会议,决定在未来2年内将核电站产生的核废水分批排入大海,核废水中包含63种放射性物质,其中Sr可导致白血病,下列有关说法不正确的是( )A.Sr的质子数为38B.90Sr内中子数和核外电子数之差为11C.87Sr和90Sr互为同位素D.90Sr转变87Sr属于物理变化关键能力综合练进阶训练第二层一、选择题:每小题只有一个选项符合题意。




第一章第一节元素周期表(第二课时)
【学习目标】
1.了解原子结构与元素性质的关系。
2.初步学会总结元素递变规律的能力。
【学习重点】元素性质的递变规律与元素组成微粒结构的联系
【预备知识】
请同学们画出碱金属的原子结构示意图,分析碱金属原子结构的共同之处。
[
化学性质如何?是否完全相同?
[实验1]将一干燥的坩埚加热,同时取一小块钾,擦干表面的煤油后,迅速的投入到热坩埚中,观察现象。
同钠与氧气的反应比较。
[实验2]在培养皿中放入一些水,然后取绿豆大的钾,吸干表面的煤油,投入到培养皿中,观察现象。
同钠与水的反应进比较。
【基础知识】
二、元素的性质与原子结构
(一)碱金属的化学性质
1、与非金属的反应
Li+O2 Na+O2 K+O2
K、Rb等碱金属与O2反应,会生成超氧化物。
Rb、Cs在室温时,遇到空气会立即燃烧。
2、与水的反应
K+H2O Rb+H2O
除Na、K外,其他碱金属元素也都可以和水反应生成相应的碱与H2。
[小结]2M+2H2O == 2MOH+H2↑碱性:
[思考与交流]根据实验讨论钠与钾的性质有什么相似性和不同。
你认为元素的性质与他们的原子结构有关系吗?
(二)碱金属的物理性质的比较(见课本第7页)
[课堂练习1]:钫(Fr)具有放射性,它是碱金属元素中最重的元素,下列预言错误的是:
A.在碱金属中它具有最大的原子半径B.它的氢氧化物化学式为FrOH,是一种极强的碱
C.钫在空气中燃烧时,只生成化学式为Fr2O的氧化物
D.它能跟水反应生成相应的碱和氢气,由于反应剧烈而发生爆炸
[阅读教材]第7、8页典型的非金属-----卤素看看他们的性质有原子结构间是否存在联系?[归纳与整理]
(三)卤素单质的物理性质(见课本第8页)
[思考与交流]请大家根据卤素单质的物理性质,总结出卤素单质在颜色、状态、密度、熔沸点、溶解性等各方面的递变规律。
[归纳与整理]
颜色:状态:密度:
熔沸点:在水中的溶解性:
[设问]大家能否根据卤素原子的结构特点来解释一下卤素单质在性质上的相似性与递变性呢?
[归纳与小结]
(四)卤素的化学性质:
1、卤素单质与氢气的反应(见课本第8页)
卤素和H2的反应可用通式H2+X2==== 来表示,反应时按F2、Cl2、Br2、I2的顺序,反应条件越来越,反应程度依次,形成的卤化氢的稳定性也依次。
[实验1]将少量新制的饱和氯水分别注盛有NaBr溶液和KI溶液的试管中,用力振荡后,在注入少量四氯化碳,振荡。
观察四氯化碳层和水层的颜色变化。
[实验2]将少量的溴水注入盛有KI溶液的试管中,用力振荡后,在注入少量的四氯化碳。
观察四氯化碳层和水层颜色的变化。
1、卤素单质间相互置换反应:Cl2+ NaBr===== Cl2+ Br-=====
Cl2+ KI=====Cl2+ I-=====
[小结]卤素单质随着原子核电荷数的递增,在物理性质和化学性质方面,均表现出一定的相似性和递变性。
[归纳与总结]同一主族元素性质具有一定的相似性和递变性;同一主族,从上到下:原子半径逐渐增大,失电子能力逐渐,得电子能力逐渐,金属性逐渐,非金属性逐渐;
[课堂练习2]:现有下列几种物质的溶液KCl、KI、新制氯水、KBr、淀粉、AgNO3,不用其他试剂,怎样鉴别它们?
[课堂练习3]:砹(At)是卤族元素中位于碘后面的元素,试推测砹和砹的化合物最不可能具备性质
A.砹易溶于某些有机溶剂
B.砹化氢很稳定不易分解
C.砹是有色气体
D.砹化银不溶于水或稀HNO3
【自我检测】
1.下列各组比较不正确的是()
A.锂与水反应不如钠与水反应剧烈
B.还原性:K>Na>Li,故K可以从NaCl溶液中置换出金属钠
C.熔、沸点:Li>Na>K
D.碱性:LiOH<NaOH<KOH
2.关于锂的结构和性质的判断:①与水反应比钠剧烈;②锂的原子半径比钠小;③锂的氧化物暴露于空气中易吸收CO2;④锂的阳离子的最外层电子数和钠离子的最外层电子数相同;⑤锂是还原剂。
其中错误的是()
A.只有①和⑤B.只有②和③
C.只有③和⑤D.只有①和④
3.化学实验中传导输送高浓度溴气所用的导管最好用()
A.铁管B.橡胶管C.玻璃管D.铜管
4.实验室里下列药品的保存方法中,正确的是()
A.溴化银保存于棕色瓶中
B.液溴以少量的水液封后用橡皮塞塞紧
C.碘保存于细口玻璃瓶中
D.氢氧化钠溶液盛放在带磨口玻璃塞的试剂瓶中
5.卤素单质的性质与F2>Cl2>Br2>I2的变化规律不相符的是()
A.与氢气反应的剧烈程度B.气态氢化物的稳定性
C.单质还原性的强弱D.与水反应的剧烈程度
6.医生建议患甲状腺肿大的病人多食海带,这是由于海带含有较丰富的()
A.碘元素B.铁元素C.钾元素D.锌元素
练方法技巧——同主族元素性质应用技巧
7.向含有NaBr和KI的混合溶液中通入过量的Cl2充分反应。
将溶液蒸干,并灼烧所得的物质,最后剩余的固体物质是()
A.NaCl和KI B.NaCl、KCl和I2
C.KCl和NaBr D.KCl和NaCl
8.已知锂及其化合物的许多性质与碱金属差异较大,却与镁相似。
下面有关锂及其化合物的性质的叙述不正确的是()
A.锂在过量氧气中燃烧,主要产物是Li2O而不是Li2O2
B.Li2CO3受热很难分解
C.在相同温度下,溶解度Li2CO3小于LiHCO3
D.少量的锂保存在固体石蜡中
9.试管中装有足量煤油和水的混合物,静置后投入一小块碱金属。
可观察到金属在煤油和水的界面附近上下往复运动。
下列说法不正确的是()
A.此碱金属可能是钾或钠
B.反应过程中煤油不会燃烧
C.碱金属上下运动是由于与水反应产生了H2
D
练综合拓展
10.已知元素a A、b B、c C、d D、e E的结构示意图分别为:
请回答下列问题:
(1)属于同周期的元素是____________(填元素符号,下同),属于同主族的元素
____________。
(2)金属性最强的元素是____________,非金属性最强的元素是__________。
(3)上述元素中最高价氧化物对应的水化物碱性最强的是____________。
【拓展提升】
11.实验室常用氯化钠固体和浓硫酸共热来制取氯化氢,有关反应如下: NaCl +H 2SO 4(浓)=====△
NaHSO 4+HCl ↑ NaCl(固)+NaHSO 4(固)=====△
Na 2SO 4+HCl ↑ 某实验操作步骤和现象如图所示:
⎭
⎪⎬⎪
⎫固体A 固体B ――→混合
⎪⎪⎪⎪⎪
→
钠盐C ――→水溶解――→无色溶液――→加入BaCl 2
和稀硝酸白色沉淀E
→气体D ――→少量水溶解D 的浓溶液――→黑色粉末F △
气体G ――→加入NaBr
溶液
橙黄色溶液
(1)写出有关物质的化学式。
A :______________,
B :______________,
C :__________________,
D :______________,
E :______________,
F :______________________________,
G :______________。
(2)若要从橙黄色溶液中分离出有色溶质,采用的分离方法是________,分离时所使用的主要仪器是________________________________________。