甲醇水溶液沸点
- 格式:xls
- 大小:15.00 KB
- 文档页数:1


甲醇的理化性质甲醇是一种透明、无色、易燃、有毒的液体,略带酒精味。
熔点-97.8度,沸点64.8度,闪点12.22度,自燃点47度,相对密度0.7915(20度/4度),爆炸极限下限6%,上限36.5%,能与水、乙醇、乙醚、苯、丙酮和大多数有机溶剂相混溶。
它是重要有机化工原料和优质燃料。
主要用于制造甲醛、醋酸、氯甲烷、甲氨、硫酸二甲脂等多种有机产品,也是农药、医药的重要原料之一。
甲醇亦可代替汽油作燃料使用。
甲醇是假酒的主要成分,过多食用会导致失明,甚至死亡!我的补充:一产品介绍 1.甲醇性能与用途甲醇又名:木醇,木酒精英文名: Methanol; Methyl alcohol;Carbinol;Wood alcohol; Wood spirit; Methyl hydroxide; 理化性质:无色、透明、高度挥发、易燃液体。
略有酒精气味。
分子式 C-H4-O。
分子量32.04。
相对密度0.792(20/4℃)。
熔点-97.8℃。
沸点64.5℃。
闪点 12.22℃。
自燃点463.89℃。
蒸气密度1.11。
蒸气压 13.33KPa(100mmHg 21.2℃)。
蒸气与空气混合物爆炸下限 6~36.5 % 。
能与水、乙醇、乙醚、苯、酮、卤代烃和许多其他有机溶剂相混溶。
遇热、明火或氧化剂易着火。
用途:基本有机原料之一。
主要广泛应用于精细化工,塑料,医药,林产品加工等领域的基本有机化工原料,可开发出100多种高附加值化工产品,尤其深加工后作为一种新型清洁燃料和加入汽油掺烧,其发展前景越来越广阔。
2. 甲醇生产技术及制法主要是合成法,尚有少量从木材干馏作为副产回收。
合成甲醇可以固体(如煤、焦炭)液体(如原油、重油、轻油)或气体(如天然气及其他可燃性气体)为原料,经造气净化(脱硫)变换,除去二氧化碳,配制成一定的合成气(一氧化碳和氢)。
在不同的催化剂存在下,选用不同的工艺条件。
单产甲醇(分高压法低压和中压法),或与合成氨联产甲醇(联醇法)。




甲醇物性数据甲醇(化学式CH3OH),也被称为甲基醇或木精,是一种无色、易挥发的液体。
它是一种重要的有机溶剂和化工原料,在工业生产、医药、能源等领域都有广泛的应用。
为了更好地了解甲醇的物性数据,以下将详细介绍甲醇的常见物性参数。
1. 分子结构:甲醇的分子式为CH3OH,分子量为32.04 g/mol。
它由一个碳原子、四个氢原子和一个氧原子组成。
甲醇的分子结构使其具有一些特殊的物理和化学性质。
2. 密度:甲醇的密度是指单位体积内所含质量的大小。
在常温下,甲醇的密度约为0.7918 g/cm³。
这意味着在每立方厘米的甲醇中,含有大约0.7918克的质量。
3. 沸点和熔点:甲醇的沸点和熔点是其常见的物理性质之一。
甲醇的沸点约为64.7℃,熔点约为-97.6℃。
这意味着在常温下,甲醇呈液态状态,但在低于-97.6℃时会凝固为固体。
4. 折射率:甲醇的折射率是指光线在通过甲醇时的折射程度。
在常温下,甲醇的折射率约为1.328。
这意味着当光线通过甲醇时,其传播速度会减慢,并发生折射现象。
5. 摩尔体积:摩尔体积是指单位摩尔物质所占据的体积大小。
对于甲醇而言,其摩尔体积约为40.0 cm³/mol。
这意味着每摩尔的甲醇占据约40.0立方厘米的体积。
6. 热容:热容是指单位质量物质在温度变化时吸收或释放的热量大小。
甲醇的热容约为2.51 J/(g·K)。
这意味着每克甲醇在温度变化1开尔文时,吸收或释放约2.51焦耳的热量。
7. 溶解性:甲醇是一种极性溶剂,因此具有良好的溶解性。
它可以与许多有机物和无机物相溶。
例如,甲醇可以与水混合形成任意比例的溶液。
这种良好的溶解性使得甲醇在化学实验和工业生产中被广泛应用。
8. 燃烧性:甲醇是一种易燃液体。
它可以在空气中燃烧,产生二氧化碳和水。
甲醇的燃烧热为726 kJ/mol,燃烧时释放的能量可用于发电和供热。
9. 比热导率:比热导率是指单位时间内单位面积的热量传导量。


甲醇水物理化学性质调研报告一可燃性甲醇是极易可燃性液体,遇明火、热源即可燃烧,火焰几乎呈无色(稍显极微弱蓝色)。
1.闪点:11℃;2.甲醇自燃温度:436℃3.甲醇空气中甲醇蒸汽含量爆炸上限36.5%,爆炸下限6%;4.甲醇及甲醇水灭火通常采用干粉或泡沫灭火器,禁止用水灭火。
图1燃烧中的甲醇水图2 干粉灭火器扑灭燃烧中的甲醇水图3 燃烧中的甲醇图4 干粉灭火器扑灭燃烧中的甲醇二挥发性判断挥发性强弱的依据是物质的沸点,沸点越低,挥发性越弱,反之越强。
1.甲醇沸点:64.7℃,凝固点:-97.8℃。
2.甲醇和水不形成共沸物,对于不同浓度甲醇水的沸点不一样,54%的甲醇水沸点为77.7℃,凝固点:-74℃~-54.3℃。
3.汽油是由多种烷烃混合组成,没有沸点只有沸程,一般为30-205℃,也就是说在30℃时,汽油中最低组分就会发生气化,故在炎热的环境中,汽油就会产生较大的气味。
总结:在30℃以下(即常温以下),甲醇水和汽油的挥发性都较弱,但由于汽油最低组分沸点低于甲醇沸点,故汽油挥发性大于甲醇挥发性;在30-77.7℃,随着温度升高,甲醇水和汽油的挥发性越来越大,达到77.7℃时,汽油中低于77.7℃的组分全部挥发,甲醇水可以全部挥发;高于77.7℃,甲醇水几乎全部气化。
三毒理甲醇的毒性对人体的神经系统和血液系统影响最大,它经消化道、呼吸道或皮肤摄入都会产生毒性反应,甲醇蒸气能损害人的呼吸道粘膜和视力。
急性中毒症状有:头疼、恶心、胃痛、疲倦、视力模糊以至失明,继而呼吸困难,最终导致呼吸中枢麻痹而死亡。
慢性中毒反应为:眩晕、昏睡、头痛、耳鸣、视力减退、消化障碍。
甲醇摄入量超过4克就会出现中毒反应,误服一小杯超过10克就能造成双目失明,饮入量大造成死亡。
致死量为30毫升以上,甲醇在体内不易排出, 会发生蓄积,在体内氧化生成甲醛和甲酸也都有毒性。
在甲醇生产工厂,我国有关部门规定,空气中允许甲醇浓度为50mg/m³,在有甲醇气的现场工作须戴防毒面具、工厂废水要处理后才能排放,允许含量小于200mg/L的甲醇。

列举十种高沸点液体(>200℃),简单列出其理化性质,以及对金属盐的溶解能力:1、苯甲醇沸点:205 ℃密度:g/ml(25℃)水溶性:g/100mL(20℃)性质与用途、以及金属盐溶解性::①有极性,低毒,蒸汽压低,因此用作醇类溶剂。
可燃,可与乙醇、乙醚、苯、氯仿等有机溶剂混溶。
②苯甲醇不宜久贮,它在空气中能缓慢氧化为苯甲醛和苯甲醚。
③用作色谱分析试剂,也用于有机合成。
与卤化磷和氢卤酸反应生成卤化苄。
卤化苄和苯甲醇都是苄基(苯甲基)化试剂。
④可通过氯化苄与碳酸钾或碳酸钠长时间加热水解而得;或苯甲醛的甲醇溶液与氢氧化钠液在65~75℃下反应而得。
⑤能溶解Na,与其发生酸碱反应。
2、二甲酸酯(DBE)沸点:196~225 ℃密度:g/ml(25℃)水溶性:/性质与用途、以及金属盐溶解性::①DBE是由三种二价酸酯组成的混合物,是丁二酸二甲酯,戊二酸二甲酯和已二酸二甲三种良好环境溶剂的组合。
②低毒、低味、含水量低、使用安全;良好的稳定性,自然存放不会产生氧化和分解;沸点高,馏程长,可帮助调节整个溶剂系统的挥发速率③极好的溶解力,与聚氯酯树脂、丙烯酸树脂、聚酯树脂、醇酸树脂、环氧树脂等相溶性良好。
④生产时,先由甲醇同混和的二元酸反应,然后精馏分离成不同的产品。
3、苯甲酸乙酯沸点:212 ℃密度:g/ml(25℃)水溶性:insoluble性质与用途、以及金属盐溶解性::①无色液体,溶于乙醇、乙醚、石油醚、丙二醇、矿物油和大多数非挥发性油,不溶于水和甘油。
②用作溶剂及香料辅助剂,也用于有机合成:用作纤维素酯、纤维素醚、树脂类的溶剂、适用于香蕉、樱桃、梅子、葡萄等香精以及烟用和酒用香精中。
③由苯甲酸和乙醇在无水硫酸铝和微量硫酸存在下酯化而制备。
④苯甲酸乙酯的金属盐溶解性较好,能与多种金属盐和氯化锡、三氯化铝、氯化钛、碘化镁、五氯化锑等形成结晶性复合物,但不太稳定,在空气中易分解。
4、1,1,3-三甲基环己烯酮(异佛尔酮)沸点:213-214 ℃密度:g/ml(25℃)水溶性:12 g/L(20℃)性质与用途、以及金属盐溶解性::①有机溶剂,是油脂、树胶、树脂等的优良溶剂,特别适用于乙烯基树脂。

概述甲醇是最简单的化学品之一,是重要的化工基础原料和清洁液体燃料,广泛应用于有机合成、染料、医药、农药、涂料、汽车和国防等工业中。
甲醇最早由木材和木质素干馏制得,故俗称木醇。
木材在长时间加热炭化过程中,产生可凝和不可凝的挥发性物质,这种被称为焦木酸的可凝性液体中含有甲醇、乙酸和焦油。
除去焦油的焦木酸可通过精馏分离出天然甲醇和乙酸。
生产1kg的甲醇约需60~80kg的木材。
这是生产甲醇的最古老方法。
美国于20世纪70年代初才完全抛弃这一过程。
1923年,德国BASF公司在合成氨工业化的基础上,首先用锌铝催化剂在高温高压的操作条件下实现了由一氧化碳和氢合成甲醇的工业化生产,开创了工业合成甲醇的先河。
工业合成甲醇成本低,产量大,促使了甲醇工业的迅猛发展。
甲醇消费市场的扩大,又促使甲醇生产工艺不断改进,生产成本不断下降,生产规模日益增大。
1966年,英国ICI公司成功地实现了铜基催化剂的低压甲醇合成工艺,随后又实现了更为经济的中压法甲醇合成工艺。
与此同时德国Lurgi公司也成功地开发了中低压甲醇合成工艺。
随着甲醇合成工艺的成熟和规模的扩大,由甲醇合成和甲醇应用所组成的甲醇工业成为化学工业中的一个重要分支,在经济的发展中起着越来越重要的作用。
物理性质甲醇是最简单的饱和脂肪酸,分子式CH30H,相对分子质量32.04。
甲醇分子中的碳原子和氧原子的成键轨道为四面体结构的sp3杂化轨道,相互重叠结合成C—O键。
而O—H键是氧原子的一个sp3杂化轨道和氢原子的1s轨道相互重叠,氧原子的两对未共用电子对分别占据其他两个sp3杂化轨道。
甲醇分子的成键轨道和氧原子的正四面体结构见图1-1;甲醇分子的键长和键角见表1-1。
(a)(b)图1-1 甲醇的成键轨道(a)和甲醇分子中氧原子正四面体结构(b)表1-1 甲醇分子的键长和键角和水以及乙醇、乙醚等许多有机液体无限互溶,但不能与脂肪烃类化合物相互溶。
甲醇蒸气和空气混合能形成爆炸性混合物,爆炸极限为6.0%~36.5%(体积)。
甲醇物理性质:无色水溶液或气体。
有刺激性气味。
液体在较冷时久贮易混浊,在低温时则形成三聚甲醛沉淀。
蒸发时有一部分甲醛逸出,但多数变成三聚甲醛。
该品为强还原剂,在微量碱性时还原性更强。
在空气中能缓慢氧化成甲酸。
能与水、乙醇、丙酮等有机溶剂按任意混溶。
pH 2.8~4.0。
相对密度(d2525)1.081~1.085。
熔点-118℃,沸点-19.5℃。
折光率(n20D)1.3746。
闪点60℃。
易燃。
低毒,半数致死量(大鼠,经口)800mG/kG。
其蒸气能强烈刺激粘膜、具有致癌性、属于高毒物。
化学性质:1.与Ag(NH3)2OH反应:HCHO + 2Ag(NH3)2OH==加热==HCOONH4 +2Ag↓+ 3NH3(气体)+H2O或HCHO+4Ag(NH3)2OH==水浴加热==4Ag↓+8NH3+CO2+3H2O2.与Cu(OH)反应:HCHO+4Cu(OH)2==加热== CO2+2Cu2O(砖红色沉淀)+5H2O3.加聚反应:nHCHO====-[---CH—O--]n--说明:-[---CH—O--]n--是人造象牙的主要成分。
4.与其他醛的歧化反应(CH传H)3CCHO+CH传====(CH2OH)4C+HCOO- 在氢氧化钙的催化下分子结构:C原子以sp2杂化轨道成键。
分子为平面形极性分子。
主要危害:甲醛是无色、具有强烈气味的刺激性气体,其35%~40%的水溶液通称福尔马林。
甲醛是原浆毒物,能与蛋白质结合,吸入高浓度甲醛后,会出现呼吸道的严重刺激和水肿、眼刺痛、头痛,也可发生支气管哮喘。
皮肤直接接触甲醛,可引起皮炎、色斑、坏死。
经常吸入少量甲醛,能引起慢性中毒,出现黏膜充血、皮肤刺激症、过敏性皮炎角化和脆弱、甲床指端疼痛,孕妇长期吸入可能导致新生婴儿畸形,甚至死亡,男子长期吸入可导致男子精子畸形、死亡,性功能下降,严重的可导致白血病,气胸,生殖能力缺失,全身症状有头痛、乏力、胃纳差、心悸、失眠、体重减轻以及植物神经紊乱等。
列举十种高沸点液体(>200℃),简单列出其理化性质,以及对金属盐的溶解能力:1、苯甲醇沸点:205 ℃密度:1.045 g/ml(25℃)水溶性:4.29 g/100mL(20℃)性质与用途、以及金属盐溶解性::①有极性,低毒,蒸汽压低,因此用作醇类溶剂。
可燃,可与乙醇、乙醚、苯、氯仿等有机溶剂混溶。
②苯甲醇不宜久贮,它在空气中能缓慢氧化为苯甲醛和苯甲醚。
③用作色谱分析试剂,也用于有机合成。
与卤化磷和氢卤酸反应生成卤化苄。
卤化苄和苯甲醇都是苄基(苯甲基)化试剂。
④可通过氯化苄与碳酸钾或碳酸钠长时间加热水解而得;或苯甲醛的甲醇溶液与氢氧化钠液在65~75℃下反应而得。
⑤能溶解Na,与其发生酸碱反应。
2、二甲酸酯(DBE)沸点:196~225 ℃密度:1.19 g/ml(25℃)水溶性:/性质与用途、以及金属盐溶解性::① DBE是由三种二价酸酯组成的混合物,是丁二酸二甲酯,戊二酸二甲酯和已二酸二甲三种良好环境溶剂的组合。
②低毒、低味、含水量低、使用安全;良好的稳定性,自然存放不会产生氧化和分解;沸点高,馏程长,可帮助调节整个溶剂系统的挥发速率③极好的溶解力,与聚氯酯树脂、丙烯酸树脂、聚酯树脂、醇酸树脂、环氧树脂等相溶性良好。
④生产时,先由甲醇同混和的二元酸反应,然后精馏分离成不同的产品。
3、苯甲酸乙酯沸点:212 ℃密度:1.045 g/ml(25℃)水溶性:insoluble性质与用途、以及金属盐溶解性::①无色液体,溶于乙醇、乙醚、石油醚、丙二醇、矿物油和大多数非挥发性油,不溶于水和甘油。
②用作溶剂及香料辅助剂,也用于有机合成:用作纤维素酯、纤维素醚、树脂类的溶剂、适用于香蕉、樱桃、梅子、葡萄等香精以及烟用和酒用香精中。
③由苯甲酸和乙醇在无水硫酸铝和微量硫酸存在下酯化而制备。
④苯甲酸乙酯的金属盐溶解性较好,能与多种金属盐和氯化锡、三氯化铝、氯化钛、碘化镁、五氯化锑等形成结晶性复合物,但不太稳定,在空气中易分解。
浏览次数:216日期:2010年5月7日15:36摘要:甲醇分子的键长、键角与键能见表1-1-1。
表1-1-1 甲醇分子的键长、键角和键能一、物理性质常温常压下,纯甲醇是无色透明,易挥发、可燃,略带醇香味的有毒液体。
甲醇可以和水以及乙醇、乙醚等许多种有机物液体无限互溶。
甲醇蒸气和空气混合能形成爆炸性混合物,爆炸极限为6.0%~36.5%(体积)。
甲醇的主要物理性质见表1-1-2。
甲醇在不同压力下的沸点和不同温度下的蒸汽压见表1-1-3和表1-1-4。
①1mm Hg=133.322 Pa,1 atm=101325 Pa。
表1-1-4 甲醇的蒸气压①1 mmHg=133.322 Pa1.1 甲醇水溶液的性质甲醇和水可无限互溶,甲醇水溶液的性质是甲醇的重要物理性质,对于甲醇应用、精制以及环境保护方面具有重要的作用。
表1-1-5为甲醇水溶液的密度与甲醇浓度和温度的关系。
表1-1-6为甲醇水溶液的闪点,表1-1-7为甲醇水溶液的沸点。
表1-1-5 甲醇水溶液的密度与甲醇浓度和温度的关系表1-1-6 9.6×104 Pa压力下甲醇水溶液的闪点表1-1-7 甲醇水溶液的沸点注:1 mmHg=133.322 Pa由以上各表可以看出,甲醇水溶液的密度随甲醇浓度和温度的增加而减小;甲醇水溶液的沸点随液相中甲醇浓度的增加而降低;相同温度压力下,气相中甲醇浓度大于液相中甲醇浓度,尤其是当甲醇液相浓度较小时。
甲醇的闪点较低,纯甲醇的闪点为16 ℃。
甲醇水溶液的闪点仍然较低。
1.2 甲醇的其他性质甲醇属强极性有机化合物,具有很强的溶解能力,能和多种有机溶液互溶,并形成共沸混合物。
共沸物的生成影响甲醇中有机杂质的消除和以甲醇为原料合成其他下游产品的精制。
表1-1-8为甲醇和部。
甲醇理化性质及应急处理一、甲醇的理化性质甲醇是一种透明、无色、易燃、高度挥发、有毒的液体,略带酒精味。
熔点-97.8度,沸点64.8度,闪点12.22度,自燃点47度,相对密度0.7915(20度/4度),爆炸极限下限6%,上限36.5%,能与水、乙醇、乙醚、苯、丙酮和大多数有机溶剂相混溶。
它是重要有机化工原料和优质燃料。
主要用于制造甲醛、醋酸、氯甲烷、甲氨、硫酸二甲脂等多种有机产品,也是农药、医药的重要原料之一。
甲醇亦可代替汽油作燃料使用。
甲醇是假酒的主要成分,过多食用会导致失明,甚至死亡!二、甲醇的危害健康危害:对中枢神经系统有麻醉作用;对视神经和视网膜有特殊选择作用,引起病变;可致代谢性酸中毒急性中毒:短时大量吸入出现轻度眼及上呼吸道刺激症状,经一段时间潜伏期后出现头痛、头晕、乏力、眩晕、酒醉感、意识朦胧、谵妄,甚至昏迷。
视神经及视网膜病变,可有视物模糊、复视等,重者失明。
代谢性酸中毒时出现二氧化碳结合力下降、呼吸加速等。
慢性影响:神经衰弱综合征,植物神经功能失调,粘膜刺激,视力减退等。
皮肤出现脱脂、皮炎等危险特性:易燃,其蒸气与空气可形成爆炸性混合物。
遇明火、高热能引起燃烧爆炸。
与氧化剂接触发生化学反应或引起燃烧。
在火场中,受热的容器有爆炸危险。
其蒸气比空气重,能在较低处扩散到相当远的地方,遇明火会引着回燃三、应急处理处置方法:1、泄漏应急处理迅速撤离泄漏污染区人员至安全区,并进行隔离,严格限制出入。
切断火源。
建议应急处理人员戴自给正压式呼吸器,穿防毒服。
不要直接接触泄漏物。
尽可能切断泄漏源,防止进入下水道、排洪沟等限制性空间。
小量泄漏:用砂土或其它不燃材料吸附或吸收。
也可以用大量水冲洗,洗液稀释后放入废水系统。
大量泄漏:构筑围堤或挖坑收容;用泡沫覆盖,降低蒸气灾害。
用防爆泵转移至槽车或专用收集器内。
回收或运至废物处理场所处置。
2、防护措施呼吸系统防护:可能接触其蒸气时,应该佩戴过滤式防毒面罩(半面罩)。
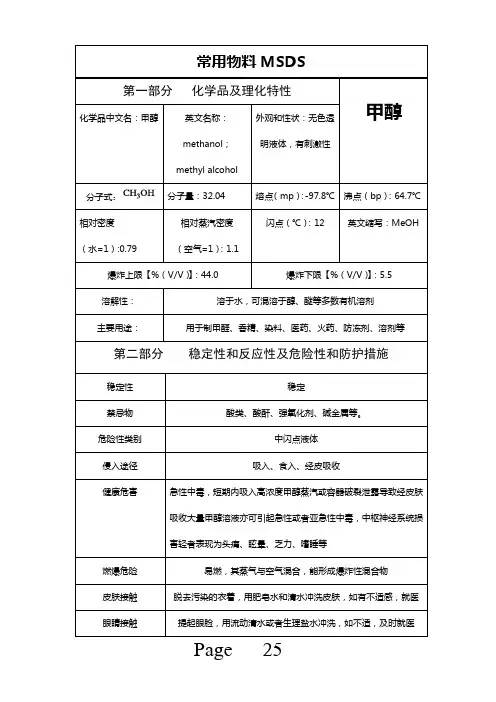
甲醇 MSDS甲醇 MSDS基本信息中文名:甲醇;木酒精木精;木醇英文名: Methyl alcohol;Methanol分子式:CH4O 分子量: 32.04 CAS号: 67-56-1外观与性状:无色澄清液体,有刺激性气味。
主要用途:主要用于制甲醛、香精、染料、医药、火药、防冻剂等。
物理化学性质熔点:-97.8 沸点: 64.8 相对密度(水=1):0.79相对密度(空气=1): 1.11 饱和蒸汽压(kPa):13.33/21.2℃溶解性:溶于水,可混溶于醇、醚等多数有机溶剂临界温度(℃): 240临界压力(MPa):7.95燃烧热(kj/mol):727.0甲醇由甲基和羟基组成的,具有醇所具有的化学性质。
[3]甲醇可以在纯氧中剧烈燃烧,生成水蒸气(I)和二氧化碳(IV)。
另外,甲醇也和氟气会产生猛烈的反应。
[4]与水、乙醇、乙醚、苯、酮、卤代烃和许多其他有机溶剂相混溶,遇热、明火或氧化剂易燃烧。
燃烧反应式为:CH3OH + O2 → CO2 + H2O具有饱和一元醇的通性,由于只有一个碳原子,因此有其特有的反应。
例如:① 与氯化钙形成结晶状物质CaCl2·4C H3OH,与氧化钡形成BaO·2CH3OH的分子化合物并溶解于甲醇中;类似的化合物有MgCl2·6CH3OH、CuSO4·2CH3OH、CH3OK·CH3OH、AlCl3·4CH3OH、AlCl3·6CH3OH、AlCl3·10CH3OH等;② 与其他醇不同,由于-CH2OH基与氢结合,氧化时生成的甲酸进一步氧化为CO2;③ 甲醇与氯、溴不易发生反应,但易与其水溶液作用,最初生成二氯甲醚(CH2Cl)2O,因水的作用转变成HCHO与HCl;④ 与碱、石灰一起加热,产生氢气并生成甲酸钠;CH3OH+NaOH→HCOONa+2H2;⑤ 与锌粉一起蒸馏,发生分解,生成CO和H2O。