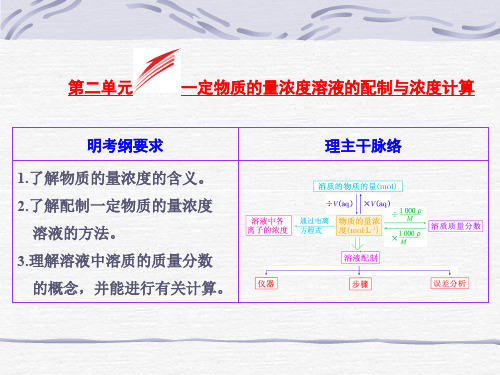
物质的量浓度与溶质的质量分数
- 格式:doc
- 大小:27.50 KB
- 文档页数:1

物质的量浓度的计算的几种类型【类型一】定义式的计算C B = n b / V aq【类型二】溶质的质量分数与物质的量浓度之间的换算计算公式:例1:98%的密度为1.84 g/mL的浓硫酸,其物质的量浓度为多少?例2:将某质量分数为98%(18.4 mol/L)的浓硫酸加水稀释至49%,则其物质的量浓度变为()A. =9.2 mol/LB. >9.2 mol/LC. <9.2 mol/LD. 无法确定补充:溶解度指在一定温度下,某固态物质在100g溶剂中达到饱和状态时所溶解的质量。
①溶解度与质量分数的关系:②溶解度与物质的量浓度的关系:【类型三】溶液的稀释或浓缩关系式:例3:要配置500mL 0.6mol/L的NaOH溶液,需6mol/L的NaOH多少毫升?例4:用36.5%的密度为1.3 g/mL的浓盐酸配制0.1mol/L的稀盐酸650 mL,所需浓盐酸的体积为多少mL?【类型四】不同浓度溶液混合时的计算注意:除非忽略混合后体积变化,否则V混≠V1+V2,即体积不具有加和性。
例5:把100mL0.3mol/L的硫酸溶液和50mL0.6mol/L的硫酸溶液混合后,该溶液中H+的物质的量浓度为?(假定溶液体积可以加和)补充:①同一溶质质量分数分别为a%和b%的溶液等质量混合,混合后溶质的质量分数:②溶质质量分数为a%的某溶液(溶剂为水)和水等质量混合,混合后溶质的质量分数:③同一溶质质量分数分别a%和b%的溶液等体积混合,混合后溶质的质量分数:◇当溶液密度随质量分数的增加而增大时,如硫酸溶液、氢氧化钠溶液:◇当溶液密度随质量分数的增加而减小时,如乙醇溶液、氨水:【类型五】气体溶于水后物质的量浓度的计算例6:标况下,将44.8LNH3溶于1L水中,得到密度为0.9g/mL的氨水,求此氨水的物质的量浓度。

溶质的物质的量浓度与质量分数的关系示例文章篇一:哎呀呀,同学们,今天咱们来好好聊聊这个看起来有点复杂,其实搞懂了就超简单的“溶质的物质的量浓度与质量分数的关系”。
你说这玩意儿神秘不?其实就像咱们玩的拼图游戏,每一块看似独立,组合起来就成了一幅完整的画面。
先来说说什么是溶质的物质的量浓度吧。
比如说,咱把一勺糖放进一杯水里,这勺糖就是溶质。
那物质的量浓度呢,就是说这杯水里糖分子的数量有多少。
那质量分数又是啥呢?还是刚才那杯糖水,质量分数就是这勺糖在整杯糖水质量里占了多大比例。
咱来打个比方,物质的量浓度就像是一个班级里戴眼镜的同学有几个,而质量分数呢,就像是戴眼镜的同学在全班同学里占的比例。
这能明白不?老师在课堂上讲的时候,我一开始也晕头转向的。
我就想,这咋这么难呢?后来啊,我多做了几道题,跟同学们一起讨论,慢慢就懂啦。
我问同桌:“你搞懂这溶质的物质的量浓度和质量分数的关系没?”同桌摇摇头说:“还迷糊着呢!”我就给他讲:“你看啊,其实就像咱俩分糖果,我拿到的糖果数量和咱俩糖果总数的比例,这是不是和它们的关系有点像?”同桌眼睛一亮,说:“好像有点明白了!”再比如说,咱去超市买饮料,有的饮料标注了各种成分的含量,这其实不就和溶质的物质的量浓度、质量分数有关系嘛。
你想想,如果不知道这些,怎么能知道这饮料里到底有多少咱们想要的东西呢?经过这么一琢磨,我发现这溶质的物质的量浓度和质量分数的关系其实也没那么可怕。
它们就像是一对好兄弟,虽然表现形式不一样,但本质上都是在告诉我们溶液里溶质的情况。
所以呀,同学们,别被它们看起来复杂的样子吓到,只要咱们用心去理解,多思考多练习,一定能把它们搞得清清楚楚!示例文章篇二:哎呀呀,同学们,今天咱们来聊聊溶质的物质的量浓度与质量分数的关系,这可真是个有点复杂但又超级有趣的话题呢!你想啊,咱们在做化学实验的时候,是不是经常会碰到要配制各种溶液的情况?那这时候,溶质的物质的量浓度和质量分数可就派上大用场啦!比如说,咱们把盐溶解在水里,那盐就是溶质,水就是溶剂。



质量分数10%
质量分数是表示溶质质量占溶液质量的百分率,其计算公式为“质量分数(ω) = (溶质质量(m)/ 溶液质量(m))× 100%”。
以质量分数10%为例,表示该物质溶于水中时,有10%的质量为该物质的质量,而剩下的90%是溶剂或其他溶质的质量。
质量分数与物质的量浓度(溶质的物质的量除以溶液的体积)等物理量不同,但其可以互相换算。
例如,如果有一个溶液的质量为100克,其中含有10克溶质,则其质量分数为10%,若想要转换为物质的量浓度,可参照溶液密度的差异将其转化为一定体积(比如1L)的溶液,再计算溶质的物质的量。
综上,质量分数10%表示的是溶质在溶液中的含量,是一种表示物质浓度的方式。





密度和物质的量浓度求质量分数密度和物质的量浓度是描述物质特性的重要参数,它们可以帮助我们理解物质的组成和性质。
而质量分数则是描述溶液中溶质的含量,是化学中常用的一个概念。
本文将探讨密度和物质的量浓度如何与质量分数相关联,以及它们在化学和物理学中的重要性。
首先,密度是指单位体积内物质的质量,通常用公式ρ = m/V 表示,其中ρ为密度,m为物质的质量,V为物质的体积。
密度是物质的重要特性之一,不同物质的密度可以帮助我们区分它们。
例如,水的密度约为1克/立方厘米,而铁的密度约为7.87克/立方厘米。
通过密度,我们可以判断物质的种类和纯度。
其次,物质的量浓度是指单位体积或单位质量溶剂中溶质的物质的量,通常用公式C = n/V 或 C = n/m 表示,其中C为物质的量浓度,n为溶质的物质的量,V为溶剂的体积,m为溶剂的质量。
物质的量浓度可以帮助我们控制溶液中溶质的含量,是化学实验和工业生产中常用的重要参数。
最后,质量分数是指溶液中溶质的质量占整个溶液质量的比例,通常用公式w% = (m溶质 / m溶液) × 100%表示,其中w%为质量分数,m溶质为溶质的质量,m溶液为溶液的质量。
质量分数可以帮助我们了解溶液中溶质的含量,是评价溶液浓度的重要指标。
密度和物质的量浓度与质量分数之间存在着密切的关系。
通过密度和物质的量浓度,我们可以计算出溶液中溶质的质量,从而得到质量分数。
这些参数的相互关联帮助我们更好地理解物质的组成和性质,为化学和物理学的研究提供了重要的理论基础。
综上所述,密度和物质的量浓度是描述物质特性的重要参数,它们与质量分数之间存在着密切的关系。
通过对这些参数的研究和应用,我们可以更好地理解物质的组成和性质,推动化学和物理学领域的发展。

质量分数算物质的量浓度的公式
在化学中,物质的量浓度是指单位体积(或单位质量)溶液中所含物质的量,通常用摩尔/升(mol/L)表示。
而质量分数是指溶液中溶质质量与溶液总质量之比,通常用百分数表示。
当已知溶液的质量分数和溶质的摩尔质量时,可以通过以下公式计算出物质的量浓度:
浓度(mol/L)= 质量分数(%)×溶液密度(g/mL)÷溶质摩尔质量(g/mol)
其中,溶液密度可以通过实验或文献资料得到。
例如,已知某溶液中钠氯化物(NaCl)的质量分数为5%,溶液密度为1.2 g/mL,求其物质的量浓度。
首先,需要计算出溶液中NaCl的质量。
假设溶液的质量为100 g,则NaCl的质量为5 g。
然后,根据NaCl的摩尔质量为58.44 g/mol,代入上述公式中,得到浓度= 0.103 mol/L。
因此,该溶液中NaCl的物质的量浓度为0.103 mol/L。
- 1 -。


▁▂▃▄▅▆▇█▉▊▋▌精诚凝聚 =^_^= 成就梦想 ▁▂▃▄▅▆▇█▉▊▋▌
▃ ▄ ▅ ▆ ▇ █ █ ■ ▓点亮心灯 ~~~///(^v^)\\\~~~ 照亮人生 ▃ ▄ ▅ ▆ ▇ █ █ ■ ▓ 物质的量浓度与溶质的质量分数
溶液中溶质的质量分数表示的是溶质质量与溶液质量之比。
从这种表示溶液组成的方法中,可以了解和计算一定质量的溶液中所含溶质的质量。
在用溶液中溶质的质量分数表示溶液的组成时,没有涉及到溶液的体积,配制方法也比较简单。
同时这种表示方法最大的不方便,就是溶质的质量分数相同的不同的溶质的溶液中,所含的溶质的物质的量不一定相等。
例如,氯化钠的质量分数为10%的溶液与氯化钡的质量分数为10%的两种溶液中溶质的物质的量是不相等的。
物质的量浓度表示的是溶液中溶质的物质的量与溶液体积之比。
从这种表示溶液组成的方法中,可以了解和计算一定体积的溶液中所含溶质的物质的量。
在用物质的量浓度表示溶液的组成时,涉及到溶液的体积,配制方法虽然略复杂一些,但是它能够反映溶液中所含溶质的物质的量的多少。
同时,这种表示方法最大的方便之处,就是相同体积的相同物质的量浓度的溶液,所含溶质的物质的量一定相等,但溶质的质量并不一定相等。
这样,在运用物质的量浓度进行有关的化学计算时会带来很大的方便。
所以,掌握物质的量浓度的概念及其有关计算方法是非常重要的。
物质的量浓度和溶液中溶质的质量分数比较如下:
物质的量浓度和溶质的质量分数的比较
物质的量浓度与溶液中溶质的质量分数的换算关系
物质的量浓度[c (B)]=)
(1000)()(1
M L mL 溶质的摩尔质量溶液的密度溶质的质量分数-⋅⨯⨯ρω (上式中密度的单位为g ·mL -1,摩尔质量的单位为g ·mol -1
)。