趋化信号转导基因_i_cheA__i_突变对_i_Pseudomonas putida__i_ DLL-1甲基对硫磷的趋化性及原位降解的影响
- 格式:pdf
- 大小:554.19 KB
- 文档页数:6

26(3)241-247 中国生物防治 Chinese Journal of Biological C ontrol 2010年8月群体感应淬灭———防治植物细菌病害的新策略张力群13,田 涛2,梅桂英1(11中国农业大学植物病理系,北京100193;21天津市植物保护研究所,天津300112)摘要:群体感应(quorum sensing,QS)是细菌的一种调控机制,指细菌通过感应特定信号分子的浓度来感知周围环境中自身或其它细菌的数量,并调整相关基因的表达以适应环境的变化。
多种植物病原细菌利用QS系统调控致病因子的表达,因此,QS系统可以作为细菌病害防治的新靶点。
对细菌QS调控机制的干扰和破坏称为群体感应淬灭(quorum quenching)。
本文介绍了QS与植物病原细菌致病性的关系,以及近年来群体感应淬灭研究的新进展。
关 键 词:植物病原细菌;生物防治;群体感应;群体感应淬灭中图分类号:S476;Q93 文献标识码:A 文章编号:100529261(2010)0320241207 Q uorum Q uenching,a N e w Strategy for Controlling Plant B acterial DiseasesZH ANGLi2qun13,TI AN T ao2,MEI G ui2ying1(11Department of Plant Pathology,China Agricultural University,Beijing100193;21Institute of Plant Protection,T ianjin Academy of Agricultural Sciences,T ianjin300112,China)Abstract:Quorum sensing(QS)enables bacteria to m onitor their own population density by means of small,diffusible signals and to coordinate the expression of specialized genes with cell density.Many phytopathogenic bacteria em ploy the QS system to regulate the expression of their virulent factors.This makes QS a very attractive target for the development of novel disease2suppressive strategies.The ability to disrupt QS is known as quorum quenching.This review provides an overview on the relationship be2 tween QS and pathogenicity of phytopathogenic bacteria,and on the progress of the development of the quorum2quenching strategy in plant diseases control during the last decade.K ey w ords:bacterial phytopathogens;biocontrol;quorum sensing;quorum quenching1 细菌的群体感应早在20世纪60年代,研究人员就发现作为单细胞生物的细菌有个体间交流的能力,并能表现出一些多细胞生物的性状,这种细菌间的信号交流方式称作群体感应(quorum sensing, QS)。

i型sam依赖的甲基转移酶甲基转移酶(methyltransferase)是一类广泛存在于生物体内的酶,它在细胞内起着重要的催化作用。
甲基转移酶可以将甲基基团从一个分子转移到另一个分子上,从而改变目标分子的化学性质和功能。
在生物体内,甲基转移酶参与了多种生物过程,包括DNA修复、基因表达调控、信号转导等。
其中,DNA甲基化是甲基转移酶最为重要的功能之一。
DNA甲基化是指将甲基基团添加到DNA分子上,从而改变DNA的结构和功能。
这一过程在细胞分化、发育以及疾病的发生和进展中起着重要作用。
甲基转移酶可以分为多个亚型,其中i型SAM依赖的甲基转移酶是其中的一类。
i型SAM依赖的甲基转移酶是指依赖于S-腺苷甲硫氨酸(S-adenosylmethionine,SAM)作为甲基供体的甲基转移酶。
SAM是一种常见的辅酶,它是由腺苷三磷酸(ATP)和L-甲硫氨酸(L-methionine)通过SAM合成酶催化合成的。
i型SAM依赖的甲基转移酶在生物体内具有广泛的分布和多样的功能。
它们参与了许多重要的生物过程,如DNA甲基化、RNA修饰、蛋白质修饰等。
这些过程对于维持细胞正常功能和生命活动至关重要。
以DNA甲基化为例,i型SAM依赖的甲基转移酶可以将甲基基团添加到DNA分子上,从而改变DNA的结构和功能。
这种改变可以影响DNA的可读性,进而影响到基因的表达。
在细胞分化和发育过程中,通过DNA甲基化可以实现细胞类型特异性基因表达的调控。
此外,DNA甲基化还与一些疾病的发生和进展密切相关,如癌症、心血管疾病等。
除了参与DNA甲基化,i型SAM依赖的甲基转移酶还可以参与RNA修饰。
RNA修饰是指通过在RNA分子上添加化学修饰基团来改变RNA的结构和功能。
这种修饰可以影响RNA 的稳定性、转运能力以及与其他分子的相互作用。
i型SAM 依赖的甲基转移酶可以在RNA分子上添加甲基基团,从而实现对RNA结构和功能的调控。
此外,i型SAM依赖的甲基转移酶还可以参与蛋白质修饰。

综述BRAF基因V600E突变与甲状腺乳头状癌关系的研究进展张富全ꎬ王兴越ꎬ高英堂ꎬ孟祥朝(天津医科大学天津市第三中心医院ꎬ天津300170)㊀㊀摘要:甲状腺乳头状癌(PTC)是起源于甲状腺滤泡上皮细胞的恶性肿瘤ꎬBRAFV600E突变是PTC中最常见的基因突变ꎬ与PTC的病理特征㊁侵袭性㊁复发和相关病死率有密切关联ꎮ本综述主要从BRAFV600E突变在PTC的发病机制与其病理特征相关性着手ꎬ论述其在临床诊断及预后方面的应用ꎬ并大体概括目前为止BRAFV600E突变在治疗PTC方面的应用现状ꎬ希望对甲状腺癌精准诊治制定更为个体化的治疗方案有所帮助ꎮ㊀㊀关键词:甲状腺乳头状癌ꎻBRAFV600Eꎻ诊断ꎻ治疗ꎻ预后㊀㊀doi:10.3969/j.issn.1002 ̄266X.2019.34.024㊀㊀中图分类号:R736.1ꎻR349.8㊀㊀文献标志码:A㊀㊀文章编号:1002 ̄266X(2019)34 ̄0087 ̄06通信作者:孟祥朝(E ̄mail:mxc5168@sina.com)㊀㊀甲状腺癌(TC)是内分泌系统最常见的恶性肿瘤ꎬ约占所有甲状腺结节的5%ꎬ全身恶性肿瘤的1%[1]ꎮ根据WHO病理分型TC主要包括以下四大类:甲状腺乳头状癌(PTC)㊁甲状腺滤泡状癌(FTC)㊁甲状腺髓样癌(MTC)和甲状腺未分化癌(ATC)ꎮ其中PTC是最常见的病理类型ꎬ占TC的90%以上[2]ꎮ最新数据显示TC的发病率仍在不断上升ꎬ预计占女性恶性肿瘤的4%ꎬ排第5位[3]ꎬ其中甲状腺微小乳头状癌(PTMC)占主要部分ꎬ这与环境的改变㊁高分辨超声等诊断技术的进步有关ꎮ随着分子生物学的进展ꎬ越来越多的TC相关基因突变被报道ꎬ主要包括BRAF㊁RAS和TERT等基因突变ꎬ以及RET/PTC和PAX8 ̄PPARγ重排㊁DNA甲基化等[4]ꎬ其中BRAF突变是PTC中最常见的ꎬ而BRAF突变中以BRAFV600E突变为主ꎬ也是研究最多㊁应用最广泛的ꎮ在中国ꎬPTC患者中BRAFV600E突变的阳性率为69.0%~85.3%ꎬ且近年来在PTC中的比例还有上升的趋势ꎮ现对BRAFV600E突变与PTC的关系及其在临床中的应用进展进行综述ꎬ为PTC患者制定个体化精准治疗方案提供参考ꎮ1㊀BRAFV600E致病机制㊀㊀BRAF(又称鼠类肉瘤滤过性毒菌致癌同源体B1)基因ꎬ属于RAF激酶基因家族ꎬ位于人染色体7q34ꎬ含18个外显子ꎬ编码B型有丝分裂原激活的蛋白依赖性激酶(又称为BRAF激酶)ꎬ是一种丝氨酸/苏氨酸蛋白激酶ꎬ是RAS ̄RAF ̄MEK ̄ERK/MAPK信号传导级联反应的重要组成部分ꎬ在细胞的分化及增殖中发挥着重要作用[5]ꎮBRAFV600E突变是位于BRAF基因第15外显子的T1799A点突变ꎬ导致其编码产物的第600位氨基酸由缬氨酸(V)变为谷氨酸(E)ꎮ除罕见的BRAF突变(如:K601E㊁AKAP9 ̄BRAF㊁V599ins和V600D+FGLAT601 ̄605ins)外ꎬPTC中90%以上的BRAF突变为V600EꎮBRAFV600E突变导致RAS ̄RAF ̄MEK ̄ERK/MAPK通路持续激活ꎬ诱导细胞有丝分裂能力增强ꎬ最终使细胞异常增殖并诱导肿瘤发生[6]ꎮ㊀㊀还有研究发现ꎬBRAFV600E突变也能引起钠碘转运体(NIS)基因启动子组蛋白的去乙酰化ꎬ导致染色质紧实ꎬ阻断基因启动子与转录因子的结合ꎬ使NIS基因沉默[7]ꎮ与未发生突变的PTC组织相比ꎬBRAFV600E突变组织中NIS表达水平较低ꎬ使PTC细胞摄碘能力下降ꎬ从而导致放射性碘(RAI)治疗效果差ꎬ增加了肿瘤的难治性ꎮ另外ꎬBRAFV600E突变会促进促甲状腺素受体(TSHR)基因启动子甲基化ꎬ导致TSHR沉默或者表达显著下降ꎬ使促甲状腺素(TSH)反馈性升高ꎬ促进肿瘤细胞的生长[8]ꎮBRAFV600E基因突变协同端粒酶反转录酶(TERT)启动子突变也在PTC的发生中发挥着重要作用ꎬ二者共同存在于PTC的比例为7%~8%[10]ꎬ其可能的机制是异常激活BRAFV600E ̄MAPK ̄FOS ̄GABP ̄TERT信号转导通路ꎬ经BRAFV600E激酶磷酸化的低聚果糖(FOS)在此通路上发挥了重要作用[24]ꎮ此外ꎬBRAFV600E突变通过癌基因MYC78以非TERT启动子突变依赖性的方式上调TERT表达同样促进了PTC的发生[9]ꎮXing等[10]研究发现ꎬ同时携带有BRAF和TERT两种突变会导致PTC患者的复发和死亡风险急剧上升ꎮ上述研究表明BRAFV600E突变是PTC形成与进展过程中的重要分子改变ꎬ为PTC的诊断及靶向治疗提供了理论基础ꎮ2㊀BRAFV600E在PTC诊断中的应用㊀㊀随着超声技术的发展ꎬ在随机选择人群中甲状腺结节的检出率为19%~67%[11]ꎬTC在甲状腺结节中占5%~10%ꎬ因此ꎬ术前诊断结节良恶性对于甲状腺结节患者十分重要ꎬ可以避免很多诊断性手术ꎬ减少手术相关并发症ꎮ当前ꎬ初步判断结节性质的检查为高分辨超声结合甲状腺影像报告和数据系统(TI ̄RADS)分级ꎮ而术前判断结节良恶性的标准依然是细胞学检查ꎬ即细针穿刺活检(FNAB)ꎮ目前ꎬFNAB是诊断甲状腺结节的一种较为准确㊁经济㊁微创的方法ꎬ据报道ꎬFNAB诊断PTC的灵敏度为83%㊁特异度为92%[11]ꎮ但其存在一定的局限性:穿刺样本量过少ꎬ不能完全代表肿瘤组织ꎻ潜在的背景污染ꎻ穿刺到正常甲状腺组织ꎻ未穿刺到肿瘤组织等原因ꎬ造成诊断不明确及假阴性结果ꎮ对于涉及到组织结构异常的滤泡性肿瘤ꎬ在细胞学水平无法明确诊断ꎮ此项检查也与医师穿刺技巧及病理科医师诊断经验有很大关系ꎮKim等[12]研究显示ꎬ10%~40%的FNAB结果不能明确诊断ꎬ其中20%~25%的结节在术后石蜡病理中确诊为恶性肿瘤ꎮ㊀㊀随着TC相关分子生物学的研究进展ꎬ大量研究发现BRAFV600E突变只见于PTC和ATCꎬ而在FTC㊁MTC和良性结节中未见ꎮ所以ꎬ若能在术前利用FNAB诊断PTC时ꎬ同时检测相关基因突变ꎬ这将会提高诊断的准确性ꎮ研究发现ꎬ术前单独应用FNAB诊断PTC的敏感性㊁特异性㊁阳性预测值㊁阴性预测值分别是44%㊁100%㊁100%㊁92.9%ꎬ联合分子生物学(包含BRAF㊁RAS㊁RET/PTC和PAX8/PPAR等ꎬ其中以BRAF基因突变最常见)检测后ꎬ敏感性㊁特异性㊁阳性预测值㊁阴性预测值分别可达到80%㊁99.7%㊁97.6%㊁97.4%ꎬ这提示FNAB联合BRAFV600E基因检测可提高诊断的准确度[13]ꎮZhang等[14]研究也发现ꎬFNAB联合BRAFV600E诊断PTC的准确性要明显高于单独应用FNABꎮ2014年ꎬ一项关于PTC患者FNAB标本联合分子检测的研究指出ꎬ虽然分子检测诊断并不优于细胞学ꎬ但将二者结合ꎬ可以将诊断的准确性从89.57%提高到98.26%[15]ꎮ基于这些研究成果ꎬ2015年美国甲状腺协会(ATA)发布的癌症管理指南提出ꎬ甲状腺结节的患者在细胞学检查不确定时ꎬ建议使用分子标志物(如BRAF㊁RAS㊁RET基因突变等)进行辅助诊断[16]ꎮ2018年NCCN指南中也改变了传统做法并指出:对FNAB诊断不确定的结节ꎬ可以重复FNAB或者考虑分子生物学诊断ꎮ随着TC相关的基因突变被相继发现ꎬFNAB联合多基因检测的应用可以进一步提高细胞学诊断的准确度ꎬ弥补了FNAB诊断的不足ꎬ但可能导致假阳性结果ꎬ因为有的基因突变(如RAS突变)可见于甲状腺良性肿瘤ꎮ㊀㊀肿瘤细胞游离DNA(cfDNA)由肿瘤细胞坏死或凋亡后释放ꎬ或者由肿瘤细胞分泌而进入血液循环ꎮ随着关于cfDNA研究的深入ꎬ再一次将BRAFV600E突变检测在PTC中的应用提高了一个台阶ꎮNichols等在26例确诊为PTC的患者术前血浆标本中ꎬ检测到8例患者(占30.8%)有BRAFV600EcfDNAꎮ同时ꎬ随访其中6例术前存在BRAFV600EcfDNA的患者ꎬ均于术后1个月复查ꎬ1例术后血浆中可检测到BRAFV600EcfDNAꎬ但水平明显下降ꎬ其余5例均未检出BRAFV600EcfDNAꎮ他们认为BRAFV600EcfDNA对PTC的诊断及术后随访有一定作用ꎮ韩国学者Kim等[18]对72例PTC患者进行了肿瘤组织DNA和血浆DNA检测ꎬ其中49例(68.1%)有BRAFV600E突变ꎬ仅3例(6.1%)PTC患者血浆存在BRAFV600E突变DNAꎬ但这3例患者均有侧颈淋巴结转移和肺转移ꎮLubitz等研究发现ꎬ血液中存在BRAFV600EcfDNA的PTC患者经过手术㊁靶向治疗或131I治疗后ꎬ其血液中BRAFV600E水平较治疗前明显下降ꎬ且血液中BRAFV600E水平与肿瘤大小㊁TSH水平㊁甲状腺球蛋白(Tg)水平或治疗后抽血时间无关ꎬ仅与肿瘤的甲状腺外侵犯相关ꎮ以上研究结果表明ꎬ检测BRAFV600EcfDNA对于PTC的诊断㊁预测侧颈淋巴结转移和远处转移有一定作用ꎮ同时也可以反映部分患者的治疗效果ꎮ㊀㊀结合相关文献ꎬ将PTC患者血液中检测BRAFV600E的优势概括如下:与FNAB相比ꎬ血液检测更加简便ꎬ侵入性更小ꎬ同时更廉价㊁更安全ꎻ可避免FNAB对多灶癌穿刺不全面而造成的假阴性结果ꎬ提高多灶性PTC患者诊断的敏感性ꎻ血液学检测可提供连续的㊁定量的㊁可跟踪的信息ꎬ对于存在甲状腺球蛋白抗体㊁非甲状腺全切的患者以及接受BRAF抑制剂靶向治疗的晚期PTC患者ꎬBRAFV600EcfDNA可作为肿瘤标志物用于术后随访和疗效监测[19]ꎮ然而cfDNA的量过少ꎬ目前的检测技术88只能在大约10%携带BRAFV600E突变的PTC患者的血液中检测到BRAFV600EcfDNAꎬ这种较低的敏感性ꎬ极大限制了其在临床中的应用[20]ꎮ其次ꎬ对于血浆BRAFV600E阳性的患者来说ꎬ不能除外患者患有黑色素瘤㊁非小细胞型肺癌㊁结肠癌等恶性肿瘤的可能ꎬ因为该基因突变也可见于上述恶性肿瘤中ꎮBRAFV600EcfDNA突变检测联合cfDNA甲基化和其他基因突变(如:Calca㊁Cdh1㊁TIMP3㊁DAPK和RARβ2等)检测也可以进一步提高诊断的敏感性和特异性[20]ꎬ但相关研究目前较少ꎬ且cfD ̄NA提取和检测的方法也不同ꎬ所以ꎬ期待未来有更加敏感的检测方式以及多中心㊁大样本的研究出现ꎬ进一步论证cfDNA在PTC诊断当中的作用ꎮ在PTC的诊治中ꎬ血浆中cfDNA的BRAFV600E突变的检测更方便ꎬ且可提供术后连续性随访数据ꎬ但目前因提取方法以及诊断的特异性尚需改进ꎬ其临床应用仍有局限性ꎮ3㊀BRAFV600E与PTC临床病理特征及预后的关系㊀㊀PTC患者经手术治疗后ꎬ基于传统的复发风险分层ꎬ包括甲状腺腺外或者血管侵犯㊁中央区或侧颈淋巴结转移㊁远处转移㊁肿瘤的组织学亚型等因素ꎬ予以相应的TSH抑制治疗或者131I治疗ꎮPTC患者总体预后是乐观的ꎬ生存率较高ꎬ但对于有侵袭性病理特征的患者ꎬ治疗效果并不理想ꎬ复发率和病死率较高ꎮ所以ꎬ如果对这部分患者做到早期识别将会有重要意义ꎮBRAFV600E突变在PTC的各亚型之间发生率不尽相同ꎬ其中经典型约为60%ꎬ高细胞型约为77%ꎬPTC衍生型约为25%ꎬ而滤泡变异型PTC中BRAFV600E突变的检出率仅为0~12%[21]ꎮ研究表明ꎬBRAFV600E突变与PTC更具侵袭性的临床病理特征(如多灶性㊁腺外侵犯㊁淋巴结转移㊁远处转移㊁高TNM分期㊁放射性碘抵抗以及术后复发率和病死率)呈正相关[22ꎬ23]ꎬ而与患者年龄㊁性别的关系仍不明确[24]ꎮXing等[25]通过一项纳入2099例患者的多中心研究(随访时间中位数为36个月ꎬIQR为14~75个月)发现ꎬBRAFV600E阳性组复发率为20.9%(213/1017)ꎬBRAFV600E阴性组复发率为11.6%(125/1082)ꎬHR为1.82(95%CI:1.46~2.28)ꎬ在调整了医疗中心㊁各种常规病理因素㊁患者性别和年龄的多变量模型中ꎬ这种差异仍然是显著的ꎬ认为BRAFV600E突变对PTC复发具有独立的预后价值ꎮBRAFV600E突变与PTC肿瘤的大小同样也有联系ꎮ在肿瘤直径<20mm的PTC患者中ꎬBRAFV600E突变率更高ꎬ且当肿瘤直径<10mm时ꎬ伴有BRAFV600E突变的肿瘤更具侵袭性ꎬ这提示BRAFV600E突变会增加PTMC的不良预后[26]ꎮ桥本甲状腺炎是一种常见的甲状腺慢性炎症ꎮ研究发现ꎬ合并桥本甲状腺炎的PTC患者BRAFV600E突变率较低ꎬ同时疾病的侵袭性也更低ꎬ提示桥本甲状腺炎可能是PTC的保护因素[27]ꎮ2015年ATA发布的成人甲状腺结节与分化型甲状腺癌(DTC)指南把BRAFV600E突变检测作为术前风险分层的参考因素ꎬ术前对BRAFV600E突变状态的检测ꎬ有助于指导手术方式及术后治疗和随访ꎮBRAFV600E突变检测对PTMC患者的术后随访作用更加明显ꎬ因为此类患者TNM分期一般较低ꎬ基于传统复发危险风险分层ꎬ其复发风险较小ꎬ应用BRAFV600E突变检测可以筛选出复发风险较高的PTMC患者ꎮ所以ꎬ诊断为Ⅰ/Ⅱ期且BRAFV600E突变阳性的PTC患者将会得到更为积极的治疗和随访ꎮ㊀㊀目前ꎬBRAFV600E突变对PTC患者预后是否有影响仍有很多不同的观点ꎮ有文献明确指出BRAFV600E和不良预后相关[24]ꎬ也有研究者[28]认为它只是侵袭性因素ꎬ而不是真正的预后因素ꎬ因为在双变量分析中ꎬ它与侵袭性特征和病死率显著相关ꎬ当分析中加入其他临床变量时ꎬ比如年龄㊁性别㊁肿瘤大小㊁TNM分期ꎬ相关性消失ꎮ这些研究的不一致处可能是因为选取研究对象的疾病处于不同的阶段以及所采用的实验方法不同等ꎬ因此ꎬ仍需要更深入的研究来证实BRAFV600E突变检测是否可以作为一个判断预后的标志ꎮ4㊀BRAFV600E在PTC治疗中的应用㊀㊀PTC的治疗方式以手术切除为主ꎬ也是最重要的治疗方式ꎮ术后辅以TSH抑制或放射性碘治疗ꎬ可以使PTC患者的5年生存率达到97.8%ꎮ但对分化较差㊁放射性碘抵抗㊁复发及转移性PTC患者的治疗效果并不理想ꎬ因此需要更为有效的治疗方式ꎮ靶向治疗是近年来出现的新型治疗方式ꎬ逐渐被用于治疗难治性甲状腺癌ꎬ并取得了一定的疗效ꎮBRAFV600E突变就是其中一个重要的靶点ꎬ用于治疗BRAFV600E突变的PTC患者的靶向药物主要包括BRAFV600E抑制剂和酪氨酸激酶受体拮抗剂(TKI)ꎬ见表1ꎮ目前ꎬBRAFV600E抑制剂已经很成熟的应用于黑色素瘤的治疗当中ꎬ在PTC治疗方面ꎬ研究较多的主要是威莫菲尼和达帕菲尼ꎮ2016年ꎬ一项入组51例来自10个不同机构的复发或转移性RAIR ̄PTC患者ꎬ给予960mg威莫菲尼ꎬ每天2次ꎬ平均随访18.8个月ꎬ结果显示患者的总98缓解率为38.5%ꎬ35%的患者病情稳定至少6个月ꎬ73%患者达到疾病控制[29]ꎮ威莫菲尼的主要不良反应包括疲劳㊁体质量减轻㊁畏食㊁关节痛㊁脱发㊁皮疹㊁手足综合征㊁腹泻㊁发热㊁口干㊁恶心以及疣状角化病ꎮ同时ꎬ针对达帕菲尼的研究也在逐渐增多并且显示出较好的发展前景ꎮBRAFV600E抑制剂的耐药性限制了其临床疗效ꎬ其耐药性的产生主要是由于ERK信号通路的激活ꎬ从而导致患者在短时间内耐药ꎮ对于BRAFV600E野生型的PTC患者ꎬBRAFV600E抑制剂有刺激其增长的可能[30]ꎬ其机制可能是其通过刺激RAS的表达ꎬ促进肿瘤细胞的生长和转移ꎮ所以ꎬ对于BRAFV600E野生型的癌症患者ꎬ包括RAS突变的患者ꎬ是BRAF抑制剂治疗的禁忌ꎮ表1㊀PTC相关分子靶向药物名称英文名种类作用靶点不良反应适应证进展状态索拉非尼SorafenibTKIVEGFR手足综合征㊁腹泻㊁疲劳㊁皮疹㊁体质量减轻㊁高血压RAIR ̄DTCFDA批准且在国内上市CRAFBRAFC ̄kitPDGFRRET凡德他尼VandetanibTKIRET腹泻㊁皮疹㊁恶心不能手术的晚期MTCFDA批准VEGFR高血压㊁头痛EGFRRET ̄KIF58重排乐伐替尼LenvatinibTKIVEGFR高血压㊁疲乏ꎬ腹泻㊁关节痛㊁肌肉痛㊁食欲减退㊁体质量减轻㊁恶心有局部复发或转移或进展性DTCFDA批准FGFRPDGFRRETc ̄KITRR ̄DTCBRAFV600ERET ̄KIF58CCDC6 ̄RETNcoA4 ̄RET重排卡博替尼CabozantinibTKIVEGFR1腹泻㊁手足皮肤反应㊁疲乏㊁高血压㊁少部分胃肠道穿孔和肠瘘MTCFDA批准VEGFR2RETMET威莫菲尼VemurafenibBRAFV600E抑制剂BRAF疲劳㊁体质量减轻㊁畏食㊁关节痛㊁脱发㊁皮疹㊁手足综合征㊁腹泻㊁发热㊁口干㊁恶心㊁疣状角化病转移性PTCⅡ期临床试验达帕菲尼DabrafenibBRAFV600E抑制剂BRAFV600E皮肤增厚ꎬ头痛ꎬ发热ꎬ关节痛ꎬ脱毛ꎬ掌趾红肿疼痛综合征转移性PTCⅡ期临床试验司美替尼SelumetinibBRAFV600E抑制剂MEK1腹泻㊁疲劳㊁厌食㊁手足皮肤反应和高血压RAIR ̄DTCⅡ期临床试验MEK2晚期DTC㊀㊀索拉菲尼和乐伐替尼已经被FDA批准用于BRAFV600E突变阳性的PTC患者的治疗ꎬ两者都属于多靶点TKIꎮ一项纳入417例碘治疗失败的复发或转移性DTC患者的研究显示ꎬ接受索拉非尼治疗的患者与安慰剂组相比ꎬ索拉非尼可以延长DTC患者的无进展生存期(PFS)多达5个月ꎬ明显改善了转移性RAIR ̄DTC患者的生存情况[31]ꎮ2015年ꎬ一项纳入21个国家的392例碘治疗失败的复发或转移性DTC患者的研究显示ꎬ乐伐替尼组患者的总缓解率为64.8%ꎬ明显高于安慰剂组的1.5%(P﹤0.001)[32]ꎮ一项关于凡德他尼的多中心㊁随机对照的Ⅲ期临床试验显示ꎬ与安慰剂治疗的患者相比ꎬ接受凡德他尼治疗的患者PFS对比安慰剂组显著延长(30.5个月vs19.3个月)[33]ꎮTKI的严重或致命毒副作用包括皮肤毒性㊁出血㊁高血压㊁脑卒中和肝脏毒性ꎬ然而ꎬ大多数毒副作用可以通过停止使用药物来控制和逆转[34]ꎮ㊀㊀此外ꎬ还有研究显示ꎬ与BRAFV600E抑制剂单药治疗相比ꎬBRAFV600E抑制剂和MEK抑制剂二者联用治疗效果要更好ꎬ二者联用不仅可以提高患09者PFSꎬ并且还可以减轻不良反应[30]ꎮ在黑色素瘤的治疗中ꎬ二者联用的疗效已经得到证实ꎮ2018年NCCN指南提出ꎬ对于BRAFV600E阳性的PTC患者ꎬ可以联用BRAFV600E抑制剂达帕菲尼和MEK抑制剂曲美替尼ꎮ同时ꎬ乐伐替尼和索拉菲尼被推荐用于放射性碘抵抗的患者ꎬ而重新获得摄碘能力ꎮ故对于晚期PTC或分化较差TC患者ꎬ推荐分子学检测ꎬ指导靶向用药ꎮ㊀㊀BRAFV600E突变是PTC最常见的基因突变ꎬ在术前诊断㊁治疗㊁危险分层等方面已初步展现出令人鼓舞的结果ꎬ但是否可以指示预后ꎬ仍然存在争议ꎬ需进一步的研究ꎮ靶向药物的研究是目前研究热点ꎬ不良反应及耐药性是其局限性ꎬ后续仍需要更多的研究ꎬ或许可以多药联用ꎬ以提升效果ꎮ在血浆cfDNA方面ꎬ目前检测技术的敏感性还较低ꎬ期待有更加敏感的检测技术出现ꎬ会为术前诊断和术后随访带来深远影响ꎮ因此ꎬ还需要广大学者及医疗中心对BRAFV600E突变进行更深入的研究ꎬ指示并验证其临床应用价值ꎮ参考文献:[1]SiegelRLꎬMillerKDꎬJemalA.Cancerstatisticsꎬ2017[J].CACancerJClinꎬ2016ꎬ60(5):277 ̄300.[2]CabanillasMEꎬMcfaddenDGꎬDuranteC.Thyroidcancer[J].Lancetꎬ2016ꎬ388(10061):2783 ̄2795.[3]SiegelRLꎬMillerKDꎬJemalA.Cancerstatisticsꎬ2019[J].CACancerJClinꎬ2019ꎬ69(1):7 ̄34.[4]王松ꎬ项承ꎬ王平.甲状腺癌相关基因检测进展及意义[J].中国实用外科杂志ꎬ2019ꎬ39(3):268 ̄270ꎬ274.[5]TorregrossaLꎬViolaDꎬSensiEꎬetal.Papillarythyroidcarcino ̄mawithrareexon15BRAFmutationhasindolentbehavior:Asin ̄gle ̄institutionexperience[J].JClinEndocrinolMetabꎬ2016ꎬ110(11):4413 ̄4420.[6]LavoieHꎬTherrienM.RegulationofRAFproteinkinasesinERKsignalling[J].NatRevMolCellBiolꎬ2015ꎬ16(5):281 ̄298. [7]ZhangZꎬLiuDꎬMuruganAKꎬetal.HistonedeacetylationofNISpromoterunderliesBRAFV600E ̄promotedNISsilencinginthyroidcancer[J].EndocrRelatCancerꎬ2014ꎬ21(2):161 ̄173. [8]KhanMSꎬPandithAAꎬMasoodiSRꎬetal.EpigeneticsilencingofTSHRgeneinthyroidcancerpatientsinrelationtotheirBRAFV600Emutationstatus[J].Endocrineꎬ2014ꎬ47(2):449 ̄455. [9]KongJSꎬKimHJꎬKimMJꎬetal.ThesignificanceofTROP2ex ̄pressioninpredictingBRAFmutationsinpapillarythyroidcarcino ̄ma[J].JPatholTranslMedꎬ2018ꎬ52(1):14 ̄20.[10]XingMꎬLiuRꎬLiuXꎬetal.BRAFV600EandTERTpromotermutationscooperativelyidentifythemostaggressivepapillarythy ̄roidcancerwithhighestrecurrence[J].JClinOncolꎬ2014ꎬ32(25):2718 ̄2726.[11]MisiakosEP.Cytopathologicdiagnosisoffineneedleaspirationbiop ̄siesofthyroidnodules[J].WorldJClinCasesꎬ2016ꎬ4(2):38 ̄48. [12]KimWYꎬKimHꎬHwangTS.Comparisonbetweenreal ̄timePCRandpyrosequencingfordetectionofBRAFV600Emutationinthy ̄roidfine ̄needleaspirates[J].ApplImmunohistochemMolMor ̄pholꎬ2017ꎬ25(5):358 ̄365.[13]NikiforovYEꎬStewardDLꎬRobinson ̄SmithTMꎬetal.Moleculartestingformutationsinimprovingthefine ̄needleaspirationdiagno ̄sisofthyroidnodules[J].JClinEndocrinolMetabꎬ2009ꎬ94(6):2092 ̄2098.[14]ZhangBꎬLiuSꎬZhangZꎬetal.AnalysisofBRAF(V600E)mu ̄tationandDNAmethylationimprovesthediagnosticsofthyroidfineneedleaspirationbiopsies[J].DiagnPatholꎬ2014ꎬ9:45. [15]LiuSꎬGaoAꎬZhangBꎬetal.Assessmentofmoleculartestinginfine ̄needleaspirationbiopsysamples:AnexperienceinaChinesepopulation[J].ExpMolPatholꎬ2014ꎬ97(2):292 ̄297. [16]HaugenBRꎬAlexanderEKꎬBibleKCꎬetal.2015AmericanThy ̄roidAssociationmanagementguidelinesforadultpatientswiththy ̄roidnodulesanddifferentiatedthyroidcancer:theAmericanThy ̄roidAssociationGuidelinesTaskForceonThyroidNodulesandDifferentiatedThyroidCancer[J].Thyroidꎬ2016ꎬ26(1):1 ̄133. [17]PupilliCꎬPinzaniPꎬSalviantiFꎬetal.CirculatingBRAFV600Einthediagnosisandfollow ̄upofdifferentiatedpapillarythyroidcarcinoma[J].JClinEndocrinolMetabꎬ2013ꎬ98(8):3359 ̄3365.[18]KimBHꎬKimIJꎬLeeBJꎬetal.DetectionofplasmaBRAF(V600E)mutationisassociatedwithlungmetastasisinpapillarythyroidcarcinomas[J].YonseiMedJꎬ2015ꎬ56(3):634 ̄640. [19]SpencerCA.Clinicalutilityofthyroglobulinantibody(TgAb)measurementsforpatientswithdifferentiatedthyroidcancers(DTC)[J].JClinEndocrinolMetabꎬ2011ꎬ96(12):3615 ̄3627. [20]FusseyJMꎬBryantJLꎬBatisNꎬetal.TheclinicalutilityofCell ̄FreeDNAmeasurementindifferentiatedthyroidcancer:asystem ̄aticreview[J].FrontOncolꎬ2018ꎬ8:132.[21]TangKTꎬLeeCH.BRAFmutationinpapillarythyroidcarcinoma:pathogenicroleandclinicalimplications[J].JChinMedAssocꎬ2010ꎬ73(3):113 ̄128.[22]PrescottJDꎬSadowPMꎬHodinRAꎬetal.BRAF(V600E)statusaddsincrementalvaluetocurrentriskclassificationsystemsinpre ̄dictingpapillarythyroidcarcinomarecurrence[J].Surgeryꎬ2012ꎬ152(6):984 ̄990.[23]XingMꎬAlzahraniASꎬCarsonKAꎬetal.AssociationbetweenBRAFV600Emutationandmortalityinpatientswithpapillarythy ̄roidcancer[J].JAMAꎬ2013ꎬ309(14):1493 ̄1501.[24]LiuRꎬZhangTꎬZhuGꎬetal.RegulationofmutantTERTbyBRAFV600E/MAPkinasepathwaythroughFOS/GABPinhumancancer[J].NatCommunꎬ2018ꎬ9(1):579.[25]XingMꎬAlzahraniASꎬCarsonKAꎬetal.AssociationbetweenBRAFV600Emutationandrecurrenceofpapillarythyroidcancer[J].JClinOncolꎬ2015ꎬ1ꎬ33(1):42 ̄50.[26]KimSKꎬLeeJHꎬWooJWꎬetal.BRAFV600Emutation:differ ̄entialimpactoncentrallymphnodemetastasisbytumorsizeinpa ̄pillarythyroidcarcinoma[J].HeadNeckꎬ2016ꎬ38Suppl1:E1203 ̄1209.[27]KimSJꎬMyongJPꎬJeeHGꎬetal.CombinedeffectofHashimotoᶄsthyroiditisandBRAF(V600E)mutationstatusonaggressivenessinpapillarythyroidcancer[J].HeadNeckꎬ2016ꎬ38(1):95 ̄101.19细胞应激对外泌体功能影响的研究进展刘朝阳1ꎬ李文博2ꎬ王炜2ꎬ胡雅茹1ꎬ任伟宏2(1河南中医药大学ꎬ郑州450000ꎻ2河南中医药大学第一附属医院)㊀㊀摘要:外泌体是细胞分泌的直径30~150nm的细胞外囊泡ꎬ由脂质㊁核酸和蛋白质组成ꎬ介导着细胞间的信息交流ꎮ细胞应激是细胞对各种不利因素产生的一系列增强细胞生存能力的适应性代偿反应ꎮ研究表明ꎬ外泌体是细胞应对各种不同的应激因素的关键分子ꎬ研究细胞应激对外泌体功能的影响有助于阐明疾病的发病机制和疗效ꎮ本文就细胞应激(包括热应激㊁氧化应激㊁低氧应激㊁基因毒应激㊁营养应激)对外泌体功能的影响进行了综述ꎮ㊀㊀关键词:外泌体ꎻ热应激ꎻ氧化应激ꎻ低氧应激ꎻ基因毒应激ꎻ营养应激㊀㊀doi:10.3969/j.issn.1002 ̄266X.2019.34.025㊀㊀中图分类号:Q256㊀㊀文献标志码:A㊀㊀文章编号:1002 ̄266X(2019)34 ̄0092 ̄04㊀㊀外泌体是细胞内多囊泡体与细胞膜融合释放到细胞外环境的直径30~150nm的囊泡ꎬ外泌体由脂质㊁核酸(mRNA㊁miRNA㊁lncRNA和circRNA)和蛋白质(受体ꎬ转录因子ꎬ酶)组成[1ꎬ2]ꎮ细胞通过外泌体将脂质㊁核酸或蛋白质转移至受体细胞中ꎬ介导细胞间通信ꎬ调节细胞的生理和病理状态ꎬ如炎症㊁免疫反应㊁血管生成㊁细胞死亡㊁神经退行性疾病和癌症等[3]ꎮ细胞应激是指在细胞受到各种理化代谢或生物性损伤因素时ꎬ产生一系列适应性的代偿反应ꎬ以增强细胞的抗损伤能力和生存能力ꎮ现已发现ꎬ细胞能够通过外泌体来对应激做出反应ꎬ即不同的应激因素会影响细胞分泌的外泌体的丰度㊁组成以及功能ꎬ以此来调节细胞间的信息交流[4]ꎮ对外泌体介导的细胞应激反应的深入研究ꎬ有助于人们阐明疾病的发病机制以及疾病治疗的疗效ꎮ现就细基金项目:河南省高等学校重点科研项目(19zx009)ꎮ通信作者:任伟宏(E ̄mail:ren_weihong@163.com)胞应激(包括热应激㊁氧化应激㊁低氧应激㊁基因毒应激㊁营养应激)对外泌体功能的影响进行综述ꎮ1 热应激对外泌体功能的影响㊀㊀热是最常见的应激因素之一ꎬ蛋白质会因温度升高而变性ꎬ进而失去活性和丧失功能ꎬ因此热应激是细胞应激中典型的蛋白毒性类型ꎮ蛋白质功能发生变化会干扰细胞内部的稳态ꎬ产生热休克反应(HSR)ꎮHSR的主要效应物是热休克蛋白(HSP)ꎬHSP能帮助蛋白质恢复正常的生理功能ꎬ维持细胞的稳态ꎮ研究表明ꎬ不论外泌体来源如何ꎬ其内部均广泛存在着HSP70和HSP90[5]ꎮCho等[6]发现热应激(43ħꎬ30min)处理后的小鼠结肠癌细胞分泌的外泌体中HSP70的含量较未经处理的细胞高ꎬ同时ꎬ热应激处理后产生的外泌体能够激活树突状细胞和巨噬细胞ꎬ触发协同免疫反应ꎬ并能增强辅助性T细胞1(Th1)型免疫应答ꎬ清除肿瘤细胞ꎮZhong等[7]发现ꎬ热应激(42.8ħꎬ4h)能够使胃癌患者的[28]CiarrocchiAꎬCavutoSꎬPianaS.BRAFV600Emutationandpa ̄pillarythyroidcancer[J].JAMAꎬ2013ꎬ310(5):534. [29]BroseMSꎬCabanillasMEꎬCohenEEꎬetal.Vemurafenibinpa ̄tientswithBRAF(V600E) ̄positivemetastaticorunresectablepap ̄illarythyroidcancerrefractorytoradioactiveiodine:anon ̄random ̄isedꎬmulticentreꎬopen ̄labelꎬphase2trial[J].LancetOncolꎬ2016ꎬ17(9):1272 ̄1282.[30]RoskoskiRJr.TargetingoncogenicRafproteinserine/threonineki ̄nasesinhumancancers[J].PharmacolResꎬ2018ꎬ135:239 ̄258. [31]BroseMSꎬNuttingCMꎬJarzabBꎬetal.Sorafenibinradioactivei ̄odine ̄refractoryꎬlocallyadvancedormetastaticdifferentiatedthy ̄roidcancer:arandomisedꎬdouble ̄blindꎬphase3trial[J].Lan ̄cetꎬ2014ꎬ384(9940):319 ̄328.[32]HewettYꎬGhimireSꎬFarooqiBꎬetal.Lenvatinib ̄Amultikina ̄seinhibitorforradioiodine ̄refractorydifferentiatedthyroidcancer[J].JOncolPharmPractꎬ2018ꎬ24(1):28 ̄32.[33]WellsSAJrꎬRobinsonBGꎬGagelRFꎬetal.Vandetanibinpa ̄tientswithlocallyadvancedormetastaticmedullarythyroidcancer:arandomizedꎬdouble ̄blindphaseⅢtrial[J].JClinOncolꎬ2012ꎬ30(2):134 ̄141.[34]KarouliaZꎬGavathiotisEꎬPoulikakosPI.NewperspectivesfortargetingRAFkinaseinhumancancer[J].NatRevCancerꎬ2017ꎬ17(11):676 ̄691.(收稿日期:2019 ̄08 ̄17)29。

植物免疫系统中的信号转导通路植物无法逃离环境的威胁,它们只能通过不同的机制来对抗病原体和有害环境。
植物的免疫系统包括两个主要方面:基础免疫和适应性免疫。
基础免疫是植物对常见的病原体和环境应激的回应,而适应性免疫则是植物对先前未遇到的特定病原体的特异反应。
植物在免疫应答中涉及到一系列的信号转导通路,最终导致基因表达的改变和产生免疫反应。
下面,我将详细介绍植物免疫系统中的信号转导通路。
1. PAMPs信号通路PAMPs (Pathogen-Associated Molecular Patterns) 信号通路是植物基础免疫的一个重要部分。
PAMPs 是微生物体表面上的分子,如蛋白质、多糖和核酸。
它们是微生物的“指纹”,可以被植物的受体感知。
当一个 PAMPs 被植物受体识别后,植物会产生一系列的信号转导反应,导致基因表达的改变和免疫应答的触发。
这些反应包括钙离子(Ca2+)信号、PIP2 次级信号、激活蛋白激酶(MAPK)模块、NADPH 氧化酶的激活、转录因子激活等。
此外,PAMPs 信号通路还涉及一些基因的转录,例如 WRKY、MYB、NAC和 ERF 家族转录因子等。
这些转录因子能够导致基因的表达变化,从而激发免疫应答。
2. R蛋白信号通路R 蛋白(Resistance proteins)信号通路是植物适应性免疫的关键组成部分。
R蛋白能够识别细菌、真菌和病毒等寄生性微生物。
当一个 R 蛋白识别到目标病原体时,它会形成一个信号复合物,促进一系列的信号转导反应。
这些反应包括活化特异性NADPH 氧化酶、活化植物激酶(PIK)、活化 MAPK 和其他激酶以及调控转录因子的激活等。
R 蛋白信号通路还包括一些特定的转录因子,例如:TGA 转录因子和 EDS1 转录因子。
TGA 转录因子是一种可激活植物抗氧化酶的DNA结合蛋白。
EDS1 转录因子在植物免疫应答中起着重要的作用,它与 PAD4、NPR1 等蛋白质相互作用,调节免疫反应基因的表达。


26(3)241-247 中国生物防治 Chinese Journal of Biological C ontrol 2010年8月群体感应淬灭———防治植物细菌病害的新策略张力群13,田 涛2,梅桂英1(11中国农业大学植物病理系,北京100193;21天津市植物保护研究所,天津300112)摘要:群体感应(quorum sensing,QS)是细菌的一种调控机制,指细菌通过感应特定信号分子的浓度来感知周围环境中自身或其它细菌的数量,并调整相关基因的表达以适应环境的变化。
多种植物病原细菌利用QS系统调控致病因子的表达,因此,QS系统可以作为细菌病害防治的新靶点。
对细菌QS调控机制的干扰和破坏称为群体感应淬灭(quorum quenching)。
本文介绍了QS与植物病原细菌致病性的关系,以及近年来群体感应淬灭研究的新进展。
关 键 词:植物病原细菌;生物防治;群体感应;群体感应淬灭中图分类号:S476;Q93 文献标识码:A 文章编号:100529261(2010)0320241207 Q uorum Q uenching,a N e w Strategy for Controlling Plant B acterial DiseasesZH ANGLi2qun13,TI AN T ao2,MEI G ui2ying1(11Department of Plant Pathology,China Agricultural University,Beijing100193;21Institute of Plant Protection,T ianjin Academy of Agricultural Sciences,T ianjin300112,China)Abstract:Quorum sensing(QS)enables bacteria to m onitor their own population density by means of small,diffusible signals and to coordinate the expression of specialized genes with cell density.Many phytopathogenic bacteria em ploy the QS system to regulate the expression of their virulent factors.This makes QS a very attractive target for the development of novel disease2suppressive strategies.The ability to disrupt QS is known as quorum quenching.This review provides an overview on the relationship be2 tween QS and pathogenicity of phytopathogenic bacteria,and on the progress of the development of the quorum2quenching strategy in plant diseases control during the last decade.K ey w ords:bacterial phytopathogens;biocontrol;quorum sensing;quorum quenching1 细菌的群体感应早在20世纪60年代,研究人员就发现作为单细胞生物的细菌有个体间交流的能力,并能表现出一些多细胞生物的性状,这种细菌间的信号交流方式称作群体感应(quorum sensing, QS)。

趋化因子家族及其受体基础研究进展趋化因子(Chemokine)是一类小分子碱性蛋白,主要的功能是能够趋化细胞定向移动。
目前已经发现的趋化因子有50多种,随着研究的深入,趋化因子及其受体的结构、功能及在体内的作用已经被众多的研究者发现。
趋化因子及其受体的相互作用,可以参与多种生理功能,比如细胞的生长、发育、分化、凋亡和分布等,在病理过程中也具有重要作用,如炎症反应、病原体感染、创伤修复及肿瘤形成和转移等。
趋化因子一般由70-125个氨基酸组成,分子量较小(6-14KD)。
按照一级肽链结构特点,其N端半胱氨酸残基的位置和数目可将趋化因子分为4个亚族:CC、CXC、C和CX3C(C为半胱氨酸,X为任意氨基酸)。
四类趋化因子结构相似性较高,氨基酸序列具有一定的同源性。
根据趋化因子的表达方式以及其在免疫系统中的作用,可以将他们分为两类:内环境稳定性趋化因子和炎症性趋化因子。
内环境稳定性趋化因子主要在归巢场所表达,有着维持内环境稳态的功能,并且对淋巴细胞归巢及成熟有着明确的作用。
炎症性趋化因子由受到刺激的细胞表达,如炎性细胞因子的诱导、细菌毒素或其它破坏内环境稳定的因素的刺激,主要功能是募集效应细胞,在协调天然和获得性免疫反应中起重要作用。
大多数的趋化因子属于CC和CXC两个亚族族。
其中CC亚族有28个成员(CCL1-CCL28),主要对中性粒细胞、单核细胞、肥大细胞、树突细胞、NK细胞、T和B淋巴细胞等具有强大趋化活性,比较重要的有:单核细胞趋化蛋白(MCP-1/CCL2)、巨噬细胞炎症蛋白(MIP/CCL3)、正常T细胞表达和分泌,活化时表达下降的因子(RANTES/CCL5)等;CXC亚族有17个成员(CXCL1-CXCL17),CXC亚家族主要作用于中性粒细胞,这个亚族比较重要的趋化因子有:白细胞介素-8(IL-8/CXCL8)、γ干扰素诱生的单核因子(Mig/CXCL9)、γ干扰素诱生蛋白10(IP-10/CXCL10)、基质细胞来源因子1(SDF-1/CXCL12)等。
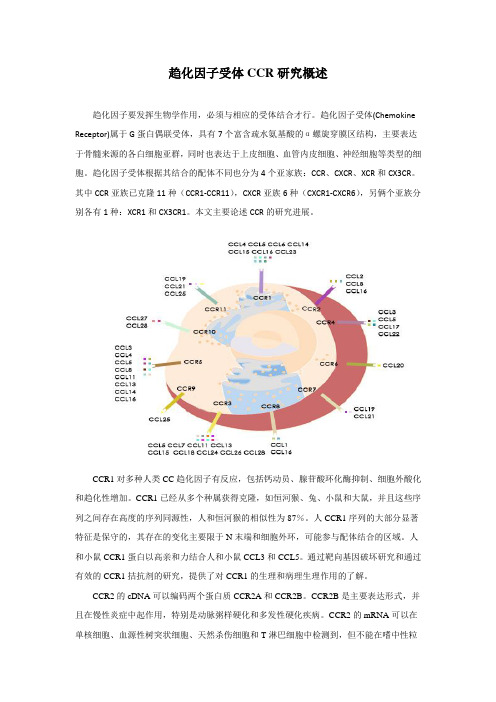
趋化因子受体CCR研究概述趋化因子要发挥生物学作用,必须与相应的受体结合才行。
趋化因子受体(Chemokine Receptor)属于G蛋白偶联受体,具有7个富含疏水氨基酸的α螺旋穿膜区结构,主要表达于骨髓来源的各白细胞亚群,同时也表达于上皮细胞、血管内皮细胞、神经细胞等类型的细胞。
趋化因子受体根据其结合的配体不同也分为4个亚家族:CCR、CXCR、XCR和CX3CR。
其中CCR亚族已克隆11种(CCR1-CCR11),CXCR亚族6种(CXCR1-CXCR6),另俩个亚族分别各有1种:XCR1和CX3CR1。
本文主要论述CCR的研究进展。
CCR1对多种人类CC趋化因子有反应,包括钙动员、腺苷酸环化酶抑制、细胞外酸化和趋化性增加。
CCR1已经从多个种属获得克隆,如恒河猴、兔、小鼠和大鼠,并且这些序列之间存在高度的序列同源性,人和恒河猴的相似性为87%。
人CCR1序列的大部分显著特征是保守的,其存在的变化主要限于N末端和细胞外环,可能参与配体结合的区域。
人和小鼠CCR1蛋白以高亲和力结合人和小鼠CCL3和CCL5。
通过靶向基因破坏研究和通过有效的CCR1拮抗剂的研究,提供了对CCR1的生理和病理生理作用的了解。
CCR2的cDNA可以编码两个蛋白质CCR2A和CCR2B。
CCR2B是主要表达形式,并且在慢性炎症中起作用,特别是动脉粥样硬化和多发性硬化疾病。
CCR2的mRNA可以在单核细胞、血源性树突状细胞、天然杀伤细胞和T淋巴细胞中检测到,但不能在嗜中性粒细胞或嗜酸性粒细胞中检测到。
抗体研究显示CCR2B在单核细胞、活化记忆T细胞、B细胞和嗜碱性粒细胞中表达。
CCR2通过与配体结合,产生许多生物学信号,包括腺苷酸环化酶的抑制、细胞内钙动员和细胞趋化性的增加。
CCR2已从许多物种克隆,包括小鼠、大鼠和恒河猴。
序列高度同源并且显示与人CCR2的78-95%氨基酸一致。
小鼠CCR2特异性结合了具有高亲和力的与MCP-1和MCP-3。

神经元迁移和轴突导向中的信号通路神经元是构成我们的大脑和神经系统的基本细胞单元。
在神经系统发育的过程中,神经元需要迁移和作出选择性细胞突出的决定。
这个过程涉及到许多复杂的信号通路,有助于引导神经元的方向性移动和分化。
在本文中,我们将深入探讨神经元迁移和轴突导向中的信号通路。
神经元迁移神经元迁移过程中,有几种不同的细胞类型在起作用。
首先,通过轴突末端放出的信号分子,如斑马鱼胶质细胞源性信号分子(SDF1)和骨髓诱导分化因子(BDNF),可以吸引神经元朝向这些信号发生迁移。
其次,神经元的细胞外基质成分,如髓鞘蛋白和蛋白聚糖,可以发挥类似于化学梯度的作用,为神经元的方向性运动提供引导。
神经元迁移中,大量的信号通路参与其中并相互作用。
其中,细胞极性作用和细胞外基质斑块(短距离运动位点)在神经元迁移中起重要作用。
蛋白质激酶C (PKC)和cAMP-responsive element-binding protein(CREB)则由转运过程中的小骨骼蛋白提供动力。
轴突导向未成熟的神经元必须作出正确的决策,确定它们轴突的方向和目标区域。
在这个过程中,解剖学和化学信号的结合在神经祖细胞的轴突导向方面起到至关重要的作用。
在神经元轴突导向中,可分为直接指引和指引策略两种。
直接指引意味着轴突生长锚定在具有特定分子置位的停靠点。
指引策略则指的是神经元在轴突生长过程中仍遵循一定的趋化性。
化学指引产生的化学梯度不仅是轴突导向的重要信号,还具有在广泛的神经细胞类型中寻找前往目标区域的可能性和细胞活动异质性。
过程有需求轴突时,这些分子会在停靠点促进神经元纤突在目标区域的精细化。
但是在许多情况下,使用排他的一系列刺激,如细胞外基质的比较几何、生化梯度和其他线索,这些表示在发育期间导向轴突的细胞单位有所受限。
因此,正在发生轴突导向的神经元只有一个不断调整内部状态的机会,以响应社会的信号,并释放刺激以协调细胞运动。
这些神经元将不断地接受新的刺激,不断调整内部状态,直到它们成功达到所需环境的目标。

糖皮质激素非基因组效应及其信号转导机制徐州医学院附属医院麻醉科刘功俭糖皮质激素具有多种重要的生理和药理作用,其经典作用途径为“基因组机制”,通过调节基因转录发挥作用。
近年来,其“非基因组机制”在生理和药理学方面的作用越来越受重视。
在这一作用途径中,可能有多种受体、激酶、信号分子的参与,“基因组机制”和“非基因组机制”间还可能存在交互调节,对非基因组机制进行深入研究有利于糖皮质激素的临床合理应用。
1糖皮质激素“非基因组效应”的标准对于糖皮质激素的“非基因组效应”,目前并没有明确的标准,如果根据“非转录机制”的概念,那么可以根据是否直接通过调节基因转录和蛋白质合成进行判断,但由于上述标准实用性不强,因此目前惯例做法是把符合下面条件之一条或数条糖皮质激素效应称为“非基因组效应”:a.效应发生时间太短,难以进行RNA和蛋白质的合成(糖皮质激素刺激后数秒到数分钟内发生);b.即使在有RNA和蛋白质合成抑制剂存在的情况下,也可以发生的效应;c.采用偶合不能通过细胞膜分子的糖皮质激素,也可以发生的效应;d.在缺少细胞核或不能进行RNA和蛋白质合成的细胞内(如红细胞、精子、培养的胚胎海马神经元),也可以发生的效应;e.糖皮质激素与不具有激活转录活性的突变受体结合后仍能发挥的效应。
2糖皮质激素的非基因组效应(1)免疫系统糖皮质激素是强效的免疫抑制剂,通常认为,其免疫抑制作用是通过其转录调节机制实现的。
最近研究发现,糖皮质激素也可以通过非基因组机制发挥免疫调节作用,糖皮质激素可通过减弱Lck-cd4和fyn-cd3的偶联而抑制这些激酶向T细胞复合体募集,同时,糖皮质激素可以通过非基因组机制快速抑制人中性粒细胞脱颗粒;(2)心血管系统糖皮质激素可通过非基因组机制快速增加内皮细胞一氧化氮合酶活性,增加大脑缺血局部的血流,减小梗死面积。
此外,糖皮质激素还可通过此机制减轻心脏缺血再灌注损伤后血管炎症反应并减小心肌梗死面积;(3)神经细胞①腹腔神经节细胞.体外细胞培养实验表明,在低Ca2+/高Mg2+条件下,糖皮质激素可在2min 内使豚鼠腹腔神经节神经元细胞膜电位发生超级化,该效应可被GC胞浆可溶性受体拮抗剂阻断。


. 382 .世界范围内细菌耐药性不断提高的状况下,病原菌的致病性也发生了相应的变化。
虽然病原菌的致病性与耐药性在进化时间上不同步[1],但它们均是克服抗生素压力和宿主防御体系等不利条件最终引起感染所必需的因 素。
致病性与耐药性是细菌适应环境的体现。
在耐药性不断增强的情况下,细菌的致病性将收稿日期:2014-06-23基金项目:国家自然科学基金NSFC(No.81171620, No.1210063);西北大学省级大学生创新训练计划项目(No.0795)作者简介:宁唤唤,女,生于1992年,主要从事病原菌耐药性相关基因的研究,E-mail: ninghuanhuan2014@*通讯作者,E-mail: shenlx@文章编号:1001-8689(2015)05-0382-07铜绿假单胞菌耐药性与致病性共选择机制研究进展宁唤唤 李晶 王严 李博 王波波 张悦 陈林 沈立新*(西北大学生命科学学院,西部资源与现代生物技术省部共建教育部重点实验室,西安 710069)摘要 :世界范围内细菌耐药性问题日益严重状况下,包括铜绿假单胞菌(Pseudomonas aeruginosa ,PA )在内的病原微生物的致病性与耐药性的共选择、共进化现象引起了人们越来越多的关注和不断深入的研究,这将有助于优化临床治疗方案,为药物治疗和筛选提供新靶点。
本文综述了PA 致病性与耐药性共选择机制的遗传物质基础,并简单讨论二者变化关系及相关应用。
关键词:铜绿假单胞菌;耐药性;致病性;共选择;共进化中图分类号:R378 文献标志码:A Progress on co-selection mechanism of antibiotics resistanceand virulence in Pseudomonas aeruginosaNing Huan-huan, Li Jing, Wang Yan, Li Bo, Wang Bo-bo, Zhang Yue, Chen Lin and Shen Li-xin(Faculty of Life Sciences, Northwest University, Key Laboratory of Resources Biology and Biotechnology in Western China,Ministry of Education, Xi’an 710069)Abstract Antibiotics resistance of bacteria has accelerated around the world nowadays. More and more multidrug-resistant pathogens with increased pathogenicity emerged in clinic and caused much more problems in human health all over the world. Co-selection is one of the most important mechanisms that favor the persistence of the resistant pathogens and the selection of the most virulent and most resistant pathogens. Pseudomonas aeruginosa is an important pathogen, capable of causing serious and often life-threatening infection in humans because of its resistance to many kinds of antibiotics as well as the large arsenal of virulence factors. P. aeruginosa has joined the ranks of these most virulent and most resistant "superbug". The progress on the co-selection of resistance and virulence in P . aeruginosa and the sequent application in clinic have been reviewed in this paper.Key words Pseudomonas aeruginosa ; Resistance; Virulence; Co-selection; Co-evolution 怎样被耐药性影响以及他们之间的关系如何,即细菌致病性与耐药性共选择(co-selection)的结果,将影响细菌的存活及对宿主的感染状态。

植物信号转导路径及其在抗病中的应用植物作为一类无法逃避外界环境变化的生物,需要对于环境变化作出相应的反应。
植物的生长和发育、光合作用和免疫反应等过程都离不开信号传导。
在这些过程中,植物通过一系列的信号转导路径,将外界信息转导成细胞内信号,进而调节基因表达和细胞代谢。
其中,植物免疫反应的信号转导路径,是保护植物不受病原体入侵的重要方式。
一、植物免疫反应的信号转导路径植物免疫反应分为两个阶段:PAMPs-PRRs(pathogen-associated molecular patterns - pattern recognition receptors)和ETI (effector-triggered immunity)。
PAMPs-PRRs是一种非特异性抗病反应,是植物通过识别病原体特征群体(PAMPs),例如细菌脂多糖、真菌低分子量物质、病毒外壳蛋白等,来启动免疫反应。
PRRs就是一类能够识别PAMPs的受体蛋白,激活后通过一系列的STKs(serine/threonine kinases)和MAPKs(mitogen-activated protein kinases)信号转导,促使细胞出现各种抗病反应,如生成激素、产生氧化物、调节基因表达等。
其中,一个重要的PRR是LPS2(lipopolysaccharide-induced protein2),它主要识别棉铃虫毒素(Spodoptera littoralis oral secretion2,简称SOLt),能启动融合蛋白的积累,使其合成NADPH氧化酶,并产生大量ROS(reactive oxygen species),这些信号分子可导致植物迅速响应抗病。
ETI是一种针对抗原特异性的保护机制,是植物通过识别病原体引起的特异蛋白,如外分泌蛋白、类型Ⅲ分泌系统的效应蛋白等,启动的一种强烈的免疫反应。
这种免疫反应的特点是:与PAMPs-PRRs不同,它特异性激活蛋白酶C(protein kinase C)、十字花科甙(cruciferin)和PERK多激酶(protein kinase PERK),并通过特定的信号通路来表达,触发不同的转录和翻译修饰等事件,引发细胞凋亡。

趋化因子基因集简介
趋化因子是一类蛋白质,它们可以通过与细胞表面的特定受体结合来引导细胞朝着特定的方向移动。
在人体中,趋化因子基因集包括多个基因,这些基因编码了不同种类的趋化因子蛋白质。
以下是一些与趋化因子相关的基因集:
L家族基因集:CCL基因家族编码C-C趋化因子受体,这些受体广泛表达在不同的细胞类型中,包括免疫细胞和内皮细胞。
CCL基因家族编码的趋化因子对于免疫系统的发育和功能至关重要。
2.CXCL基因集:CXCL基因家族编码趋化因子配体,这些配体与CXC趋化因子受体相互作用,介导细胞的定向移动。
CXCL基因家族编码多种类型的趋化因子,如IL-8、MIP-1α和MIP-1β等。
3.SELL基因集:SELL基因家族编码趋化因子配体,这些配体与SELL趋化因子受体相互作用,介导细胞的定向移动。
SELL基因家族编码的趋化因子主要与炎症和免疫应答相关。
4.TSP基因集:TSP基因家族编码趋化因子配体,这些配体与TSP趋化因子受体相互作用,介导细胞的定向移动。
TSP基因家族编码的趋化因子主要与炎症和免疫应答相关。
这些趋化因子基因集在人类疾病的发生和发展中起着重要作用,例如炎症性疾病、自身免疫性疾病和肿瘤等。
因此,对这些基因的研究有助于深入了解疾病的发生机制,并为疾病的治疗提供新的思路和方法。

S1PR1-mediated IFNAR1 degradation modulates plasmacytoiddendritic cell interferon-α autoamplification由S1PR1介导的IFNAR1降解可以调节浆细胞样树突状细胞α-干扰素的自动扩增/信号放大摘要:Blunting immunopathology without abolishing host defense is the foundation for safe and effective modulation of infectious and autoimmune diseases.没有废除宿主防御机制的免疫病理钝化是安全、有效调节传染病和自身免疫性疾病的基础。
Sphingosine 1-phosphate receptor 1 (S1PR1) agonists are effective in treating infectious and multiple autoimmune pathologies; however, mechanisms underlying their clinical efficacy are yet to be fully elucidated.1-磷酸-鞘氨醇受体1(S1PR1)促效药对于治疗传染病和多种自身免疫性疾病是有效的,然而,其临床疗效的具体机制尚未被完全阐明。
Here, we uncover an unexpected mechanism of convergence between S1PR1 and interferon alpha receptor 1 (IFNAR1) signaling pathways.在本研究中,我们意外发现S1PR1与α-干扰素受体1(IFNAR1)信号通路之间的趋同/聚集机制。
Activation of S1PR1 signaling by pharmacological tools or endogenous ligand sphingosine-1 phosphate (S1P) inhibits type 1 IFN responses that exacerbate numerous pathogenic conditions.通过药理作用或内源性配体1-磷酸-鞘氨醇(S1P)发出信号激活S1PR1可以抑制1型干扰素应答,这将提供大量致病条件。

趋化因子和小胶质细胞在阿尔茨海默病神经炎症中的作用研究进展阿尔茨海默病(AD)是一种常见的神经变性疾病,主要特征是认知障碍和记忆功能下降。
AD的发病机制尚未完全明确,但炎症反应已经被证实在其发病中起到了重要的作用。
趋化因子和小胶质细胞是炎症反应的重要组成部分,在AD神经炎症中也发挥着重要作用。
一、趋化因子在AD神经炎症中的作用趋化因子是炎症反应的重要组成部分,主要作用是引导白细胞到达炎症部位。
在AD的神经炎症中,趋化因子的表达和作用都发生了变化,对疾病的发展起到了重要作用。
以下是几种常见的趋化因子在AD神经炎症中作用的研究进展:1. 白细胞介素-1β(IL-1β)IL-1β是一种重要的趋化因子,广泛参与免疫炎症过程。
研究表明,AD患者大脑组织中IL-1β的表达显著增加,而且IL-1β与AD神经炎症的发生和发展有关。
IL-1β在AD中的作用主要是引起神经元凋亡、激活神经胶质细胞、促进淀粉样蛋白沉积等。
2. 肿瘤坏死因子-α(TNF-α)TNF-α是另一种重要的趋化因子。
AD的病理表现与TNF-α相关。
研究表明,AD患者的大脑组织中TNF-α的表达增加,这可能与淀粉样蛋白沉积、神经元死亡等有关。
此外,TNF-α还能够激活胶质细胞,导致神经胶质炎症反应。
3. 白介素-6(IL-6)IL-6是一种趋化因子和细胞因子,参与各种炎症反应。
AD患者大脑组织中IL-6的水平明显升高,与疾病的临床症状密切相关。
研究发现,IL-6通过调节神经胶质细胞的活性、促进淀粉样蛋白沉积等方式对AD神经炎症发挥重要作用。
二、小胶质细胞在AD神经炎症中的作用小胶质细胞是脑部胶质细胞的一种,是脑部免疫系统的重要组成部分。
在神经炎症反应中,小胶质细胞能够释放趋化因子、促炎因子等,引起神经炎症反应,如果活化过度,还可能导致神经元死亡。
以下是几种小胶质细胞在AD神经炎症中作用的研究进展:1. 活化型小胶质细胞活化型小胶质细胞是神经炎症中的主要细胞类型之一。

肝癌基因突变和标志物Gastroenterology超长论文全景解读来源:探肝研究背景肝细胞癌(Hepatocellular carcinoma ,HCC)已成为癌症相关死亡的主要原因。
其死亡率在西方人群中有所增加,少数患者在早期阶段被诊断出来,该阶段患者可进行治愈性治疗。
在过去的十多年里,研究者对HCC分子发病机制的认识有了显著提高。
大量样本的高通量测序分析的累积数据为HCC基因突变情况提供了准确的全景分析。
这使得研究者能够描述一些可能主导肿瘤发生发展的关键事件,并有望将这些知识转化为新的靶标和生物标志物,从而可能影响肝癌的治疗决策,并最终改善患者的治疗效果。
然而,今后还会面临一些挑战:(1)HCC最普遍的致癌突变目前是无药可用的;(2)在可以确定HCC的分子亚型或明显驱动通路的情况下,将这些知识转化为临床试验的努力仍很少;(3)关于肿瘤异质性的作用及其在肿瘤晚期评估的争论,引发了人们对基于单个样本活检分层治疗未来的一些怀疑;(4)通过免疫系统治疗肝癌很有潜力,但仍有待评估。
该综述概述了 HCC 发生发展所涉及的基因改变,并讨论在根据患者的预后和对治疗的反应下分子标志物在患者分层中的作用。
综述框架Key Points 摘选1. 在HCC中,每个肿瘤编码区的平均突变数为35~80,其中估计可能有4~8个致癌基因成瘾的驱动因子。
2. HCC的遗传易感性:APC 胚系突变、引发罕见遗传代谢疾病的基因突变;与危险因素(如病毒性肝炎,酒精摄入或肥胖)、慢性肝病的严重程度及其向肝硬化演变或恶性转化和肿瘤进展相关的一些SNPs。
3. 肝硬化恶性转化过程:肝硬化→低度异常增生结节(LGDN)→高度异常增生结节(HGDN)→早期HCC →进展性HCC和晚期HCC;其恶性转化与TERT的胚系和体系突变相关。
4. 肝细胞腺瘤的恶性转化过程:在正常肝细胞中具有转化风险的单克隆良性增殖,β-连环蛋白激活突变提高恶性的转化风险,最后TERT启动子突变同时伴随全基因组低甲基化和染色体畸变的增加。

CXCL1与肝癌关系的研究进展发布时间:2023-06-28T11:13:59.158Z 来源:《中国医学人文》2023年2月2期作者:蔡育莹许壮志曲义坤通讯作者[导读]CXCL1与肝癌关系的研究进展蔡育莹许壮志曲义坤通讯作者(佳木斯大学附属第一医院;黑龙江佳木斯154000)摘要:CXC基序趋化因子配体1(CXCLI)作为多种信号转导通路中的关键枢纽,属于细胞因子超家族成员,通过其受体参与多种肿瘤的发生与演进过程。
近年来关于CXCLI与肝癌的关系被受学者关注,研究表明,趋化因子及其受体在肿瘤生长、转移和免疫逃逸中发挥重要作用。
本文根据既往学者的研究基础上就CXCLI与肝癌的关系作以综述。
关键词:肝癌;CXC基序趋化因子配体1(CXCL1);肿瘤1肝癌概述肝癌作为是一个持续性的全球性健康问题,在世界范围内发病率逐年攀升。
据估算,根据2020年的统计数据,肝癌是发病率第六高、死亡率第三高的癌症[1]。
在中国,肝癌是影响人们健康的重要因素,在六大癌症中排名第二[2]。
肝细胞癌(HCC)是最常见的肝癌类型,约占75%~85%[2]。
通常发生在慢性肝病/肝硬化的病因下,预后较差。
HCC早期无典型症状,晚期通常表现为厌食、体重减轻、乏力、右上腹疼痛等症状,体格检查可发现黄疸或肝肿大。
利用超声LI-RADs进行分级、增强CT扫描或MRI成像是诊断可疑患者的关键,活检有时也是诊断所必需的。
血清甲胎蛋白(AFP)是诊断HCC最常用的生物标志物,但它既不敏感也不特异,不能可靠地用于排除HCC。
HCC的治疗方式在过去十年中不断发展,手术切除和移植仍然是早期和中期疾病的主要治疗模式,最适合切除的患者通常是单发肿瘤,没有血管侵犯的证据,有足够的肝储备。
但许多患者由于潜在的肝功能障碍或局部晚期疾病而不适合切除。
肝移植为最佳的长期结果提供了最好的机会,但肝移植与肝切除的判断是复杂的,需要权衡肝功能、是否存在门脉高压症、性能状况、肿瘤特征等多种因素。

SDF-1促进BMSCs迁移的研究进展刘想忠;李章华;许海甲【摘要】骨髓中主要包括两种多能干细胞, 即造血干细胞 (hematopoietic stem cells, HSCs) 和骨髓间充质干细胞 (bone marrow derived mesenchymal stem cells, BMSCs).BMSCs具有多种分化潜能, 在一定条件下可向多种细胞方向分化, 并且具有免疫调节能力.由于取材方便, 不会违背伦理问题.因此近年来, 其在免疫调节及组织工程学方面的应用有着越来越重要的作用.基质细胞衍生因子-1 (stromal cell-derived factor 1, SDF-1) 属于趋化因子家族, 与其受体CXCR4 (C-X-C Chemokine Receptor 4) 相互作用后对BMSCs具有明显定向趋化作用, 虽然近年来有很多研究对其作用机制进行了探讨, 但具体机制仍不十分清楚.本文对近年来SDF-1及其受体对BMSCs的趋化作用机制进行总结, 旨在为后续进一步研究提供参考.%Bone marrow stem cells mainly include hematopoietic stem cells (HSCs) and bone marrow derived mesenchymal stem cells (BMSCs). BMSCs not only have multiplex potential of differentiation, but also have immunomodulatory properties. They can differentiate into various cells. Recently, BMSCs have been increasingly used in the field of immunomodulatory and tissue engineering because of easily available and no ethnic violation. Stromal cell-derived factor 1 (SDF-1) is a member of chemokine family. It has obvious migration effect on BMSCs after binding to its receptor CXCR4 (C-X-C Chemokine Receptor 4). Although there are many studies about the migration mechanism of BMSCs, the detail has not been explanted clearly. This paper summarizes the mechanism of themigration of BMSCs by SDF-1 and its receptors in recent years. We hope that this could provide a reference for further research.【期刊名称】《中国骨质疏松杂志》【年(卷),期】2019(025)003【总页数】8页(P408-415)【关键词】骨髓间充质干细胞;基质细胞衍生因子;迁移【作者】刘想忠;李章华;许海甲【作者单位】武汉大学附属同仁医院(武汉市第三医院), 湖北武汉 430000;武汉大学附属同仁医院(武汉市第三医院), 湖北武汉 430000;武汉大学附属同仁医院(武汉市第三医院), 湖北武汉 430000【正文语种】中文【中图分类】R329.2骨髓间充质干细胞(bone marrow derived mesenchymal stem cells,BMSCs)是近年来发现的多能干细胞,存在于骨髓之中,含量在0.01%以下,属于成体干细胞的一种,具有多种分化能力及自我更新能力,在不同的诱导环境下可分化成种细胞,如成骨细胞,软骨细胞,心肌细胞及脂肪细胞等。

趋化因子(1)六、趋化因子由组织细胞和微生物产生的趋化剂(chemoattractants)对白细胞的趋化作用(chemotaxis)是炎症发生过程中重要的起始步骤,也是机体防御和清除入侵病原体等异物先天性免疫功能的一个重要方面。
1986年以前,“经典”的(classical)白细胞趋化物质主要有补体片段C5 a、白三烯B4(leukotrinin B4,LTB4)、血小板激活因子(platelet-a ctivating factor,PAF)和fMLP(N-formylmethionyl-leucyl-phenyl-alanine,N-甲酰甲硫氨酰-亮氨酰-苯丙氨酸),这些趋化物质的受体同属于G蛋白偶联受体(Gprotein-coupled receptor)。
(一)趋化因子的种类1.趋化因子的命名1986年以来,陆续发一现了一类主要由免疫细胞产生的、具有趋化白细胞作用的细胞因子(chemoattractant cyt okines或chemotactic cytokines)。
在1992年第3届国际趋化因子研讨会上,绝大多数学者建议把chemoattractant(chemotactic)cytokine简称为chemokines,本书暂译名为趋化因子。
趋化因子又称可诱导的小分子蛋白(small-inducible protein,SIP)、间分泌(intercrine)、细胞因子PE-4超家族(PF-4superfamily of common an-cestral cyto kines)或PF-4样细胞因子(PF-4 like cytokine)等。
2.趋化因子亚族及其成员通过基因克隆和cDNA、氨基酸序列分析,人的趋化因子超家族目前至少发现有19个成员,它们具有以下共同的特点。
(1)来自同一个祖先基因(com-mon ancestral gene)。
(2)成熟分子为分子量8~10kDa的小分子多肽。