用于酸碱滴定的指示剂
- 格式:docx
- 大小:19.50 KB
- 文档页数:5

什么是酸碱指示剂?
酸碱指示剂是一种化学物质,它在酸碱溶液中表现出不同的颜色,用于判断溶液的酸碱性质和酸碱滴定等化学实验中。
酸碱指示剂可以通过颜色的变化来显示溶液的pH值范围,从而确定溶液的酸碱性质。
酸碱指示剂的工作原理基于酸碱指示剂分子的结构和电荷状态的变化。
酸碱指示剂通常是弱酸或弱碱,它们会在不同pH条件下发生酸碱中和反应,导致颜色的变化。
常见的酸碱指示剂包括酚酞、甲基橙、溴酚蓝、酚红等。
以下是几种常见的酸碱指示剂及其颜色变化范围:
1. 酚酞(Phenolphthalein):
酚酞在酸性溶液中呈无色,在pH值为8.2-10之间的溶液中呈粉红色。
2. 甲基橙(Methyl Orange):
甲基橙在酸性溶液中呈红色,在pH值为3.1-4.4之间的溶液中呈橙黄色。
3. 溴酚蓝(Bromothymol Blue):
溴酚蓝在酸性溶液中呈黄色,在中性溶液中呈绿色,在碱性溶液中呈蓝色。
4. 酚红(Phenol Red):
酚红在酸性溶液中呈黄色,在中性溶液中呈橙红色,在碱性溶液中呈红色。
使用酸碱指示剂进行酸碱滴定时,通常将指示剂溶液滴加到待测溶液中,并观察颜色变化。
当颜色发生变化时,表示酸碱中和点已经达到,可以根据变化点确定溶液的酸碱性质。
需要注意的是,不同的酸碱指示剂适用于不同的pH范围,选择合适的指示剂对于准确测定溶液的酸碱性非常重要。
此外,酸碱指示剂的颜色变化是定性的,并不能提供精确的pH值,因此在需要精确测定pH值的情况下,应使用pH计等仪器进行测量。

酸碱滴定指示剂的选择酸碱滴定指示剂是一种可以通过颜色的改变来指示滴定终点的化学物质。
根据滴定过程中pH的变化,可以选择不同的指示剂来实现准确的滴定。
常用的酸碱滴定指示剂有苯酚磺酸、溴刚酸、甲基红、甲基橙、酚酞、溴酚蓝、溴酸高锰酸钾等。
1.苯酚磺酸是一种常用的酸碱指示剂,其pH范围在1-2之间变色,可用于酸滴定。
2.溴刚酸在pH为3-4时呈现黄色,用于滴定弱酸。
3.甲基红是一种弱酸性指示剂,pH在4.2-6.3时变红色,可用于酸滴定。
4.甲基橙对酸碱都有较强的指示能力,pH在3.1-4.4时呈现红色,可用于酸滴定。
5.酚酞的pH范围在8.2-10之间变色,可用于弱碱滴定。
6.溴酚蓝呈现黄色,当pH值为6.0时变色,可用于弱酸滴定。
7.溴酸高锰酸钾是一种强氧化剂,酸碱滴定中可作为指示剂和滴定剂,当滴定终点附近出现粉红色时停止滴定。
在选择适当的酸碱滴定指示剂时,需要考虑以下几个因素:1.滴定过程中pH值的范围:不同的滴定反应具有不同的pH 范围,因此指示剂的pH变色区间要与滴定反应的pH范围相匹配。
2.指示剂的变色范围与化学品的滴定终点:滴定终点是指溶液中被测定物质与滴定试剂的化学反应达到完全的点。
在选择指示剂时,需要确保其变色范围与化学品的滴定终点相一致,以确保准确的滴定。
3.指示剂的稳定性:选用的指示剂应具有较好的稳定性,不易受光、热、氧化等因素影响。
4.指示剂与滴定试剂的相容性:指示剂与滴定试剂应该相容,不产生相互干扰或反应的产物。
总之,选择适当的酸碱滴定指示剂对于准确完成滴定分析非常重要。
根据滴定的酸碱特性和变色范围,选择合适的指示剂可以提高滴定分析的准确性和可靠性。

酸碱指示剂的选择与鉴别酸碱指示剂是一种可以改变颜色的化学物质,在酸碱中起到指示作用。
在实验室和工业生产中,酸碱指示剂被广泛应用于酸碱滴定、溶液酸碱性检测等方面。
本文将介绍酸碱指示剂的选择与鉴别。
一、酸碱指示剂的选择酸碱指示剂的选择主要取决于所要测定溶液的酸碱性范围。
以下是几种常见的酸碱指示剂及其适用范围:1. 酚酞:酸性溶液呈现红色,中性和碱性溶液无色。
适用于酸性溶液的滴定以及pH值低于6的测定。
2. 溴酚蓝:酸性溶液呈黄色,中性和弱碱性溶液呈绿色,强碱性溶液呈蓝色。
适用于中性和弱碱性溶液的滴定以及pH值在3.0-4.6范围内的测定。
3. 甲基橙:酸性溶液呈红色,中性溶液呈橙色,碱性溶液呈黄色。
适用于酸性溶液的滴定以及pH值在3.1-4.4范围内的测定。
4. 酚酞:酸性溶液呈红色,中性和碱性溶液无色。
适用于酸性溶液的滴定以及pH值低于6的测定。
5. 金黄色红:酸性溶液呈红色,中性和碱性溶液呈黄色。
适用于酸性溶液的滴定以及pH值低于5.0的测定。
通过选择合适的酸碱指示剂,我们可以准确、快速地判断溶液的酸碱性,从而开展后续的实验操作和分析。
二、酸碱指示剂的鉴别为了确保测定结果的准确性,我们需要对酸碱指示剂进行鉴别。
下面介绍几种常见的酸碱指示剂的鉴别方法:1. 鉴别酚酞和酚酞钠:将少量酚酞溶于无水乙醇中,滴加氢氧化钠溶液。
若溶液出现红色,则为酚酞;若溶液无色,则为酚酞钠。
2. 鉴别甲基橙和溴酚蓝:将少量甲基橙溶于无水乙醇中,滴加氯化钠溶液。
若溶液出现红色,则为甲基橙;若溶液无色,则为溴酚蓝。
3. 鉴别甲基橙和金黄色红:将少量甲基橙溶于无水乙醇中,滴加氯化钙溶液。
若溶液出现橙色,则为甲基橙;若溶液呈红色,则为金黄色红。
以上鉴别方法可以帮助我们辨认不同的酸碱指示剂,确保实验结果的准确性。
总结:酸碱指示剂在化学实验和工业生产中起到重要的指示作用。
选择合适的酸碱指示剂可以帮助我们准确判断溶液的酸碱性,进而进行后续的实验与分析。
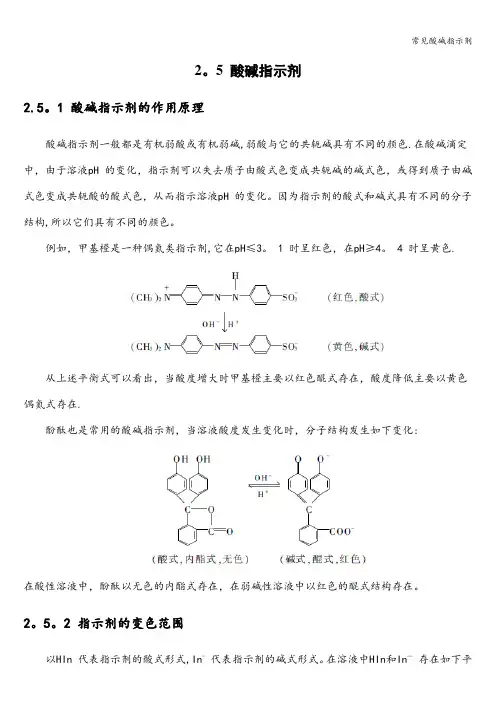
2。
5 酸碱指示剂2.5。
1 酸碱指示剂的作用原理酸碱指示剂一般都是有机弱酸或有机弱碱,弱酸与它的共轭碱具有不同的颜色.在酸碱滴定中,由于溶液pH 的变化,指示剂可以失去质子由酸式色变成共轭碱的碱式色,或得到质子由碱式色变成共轭酸的酸式色,从而指示溶液pH 的变化。
因为指示剂的酸式和碱式具有不同的分子结构,所以它们具有不同的颜色。
例如,甲基橙是一种偶氮类指示剂,它在pH≤3。
1 时呈红色,在pH≥4。
4 时呈黄色.从上述平衡式可以看出,当酸度增大时甲基橙主要以红色醌式存在,酸度降低主要以黄色偶氮式存在.酚酞也是常用的酸碱指示剂,当溶液酸度发生变化时,分子结构发生如下变化:在酸性溶液中,酚酞以无色的内酯式存在,在弱碱性溶液中以红色的醌式结构存在。
2。
5。
2 指示剂的变色范围以HIn 代表指示剂的酸式形式,In-代表指示剂的碱式形式。
在溶液中HIn和In—存在如下平衡关系: ++ In - [][][]HIn In H -+=a K 或 [][][]-+=In HIn H a K 对于某种指示剂而言,K a 是常数,因此 [][]-In HIn 比值只是[H + ]的函数.溶液的颜色取决于 [][]-In HIn。
在一般情况下,当一种形式的浓度是另一种形式浓度的10 倍时,才能辨别出浓度大的形式的颜色。
因此,当[][]10In HIn≥-时,可看到酸式的颜色;当[][]101In HIn ≤- 可以看到碱式的颜色。
当[][]1In HIn =-时,pH = p K a 是指示剂的颜色转变点,称为指示剂的理论变色点。
当溶液的pH 在p K a ± 1 范围内时,呈现酸式和碱式的混合色,这个pH 范围称为指示剂的理论变色范围。
从理论上讲,指示剂的变色范围都有两个pH 单位,但实际上并不都是如此。
人的眼睛对各种颜色的灵敏度不一样,人眼观察到的实际变色范围与理论变色范围不完全一致。
例如,甲基橙的p K a = 3.4,理论上的变色范围应该在pH 2。


酸碱滴定反应的指示剂选择实验酸碱滴定反应是化学实验中常见的一种定量分析方法,通过加入酸碱指示剂来确定溶液中酸碱的浓度。
选择合适的指示剂对于准确测定溶液的酸碱浓度非常重要。
一、实验目的本实验旨在通过对不同指示剂进行测试,确定不同酸碱滴定反应中最适合的指示剂,以提高滴定实验结果的准确性。
二、实验原理在酸碱滴定反应中,当溶液中的酸碱物质发生反应到接近中性时,酸碱指示剂会发生颜色变化,从而标志着反应的终点。
常用的指示剂有酚酞、溴酚蓝、甲基橙等。
三、实验步骤1. 准备滴定仪器及试剂:酸碱滴定管、滴定瓶、酸碱溶液、指示剂。
2. 将待测溶液(酸或碱)加入滴定瓶中。
3. 加入适量的指示剂,记下初始颜色。
4. 用标准溶液进行滴定,同时搅拌反应体系。
5. 当颜色发生明显变化时,立即停止滴定并记录消耗的标准溶液体积。
6. 重复上述实验步骤,更换不同的指示剂,记录相应的实验数据。
四、实验结果与分析通过实验我们得到了不同指示剂对于酸碱滴定反应的终点指示效果,根据实验数据可以做出比较和分析。
1. 酚酞指示剂:- 酸碱滴定反应中常用的指示剂之一。
- 原本为无色,转变为红色。
- 适用于酸和碱强度相近的溶液。
2. 溴酚蓝指示剂:- 原本为黄色,转变为蓝色。
- 适用于酸和碱强度差异较大的溶液。
- 当待测溶液是酸时,转变点为深蓝色;当待测溶液是碱时,转变点为绿色。
3. 甲基橙指示剂:- 原本为橙色,转变为红色。
- 适用于酸和碱强度较大的溶液。
- 当待测溶液是酸时,转变点为橙红色;当待测溶液是碱时,转变点为鲜红色。
根据实验结果分析,选择合适的指示剂需要考虑待测溶液的性质和酸碱强度的差异。
选择与待测溶液性质相近的指示剂,能够提高滴定实验结果的准确性。
五、实验注意事项1. 实验仪器要干净,以免产生误差。
2. 选择合适的指示剂,避免发生颜色变化非常明显或反应终点模糊的情况。
3. 滴定过程中要慢慢滴加标准溶液,避免量过大影响测定结果。
4. 反应溶液要充分搅拌均匀,使反应充分进行。

酸碱指示剂用于酸碱滴定的指示剂,称为酸碱指示剂。
是一类结构较复杂的有机弱酸或有机弱碱,它们在溶液中能部分电离成指示剂的离子和氢离子(或氢氧根离子),并且由于结构上的变化,它们的分子和离子具有不同的颜色,因而在pH不同的溶液中呈现不同的颜色。
常用的酸碱指示剂主要有以下四类:1 硝基酚类这是一类酸性显著的指示剂,如对-硝基酚等。
2 酚酞类有酚酞、百里酚酞和α-萘酚酞等,它们都是有机弱酸。
3 磺代酚酞类有酚红、甲酚红、溴酚蓝、百里酚蓝等,它们都是有机弱酸。
4 偶氮化合物类有甲基橙、中性红等,它们都是两性指示剂,既可作酸式离解,也可作碱式离解。
石蕊和酚酞都是酸碱指示剂,它们是一种弱的有机酸。
在溶液里,随着溶液酸碱性的变化,指示剂的分子结构发生变化而显示出不同的颜色。
石蕊(主要成分用HL表示)在水溶液里能发生如下电离: HL红色 H+ L-蓝色在酸性溶液里,红色的分子是存在的主要形式,溶液显红色;在碱性溶液里,上述电离平衡向右移动,蓝色的离子是存在的主要形式,溶液显蓝色;在中性溶液里,红色的分子和蓝色的酸根离子同时存在,所以溶液显紫色。
石蕊能溶于水,且能溶于酒精,变色范围是pH 5.0~8.0>酚酞是一种有机弱酸,它在酸性溶液中,浓度较高时,形成无色分子。
但随着溶液中H+浓度的减小,OH-浓度的增大,酚酞结构发生改变,并进一步电离成红色离子这个转变过程是一个可逆过程,如果溶液中H+浓度增加,上述平衡向反方向移动,酚酞又变成了无色分子。
因此,酚酞在酸性溶液里呈无色,当溶液中H+浓度降低,浓度升高时呈红色。
酚酞的变色范围是pH 8.0~10.0。
酚酞的醌式或醌式酸盐,在碱性介质中是很不稳定的,它会慢慢地转化成无色的羧酸盐式因此做氢氧化钠溶液使酚酞显色实验时,要用氢氧化钠稀溶液,而不能用浓溶液。

酸碱滴定指示剂的选择
当进行酸碱滴定反应时,选择合适的指示剂可以帮助我们准确地判定滴定点,从而得到准确的滴定结果。
所以,选择适合的酸碱指示剂显得尤为重要。
一、常用的酸碱指示剂
1. 酚酞:酚酞是一种常用的指示剂,可以在 pH 值为 8.0~10.0 之间变色,其酸性形式为无色,碱性形式为红色。
2. 甲基橙:甲基橙也是一种常用的指示剂,可以在 pH 值为
3.1~
4.4 之间变色,其酸性形式为红色,碱性形式为黄色。
3. 溴甲酚绿:溴甲酚绿可以在 pH 值为 3.8~5.4 之间变色,其酸性形式为黄色,碱性形式为蓝色。
4. 酚菁:酚菁可以在 pH 值为 8.0~10.0 之间变色,其酸性形式为橙色,碱性形式为蓝色。
二、如何选择酸碱指示剂
1. 根据滴定强弱选择
对于强酸强碱的滴定,如盐酸与氢氧化钠的滴定,可以选择鲜艳的指示剂,如甲基橙;对于弱酸弱碱的滴定,如碳酸氢钠与氢氧化铵的滴定,则需选择比较灵敏的指示剂,如酚酞。
2. 根据颜色选择
指示剂的变色区间影响着判断滴定点的准确性,因此需要根据滴定反应的 pH 范围和颜色来选择合适的指示剂。
如在 pH 值为 9.0 左右的滴定反应中,可以选择酚菁这一变色区间比较明显的指示剂,而在 pH 值为 4.5 左右的滴定反应中,则应选择变色区间比较集中的甲基橙。
3. 少用混合指示剂
混合指示剂是由两种或多种指示剂混合而成,用于满足更广泛的pH 范围,但其变色区间颜色变化不直观,易引起判断失误,因此在滴定反应中应尽可能少用混合指示剂。
综上所述,选择酸碱指示剂应根据滴定强弱、颜色和变色区间等因素进行选择,以达到准确判断滴定点、得出准确结果的目的。

酸碱滴定的指示剂选择酸碱滴定是一种常见的化学分析方法,用于确定溶液中酸和碱的浓度。
在酸碱滴定实验中,选择合适的指示剂至关重要,因为指示剂的选择能够直接影响滴定的准确性和可靠性。
在本文中,我们将探讨酸碱滴定的指示剂选择的重要性,并介绍几种常用的指示剂及其适用的酸碱滴定反应。
一、指示剂的作用和选择原则指示剂是一种能够在酸碱滴定过程中显示颜色变化的物质。
它能够根据酸性或碱性条件下的颜色变化来判断滴定的终点。
在选择指示剂时,应考虑以下几个原则:1. 颜色变化范围:指示剂的颜色变化范围应与待测溶液的pH变化范围相匹配。
这样才能确保在滴定过程中能够准确判断滴定终点。
2. 反应速度和灵敏度:指示剂应具有较快的反应速度和高灵敏度,可以在滴定过程中快速显示颜色变化。
3. 不影响溶液反应:指示剂在待测溶液中的存在不应对滴定反应造成影响,否则会导致滴定结果的误差。
二、常用的酸碱指示剂1. 酚酞:酚酞是一种常用的酸碱指示剂,它的酸性形式呈现无色,碱性形式则呈现粉红色。
酚酞在pH值范围为8.2-10.0时颜色变化明显,适用于酸性溶液滴定时使用。
2. 溴酚蓝:溴酚蓝是一种常用的酸碱指示剂,它在酸性条件下呈黄色,在碱性条件下呈蓝色。
溴酚蓝适用于pH范围为3.0-4.6的酸性溶液滴定。
3. 甲基橙:甲基橙是一种常用的酸碱指示剂,它在酸性条件下呈红色,在碱性条件下呈黄色。
甲基橙适用于pH范围为3.1-4.4的酸性溶液滴定。
4. 酚酞紫:酚酞紫是一种常用的酸碱指示剂,它在酸性条件下呈红色,碱性条件下呈紫色。
酚酞紫适用于pH范围为4.9-6.3的酸性溶液滴定。
5. 酸碱指示剂混合使用:有时,单一的酸碱指示剂可能无法准确判断滴定终点,此时可以尝试将不同的指示剂混合使用。
混合使用的指示剂可以扩大颜色变化范围,增加滴定的准确性。
三、酸碱滴定指示剂的实际应用1. 酸度滴定指示剂的应用:酚酞广泛应用于测定酸溶液中氢氧化物浓度的滴定中。
根据溶液的酸碱性质,酚酞的颜色变化可以明确显示滴定终点。

酸碱指示剂的种类及使用方法酸碱指示剂是化学实验中常用的一类试剂,可以通过颜色的变化来指示溶液的酸碱性质及酸碱度。
本文将介绍常见的酸碱指示剂种类及其使用方法,帮助读者更好地理解和应用这些指示剂。
一、酸碱指示剂的种类1. 酚酞指示剂(Phenolphthalein)酚酞指示剂是一种常用的酸碱指示剂,通常呈无色或微黄色。
在酸性溶液中表现为无色,在中性或碱性溶液中则呈现出桃红色。
酚酞指示剂主要用于测定弱酸和强碱之间的中和点。
2. 溴酚蓝指示剂(Bromothymol Blue)溴酚蓝指示剂是一种常见的酸碱指示剂,呈黄色或绿色。
在酸性溶液中呈黄色,中性溶液呈绿色,碱性溶液呈蓝色。
溴酚蓝指示剂常用于测定中性和弱碱之间的中和点。
3. 酚红指示剂(Phenol Red)酚红指示剂通常呈黄色或橙色。
在酸性溶液中呈黄色,在中性或碱性溶液中则呈现出红色。
酚红指示剂适用于酸和碱之间的中和点测定。
4. 甲基橙指示剂(Methyl Orange)甲基橙指示剂是一种典型的酸碱指示剂,其呈酸性溶液为红色,中性及碱性溶液则呈黄色。
甲基橙指示剂广泛用于酸碱滴定中。
5. 甲基红指示剂(Methyl Red)甲基红指示剂呈酸性溶液呈红色,中性及碱性溶液则为黄色。
甲基红指示剂常用于检测弱碱和强酸溶液的中和点。
二、酸碱指示剂的使用方法使用酸碱指示剂时需要注意以下几点:1. 选择适合的指示剂:根据实验需要,选择合适的酸碱指示剂。
不同指示剂的变色范围和反应pH范围不同,因此需要根据实验要求选择合适的指示剂。
2. 控制溶液中指示剂的浓度:通常情况下,将指示剂溶解于溶液中,以达到适当的浓度。
但是,需要注意的是,过高浓度的指示剂可能会对溶液产生影响,从而影响实验结果。
3. 指示剂的添加量:根据指示剂的种类和实验要求,控制好指示剂的添加量。
过少的指示剂可能导致颜色变化不明显,而过多的指示剂则可能影响溶液的稳定性。
4. 观察变色点:在向溶液中滴加酸或碱溶液时,观察颜色的变化。

酸碱滴定的指示剂选择
酸碱滴定是化学实验室中常见的一种分析方法,用于测定溶液
中酸碱的浓度。
在酸碱滴定中,选择合适的指示剂对于准确测定终
点至关重要。
指示剂是一种能够在溶液中显示颜色变化的化合物,
它能够帮助实验人员确定滴定溶液的终点。
选择合适的指示剂需要考虑滴定溶液的pH范围和所使用的酸碱
试剂。
例如,当使用强酸和强碱进行滴定时,可以选择甲基橙或甲
基红等指示剂,它们在酸性和碱性条件下都会出现明显的颜色变化。
而在弱酸和弱碱的滴定中,酚酞和酚酞紫等指示剂更为适合,因为
它们的颜色变化范围更接近于中性。
另外,还有一些指示剂是根据滴定终点的pH值来选择的,比如
溴甲酚绿和溴褐色指示剂,它们在不同pH条件下会呈现不同的颜色,因此非常适合用于多种酸碱滴定。
在实验中选择合适的指示剂,可以帮助实验人员准确地确定滴
定终点,从而获得准确的酸碱浓度。
因此,对于每种滴定实验,都
需要仔细选择合适的指示剂,这样才能确保实验结果的准确性和可
靠性。
自然界中的酸碱指示剂杨贺铭生化学院化本092班酸碱指示剂用于酸碱滴定的指示剂,称为酸碱指示剂。
(acid-base indicator)。
这是一类结构较复杂的有机弱酸或有机弱碱,它们在溶液中能部分电离成指示剂的离子和氢离子(或氢氧根离子),并且由于结构上的变化,它们的分子和离子具有不同的颜色,因而在pH不同的溶液中呈现不同的颜色。
常用的酸碱指示剂主要有以下四类:1 硝基酚类这是一类酸性显著的指示剂,如对-硝基酚等。
2 酚酞类有酚酞、百里酚酞和α-萘酚酞等,它们都是有机弱酸。
3 磺代酚酞类有酚红、甲酚红、溴酚蓝、百里酚蓝等,它们都是有机弱酸。
4 偶氮化合物类有甲基橙、中性红等,它们都是两性指示剂,既可作酸式离解,也可作碱式离解。
酸碱指示剂的发现酸碱指示剂是检验溶液酸碱性的常用化学试剂,像科学上的许多其它发现一样,酸碱指示剂的发现是化学家善于观察、勤于思考。
勇于探索的结果。
300多年前,英国年轻的科学家罗伯特·波义耳在化学实验中偶然捕捉到一种奇特的实验现象,有一天清晨,波义耳正准备到实验室去做实验,一位花木工为他送来一篮非常鲜美的紫罗兰,喜爱鲜花的波义耳随手取下一块带进了实验室,把鲜花放在实验桌上开始了实验,当地从大瓶里倾倒出盐酸时,一股刺鼻的气体从瓶口涌出,倒出的淡黄色液体世冒白雾,还有少许酸沫飞溅到鲜花上,他想“真可惜,盐酸弄到鲜花上了”,为洗掉花上的酸沫,他把花用水冲了一下,一会儿发现紫罗兰颜色变红了,当时波义耳既新奇又兴奋,他认为,可能是盐酸使紫罗兰颜色变红色,为进一步验证这一现象,他立即返回住所,把那篮鲜花全部拿到实验室,取了当时已知的几种酸的稀溶液,把紫罗兰花瓣分别放入这些稀酸中,结果现象完全相同,紫罗兰都变为红色。
由此他推断,不仅盐酸,而且其它各种酸都能使紫罗兰变为红色。
他想,这太重要了,以后只要把紫罗兰花瓣放迸溶液,看它是不是变红色,就可判别这种溶液是不是酸。
偶然的发现,激发了科学家的探求欲望,后来,他又弄来其它花瓣做试验,并制成花瓣的水或酒精的浸液,用它来检验是不是酸,同时用它来检验一些碱溶液,也产生了一些变色现象。
指示剂在酸碱滴定中的选择
指示剂在酸碱滴定中起到了关键的作用,它们可以通过改变颜
色来指示反应的终点。
正确选择和使用指示剂可以提高滴定的准确
性和可靠性。
下面介绍一些常用的指示剂及其适用性。
1. 酸碱指示剂:
- 酚酞(Phenolphthalein):酚酞是一种常用的酸碱滴定指示剂,它在酸性溶液中呈无色,在碱性溶液中呈粉红色。
适用于酸性反应
和弱碱与强酸之间的滴定。
- 甲基橙(Methyl orange):甲基橙是一种常用的酸碱滴定指
示剂,它在酸性溶液中呈红色,在碱性溶液中呈黄色。
适用于强酸
与强碱之间的滴定。
- 酚酞和甲基橙的选择取决于所滴定的溶液的性质和pH值。
2. 氧化还原指示剂:
- 二氧化锰(Manganese dioxide):二氧化锰在还原性溶液中
由黑色变为无色,适用于氧化滴定。
- 三碘化铁(Iron(III) iodide):三碘化铁在氧化性溶液中由黄
色变为蓝色,适用于还原滴定。
对于酸碱滴定,正确选择指示剂的关键是根据所滴定的溶液的性质和pH值来确定。
需要注意的是,一些指示剂可能会对滴定结果产生干扰,因此在选择和使用指示剂时应尽量避免这些干扰。
以上是指示剂在酸碱滴定中的选择的一些简要介绍,希望对您有所帮助。
【注】以上内容仅供参考,具体使用过程中请参照实际情况和相关实验室操作规范。
酸碱滴定时的最佳指示剂指示剂在酸碱滴定中起着重要的作用,它能够通过颜色的变化来指示溶液的酸碱性质。
选择合适的指示剂是确保滴定结果准确的关键因素之一。
本文将介绍酸碱滴定时的最佳指示剂选择方法。
1. 酸碱指示剂的选择原则在选择指示剂时,应考虑以下因素:- 指示剂变色范围和滴定终点的pH值:指示剂变色的范围应与需要测定的酸碱溶液的pH范围相匹配,以确保准确判断滴定终点。
- 颜色转变的鲜明度:指示剂颜色转变应明显,易于观察。
- 温度和溶剂的影响:应注意指示剂在不同温度和溶剂条件下的性质变化。
- 指示剂的稳定性和保存:选择稳定性好、长期保存不退色的指示剂。
2. 常用的酸碱指示剂下面列举了几种常用的酸碱指示剂及其适用范围:- 酚酞指示剂:适用于酸性溶液和弱碱性溶液的滴定,变色范围为pH 8.2-10.0。
- 甲基橙指示剂:适用于中性溶液和弱酸性溶液的滴定,变色范围为pH 3.1-4.4。
- 酸性橙指示剂:适用于碱性溶液的滴定,变色范围为pH 3.5-4.6。
- 苯酚蓝指示剂:适用于强酸和中性溶液的滴定,变色范围为pH 6.0-7.6。
- 鲜红茜素指示剂:适用于碱性溶液的滴定,变色范围为pH 7.2-8.8。
3. 指示剂的正确使用方法在使用指示剂时,应注意以下几点:- 根据需要选择适当的指示剂。
- 指示剂的浓度应适宜,通常为0.1%-1%。
- 滴定过程中要慢慢加入指示剂,以免过量而干扰判断。
- 仔细观察溶液颜色的变化,以判断滴定终点。
总结:选择合适的酸碱指示剂是确保酸碱滴定准确性的关键。
在选择指示剂时,应考虑指示剂变色范围、鲜明度、温度和溶剂影响,以及稳定性和保存等因素。
酚酞、甲基橙、酸性橙、苯酚蓝和鲜红茜素是常用的酸碱指示剂。
使用指示剂时,应注意适当的浓度和慢慢加入的方法,仔细观察滴定终点的颜色变化,以确保准确的滴定结果。
参考文献:[1] 张华,李明. 分析化学实验. 北京:化学工业出版社,2016.[2] Gupta R, Sharma A, Bhatt R. Acid-Base indicators: A review [J]. Journal of Global Pharma Technology, 2009, 1(1): 23-29.。
酸碱滴定技术所用指示剂
酸碱滴定技术是一种常用的化学分析方法,它通过滴定管向待测溶液中加入一定量的标准溶液,然后观察溶液颜色的变化来判断滴定是否完成。
而指示剂是酸碱滴定技术中的重要组成部分,用于指示滴定过程中溶液酸碱性的变化。
以下是酸碱滴定技术所用的常见指示剂及其颜色变化:
1. 酚酞:酚酞在酸性溶液中为无色,在碱性溶液中为红色。
因此,它通常用于指示碱性溶液的滴定,当酚酞颜色由无色变为红色时,表示滴定完成。
2. 甲基橙:甲基橙在酸性溶液中为红色,在碱性溶液中为黄色。
它通常用于指示酸性溶液的滴定,当甲基橙颜色由红色变为黄色时,表示滴定完成。
3. 溴甲酚绿:溴甲酚绿在酸性溶液中为黄色,在碱性溶液中为蓝绿色。
它通常用于指示碱性溶液的滴定,当溴甲酚绿颜色由黄色变为蓝绿色时,表示滴定完成。
4. 萘酚绿:萘酚绿在酸性溶液中为黄色,在碱性溶液中为绿色。
它通常用于指示碱性溶液的滴定,当萘酚绿颜色由黄色变为绿色时,表示滴定完成。
以上是酸碱滴定技术中常用的几种指示剂及其颜色变化。
在具体的滴定分析中,应根据待测溶液的性质和滴定要求选择合适的指示剂,以确保滴定的准确性和可靠性。
酸滴定碱用什么指示剂
强酸滴定强碱可以用甲基红指示剂,强碱滴定强酸可以用酚酞指示剂。
强酸滴弱碱用甲基橙(黄变橙)或酚酞(红变无色)。
用酸作滴定剂可以测定碱,用碱作滴定剂可以测定酸,这是一种用途极为广泛的分析方法。
最常用的酸标准溶液是盐酸,有时也用硝酸和硫酸。
酸碱中和滴定实验注意事项一、摇瓶时,应微动腕关节,使溶液向一个方向做圆周运动,但是勿使瓶口接触滴定管,溶液也不得溅出。
二、滴定时左手不能离开旋塞让液体自行流下。
三、注意观察液滴落点周围溶液颜色变化。
开始时应边摇边滴,滴定速度可稍快(每秒3~4滴为宜),但是不要形成连续水流。
接近终点时应改为加一滴,摇几下,最后,毎加半滴,即摇动锥形瓶,直至溶液出现明显的颜色变化,而且半分钟内不褪色,准确到达终点为止。
滴定时不要去看滴定管上方的体积,而不顾滴定反应的进行。
加半滴溶液的方法如下:微微转动活塞,使溶液悬挂在出口嘴上,形成半滴(有时还不到半滴),用锥形瓶内壁将其刮落。
四、每次滴定最好从“0.00”ML处开始(或者从0ML附近的某一段开始),这也可以固定使用滴定管的某一段,以减小体积误差。
五、计算时应注意(酸式滴定时)
A、锥形瓶不用润洗。
B、酸式滴定管没用标准液润湿,结果偏高。
六、数据处理
为减少实验误差,滴定时,要求重复试验2~3次,求出所用标准溶液体积的平均值,然后在计算待测液的物质的量浓度。
用于酸碱滴定的指示剂,称为酸碱指示剂。
(acid-base indicator)。
这是一类结构较复杂的有机弱酸或有机弱碱,它们在溶液中能部分电离成指示剂的离子和氢离子(或氢氧根离子),并且由于结构上的变化,它们的分子和离子具有不同的颜色,因而在pH不同的溶液中呈现不同的颜色。
常用的酸碱指示剂主要有4类:硝基酸类、酚酞类、磺代酚酞类、偶氮化合物类。
可以得到质子的是碱
可以失去质子的是酸
常用酸碱指示剂指示剂名称范围酸色中性色碱色
甲基橙 3.1-4.4 红橙黄甲基红4.4-6.2 红橙黄
溴百里酚蓝 6.0-7.6 黄绿蓝
酚酞 8.2-10.0 无色浅红红
石蕊 5.0-8.0 红紫蓝
一、指示剂的作用原理
1、酸碱指示剂:一般是某些有机弱酸或弱碱,或是有机酸碱两性物质,它们在酸碱
滴定过程中也能参与质子转移反应,因分子结构的改变而引起自身颜色的变化,并且这种颜色伴随结构的转变是可逆的。
例如酚酞,甲基橙。
2、分类:
单色指示剂:在酸式或碱式型体中仅有一种型体具有颜色的指示剂。
如酚酞
双色指示剂:酸式或碱式型体均有颜色的指示剂。
如甲基橙。
二、指示剂变色的pH范围
1、变色原理:以HIn表示指示
HIn = H+ + In-
酸式型体碱式型
Ka为指示剂的解离常数
⑴、溶液的颜色是由[In-]/[HIn]的比值来决定的,随溶液的[H]的变化而变化。
⑵、当[In-]/[HIn]≤1/10 PH≤PKa-1 酸式色
当10>[In-]/[HIn]>1/10 PH在PKa±1之间颜色逐渐变化的混合色
二、当[In-]/[HIn]≥10 PH≥PKa+1 碱式色
2、变色范围:当溶液的PH由PKa-1变化到PKa+1(或相反)时,才可以观察到指示
剂由酸式色经混合色变化到碱性色,这一颜色变化的pH范围,即pH===pKa±1称为指示剂的变色范围。
3、理论变色点:当指示剂的酸式型体与碱式型体的浓度相等,即[In-]/[HIn]==1时,
溶液的pH = pKa ,称为指示剂的理论变色点。
三、影响指示剂变色范围的因素:
1、指示剂的用量:
双色指示剂:指示剂的变色范围不受其用量的影响。
但指示剂的变色也要消耗一定的滴定剂,从而引入误差。
单色指示剂:单色指示剂的用量增加,其变色范围向PH减小的方向发生移动。
使用时其用量要合适。
2、温度:温度的变化会引起指示剂解离常数和水的质子自递常数发生变化,因而指
示剂的变色范围亦随之改变,对碱性指示剂的影响较酸性指示剂更为明显。
3、中性电解质:
4、溶剂:不同的溶剂具有不同的介电常数和酸碱性,因而一行指示剂的解离常数和
变色范围。
四:混合指示剂:
1、混合指示剂利用了颜色之间的互补作用,具有很窄的变色范围,且在滴定终点由敏锐的颜色变化。
2、配制方法:
[1] 采用一种颜色不随溶液中H 浓度变化而变化的染料(称为惰性染料)和一种指示剂配制而成;
[2] 选择两种(或多种)PK 值比较接近的指示剂,按一定的比例混合使用。
(1)红萝卜皮:刮下红萝卜的红皮,用95%酒精浸泡一天左右,过滤后取它的滤液。
按检验的需要制作pH1~14的标准溶液若干个。
每个标准溶液取10mL,分别加入试管中,各试管中加入红萝卜皮浸泡液(即酸碱指示剂)10滴,用橡皮塞塞紧,作为标准样品。
在测定某溶液的酸碱度时,加入上述红萝卜皮指示剂,当发生颜色变化时,跟上述制得的标准样品的颜色作比较,就能确定待测溶液的pH值大致范围。
红萝卜皮浸泡液实测的结果是
pH值在6以下时显红色,
pH值在6~8时显紫红色,
pH值在8~10时显绿色,
pH值在10以上时显黄色。
(2)紫草:在中药店买50g紫草,取5克,用50%酒精溶液浸泡,浸泡一天就得到紫草色素的酒精溶液,呈紫色。
把浸泡液一分为二,一份加入极少量稀酸(稀磷酸或稀硫酸)到溶液刚变红色,这是红色的紫草试液;另一份加极少量氢氧化钠稀溶液到溶液刚变蓝色,这是蓝色的紫草试液。
把滤纸剪成条状,一半浸入红色紫草试液中,另一半浸入蓝色紫草试液中,片刻后取出晾干,就能分别替代红色石蕊试纸和蓝色石
蕊试纸(变色范围和使用方法跟石蕊试纸相同)。
(3)紫色卷心菜:取约250g紫色卷心菜,洗净后切碎,放在大烧杯或不锈钢锅内,加水到浸没1/2菜叶,加热煮沸10分钟,并不断搅拌菜叶。
再把煮后的卷心菜汁滤入一只容器中,放置到室温后装瓶。
得到的紫色卷心菜滤汁可以用作酸碱指示剂。
使用时可参照上述操作(1)的方法,先制几个标准pH值样品,用于不同pH值的检验。
也可以把滤纸剪成条状,浸在紫色卷心菜汁内,浸透后取出晾干,再次浸泡、晾干1~2遍,得到自制的pH试纸。
该指示剂的显色情况如下。
pH值小于3时显红色,
pH值在3~5时显浅紫色,
pH值在6~7时显蓝色,
pH值在8~9时显青绿色,
pH值在10~12时显绿色,
pH值大于13时显黄色。
(4)米苋菜:把250g红色米苋洗净切碎,放在约500g水中加热煮沸约10分钟,滤去残渣,就得到红色的酸碱指示剂。
它的变色范围是
pH值小于2时显紫红色,
pH值在2~4时显玫瑰红色,
pH值在5~7时显洋红、酒红色,
pH值在7~9时显黄色,
pH值在9~13时显黄绿色,
pH值大于14时显亮黄色。
三、酸碱指示剂(Acid-base indicator),或称pH指示剂、氢离子浓度指
示剂,是用来测试pH值的化学试剂。
它们本身是弱酸或弱碱,并含有色素,在滴入溶液时色素会与H+氢离子或OH−氢氧离子结合,转化成相应的酸式或碱式,从而显示不同的色泽。
由于pH指示剂在不同pH值的溶液中能产
生可逆的色泽变化,所以可在中和分析中,指示反应终点,并可测定被试液的pH值。
pH指示剂的质量主要控制在pH变色范围的灵敏度。