酸碱滴定法【酸碱滴定实验】.
- 格式:ppt
- 大小:2.44 MB
- 文档页数:84


酸碱滴定法是一种利用酸和碱在水中以质子转移反应为基础的滴定分析方法。
在中国药典中,酸碱滴定法可以用于测定酸、碱和两性物质,是一种用途极为广泛的分析方法。
具体来说,酸碱滴定法利用了酸、碱溶液的中和反应来判断样品的酸碱性。
在滴定过程中,通过滴定管的精确计量液体体积,以及加入指示剂来指示反应终点,从而可以准确地测定样品的酸碱性。
在中国药典中,酸碱滴定法被广泛应用于药品、食品、化工等领域。
例如,可以利用酸碱滴定法测定药品中有效成分的含量,或者用于检测食品中的酸碱度等。
需要注意的是,酸碱滴定法需要使用专业的滴定仪器和试剂,并且需要经过严格的培训和操作规范才能保证测定的准确性和可靠性。
因此,在进行酸碱滴定实验时,建议在专业的实验室或机构进行操作。

高中化学备课教案酸碱滴定法的实验原理实验步骤与误差分析的实验验证与结果解释高中化学备课教案:酸碱滴定法的实验原理、实验步骤与误差分析的实验验证与结果解释酸碱滴定法是化学实验中常用的一种定量分析方法,用于测定溶液中酸碱浓度的方法。
本文将针对酸碱滴定法的实验原理、实验步骤以及误差分析进行实验验证与结果解释。
一、实验原理酸碱滴定法是基于酸碱反应的化学量的测定方法,实验中常用的指示剂是酸碱指示剂,如酚酞、溴酚蓝等。
实验原理主要包括以下几个方面:1. 酸碱中和反应的化学方程式:酸+碱→盐+水。
2. 酸碱滴定溶液的准备:分别将酸和碱溶液制备成适当浓度的滴定溶液。
3. 酸碱指示剂的选择:根据实验中的酸碱性质选择合适的指示剂。
4. 滴定过程中的反应条件控制:滴定过程中,应保持温度和酸碱滴定液的摇混均匀。
5. 滴定终点的判断:通过改变滴定溶液的颜色变化来判断滴定终点。
二、实验步骤1. 实验前准备:准备好所需试剂和仪器设备,清洗滴定管、容量瓶等。
2. 酸碱滴定液的制备:分别取一定量的酸和碱溶液,用蒸馏水稀释到一定的体积。
3. 目测法的滴定过程:将酸碱滴定溶液分别加入容量瓶中,用滴定管按滴下的速度缓慢滴加反应终点。
4. 自动滴定法的滴定过程:将酸碱滴定溶液倒入滴定瓶中,使用自动滴定仪进行滴定。
5. 滴定终点的判断:滴定过程中,观察指示剂颜色的变化,当颜色由变化较明显的红色到无色(如酚酞指示剂),则为滴定终点。
6. 记录滴定结果:记录滴定前后滴定溶液的体积差,计算出酸或碱的浓度。
三、误差分析酸碱滴定法在实验过程中可能存在一定的误差,主要包括以下几个方面:1. 试剂的误差:试剂的浓度可能会和标称值有一定的差异,因此在实验过程中需要进行试剂的标定,以减小误差。
2. 滴定指示剂的误差:滴定指示剂的选择可能会影响滴定终点的准确性,不同指示剂对滴定结果的影响也有所不同。
3. 滴定量的误差:在滴定过程中,滴定液的滴下速度和滴定时的人眼判断存在一定的误差,可能会导致滴定结果的不准确性。

化环学院食品药品监督管理杨建 200904183014 酸碱滴定的应用酸碱滴定法可分为直接滴定法和间接滴定法两种一. 直接滴定法1. 食品中苯甲酸钠的滴定食品防腐剂之一,最高允许误差0.1%苯甲酸钠在HCl的作用下生成苯甲酸,苯甲酸在乙醚的作用下萃取于乙醚层,加热去乙醚,得到苯甲酸,将苯甲酸溶于中性乙醇,最后用NaOH标液滴定以酚酞做指示剂,滴定至红色。
二. 间接滴定法铵盐中氮的测定:甲醛法4NH4+ + 6 HCHO == (CH2)6N4H++3H+ +6 H2O (定量进行)Ka =7.1 10-6用酚酞为指示剂,终点为粉红色。
如果试样中含有游离酸,事先用甲基红作指示剂。
混合碱的测定-双指示剂法混合碱通常是指NaOH 与Na 2CO 3或Na 2CO 3与NaHCO 3的混合物。
所谓双指示剂法,就是在同一溶液中先后用两种不同的指示剂来指示两个不同的终点。
NaOH 和Na 2CO 3混合物的测定可用双指示剂法,即先用酚酞指示第一计量点,再用甲基橙指示第二计量点。
当用HCl 标准溶液滴定到第一计量点时,NaOH 已全部中和生成了NaCl 和H 2O ,而Na 2CO 3只被滴定成NaHCO 3,设这一过程所耗HCl 的总体积为V 1mL 。
继续用HCl 标准溶液滴定时,第一计量点所生成的NaHCO 3与HCl 反应,生成CO 2和H 2O ,设此过程所消耗HCl 标准溶液的体积为V 2mL 。
则NaOH 所消耗的HCl 体积为(V 1-V 2)mL ,Na 2CO 3消耗的HCl 总体积为2V 2mL ,如下图所示:第一计量点第二计量点NaOHNa 2CO 3NaCl H 2O CO 2NaHCO 3H 2O 1V 2++V 1V 2V 2V 2NaOH 和Na 2CO 3的质量分数可按下列公式计算:12HCl NaOH 1000(NaOH)100%V V c M w W -⋅⋅=⨯样232HCl 1/2Na CO 2321000(Na CO )100%V c M w W ⋅⋅=⨯样Na 2CO 3与NaHCO 3混合物的测定与上述方法类似。
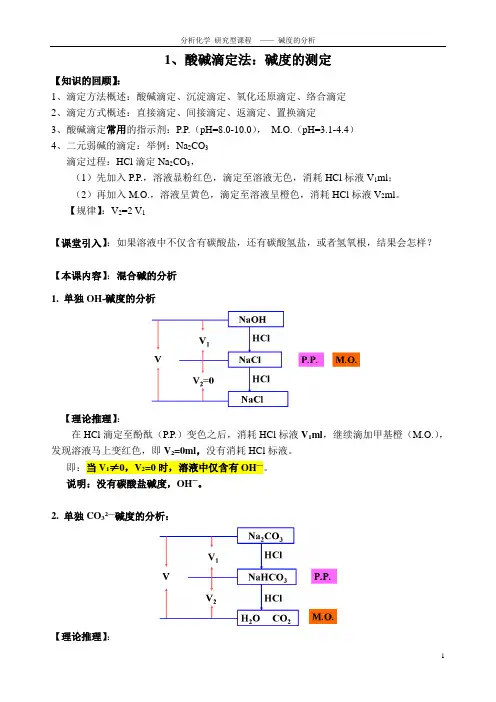
1、酸碱滴定法:碱度的测定【知识的回顾】:1、滴定方法概述:酸碱滴定、沉淀滴定、氧化还原滴定、络合滴定2、滴定方式概述:直接滴定、间接滴定、返滴定、置换滴定3、酸碱滴定常用的指示剂:P.P.(pH=8.0-10.0),M.O.(pH=3.1-4.4)4、二元弱碱的滴定:举例:Na2CO3滴定过程:HCl滴定Na2CO3,(1)先加入P.P.,溶液显粉红色,滴定至溶液无色,消耗HCl标液V1ml;(2)再加入M.O.,溶液呈黄色,滴定至溶液呈橙色,消耗HCl标液V2ml。
【规律】:V2=2 V1【课堂引入】:如果溶液中不仅含有碳酸盐,还有碳酸氢盐,或者氢氧根,结果会怎样?【本课内容】:混合碱的分析1. 单独OH-碱度的分析【理论推理】:在HCl滴定至酚酞(P.P.)变色之后,消耗HCl标液V1ml,继续滴加甲基橙(M.O.),发现溶液马上变红色,即V2=0ml,没有消耗HCl标液。
即:当V1≠0,V2=0时,溶液中仅含有OH—。
说明:没有碳酸盐碱度,OH—。
2. 单独CO32—碱度的分析:【理论推理】:在HCl滴定至酚酞(P.P.)变色之后,消耗HCl标液V1ml,继续滴加甲基橙(M.O.),滴定至溶液变红色,消耗HCl标液V2 ml,且V1=V2。
即:当V1=V2时,溶液中仅含有OH—。
说明:只有碳酸盐碱度,CO32—。
3. 单独HCO3—(重碳酸盐)碱度的分析:【理论推理】:向溶液中加入指示剂酚酞(P.P.),溶液不显粉红色,即消耗HCl标液V1=0ml,继续滴加甲基橙(M.O.),溶液呈现橙黄色,滴定至溶液变红色,消耗HCl标液V2 ml。
即:当V1=0,V2≠0时,溶液中仅含有HCO3—。
说明:只有碳酸盐碱度,HCO3—。
4. CO32—和HCO3—碱度的分析:【理论推理】:向溶液中加入指示剂酚酞(P.P.),溶液显粉红色,滴定至粉红色消失,消耗HCl标液V1ml,继续滴加甲基橙(M.O.),溶液呈现橙黄色,滴定至溶液变红色,消耗HCl标液V2 ml。


化学实验中的溶液的酸碱中和滴定在化学实验中,溶液的酸碱中和滴定是一种常用的分析方法。
它通过滴加已知浓度的酸或碱溶液到待测溶液中,利用酸碱反应的中和反应完成对待测物质浓度的测定。
本文将介绍溶液的酸碱中和滴定的原理、操作步骤以及注意事项。
一、原理溶液的酸碱中和滴定是基于酸碱中和反应的理论基础进行的。
在酸碱反应中,酸和碱发生化学反应,产生相应的盐和水。
滴定过程中,通过逐滴加入酸或碱溶液,使待测溶液中的反应物与滴加溶液中的反应物按化学计量比例进行反应,从而达到酸碱中和的状态。
当酸或碱溶液滴加到与待测溶液中的反应物完全反应时,可以根据滴加的酸碱溶液的体积计算出待测溶液中的物质浓度。
二、操作步骤1.准备工作首先,需要准备好实验所需的仪器和试剂,包括滴定管、容量瓶、酸或碱溶液、指示剂等。
同时,要确保实验操作区域的清洁和安全,避免交叉污染和意外事故的发生。
2.样品制备将待测溶液准备好,并计量出适量的待测溶液放入容量瓶中。
3.滴定过程a) 将滴定管插入滴定瓶中,吸取适量的滴定液。
b) 将滴定管中的滴定液滴加到容量瓶中的待测溶液中。
c) 同时加入一滴指示剂,用以指示中和点的变化。
d) 持续滴加滴定液,直到待测溶液的颜色变化示意达到中和点。
e) 记录滴定液的滴定体积。
4.计算结果根据已知滴定液的浓度和滴定液的滴定体积,可以计算出待测溶液中的物质浓度。
三、注意事项1.实验过程中应注意操作的准确性和仪器的清洁,避免误差的发生。
2.选用适当的指示剂,以获得准确的中和点。
3.滴定液和待测溶液应有明显的颜色区分,便于观察颜色变化。
4.滴定液应以适量滴加,避免一次加入过多导致误差。
5.实验过程中,要注意安全操作,避免对皮肤和眼睛的直接接触。
总结:溶液的酸碱中和滴定是一种常用的分析方法,通过对待测溶液中的物质浓度进行测定。
在操作过程中,我们需要掌握滴定的原理和操作步骤,并注意实验的准确性和安全性。
只有在滴定液与待测溶液中的物质按化学计量比例完全反应时,才能得到准确的测定结果。


酸碱滴定实验报告数据酸碱滴定实验报告数据一、实验目的酸碱滴定实验是化学实验中常见的一种实验方法,通过滴定的方式确定溶液中酸碱物质的浓度。
本次实验的目的是通过酸碱滴定法测定未知浓度的盐酸溶液中氢氧化钠的浓度。
二、实验原理酸碱滴定实验是利用酸碱中和反应进行的。
在实验中,首先将一定体积的盐酸溶液与氢氧化钠溶液反应,通过滴定的方式逐渐加入氢氧化钠溶液,直到反应达到中和点。
在中和点时,酸碱溶液中的酸和碱完全反应,生成盐和水。
通过滴定过程中溶液颜色的变化,可以确定滴定终点。
三、实验步骤1. 准备工作:将盐酸溶液和氢氧化钠溶液分别取出,并用蒸馏水稀释至适当浓度。
2. 滴定过程:取一定体积的盐酸溶液放入滴定瓶中,加入几滴酚酞指示剂。
然后,用氢氧化钠溶液滴定盐酸溶液,直到颜色由无色变为粉红色。
记录滴定过程中加入的氢氧化钠溶液体积。
3. 重复实验:重复以上步骤,进行多次实验,以提高实验结果的准确性。
4. 数据处理:根据滴定过程中加入的氢氧化钠溶液体积,计算出氢氧化钠的浓度。
四、实验数据实验1:滴定过程中加入氢氧化钠溶液体积为10.2 mL。
实验2:滴定过程中加入氢氧化钠溶液体积为9.8 mL。
实验3:滴定过程中加入氢氧化钠溶液体积为10.0 mL。
五、数据处理根据实验数据,可以计算出氢氧化钠溶液的平均滴定体积。
平均滴定体积=(10.2 mL + 9.8 mL + 10.0 mL)/ 3 = 10 mL。
根据滴定反应的化学方程式:HCl + NaOH → NaCl + H2O可以知道,滴定反应中1 mol的盐酸与1 mol的氢氧化钠完全反应生成1 mol的氯化钠和1 mol的水。
因此,可以得到氢氧化钠的浓度计算公式:C(NaOH) = C(HCl) × V(HCl) / V(Na OH)其中,C(NaOH)为氢氧化钠的浓度,C(HCl)为盐酸的浓度,V(HCl)为盐酸滴定液的体积,V(NaOH)为氢氧化钠滴定液的体积。


提取酸碱滴定法
酸碱滴定法是一种重要的分析技术,可以用来测定样品中离子溶液的酸碱度。
其基本原理是用准确测定溶液中给定量酸或碱来改变溶液中离子溶液浓度,通过测量该变化,以及溶液中离子溶液的pH,可以准确测定样品中离子溶液的酸碱度,从而了解溶液的性质。
酸碱滴定法有两种主要模式,即开放式滴定法和闭合式滴定法。
其中,开放式滴定法指的是使用一定的酸或碱,使溶液的 pH 值在一定的范围内,微量叠加到该溶液中,观察溶液的 pH 值及溶液的颜色变化,从而测定样品中溶液的酸碱度。
闭合式滴定法指的是将样品加入到一定体积的容器中,使用恒定的酸或碱精密叠加到容器中,直到该溶液达到特定 pH 值,然后计算出溶液酸碱度是多少。
酸碱滴定法最常用于测定水中离子溶液的含量,它可以检测出水溶液中的酸碱度,以定量的方式确定水样的酸碱度和弱电解质的含量,为水处理工作提供参考依据。
此外,酸碱滴定还有着比较广泛的应用,比如食品QA,环境安全监测,生化molecular biology,卫生检验,药物分析,谱分析检测等,都常用此方法来进行检测和分析。
总之,酸碱滴定法是一种重要的分析技术,它不仅可以用于科学研究,而且可以广泛应用于生产和环境监测领域,其准确性及其调节成本等优点,使它在检测样品质量和环境安全方面,日益受到重视。
1. 理解并掌握酸碱滴定法的原理和操作步骤。
2. 学习使用酸碱滴定仪器,如滴定管、锥形瓶等。
3. 通过实验,学会如何正确选择酸碱指示剂,并观察颜色变化。
4. 练习滴定操作,提高实验技能。
5. 学习通过滴定计算分析物质的浓度。
二、实验原理酸碱滴定法是一种利用酸碱中和反应来测定未知溶液浓度的定量分析方法。
其基本原理是:已知浓度的酸(或碱)溶液(标准溶液)与未知浓度的碱(或酸)溶液(待测溶液)在酸碱指示剂的存在下,通过逐滴加入标准溶液,直到反应达到化学计量点,此时酸碱的物质的量相等,从而可以计算出待测溶液的浓度。
三、实验仪器与药品仪器:1. 滴定台一台2. 25mL酸(碱)滴定管各一支3. 10mL移液管一支4. 250mL锥形瓶两个5. 酸碱指示剂(如酚酞、甲基橙等)药品:1. 0.1mol/L NaOH溶液2. 0.1mol/L 盐酸3. 0.05mol/L 草酸(二水草酸)4. 酚酞试剂5. 甲基橙试剂1. 准备工作:- 检查滴定管是否漏水,确保滴定管处于良好状态。
- 配制标准溶液:用已知浓度的酸(或碱)溶液,通过稀释或稀释与浓缩的方法,制备出一定浓度的标准溶液。
- 准备待测溶液:准确称取一定量的待测溶液,用移液管移取一定体积的待测溶液至锥形瓶中。
2. 滴定过程:- 将锥形瓶放在滴定台上,加入适量的酸碱指示剂。
- 将标准溶液加入滴定管中,记录初始读数。
- 用滴定管逐滴加入标准溶液至锥形瓶中,边加边振荡锥形瓶,观察颜色变化。
- 当颜色变化达到滴定终点时,记录标准溶液的读数。
3. 计算与结果分析:- 根据滴定过程中消耗的标准溶液体积,计算出待测溶液的浓度。
- 分析实验误差,讨论实验结果。
五、实验结果与分析1. 滴定曲线:- 根据实验数据,绘制滴定曲线,观察滴定终点的颜色变化。
2. 计算待测溶液的浓度:- 通过计算公式,计算出待测溶液的浓度。
3. 误差分析:- 分析实验误差,如滴定管读数误差、操作误差等。