大学化学---氧化还原反应与电化学基础
- 格式:ppt
- 大小:3.50 MB
- 文档页数:78

氧化还原反应和电化学反应氧化还原反应是化学反应中最为重要和常见的反应之一。
它涉及到物质中的电子转移过程。
在氧化还原反应中,物质可以同时发生氧化和还原。
与之相伴随的是电化学反应,电化学反应是指在化学反应中涉及电子的转移和电流的流动的反应。
一、氧化还原反应氧化还原反应中,氧化和还原是同时进行的。
氧化是指物质失去电子;还原则是指物质获得电子。
这一过程中,电子从一个物质转移到另一个物质。
氧化和还原总是同时发生,因为电子不能独立存在。
例如,当铁和氧气发生反应时,铁原子(Fe)失去两个电子,被氧(O2)接受,生成氧化铁(Fe2O3)。
这里,铁原子发生了氧化,而氧气发生了还原。
氧化还原反应在日常生活中非常常见。
例如,金属的生锈、水的电解、电池的工作原理等都是氧化还原反应的例子。
二、电化学反应电化学反应是指在化学反应中涉及电子的转移和电流的流动的反应。
它是由氧化还原反应导致的。
电化学反应可以分为两种类型:电解反应和电池反应。
1. 电解反应电解反应是指在电解池中,通过外加电压使化学反应发生。
在电解过程中,正极(阳极)接受电子,发生氧化反应;负极(阴极)释放电子,发生还原反应。
电解反应在工业生产和实验室中广泛应用。
例如,电解盐水时,氯离子(Cl-)在阳极上接受电子,发生氧化反应生成氯气(Cl2),而阳离子(Na+)在阴极上释放电子,发生还原反应生成氢气(H2)。
2. 电池反应电池反应是指在电化学电池内,将化学能转化为电能的反应。
电池由两个半电池组成,每个半电池都有一个氧化反应和一个还原反应。
半电池之间通过电子流进行电荷平衡。
常见的电池包括干电池、蓄电池和燃料电池等。
干电池是通过将氧化剂和还原剂隔离,以阻止反应直接进行,并通过电子在电路中流动来提供电能。
蓄电池是通过可逆的氧化还原反应来存储和释放电能。
燃料电池是通过将燃料和氧气直接反应生成电能。
总结:氧化还原反应和电化学反应密切相关,涉及到电子转移和电流的流动。
氧化还原反应是物质中的电子转移过程,分为氧化和还原。

氧化还原反应与电化学电池氧化还原反应是化学中常见的一种反应类型,也是电化学电池的基础原理。
本文将从氧化还原反应的基本概念入手,介绍其在电化学电池中的应用。
一、氧化还原反应基本概念氧化还原反应通常涉及物质的电子转移过程,其中一个物质被氧化失去电子,而另一个物质被还原获得电子。
氧化还原反应可以表示为以下形式:氧化物 + 还原剂→ 还原物 + 氧化剂在氧化还原反应中,氧化剂是接受电子的物质,而还原剂是捐赠电子的物质。
通过电子的转移,原子或离子的氧化态和还原态发生了变化。
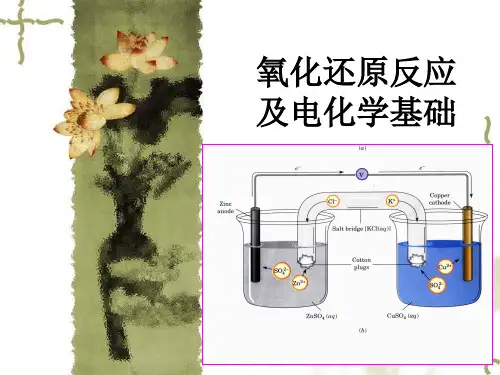
二、电化学电池的构成电化学电池由两个电极(阳极和阴极)以及连接电极的导体和电解质组成。
其中,阳极是氧化反应的发生地,而阴极是还原反应的发生地。
导体则负责电子在电池中的传递,而电解质则负责离子在电池中的传递。
三、电化学电池的工作原理电化学电池的工作过程涉及氧化还原反应。
当外部电源连接到电池时,电流开始在电解质中流动。
在阳极,氧化反应发生,导致电子从阳极流出。
在阴极,还原反应发生,电子流入阴极。
这种电流生成的动力来源于化学反应,而不是外部电源本身。
四、电化学电池的应用电化学电池在现代社会中有着广泛的应用。
以下是几个常见的应用领域:1. 蓄电池:蓄电池是一种可反复充电和放电的电池,常用于车辆启动、应急备用电源等场合。
2. 燃料电池:燃料电池利用化学能源直接转化为电能,常用于汽车、船舶等领域,具有高效率和低污染的特点。
3. 电解水制氢:电化学电池可以通过电解水来产生氢气和氧气。
这种方法是可再生能源的重要途径之一。
4. 金属电镀:电化学电池可以用于金属电镀,通过电流使金属离子在物体表面还原成金属沉积。
五、总结氧化还原反应是电化学电池运作的基础原理。
电化学电池在能源领域、材料科学、环境保护等方面有着重要的应用。
通过深入理解氧化还原反应的原理,我们可以更好地理解和应用电化学电池技术,进一步推动相关领域的发展。



氧化还原反应与电化学氧化还原反应是化学中最基本的反应类型之一,其与电化学的关系密不可分。
本文将探讨氧化还原反应与电化学之间的联系,并介绍其在实际应用中的意义。
一、氧化还原反应的基本概念氧化还原反应是指物质中电子的转移过程,其中一种物质被氧化(失去电子),另一种物质被还原(获得电子)。
在氧化还原反应中,氧化剂接受电子而被还原,还原剂失去电子而被氧化。
二、氧化还原反应的判别方法为了判断一个反应是否为氧化还原反应,我们可以根据以下几点进行分析:1. 电荷变化:氧化反应中,氧化剂的电荷减少,还原剂的电荷增加。
2. 氧化态的改变:化学物质的氧化态改变可以作为氧化还原反应的标志。
三、电化学的基本概念电化学是研究电与化学反应之间相互转化的科学,主要包括电解和电池两个方面。
1. 电解:将电能转化为化学能的过程称为电解。
电解涉及到正负电极、电解质和电解液等因素。
2. 电池:将化学能转化为电能的装置称为电池。
电池由两个半电池组成,每个半电池都包含一个电解质和一个电极。
四、氧化还原反应与电化学的联系氧化还原反应与电化学密切相关,电子的转移正是氧化还原反应中的核心过程。
氧化剂与还原剂之间的电子转移导致了电流的流动。
1. 电解过程中的氧化还原反应:在电解中,当外加电压大于一定值时,电解液中的化学物质发生氧化还原反应,从而实现电流的通过。
2. 电池中的氧化还原反应:在电池中,化学反应导致了电子的转移和电势的变化。
正极发生氧化反应,负极发生还原反应,电子在电解质中流动,产生了电势差。
五、氧化还原反应与电化学的应用氧化还原反应与电化学在各个领域中都有重要的应用,下面简要介绍其中几个方面:1. 电解产生金属:通过电解可以将金属离子还原为金属,实现金属的提取和纯化。
2. 电池的应用:电池作为一种便携式的能源装置,广泛应用于生活中的电子产品、交通工具和能源储备等方面。
3. 化学分析:电化学分析技术可以用于测定物质的含量、离子浓度和pH值等参数,具有快速、准确、灵敏的特点。



第九章氧化还原反应与电化学基础【竞赛要求】氧化态。
氧化还原的基本概念和反应的书写与配平。
原电池。
电极符号、电极反应、原电池符号、原电池反应。
标准电极电势。
用标准电极电势判断反应的方向及氧化剂与还原剂的强弱。
电解池的电极符号与电极反应。
电解与电镀。
电化学腐蚀。
常见化学电源。
Nernst方程及有关计算。
原电池电动势的计算。
pH对原电池的电动势、电极电势、氧化还原反应方向的影响。
沉淀剂、络合剂对氧化还原反应方向的影响。
【知识梳理】一、氧化还原反应的基本概念1、氧化数在氧化还原反应中,由于发生了电子转移,导致某些元素带电状态发生变化。
为了描述元素原子带电状态的不同,人们提出了氧化数的概念。
1970年,国际纯粹与应用化学联合会(IUPAC)对氧化数的定义是:氧化数是某元素一个原子的荷电数,这个荷电数是假设把每个化学键的电子指定给电负性更大的原子而求得的。
例如,在NaCl中,钠的氧化数为+1,氯的氧化数为–1。
在SO2中,硫的氧化数为+4,氧的氧化数为–2。
由此可见,氧化数是元素在化合状态时人为规定的形式电荷数。
确定氧化数的规则:(1)在单质中,元素的氧化数为零。
(2)在单原子离子中,元素的氧化数等于离子所带的电荷数。
(3)在大多数化合物中,氢的氧化数为+1,只有在活泼金属的氢化物(如NaH,CaH2)中,氢的氧化数为–1。
(4)通常,在化合物中氧的氧化数为–2;但在过氧化物(如H2O2、Na2O2、BaO2)中氧的氧化数为–1;而在OF2和O2F2中,氧的氧化数分别为+2和+1。
(5)在所有氟化物中,氟的氧化数为–1。
(6)碱金属和碱土金属在化合物中的氧化数分别为+1和+2。
(7)在中性分子中,各元素氧化数的代数和为零。
在多原子原子离子中各元素氧化数的代数和等于离子所带的电荷数。
根据上述原则,可以确定化合物中某元素的氧化数。
2、氧化还原电对在氧化还原反应中,元素氧化数升高的物质是还原剂,元素氧化数降低的物质是氧化剂。

氧化还原反应与电化学氧化还原反应(简称氧化反应或还原反应)是化学反应的一种重要类型,也是电化学研究的基础。
电化学研究了物质在电场和电流的作用下的性质和变化规律,将电能与化学变化联系起来。
本文将着重介绍氧化还原反应与电化学之间的关系,探讨电流与氧化还原反应的本质联系,以及电化学在实际应用中的重要性。
1. 氧化还原反应的基本概念和原理氧化还原反应是指物质中的原子、离子或分子失去电子的过程为氧化反应,而得到电子的过程称为还原反应。
在氧化还原反应中,存在着氧化剂和还原剂两个参与物质,氧化剂接受电子,还原剂失去电子。
这一过程可以用化学方程式表示,例如:2Na + Cl2 → 2NaCl。
在这个反应中,钠(Na)失去了电子,发生了氧化反应;氯气(Cl2)接受了钠的电子,发生了还原反应。
2. 电流与氧化还原反应的联系氧化还原反应离不开电流的存在。
电流是指电荷在单位时间内通过导体横截面的量,其方向由正电荷流动的方向确定。
在氧化还原反应中,氧化剂接受电子,必须有电子从还原剂中流向氧化剂,才能维持反应的进行。
这个电子的流动过程形成了电流。
因此,可以说氧化还原反应是电流流动的结果,电流的存在促使了氧化还原反应的进行。
3. 电化学的研究内容电化学研究了物质在电场和电流的作用下的性质和变化规律。
其研究内容主要包括三个方面:电解学、电池学和电化学分析。
(1)电解学:电解学研究了物质在电解过程中的行为和特性。
电解是指将电能转化为化学能的过程,通过电解可以将化合物分解成对应的离子,或将离子还原为相应的化合物。
例如,通过电解水可以将水分解为氢气和氧气。
(2)电池学:电池学研究了电化学电池的工作原理和特性。
电化学电池是指利用氧化还原反应转化化学能为电能的装置。
电池由正极、负极和电解质组成,正极发生氧化反应,负极发生还原反应,通过电路和外部载荷与电解质之间的电子流动将化学能转化为电能。
(3)电化学分析:电化学分析是利用氧化还原反应进行分析的一种方法。

氧化还原反应和电化学氧化还原反应(简称“氧化还原反应”)是化学反应中一种非常重要的类型。
在氧化还原反应中,物质的电荷状态发生变化,原子失去或获得电子,从而形成离子,以完成化学反应。
电化学则是研究电能与化学能之间转化的学科。
一、氧化还原反应1. 概念和基本原理氧化还原反应是指在化学反应中,原子、离子或分子中的电子的互相转移过程。
氧化是指物质失去电子,而还原则是指物质获得电子。
在氧化还原反应中,存在着氧化剂和还原剂的概念。
氧化剂接受电子,自身被还原,而还原剂则失去电子,自身被氧化。
2. 氧化还原反应的应用氧化还原反应广泛应用于生活和工业领域。
例如,在电池中,氧化还原反应产生电能;在腐蚀过程中,金属发生氧化还原反应,导致金属的破坏;在生物体内,呼吸作用中的氧化还原反应产生能量。
二、电化学1. 电化学基本概念电化学是研究电能与化学能之间相互转化的学科。
它涉及到电解、电极反应、电池和电解质溶液等概念。
电化学通常分为两个分支:电解学和电池学。
2. 电化学实验电化学实验是研究电化学现象的重要手段。
在实验中,常见的电化学装置包括电解槽、电极、电解质溶液等。
通过实验可以观察到电流的流动和电极上发生的反应,从而揭示电化学过程的本质。
三、氧化还原反应与电化学的联系氧化还原反应与电化学紧密相关。
在电池中,氧化还原反应产生电能,而在电解槽中,电能则用于促使氧化还原反应发生。
此外,电极反应是电化学研究的重点之一,它涉及到氧化还原反应中电子的转移过程。
结论氧化还原反应是化学反应中重要的类型,通过氧化和还原的相互转化,实现能量的转化。
电化学则是研究电能与化学能之间相互转化的学科,它与氧化还原反应密切相关。
两者的研究和应用对于能源、环保等领域具有重要意义。
通过深入理解氧化还原反应和电化学,我们可以更好地应用于实际生活和工业中,促进科学技术的发展和进步。
这篇文章介绍了氧化还原反应和电化学的基本概念、原理和应用,并强调了两者之间的联系。
氧化还原反应与电化学反应氧化还原反应(简称氧化反应或还原反应)和电化学反应是化学领域中重要的两个概念。
尽管它们在某些方面存在联系,但实际上是两个独立的概念,具有不同的定义和特点。
本文将探讨氧化还原反应和电化学反应的概念、区别以及在实际应用中的重要性。
一、氧化还原反应氧化还原反应是指化学反应中物质的氧化态和还原态之间的转变。
在氧化还原反应中,某一物质被氧化,即失去电子,同时另一物质被还原,即获得电子。
典型的氧化还原反应可以表示为以下形式:氧化剂 + 还原剂→ 氧化产物 + 还原产物其中,氧化剂是指能够接受电子的物质,而还原剂是指能够提供电子的物质。
氧化剂在反应中被还原,还原剂在反应中被氧化。
这种电子的转移过程是氧化还原反应的核心。
例如,常见的金属与酸反应产生金属盐和氢气的反应就是典型的氧化还原反应。
在这个反应中,金属被酸氧化失去电子,而酸则被金属还原获得电子。
这种反应过程不仅仅发生在化学实验室中,还存在于自然界的许多过程中,如腐蚀、燃烧等。
二、电化学反应电化学反应是指化学反应中涉及电子转移的反应。
与氧化还原反应类似,电化学反应也涉及物质的氧化态和还原态的转变。
然而,电化学反应更加注重反应过程中的电流和电势差。
电化学反应可以通过电解或电池(包括电解池和电池)进行。
在电解中,外加电势通过电解质中的离子传递,导致氧化还原反应发生。
在电池中,氧化还原反应会产生电流,从而进行能量转换和电化学合成。
电化学反应在许多实际应用中发挥着重要作用。
例如,电解法是一种常用的工业制备金属的方法。
充电电池则是一种广泛使用的能量储存设备。
在电化学反应中,电流和电势差是关键参数,影响反应速率和反应的方向。
三、氧化还原反应与电化学反应的区别尽管氧化还原反应和电化学反应都涉及到物质的氧化态和还原态的转变,但它们在定义、特点和应用方面存在着一些区别。
首先,氧化还原反应是一个广义的概念,而电化学反应则是其中的一种特殊情况。
氧化还原反应可以发生在气相、液相或固相中,而电化学反应通常发生在电解质溶液中。
氧化还原反应和电化学氧化还原反应是化学反应中常见的一种类型。
在这种反应中,物质失去或获得电子,导致氧化态和还原态之间的转变。
电化学是研究氧化还原反应的学科。
氧化还原反应氧化还原反应通过电子转移来传递能量。
在氧化反应中,物质失去电子,并增加氧化态。
在还原反应中,物质获得电子,并减少氧化态。
氧化还原反应通常涉及两个反应物,一个被氧化,一个被还原。
这种反应可以被描述为:氧化物 + 还原物→ 氧化物 + 还原物。
在这个过程中,电子在两个物质之间传递。
电化学电化学是研究氧化还原反应和相应的电荷转移过程的学科。
它的研究对象包括电解反应、电敏反应和电池等。
电解反应是通过外加电压来促使氧化还原反应发生的反应。
电敏反应是指利用电子转移来检测物质浓度或触发特定的化学反应。
电池是将化学能转化为电能的装置。
在电化学中,有两个重要的概念:电势和电流。
电势是指物质相对于某个参考电极的电压。
它是衡量物质氧化还原能力的指标。
电流是电荷经过单位时间的流动量,用安培(A)表示。
电化学还涉及到一些重要的概念,如电解质、阳极、阴极、溶液电导率等。
电解质是能够导电的物质,它在电解质溶液中会发生电离。
阳极是在电化学中发生氧化反应的电极,而阴极是发生还原反应的电极。
溶液电导率是指溶液中的离子导电能力。
总结氧化还原反应和电化学是相关的领域,它们研究了物质之间的电子转移和能量传递。
氧化还原反应通过电子转移来传递能量,而电化学则研究了这些反应及其应用。
在电化学中,电势和电流是重要的概念,同时还有其他涉及电解质、阳极、阴极等概念。
理解氧化还原反应和电化学对于深入理解化学领域的许多过程和应用具有重要意义。
氧化还原反应与电化学氧化还原反应是化学反应中十分重要的一类反应。
与之密切相关的是电化学,它研究的是电流与化学反应之间的关系。
本文将探讨氧化还原反应与电化学之间的联系以及其在实际应用中的重要性。
一、氧化还原反应的基本概念氧化还原反应是指物质失去电子的过程称为氧化,物质获得电子的过程称为还原。
氧化还原反应是通过电子的转移来达到化学变化的。
在氧化还原反应中,被氧化的物质被称为还原剂,因为它促使其他物质被氧化;而被还原的物质被称为氧化剂,因为它促使其他物质被还原。
氧化还原反应中,电子的转移通常会伴随着原子的转移,使得反应物在电荷上发生变化。
二、电化学基础知识电化学是研究电荷与化学反应之间相互转化关系的学科。
其中最重要的概念是电解质溶液和电解池。
电解质溶液是指在溶液中存在自由离子的物质,能够导电。
电解质溶液中,正负离子在电场作用下会迁移,形成电流。
而电解池是由两个电极和其中的电解质溶液构成的系统。
电极又分为阴极和阳极,阴极是在电解质溶液中的负极,而阳极则是正极。
电解质溶液中的离子在电极上发生氧化还原反应,产生电流。
三、氧化还原反应与电化学之间的联系氧化还原反应与电化学密不可分。
在电化学中,氧化还原反应是产生电流的基础。
电化学反应中,阴极上发生还原反应,而阳极上发生氧化反应。
阴极接受来自阳极的电子,使得阴极上的物质还原;而阳极失去电子,使得阳极上的物质氧化。
四、氧化还原反应在实际应用中的重要性氧化还原反应在实际应用中有着广泛的应用。
以下是一些例子:1. 电池:电池是将化学能转化为电能的装置。
其中的电化学反应是氧化还原反应的典型例子。
在电池中,化学反应将化学能转化为电能,提供给我们的日常生活所需。
2. 腐蚀:金属的腐蚀也是一种氧化还原反应。
金属与氧气或其他化合物反应,使金属表面形成氧化物,从而损坏金属的性能。
腐蚀的控制和防治是保护金属材料的重要方法。
3. 电解制氢:电解水是将水分解为氢气和氧气的过程。
在电解水过程中,水发生氧化还原反应,电流通过水分子,将水分解为氧气和氢气。