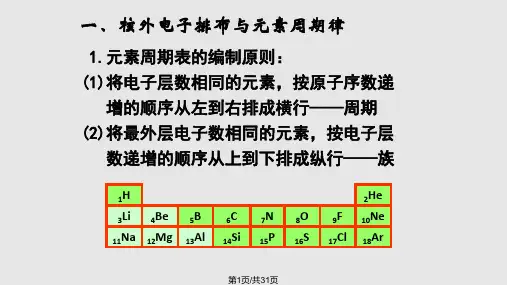
解析:同一周期的元素,非金属性越强,其最高价氧化物对应 水化物的酸性越强。电子层数相同的三种元素X、Y、Z,它 们的最高价氧化物对应水化物的酸性由强到弱的顺序为
HXO4>H2YO4>H3ZO4,则元素的非金属性:X>Y>Z,元素的原 子序数:X>Y>Z。同周期主族元素,原子序数越大,元素的原 子半径越小,所以原子半径:X<Y<Z,A项错误。元素的非金属 性越强,其对应简单气态氢化物的热稳定性越强,由于元素的 非金属性:X>Y>Z,所以简单气态氢化物的热稳定 性:X>Y>Z,B项正确。
第1课时 元素性质的周期性变化规律
素养·目标定位 课前·基础认知 课堂·重难突破
随堂训练
素养•目标定位
目标素养
1.结合有关数据和实验事实认识原子核外电子排布、元素最 高化合价和最低化合价、原子半径等随元素原子序数递增而 呈周期性变化的规律。 2.以第三周期元素为例,认识同周期元素的金属性、非金属性 等随元素原子序数递增而呈周期性变化的规律,构建元素周 期律。
(4)非金属元素的单质与盐在水溶液中进行置换反应,若A置 换出B,并且A体现出氧化性,则A的非金属性强于B。
(5)非金属阴离子的还原性越强,则其单质的氧化性越弱,元 素的非金属性越弱。
(1)试根据同周期主族元素非金属性的变化规律,比较SiH4、 PH3、H2S和HCl的热稳定性。
(2)请从原子结构变化的角度解释,同周期主族元素随着原
②向AlCl3溶液中逐滴加入NaOH溶液至过量,现象: 先产 生白色沉淀,后白色沉淀溶解 ,反应的化学方程式:
AlCl3+3NaOH══3NaCl+Al(OH)3↓ , NaOH+Al(OH)3══Na[Al(OH)4] 。