原料药数据库
- 格式:xls
- 大小:83.00 KB
- 文档页数:49

化工人员必备数据库大全化工行业是一个复杂的领域,涵盖了广泛的工艺过程和原材料类型。
为了更好地管理和操作化工过程,化工人员需要使用各种数据库。
下面是化工人员必备的数据库大全,帮助他们更高效地开展工作。
1. 化学品数据库:化学品数据库包含了各种化学品的基本信息,如化学结构、分子量、物理性质和安全数据等。
这些信息对于化工人员来说至关重要,可以帮助他们了解化学品的特性和用途,选择合适的化学品进行实验或生产。
常见的化学品数据库包括ChemSpider和PubChem。
2. 反应数据库:反应数据库记录了各种化学反应的条件和结果,包括反应物、产物、反应温度和反应时间等。
通过反应数据库,化工人员可以快速查找和比较不同反应条件下的反应结果,以找到最佳的反应条件和工艺参数。
常见的反应数据库包括Reaxys和Scifinder。
3. 原料数据库:原料数据库包含了各种化工原料的供应商、价格和质量信息。
化工人员可以通过原料数据库查找合适的原料供应商和物料清单,评估供应风险和成本,并选择最优的原料供应链。
常见的原料数据库包括ICIS和ChemCost。
4. 工艺数据库:工艺数据库记录了不同化工工艺的详细步骤和参数,包括反应条件、设备要求和产品质量等。
化工人员可以根据工艺数据库设计和优化工艺流程,确保生产过程的稳定性和可靠性。
常见的工艺数据库包括Knovel和E-WorkBook。
5. 安全数据库:安全数据库包含了化学品的危险性评估和安全操作指南,帮助化工人员了解和管理化学品的风险,采取必要的安全措施。
安全数据库还提供了应急响应和事故预防的信息,保障化工生产的安全性和可持续发展。
常见的安全数据库包括EHS Insight和Chemwatch。
6. 质量数据库:质量数据库记录了化工产品的质量标准和检测方法,帮助化工人员评估产品质量,并进行质量控制和质量改进。
质量数据库还提供了质量管理的最佳实践和经验教训,帮助化工人员提高产品质量和客户满意度。

原料药、药用辅料及药包材与药品制剂共同审评审批管理办法(征求意见稿)第一章总则第一条为建立以药品上市许可持有人为责任主体的药品质量管理体系,提高药品注册质量和效率,保证药品的安全性、有效性和质量可控性,根据中共中央办公厅、国务院办公厅印发的《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔2017〕42号),制定本办法。
第二条国家建立以药品制剂(以下简称制剂)质量为核心,原料药、药用辅料及药包材(以下简称原辅包)为质量基础,原辅包与制剂共同审评审批的管理制度,对原辅包不单独进行审评审批。
第三条国家食品药品监督管理总局(以下简称总局)实施原辅包技术主卷档案管理制度,建立“原辅包登记平台”,对原辅包分别建立“原料药数据库”“药用辅料数据库”“药包材数据库”,并公示原辅包的相关信息。
原辅包企业可单独提交原辅包登记资料。
第二章责任与义务第四条药品上市许可持有人承担制剂质量的主体责任,建1立以制剂为核心,原辅包为基础的质量管理体系。
第五条药品上市许可持有人应当围绕制剂的质量要求选择合适的原辅包,对所选用的原辅包质量负责,与原辅包企业建立授权使用和监督的质量保障制度。
第六条药品上市许可持有人建立的质量管理体系应当能涵盖制剂全生命周期的质量管理,对制剂所用的原辅包质量应能追溯,并明晰原辅包来源、批次、生产、质控和变更情况。
第七条原辅包企业对所生产的产品质量负责,应当与药品上市许可持有人建立供应链质量管理制度,根据协议持续稳定地供应符合制剂质量的原辅包产品,提交必要信息供药品上市许可持有人评估和控制由原辅包引入制剂的质量风险,并接受药品上市许可持有人开展的供应商审计。
第八条原辅包企业在完成登记资料登记之日起,每十二个月应当向总局提供一份年度报告;年度报告应当列明本年度的所有变更及摘要,并说明该年度所有新发生的授权药品上市许可持有人使用的情况。
第九条原辅包企业应当将产品变更信息提前告知药品上市许可持有人,并及时登记变更后的原辅包登记资料。
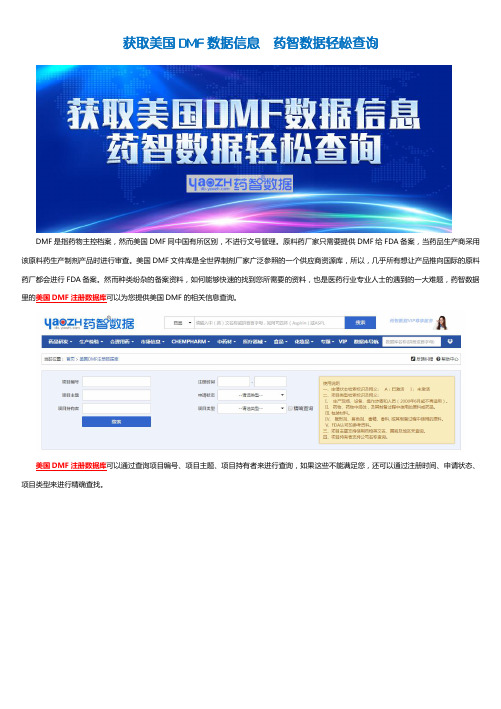
获取美国DMF数据信息药智数据轻松查询
DMF是指药物主控档案,然而美国DMF同中国有所区别,不进行文号管理。
原料药厂家只需要提供DMF给FDA备案,当药品生产商采用该原料药生产制剂产品时进行审查。
美国DMF文件库是全世界制剂厂家广泛参照的一个供应商资源库,所以,几乎所有想让产品推向国际的原料药厂都会进行FDA备案。
然而种类纷杂的备案资料,如何能够快速的找到您所需要的资料,也是医药行业专业人士的遇到的一大难题,药智数据里的美国DMF注册数据库可以为您提供美国DMF的相关信息查询。
美国DMF注册数据库可以通过查询项目编号、项目主题、项目持有者来进行查询,如果这些不能满足您,还可以通过注册时间、申请状态、项目类型来进行精确查找。
美国DMF注册数据库共有超过20000多条相关数据信息,内容权威,收录了自2005年来的FDA备案专用数据,是美国DMF数据信息查询的最佳网络数据库查询渠道。
同时,美国DMF注册数据库不仅可以查询相关的美国DMF数据信息,在药智岛里,我们还能为您提供技术服务翻译制作DMF的英文文件、医药包材DMF服务、特色化合物的提供、药品转让,药品注册信息查询等等,方便快捷,服务领先。
药智岛作为领跑全国的医药行业B2B产业要素商机平台,汇集国内外优质医药原料药、特色化合物、技术服务的资源高地,想获取更多美国DMF的相关信息,可以上药智岛,药智岛为您提供求购、供应信息展示,医药商机轻松掌握。


我国现已注册的医药生产企业7100多家,通过GMP认证的有4000多家,在国家食品药品监督管理局注册的原料药生产企业1600多家,获得GMP认证的原料药有3700多个。
近年来,我国制药业迅速发展,作为原料药和医药中间体全球最大的供应商,中国已经树立了其牢固的国际地位。
2010年我国医药工业总产值将达12560亿元人民币,同比增长33%以上。
从生产方面来看,我国可生产1500多种化学原料药,产能达200多万吨,约占全球产量的1/5以上。
近年来,原料药行业一直维持了稳步的增长速度,产量年均增速在10%以上,已经成为我国医药工业的支柱。
企业名称浙江华纳药业有限公司
生产单位浙江华纳药业有限公司
相关数据库查询药品广告
中药保护品种库
生产单位浙江华纳药业有限公司
相关数据库查询药品广告
中药保护品种库
相关数据库查询中药保护品种库GMP认证
国产药品
药品广告。

附件原料药、药用辅料及药包材与药品制剂共同审评审批管理办法(征求意见稿)第一章总则第一条为建立以药品上市许可持有人为责任主体的药品质量管理体系,提高药品注册质量和效率,保证药品的安全性、有效性和质量可控性,根据中共中央办公厅、国务院办公厅印发的《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔2017〕42号),制定本办法。
第二条国家建立以药品制剂(以下简称制剂)质量为核心,原料药、药用辅料及药包材(以下简称原辅包)为质量基础,原辅包与制剂共同审评审批的管理制度,对原辅包不单独进行审评审批。
第三条国家食品药品监督管理总局(以下简称总局)实施原辅包技术主卷档案管理制度,建立“原辅包登记平台”,对原辅包分别建立“原料药数据库”“药用辅料数据库”“药包材数据库”,并公示原辅包的相关信息。
原辅包企业可单独提交原辅包登记资料。
第二章责任与义务第四条药品上市许可持有人承担制剂质量的主体责任,建立以制剂为核心,原辅包为基础的质量管理体系。
第五条药品上市许可持有人应当围绕制剂的质量要求选择合适的原辅包,对所选用的原辅包质量负责,与原辅包企业建立授权使用和监督的质量保障制度。
第六条药品上市许可持有人建立的质量管理体系应当能涵盖制剂全生命周期的质量管理,对制剂所用的原辅包质量应能追溯,并明晰原辅包来源、批次、生产、质控和变更情况。
第七条原辅包企业对所生产的产品质量负责,应当与药品上市许可持有人建立供应链质量管理制度,根据协议持续稳定地供应符合制剂质量的原辅包产品,提交必要信息供药品上市许可持有人评估和控制由原辅包引入制剂的质量风险,并接受药品上市许可持有人开展的供应商审计。
第八条原辅包企业在完成登记资料登记之日起,每十二个月应当向总局提供一份年度报告;年度报告应当列明本年度的所有变更及摘要,并说明该年度所有新发生的授权药品上市许可持有人使用的情况。
第九条原辅包企业应当将产品变更信息提前告知药品上市许可持有人,并及时登记变更后的原辅包登记资料。
Pharmaprojects数据库简介及检索方法一、数据库简介Pharmaprojects是国际药物研制开发的商业智能资源,它监控着国际上处于开发过程中的每一个重要新药,跟踪着国际上处于研究发展活跃阶段的候选药物,提供给用户产品开发的全面资料。
Pharmaprojects数据库包括超过26000个开发中的药物,并且每月都有1000多个药物的更新信息。
Pharmaprojects中的每个药物都包含以下信息:1.主要信息:包括药物名称、开发阶段、各国上市情况。
2.该药物开发公司的情况:包括原始开发公司、国家、开发状况、上市国家。
3.药理数据:包括药效分类及代号、药物用于该适应证的开发状况、药理作用描述、适应证描述、给药途径等。
4.化学数据:包括化合物代号、CA注册号、分子量、分子式、化学名、结构式。
5.专利情况:包括专利国家、专利号码、专利优先号、优先日期等。
6.各国上市情况:包括上市国家、上市情况、上市时间、批准情况等。
7.主要事件:记录了该药物开发过程中的重大事件。
8.开发进度:记录了药物开发的进度、市场估测。
9.细节信息:详细记录了该药物的市场和临床前以及临床情况。
除了药物信息之外,Pharmaprojects还提供了世界上1100余家主要制药企业和197个治疗领域药品的相关文件,通过组合查询,可以轻松获得所需的开发信息。
总之,Pharmaprojects是跟踪国际上的新药开发动态、寻找新药报批机会及市场合作开发伙伴和分析市场收益的最佳利器!二、检索方法1.打开主界面选中“Pharmaprojects”,双击鼠标左键,出现如下界面:点击“accept”进入检索主界面(如下图),左栏是主要的检索途径;中间栏为“Tree Search”(目录树检索);右栏是检索框。
2.目录树检索在目录树检索中包括9种路径:(1)Main Details (4) Chemical Data (7) Ratings(2)Company/Status (5) Patent Data (8) Major Events(3)Activity Data (6) Country Data (9) Alert Servic点击各路径前(+)可以看见每个途径又分为许多分支途径,如点击“Main Details”可见其包括:Drug NameDrug Name IncludesActive,Ceased,Fully LaunchedAccession NumberDetailed Information每一个子标题都可以作为一个检索途径。
收藏的国内药学数据库查询网站
网站目录
一.非官方网站
1. 中国药典在线()特点:可查到药典标准
2. 丁香园药学系列数据库() 特点:可非常方便查到药品注册信息,药品说明书
3. 大众医药网(/index300
4.php)特点:药品说明书
4. 开时医药(/ )特点:系统中收录有约2万种药物,6000种商品名称,5000家药品生产企业、6000家药品批发企业
5. 药智网(), 特点:数据库方便,可查到国内多数药品质量标准全文,以及标准红外光谱图,药品说明书,新药批准信息等,
6. 中国医药网:(/)特点:数据库丰富,但更新不及时
二、国内官方网站:
1.国家药监局网站(),特点:最权威、最丰富的药品数据库,但不方便查找。
2.国家药品审评中心()特点:最权威、最及时的药品受理、注册、批准信息查询。
3.国家中药品种保护审评委员会() 特点:查询中药保护品种的权威网站
4. 中国医药经济信息网(/ )特点:在线提供各种专业数据库的查询;但实行会员制,会费2000元/年。
新药研发必看数据库随着科技的不断发展,新药研发已成为医药领域的焦点之一。
但是,要想成功研发新药,需要投入大量的时间和金钱,因此寻找有效的研发平台和资源已经成为各大药企和研发机构所需要面对的一个重要问题。
要想更好地把握新药研发的机遇,最好的方法就是利用最新的,最全面的数据库资源。
下面,我们来介绍一些新药研发必看的数据库。
1. PubMedPubMed 是美国国家医学图书馆开发的免费数据库,收集了来自全球各地的150多个国家的超过3000万篇杂志文章和书籍资料。
该数据库覆盖了临床医学、药学、生物医学等领域的文献资料,不仅包括了人类临床试验数据,也包括了动物模型和福利调查等各种前期动物研究的数据。
另外,PubMed 已与许多数据库和搜索工具整合,提供了更方便的搜索和浏览功能。
2. 是由美国国立卫生研究院开发的临床试验数据库,它是全球最大的公共临床试验数据库之一,并且每天都在不断更新。
该数据库覆盖了美国和全球范围内的各种药物和医学研究,包括新药研发、药物作用机制研究等。
研究者可以在该数据库中搜索到他们感兴趣的临床试验资料,该数据库还提供了研究数据的可视化和下载功能,帮助研究者更好地了解相关临床试验信息。
3. ChemIDplusChemIDplus 是美国国立医学图书馆开发的化学物质数据库,收录了近400万种化学物质的信息。
该数据库提供了各种物质的化学性质、毒性等信息,并支持用户进行不同化学物质之间的比较和查询。
这个数据库对于药物研发来说非常重要,因为研发人员常常需要从大量的化学物质当中筛选出具有潜在生物活性的新化合物,这就需要对化学物质进行准确的分析和比较。
4. ChEMBLChEMBL 是欧洲生物信息研究所开发的药物化学数据库,收集了来自各种文献和专利资料的药物化学信息。
该数据库不仅涵盖了合成化合物的描述,还包括药物作用的分子生物学、临床试验、结构、活性测定和药物代谢动力学等各种信息。
用户可以搜索有关已知药物作用和已知目标蛋白之间的关系等各种实验信息。