YL-20480诃子原料检验操作规程
- 格式:docx
- 大小:36.92 KB
- 文档页数:3
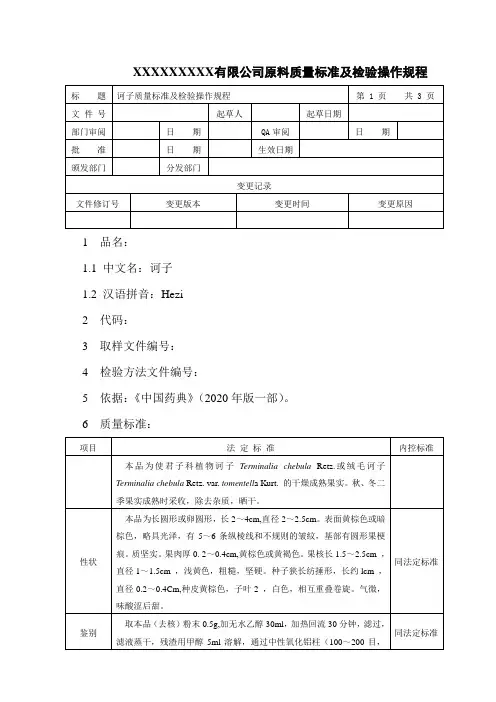
XXXXXXXXX有限公司原料质量标准及检验操作规程1 品名:1.1 中文名:诃子1.2 汉语拼音:Hezi2 代码:3 取样文件编号:4 检验方法文件编号:5 依据:《中国药典》(2020年版一部)。
6 质量标准:7 检验操作规程:7.1 试药与试剂:乙醇、甲醇、诃子对照药材、甲苯、冰醋酸、水、硫酸乙醇溶液。
7.2 仪器与用具:电子天平、水浴锅、紫外光灯、烘箱、硅胶G板、马福炉、中性氧化铝柱、C18固相固相萃取小柱、二氧化硫测定仪。
7.3 性状:取本品适量,自然光下目测色泽,嗅闻气味。
7.4 鉴别:取本品(去核)粉末0. 5g,加无水乙醇30ml,加热回流30分钟,滤过,滤液蒸干,残渣用甲醇5ml溶解,通过中性氧化铝柱(100~200目,5g ,内径为2cm),用稀乙醇50ml洗脱,收集洗脱液,蒸干,残渣用水5ml溶解后通过C18(300mg)固相固相萃取小柱,用30%甲醇10ml洗脱,弃去30%甲醇液,再用甲醇10ml洗脱,收集洗脱液,蒸干.残渣加甲醇lml使溶解,作为供试品溶液。
另取子对照药材(去核)0.5g,同法制成对照药材溶液。
照薄层色谱法(附录7)试验,吸取上述两种溶液各4µl,分别点于同一珪胶G薄层板上,以甲苯-冰醋酸-水(12:10:0.4)为展开剂,展开,取出,晾干,喷以10%硫酸乙醇溶液,在105℃加热至斑点显色清晰,置紫外光灯(365nm)下检视。
供试品色谱中,在与对照药材色谱相应的'位置上,显相同颜色的荧光斑点。
7.5 检查:7.5.1水分不得过13.0%(附录15 第二法)。
7.5.2总灰分不得过5.0%(附录17) 。
7.5.3二氧化硫残留量照二氧化硫残留量测定法(附录58)测定,不得过150mg/kg。
7.6 浸出物:照水溶性浸出物测定法(附录19)项下的冷浸法测定,不得少于30.0%。

HPLC法同时测定诃子和毛诃子中没食子酸及鞣花酸的含量Δ发表时间:2018-09-04T15:22:52.073Z 来源:《中国医学人文》(学术版)2018年4月上第7期作者:德吉多杰仁青白玛罗布索郎平措[导读] 采用高效液相色谱法测定诃子和毛诃子中没食子酸及鞣花酸的含量。
德吉多杰仁青白玛罗布索郎平措西藏藏医学院附属医院西藏拉萨 850000【摘要】目的:采用高效液相色谱法测定诃子和毛诃子中没食子酸及鞣花酸的含量。
方法:采用Inertsustain C18-5µm(4.6 × 250 mm)色谱柱,以甲醇-0.2%磷酸溶液为流动相梯度洗脱,流速1.0 mL/min,柱温30℃,检测波长273 nm。
结果:没食子酸和鞣花酸分别在各自进样量范围内与峰面积呈良好线性关系,相关系数均在0.9993以上;各成分的平均回收率均在99.92~100.29%(n = 6),RSD均小于0.67%。
结论:该方法快速、准确、简便,可用诃子和毛诃子中没食子酸及鞣花酸的含量测定。
【关键词】高效液相色谱法;诃子和毛诃子;没食子酸;鞣花酸;含量测定诃子和毛诃子均收载于《中华人民共和国药典》2015年版一部,其中诃子的基原植物为使君子科植物诃子Terminalia chebula Retz.和绒毛诃子Terminalia chebula Retz. var. tomentella Kurt.的干燥成熟果实,而毛诃子的基原植物为使君子科植物毗黎勒Terminalia bellirica (Gaertn.)Roxb.的干燥成熟果实,为藏、蒙医常用药,但均无相关的含量测定项[1-3]。
现代化学成分研究表明,诃子和毛诃子中主要含有鞣质类、酚酸类、脂肪酸类等多种结构类型[4,5]。
本文旨在建立HPLC法同时测定诃子和毛诃子中没食子酸及鞣花酸的含量,为建立诃子和毛诃子药材的质量标准提供一定的科学依据。
1 仪器与材料1.1 仪器:岛津LC-20AT高效液相色谱仪,SIL-20A自动进样器,SPA-20A检测器,CTO-20AC柱温箱(SHIMADAZU公司,日本);mettler toledo分析天平(梅特勒-托利多仪器上海有限公司),ohaus分析天平(奥豪斯,美国)。

制剂检验操作规程制剂检验操作规程一、目的和适用范围1.1 目的为确保制药过程中制剂的质量和安全性,规范制剂的检验操作,保证制剂的质量符合相关法规和标准要求。
1.2 适用范围本操作规程适用于所有制剂的检验操作,包括固体制剂、液体制剂、半固体制剂等。
二、检验设备和材料准备2.1 检验设备根据不同的制剂类型,准备相应的检验设备,例如电子天平、显微镜、紫外可见分光光度计、高效液相色谱仪等。
2.2 材料准备准备所需的标准品、溶剂、试剂和耗材等。
三、检验操作流程3.1 样品准备3.1.1 从生产批次中取得代表性样品,按照规定的方法进行样品的制备和处理。
3.1.2 根据需要,对样品进行稀释或浓缩处理,以满足检验要求。
3.2 检验项目选择根据药典或内部标准,确定所需检验的项目和方法。
3.3 检验仪器和设备的校准3.3.1 在每次使用前,对检验仪器和设备进行校准,确保其准确性和可靠性。
3.3.2 根据校准结果,对仪器和设备进行相应的调整和修正。
3.4 检验操作步骤3.4.1 操作前的准备:①清洁工作台和检验设备,确保无污染。
②准备所需试剂和标准品,确保其纯度和有效性。
3.4.2 检验操作:①按照方法要求,将样品放置在试剂或溶剂中进行溶解。
②根据检验项目的要求,进行样品的稀释或浓缩处理。
③依次进行各项检验操作,如pH值测定、溶解度测试、含量测定等。
④记录检验结果和观察的现象,如颜色、气味等。
⑤检查结果是否符合药典或内部标准的要求,如不符合要求,进行重新检验或调整仪器和方法。
3.5 数据处理和结果判定3.5.1 按照所设定的标准,对检验结果进行数据处理和计算。
3.5.2 比对检验结果和标准要求,判断制剂是否合格。
3.5.3 如结果不合格,根据不合格原因进行分析,并根据需要进行调整或重新制备样品。
3.6 结果报告3.6.1 对检验结果进行汇总,制作检验报告。
3.6.2 报告中应包括样品信息、检验项目、结果和评价等内容。


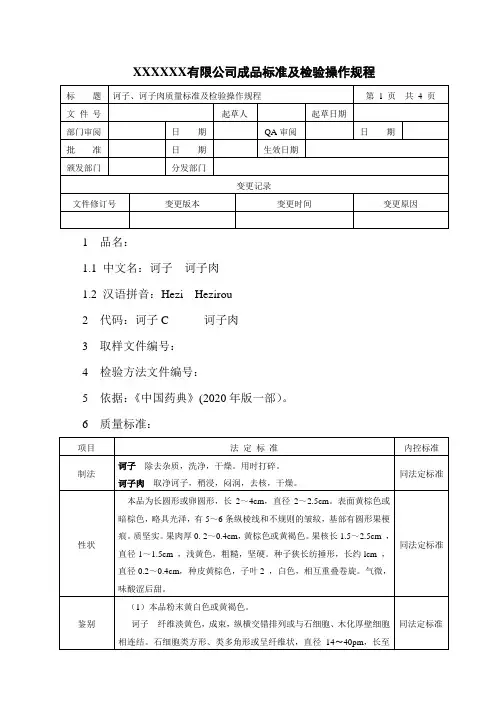
XXXXXX有限公司成品标准及检验操作规程1 品名:1.1 中文名:诃子诃子肉1.2 汉语拼音:Hezi Hezirou2 代码:诃子C 诃子肉3 取样文件编号:4 检验方法文件编号:5 依据:《中国药典》(2020年版一部)。
6 质量标准:7 检验操作规程:7.1 试药与试剂:乙醇、甲醇、诃子对照药材、甲苯、冰醋酸、水、硫酸乙醇溶液、氢氧化钠滴定液、甲基红乙醇溶液指示剂。
7.2 仪器与用具:电子天平、水浴锅、紫外光灯、烘箱、硅胶G板、马弗炉、中性氧化铝柱、C18固相固相萃取小柱、中药二氧化硫测定仪。
7.3 性状:取本品适量,自然光下目测色泽,嗅闻气味。
7.4 鉴别:7.4.1诃子纤维淡黄色,成束,纵横交错排列或与石细胞、木化厚壁细胞相连结。
石细胞类方形、类多角形或呈纤维状,直径14〜40pm,长至13um,壁厚,孔沟细密;胞腔内偶见草酸钙方晶和砂晶。
木化厚壁细胞淡黄色或无色,呈长方形、多角形或不规则形,有的一端膨大成靴状;细胞壁上纹孔密集;有的含草酸钙簇晶或砂晶。
草酸钙簇晶直径5〜40um,单个散在或成行排列于细胞中。
7.4.2取本品(去核)粉末0. 5g,加无水乙醇30ml,加热回流30分钟,滤过,滤液蒸干,残渣用甲醇5ml溶解,通过中性氧化铝柱(100~200目,5g ,内径为2cm),用稀乙醇50ml洗脱,收集洗脱液,蒸干,残渣用水5ml 溶解后通过C18(300mg)固相固相萃取小柱,用30%甲醇10ml洗脱,弃去30%甲醇液,再用甲醇10ml洗脱,收集洗脱液,蒸干.残渣加甲醇lml使溶解,作为供试品溶液。
另取子对照药材(去核)0.5g,同法制成对照药材溶液。
照薄层色谱法(附录7)试验,吸取上述两种溶液各4µl,分别点于同一珪胶G 薄层板上,以甲苯-冰醋酸-水(12:10:0.4)为展开剂,展开,取出,晾干,喷以10%硫酸乙醇溶液,在105°C加热至斑点显色清晰,置紫外光灯(365nm)下检视。



1.目的:为确保所取样样品具有代表性,规范取样程序,保证检验结果的准确性,特制定本规程。
2. 范围:适用于我司原辅料取样标准操作。
3. 职责:质量部取样人员(取样QA人员)对本程序实施负责。
4. 内容:4.1取样前准备工作4.1.1 取样前的确认抽取样品前应注意品名、产地、规格、等级及包件式样是否一致,检查包装的完整性、清洁程度以及有无水迹、霉变或其他物质污染等情况,并详细记录。
凡有异常情况的包件,应单独取样检验。
4.1.2 抽样件数计算QA收到请验单后,根据请验单上的内容,计算好抽样件数、取样量。
抽样一般原则为:4.1.2.1 化学原料药或辅料总件数n≤3时,每件取样;n为4~300时,取样数为n+1;n+1;n>300时,取样数为24.1.2.2 中药材总件数(n)不足5件或为贵重药材时,逐件取样;n为5~99时,随机抽5件取样;n为100~1000时,按n的5%取样;n>1000时,超出部分按1%比例取样。
4.2 取样量4.2.1 最终取样数量一般不得少于全部检验所需用量的3倍。
1/3供实验室分析用,1/3供复核用,1/3为留样备查用,若不须复核样品,作为留样品管理,保存至产品放行后2年;4.2.2需重点持续稳定性考察的原辅料,其取样量应包括完成考察期考察项目所需的数量。
4.2.3 无菌原辅料用于无菌项目检查的样品应单独取样盛装于具塞灭菌瓶中,除另有规定外,其检验数量为15g。
4.2.4 用于粉针分装的供注射用无菌原料药,还应用具塞灭菌瓶取样10瓶(每瓶数量不得少于分装制剂的最大规格量),用于可见异物和不溶性微粒检查,详细数量见下表:4.2.5 原料药中规定有检查热原、细菌内毒素、异常毒性等药理实验项目的,每个项目用具塞灭菌瓶取样约2g。
4.2.6 非无菌的冻干粉针剂和口服固体制剂原辅料,应单独取样做微生物限度检查,取样数量约为10g。
4.3 取样器具根据物料特征,准备好取样工具,取样器和辅助工具(手套、剪刀、纸、笔、取样证、样品盒等)。

枸橼酸检验操作规程1. 目的建立枸橼酸检验标准操作规程,使枸橼酸检验操作规范化。
2. 范围适用于枸橼酸的质量检验。
3. 术语或定义3.1 GMP:药品生产质量管理规范(Good Manufacturing Practice)的英文简称。
3.2 SMP:标准管理程序(Standard Management Procedure),用于指导工作的管理类文件。
3.3 SOP:标准操作程序(Standard Operating Procedure),用于指导如何完成一项工作的文件。
4. 职责质量控制部对本规程的实施负责。
5. 程序5.1 检验依据5.1.1 《中国药典》2020年版四部(702页)。
5.1.2 枸橼酸质量标准(质量标准编号:)。
5.1.3 《中国药典》2020年版四部。
1.【性状】本品无色的半透明结晶、白色颗粒或白色结晶性粉末;无臭,味极酸;在干燥空气中微有风化性;水溶液显酸性反应。
本品在水中极易溶解,在乙醇中易溶,在乙醚中略溶。
2.【鉴别】2.1鉴别⑴2.1.1仪器与用具红外分光光度计、压片机、玛瑙研钵2.1.2操作方法取本品,在105℃干燥2小时,取干燥后的供试品约1mg,置入玛瑙研钵研细,再取溴化钾粉(约200mg),在玛瑙研钵中充分研磨混匀,移置于直径13mm的压模中,使铺布均匀,加压至20MPa,约60秒取出。
将供试片置于仪器的样品光路中,进行光谱扫描,本品的红外光吸收图谱应与对照的图谱(光谱集263图)一致。
2.2鉴别⑵---枸橼酸盐鉴别反应2.2.1试药稀硫酸、高锰酸钾试液、硫酸汞试液、溴试液、吡啶、醋酐2.2.2操作方法①取供试品溶液2ml(约相当于枸橼酸10mg),加稀硫酸数滴,加热至沸,加高锰酸钾试液数滴,振摇,紫色即消失;溶液分成两份,一份中加硫酸汞试液1滴,另一份中逐滴加入溴试液,均生成白色沉淀②取供试品约5mg,加吡啶-醋酐(3∶1)约5ml,振摇,即生成黄色到红色或紫红色的溶液。

诃子提取物安全操作及保养规程概述诃子提取物是一种常用的中药材,具有多种药理作用,被广泛应用于医疗、保健等领域。
然而,诃子提取物的使用也同时存在一定的风险,需要进行正确的操作和保养,以确保其安全、有效、持久地使用。
本文将介绍诃子提取物的安全操作及保养规程,帮助使用者了解如何正确、安全地进行提取物的提取、保存、使用等操作。
本文仅供参考,使用者应按照相关法律法规和实际情况进行操作。
提取物的储存诃子提取物属于易于受潮、易于变质的物品,需要在正确的条件下保存,否则会影响其药效。
以下是提取物储存的注意事项:1.避免阳光直射:提取物应储存在避光、通风、干燥的地方,防止阳光直射。
2.避免高温:提取物应储存在室温下,避免高温、潮湿的环境,否则容易变质,影响其药效。
3.空气密封储存:为避免吸潮、氧化等现象,储存容器应为具有密封性的玻璃瓶、不锈钢盒等,同时应定期检查密封性。
4.避免交叉污染:提取物容易受污染,因此应避免与其他物品存放在一起,特别是有毒、有害物品。
5.标注存储信息:提取物储存后,应在存储容器上标注名称、日期等信息,以便日后使用。
提取物的操作正确的操作流程可以保证提取物的纯度和药效,避免污染和浪费。
下面介绍提取物的操作流程及相关注意事项:1.准备材料:手套、口罩、保护镜、称量仪器等。
2.量取提取物:按照所需量取提取物,使用称量仪器精确称取,不要超量。
3.操作环境准备:在操作前,将区域进行消毒、清洁,并将电风扇等污染源关闭。
4.操作流程:在戴好手套、口罩和保护镜的情况下,分别将提取物溶于适量水中,进行加热、过滤等操作。
注意过程中不要进食、吸烟等。
5.操作后清洁:操作结束后应将操作区域进行彻底清洁,同时清洗所用仪器。
提取物的保养为保证提取物的良好品质和长期使用,需要注意以下几点:1.定期检查:定期检查提取物的品质、药效等,如有异常应及时报修。
2.外观检查:检查提取物的外观,如有霉变、变质等现象应及时清理、更换。
远志原料检验标准操作规程文件编号:LT0xx00山西振东道地药材部门:质量管理部题目:远志原料检验标准操作规程第1 页共2 页起草人:日期:审核人:日期:批准人:日期:生效日期:颁发部门:分发部门:变更记载:修订号:修订日期:批准日期:变更原因及目的:标准依据:《中华人民共和国药典》xx 年版一部1 仪器设备显微镜.恒温干燥箱.恒重蒸发皿.万分之一天平.万分之一天平.高温炉.高效液相色谱仪.紫外灯2 试剂与试药三氯甲烷.甲醇.10%硫酸乙醇溶液.细叶远志皂苷(对照品) . 远志口山酮Ⅲ(对照品) .3,6 二芥子酰基蔗糖(对照品)3 取样3.1 按“药材取样法”的原则取样。
3.2 取样标记清楚.明白.以供检验。
4 检测4.1 性状本品呈圆柱形,略弯曲,长3~15cm。
直径 0.3~0.8cm。
表面灰黄色至灰棕色,有较密并深陷的横皱纹.纵皱纹及裂纹,老根的横皱纹较密更深陷,略呈结节状。
质硬而脆,易折断,断面皮部棕黄色,木部黄白色,皮部易与木部剥离。
气微,味苦.微辛,嚼之有刺喉感。
4.2 鉴别(1)本品横切面:木栓细胞10 余列。
栓内层为20 余列薄壁细胞,有切向裂隙。
韧皮部较宽广,常现径向裂隙。
形成层成环。
木质部发达,均木化,射线宽 l~3 列细胞。
薄壁细胞大多含脂肪油滴;有的含草酸钙簇晶和方晶。
(2)取本品粉末0.5g,加70%甲醇20ml,超声处理30 分钟,滤过,滤液蒸干,残渣加文件编号:LT0xx00部门:质量管理部题目:远志原料检验标准操作规程第2 页共2 页甲醇1ml 使溶解,作为供试品溶液。
另取远志口山酮Ⅲ对照品,加甲醇制成每1ml 含 0.5mg的溶液,作为对照品溶液。
照《薄层色谱法检验标准操作程序》(附录ⅥB)试验,吸取上述两种溶液各2μl,分别点于同一硅胶 G 薄层板上,以三氯甲烷-甲醇-水(7:3:1)的下层溶液为展开剂,展开,取出,晾干,置紫外光灯(365nm)下检视。
供试品色谱中,在与对照品色谱相应的位置上,显相同颜色的荧光斑点。
诃子肉工艺标准管理规程
4、诃子肉工艺流程图
标准管理规程
标准管理规程
标准管理规程
6、物料平衡的计算及其平衡限度
7、成品收率
成品收率=
×100%≥70.0%
8、产品质量监控点,项目及频次。
9、原辅料、包装材料消耗定额
9.1原辅料消耗定额(按300kg计算)
9.2包装材料消耗定额
9.2.1按300kg计算20kg/件、1kg/袋规格包装
9.2.2按300kg计算30kg/件、2kg/袋规格包装
10.设备一览表主要设备生产能力、型号
11.劳动组织与岗位定员
标准管理规程
标准管理规程
13.工艺卫生
执行的管理规程及清洁规程编号如下表:(具体内容参见各项目下规程)
14.动力消耗定额、综合利用与“三废”处理
14.1动力消耗定额:
14.2综合利用与三废处理:
14.2.1严格执行厂订制度及各种标准作规定,保证生产用料得以充分利用。
14.2.2加强管理,降低物料及水电汽的消耗,减少损失率。
14.2.3对本车间的废料,及时进行处理。
14.2.4对废品,按指定地点和要求进行清洁和回收。
15. 变更历史。
1.目的:建立枸橼酸鉴别检验标准操作程序,以保证检验结果的准确性。
2.范围:枸橼酸。
3.责任者:检测中心。
4.程序:4.1器具4.1.1 WGH-30/30A型双光束红外分光光度计4.1.2 DF-4A型压片机4.1.3 HW-3A型红外烘干箱4.1.4压片模具4.1.5玛瑙研钵4.2药品溴化钾(光谱纯)4.3操作步骤4.3.1试样的制备:4.3.1.1将适量枸橼酸及溴化钾置红外烘干箱内烘干至恒重。
4.3.1.2称取烘干后的试样0.5-2.0mg,再加入100-200mg磨细干燥的KBr粉末,在玛瑙研钵中研细,混合均匀后,将约100mg试样均匀地撒在模具的下压头上,手压并旋转上压头使试样均匀并铺平。
然后将压片模具放在压片机工作台中心,用手旋转压片机丝杠把压片模具固定好后,顺时针旋紧放油阀,摇动手柄直至压力达20MPa左右,保持压力1-2分钟,即可脱模制成一个一定直径及厚度的枸橼酸透明片,再用同样的制样方法制取个一定直径及厚度的溴化钾透明片。
4.3.2测试4.3.2.1软件的启动软件安装后,从“开始”菜单执行“程序”组中或桌面上的“WGH-30型双光束红外分光光度计”快捷方式启动控制处理系统。
4.3.2.2进入系统后,操作人单击鼠标或键盘上的任意键;等待五秒钟后,显示器上马上显示工作界面,同时弹出一个对话框,提示用户当前正在分别进行狭缝初始化、光栅初始化、滤光片初始化和校准。
所有工作结束后,波数位置在4000cm-1处。
4.2.2.1执行“校正”命令后,用鼠标点击“是”按钮后,系统将在当前位置自动重新测量零系数和百系数。
4.2.2.2将溴化钾片放在红外分光光度计里侧的透光孔,将枸橼酸透明片放在红外分光光度计外侧的透光孔。
4.2.2.3执行“单程”命令后,用鼠标点击“是”按钮后,等待扫描完毕,保存、打印。
4.3测得红外光吸收图谱应与对照的图谱(光谱集263图)一致。
4.4注意事项4.4.1试样的浓度和测试厚度应选择适当,以使光谱图中大多数吸收峰的透光度处于15-17%范围内。