肿瘤动物模型
- 格式:pptx
- 大小:1.58 MB
- 文档页数:30

肿瘤动物模型得建立可以:(1)评价抗肿瘤免疫治疗得疗效;(2)作为抗肿瘤药物筛选模型;(3)为肿瘤转移研究提供更好得研究平台;(4)为研发抗肿瘤转移性药物提供良好得实验工具。
实验方法:诱发性肿瘤动物模型实验方法原理:诱发性肿瘤动物模型就是指研究者用化学致癌剂、放射线、致癌病毒诱发动物得肿瘤等。
实验材料:肿瘤细胞小鼠试剂、试剂盒、无血清培养基质、3%中性甲醇石腊仪器、耗材、低温离心机、血球计数器、游标卡尺实验步骤一、肝癌1.二乙基亚硝胺(DEN)诱发大白鼠肝癌(1)取体重250 g左右得封闭群大白鼠,雌雄不拘;(2)按性别分笼饲养。
除给普通食物外,饲以致癌物,即用0、25%DEN水溶液灌胃,剂量为10 mg/kg,每周一次,其余5天用0、025%DEN水溶液放入水瓶中,任其自由饮用;(3)共约4个月可诱发成肝癌;(4)也可以单用0、005%掺入饮水中口吸服8个月诱发肝癌。
2.4-2甲基氨基氮苯(DBA)诱发大鼠肝癌(1)用含0、06%DBA得饲料喂养大鼠,饲料中维生素B2不应超过1、5~2 mg/kg;(2)4~6月就有大量得肝癌诱发成功。
3.2-乙酰氨基酸(2AAF)诱发小鼠、狗、猫、鸡、兔肝癌(1)给成年大鼠含0、03% 2AAF标准饲料;(2)每日每平均2~3 mg 2AAF(也可将2AAF混于油中灌喂),3~4月后有80~90%动物产生肝肿瘤。
4.二乙基亚硝胺诱发大鼠肝癌:(1)用剂量为每日0、3~14 mg/kg体重,混于饲料或饮水中给予;(2)6~9个月后255/300大鼠发生了肝癌。
5.亚胺基偶氮甲苯(OAAT)诱发小鼠肝癌(1)用1%OAAF苯溶液(约0、1 ml含1 mg)涂在动物得两肩胛间皮肤上,隔日一次,每次2~3滴,一般涂100次。
(2)实验后7~8周即而出现第一个肝肿瘤,7个月以上可诱发小鼠肝肿瘤约55%。
(3)或用2、5 mg OAAT溶于葵瓜子油中,给C3H小鼠皮下注射4次,每日间隔10天,也可诱发成肝癌。

乳腺癌动物模型构建乳腺癌是一种常见的恶性肿瘤,临床表现为乳房肿块、乳房异常分泌物、乳房皮肤红肿等症状。
为了更好地研究乳腺癌的发病机制和寻找新的治疗方法,科学家们通过构建乳腺癌动物模型来模拟乳腺癌的发展过程。
本文将介绍乳腺癌动物模型的构建方法和研究价值。
一、乳腺癌动物模型的构建1. 细胞系移植模型细胞系移植模型是构建乳腺癌动物模型的常用方法之一。
研究人员可以选择已知的乳腺癌细胞系,将其移植到小鼠的乳腺组织中,观察肿瘤的生长和转移情况。
这种模型可以模拟乳腺癌的肿瘤生长、浸润和转移过程,为进一步研究乳腺癌的发病机制提供了可靠的平台。
2. 基因工程小鼠模型基因工程小鼠模型是通过基因突变或基因操纵技术,使小鼠表达人类乳腺癌相关基因,从而模拟乳腺癌的发展过程。
这种模型可以精确控制乳腺癌发生的时间和位置,研究人员可以观察到乳腺癌的发展过程以及与基因突变相关的病理变化。
基因工程小鼠模型在研究乳腺癌的发病机制和筛选治疗靶点方面具有重要意义。
3. 化学诱导模型化学诱导模型是通过给小鼠注射化学物质,如致癌物质DMBA (7,12-二甲基苯[α]蒽)或NMU(N-甲基-N-亚硝基脲),诱导乳腺癌的发生。
这种模型可以模拟乳腺癌的致癌过程,研究人员可以观察到肿瘤的生长速度、转移能力以及对化疗药物的敏感性。
化学诱导模型的优势在于可以快速诱导肿瘤形成,是进行大规模筛选实验的理想模型。
二、乳腺癌动物模型的研究价值1. 研究乳腺癌的发病机制乳腺癌动物模型能够模拟乳腺癌的发展过程,帮助研究人员深入理解乳腺癌的发病机制。
通过观察肿瘤的生长、浸润和转移过程,研究人员可以揭示乳腺癌的发展规律,寻找新的治疗靶点。
2. 评估抗癌药物疗效乳腺癌动物模型是评估抗癌药物疗效的重要工具。
研究人员可以在动物模型中测试新的抗癌药物,观察肿瘤的生长速度、转移能力以及对药物的敏感性,从而评估药物的疗效。
3. 验证分子靶向治疗方法乳腺癌动物模型对于验证分子靶向治疗方法的有效性具有重要作用。

动物肿瘤模型的选择如上已述,不同种属、品系和类型的实验动物其肿瘤学方面的性状各不相同,肿瘤学研究工作应当熟悉实验动物科学的开发研究成果,对有关的资料有比较全面的了解,才能为自己的课题选到合适的实验动物肿瘤模型。
实验动物的肿瘤模型可以概括地区分为下面四类:(一)自发性肿瘤模型实验动物种群中不经有意识的人工实验处置而自然发生的一类肿瘤称之为自发性肿瘤。
自发性肿瘤发生的类型和发病率可随实验动物的种属、品系及类型的不同而各有差异。
肿瘤实验研究中,一般应当选用高发病率的实验动物肿瘤模型作为研究对象,否则就无法进行研究。
当然,低发病率的肿瘤模型也有一定用处,可以用它作为对照。
肿瘤实验研究中选用自发性肿瘤型为对象进行研究有一定优点:首先是自发性肿瘤通常比用实验方法诱发的肿瘤与人类所患的肿瘤更为相似,有利于将动物实验结果推用到人:其次是这一类肿瘤发生的条件比较自然,有可能通过细致观察和统计分析而发现原来没有发现的环境的或其它的致癌因素,可以着重观察遗传因素在肿瘤发生上的作用。
但应用自发性肿瘤模型也存在一些缺点:肿瘤的发生情况可能参差不齐,不可能在短时间内获得大量肿瘤学材料,观察时间可能较长,实验耗费较大。
某个近交品系动物在一定年龄内,可以发生一定比率的某种自发性肿瘤。
目前已培育了许多种小鼠自发肿瘤,从肿瘤发生学上看,这些自发瘤与人体肿瘤相似,进行肿瘤发病学和药物筛选等实验应属理想。
但由于不易同时获得大批病程相似的自发瘤动物,又因这种肿瘤生长较慢,实验周期相对较长,所以一般很少用于筛药。
近年有人应用AKR自发白血病小鼠进行化研究,该小鼠出生后一年半内有高于90%的发病率,曾作为研究人体白血病和淋巴瘤的模型,它对药物的治疗反应类似儿童急性淋巴性白血病。
由于病程较长,已用于综合化疗研究药物诱导缓解和维持缓解的最适治疗方案。
此肿瘤可用强的松和长春新碱诱导缓解,也可以环磷酰胺和甲基-CCNU诱导缓解,再用阿糖胞苷维持缓解,后者疗效最好。

动物模型:裸鼠PC-9细胞肿瘤模型一、嘉美实验裸鼠PC-9细胞肿瘤模型的构建方法采用腋窝皮下接种PC-9人肺癌细胞,建立PC-9人肺腺癌细胞裸鼠移植瘤模型并给与药物进行干预,观察药物对肿瘤的作用。
二、裸鼠PC-9细胞肿瘤模型的构建及后续实验操作1、25只BALB c裸鼠,适应性饲养一周后,调整制备好的PC-9人肺腺癌细胞单细胞悬液浓度,用1m 1l无菌注射器吸取细胞悬液,于每裸鼠右侧腋下皮下注射0.2mL细胞悬液(接种细丹包量约为1×x102/ml),细胞悬液接种于裸鼠的右侧腋下7-10d后,观察成瘤情况,肿瘤仁本积大于100m3后,选取肿瘤大小相近的小鼠按肿瘤体积随机分为4组:(1)对照组,5只;(2)高剂量组,7只:(3)中剂量组,7 )顺铂组,6只。
当天高剂量组、中剂量组、顺铂组开始给药其中,高剂量组连续21天每天灌胃给药,顺铂组每三天腹腔注射给药,齐量5m/e次。
每两天测量荷瘤裸鼠体重和冲瘤体积。
于第22天停止给药病禁食2h,第再次测量肿瘤体积,计算相对肿瘤体积(RTV),绘制肿瘤生长曲线,毛材当天称量最后一次体重和瘤重计算肿瘤指数完整剥离瘤块,其中一半瘤块组织于 10%福尔马林中固定,备用;另半肿瘤组织存放于液氮中冻存。
血样用109 mmol/L枸櫞酸钠19抗凝,分离血浆。
2、小鼠接种PC-9人肺腺癌细胞后 9天左右,可观察到裸鼠右侧腋下均现黄豆大小瘤块,于当天开始测量肿瘤体积并称重。
于接种第11天时,测量肿瘤生长指数和体重时发现,各组荷瘤裸鼠肿瘤体积均值达到100mm3,于当天开始分组给药在给药过程中发现,顺铂组荷瘤裸鼠的体重下阳夆明显,与对照组相比具有极显著性差异루(P<0.01)高剂量组荷瘤裸鼠的体重于d7、dI 3、d19天时有显著性差异(P~0.05),其他各组体重与对照组相比均无明显差异。
顺铂组肿瘤体积于d13、d17、dl9、d21 d23时与对照组相比明显减小,并有显著性差 :(P<0.05),在d15天时有极显著性差쿠(P<0.01)。


这几天仔细阅读了一篇今年7月CancerCell的文献,从里面学到了一个很有用的人类肺癌小鼠模型制作思路。
他们首先把人类的EGFR基因定点突变,改造后的基因插入到含有7个四环素调节的启动子和β-globin 的Poly(A)载体,然后制作转基因小鼠,通过PCR检测出他们的子代中含有目的基因的小鼠,这些小鼠再和另外一种已经做好的含有CCSP-rtTA的转基因小鼠杂交,F1代中就会有含有目的基因的转基因小鼠,在经过脱氧土霉素(Doxycycline)共给,小鼠就能长出肺癌来了。
我觉得这个动物模型有几个优点:
1. 能模拟人类原发性肺癌,是一个很好的原发疾病模型。
这样可以尽最大可能模拟一些人类疾病的发病过程,因此,在这种模型上的实验可信度和实用度都很高。
2. 特异性好,他们用的CCSP-rtTA只有在肺泡中有表达,(CCSP是Clara Cell Secretion Protein 的简写,这种蛋白只会在肺泡表达,CCSP-rtTA指的是用CCSP的启动子调控rtTA的表达),因此,也避免了其他转基因动物模型中的非特异作用问题。
3. 可以直接构建近交系杂交F1代模型,这是人类疾病动物模型制作中最提倡的动物载体。
杂交F1代可以最大程度的保持基因背景的稳定性
所以这个模型制作思路还是很有参考价值的,值得我们学习。
我们也可以在此基础上发挥一下,制作出其他肿瘤或者疾病的模型。
但是这种动物模型制作过程比较复杂,效率也不高。
这可能是它美中不足的地方了。
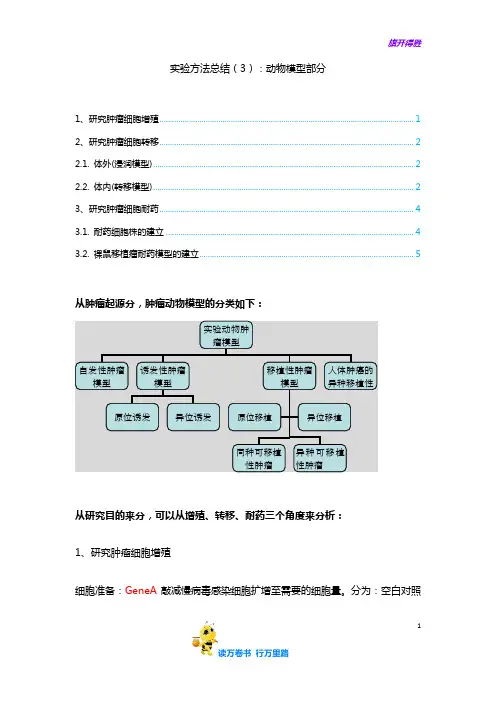
1实验方法总结(3):动物模型部分1、研究肿瘤细胞增殖 (1)2、研究肿瘤细胞转移 (2)2.1. 体外(浸润模型) (2)2.2. 体内(转移模型) (2)3、研究肿瘤细胞耐药 (4)3.1. 耐药细胞株的建立 (4)3.2. 裸鼠移植瘤耐药模型的建立 (5)从肿瘤起源分,肿瘤动物模型的分类如下:从研究目的来分,可以从增殖、转移、耐药三个角度来分析:1、研究肿瘤细胞增殖细胞准备:GeneA 敲减慢病毒感染细胞扩增至需要的细胞量。
分为:空白对照实验动物肿瘤模型自发性肿瘤模型 诱发性肿瘤模型移植性肿瘤模型 人体肿癌的异种移植性原位诱发 异位诱发 同种可移植性肿瘤 异种可移植性肿瘤 原位移植 异位移植组、阴性对照组、实验组。
取Balb/c裸鼠,雄性,6周龄,每组10只,适应一周后进行肿瘤细胞注射。
XXX细胞消化离心后制成单细胞悬液,计数后取适量的细胞用PBS悬浮,在Balb/c裸鼠侧腹部皮下接种。
每只接种2×106个细胞,注射体积为100 μL。
此后,每隔5天测量注射部位肿瘤的体积。
30天后裸鼠小鼠腹腔注射80 mg/kg 戊巴比妥钠,小鼠麻醉后置蓝色背景布上拍照(侧卧位,接种部位朝上),小鼠颈椎脱臼处死,取出肿瘤称重,将肿瘤置蓝色背景布上拍照,肿瘤一分为二,一份4%多聚甲醛固定,待后续病理分析,一份-80℃冻存。
2、研究肿瘤细胞转移肿瘤转移的模型包括两大类:体外(浸润模型)和体内(转移模型)。
体外(浸润模型):了解肿瘤细胞对周围相连组织的侵润性。
体内模型主要研究肿瘤细胞的转移性即肿瘤细胞在远端组织形成病灶的能力。
2.1. 体外(浸润模型)例:浸润型脑胶质瘤动物模型的建立方法:取若干只Balb/c免疫缺陷裸鼠,将分离和鉴定并转染携带绿色荧光蛋白的脑胶质瘤干细胞立体定向法行小鼠颅内接种,每组10只。
小鼠麻醉后头部正中切口,剥离骨膜后钻孔(坐标是冠状缝后0.5 cm,矢状缝右侧2.5 cm) 。



动物肿瘤造模实验方案
动物肿瘤造模实验是一种常用的动物实验方法,用于研究肿瘤的发生、生长、转移和治疗方案。
下面是一个可能的动物肿瘤造模实验方案:
1. 选择动物模型:常用的动物模型包括小鼠、大鼠和兔子等。
根据研究目的和肿瘤类型选择合适的动物模型。
2. 选择肿瘤细胞系:常用的肿瘤细胞包括人源性肿瘤细胞系和动物源性肿瘤细胞系。
根据研究目的和肿瘤类型选择合适的肿瘤细胞系。
3. 准备肿瘤细胞:将肿瘤细胞培养至合适浓度,并用生理盐水或其它合适的载体悬浮。
4. 动物模型建立:将肿瘤细胞注射到动物体内建立肿瘤模型。
常用的注射方式包括皮下、脾脏或其他器官内注射。
5. 观察肿瘤生长:观察肿瘤模型的生长情况,包括肿瘤体积、肿瘤质地、肿瘤血液供应等。
6. 取样分析:在不同时间点取样,对肿瘤模型进行分析,包括病理学检查、免疫组化分析、分子生物学检测等。
7. 肿瘤治疗试验:根据研究目的,对肿瘤模型进行治疗试验,可以采用化疗、放疗、免疫治疗或其它治疗方法。
8. 结果分析:根据实验结果进行数据分析和统计,并对实验结果进行解读和讨论。
需要注意的是,动物实验需要遵守伦理规范和相关法律法规,确保实验过程的合法性和道德性,并尽量减少对动物的伤害和痛苦。
在进行动物肿瘤造模实验时,应严格按照相关实验规范进行操作,并有专业实验人员进行监督和管理。

肿瘤动物模型的分类
1. 自发肿瘤动物模型,就像身体里自己突然冒出来的“捣蛋鬼”!比如说老年犬,它们年龄大了可能就会自己长出肿瘤。
这是不是很神奇呢?
2. 诱发性肿瘤动物模型啊,这就像是人为制造出来的麻烦。
好比给小鼠特定的致癌物,让它长出肿瘤来研究,是不是很有意思呢?
3. 移植性肿瘤动物模型,哇,就像是把一个肿瘤“乾坤大挪移”到动物身体里。
比如把人的肿瘤细胞移植到小老鼠身上,看看会发生什么,这感觉很奇妙吧?
4. 基因工程肿瘤动物模型呢,这简直是高科技的杰作呀!通过改造基因让动物更容易得肿瘤,就像给动物“定制”了肿瘤一样,厉害吧!
5. 同种移植肿瘤模型,这有点像把“自己人”的肿瘤挪过来。
就像把同一种小鼠的肿瘤移植到另一只小鼠身上,这可真特别!
6. 异种移植肿瘤模型呀,可不就像是把“外人”的肿瘤弄进来嘛!把别的物种的肿瘤移植到动物身上,是不是能发现很多新东西呢?
7. 人源化肿瘤动物模型,嘿,这可是尽量让动物变得像人一样得肿瘤呢!就如同给动物披上了人类肿瘤的“外衣”,太有研究价值啦!
总之,肿瘤动物模型的分类真是丰富多彩,每一种都有其独特之处和重要价值,为我们研究肿瘤提供了强大的工具和手段呀!。
如何正确地选择肿瘤动物模型?展开全文导读在中国,每天约有7710例患者死于癌症,每分钟大概6人死于癌症,因此,癌症的研究无疑成为生物医学的重中之重,动物模型在肿瘤发生发展及药物研发上扮演着至关重要角色。
那么面对不同的肿瘤模型,究竟怎样的动物模型才可以准确反映人类肿瘤发展情况呢?这就是我们本期内容,告诉大家什么样的肿瘤动物模型才是你真正想要的。
首先我们要知道,最大的问题不是如何去建立模型,而是建立什么样的模型。
因为不同的模型会导致实验结果有较大出入,肿瘤学研究工作者应当熟悉该领域已有的研究成果,查阅全面资料后,才能为自己的课题选到合适的实验动物肿瘤模型。
第一步,需要明确你的实验目的根据设定的实验目标来选择最合适的动物模型,才能得到科学的结论和理想的结果。
肿瘤动物模型的应用一般分为:肿瘤发生发展机制研究、抗肿瘤药物筛选、免疫疗法相关研究等。
第二步,了解已有的各类常见肿瘤模型分类及特点肿瘤动物模型一般分为:①CDTX(肿瘤细胞系移植模型)②P DTX(人源肿瘤组织异种移植模型)③诱发性肿瘤动物模型④基因修饰肿瘤模型⑤自发性肿瘤动物模型;每个模型介绍详情可点击往期文章(3.4肿瘤动物模型介绍)。
第三步,进一步细化到模型的每一个不定因素主要包括以下几个不确定因素:(1)细胞系的选择根据研究的肿瘤类型以及基因型选取相应的肿瘤细胞系,用于荷瘤的细胞要保证较好的生长状态,无污染,处于对数生长期。
不同肿瘤细胞系的成瘤率不同,结合自身选取成瘤率高的细胞系进行实验。
如乳腺癌细胞有几十种,根据来源有鼠源和人源的,根据分型有三阴性与非三阴性的,如果要更贴近人类三阴性乳腺癌的研究,一般会选择易荷瘤的MDA-MB-231细胞。
(2)小鼠品系的选择肿瘤细胞系移植模型分为两种:将人的肿瘤细胞系或肿瘤组织移植到小鼠体内和将小鼠的肿瘤细胞移植到小鼠体内,前者为异种移植因此必须选择具有免疫缺陷的小鼠(如:nude,NOD/scid,NSG),后者为同种移植,因此选择与肿瘤细胞系来源一致的小鼠(C57BL/6品系来源的黑色素瘤细胞系B16F10以及路易斯肺癌细胞系LLC就要选择C57BL/6品系的小鼠)。
理想的肿瘤动物模型的主要特征1. 引言1.1 概述肿瘤是当今社会中一大公共卫生问题,世界各地都有无数的人因肿瘤而失去生命。
为了更好地理解和应对肿瘤的发生、发展和治疗,科学家们致力于寻找最合适的动物模型来模拟人体内的肿瘤过程。
然而,现有的肿瘤动物模型往往存在一些局限性和缺陷,这就需要我们进一步探索理想的肿瘤动物模型及其主要特征。
1.2 文章结构本文将首先介绍理想的肿瘤动物模型所需具备的主要特征,并分别从动物模型的选择准则、生理和解剖特征相似性以及癌症发生与进展的可模拟性三个方面进行阐述。
接下来,我们将讨论现有肿瘤动物模型存在的局限性,包括免疫系统缺陷性、基因组背景多样性以及肿瘤异质性与转移能力缺失等问题。
然后,我们还将探讨发展理想肿瘤动物模型所面临的挑战与前景,包括技术难题与资源需求、多层面模拟与个体化治疗需求的结合以及人类伦理道德和动物福利考量下的优化方向。
最后,我们将对文章进行总结回顾,并展望未来理想肿瘤动物模型发展方向,并强调其对研究和应用的意义与前景。
1.3 目的本文旨在全面梳理和分析理想肿瘤动物模型的主要特征,并探讨现有肿瘤动物模型存在的局限性。
通过深入剖析发展理想肿瘤动物模型所面临的挑战与前景,旨在推动相关领域科学家共同努力,不断改进和优化肿瘤动物模型,并为人类提供更准确、可靠的治疗策略和方法。
这对于提高癌症治愈率、缓解社会负担具有重要而长远的意义。
2. 主要特征:2.1 动物模型的选择准则:在选择理想的肿瘤动物模型时,需要考虑以下几个关键准则。
首先,动物模型应该基于人类肿瘤生物学的相似性,即对人类癌症发展和治疗反应的预测具有高度可靠性。
其次,模型应该在实验室环境下易于维护且具备较长的寿命,以保证长期观察与研究。
此外,动物模型还应具备足够高的显示率和可重复性,以提供稳定且可靠的数据。
最后,在伦理上不会引起道德困扰并且对动物福利有所保障。
2.2 生理和解剖特征的相似性:一个理想的肿瘤动物模型应当尽可能地与人类生理和解剖特征保持相似。
实验动物移植性肿瘤模型的选择目前肿瘤化疗所应用的大多数药物,都经动物移植性肿瘤试验而被发现,因此它是筛选抗肿瘤新药中最常用模型。
其优点是接种一定量瘤细胞或无细胞滤液(病毒性肿瘤)后,可以使一群动物带有同样的肿瘤,生长速率一致,个体差异较小,接种存活率近100%。
对宿主的影响也类似,易于客观判断疗效,且可以同种或同品系动物中连续移植,长期保留供试验之用,试验周期一般均较短,因此当前抗癌筛选中绝大多数用移植瘤试验,如各种实体型肿瘤,腹水瘤和白血病等均被广泛作用。
但是这类肿瘤生长速度快,增殖比率高,体积倍增时间短,这些都是与人体肿瘤的显著不同点,特别是与人的实体瘤差别更大。
许多国家筛抗癌药物中选用移植瘤株经常改变,主要原因可能也与此有关。
现在世界上有近500种的动物移植瘤,但常用于筛药的不到40种,多数为小鼠肿瘤,其次是大鼠和仓鼠移植瘤,包括小鼠L-1210淋巴白血病,艾氏腹水瘤,Frieha病毒白血病,肉瘤180, Lewis肺癌,腺癌755,白血病615Y, P1534淋巴白血病,P1798淋巴肉肉瘤,LPC-1浆细胞瘤,淋巴瘤8,Gardner淋巴肉瘤,B16或Cloadman黑色素瘤,Ridaway骨肉瘤,肉瘤37,P315白血病,Wagner癌肉瘤,Murhy-sturm淋巴瘤,Jensen肉瘤,Geurin氏癌,仓鼠十二指肠腺癌和人体瘤HSL第1代杂交鼠移植。
(摘自姜承和等.实验动物在肿瘤研究中的选择和应用.见汪谦主编.现代医学实验方法.第1版.北京:人民卫生出版社, 1997.1092-1095)可移植肿瘤模型可移植肿瘤模型应用日益广泛,并是目前研究最多的肿瘤模型。
容易人为操作,动物成瘤稳定,均一性好,发病率高,成瘤时间差异不大,容易施加干扰因素,该模型不能用于病因学、癌前病变和癌变的研究。
但对成瘤、治疗、浸润和转移等研究非常有用。
移植肿瘤可以是肿瘤组织块也可以是细胞株。
Leader和Padgett认为可移植肿瘤的基本条件是:(1)能准确重现所移植的肿瘤;(2)有足够的体积和荷瘤时间供研究者使用;(3)便于推广应用。
肿瘤模型我们一般常用的就是小鼠模型和人肿瘤裸小鼠移植瘤模型。
其中用得最多的是皮下模型,另外还有腹水(或者尾静脉注射)以及原位模型,其他的模型很少用,就不提他们了。
小鼠模型分三大类:第一类是以S180、EAC、H22等为代表的,他们的宿主小鼠多选用KM,可产生腹水,也可在皮下成瘤。
多以腹水传代,实验时抽取腹水,经过一定稀释后皮下接种构建模型,接踵后第二天开始给药,给药7到10天,接种10天后结束试验,剥取肿瘤称瘤重。
1. 关于构建瘤种可以用体外细胞株培养后,用PBS悬浮至1~3×106/0.1ml/mouse,i.p接种即可,最好用6号左右的针头,就是常用的2ml一次性注射的针头。
2. 关于腹水传代观察到第一代的种鼠肚子较大后(一般约8~9天左右),可以传代,传代时取1ml注射器,用2ml 注射器的针头,种鼠腹部消毒后直接将针头插入抽取腹水即可,注意不要把针头插得很深,尽量浅一点,还可以把老鼠拎起来,利用重力,让腹水集中在某处便于抽取,一般抽个0.5ml就可以了,不用离心,直接用PBS3~6倍稀释后,接种到新的老鼠腹腔,腹水颜色为白色或者略有发黄都是正常的,但是血性腹水说明不好,需要注意调整,第二代以后,尽量6~7天的时候传代,不要等的时间太久,否则腹水容易血性。
三代后可用于试验。
3. 关于接种进行试验这个时候抽取的腹水需要量比较多,一般需要处死种鼠后,小心地用消毒眼科剪刀镊子剥开腹部皮肤,注意不要弄破肌肉,然后,用镊子(最好是哪种前面有倒勾的镊子,学名好像是唇型镊)拎起腹部的肌肉,用剪刀剪开一个小口,然后用玻璃滴管或者去掉针头的注射器吸取腹水。
然后进过一定的稀释后,接种到小鼠的腋下。
关于稀释量,各个实验室的情况都不一样,最好摸索一下,开始的时候可以适当的计数,但是要用台盼兰染色后计活细胞数。
接种部位在小鼠腋下,但是不要深入到腋窝里面,会给以后的操作带来麻烦。
接种时的进针处离接种处远一点,让针头在皮下多走一段,不容易污染。