酸碱盐化学性质的归纳
- 格式:doc
- 大小:51.50 KB
- 文档页数:4


武汉市楚才中学2012年中考复习之酸、碱、盐的性质及化学方程式归纳一、酸→H++酸根离子1、浓酸的特性:浓盐酸:有挥发性,有刺激性气味浓硫酸:有强烈的腐蚀性,脱水性,吸水性,稀释时放出大量的热2、稀酸的化学性质:(1)使紫色石蕊变红,无色酚酞不变色(2)酸+活泼的金属→盐+H2↑①实验室制氢气(锌与稀硫酸反应)Zn + H2SO4 == ZnSO4 + H2↑Zn + 2HCl == ZnCl2 + H2↑②铁与稀盐酸的反应Fe + 2HCl == FeCl2 + H2↑(实验现象:铁丝逐渐溶解,有无色气泡产生,溶液由无色变成浅绿色)③铁与稀硫酸的反应Fe + H2SO4 === FeSO4 + H2 ↑(实验现象:铁丝逐渐溶解,有无色气泡产生,溶液由无色变成浅绿色)④镁与稀盐酸的反应Mg + 2HCl === MgCl2 + H2↑⑤镁与稀硫酸的反应Mg + H2SO4 ==== MgSO4 +H2 ↑⑥铝与稀盐酸的反应2Al + 6HCl === 2AlCl3 + 3H2↑⑦铝与稀硫酸的反应2Al + 3H2SO4 ===Al2(SO4)3 +3H2 ↑(3)酸+金属氧化物-----盐 + 水①稀盐酸与氧化铁的反应6HCl+Fe2O3===2FeCl3+3H2O(除锈原理)实验现象:红棕色固体逐渐溶解,溶液由无色变成黄色②稀盐酸与氧化铜的反应2HCl+CuO==CuCl2+H2O实验现象:黑色固体逐渐溶解,溶液由无色变成蓝色③稀硫酸与氧化铁的反应3H2SO4+Fe2O3===Fe2(SO4)3+3H2O(除锈)实验现象:红棕色固体逐渐溶解,溶液由无色变成黄色④稀硫酸与氧化铜的反应H2SO4+CuO==CuSO4+H2O实验现象:黑色固体逐渐溶解,溶液由无色变成蓝色⑤稀盐酸与氧化铝的反应6HCl+Al2O3===2AlCl3+3H2O⑥稀硫酸与氧化铝的反应3H2SO4+ Al 2O3=== Al 2(SO4)3+3H2O⑦稀盐酸与氧化钙的反应2HCl+CaO==CaCl2+H2O⑧稀硫酸与氧化钙的反应H2SO4+CaO==CaSO4+H2O⑨稀盐酸与氧化镁的反应2HCl+MgO==MgCl2+H2O⑩稀硫酸与氧化镁的反应H2SO4+MgO==MgSO4+H2O(4)酸 + 碱 -------盐 +①稀盐酸与氢氧化钠的反应HCl+NaOH===NaCl+H2O②盐酸与氢氧化钙的反应2HCl+Ca(OH)2===CaCl2+2H2O③稀硫酸与氢氧化钠的反应H2SO4+2NaOH===Na2SO4+2H2O④稀硫酸与氢氧化钙的反应H2SO4+ Ca(OH)2===CaSO4+2H2O(处理酸性土壤和硫酸厂污水都用熟石灰)⑤稀硫酸与氢氧化钡的反应H2SO4+ Ba(OH)2===BaSO4 ↓+2H2O⑥稀硫酸与氢氧化铜的反应H2SO4+ Cu(OH)2===CuSO4+2H2O⑦稀盐酸与氢氧化铁的反应3HCl+Fe(OH)3===FeCl3+3H2O⑧稀盐酸与氢氧化铝的反应3HCl+Al(OH)3===AlCl3+3H2O(治疗胃酸过多的原理)⑨盐酸与氢氧化镁的反应2HCl+Mg(OH)2=== Mg Cl2+2H2O⑩硫酸与氢氧化镁的反应H2SO4+Mg(OH)2=== MgSO4+2H2O3、酸的用途(1)浓硫酸可做干燥剂(2)稀盐酸、稀硫酸可除去铁制品表面的铁锈(3)胃内盐酸可帮助消化二、碱→OH-- +金属离子1、固体碱的特性氢氧化钠固体:遇水易潮解、强烈的腐蚀性,溶解时放出大量的热氢氧化钙固体:有一定的腐蚀性,微溶于水2、碱溶液的化学性质(1)使紫色石蕊变蓝色,无色酚酞变红色(2)碱+非金属氧化物→盐+水①二氧化碳通入澄清石灰水CO2 + Ca(OH)2 ====== CaCO3↓+ H2O(该反应用于实验室鉴别二氧化碳)②二氧化碳与氢氧化钠的反应CO2 + 2NaOH ===Na2CO3 + H2O(该反应用于吸收二氧化碳)③三氧化硫与氢氧化钠的反应SO3+ 2NaOH ===Na2SO4+ H2O④三氧化硫与氢氧化钙的反应SO3+ Ca(OH)2 ===CaSO4+ H2O⑤二氧化硫与氢氧化钠的反应SO2+ 2NaOH ===Na2SO3+ H2O⑥二氧化硫与氢氧化钙的反应SO2+ Ca(OH)2 ===CaSO3+ H2O(3)碱+酸 -------盐 +3、碱的用途(1)氢氧化钠可用于造纸、纺织、印染等;可以与油脂反应,用于除油污;固体可做干燥剂(2)氢氧化钙固体可用于改良酸性土壤、建筑材料等三、盐→金属离子+酸根离子1、几种常见的盐:(1)氯化钠,化学式NaCl,食盐的主要成分,白色晶体,易溶于水(2)碳酸钠,化学式Na2CO3,俗名:纯碱、苏打,白色粉末,易溶于水,其水溶液显碱性。

酸碱盐的归纳与总结酸碱盐是化学中常见的三大类物质之一,它们在我们的日常生活和工业生产中起着重要的作用。
本文将对酸碱盐进行归纳与总结,以更好地理解这些物质的性质和应用。
一、酸的性质酸是一类具有酸性质的物质,其主要特点是呈现酸性反应。
下面是一些常见的酸的性质:1. 蓝色石蕊试纸变红:酸能够使蓝色石蕊试纸变红,这是酸性的一个明显表现。
2. 与金属反应产生氢气:酸与某些金属反应时,会产生氢气。
例如,盐酸和锌发生反应会产生氢气。
3. 与碳酸盐反应产生二氧化碳:酸与碳酸盐反应时,会释放出二氧化碳气体。
例如,硫酸和碳酸钙反应会产生二氧化碳气体。
4. 酸呈酸味:大多数酸呈酸味,例如柠檬汁和醋都有酸味。
二、碱的性质碱是另一类常见的化学物质,具有碱性质。
以下是一些常见的碱的性质:1. 红色石蕊试纸变蓝:碱能够使红色石蕊试纸变蓝,这是碱性的一个显著特征。
2. 碱可以中和酸:碱可以与酸反应,发生中和反应,生成盐和水。
例如,氢氧化钠和盐酸反应会生成氯化钠和水。
3. 碱呈苦味:大多数碱有苦味,例如肥皂水和氢氧化钠溶液。
4. 碱与脂肪酸形成肥皂:碱与脂肪酸(如橄榄油中的油酸)反应,可以生成肥皂。
三、盐的性质盐是酸碱反应的产物,具有与酸和碱不同的性质。
以下是一些常见的盐的性质:1. 盐是离子化合物:盐是由阳离子和阴离子组成的离子化合物,如氯化钠(NaCl)。
2. 盐在水中溶解:大多数盐可以在水中溶解,形成电解质溶液。
3. 盐具有熔点和沸点:盐在加热过程中具有熔点和沸点,不同盐的熔点和沸点各异。
4. 盐可用于烧蓝色火焰:某些盐在燃烧时,可以使火焰变为不同颜色,如钠盐(NaCl)可以使火焰变为黄色。
四、酸碱盐的应用1. 酸的应用:酸在许多方面都有重要应用,如工业生产中的酸洗、制备肥料、制药等。
同时,酸也可用于食品加工和调味。
2. 碱的应用:碱在生活和工业中有许多应用,如肥皂制造、清洁剂、制药等。
碱还可以用于中和酸性物质和调整酸碱平衡。

九年级化学酸碱盐知识点归纳一、酸碱盐的基本概念酸:电离时生成的阳离子全部是氢离子的化合物。
如:HCl、H2SO4、HNO3、CH3COOH 等。
碱:电离时生成的阴离子全部是氢氧根离子的化合物。
如:NaOH、KOH、Ca(OH)2、Ba(OH)2、NH3·H2O等。
盐:由金属离子(或铵根离子)和酸根离子组成的化合物。
如:NaCl、Na2CO3、CuSO4、NH4Cl等。
二、酸碱盐的通性酸的通性:使紫色石蕊试液变红,无色酚酞试液不变色。
与活泼金属反应生成盐和氢气。
与金属氧化物反应生成盐和水。
与碱反应生成盐和水。
与盐反应生成新盐和新酸。
碱的通性:使紫色石蕊试液变蓝,无色酚酞试液变红。
与非金属氧化物反应生成盐和水。
与酸反应生成盐和水。
与盐反应生成新盐和新碱。
盐的通性:有些盐能与酸反应生成新盐和新酸。
有些盐能与碱反应生成新盐和新碱。
有些盐能与某些盐反应生成两种新盐。
三、酸碱盐之间的反应酸碱中和反应:酸和碱反应生成盐和水,这类反应属于复分解反应。
如:HCl + NaOH = NaCl + H2O。
盐与酸的反应:生成新盐和新酸。
如:Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑。
盐与碱的反应:生成新盐和新碱。
如:CuSO4 + 2NaOH = Cu(OH)2↓+ Na2SO4。
盐与盐的反应:生成两种新盐。
如:Na2CO3 + CaCl2 = CaCO3↓+ 2NaCl。
四、酸碱盐在生活中的应用酸:用于清洁金属表面、除锈、生产化肥等。
碱:用于中和酸性废水、生产洗涤剂、肥皂等。
盐:用于调味、防腐、生产化学原料等。
五、常见的酸碱指示剂紫色石蕊试液:遇酸变红,遇碱变蓝。
无色酚酞试液:遇酸不变色,遇碱变红。
六、溶液的酸碱度pH值:表示溶液酸碱度的数值,范围为0-14。
pH < 7为酸性,pH = 7为中性,pH > 7为碱性。
酸碱指示剂与pH试纸:用于测定溶液的酸碱度。
七、常见的酸碱盐及其性质盐酸(HCl):无色液体,具有刺激性气味,能与多种物质发生反应。

酸碱盐的化学性质(一)酸的性质(1)与指示剂反应紫色石蕊试液变红色,无色酚酞试液不变色。
(2)酸+碱=盐+水。
(3)酸+某些金属氧化物=盐+水。
(4)酸+活泼金属=盐+氢气。
(5)酸+盐=新盐+新酸。
1、锌跟稀盐酸反应:Zn + 2HCl = ZnCl2 + H2 ↑ 有气泡产生,锌粒逐渐减少。
2、锌跟稀硫酸反应:Zn + H2SO4 = ZnSO4 + H2 ↑3、铁跟稀盐酸反应:Fe + 2HCl = FeCl2+ H2 ↑ 有气泡产生,铁逐渐减少,4、铁跟稀硫酸反应:Fe + H2SO4 =FeSO4 + H2 ↑ 溶液变成浅绿色。
5、铁锈跟稀盐酸反应:Fe2O3 +6HCl = 2FeCl3 + 3H2O 红色铁锈逐渐消失,6、铁锈跟稀硫酸反应:Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O 溶液变成黄色7、氧化铜跟稀盐酸反应:CuO + 2HCl =CuCl2 +H2O 黑色氧化铜逐渐消失,8、氧化铜跟稀硫酸反应:CuO + H2SO4 = CuSO4 + H2O 溶液变成蓝色。
(二)碱的性质:(1)碱溶液能使紫色石蕊试液变蓝色,无色酚酞试液变红色。
(2)碱+多数非金属氧化物=盐+水(3)碱+酸=盐+水(4)碱+某些盐=另一种盐+另一种碱1、氢氧化钠跟二氧化碳反应:2NaOH + CO2 = Na2CO3 + H2O2、氢氧化钠跟二氧化硫反应:2NaOH + SO2 = Na2SO3 + H2O3、氢氧化钠跟三氧化硫反应:2NaOH + SO3 = Na2SO4 + H2O4、氢氧化钙跟二氧化碳反应:Ca(OH)2 + CO2 = CaCO3↓ + H2O 使澄清石灰水变浑浊5、氢氧化钠跟稀硫酸反应:2NaOH + H2SO4 = Na2SO4 + 2H2O6、氢氧化钠跟稀盐酸反应:NaOH + HCl = NaCl + H2O7、生石灰跟水反应:CaO + H2O =Ca(OH)2(三)盐的性质:(1)盐+某些金属=另一种盐+另一种金属。

酸碱盐的化学性质(一)酸的性质(1)与指示剂反响紫色石蕊试液变红色,无色酚酞试液不变色。
(2)酸+碱=盐+水。
(3)酸+某些金属氧化物=盐+水。
(4)酸+开朗金属=盐+氢气。
(5)酸+盐=新盐+新酸。
1、锌跟稀盐酸反响: Zn + 2HCl = ZnCl2 + H22、锌跟稀硫酸反响:Zn + H2SO4 = ZnSO4 + H2有↑气泡产生,锌粒渐渐减少。
↑3、铁跟稀盐酸反响:4、铁跟稀硫酸反响:Fe + 2HCl = FeCl2 + H2 ↑有气泡产生,铁渐渐减少,Fe + H2SO4 =FeSO4 + H2 ↑溶液变为浅绿色。
5、铁锈跟稀盐酸反响:6、铁锈跟稀硫酸反响:色Fe2O3 +6HCl = 2FeCl3 + 3H2O 红色铁锈渐渐消逝,Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O 溶液变为黄7、氧化铜跟稀盐酸反响: CuO + 2HCl = CuCl2 +H2O 黑色氧化铜渐渐消逝,8、氧化铜跟稀硫酸反响: CuO + H2SO4 = CuSO4 + H2O溶液变为蓝色。
(二)碱的性质:( 1)碱溶液能使紫色石蕊试液变蓝色,无色酚酞试液变红色。
(2)碱+多半非金属氧化物=盐+水(3)碱+酸=盐+水(4)碱+某些盐=另一种盐+另一种碱1、氢氧化钠跟二氧化碳反响: 2NaOH + CO2 = Na2CO3 + H2O2、氢氧化钠跟二氧化硫反响: 2NaOH + SO2 = Na2 SO3 + H2O3、氢氧化钠跟三氧化硫反响: 2NaOH + SO3 = Na2SO4 + H2O4、氢氧化钙跟二氧化碳反响: Ca(OH)2 + CO2 = CaCO3 ↓ + H2O 使澄清石灰水变污浊5、氢氧化钠跟稀硫酸反响:2NaOH + H2SO4 = Na2SO4 + 2H2O6、氢氧化钠跟稀盐酸反响:NaOH + HCl = NaCl + H2O7、生石灰跟水反响: CaO + H2O =Ca(OH)2(三)盐的性质:( 1)盐+某些金属=另一种盐+另一种金属。

酸碱盐化学性质总结一、 酸的化学性质(1) 酸跟酸碱指示剂作用酸使紫色石蕊试液变红,使无色酚酞试液不变色。
(2) 金属+酸→盐+氢气 (在金属活动表中排在氢前面的金属)↑+=+2442H ZnSO SO H Zn ↑+=+222H FeCl HCl Fe↑+=+2342423)(32H SO Al SO H Al ↑+=+222H MgCl HCl Mg(3) 金属氧化物+酸→盐+水O H FeCl HCl O Fe 2332326+=+ O H SO Fe SO H O Fe 234242323)(3+=+ O H CaCl HCl CaO 222+=+ O H CuSO SO H CuO 2442+=+(4) 碱+酸→盐+水O H SO Na SO H NaOH 2424222+=+ O H CaSO SO H OH Ca 244222)(+=+ O H AlCl HCl OH Al 23333)(+=+ O H MgCl HCl OH Mg 22222)(+=+(5)盐+酸→新盐+新酸↑++=+22232CO O H CaCl HCl CaCO ↑++=+22424232CO O H SO Na SO H CO Na HCl BaSO SO H BaCl 24422+↓=+ ↑++=+223CO O H NaCl HCl NaHCO 33HNO AgCl HCl AgNO +↓=+二、 碱的化学的性质(1) 碱溶液跟酸碱指示剂作用参加反应的碱必须可溶或微溶。
碱溶液使紫色石蕊试液变蓝,使无色酚酞试液变红。
(2) 非金属氧化物+碱(溶液)→盐+水(碱必须是可溶或微溶性的碱)O H CaCO OH Ca CO 2322)(+↓=+ O H CO Na NaOH CO 23222+=+O H SO Na NaOH SO 23222+=+ O H SO Na NaOH SO 24232+=+(3) 酸+碱→盐+水O H NaCl HCl NaOH 2+=+(4) 盐+碱→新盐+新碱(参加反应的盐碱必须可溶或微溶,生成物满足复分解反应的条件。

酸碱盐的性质与分类酸碱盐是化学中常见的物质,它们具有特定的性质和分类方式。
本文将探讨酸碱盐的性质与分类,以帮助读者更好地理解这一概念。
一、酸碱盐的性质1. 酸性性质:酸碱盐在溶液中可以释放氢离子(H+)或者氧根离子(OH-),呈现酸性性质。
酸性溶液具有酸味、蓝色石头纸变红等特征。
2. 碱性性质:酸碱盐可以释放氢氧化物离子(OH-),在溶液中呈现碱性性质。
碱性溶液滋味苦,红色石头纸变蓝等。
3. 中性性质:一些酸碱盐既不反应释放H+也不释放OH-,因此呈现中性性质。
中性溶液没有明显的酸碱特征。
二、酸碱盐的分类根据酸的性质和碱的性质不同,酸碱盐可以分为四种类型:酸性盐、碱性盐、中性盐和混合盐。
1. 酸性盐:酸性盐是由酸和碱反应生成的盐类物质。
它在溶液中具有酸性性质,可以释放出H+离子。
常见的酸性盐有硫酸铁、硫酸锌等。
2. 碱性盐:碱性盐是由强碱和强酸反应生成的盐类物质。
它在溶液中具有碱性性质,可以释放出OH-离子。
常见的碱性盐有氢氧化钠、氢氧化钾等。
3. 中性盐:中性盐是由强酸和强碱反应生成的盐类物质。
它在溶液中的pH值接近中性,不具有明显的酸碱性质。
常见的中性盐有氯化钠、硝酸银等。
4. 混合盐:混合盐是由酸、碱、氧化物或酸碱盐相互作用生成的盐类物质。
它的性质根据具体的成分而有所不同。
常见的混合盐有氯化铜、硫酸铵等。
三、酸碱盐的应用1. 工业应用:酸碱盐在工业中具有广泛的应用。
例如,氯化钠可用于制备氨水和氯气,硫酸铜可用于电镀和制造电池等。
2. 农业应用:酸碱盐在农业领域也有重要应用。
例如,硝酸钾可用于提供植物所需的氮元素,磷酸二铵可用作化肥等。
3. 医疗应用:酸碱盐在医疗领域中有着广泛的应用。
例如,氯化钾可用于补充体内缺失的钾离子,碳酸氢钠可用于缓解胃酸引起的不适等。
总结:酸碱盐是具有特定性质和分类方式的化学物质。
通过理解酸碱盐的性质与分类,我们可以更好地应用它们于工业、农业和医疗等领域。
掌握酸碱盐的基本概念,有助于我们更好地理解和应用化学知识。
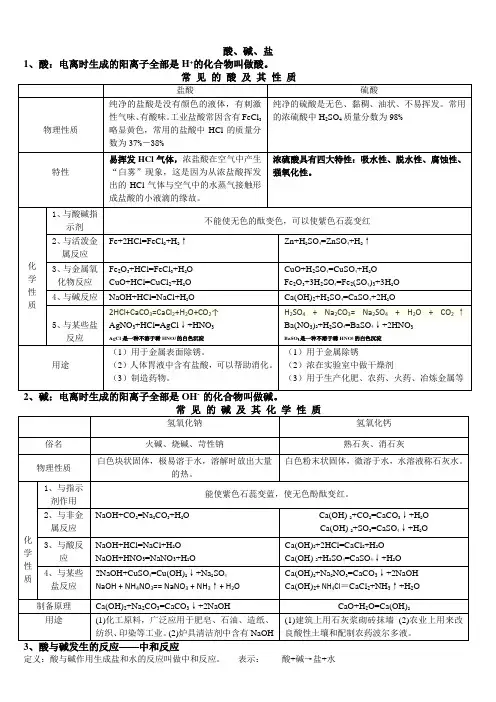
酸、碱、盐1、酸:电离时生成的阳离子全部是H+的化合物叫做酸。
定义:酸与碱作用生成盐和水的反应叫做中和反应。
表示:酸+碱→盐+水举例:NaOH+HCl→NaCl+H2O Ca(OH)2+H2SO4=CaSO4↓+H2O反应实质:酸中的H+和碱中的OH—生成水。
应用:改良土壤;处理工厂废水解决环境污染问题;在医药方面的问题。
4、盐:组成中含有金属离子和酸根离子的化合物8、复分解反应:两种化合物互相交换成分生成另外两种化合物的反应, 表达形式:AB+CD=AD+BC复分解反应条件:(1)对反应物的要求:有酸可溶可不溶;无酸都必须可溶(碱与盐、盐与盐反应,反应物须可溶才能发生)(2)对生成物的要求:有水生成或有所体生成或有沉淀生成9、铵态氮肥的鉴别:加熟石灰研磨,有刺激性气味是铵态氮肥。
NH4++OH-==NH3↑+H2O例:NH4Cl+ Ca(OH)2=CaCl2+NH3↑+H2O NH4NO3 + NaOH == NaNO3 + NH3↑+ H2O10、碳酸盐的鉴别:加稀盐酸有气泡,用澄清石灰水检验产物CO2。
CO32-+H+==CO2↑+H2O 例:CaCO3+2HCl=CaCl2+H2O +CO2↑Na2CO3+2HCl=2NaCl+H2O +CO2↑11、复分解反应方程式(1)酸+金属氧化物=盐+水Fe2O3+6HCl=2FeCl3+3H2O CuO+H2SO4=CuSO4+H2O(2)酸+碱─盐+水(中和反应)H2SO4+Cu(OH)2=CuSO4+2H2O H2SO4+Ca(OH)2=CaSO4↓+2H2O H2SO4+2NaOH=Na2SO4+2H2O H2SO4+Ba(OH)2=BaSO4↓+2H2O 2HCl+Cu(OH)2=CuCl2+2H2O 2HCl+Ca(OH)2=CaCl2+2H2O HCl+NaOH=NaCl+H2O 2HCl+Ba(OH)2=BaCl2+2H2O(3)酸+盐─新酸+新盐2HCl+CaCO3=CaCl2+H2O+CO2↑BaCl2+H2SO4=BaSO4↓+2HCl AgNO3+HCl=AgCl↓+HNO3Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑Na2CO3 + H2SO4 = Na2SO4 + H2O + CO2↑NaHCO3 + HCl = NaCl + H2O + CO2↑2NaHCO3 + H2SO4 = Na2SO4 + 2H2O + 2CO2↑(4)盐(可溶)+碱(可溶)─新盐+新碱2NaOH+CuSO4=Na2SO4+Cu(OH)2↓NaOH+NH4Cl=NaCl+NH3↑+H2O Na2CO3+Ca(OH)2=CaCO3↓+2NaOH NH4Cl+ Ca(OH)2=CaCl2+NH3↑+H2O(5)盐(可溶)+盐(可溶)─两种新盐Na2SO4+BaCl2=2NaCl+BaSO4↓,Na2CO3+CaCl2=2NaCl+CaCO3↓,AgNO3+NaCl=AgCl↓+NaNO3 ,Na2CO3+BaCl2=2NaCl+BaCO3↓。

酸碱盐的十大重要化学性质一、酸、碱与指示剂作用1、酸碱指示剂(简称指示剂):能与酸或碱作用显示不同颜色的物质。
指示剂在不同性质的物质中的颜色:指示剂物质酸性溶液中性溶液碱性溶液pH<7pH=7pH>7紫色石蕊试液红色紫色蓝色无色酚酞试液无色无色红色酸能使紫色石蕊试液变红,不能使无色酚酞变色。
碱能使紫色石蕊试液变蓝,能使无色酚酞变红。
记忆口诀:紫色石蕊:酸里红、碱里蓝,中性那是紫罗兰;无色酚酞:无色酚酞最大胆,只有遇碱才红脸。
注意:难溶的酸碱不能使指示剂变色。
如Cu(OH)2、Fe(OH)3、Al(OH)3等不能使指示剂变色,因为它们难溶于水。
二、活泼金属+ 酸→盐 + H2↑(置换反应)条件:金属要比氢活泼,酸为稀硫酸或盐酸,不能是浓硫酸或硝酸(有强氧化性)。
钾钙钠镁铝、锌铁锡铅 (氢)、铜汞银铂金。
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au(1)镁和稀盐酸:Mg + 2HCl = MgCl2+ H2↑(2)镁和稀硫酸:Mg + H2SO4= MgSO4+ H2↑(3)铝和稀盐酸:2Al + 6HCl = 2AlCl3+ 3H2↑(4)铝和稀硫酸:2Al + 3H2SO4= Al2(SO4)3+ 3H2↑(5)锌和稀盐酸:Zn + 2HCl = ZnCl2+ H2↑(6)锌和稀硫酸:Zn + H2SO4= ZnSO4+ H2↑(实验室制取氢气)(7)铁和稀盐酸:Fe + 2HCl = FeCl2+ H2↑(8)铁和稀硫酸:Fe + H2SO4= FeSO4+ H2↑三、金属 + 盐(溶液)→新盐 + 新金属(置换反应,在溶液中进行)钾钙钠镁铝、锌铁锡铅 (氢)、铜汞银铂金。
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au条件:只有排在前面的金属能把排在后面的金属从盐溶液中置换出来(钾、钙、钠除外),而排在后面的金属则不能置换前面的金属。

酸碱盐化学性质总结
酸碱盐和酸发生反应称为复分解反应,过程:酸+盐→新盐+新酸,强酸变弱酸,这里的盐可以是不溶性盐。
和碱发生复分解反应,碱可溶+盐可溶→新碱+新盐。
和某些金属发生置换反应:盐+金属单质→新金属单质+新盐,反应中的金属一定要比盐中的金属活泼才可以把它给置换出来。
酸碱盐的化学性质是盐是由阳离子正电荷离子与阴离子负电荷离子所组成的中性不带电荷的离子化合物。
酸指电离时产生的阳离子全部都是氢离子的化合物;碱指电离时产生的阴离子全部都是氢氧根离子的化合物。
可以简记为:氢头酸、氢氧根结尾碱、金属开头酸根结尾的是盐。
盐的种类:盐分为正盐,酸式盐,中性盐,碱式盐,复盐。
正盐:单由金属离子(包括铵根离子)和酸根离子构成;酸式盐:由金属离子(包括铵根离子)、氢离子酸根离子和非金属离子构成;碱式盐:由金属离子(包括铵根离子)、氢氧根离子酸根离子和非金属离子构成。
复盐:由不同金属离子(包括铵根离子)和酸根离子构成;碱式盐详细解释:电离时生成的阴离子除酸根离子外还有氢氧根离子,阳离子为金属离子(或铵根)的盐。
酸跟碱反应时,弱碱中的氢氧根离子部分被中和,生成的盐为碱式盐。
碱式盐,二元碱或多元碱才有可能形成碱式盐。
酸碱盐的性质酸碱盐性质是指酸碱盐物质的性质和特征,也称为烷基盐物质的性质。
其是由酸性物质和碱性物质相互反应,形成具有一定水溶性的物质。
由于他们具有特殊的物理和化学性质,酸碱盐经常用于生活、工业和药物制备中。
二、物理性质(1)密度和比重酸碱盐的密度和比重取决于其组成成分。
通常情况下,具有同种组成成分的酸碱盐具有相同的密度和比重。
(2)冰点酸碱盐的冰点是指其在降温到冰点以下时起冰变的温度,其冰点取决于其组成,有些酸碱盐的冰点非常低,有些则非常高。
(3)沸点酸碱盐的沸点是指在加热到蒸发温度以上时蒸发的温度,其蒸发温度也取决于其组成成分,有些酸碱盐的蒸发温度非常低,有些则非常高。
三、化学性质(1)稳定性酸碱盐的稳定性取决于其组成成分,大多数酸碱盐组合在一起的稳定性很好,而部分因子可能会导致稳定性降低。
(2)pH值酸碱盐的 pH是指其在一定环境下的酸碱度,其 pH取决于其组成成分,某些酸碱盐具有中性pH,而有些则具有酸性或碱性 pH。
(3)水溶性酸碱盐的水溶性取决于其组成成分,大多数酸碱盐组合在一起对水具有良好的溶解性,而少数则有极低的水溶性。
四、用途(1)生活用途酸碱盐在生活中有很多用处,作为原料可用于食品加工和烹饪,酸碱盐的调味剂还可以改善食物的口感、色泽和口味。
此外,还可用于苗圃需求时的灌浆,以及蔬菜和水果的保鲜。
(2)工业用途在工业生产中,酸碱盐有广泛的用途,例如软化剂、清洁剂、抗菌剂、消毒剂和防腐剂等,还可用于实体电池和细胞操纵中。
(3)药物制备酸碱盐也可用于药物制备,例如缓释药片、缓释胶囊和药片,它们可以使药物在动物体内的分布更加均衡,提高药物的生物利用度。
总之,酸碱盐的性质在现代生活中扮演着重要的角色,它们也成为制药、处理和分析等领域重要的原料和应用。
【精品】酸碱盐化学性质总结酸碱盐化学性质总结酸碱盐是化学课中的重点内容。
它们有着不同的性质和作用,也具有实用和解决实际问题的价值。
所以,我们必须正确掌握该物质的化学性质,以便更好的发挥它的作用。
本文简要介绍了酸、碱、盐的统一性和不同之处,以及三者各自的化学性质:一、酸碱之间的统一性:1、酸碱都可以与水反应,产生H+和OH-离子,调节溶液酸碱度,从而可以影响溶液的特性。
2、酸碱都可以与金属离子形成盐,这些盐也有极易溶解、极难溶解、不溶解等特性。
3、酸碱都可以与有机物质反应,从而可以合成特定的有机物质。
二、酸、碱、盐各自的特性及其化学性质:a) 酸在溶液中可以捕获H+离子,能使溶液的pH降低,使溶液的中性有氧化还原变化,使得pH在7时溶液处于中性状态;b) 酸可以与氧化物溶解,溶解形成酸盐,如HCl溶解氧化铝而形成的氯化铝;c) 酸可以与碱反应,在反应产生的H+离子中,都有互相分离的共价水合键,能与其他离子结合,形成盐;d) 酸可以参与水解、加成和聚合反应,如罗宾逊反应,能生成新的化合物;b) 碱可以与某些有机物质反应,形成新的分子物质;c) 碱可以与金属反应,形成金属碱酸盐;a) 盐是由H+离子和OH-离子结合而成的,它们之间都有相互作用,构成共价结构而形成盐;b) 盐可以与水反应,构成溶液,并可以调节溶液的pH值;c) 盐可以参与前面所提到的酸碱反应,从而形成更复杂的离子,也可以形成多种有机物质;d) 盐可以与多种离子及金属发生反应,形成很多重要的有机物质。
以上就是酸碱盐的统一性及其各自的化学特性及作用总结。
在未来的实验室研究和实际应用中,我们应准确掌握酸碱盐的不同特性,并能够灵活运用,以解决实际问题。
酸碱盐碱性氧化物酸性氧化物非金属单质等化学性质总结1.酸的性质:(1)酸是一类能够产生H+离子的物质,在水溶液中呈酸性。
(2)酸具有腐蚀性,可以与金属反应,产生相应的金属盐和放出氢气。
(3)酸可以与碱进行中和反应,产生相应的盐和水。
(4)酸可以与碱性氧化物反应,产生相应的盐和水。
(5)酸可以与酸性氧化物反应,产生相应的盐和水。
2.碱的性质:(1)碱是一类能够产生OH-离子的物质,在水溶液中呈碱性。
(2)碱具有腐蚀性,可以与金属反应,产生相应的金属盐和放出氢气。
(3)碱可以与酸进行中和反应,产生相应的盐和水。
(4)碱可以与酸性氧化物反应,产生相应的盐和水。
(5)碱可以与碱性氧化物反应,产生相应的盐和水。
3.盐的性质:(1)盐是由酸与碱中和反应产生的化合物。
(2)盐晶体一般呈固体形态。
(3)盐的溶液可以导电。
(4)盐可以在高温下熔化,形成液体状态。
(5)盐在常温下一般不发生化学反应。
4.碱性氧化物的性质:(1)碱性氧化物能够与水反应,产生相应的碱溶液。
(2)碱性氧化物是碱的氧化物,可以产生OH-离子。
(3)碱性氧化物可以与酸反应,产生相应的盐和水。
5.酸性氧化物的性质:(1)酸性氧化物能够与水反应,产生相应的酸溶液。
(2)酸性氧化物是酸的氧化物,可以形成H+离子。
(3)酸性氧化物可以与碱反应,产生相应的盐和水。
6.非金属单质的性质:(1)非金属单质一般为非金属元素的简单物质形态。
(2)非金属单质的存在形式有固体、液体和气体。
(3)非金属单质具有较高的电负性,容易与金属元素发生反应。
(4)非金属单质可以与氧、氢、卤素等元素形成化合物。
(5)非金属单质的性质因元素的不同而有差异,如:氧气具有较强的氧化性,氯气具有强烈的腐蚀性等。
总结起来,酸、碱、盐、碱性氧化物、酸性氧化物和非金属单质在化学中具有不同的性质。
酸和碱可以通过中和反应产生盐和水,盐是酸碱中和反应的产物。
碱性氧化物和酸性氧化物分别是碱和酸的氧化物,与水反应分别可以产生碱和酸。
初中化学—酸碱盐化学性质得归纳
一、酸得化学性质
1、酸得通性:酸→H++酸根离子
2、常见得酸:硫酸(H 2SO 4) H2SO 4→H ++ SO 42-
硝酸(H NO3) HNO 3→H++ NO 3- 盐酸(HCl) HC l→H ++ Cl - 碳酸(H 2CO 3) H2CO 3→H++ CO 32-
醋酸(CH 3COOH) C H3C OOH →H ++CH 3C OO-(醋酸根离子)
3、酸具有酸得通性——原因:不同得酸在溶于水时,都能电离出相同得H +。
4、酸得化学性质归纳
(1)酸溶液与酸碱指示剂得反应
紫色石磊溶液遇酸溶液变红,无色酚酞溶液遇酸溶液不变色 (2)酸与活泼金属反应
表达式:酸+金属→盐+H 2↑ (置换反应)
条件:金属活动性必须在H 得前面(K 、Ca 、Na 除外) 比如:Fe+H2SO 4===Fe SO 4+ H 2↑
Zn +2HCl === ZnCl 2+ H 2↑
Cu+H 2SO 4 /HC l 不能反应,因为Cu 在H 后面 (3)酸与某些金属氧化物反应
表达式:酸+金属氧化物→盐+H 2O (复分解反应) 条件:常见得金属氧化物(ZnO 、F e2O 3、Al 2O 3) 比如:Zn O +H2SO 4===Zn SO 4+ H 2O
Fe 2O 3+6HCl ===2FeCl 3+3H 2O Al 2O 3 +3H 2SO 4=== A l2(SO 4)3+3H 2O F e2O 3+3H2SO4=== Fe2(SO 4)3+3H 2O (4)酸与碱反应
表达式:酸+碱→盐+H 2O (中与反应、复分解反应) 条件:酸与碱都能反应 比如:NaOH+HCl ===NaCl+H 2O
Ca(OH)
2+H
2
SO
4===
CaSO
4
+2H
2
O
Mg(OH)
2+2HCl ===MgCl
2
+2H
2
O
Al(OH)
3+3HCl=== AlCl
3
+3H
2
O
Fe(OH)
3+3HCl === FeCl
3
+3H
2
O
(5)酸与盐反应
①酸与含碳酸根(CO
3)或碳酸氢根(HCO
3
)得盐反应
表达式:酸+含CO
3/HCO
3
盐→新盐+H
2
O+CO
2
↑ (复分解反应)
条件:酸与含碳酸根(CO
3)或碳酸氢根(HCO
3
)得盐都能反应
比如:CaCO
3+2HCl===CaCl
2
+H
2
O+CO
2
↑
Na
2CO
3
+2HCl===2NaCl+H
2
O+CO
2
↑
NaHCO
3+HCl===NaCl+H
2
O+CO
2
↑
Ca(HCO
3)
2
+2HCl===CaCl
2
+2H
2
O+2CO
2
↑
②酸与不含碳酸根(CO
3)或碳酸氢根(HCO
3
)得盐反应
表达式:酸+盐→新酸+新盐 (复分解反应) 条件:反应得盐必须可溶,生成物得盐必须就是沉淀
比如:AgNO
3+HCl ===AgCl↓+HNO
3
BaCl
2+H
2
SO
4===
BaSO
4
↓+2HCl
BaSO
4+HNO
3
不能反应,反应物盐BaSO
4
不溶
KNO
3+HCl不能反应,虽然反应物盐KNO
3
可溶,但就是交换成分后,生成物没有沉
淀、H
2
O、气体生成
二、碱得化学性质
1、碱得通性:碱→金属离子+OH-
2、常见得碱:氢氧化钠NaOHNaOH→Na++OH-
氢氧化钙Ca(OH)
2 Ca(OH)
2
→Ca2+ + OH-
氢氧化钾KOH KOH→K++OH-
氨水NH
3·H
2
O NH
3
·H
2
O→NH
4
++OH-
3、碱具有碱得通性——原因:不同得碱在溶于水时,都能电离出相同得OH-。
4、碱得化学性质归纳
(1)碱溶液与酸碱指示剂得反应
紫色石磊溶液遇碱溶液变蓝,无色酚酞溶液遇碱溶液变红
条件:碱必须可溶
(2)碱与某些非金属氧化物反应
条件:反应物得碱必须可溶且不就是所有非金属氧化物都能碱反应 表达式:碱+非金属氧化物→盐+ H2O 比如:CO 2+2NaO H===Na 2CO 3+H2O
CO 2+C a(OH)2 ===CaCO 3↓+H 2O S O3+2NaOH ===Na 2SO 4+H2O
CO+ NaOH/Ca(OH)2不能反应 (3)酸与碱反应 (见酸得化学性质) (4)碱与盐反应
①与含铵根(NH 4)得盐反应 条件:反应物得碱必须可溶
表达式:碱+含铵根(N H4)盐→新盐+H 2O+NH 3↑ (复分解反应) 比如:C a(OH )2+2NH 4Cl == Ca Cl2+2H2O+2N H3↑
Ca (OH)2+(N H4)2SO 4== CaS O4+2H 2O+2NH 3↑ Na OH+NH 4N O3== NaNO 3+H 2O+NH 3↑
Mg(OH )2+NH 4N O3不能反应,因反应物碱Mg (OH )2不溶 ②与不含铵根(NH 4)得盐反应
条件:反应物得碱与盐都必须可溶,且生成物至少有一种沉淀生物 表达式:碱+盐→新碱+新盐 (复分解反应) 比如:2NaOH+C uSO 4===N a2SO 4+C u(OH)2↓
FeCl 3+3Na OH ===Fe(OH)3↓+3NaCl Ca(OH )2+Na 2CO 3=== CaCO 3↓+2NaOH C u(O H)2+Na 2SO 4=== CuS O4↓+2NaOH 2KOH+ Mg Cl 2=== 2KCl+ Mg(OH)2↓
Al(OH)3+CuSO 4不能反应,因为反应物得碱Al(OH)3不溶 Ca CO 3+NaOH 不能反应,因为反应物得盐C aCO 3不溶
N aOH+KNO 3不能反应,因为虽然反应物得盐与碱都可溶,但就是交换成分后,生成
物没有沉淀、H 2O、气体生成 三、盐得化学性质
1、盐得通性:盐→金属离子+酸根离子
2、常见得盐:氯化钠N aC l NaC l→N a++C l-
氯化铵NH 4Cl NH 4Cl →NH 4++Cl - 碳酸钠Na 2CO 3 Na 2CO 3→Na ++ C O32- 硝酸钙Ca(NO 3)2 Ca (N O3)2→Ca 2++NO 3-
3、盐得化学性质归纳 (1)盐与某些金属反应
条件:反应物得盐必须可溶且金属得活动性在盐中金属元素活动性得前面 表达式:金属+盐→新金属+新盐 (置换反应) 比如:Fe +C uSO 4===Fe SO 4+C u
Cu +2A gNO 3===2A g+Cu(NO 3)2
Cu+MgSO 4不能反应,因为虽然反应物盐MgSO 4可溶,但C u得活动性在Mg 得后面 Fe+AgCl 不能反应,因为虽然Fe 得活动性在Ag 得前面,但反应物盐AgCl 不溶 Fe+Z n2CO 3不能反应,因为反应物盐Zn 2CO 3不溶且Fe 得活动性在Zn 得后面
(2)酸与盐反应(同酸得化学性质) (3)碱与酸反应(同碱得化学性质) (4)盐与盐反应
条件:反应物得两种盐必须可溶且生物得新盐必须有一种沉淀生成 表达式:盐1+盐2→新盐1+新盐2 (复分解反应) 比如:AgNO 3+Na Cl===A gCl ↓+N aNO 3
BaC l2+Na2SO 4=== B aS O4↓+2NaCl
C aCO 3+NaC l不能反应,因为反应物盐CaC O3不溶
Ba SO 4+Ag Cl 不能反应,因为反应物两种盐Ca CO 3与AgC l都不溶
KNO 3+ NaCl 不能反应,因为虽然反应物两种盐KNO 3+ Na Cl 都可溶,但交换成
分后没有一种沉淀生成
五、复分解反应归纳(五类) 1、酸、碱、盐复分解反应归纳
(1)酸与某些金属氧化物反应 表达式:酸+金属氧化物→盐+H 2O
(2)酸与碱反应 表达式:酸+碱→盐+H2O(又叫做中与反应)
(3)酸与盐反应 表达式:酸+含C O3/H CO3盐→新盐+H 2O+CO 2↑
酸+盐→新酸+新盐
(4)碱与盐反应 表达式:碱+含铵根(NH 4)盐→新盐+H 2O +NH 3↑
碱+盐→新碱+新酸
(5)盐与盐反应 表达式:盐1+盐2→新盐1+新盐2 2、复分解反应得条件:两种化合物互相交换成分,生成物中有沉淀或有气体或有水生成时,复分解反应才可以发生。
(AB+CD=A D+CB)
3、复分解反应得特点:复分解反应中每种元素得化合价在反应前后都不变。