氮元素及氮肥一培训材料
- 格式:ppt
- 大小:766.50 KB
- 文档页数:60


九年级化学氮肥知识点氮肥是一种常用的植物营养物质,对于农作物的生长发育起着至关重要的作用。
本文将介绍九年级学生所需了解的关于氮肥的基本知识点。
一、氮肥的定义和作用氮肥是指含有高浓度氮元素的化肥,它能够为植物提供充足的氮源,促进植物的生长。
氮肥的作用主要包括以下几个方面:1. 促进叶片生长:氮肥是构成植物叶绿素和蛋白质的重要原料,能够促进植物叶片的生长和光合作用效率。
2. 增加果实数量:氮肥能够促进植物生长,增加果实数量和均匀度。
3. 提高作物产量:作物在生长过程中需要大量的氮素,氮肥的施用能够满足植物对氮素的需求,进而提高作物的产量。
二、不同种类的氮肥1. 硝态氮肥:硝酸盐肥(如硝酸铵、硝酸钾)是常见的硝态氮肥。
硝态氮肥能够被植物快速吸收利用,但容易流失,需要注意正确施用。
2. 铵态氮肥:铵态氮肥(如铵硝、尿素)是常见的铵态氮肥。
铵态氮肥吸附力强,适合用于土壤pH偏酸的情况下。
3. 有机氮肥:有机氮肥是以有机物质为原料加工而成的氮肥,如腐熟的动植物残体和粪便。
有机氮肥施用后需进行分解,释放出有效氮元素供植物吸收利用。
三、氮肥的施用方法与注意事项1. 施肥时间:氮肥的施用应根据不同作物的需求和生长阶段进行合理安排。
通常在作物生长初期和追肥期进行施用效果较好。
2. 施肥量:施肥量的多少需要根据不同作物和土壤的要求来确定,过少会导致氮素不足,过多则容易造成浪费和环境污染。
3. 施肥方式:根据不同作物和土壤的特点,可采用基肥、追肥、叶面喷施等不同的施肥方式。
4. 施肥技巧:在施用氮肥时,避免与种子直接接触,以免烧伤作物。
另外,施用硝态氮肥时要注意避光防潮,以减少氮素损失。
四、氮肥的环境影响与解决方法1. 氮肥过量使用会导致土壤酸化、地下水污染等环境问题。
因此,合理掌握施肥量,避免过量使用氮肥是非常重要的。
2. 利用农家肥、有机肥等替代化学氮肥,可以有效降低氮肥的使用量,并且对环境影响较小。
3. 在氮肥施用前进行土壤质量检测,了解土壤的氮素含量和作物的需求,有针对性地施用化肥。

《氮及其化合物》学历案一、学习目标1、了解氮元素在自然界中的存在形式和氮循环的基本过程。
2、掌握氮气的性质,包括物理性质和化学性质。
3、理解氮的氧化物(一氧化氮、二氧化氮)的性质、生成和转化。
4、熟悉氨的性质、制备方法和用途。
5、掌握硝酸的性质和用途。
6、了解常见的氮肥及其使用注意事项。
二、知识梳理(一)氮元素在自然界中的存在氮元素是地球上含量丰富的元素之一,在自然界中主要以氮气的形式存在于大气中。
氮气约占空气体积的 78%。
此外,氮还存在于动植物体内的蛋白质、土壤中的硝酸盐和铵盐等物质中。
氮循环是自然界中氮元素在不同物质之间转化和转移的过程。
氮气通过生物固氮、工业固氮和雷电固氮等方式转化为含氮化合物,这些含氮化合物又通过动植物的代谢、分解等过程回到大气中,形成氮的循环。
(二)氮气1、物理性质氮气是一种无色、无味、无毒的气体,密度比空气略小,难溶于水。
在标准状况下,氮气的沸点为-1958℃,熔点为-2098℃。
2、化学性质(1)稳定性氮气分子中存在氮氮三键,键能很大,所以氮气的化学性质很稳定,在通常情况下不易与其他物质发生反应。
(2)与氧气的反应在放电或高温条件下,氮气能与氧气反应生成一氧化氮:N₂+O₂= 2NO(放电或高温)(3)与氢气的反应氮气和氢气在高温、高压、催化剂的条件下可以发生反应生成氨气:N₂+ 3H₂⇌ 2NH₃(高温、高压、催化剂)(三)氮的氧化物1、一氧化氮(NO)(1)物理性质一氧化氮是一种无色、无味、难溶于水的有毒气体。
(2)化学性质具有还原性,易被氧气氧化为二氧化氮:2NO + O₂= 2NO₂2、二氧化氮(NO₂)(1)物理性质二氧化氮是一种红棕色、有刺激性气味、易溶于水的有毒气体。
(2)化学性质①与水反应:3NO₂+ H₂O = 2HNO₃+ NO②自身化合:2NO₂⇌ N₂O₄(四)氨1、物理性质氨气是一种无色、有刺激性气味的气体,密度比空气小,极易溶于水(1:700),易液化。

《氮及其化合物》学历案一、学习目标1、了解氮元素在自然界中的存在形式,认识氮的固定对人类生产生活的重要意义。
2、掌握氮气的性质,包括物理性质和化学性质。
3、理解氮的氧化物(一氧化氮、二氧化氮)的性质、生成和转化。
4、掌握氨气的性质,包括物理性质、化学性质以及氨气的实验室制法。
5、了解硝酸的性质,包括强氧化性等。
二、学习重难点1、重点(1)氮气的化学性质。
(2)氮的氧化物的性质及相互转化。
(3)氨气的化学性质和实验室制法。
(4)硝酸的强氧化性。
2、难点(1)氮的氧化物与水反应的计算。
(2)有关氨气和硝酸的化学计算。
三、知识梳理(一)氮元素在自然界中的存在氮元素在自然界中主要以氮气的形式存在于大气中,此外还以硝酸盐等形式存在于土壤和水体中。
(二)氮气1、物理性质氮气是一种无色、无味、难溶于水的气体,密度略小于空气。
2、化学性质(1)氮气分子中存在氮氮三键,键能很大,所以氮气的化学性质很稳定。
但在一定条件下,氮气也能发生化学反应。
(2)氮气与氧气在放电条件下反应生成一氧化氮:N₂+ O₂=放电= 2NO(3)氮气与氢气在高温高压、催化剂的条件下合成氨:N₂+3H₂⇌高温高压催化剂 2NH₃(三)氮的氧化物1、一氧化氮(NO)(1)物理性质:无色、无味的气体,难溶于水。
(2)化学性质:极易与氧气反应生成二氧化氮,2NO + O₂=2NO₂2、二氧化氮(NO₂)(1)物理性质:红棕色、有刺激性气味的气体,易溶于水。
(2)化学性质①与水反应:3NO₂+ H₂O = 2HNO₃+ NO②二氧化氮自身发生化合反应生成四氧化二氮:2NO₂⇌ N₂O₄(四)氨气1、物理性质氨气是一种无色、有刺激性气味的气体,极易溶于水,常温常压下1 体积水大约能溶解 700 体积氨气。
2、化学性质(1)与水反应:NH₃+ H₂O ⇌ NH₃·H₂O ⇌ NH₄⁺+ OH⁻,溶液显碱性。
(2)与酸反应:NH₃+ HCl = NH₄Cl(产生白烟)(3)还原性:4NH₃+ 5O₂=催化剂△= 4NO + 6H₂O3、氨气的实验室制法(1)反应原理:2NH₄Cl + Ca(OH)₂=△= CaCl₂+ 2NH₃↑ +2H₂O(2)发生装置:固体与固体加热制气体的装置。

九年级下册化学氮肥知识点化学氮肥是一种重要的农业肥料,对促进农作物的生长和提高产量起着关键作用。
在九年级化学课程中,学生需要掌握与氮肥相关的基本概念、生产过程、应用方法以及与之相关的环境问题。
以下是九年级下册化学氮肥知识点的详细介绍:一、氮肥的概念氮肥是一种为农作物提供氮元素的肥料。
氮是构成植物生命必需的元素之一,对于植物的生长发育、蛋白质合成等过程至关重要。
氮肥通常包含了可被植物吸收和利用的氮化合物,如尿素、铵态氮、硝态氮等。
二、氮肥的生产过程1. 合成氨:合成氨是氮肥的基础原料。
它是通过哈伯-玻兹曼过程将氮气(来自空气)和氢气(来自天然气或煤炭)在高温高压条件下反应生成的。
合成氨是氮肥工业中最重要的产物之一。
2. 氮肥的制备:在制备氮肥的过程中,合成氨与其他物质反应,生成不同类型的氮肥产品。
例如,尿素是通过合成氨与二氧化碳反应得到的;铵态氮肥是通过合成氨与酸性物质(如硫酸)反应得到的;硝态氮肥则是通过将合成氨氧化成硝酸盐而得到的。
三、常见的氮肥产品1. 尿素:尿素是一种含有46%氮的有机氮肥,是世界上使用最广泛的氮肥之一。
它可溶于水,便于植物吸收利用,适用于各种农作物的施肥。
2. 铵态氮肥:铵态氮肥主要包括铵硫酸、铵硝酸等,它们能够提供植物所需的铵态氮。
铵态氮肥在土壤中相对稳定,不易挥发和流失。
3. 硝态氮肥:硝态氮肥主要包括硝酸铵和硝酸盐等,它们能够提供植物所需的硝态氮。
硝态氮肥易溶于水,在土壤中吸附力较小,容易流失,因此施用时需要注意控制用量。
四、氮肥的施用方法1. 基础追肥:氮肥的基础追肥是在作物播种或移栽前施用,以提供作物生长初期所需的氮元素。
一般选择相对稳定的氮肥产品,如铵态氮肥。
2. 播种追肥:播种追肥是在作物播种或移栽后的一段时间内进行的追肥,以满足作物生长发育的氮需求。
可选择合适的氮肥产品,如尿素或铵态氮肥。
3. 分蘖追肥:对一些需要分蘖生长的作物(如玉米)来说,适时的分蘖追肥能够促进作物分蘖和茎叶生长。





《氮肥基础知识综合性概述》一、引言氮是植物生长发育所必需的大量营养元素之一,在农业生产中起着至关重要的作用。
氮肥作为提供植物氮素营养的重要肥料来源,对提高农作物产量和品质有着不可替代的地位。
本文将全面深入地介绍氮肥的基础知识,包括基本概念、核心理论、发展历程、重要实践以及未来趋势,为读者提供一个对氮肥的系统认识。
二、氮肥的基本概念1. 定义氮肥是指以氮为主要养分的化肥,其作用是为植物提供生长所需的氮元素。
氮在植物体内主要以氨基酸、蛋白质、核酸等有机化合物的形式存在,参与植物的生长、发育、代谢等生理过程。
2. 分类(1)按含氮基团可分为铵态氮肥、硝态氮肥、酰胺态氮肥等。
- 铵态氮肥:如硫酸铵、氯化铵等,铵离子易被土壤胶体吸附,不易流失,但在碱性土壤中易挥发。
- 硝态氮肥:如硝酸铵、硝酸钠等,硝态氮易溶于水,在土壤中移动性强,易被植物吸收,但在水田中易流失。
- 酰胺态氮肥:如尿素,含氮量高,肥效持久,是目前使用最广泛的氮肥之一。
(2)按生产方法可分为合成氮肥、天然氮肥等。
- 合成氮肥:通过化学合成方法生产的氮肥,如尿素、碳酸氢铵等。
- 天然氮肥:如厩肥、堆肥等有机肥中含有的氮素,以及豆科植物根瘤菌固定的氮等。
3. 主要成分及性质(1)铵态氮肥:含有铵离子,呈白色或浅色结晶,易溶于水,吸湿性强,在空气中易潮解。
(2)硝态氮肥:含有硝酸根离子,多为无色或白色结晶,易溶于水,吸湿性较小。
(3)酰胺态氮肥:主要成分是尿素,为白色结晶,易溶于水,在土壤中需经过脲酶的作用转化为铵态氮才能被植物吸收。
三、氮肥的核心理论1. 植物对氮的需求植物生长需要大量的氮素,氮是构成蛋白质、核酸、叶绿素等重要有机化合物的组成元素。
蛋白质是细胞的重要组成部分,参与植物的生长、发育和代谢;核酸是遗传物质,控制着植物的生长和繁殖;叶绿素是光合作用的重要色素,氮素供应充足时,植物叶片浓绿,光合作用强,有利于提高农作物产量和品质。
2. 氮肥的作用机理氮肥施入土壤后,通过以下几种方式为植物提供氮素营养:(1)直接被植物根系吸收:铵态氮和硝态氮可以直接被植物根系吸收,进入植物体内参与代谢过程。
第一章《氮族元素》备课材料一、新教材内容安排与教学目标从知识内容上看,本章可分为三部分。
第一部分是章引言及第一、二、三节,介绍氮族元素的单质及其化合物的知识。
第二部分是第四节,介绍氧化还原反应方程式的配平方法。
第三部分是第五节,介绍有关化学方程式的计算。
㈠内容变化1、增加的内容⑴增加相当数量的插图(包括演示实验示意图及其它图示等)。
⑵增加环保知识“光化学烟雾”。
⑶增加“红磷转变成白磷”的演示实验。
⑷增加“铵盐与碱的反应及铵离子的检验”的演示实验。
⑸增加用浓氨水制氨气的内容。
⑹增加氧化还原反应的离子方程式配平内容。
⑺增加“有关化学方程式的计算”一节内容。
⑻增加阅读材料《玻尔的诺贝尔金质奖章》和资料《砷的发现》。
2、删减的内容⑴删减氮气与镁的反应。
⑵删减白磷的分子组成与结构。
⑶删减“白磷和红磷的着火点的比较”的演示实验。
⑷删减五氧化二磷的部分性质、偏磷酸和磷酸的部分性质和工业制法。
⑸删减硝酸的实验室制法和工业制法。
⑹删减同素异形体的概念。
3、变更的内容⑴将“氮族元素”一节改作章引言。
⑵将磷的知识内容删减后与氮合为一节。
⑶将旧教材第一章“磷与氯气反应”的内容放在本章磷的内容里。
⑷将“安全火柴”作为资料,“氮的固定”作为阅读材料“自然界中氮的循环”,“亚硝酸钠”作为选学内容“亚硝酸盐的用途及对人体的危害”。
⑸将“氨的实验室制法”改成了讨论内容。
⑹改进了“铜分别与浓、稀硝酸反应”的演示实验。
⑺将旧教材第一章“有一种反应物过量时的计算”安排于本章。
⑻新材料增设了“思考题”改变了以往教材编写演示实验的方法,增加了学生的活动量。
*建议:⑴考虑到铵盐用途的广泛性,建议在铵盐的用途中补上硝铵用作炸药,氯化铵用作焊药的内容。
⑵教材中图1-14“铵盐与碱的反应”,试纸接触试管口的画法不妥,建议改作接近试管口。
4、必修本情况第二册化学必修本第一章为《氮和氮的化合物》,与必修加选修本相比,删去了磷元素部分、氧化还原反应方程式的配平和有关化学方程式的计算,以及氮元素及其化合物知识中的某些讨论题和思考题。
《氮及其化合物》学历案一、学习目标1、了解氮元素在自然界中的存在形式以及氮的固定。
2、掌握氮气的性质,包括物理性质和化学性质。
3、理解氮的氧化物(一氧化氮、二氧化氮)的性质及其相互转化。
4、熟悉氨的性质,包括物理性质、化学性质以及氨的实验室制法。
5、掌握硝酸的性质,包括强氧化性等。
二、知识梳理(一)氮元素在自然界中的存在氮元素是生命活动中不可或缺的元素之一。
在自然界中,氮主要以氮气(N₂)的形式存在于大气中,约占空气体积的 78%。
此外,氮还以硝酸盐、铵盐等化合物的形式存在于土壤和水体中。
(二)氮气(N₂)1、物理性质氮气是一种无色、无味、难溶于水的气体,密度略小于空气。
2、化学性质(1)氮气的化学性质很不活泼,通常情况下不易与其他物质发生化学反应。
但在一定条件下,如高温、高压、放电等,氮气能与氢气、氧气等发生反应。
(2)氮气与氢气反应生成氨气(N₂+ 3H₂⇌ 2NH₃),这是工业合成氨的重要反应。
(3)氮气与氧气在放电条件下生成一氧化氮(N₂+ O₂=2NO)。
(三)氮的氧化物1、一氧化氮(NO)(1)物理性质:无色、无味的气体,难溶于水。
(2)化学性质:具有还原性,易被氧气氧化为二氧化氮(2NO +O₂= 2NO₂)。
2、二氧化氮(NO₂)(1)物理性质:红棕色、有刺激性气味的气体,易溶于水。
(2)化学性质:二氧化氮与水反应生成硝酸和一氧化氮(3NO₂+ H₂O = 2HNO₃+ NO)。
(四)氨(NH₃)1、物理性质氨气是一种无色、有刺激性气味的气体,极易溶于水,常温常压下1 体积水大约能溶解 700 体积氨气。
2、化学性质(1)氨气与水反应生成一水合氨(NH₃+H₂O ⇌NH₃·H₂O),一水合氨部分电离出铵根离子(NH₄⁺)和氢氧根离子(OH⁻),使溶液呈碱性。
(2)氨气与氯化氢气体反应生成氯化铵(NH₃+ HCl =NH₄Cl),产生白烟。
(3)氨气具有还原性,能被氧气催化氧化(4NH₃+ 5O₂= 4NO + 6H₂O)。
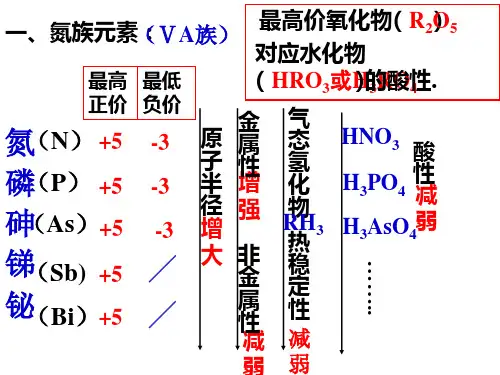
化学第三章第三节氮1---氮族元素、氮气导学案教学目标1、了解氮族元素及其递变情况。
2、了解氮气与氢气、氧气的反应。
复习回顾同主族元素的性质递变规律:课堂学习(阅读课本P52-P53,完成下列问题)一、氮族元素:1、氮族元素包括、、、、。
位于元素周期表中族,其最外层电子数都是,其最高价氧化物的化学式,气态氢化物的化学式是。
2、从氮到铋,核电荷数逐渐,原子半径逐渐,原子核对外层电子的吸引力逐渐,因此原子得电子能力逐渐,失电子能力逐渐,即:元素的非金属性逐渐;金属性逐渐。
3、N元素最高价含氧酸的化学式为,而P和As的分别为和。
4、氮族元素的非金属性比同周期的卤族、氧族,其最高价含氧酸的酸性也比同周期的卤族、氧族。
1二、氮气:1、氮元素的存在状态:氮气中的氮元素是以形式存在的,而硝酸、硝酸钾、氮的氧化物、氨气、蛋白质、核酸中的氮元素则是以形式存在的。
2、氮气的物理性质:氮气是一种色味的气体,供给人类及动物呼吸,密度比空气稍,在100KPa-195.8°C时变为,-209.8°C时变为。
3、氮气的化学性质:⑴与氢气反应:H2 + N2---- NH3此反应工业上用于。
②与氧气反应N2+ O2 ---- NO(色气体)4、氮的氧化物与大气污染:NO+ O2 ---- NO2(色气体)NO2+ H2O ---- HNO3 + NO2小结:雷雨发庄稼的原因:;氮的氧化物随雨雪降落地面,会形成也因此。
氮的氧化物都有毒,都是大气污染物,其中,是造成光化学污染的原因。
及时练习:一、选择题1.下列关于NO的说法正确的是( )A.NO是红棕色气体 B.常温下氮气与氧气反应可生成NO C.NO溶于水可以生成硝酸 D.NO是汽车尾气的有害成分之一2.下列气体中,既可用浓硫酸干燥,又可用固体NaOH干燥的是( )A.Cl2 B.SO2 C.O2 D.NH33.起固定氮作用的化学反应是: ( )A、N2与H2在一定条件下反应生成NH3;B、NO与O2反应生成NO2;C、NH3经催化氧化生成NO;D、由NH3制碳铵和硫铵。
氮肥的种类培训课件
近20年,商品肥料消费量的增加已引起美国和其他国家的重视,其引人注目的原因主要是上述的氮肥生产厂家效率高,且向农民提供的氮肥价格低。
广义地讲,氮肥可分为天然有机氮肥和化学氮肥。
天然有机肥来自植物和动物,化肥却不来自动植物。
1850年以前,美国使用的全部氮肥实际上都是天然有机物质,而1978~1980年,有机肥仅占美国氮肥总用量的1%或更少。
虽然仍有少量这种专用肥料应用于草坪、花园、灌木和烤烟,但它只保留了历史的意义。
天然有机物质中含氮量平均为l%^13%o
一度认为,天然有机物质缓慢释出氮。
因此,可按照作物的需要供氮,这样既避免了植物吸收过多,又防止了淋洗和反硝化造成氮的潜在损失。
但事实并非如此,因为大部分转变成有效态的氮在头21天内就已淋失或反硝化损失掉。
在适宜硝化作用的条件下,第105天末最多只有一半氮能转变成植物有效态,而这105天矿化的氮中有80%在头21天就转
化成NO3o显然,在温暖湿润的条件下,有机质不可能缓慢释放氮,转变成作物有效态的数量也只不过是其所含总氮量的一部分。
合成肥料或化学肥料是最重要的氮肥来源。
液氨几乎是其他所有化学氮肥的基本材料。
世界上大部分氨是由氮气和氢气反应合成的,虽然也有一部分是回收的煤炭炼焦副产品,第十章将讨论氮肥和其他肥料的生产原理。
由氮的基本化合物NL可生产很多种氮肥,也有几种氮肥并不源于合成氨,但其在世界上所有氮肥中占很小比例。
为了方便起见,把各种氮肥分成四类:氨态、硝态、缓效态和其他类型。
一些常见的化学氮肥成分列于表5-11。