化学反应工程例题
- 格式:doc
- 大小:144.50 KB
- 文档页数:4

化学反应工程习题第一部分:均相反应器基本理论1、试分别写出N 2+3H 2=2NH 3中用N2、H 2、NH 3的浓度对时间的变化率来表示的该反应的速率;并写出这三种反应速率表达式之间的关系。
2、已知某化学计量式为S R B A 2121+=+的反应,其反应速率表达式为B AA C C r 5.02=,试求反应速率B r =?;若反应的化学计量式写成S R B A +=+22,则此时反应速率A r =?为什么?3、某气相反应在400 oK 时的反应速率方程式为221061.3AA P d dP -⨯=-τh kPa /,问反应速率常数的单位是什么?若将反应速率方程改写为21AA A kC d dn V r =⨯-=τh l mol ./,该反应速率常数k 的数值、单位如何?4、在973 oK 和294.3×103Pa 恒压下发生下列反应:C 4H 10→2C 2H 4+H 2 。
反应开始时,系统中含丁烷为116kg ,当反应完成50%时,丁烷分压以235.4×103Pa /s 的速率发生变化,试求下列项次的变化速率:(1)乙烯分压;(2)H 2的摩尔数;(3)丁烷的摩尔分率。
5、某溶液反应:A+B →C ,开始时A 与B 摩尔数相等,没有C ,1小时后A 的转化率为75%,当在下列三种情况下,2小时后反应物A 尚有百分之几未反应掉? (1)对A 为一级、B 为零级反应; (2)对A 、B 皆为一级反应; (3)对A 、B 皆为零级反应。
6、在一间歇反应器中进行下列液相反应: A + B = R A + R = S已知原料组成为C A0 = 2 kmol/m 3,C B0 = 4 kmol/m 3,C R0 = C S0 = 0。
反应混合物体积的变化忽略不计。
反应一段时间后测得C A = 0 .3 kmol/m 3,C R = 1.5 kmol/m 3。
计算这时B 和S 的浓度,并确定A 的转化率、生成R 的选择性和收率。

1. 当计量方程中计量系数的代数和等于零时,这种反应称为_______,否则称为_______。
(等分子反应、非等分子反应)2. 化学反应速率式为(-r A )=kC AαC Bβ,用浓度表示的速率常数为Kc,假定符合理想气体状态方程,如用压力表示的速率常数Kp,则Kc=_______Kp。
((RT)α+β)3. 化学反应的总级数为n,如用浓度表示的速率常数为Kc,用逸度表示的速率常数Kf,则Kc=_______Kf。
((RT)n)4. 化学反应的总级数为n,如用浓度表示的速率常数为Kc,用气体摩尔分率表示的速率常数Kp,则Kc=_______Kp。
((RT/P)n)5.在构成反应机理的诸个基元反应中,如果有一个基元反应的速率较之其他基元反应慢得多,他的反应速率即代表整个反应的速率,其他基元反应可视为处于_______。
(拟平衡常态)6.当构成反应机理的诸个基元反应的速率具有相同的数量级时,既不存在速率控制步骤时,可假定所有各步基元反应都处于_______。
(拟定常态)7. 活化能的大小直接反映了______________对温度的敏感程度。
(反应速率)8. 一个可逆的均相化学反应,如果正、逆两向反应级数为未知时,采用______________法来求反应级数。
(初始速率法)9.生成主产物的反应称为_______,其它的均为_______。
(主反应、副反应)10. 平行反应均为一级不可逆反应,若E主>E副,选择性Sp与_______无关,仅是_______的函数。
(浓度、温度)11. 如果平行反应均为一级不可逆反应,若E主>E副,提高选择性Sp应______________ _。
(提高温度)12. 一级连串反应在全混流釜式反应器中,则目的产物P的最大浓度C p,max=______、τopt______。
(、)13. 一级连串反应在平推流反应器中,则目的产物P的最大浓度C p,max=______、τopt______。

化学反应工程试题及答案一、选择题(每题2分,共10分)1. 化学反应工程中,反应速率常数k与温度的关系遵循()。
A. Arrhenius方程B. Van't Hoff方程C. Le Chatelier原理D. Nernst方程2. 在固定床反应器中,流体通过催化剂床层的流动方式是()。
A. 并流B. 逆流C. 交叉流D. 层流3. 以下哪种催化剂不属于均相催化剂?()A. 酸B. 碱C. 金属D. 酶4. 反应器的体积效率是指()。
A. 反应器体积与所需反应体积的比值B. 反应器体积与实际反应体积的比值C. 反应器体积与理论反应体积的比值D. 反应器体积与催化剂体积的比值5. 在反应器设计中,为了提高反应速率,通常采取的措施是()。
A. 增加反应物浓度B. 提高反应温度C. 增加催化剂用量D. 以上都是二、填空题(每空1分,共10分)1. 在化学反应工程中,反应速率的表达式通常为__________。
2. 反应器的类型主要包括__________、__________和__________。
3. 催化剂的作用是__________反应速率,而不影响__________。
4. 反应器设计时,需要考虑的主要因素包括__________、__________和__________。
5. 根据反应器内物料流动的特点,可以将反应器分为__________流动和__________流动。
三、简答题(每题5分,共20分)1. 简述反应速率和反应速率常数的区别。
2. 描述固定床反应器和流化床反应器的主要区别。
3. 解释为什么在某些情况下需要使用催化剂。
4. 讨论温度对化学反应速率的影响及其在工业应用中的意义。
四、计算题(每题10分,共20分)1. 已知某化学反应的速率常数k=0.05 s^-1,反应物A的初始浓度为1 mol/L,求10秒后A的浓度。
2. 假设一个完全混合反应器中进行一级反应,反应物B的初始浓度为2 mol/L,反应速率常数k=0.02 min^-1,求5分钟后B的浓度。

《化学反应工程》试题二、计算分析题1. 在恒容条件下,反应A+2B==R ,原料气组成为C A0=C B0=100kmol /m 3,计算当C B =20 kmol /m 3时,计算反应转化率x A 、x B 及各组分的浓度。
解:在恒容条件下:x B =( C B0- C B )/ C B0=0.8由C A0- C A =( C B0- C B )/2得到:C A =20 kmol /m 3=60 kmol /m 3x A =( C A0- C A )/ C A0=0.42. 在恒压条件下,反应A+2B==R ,原料气组成为C A0=C B0=100kmol /m 3,计算当C B = 20 kmol /m 3时,反应转化率x A 、x B 及各组分的浓度。
解:δB =(1-1-2)/2=-1;y B0=0.5 n =n 0(1+ y B0δB x B ) = n 0(1-0.5 x B )在恒压条件下:V =V 0 n /n 0= V 0(1-0.5x B )C B =n B /V= n B0(1- x B )/[V 0(1-0.5x B )]= C B0(1- x B )/ (1-0.5x B ) x B =8/9n A0- n A =( n B0- n B )/2 x A =( n A0- n A )/ n A0=( n B0- n B )/(2 n A0)= ( n B0- n B )/(2 n B0)=0.5 x B =4/93. 串联-平行反应A+B==R ,A+R==S ,原料中各组分的浓度为C A0=2.0mol /L ,C B0=4.0 mol /L ,C R0=C S0=0,在间歇反应器中恒容操作一定时间后,得到C A =0.3mol /L ,C R =1.5 mol /L ,计算此时组分B 和S 的浓度。
解:在恒容条件下:ΔC A1= C B0-C B ;ΔC A2= C S ;C R = (C B0-C B )-C S ;C A0-C A =ΔC A1+ΔC A2得到:C S =( C A0-C A - C R )/2=(2.0-0.3-1.5)/2=0.1 mol /L C B = C B0- C R -C S =4.0-1.5-0.1=2.4 mol /L 4. 在间歇反应器中进行等温2级、1级、0级均相反应,分别求出转化率由0至0.9所需的时间与转化率由0.9至0.99所需时间之比。

题目:全混流连续操作反应器,反应器内温度、浓度处处均匀一致,故所有物料粒子在反应器内的停留时间相同。
正确答案:错题目:相同条件下,分别用下列反应器处理物料,比较反应器有效容积的大小。
①单段全混流反应器(V R1)②四个体积相同的全混流反应器串联(V R2)③两个体积相同的全混流反应器串联(V R3)④平推流反应器(V R4)则(V R4)>(V R2)>(V R3)>(V R1)正确答案:错题目:设备放大,造成微元停留时间分布和返混程度改变,放大时反应结果恶化。
正确答案:对题目:生产能力是相同条件下,单位时间、单位反应器体积所能获得的(产物量),或完成相同生产任务,所需反应器的(体积)。
题目:化工生产中应用于均相反应过程的化学反应器主要有(釜式)反应器和(管式)反应器。
题目:釜式反应器的基本结构主要包括反应器(壳体)、(搅拌器)、(密封装置)和(换热装置)等。
题目:手孔或人孔的安设是为了检查(内部空间)以及安装和拆卸设备(内部构件)。
题目:釜式反应器中夹套式换热器适用于传热面积(较小),传热介质压力(较低)的情况。
题目:基元反应的级数即为化学反应式的(计量系数),对非基元反应的级数通过(实验)确定。
题目:单一反应利用(转化率)可以确定反应物转化量与产物生成量之间的关系。
题目:间歇反应,只要C AO相同,无论处理量多少,达一定(转化率)每批所需的(反应时间)相同。
题目:对同一反应在相同条件下,达到相同转化率,全混釜反应器所需有效体积(最大),平推流反应器所需有效体积(最小),多釜串联全混釜所需有效体积(介于其间)。
题目:一级不可逆反应,其反应速率方程为(-r A =kC A a ),反应时间与转化率的关系为(kt )x 11ln(A =-)。
题目:复合反应动力学为由两个以上(化学反应计量式)或(动力学方程式)表示的化学反应过程。
题目:间歇釜式反应器有效体积不但与(反应时间)有关,还与(非生产时间)有关。

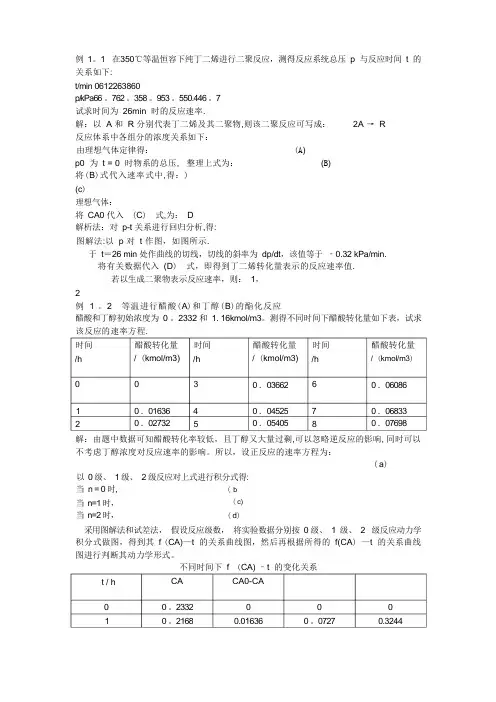
例1.1 在350℃等温恒容下纯丁二烯进行二聚反应,测得反应系统总压 p 与反应时间 t 的关系如下:t/min 0 6 12 26 38 60p/kPa 66.7 62.3 58.9 53.5 50.4 46.7 试求时间为 26min 时的反应速率。
解:以 A 和 R 分别代表丁二烯及其二聚物,则该二聚反应可写成: 2A → R 反应体系中各组分的浓度关系如下: 由理想气体定律得: (A)p0 为 t = 0 时物系的总压, 整理上式为:(B)将(B )式代入速率式中,得:) (c)理想气体: 将 CA0 代入 (C) 式,为: D解析法:对p-t 关系进行回归分析,得:图解法:以 p 对 t 作图,如图所示。
于t =26 min 处作曲线的切线,切线的斜率为 dp/dt ,该值等于‐0.32 kPa/min 。
将有关数据代入 (D) 式,即得到丁二烯转化量表示的反应速率值。
若以生成二聚物表示反应速率,则:1,2 例1.2 等温进行醋酸(A)和丁醇(B)的酯化反应 醋酸和丁醇初始浓度为0.2332和1.16kmol/m3。
测得不同时间下醋酸转化量如下表,试求时间 /h 醋酸转化量 /(kmol/m3) 时间 /h醋酸转化量 /(kmol/m3) 时间 /h醋酸转化量 /(kmol/m3) 0 0 3 0.03662 6 0.06086 1 0.01636 4 0.04525 7 0.06833 20.0273250.0540580.07698000000()/2()/2A A A A A A A t t t C C C C C C C ==-+原 料产 物总浓度000()/2A A A C pC C p =+021AA pC C p ⎛⎫=- ⎪⎝⎭002A A A C dCdp r dt p dt -=-=-⋅00/A C p RT=2A A dC dp r dt RT dt-=-=-⋅22.90exp 43.6430.45t p ⎛⎫=-+⎪⎝⎭22.90exp 30.4530.45dp t dt ⎛⎫=-- ⎪⎝⎭26min ,0.32/min dpt kPa dt==-4322(0.32)8.314(350273.15)1.2410/(min)A dp r RT dt kmol m --=-⋅=-⨯-⨯+=⨯⋅536.210/(min)2A R r r kmol m --===⨯⋅3493492CH COOH C H OH CH COOC H H O+⇔+解:由题中数据可知醋酸转化率较低,且丁醇又大量过剩,可以忽略逆反应的影响,同时可以不考虑丁醇浓度对反应速率的影响。

t/min 0 6 12 26 38 60p/kPa试求时间为 26min 时的反应速率。
解:以 A 和 R 分别代表丁二烯及其二聚物,则该二聚反应可写成:2A → R 反应体系中各组分的浓度关系如下:由理想气体定律得:(A)p0 为 t = 0 时物系的总压,整理上式为:(B)将(B)式代入速率式中,得:)(c)理想气体:将 CA0 代入 (C) 式,为:D解析法:对p-t关系进行回归分析,得:图解法:以 p 对 t 作图,如图所示。
于t=26 min 处作曲线的切线,切线的斜率为 dp/dt,该值等于‐ kPa/min。
将有关数据代入 (D) 式,即得到丁二烯转化量表示的反应速率值。
若以生成二聚物表示反应速率,则:1,2例等温进行醋酸(A)和丁醇(B)的酯化反应醋酸和丁醇初始浓度为和m3。
测得不同时间下醋酸转化量如下表,试求该反应的速率方程。
解:由题中数据可知醋酸转化率较低,且丁醇又大量过剩,可以忽略逆反应的影响,同时可以不考虑丁醇浓度对反应速率的影响。
所以,设正反应的速率方程为:(a)以0级、1级、2级反应对上式进行积分式得:当n = 0时, (b当n=1时, (c)当n=2时, (d)采用图解法和试差法,假设反应级数,将实验数据分别按 0 级、1 级、2 级反应动力学积分式做图,得到其 f(CA)-t 的关系曲线图,然后再根据所得的 f(CA)-t 的关系曲线图进行判断其动力学形式。
不同时间下 f (CA)–t 的变化关系零级反应和一级反应的 f (CA) – t 的关系图如对t作图得一直线,则说明假设正确,由此可知反应级数 n=2。
但丁醇浓度是否存在影响,还需做进一步实验证明。
对 t 作图为一直线,则说明 n =2 是正确的,故该反应对醋酸为二级反应,从直线的斜率可以求得在此温度下包含丁醇浓度的 k’值。
而丁醇的反应级数 m 可以用保持醋酸浓度不变的方法求得,二者结合可以求得反应在此温度下的速率常数 k。
例 1。
1 在350℃等温恒容下纯丁二烯进行二聚反应,测得反应系统总压 p 与反应时间 t 的 关系如下:t/min 0612263860p/kPa66 。
762 。
358 。
953 。
550.446 。
7试求时间为 26min 时的反应速率.解:以 A 和 R 分别代表丁二烯及其二聚物,则该二聚反应可写成: 2A → R 反应体系中各组分的浓度关系如下:由理想气体定律得: (A ) p0 为 t = 0 时物系的总压, 整理上式为: (B ) 将(B )式代入速率式中,得:) (c )理想气体:将 CA0 代入 (C ) 式,为: D解析法:对 p-t 关系进行回归分析,得: 图解法:以 p 对 t 作图,如图所示.于 t =26 min 处作曲线的切线,切线的斜率为 dp/dt ,该值等于 ‐0.32 kPa/min. 将有关数据代入 (D ) 式,即得到丁二烯转化量表示的反应速率值.若以生成二聚物表示反应速率,则: 1, 2例 1 。
2 等温进行醋酸(A )和丁醇(B )的酯化反应醋酸和丁醇初始浓度为 0 。
2332 和 1. 16kmol/m3。
测得不同时间下醋酸转化量如下表,试求 该反应的速率方程.解:由题中数据可知醋酸转化率较低,且丁醇又大量过剩,可以忽略逆反应的影响, 同时可以 不考虑丁醇浓度对反应速率的影响。
所以,设正反应的速率方程为:(a )以 0 级、 1 级、 2 级反应对上式进行积分式得:当 n = 0 时,当 n=1 时,当 n=2 时,(b (c)(d )采用图解法和试差法, 假设反应级数, 将实验数据分别按 0 级、 1 级、 2 级反应动力学 积分式做图,得到其 f (CA)—t 的关系曲线图,然后再根据所得的 f(CA ) —t 的关系曲线 图进行判断其动力学形式。
不同时间下 f (CA) –t 的变化关系CA0-CA0 0.01636CA0 。
2332 0 。

1、相基元反应A+2B →2P 在30℃和常压下的反应速率常数kc=2.65×104m6kmol-2s-1。
现以气相分压来表示速率方程,即(−rA)=kPpApB2,求kP=?(假定气体为理想气体)()3-1-3631112643c P 2BA p A 2B A c 2BA c A 1264c kPa s m kmol 10655.1K303K kmol kJ 314.8s kmol m 1065.2)(s kmol m 1065.2K 30330273--------⋅⨯=⨯⋅⨯===-⎪⎭⎫⎝⎛==-=⨯==+=RT k k p p k r RT p RT p k c c k r RTp c k T2、考虑反应3P A →,其动力学方程为Vnk t n V r A A A d d 1=⋅-=-试推导在恒容下以总压表示的动力学方程。
()()()()()()总总总总总总总总p p tp V RT V p p k t p RT V V p RT Vn RTV p p n p p p p p p p p n n n t t p p n t p -=-=⎪⎭⎫ ⎝⎛---=-=-=---==A0A0A A0A A0A AA0A A0A A A0A A0A0A03d d 23d d 21d 2d 233212333000P A 3、丁烷在700℃,总压为0.3MPa 的条件下热分解反应:C 4H 10→2C 2H 4+H 2 (A) (R) (S)起始时丁烷为116kg ,当转化率为50%时1As MPa 24.0d d -⋅=-tp ,求此时tyt n t p d d d d d d A S R -,,。
1A R s MPa 48.024.02d d 2d d -⋅=⨯=⎪⎭⎫⎝⎛-=t p t p 1S S S t t S R A A A0S S S S A S s kmol 032.03004.24d d 3004d d d d 3004kmol 4kmol 1kmol 2kmol 15.0kmol 258116d d d d d d -⋅=⨯===⨯===========-=t p t p RT V t n RTp RT n V n n n n x n p RTV n RT V p n t p t p 总,,,时1A A s 8.024.03.01d d 1d d -=⨯=-=-t p p t y 总 4、在间歇搅拌槽式反应器中,用醋酸与丁醇生产醋酸丁酯,反应式为:()()()()S R B A O H H COOC CH OH H C COOH CH 2943SO H 94342+−−→−+反应物配比为:A(mol):B(mol)=1:4.97,反应在100℃下进行。

《化学反应工程》课程习题集一、单选题1.某反应的速率常数k=0.0462-1,又知初始浓度为0.1mol.dm-3,则该反应的半衰期为:(A) 1/(6.93×10-2×0.12) (B) 15分(C) 30分 (D) 1/(4.62×102×0.1)分2.某一级反应, 当反应物的浓度降为起始浓度的1%时,需要t1秒, 若将反应物的浓度提高一倍, 加快反应速率, 当反应物浓度降低为起始浓度的1%时, 需时为t2, 则:(A ) t1﹥t2 (B) t1=t2(C) t1﹤t2 (D) 不能确定二者关系3.某反应物反应掉7/8所需的时间恰好是它反应掉1/2所需时间的3倍, 则该反应的级数是:(A) 零级 (B) 一级反应 (C) 三级反应 (D) 二级反应4.若两个相同类型的气相双分子反应的△H⊙值相等, 又在400k时,它们的活化熵之差△S1⊙-△S2⊙=10 J.mol-1,则两反应的速率常数之比为:(A) K1/K2=0.300 (B) K1/K2=0.997(C) K1/K2=1.00 (D) K1/K2=3.335.对反应A+B→C, 由下列数据C A0/mol.dm-3 C B0/mol.dm-3 r0/ mol.dm-31.0 1.0 0.152.0 1.0 0.301.02.0 0.15则该反应的速率方程为:(A) r=K C B (B) r=K C A C B(C) r=K C A (D) r=K C A C B26.一个反应的活化能是33kJ·mol-1, 当 T = 300K 时,温度每增加1K,反应速率常数增加的百分数约是___。
A. 4.5%B. 90%C. 11%D. 50%7.下列叙述正确的是_ 。
A. 吸热反应的活化能比放热反应的活化能高B. 一个反应的反应速率与化学方程式中出现的所有作用物浓度都有关C. 催化反应的速率与催化剂的浓度无关D. 反应速率常数与作用物浓度无关8.关于催化剂的使用,下列叙述中不正确的是_ 。
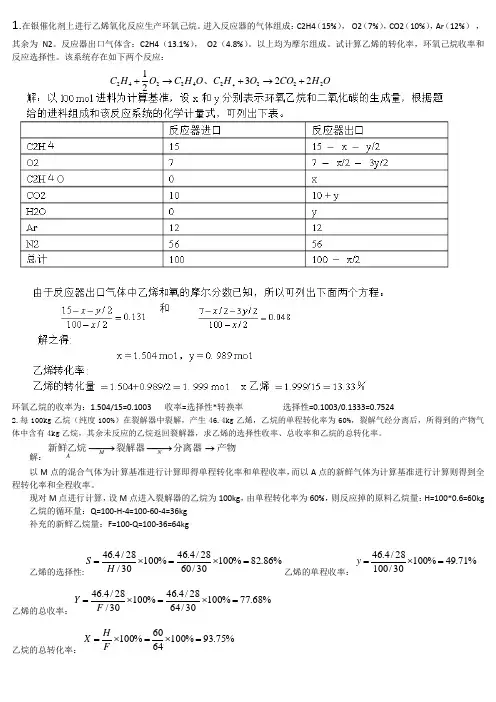
1.在银催化剂上进行乙烯氧化反应生产环氧己烷。
进入反应器的气体组成:C2H4(15%), O2(7%),CO2(10%),Ar (12%) ,其余为N2。
反应器出口气体含:C2H4(13.1%), O2(4.8%)。
以上均为摩尔组成。
试计算乙烯的转化率,环氧己烷收率和反应选择性。
该系统存在如下两个反应:环氧乙烷的收率为:1.504/15=0.1003 收率=选择性*转换率 选择性=0.1003/0.1333=0.75242.每100kg 乙烷(纯度100%)在裂解器中裂解,产生46.4kg 乙烯,乙烷的单程转化率为60%,裂解气经分离后,所得到的产物气体中含有4kg 乙烷,其余未反应的乙烷返回裂解器,求乙烯的选择性收率、总收率和乙烷的总转化率。
解:以M 点的混合气体为计算基准进行计算即得单程转化率和单程收率,而以A 点的新鲜气体为计算基准进行计算则得到全程转化率和全程收率。
现对M 点进行计算,设M 点进入裂解器的乙烷为100kg ,由单程转化率为60%,则反应掉的原料乙烷量:H=100*0.6=60kg 乙烷的循环量:Q=100-H -4=100-60-4=36kg 补充的新鲜乙烷量:F=100-Q=100-36=64kg乙烯的选择性:乙烯的单程收率:乙烯的总收率:乙烷的总转化率:产物分离器裂解器新鲜乙烷→−→−−→−NM A%86.82%10030/6028/4.46%10030/28/4.46=⨯=⨯=H S %71.49%10030/10028/4.46=⨯=y %68.77%10030/6428/4.46%10030/28/4.46=⨯=⨯=F Y %75.93%1006460%100=⨯=⨯=F H X O H CO O H C O H C O H C 222242242223214+→+→+、3.丁二烯是制造合成橡胶的重要原料,制取丁二烯的生产方法之一是将正丁烯和空气及水蒸气的混合气体在磷钼铋催化剂上进行氧化脱氢,其主反应为:此外还有许多副反应,如生成酮、醛及有机酸的反应。
化学反应工程原理一、选择题1、气相反应进料时无惰性气体,与以1∶2摩尔比进料,则膨胀因子=__A_。
A. —2B. -1 C. 1 D. 22、一级连串反应在间歇式反应器中,则目的产物P的最大浓度___A____。
A。
B。
C. D。
3、串联反应A → P(目的)→R + S,目的产物P与副产物S的选择性=__C_。
A。
B。
C。
D。
4、全混流反应器的容积效率η=1。
0时,该反应的反应级数n___B__。
A。
<0 B。
=0 C.≥0 D. >05、对于单一反应组分的平行反应,其瞬间收率随增大而单调下降,则最适合的反应器为____B__.A。
平推流反应器B。
全混流反应器C. 多釜串联全混流反应器 D.全混流串接平推流反应器6、对于反应级数n〉0的不可逆等温反应,为降低反应器容积,应选用____A___。
A。
平推流反应器 B. 全混流反应器C。
循环操作的平推流反应器D. 全混流串接平推流反应器7、一级不可逆液相反应,, 出口转化率,每批操作时间,装置的生产能力为50000 kg产物R/天,=60,则反应器的体积V为_C_.A。
19。
6 B。
20。
2C。
22。
2 D。
23。
48、在间歇反应器中进行等温一级反应A→B,,当时,求反应至所需时间t=____B___秒。
A。
400 B。
460 C。
500 D。
5609、一级连串反应A → P → S在全混流釜式反应器中进行,使目的产物P浓度最大时的最优空时_____D__。
A. B.C。
D.10、分批式操作的完全混合反应器非生产性时间不包括下列哪一项____B___。
A。
加料时间 B. 反应时间 C。
物料冷却时间D。
清洗釜所用时间11、全混流反应器中有___B__个稳定的定常态操作点。
A。
1 B. 2 C。
3 D. 412、全混流反应器的容积效率η小于1.0时,且随着的增大而减小,此时该反应的反应级数n _ D_ 。
A。
〈0 B。
=0 C。
一、填空题1.对可逆放热反应,为使整个反应始终在最大反应速率下操作,工业上通常采用的方法是 绝热操作 。
2.平推流反应器的返混为 最小 ,全混流反应器的返混为 最大 。
3.表征反应前后分子数变化程度的方法有 膨胀率 和 膨胀因子法 。
4.对于循环操作的平推流反应器,当循环比R →0时为 平推流 反应器,而当R →∞时, 则相当于 全混流 反应器。
5.全混流反应器其f (t )曲线的方差σ2= 1 ,平推流反应器的方差σ2= 0 。
6.停留时间分布测定中,示踪物的输入方法主要有 脉冲输入法 和 阶跃输入法 。
7.混合按混合对象的年龄可以把混合分为 同龄混合 和 返混 。
8.膨胀因子 δA 与膨胀率 εA 的关系为 。
9.为了获得最大的平均选择率,对于平行反应,当主反应级数大于副反应级数时,则优先 选择 平推流 反应器,当主反应级数小于副反应级数时,优先选择 全混流 反应器。
10.要提高串联反应中间产物P 收率,优先选择 平推流 反应器。
11.当返混对反应结果不利时,限制返混的主要措施是 分割 。
12.对于反应 A+B→R , r 1=k 10e -125000/RT C A 2C BA+B→S , r 2=k 20e -175000/RT C A C B若R 为目的产物,应选择 平推流 反应器最好(填平推流流或全混流),应选择在 低 温度(填高或低)下操作反应器较有利。
1.工业反应过程的主要技术指标有: 反应速率 、 选择性 、和 能量消耗 。
3.在实际反应器中存在 死区 、 短路 和 循环流 等非理想流动现象。
4.理想流动是指 平推流 和 全混流 。
5.若流体是分子尺度作为独立运动单元来进行混合,这种流体称为 微观流体 。
8.不论是设计、放大或控制,都需要对研究对象作出定量的描述,也就要用数学式来 表达参数间的关系,简称 数学模型 。
9. 通常自催化反应较合理的反应器组合方式为全混流 串联 平推流 。
化学反应工程计算题1、80℃时氯乙醇的皂化反应为:CH 2Cl-CH 2OH+NaHCO 3→CH 2OHCH 2OH+NaCl+CO 2 属基元反应,其反应速度常数k =5.2L/mol ·h 现拟用15%(质量)的NaHCO 3水溶液30%(质量)的氯乙醇水溶液为原料,建立一个日产480Kg 的乙二醇的中间工厂,今使用等摩尔比原料,要求氯乙醇转化率为95%,试计算:采用间歇反应器,非生产时间为0.5小时/批时所需有效体积。
反应为等温等容过程,混合物料比重为1.02。
解:V =υ0(t+t 0)投料中氯乙醇量为:2495.0624800.34 kmol/h氯乙醇水溶液量为:23.9130.05.8034.0 kg/h碳酸氢钠水溶液量为:4.19015.08434.0 kg/hυ0=02.14.19023.91 =276.1 l/h t =01kCa XafXaf 1进料中氯乙醇量的浓度:C Ao =1023.11.27634.0 -3kmol/l =1.23 mol/lt =95.0195.023.12.51 2.97 h V =276.1×(2.97+0.5)=958.07 l2、已知氯乙醇2.97的皂化反应为:CH 2Cl-CH 2OH+NaHCO 3→CH 2OHCH 2OH+NaCl+CO 2 属基元反应,其反应速度常数k=5.2L/mol ·h ,现拟用15%(质量)的NaHCO 3水溶液30%(质量)的氯乙醇水溶液为原料,建立一个日产480Kg 的乙二醇的中间工厂,今使用等摩尔比原料,要求氯乙醇转化率为95%,反应为等温等容过程,混合物料比重为1.02,试计算: 采用理想管式流动反应器时所需体积。
解:V =υ0t投料氯乙醇的量为:2495.0624800.34 kmol/hCH 2CL -CH 2OH 的水溶液量为:23.9130.05.8034.0 kg/hNaHCO 3水溶液量为:4.19015.08434.0 kg/hυ0=02.14.19023.91 =276.1 l/h t =01kCa XafXaf 1进料中C Ao =1.2761034.0 =1.23 mol/l∴t =95.0195.023.12.51 2.97 h ∴V =2.97×276.1=820.02 l3、已知基元反应:CH 2Cl-CH 2OH+NaHCO 3→CH 2OHCH 2OH+NaCl+CO 2,其反应速度常数k =5.2L/mol ·h ,现拟用15%(质量)的NaHCO 3水溶液30%(质量)的CH 2Cl-CH 2OH 水溶液为原料,建立一个日产480Kg 的CH 2OHCH 2OH 的中间工厂,反应可视为等温等容过程,混合物料比重为1.02。
化学反应工程1、有如下平行反应:R B A k−→−+1(主反应) R B A R C C C k r 1=S B A k −→−+2 (副反应) B A S C C k r 2=(1) 若采用间歇操作,试选择合适的加料方式; (2) 若采用连续操作,试选择用合适的反应器型式;(3) 若主、副反应的活化能分别为30和20,反应温度宜高还是宜低? 解: R S R P C k k r r S 21==(1) 若用间歇操作,应采用向事先含R 的BR 中同时加入A 、B 物料; (2) 若用连续操作,应选用CSTR ,A 、B 同时连续加入; (3) ∵ E 1 〉E 2,∴反应温度宜高。
(∵温度升高,有利于活化能高的反应)2、在一等温操作的间歇釜式反应器中,进行某一级液相反应A →R ,13分钟后,反应物转化率为70%,若让此反应在PFR 或CSTR 单釜中进行,为达到相同转化率,所需的空时和平均停留时间分别为多少? 解: 11111lnln 0.0926min 11310.7A k tx -===--(1) PFR : 113min t τ-== (2) CSTR : 0.725.20min (1)0.0926(10.7)A A x t k x ===-⨯-3、1、有下列反应:C 2H 4 的二聚反应,反应温度为200℃,反应活化能mol kJ E /9.156=,为使反应速率提高一倍,计算所需提高的温度为多少? 解:反应速率提高一倍,即212=k k21122211ln()15690011ln 2()481.568.314473.158.4k E k R T T T K T T C=-=-⇒=∆=︒提高温度为8.4C ︒4、在一反应体积为3 m 3的连续釜式反应器中等温进行下列液相反应:h C h C A A ⋅=−→−⋅=−→−+32Q 3P kmol/m 2.0r Q 2A kmol/m 6.1r P B Ar P 及r Q 分别为产物P 及Q 的生成速率,P 为目的产物。
福建农林大学考试试卷 ( A )卷
2012 ——2013 学年第 2 学期
课程名称: 化学反应工程 考试时间 120 min
化工 专业 2010 年级 班 学号 姓名
一、填空题每空1分,共20分)
2、化学反应速率式为β
αB A C A C C K r =-,如用浓度表示的速率常数为C K ,用压力表示的速率常数P K ,则C K = 。
3、平行反应
A
P(主)
S(副)均为一级不可逆反应,若主E >副E ,选择性S p 与 无关,仅
是 的函数。
4、对于反应级数n >0的反应,为降低反应器容积,应选用 反应器为宜。
5、对于恒容的平推流管式反应器 一致。
9、对于多孔性的催化剂,分子扩散很复杂,当微孔孔径在约_ _时,分子与孔壁的碰撞为扩散阻力的主要因素,这种扩散称为 。
10、绝热床反应器由于没有径向床壁传热,一般可以当作平推流处理,只考虑流体流动方向上有温度和浓度的变化,因此一般可用 模型来计算。
16、不论是设计、放大或控制,都需要对研究对象作出定量的描述,也就要用数学式来表达个参数间的关系,简称_ _。
17、一级连串反应A
S P
在平推流反应器中,则目的产物P 的最大浓度
=
m a x ,P C _______、
=
opt t ______。
、)
19、一级连串反应A
S P
在间歇式全混流反应器中,则目的产物P 的最大浓度
=
max ,P C _______、
=
opt t ______。
、)
21、理想反应器是指 。
24、平推流反应器的返混为____ ___。
31、当前用于描述气-液两相流相间传质的模型有两大类:一是按稳态扩散来处理的
_;一是按非稳态扩散处理模型,如_ _和_ _。
32、在建立数学模型时,根据基础资料建立物料衡算式的一般式为_ _。
33、活化能的大小直接反映了_ _对温度的敏感程度。
35、固定床中颗粒的体积相当直径定义为具有相同体积V p的球粒子直径,表达式d v=__
_。
1.一不可逆反应,当反应温度从25℃升高到35℃时,反应速率增加一倍,则该反
应的活化能为。
3.间歇釜反应器中进行如下反应:
P
A→(1) -r
A1
=k1C A a1
S
A→(2) -r
A2
=k2C A a2
在C A0和反应时间保持不变下,降低反应温度,釜液中C P/C S增大,表明活化能E1
与E2的相对大小为;在温度和反应时间保持不变下,增高反应
浓度,釜液中C P/C S增大,表明反应级数al、a2的相对大小为。
4.从反应器停留时间分布测定中,求得无因次方差
98
.0
2=
θ
σ
,反应器可视
为 ,
又若求得无因次方差
02
.0
2=
θ
σ
,则反应器可视为。
5.有两个有效容积不等的全混流反应器串联操作,反应为二级不可逆反应A→P,
若大釜在先,小釜在后,出口转化率为x A1,小釜在先、大釜在后,则出口转化率
为x A2,两种情况下,进料流速、进料浓度和反应温度均相同,比较x A1和x A2的相
对大小为。
4.对于气—固系统的流化床反应器,只有细颗粒床,才有明显的膨胀,待气速达到_______后才出现气泡;而对粗颗粒系统,则一旦气速超过起始流化速度后,就出现气泡,这些通称为_______。
8.气—液—固体系的浆态反应器可以通过_______的作用,也可以仅仅借助_______作用使催化剂的固体细粒很好的分散于液体中并形成淤浆状,这两种类型的浆态反应器在工业上均有采用。
二、选择题(每小题1分,共25分)
试题第1页(共3页)
三、简答题(每小题4分,共16分)
1、简述等温恒容平推流反应器空时、反应时间、停留时间三者关系? 空时是反应器的有效容积与进料流体的容积流速之比。
(①分)反应时间是反应物料进入反应器后从实际发生反应的时刻起到反应达某一程度所需的反应时间。
(①分)停留时间是指反应物进入反应器的时刻算起到离开反应器内共停留了多少时间。
(①分)由于平推流反应器内物料不发生返混,具有相同的停留时间且等于反应时间,恒容时的空时等于体积流速之比,所以三者相等。
(②分)
3、简述均相反应及其动力学的研究内容?
答:参与反应的各物质均处于同一个相内进行的化学反应称为均相反应。
均相反应动力学是研究各种因素如温度、催化剂、反应物组成和压力等对反应速率、反应产物分布的影响,并确定表达这些影响因素与反应速率之间定量关系的速率方程。
4、对于可逆放热反应如何选择操作温度?
答:1)对于放热反应,要使反应速率尽可能保持最大,必须随转化率的提高,按最优温度曲线相应降低温度; 2)这是由于可逆放热反应,由于逆反应速率也随反应温度的提高而提高,净反应速率出现一极大值;3)而温度的进一步提高将导致正逆反应速率相等而达到化学平衡。
5、简述气-液反应的宏观过程:A (g ) + bB (l )→ cC (g )
1)反应物气相组分从气相主体传递到气液相界面,在界面上假定达到气液相平衡; 2)反应物气相组分A 从气液相界面扩散入液相,并在液相内反应; 3)液相内的反应产物向浓度下降方向扩散,气相产物则向界面扩散; 4)气相产物向气相主体扩散。
6、简述固定床反应器的优缺点?
1)催化剂在床层内不易磨损; 2)床层内流体的流动接近于平推流,与返混式反应器相比,用较少的催化剂和较小的反应器容积来获得较大的生产能力; 3)固定床中的传热较差; 4)催化剂的更换必须停产进行。
7、简述双膜理论?
四、计算题(每小题 13 分,共39分)
(摩尔比):C 2H 4:15%, O 2 :7%, CO 2 :10%, H 2O :0%, C 2H 4O :0%,其余为Ar 、N 2;出反应器气体中现已知:C 2H 4 :13.1%, O 2 :4.8%。
试计算乙烯的转化率、环氧乙烷的选择性及收率。
假设H 2O 及C 2H 4O 为关键组分
24224242220.5322C H O C H O C H O CO H O
+→+→+
2、在一反应体积为3m 3的连续釜式反应器中等温进行下列液相反应:
h C h C A A ⋅=−→−⋅=−→−+32Q 3
P kmol/m 2.0r Q 2A kmol/m 6.1r P B A
r P 及r Q 分别为产物P 及Q 的生成速率,P 为目的产物。
反应用的原料为A 及B 的
混合液,其中C A0=2 kmol/m 3,每小时处理混合液6 m 3。
求:反应器出口A 、P 、Q 的浓度,P 的收率及总选择性。
3、在反应体积为1 m 3的釜式反应器中,环氧丙烷的甲醇溶液与水反应生产1,2-丙二醇:
23223+→H COCHCH H O H COHCHOHCH
该反应对环氧丙烷为一级,对水为零级,反应温度下反应速率常数等于0.98h -1,原料液中环氧丙烷的浓度为2.1kmol/m 3,环氧丙烷的最终转化率为90%。
(1)若采用间歇操作,辅助时间为0.65h ,则1,2-丙二醇的日产量是多少? (2)有人建议改在定态下连续操作,其余条件不变,则丙二醇-1,2的日产量又是多少?
(3)为什么这两种操作方式的产量会有不同?
4、在间歇釜中一级不可逆反应,液相反应 A → 2R ,A A kC r =-kmol/m 3
·h ,k=9.52×
109exp[-7448.4/T] h -1,=0A C 2.3 kmol/m 3,=R M 60 g/mol ,=0R C 0 kmol/m 3
,若转化率
=A x 0.7,装置的生产能力为50000 kg 产物R/天。
求50℃等温操作所需反应器的有效容积?
(用于非生产性操作时间t 0=0.75 h )
5、有一个反应器测其方差
min 15,min 5.11222==t t σ,如果这个反应器可以用等体积多釜串联模型来描述,并在这个反应器中进行液相反应A + B → 2R ,已知B A A C kC r =-,
l mol C C B A /1200==,min /1⋅=mol l k ,求反应器的出口转化率?
6、有一管式反应装置经脉冲示踪法实验测得如下表所示的数:
0v =0.8 m 3/min ;m=80kg ;∴0C =80/0.8=100 kg/m 3
t(分) 0
2 4 6 8 10 12 14 16 C A (kg/m 3) 0 6.5
12.5 12.5 10
5.0
2.5
1.0
试根据表列数据确定该装置的有效容积V 、平均停留时间t 、方差2
t σ和2
θσ。
7 用多级全混流串联模型来模拟一管式反应装置中的脉冲实验,已知
971.82=t σ,187.62=t ,求
1)1) 推算模型参数N ;
2) 推算一级不可逆等温反应的出口转化率。