1-4方程式默写
- 格式:doc
- 大小:35.50 KB
- 文档页数:2

初中数学方程式默写版(全)本文档为初中数学方程式的默写版,旨在帮助学生们复和巩固数学方程的相关知识。
以下是方程的默写内容:1.一元一次方程定义:只含有一个未知数的一次方程。
示例:2x + 3 = 72.一元一次方程的解法移项法:将含有未知数的___到方程的一边,常数项移到另一边。
示例:4x + 2 = 14,解为:x = 33.一元一次方程的应用示例:已知一个饭店费用公式为5元/人加上固定费用30元,求6人就餐的总费用。
方程为:总费用 = (饭店费用/人) ×人数 + 固定费用解为:总费用 = (5 × 6) + 30 = 60元4.一元二次方程定义:含有一个未知数的二次方程。
示例:2x^2 + 3x + 1 = 05.一元二次方程的解法因式分解法:将方程进行因式分解并令每个因式等于零,求解得到未知数的值。
示例:x^2 + 5x + 6 = 0,因式分解为(x + 2)(x + 3) = 0,解为:x = -2 或 x = -36.一元二次方程的判别式判别式:Δ = b^2 - 4ac,其中a、b、c分别为方程中各项的系数。
若Δ。
0,则方程有两个不相等的实数根。
若Δ = 0,则方程有一个实数根。
若Δ < 0,则方程无实数根。
7.一元二次方程的应用飞机起落:飞机起飞时,起飞距离y与起飞速度v的关系符合一元二次方程y = ax^2 + bx + c。
根据需要,可求解出a、b、c的值,从而确定飞机起飞的最小速度和起飞距离。
以上是初中数学方程式的默写内容。
希望这份文档能帮助你更好地理解和记忆数学方程的相关知识。
如有任何疑问,请随时向我提问。

化学《上册》必须过关的化学方程式1.实验室制取二氧化碳(必须熟记)________________________________________________2.二氧化碳使石灰水变浑浊(必须熟记)____________________________________________3.二氧化碳与水反应______________________________________________________________4.碳酸不稳定分解________________________________________________________________5.一氧化碳燃烧__________________________________________________________________6.一氧化碳还原氧化铜____________________________________________________________7.一氧化碳还原氧化铁____________________________________________________________8.甲烷燃烧______________________________________________________________________9.酒精燃烧_____________________________________________________________________10.实验室制取氢气_______________________________________________________________11.生石灰(氧化钙)与水反应_____________________________________________________12.氢气燃烧_____________________________________________________________________13.镁条与稀盐酸反应_____________________________________________________________14.红磷(或白磷)燃烧___________________________________________________________15.木炭还原氧化铜_______________________________________________________________16.木炭还原氧化铁_______________________________________________________________17.木炭还原四氧化三铁___________________________________________________________18.木炭还原二氧化碳_____________________________________________________________19.木炭燃烧(氧气充足)_________________________________________________________20.木炭不完全燃烧(氧气不充足)_________________________________________________21.实验室制氧气(三个化学方程式必须熟记)(1)分解过氧化氢______________________________________________________________ (2)加热氯酸钾________________________________________________________________ (3)加热高锰酸钾______________________________________________________________22.电解水______________________________________________________________________23.氢气还原氧化铜______________________________________________________________24.氢气还氧化铁________________________________________________________________25.铁与硫酸铜反应______________________________________________________________26.镁条燃烧____________________________________________________________________27.硫燃烧______________________________________________________________________28.铁丝燃烧____________________________________________________________________初中化学<下册>必须熟记的化学方程式1.金属单质+ 酸---盐+ 氢气(1)锌和稀硫酸: _______________________ (2)铁和稀硫酸: __________________________ (3)镁和稀硫酸: _______________________ (4)铝和稀硫酸:___________________________(5)锌和稀盐酸:________________________ (6)铁和稀盐酸: __________________________ (7)镁和稀盐酸: _______________________ (8)铝和稀盐酸: __________________________2.金属单质+ 盐(溶液) -----另一种金属+ 另一种盐(1)铁和硫酸铜溶液反应:_____________________________________(2)铜和硝酸银溶液反应:_____________________________________3.金属(碱性)氧化物+ 酸------盐+ 水(1)氧化铁和稀盐酸反应:_____________________________________(2)氧化铁和稀硫酸反应:_____________________________________(3)氧化铜和稀盐酸反应:_____________________________________(4)氧化铜和稀硫酸反应: ____________________________________4.非金属(酸性)氧化物+ 碱------盐+ 水(1)烧碱暴露在空气中变质(与空气中的CO反应): __________________________________ 2(2)苛性钠(烧碱、火碱)吸收二氧化硫气体: _______________________________________(3)苛性钠(烧碱、火碱)吸收三氧化硫气体: _______________________________________(4)熟石灰(消石灰)在空气中变质(与空气中的CO反应):___________________________ 25.酸+ 碱-----盐+ 水(1)盐酸和烧碱反应:____________________________________________(2)盐酸和氢氧化铝反应(治疗胃酸过多):_________________________________________(3)盐酸和氢氧化镁反应(治疗胃酸过多):_________________________________________(4)硫酸和烧碱反应:____________________________________________其他:(1)二氧化碳与水反应:______________________________(2)生石灰与水反应:________________________________化学《上册》必须过关的化学方程式答案1.实验室制取二氧化碳CaCO+2HCl=CaCl+HO+CO↑23222.二氧化碳使石灰水变浑浊CO+Ca(OH)=CaCO↓+HO22323.二氧化碳与水反应CO+HO=HCO 32224.碳酸不稳定分解HCO= HO +CO↑2223点燃= 2CO5.一氧化碳燃烧2CO+O22高温CO+CuO = Cu+CO6.一氧化碳还原氧化铜2高温= 2Fe+3CO7.一氧化碳还原氧化铁3CO+FeO223点燃O = CO+2H+2O8.甲烷燃烧:CH2224点燃O HOH+3O+3H = 2CO9.酒精燃烧C25222↑=ZnSO+H10.实验室制取氢气Zn+HSO2424 CaO + HO = Ca(OH)11.生石灰(氧化钙)与水反应22点燃O12.氢气燃烧2H + O = 2H222+ H↑13.镁条与稀盐酸反应Mg + 2HCl = MgCl22点燃4P + 5O =2PO14.红磷(或白磷)燃烧522高温15.木炭还原氧化铜2CuO+C = 2Cu+CO↑2高温O + 3C = 4Fe + 3CO↑16.木炭还原氧化铁2Fe322高温17.木炭还原四氧化三铁FeO↑+ 2C = 3Fe + 2CO432高温+ C = 2CO 木炭还原二氧化碳CO18.2点燃= CO19.木炭燃烧(氧气充足)C + O22点燃= 2CO 20.木炭不完全燃烧(氧气不充足)2C + O2 21.实验室制氧气(三个化学方程式必须熟记)MnO2= 2HOO + O↑)分解过氧化氢(12H2222 MnO2= 2KCl + 3O2KClO2()加热氯酸钾↑32△△MnO = K(3)加热高锰酸钾2KMnO + O↑+ MnO22442通电↑↑电解水22.2HO = 2H + O 222高温O 氢气还原氧化铜23.CuO + H = Cu + H22高温O Fe24.氢气还氧化铁+ 3HO = 2Fe + 3H2232 25. = Cu +FeSO铁与硫酸铜反应Fe + CuSO44点燃= 2MgO 2Mg + O镁条燃烧26.2点燃27.S + O = SO硫燃烧22点燃O3Fe +2O铁丝燃烧28. = Fe432.答案必须熟记的化学方程式下册>初中化学<1.金属单质+ 酸---盐+氢气(1)锌和稀硫酸: Zn + HSO = ZnSO + H↑(2)铁和稀硫酸: Fe + HSO = FeSO + H↑22422444(3)镁和稀硫酸: Mg +HSO=MgSO +H↑(4)铝和稀硫酸: 2Al +3HSO = Al(SO) +3H↑2242432442(5)锌和稀盐酸: Zn + 2HCl = ZnCl + H↑(6)铁和稀盐酸: Fe + 2HCl = FeCl + H↑2222(7)镁和稀盐酸: Mg + 2HCl = MgCl + H↑(8)铝和稀盐酸: 2Al + 6HCl = 2AlCl + 3H↑22232.金属单质+ 盐(溶液) -----另一种金属+ 另一种盐(1)铁和硫酸铜溶液反应:Fe + CuSO = FeSO + Cu 44(2)铜和硝酸银溶液反应:Cu + 2AgNO=Cu(NO) +2Ag2333.金属(碱性)氧化物+ 酸------盐+ 水(1)氧化铁和稀盐酸反应:FeO + 6HCl =2FeCl+ 3HO 223 3(2)氧化铁和稀硫酸反应:FeO+3HSO =Fe(SO)+ 3HO 22432234(3)氧化铜和稀盐酸反应:CuO + 2HCl = CuCl + HO 22(4)氧化铜和稀硫酸反应: CuO + HSO = CuSO + HO24424.非金属(酸性)氧化物+ 碱------盐+ 水(1)烧碱暴露在空气中变质(与空气中的CO反应): 2NaOH + CO = NaCO + HO 22322(2)苛性钠(烧碱、火碱)吸收二氧化硫气体: 2NaOH + SO = NaSO + HO 2223(3)苛性钠(烧碱、火碱)吸收三氧化硫气体: 2NaOH + SO = NaSO + HO2243(4)熟石灰(消石灰)在空气中变质(与空气中的CO反应):Ca(OH) + CO = CaCO↓+ HO 22322其他:(1)二氧化碳与水反应:CO + HO = HCO 3222(2)生石灰与水反应:CaO + HO = Ca(OH) 22。

1—4章化学方程式一.化合反应1.镁带燃烧: 2Mg + O 2 ==== 2MgO2.铁丝燃烧: 3Fe + 2O 2 ==== Fe 3O 43.氢气燃烧: 2H 2 + O 2 === 2H 2O4.碳的燃烧:2C + O 2 ==== 2CO (不完全燃烧);C + O 2 === CO 2(完全燃烧)5.硫的燃烧:S + O 2 === SO 26.磷的燃烧:4P + 5O 2 === 2P 2O 57.浓盐酸与浓氨水相靠近:NH 3 + HCl == NH 4Cl8、二氧化碳与水反应: CO 2+ H 2O == H 2CO 39、一氧化碳的燃烧:2CO + O 2 == 2CO 2二.分解反应10.碳酸氢铵(碳铵)受热分解:NH 4HCO 3 NH 3↑+ CO 2↑+ H 2O 11.加热高锰酸钾制氧气: 2KMnO 4 K 2MnO 4 + MnO 2 + O 2↑ 12.二氧化锰催化双氧水制氧气:2H 2O 2 2H 2O + O 2↑ 13.电解水:2H 2O 2H 2↑+ O 2↑14.碳酸分解:H 2CO 3 == CO 2↑+ H 2O15、加热氯酸钾制取氧气:2KClO 32KCl + 3O 2↑ 三.其它反应16、硫酸铜溶液与氢氧化钠溶液反应:CuSO 4 + 2NaOH== Cu(OH)2↓+Na 2SO 417、二氧化碳与澄清石灰水反应:CO 2 + Ca(OH)2 == CaCO 3↓+ H 2O ;18、实验室制取二氧化碳:CaCO 3 + 2HCl == CaCl 2 + CO 2↑+ H 2O ; 点燃 点燃点燃 点燃 点燃 点燃 △ ===△ === 通电 === 点燃 MnO 2=== MnO 2 === △ 点燃。

化学方程式整理1.加热高锰酸钾制氧气:2KMnO 4K 2MnO 4+MnO 2+O 2↑2.二氧化锰催化双氧水制氧气:2H 2O 22H 2O +O 2↑3.氯酸钾制氧气:2KClO 32KCl +3O 2↑4.实验室制二氧化碳:CaCO 3+2HCl ==CaCl 2+CO 2↑+H 2O5.澄清石灰水检验二氧化碳:CO 2+Ca(OH)2==CaCO 3↓+H 2O 6.电解水:2H 2O 2H 2↑+O 2↑7.氢气燃烧或爆炸:2H 2+O 2===2H 2O8.镁条燃烧:2Mg +O 2====2MgO 9.磷的燃烧:4P +5O 2===2P 2O 510.铁丝燃烧:3Fe +2O 2====Fe 3O 411.硫的燃烧:S +O 2===SO 212.碳的燃烧:2C +O 2====2CO (不完全燃烧);C +O 2===CO 2(完全燃烧)13.铜丝加热:2Cu +O 2===2CuO ;14.一氧化碳的燃烧:2CO +O 2===2CO 215.甲烷(天然气)的燃烧:CH 4+2O 2==CO 2+2H 2O16.二氧化碳与水反应:CO 2+H 2O ==H 2CO 317.碳酸受热分解:H 2CO 3CO 2↑+H 2O18.碳酸氢铵(碳铵)受热分解:NH 4HCO 3NH 3↑+CO 2↑+H 2O 19.碳酸钙高温煅烧分解:CaCO 3==CaO +CO 2↑20.氢氧化钠和硫酸铜反应:CuSO 4+2NaOH ==Cu(OH)2↓+Na 2SO 421.绿色植物光合作用:6CO 2+6H 2O ===C 6H 12O 6+6O 2点燃点燃点燃高温点燃点燃叶绿素△===MnO 2===通电===MnO 2===Δ点燃点燃△点燃△===△===点燃光照。

1.镁在空气中燃烧:_______________________________现象:发出耀眼白光,产生大量的热,生成白色粉末。
2.铁在氧气中燃烧:_______________________________现象:火星四射,产生大量的热,生成黑色固体。
3.铜在空气中受热:_______________________________现象:红色固体变黑。
4.氢气中空气中燃烧:_______________________________现象:发出淡蓝色火焰。
5.红磷在空气中燃烧:_______________________________现象:发出浓厚的白烟。
6.硫粉在空气中燃烧:_______________________________现象:发出明亮的蓝紫色火焰,生成有刺激性气味的气体。
7.碳在氧气中充分燃烧:______________________________现象:发出白光。
8.一氧化碳在氧气中燃烧:____________________________现象:发出蓝色火焰。
9.甲烷在空气中燃烧:_______________________________10.加热高锰酸钾:_______________________________11.高锰酸钾制氧:_______________________________反应类型:固固加热型12.过氧化氢分解反应:_______________________________反应类型:固液常温型气密性检查:橡皮管用止水夹夹住,往漏斗中加水,水柱不变,气密性良好。
13.水在直流电的作用下分解:__________________________注意事项:V正:V负=1:2(正氧负氢)m正:m负=8:1 14.生石灰溶于水:_______________________________现象:大量水汽产生,放出热量。
15.二氧化碳可溶于水:_______________________________现象:滴加紫色石蕊,试剂由紫变红。
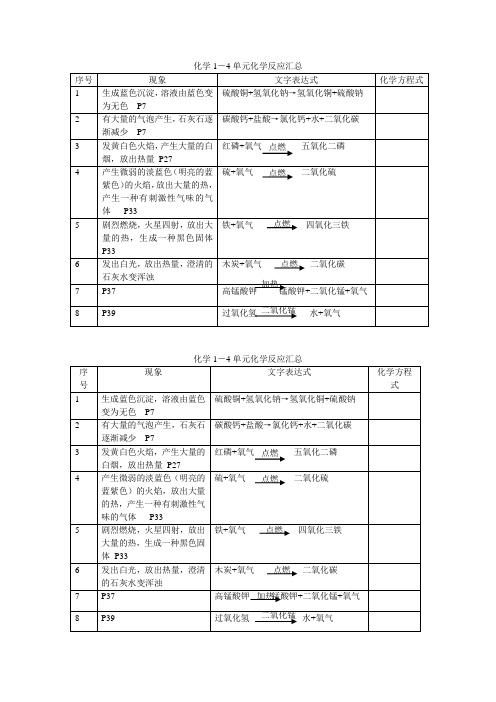
写出下列化学反应的文字表达式,并在相应的物质下方写出该物质的化学式。
(1)磷在空气中燃烧
文字表达式:
化学方程式:
(2)硫在氧气中燃烧
文字表达式:
化学方程式:
(3)木炭在空气中燃烧
文字表达式:
化学方程式:
(4)铁丝在氧气中燃烧
文字表达式:
化学方程式:
(5)镁在空气中燃烧
文字表达式:
化学方程式:
(6)氢气在氧气中燃烧
文字表达式:
化学方程式:
(7)高锰酸钾受热分解制取氧气
文字表达式:
化学方程式:
(8)氯酸钾和二氧化锰混合加入制取氧气
文字表达式:
化学方程式:
(9)过氧化氢溶液与二氧化锰混合制取氧气
文字表达式:
化学方程式:
(10)电解水
文字表达式:
化学方程式:写出下列化学反应的文字表达式,并在相应的物质下方写出该物质的化学式。
(1)磷在空气中燃烧文字表达式:化学方程式:(2)硫在氧气中燃烧文字表达式:化学方程式:(3)木炭在空气中燃烧文字表达式:化学方程式:(4)铁丝在氧气中燃烧文字表达式:化学方程式:(5)镁在空气中燃烧文字表达式:化学方程式:(6)氢气在氧气中燃烧文字表达式:化学方程式:(7)高锰酸钾受热分解制取氧气文字表达式:化学方程式:(8)氯酸钾和二氧化锰混合加入制取氧气文字表达式:化学方程式:(9)过氧化氢溶液与二氧化锰混合制取氧气文字表达式:化学方程式:(10)电解水文字表达式:化学方程式:。
化学《上册》必须过关的化学方程式1.实验室制取二氧化碳(必须熟记)________________________________________________2.二氧化碳使石灰水变浑浊(必须熟记)____________________________________________3.二氧化碳与水反应______________________________________________________________4.碳酸不稳定分解________________________________________________________________5.一氧化碳燃烧__________________________________________________________________6.一氧化碳还原氧化铜____________________________________________________________7.一氧化碳还原氧化铁____________________________________________________________8.甲烷燃烧______________________________________________________________________9.酒精燃烧_____________________________________________________________________10.实验室制取氢气_______________________________________________________________11.生石灰(氧化钙)与水反应_____________________________________________________12.氢气燃烧_____________________________________________________________________13.镁条与稀盐酸反应_____________________________________________________________14.红磷(或白磷)燃烧___________________________________________________________15.木炭还原氧化铜_______________________________________________________________16.木炭还原氧化铁_______________________________________________________________17.木炭还原四氧化三铁___________________________________________________________18.木炭还原二氧化碳_____________________________________________________________19.木炭燃烧(氧气充足)_________________________________________________________20.木炭不完全燃烧(氧气不充足)_________________________________________________21.实验室制氧气(三个化学方程式必须熟记)(1)分解过氧化氢______________________________________________________________ (2)加热氯酸钾________________________________________________________________ (3)加热高锰酸钾______________________________________________________________22.电解水______________________________________________________________________23.氢气还原氧化铜______________________________________________________________24.氢气还氧化铁________________________________________________________________25.铁与硫酸铜反应______________________________________________________________26.镁条燃烧____________________________________________________________________27.硫燃烧______________________________________________________________________28.铁丝燃烧____________________________________________________________________初中化学<下册>必须熟记的化学方程式1.金属单质+ 酸--- 盐+ 氢气(1)锌和稀硫酸: _______________________ (2)铁和稀硫酸: __________________________ (3)镁和稀硫酸: _______________________ (4)铝和稀硫酸:___________________________ (5)锌和稀盐酸:________________________ (6)铁和稀盐酸: __________________________ (7)镁和稀盐酸: _______________________ (8)铝和稀盐酸: __________________________ 2.金属单质+ 盐(溶液) ----- 另一种金属+ 另一种盐(1)铁和硫酸铜溶液反应:_____________________________________(2)铜和硝酸银溶液反应:_____________________________________3.金属(碱性)氧化物+ 酸------ 盐+ 水(1)氧化铁和稀盐酸反应:_____________________________________(2)氧化铁和稀硫酸反应:_____________________________________(3)氧化铜和稀盐酸反应:_____________________________________(4)氧化铜和稀硫酸反应: ____________________________________4.非金属(酸性)氧化物+ 碱------ 盐+ 水(1)烧碱暴露在空气中变质(与空气中的CO2反应): __________________________________(2)苛性钠(烧碱、火碱)吸收二氧化硫气体: _______________________________________(3)苛性钠(烧碱、火碱)吸收三氧化硫气体: _______________________________________(4)熟石灰(消石灰)在空气中变质(与空气中的CO2反应):___________________________5.酸+ 碱----- 盐+ 水(1)盐酸和烧碱反应:____________________________________________(2)盐酸和氢氧化铝反应(治疗胃酸过多):_________________________________________(3)盐酸和氢氧化镁反应(治疗胃酸过多):_________________________________________(4)硫酸和烧碱反应:____________________________________________其他:(1)二氧化碳与水反应:______________________________(2)生石灰与水反应:________________________________化学《上册》必须过关的化学方程式答案1.实验室制取二氧化碳CaCO 3+2HCl=CaCl 2+H 2O+CO 2↑2.二氧化碳使石灰水变浑浊CO 2+Ca(OH)2=CaCO 3↓+H 2O 3.二氧化碳与水反应CO 2+H 2O=H 2CO 34.碳酸不稳定分解H 2CO 3= H 2O +CO 2↑5.一氧化碳燃烧2CO+O 2 = 2CO 26.一氧化碳还原氧化铜CO+CuO = Cu+CO 27.一氧化碳还原氧化铁3CO+Fe 2O 3 = 2Fe+3CO 28.甲烷燃烧:CH 4+2O 2 = CO 2+2H 2O9.酒精燃烧C 2H 5OH+3O 2 = 2CO 2+3H 2O10.实验室制取氢气Zn+H 2SO 4 =ZnSO 4+H 2↑11.生石灰(氧化钙)与水反应CaO + H 2O = Ca(OH)212.氢气燃烧2H 2 + O 2 = 2H 2O13.镁条与稀盐酸反应Mg + 2HCl = MgCl 2 + H 2↑14.红磷(或白磷)燃烧4P + 5O 2 = 2P 2O 515.木炭还原氧化铜2CuO+C = 2Cu+CO 2↑16.木炭还原氧化铁2Fe 2O 3 + 3C = 4Fe + 3CO 2↑17.木炭还原四氧化三铁Fe 3O 4 + 2C = 3Fe + 2CO 2↑18.木炭还原二氧化碳CO 2 + C = 2CO19.木炭燃烧(氧气充足) C + O 2 = CO 220.木炭不完全燃烧(氧气不充足)2C + O 2 = 2CO21.实验室制氧气(三个化学方程式必须熟记)(1)分解过氧化氢2H 2O 2 = 2H 2O + O 2↑(2)加热氯酸钾2KClO 3 = 2KCl + 3O 2↑(3)加热高锰酸钾2KMnO 4 = K 2MnO 4 + MnO 2 + O 2↑22.电解水2H 2O = 2H 2↑+ O 2↑23.氢气还原氧化铜CuO + H 2 = Cu + H 2O 24.氢气还氧化铁Fe 2O 3 + 3H 2 = 2Fe + 3H 2O 25.铁与硫酸铜反应Fe + CuSO 4 = Cu + FeSO 426.镁条燃烧2Mg + O 2 = 2MgO27.硫燃烧S + O 2 = SO 228.铁丝燃烧3Fe +2O 2 = Fe 3O 4点燃高温高温点燃点燃点燃点燃高温高温高温点燃点燃MnO2MnO 2△△通电高温点燃点燃点燃高温高温初中化学<下册>必须熟记的化学方程式答案1.金属单质+ 酸--- 盐+ 氢气(1)锌和稀硫酸: Zn + H2SO4 = ZnSO4 + H2↑(2)铁和稀硫酸: Fe + H2SO4 = FeSO4 + H2↑(3)镁和稀硫酸: Mg +H2SO4=MgSO4 +H2↑(4)铝和稀硫酸: 2Al +3H2SO4 = Al2(SO4)3 +3H2↑(5)锌和稀盐酸: Zn + 2HCl = ZnCl2 + H2↑(6)铁和稀盐酸: Fe + 2HCl = FeCl2 + H2↑(7)镁和稀盐酸: Mg + 2HCl = MgCl2 + H2↑(8)铝和稀盐酸: 2Al + 6HCl = 2AlCl3 + 3H2↑2.金属单质+ 盐(溶液) ----- 另一种金属+ 另一种盐(1)铁和硫酸铜溶液反应:Fe + CuSO4 = FeSO4 + Cu(2)铜和硝酸银溶液反应:Cu + 2AgNO3=Cu(NO3)2 +2Ag3.金属(碱性)氧化物+ 酸------ 盐+ 水(1)氧化铁和稀盐酸反应:Fe2O3 + 6HCl =2FeCl 3 + 3H2O(2)氧化铁和稀硫酸反应:Fe2O3+3H2SO4 = Fe2(SO4)3+ 3H2O(3)氧化铜和稀盐酸反应:CuO + 2HCl = CuCl2 + H2O(4)氧化铜和稀硫酸反应: CuO + H2SO4 = CuSO4 + H2O4.非金属(酸性)氧化物+ 碱------ 盐+ 水(1)烧碱暴露在空气中变质(与空气中的CO2反应): 2NaOH + CO2 = Na2CO3 + H2O(2)苛性钠(烧碱、火碱)吸收二氧化硫气体: 2NaOH + SO2 = Na2SO3 + H2O(3)苛性钠(烧碱、火碱)吸收三氧化硫气体: 2NaOH + SO3 = Na2SO4 + H2O(4)熟石灰(消石灰)在空气中变质(与空气中的CO2反应):Ca(OH)2 + CO2 = CaCO3↓+ H2O 其他:(1)二氧化碳与水反应:CO2 + H2O = H2CO3(2)生石灰与水反应:CaO + H2O = Ca(OH)2。
化学方程式默写(一)1.Cl2与水反应的离子方程式2.Cl2与NaOH反应的离子方程式3.工业制漂白粉的化学方程式4.实验室制Cl2的离子方程式5.酸性KMnO4与浓盐酸反应的离子方程式6.次氯酸见光分解的化学方程式7.漂白粉在空气中失效的化学方程式8.Cl2与FeCl2反应的离子方程式9.Cl2与KI反应的离子方程式10.Cl2与SO2反应的离子方程式11.KClO3与浓盐酸反应的离子方程式12.足量铁丝在Cl2中燃烧的化学方程式13.SiO2与HF反应的化学方程式14.SiO2与NaOH反应的离子方程式15.SiO2高温下与Na2CO3反应的化学方程式16.Na2SiO3与盐酸反应的离子方程式17.少量CO2与NaOH反应的离子方程式18.过量CO2与NaOH反应的离子方程式19.Na2SiO3溶液中通入足量CO2的离子方程式20.高纯硅的制备流程方程式(原料为SiO2、C、Cl2、H2):、、。
21.小苏打溶液中加入过量的澄清石灰水的离子方程式:。
化学方程式默写(二)1.SO2与CaO反应方程式2.少量SO2与NaOH反应的离子方程式3.少量SO2与澄清石灰水反应的离子方程式4.SO2与H2S反应的化学方程式5.SO2与FeCl3反应的离子方程式6.SO2与新制氯水反应的离子方程式7.SO2与酸性KMnO4反应的离子方程式8.SO2与碘水反应的离子方程式9.工业上用浓氨水处理硫酸工业尾气的化学方程式:、。
10.SO2的催化氧化方程式11.铜与浓硫酸反应的化学方程式12.碳与浓硫酸反应的化学方程式13.铜与双氧水、稀硫酸反应的离子方程式14.少量铁粉在加热条件下与浓硫酸反应的化学方程式:15.NaHSO4与Ba(OH)2反应后溶液呈中性的离子方程式:16.电解精炼铜阳极阴极17.钥匙镀锌阳极阴极化学方程式默写(三)1.N2与O2放电时的化学方程式2.NO与O2反应的化学方程式3.NO2溶于水的离子方程式4.Cu与浓HNO3反应的离子方程式5.Cu与稀HNO3反应的离子方程式6.少量铁粉与稀HNO3反应的离子方程式7.Fe2+与稀HNO3反应的离子方程式8.实验室制NH3的化学方程式9.NH3的工业制法10.NH3·H2O的电离方程式11.氨水受热分解方程式12.工业制硝酸的反应方程式:、、。
化学必修1化学方程式默写表一、钠及其化合物1.钠与氧气:常温:点燃:2.钠与水反应:____________________________离子方程式:____________________________3.钠与硫酸反应:4.氧化钠与水反应:___________________________5.过氧化钠与二氧化碳反应:6.过氧化钠与水反应:_离子方程式:_______________________7.NaOH溶液中通入少量CO2:离子方程式:__________________NaOH溶液中通入过量CO2:离子方程式:_____________________8.①向碳酸钠溶液滴入少量稀盐酸:向稀盐酸滴入少量碳酸钠溶液:②除去碳酸氢钠溶液中混有的碳酸钠:③碳酸钠与氢氧化钙:④碳酸氢钠与盐酸:⑤少量碳酸氢钠溶液滴入氢氧化钙溶液中:少量氢氧化钙溶液滴入碳酸氢钠溶液中:⑥除去碳酸钠溶液中的碳酸氢钠:⑦除去碳酸钠固体中的碳酸氢钠:⑧鉴别碳酸钠和碳酸氢钠溶液:二、铝及其化合物1.铝与氧气的反应:2.铝与氧化铁反应(铝热反应):3.铝和稀盐酸:_______________________________ 离子方程式:_________________________4.铝和NaOH溶液:______________________________离子方程式:_________________________5.氧化铝和稀硫酸:_____________________________离子方程式:_________________________6.氧化铝和NaOH溶液:__________________________离子方程式:_________________________7.氢氧化铝和盐酸:_____________________________离子方程式:_________________________8.氢氧化铝和NaOH溶液:________________________离子方程式:_________________________9.氢氧化铝受热分解:_____________________________10.硫酸铝与氨水反应:_____________________________离子方程式:______________________11.AlCl3溶液中加入少量NaOH溶液:AlCl3溶液中加入过量NaOH溶液:12.往偏铝酸钠溶液中通入少量CO2:往偏铝酸钠溶液中通入足量CO2:13.电解氧化铝:三、铁及其化合物1.铁与氧气反应:铁与硫反应:2.铁与盐酸反应:离子方程式:___________________________铁与CuSO4溶液:离子方程式:___________________________3.铁和水蒸气:_______________________________________________4.氧化亚铁与盐酸反应:离子方程式:_____________________5.氧化铁与盐酸反应:_____________________离子方程式:_____________________6.CO还原氧化铁:__________________________________________7.氯化铁与氢氧化钠溶液:____________________________离子方程式:_____________________8.硫酸亚铁与氢氧化钠溶液:__________________________离子方程式:_____________________9.氢氧化铁加热分解:__________________________________________10.氢氧化亚铁被氧化成氢氧化铁:__________________________________________11.除去FeCl2中的FeCl3:____________________________离子方程式:_______________________12.FeCl2和Cl2反应:________________________________离子方程式:________________________13.FeCl3和Cu反应:________________________________离子方程式:________________________14.氯化铁与硫氰化钾溶液反应:________________________________四、硅及其化合物1.硅与氧气加热:硅与氟气:________________________2.硅单质与氢氟酸反应:3.硅与氢氧化钠溶液反应:____4.二氧化硅与氢氟酸反应:_______________________________________5.二氧化硅与氧化钙高温反应:__________________________________6.二氧化硅与氢氧化钠溶液反应:_____________________________________________7.二氧化硅与碳反应:____________________________________8.硅酸钠与盐酸反应:______________________________离子方程式:_________________________9.往硅酸钠溶液中通入二氧化碳:_____________________________10.二氧化硅与纯碱反应:_________________________________11.二氧化硅与石灰石反应:_________________________________12.加热硅酸:五、氯及其化合物1.实验室制氯气:______________________________________离子方程式:______________________2.钠在氯气中燃烧:____________________________________铁在氯气中燃烧:____________________________________铜在氯气中燃烧:___________________________________氢气在氯气中燃烧:___________________________3.氯气和水反应:______________________________离子方程式:_____________________________4.次氯酸光照分解:__________________________________5.氯水中通入二氧化硫:___离子方程式:_________________________6.氯气与氢氧化钠溶液:________________________________离子方程式:_______________________7.工业生产漂白粉:__________________________________________________8.漂白粉漂白原理:________________________________________________________9.向漂白粉溶液中加入稀盐酸:10.氯气通入溴化钾溶液:离子方程式:_____________________氯气通入碘化钾溶液:离子方程式:_____________________溴水和碘化钾溶液反应:离子方程式:_____________________11.氯化钠和硝酸银溶液:离子方程式:_____________________溴化钠和硝酸银溶液:离子方程式:_____________________碘化钠和硝酸银溶液:离子方程式:_____________________六、硫及其化合物1.硫在空气中燃烧:___________________________________硫与氢气加热:________2.二氧化硫与水:______________________________________二氧化硫与氧化钙:__________________________________少量SO2与氢氧化钠:______________________________离子方程式:_______________________ 过量SO2与氢氧化钠:______________________________离子方程式:_______________________3.SO2通入过量的澄清石灰水:过量的SO2通入澄清石灰水:4.二氧化硫与硫化氢:_____5.SO2的催化氧化:____________________________________6.亚硫酸钠和硫酸反应:____________________________________________________7.Na2SO3与氧气反应:__________________________________8.三氧化硫和水反应:____________________________________9.三氧化硫与氧化钙:___________________________10.三氧化硫与氢氧化钙:___________________________11.铜与浓硫酸反应:________________________________________________________12.碳与浓硫酸反应:______________________________________________________七、氮及其化合物1.氮气和氧气反应:____________________________2.工业合成氨:____________________________________3.一氧化氮与氧气反应: ____________________4.NO2溶于水:____________________________________5.氨气溶于水:___________________________氨水显弱碱性(电离方程式):____________________6.浓氨水受热分解___________________________7.氨气和氯化氢:____________________________________8.氨的催化氧化_________________________________________9.氯化铵受热分解:____________________________________10.碳酸氢铵受热分解:___________________________________11.硝酸铵和NaOH:__________________________________离子方程式:_________________________12.实验室制氨气:_______________________________________13.浓硝酸与铜反应:_________________________________离子方程式:_________________________14.稀硝酸与铜反应:________________________________离子方程式:________________________15.硝酸见光分解:_____________________________________________16.NH4+的检验离子方程式:___________________________17.NO2、O2混合气通入水中无剩余气体:18.NO、O2混合通入水中无剩余气体:化学必修1化学方程式归纳表一、钠及其化合物1.钠与氧气:常温:4Na+O2=2Na2O点燃:2Na + O2 Na2O22.钠与水反应:_2Na + 2H2O = 2NaOH + H2↑_离子方程式:2Na + 2H2O = 2Na++2OH- + H2↑3.钠与硫酸反应:2Na +H2SO4= Na2SO4+H2↑4.氧化钠与水反应:Na2O+H2O=2NaOH5.过氧化钠与二氧化碳反应:2Na2O2 + 2CO2 = 2Na2CO3 +O2↑6.过氧化钠与水反应:2Na2O2+2H2O =4NaOH+O2↑离子方程式:2Na2O2+2H2O=4Na++4OH-+O2↑7.NaOH溶液中通入少量CO2:2NaOH+CO2=Na2CO3+H2O离子方程式:2OH-+CO2=CO32-+H2ONaOH溶液中通入过量CO2:NaOH+CO2= NaHCO3离子方程式:_ OH-+CO2= HCO3-_____8.①向碳酸钠溶液滴入少量稀盐酸: Na2CO3 + HCl = NaHCO3 + NaCl向稀盐酸滴入少量碳酸钠溶液: Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑②除去碳酸氢钠溶液中混有的碳酸钠:Na2CO3 + H2O +CO2=2NaHCO3③碳酸钠与氢氧化钙:Na2CO3 +Ca(OH)2=CaCO3↓ + 2NaOH④碳酸氢钠与盐酸:NaHCO3+HCl=NaCl+H2O+CO2↑⑤少量碳酸氢钠溶液滴入氢氧化钙溶液中:NaHCO3+Ca(OH)2=CaCO3↓ +NaOH+ H2O少量氢氧化钙溶液滴入碳酸氢钠溶液中: 2NaHCO3+Ca(OH)2=CaCO3↓ +Na2CO3 + 2H2O⑥除去碳酸钠溶液中的碳酸氢钠:NaHCO3 + NaOH Na2CO3 + H2O⑦除去碳酸钠固体中的碳酸氢钠:2NaHCO3 Na2CO3 + H2O +CO2↑⑧鉴别碳酸钠和碳酸氢钠溶液:Na2CO3 +CaCl2=CaCO3↓ + 2NaCl二、铝及其化合物1.铝与氧气的反应:4Al + 3O2 2Al2O32.铝与氧化铁反应(铝热反应):2Al + Fe2O3高温2Fe + Al2O33.铝和稀盐酸:2Al + 6HCl = 2AlCl3 + 3H2↑离子方程式:2Al + 6H+ = 2Al3+ + 3H2↑4.铝和NaOH溶液:2Al+2NaOH+2H2O=2NaAlO2+3H2↑离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑5.氧化铝和稀硫酸:Al2O3+3H2SO4=Al2(SO4)3+3H2O_离子方程式:Al2O3+6H+=2Al3++3H2O6.氧化铝和NaOH溶液:Al2O3 + 2NaOH = 2NaAlO2 +H2O 离子方程式:Al2O3 + 2OH-=2AlO2-+H2O7.氢氧化铝和盐酸:Al(OH)3+3HCl = AlCl3+3H2O离子方程式:Al(OH)3+3H+ = Al3++3H2O8.氢氧化铝和NaOH溶液:Al(OH)3 +NaOH = NaAlO2+2H2O离子方程式:Al(OH)3 +OH-= AlO2-+2H2O9.氢氧化铝受热分解:_2Al(OH)3Al2O3+3H2O_10.硫酸铝与氨水反应:Al2(SO4)3+6NH3·H2O=2Al(OH)3↓+3(NH4)2SO4离子方程式:_ Al3++3NH3·H2O=Al(OH)3↓+3NH4+_______11.AlCl3溶液中加入少量NaOH溶液:AlCl3+3NaOH=A l(O H)3↓+3NaClAlCl3溶液中加入过量NaOH溶液:AlCl3+ 4NaOH =NaAlO2+ 3NaCl+2H2O 12.往偏铝酸钠溶液中通入少量CO2:2NaAlO2+3H2O+CO2=2A l(O H)3↓+Na2CO3往偏铝酸钠溶液中通入足量CO2:NaAlO2+2H2O+CO2=A l(O H)3↓+NaHCO313.电解氧化铝:2Al2O34Al+3O2↑三、铁及其化合物1.铁与氧气反应:3Fe +2O2Fe3O4铁与硫反应:Fe + S FeS2.铁与盐酸反应:Fe + 2HCl = FeCl2 + H2↑离子方程式:Fe + 2H+ = Fe2+ + H2↑_铁与CuSO4溶液:Fe+CuSO4=FeSO4+Cu离子方程式:Fe+Cu2+=Fe2++Cu_3.铁和水蒸气:_3Fe + 4H2O(g) 高温Fe3O4 + 4H2_4.氧化亚铁与盐酸反应:FeO+2HCl=FeCl2+H2O离子方程式:FeO+2H+=Fe2++H2O _5.氧化铁与盐酸反应:_Fe2O3+6HCl=2FeCl3+3H2O离子方程式:Fe2O3+6H+=2Fe3++3H2O_6.CO还原氧化铁:_ Fe2O3 + 3CO 高温2Fe + 3CO2_7.氯化铁与氢氧化钠溶液:FeCl3+3NaOH = Fe(OH)3↓+3NaCl_离子方程式:Fe3++3OH-= Fe(OH)3↓8.硫酸亚铁与氢氧化钠溶液:FeSO4+2NaOH=Fe(OH)2↓+Na2SO4离子方程式:Fe2++2OH-= Fe(OH)2↓9.氢氧化铁加热分解:__2Fe(OH)3Fe2O3+3H2O_____10.氢氧化亚铁被氧化成氢氧化铁:4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3_11.除去FeCl2中的FeCl3:2FeCl3 + Fe = 3FeCl2_离子方程式:2Fe3+ + Fe = 3Fe2+_12.FeCl2和Cl2反应:_2FeCl2 + Cl2 = 2FeCl3_离子方程式:_2Fe2+ + Cl2 = 2Fe3++2Cl-13.FeCl3和Cu反应:2FeCl3+Cu=2FeCl2+CuCl2_离子方程式:2Fe3++Cu=2Fe2++Cu2+14.氯化铁与硫氰化钾溶液反应:_Fe3+ + 3SCN-= Fe(SCN)3___四、硅及其化合物1.硅与氧气加热:Si+O2SiO2硅与氟气:_Si+2F2=SiF4__2.硅单质与氢氟酸反应:Si+4HF=SiF4+2H23.硅与氢氧化钠溶液反应:Si+2NaOH+H2O=Na2SiO3+2H2↑4.二氧化硅与氢氟酸反应:_4HF+SiO2=SiF4↑+2H2O _5.二氧化硅与氧化钙高温反应:SiO2+CaO 高温CaSiO3__6.二氧化硅与氢氧化钠溶液反应:SiO2 + 2NaOH = Na2SiO3 + H2O__7.二氧化硅与碳反应:_ SiO2 + 2C 高温Si + 2CO↑_8.硅酸钠与盐酸反应:_ Na2SiO3+2HCl=H2SiO3↓+2NaCl__离子方程式: SiO32-+2H+=H2SiO3↓9.往硅酸钠溶液中通入二氧化碳:_Na2SiO3+CO2+H2O == H2SiO3↓+ Na2CO3_10.二氧化硅与纯碱反应:SiO2+Na2CO3高温Na2SiO3+CO2↑_11.二氧化硅与石灰石反应:_ SiO2+CaCO3高温CaSiO3+CO2↑_12.加热硅酸:H2SiO3SiO2+H2O五、氯及其化合物1.实验室制氯气:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O_离子方程式:MnO2+4H++2Cl- Mn2++Cl2↑+2H2O2.钠在氯气中燃烧:_2Na+Cl2 2NaCl_铁在氯气中燃烧:2Fe+3Cl2 2FeCl3_铜在氯气中燃烧:Cu + Cl2 CuCl2氢气在氯气中燃烧:H2 + Cl2 2HCl _3.氯气和水反应:Cl2 + H2O = HCl + HClO离子方程式:Cl2 + H2O = H++Cl- + HClO4.次氯酸光照分解:_2HClO 2HCl + O2↑_5.氯水中通入二氧化硫:Cl2+SO2+2H2O=H2SO4+2HCl离子方程式:Cl2+SO2+2H2O=4H++SO42-+2Cl-6.氯气与氢氧化钠溶液:Cl2+2NaOH=NaCl+NaClO+H2O离子方程式:Cl2+2OH-=Cl-+ClO-+H2O7.工业生产漂白粉:_2Ca(OH)2 + 2Cl2=Ca(ClO)2 + CaCl2 + 2H2O _8.漂白粉漂白原理:_Ca(ClO)2 + CO2 + H2O =CaCO3↓ + 2HClO _9.向漂白粉溶液中加入稀盐酸:Ca(ClO)2 + 2HCl=CaCl2 +2HClO10.氯气通入溴化钾溶液:Cl2 + 2KBr = Br2 + 2KCl离子方程式:Cl2 + 2Br- = Br2 + 2Cl-氯气通入碘化钾溶液:Cl2 + 2KI = I2 + 2KCl离子方程式:_Cl2 + 2I- = I2 + 2Cl-溴水和碘化钾溶液反应:Br2 +2KI = I2+2KBr离子方程式:Br2 +2I- = I2+2Br-11.氯化钠和硝酸银溶液:AgNO3+ NaCl =AgCl↓+ NaNO3离子方程式:Ag++Cl-=AgC l↓溴化钠和硝酸银溶液:AgNO3+ NaBr=AgBr↓+ NaNO3离子方程式:Ag++Br-=AgBr↓_ 碘化钠和硝酸银溶液:AgNO3+ NaI =AgI↓+ NaNO3离子方程式:Ag++I-=AgI↓_ 六、硫及其化合物1.硫在空气中燃烧:_S+O2SO2__硫与氢气加热:S+H2H2S2.二氧化硫与水:_ SO2+H2O H2SO3_二氧化硫与氧化钙:_ SO2+CaO=CaSO3_少量SO2与氢氧化钠:_2NaOH+SO2=Na2SO3+H2O _离子方程式:_2OH-+SO2=SO32-+H2O_过量SO2与氢氧化钠:_ NaOH+SO2=NaHSO3_离子方程式:_ OH-+SO2= HSO3-_3.SO2通入过量的澄清石灰水: Ca(OH)2+SO2=CaSO3↓+H2O过量的SO2通入澄清石灰水:Ca(OH)2+2SO2=Ca(HSO3)24.二氧化硫与硫化氢:SO2 + 2H2S=3S↓+2H2O5.SO2的催化氧化:6.亚硫酸钠和硫酸反应:_Na2SO3+H2SO4=Na2SO4 +SO2↑+H2O__7.Na2SO3与氧气反应:_2Na2SO3+O2=2Na2SO4_8.三氧化硫和水反应:_ SO3+H2O=H2SO4_9.三氧化硫与氧化钙:__ SO3+CaO= CaSO4_10.三氧化硫与氢氧化钙:_Ca(OH)2+SO3=CaSO4↓+H2O _11.铜与浓硫酸反应:_ Cu + 2H2SO4 (浓)CuSO4 + 2H2O+SO2 ↑_12.碳与浓硫酸反应:_ C + 2H2SO4(浓) 2H2O+CO2↑+2SO2↑_七、氮及其化合物1.氮气和氧气反应:_N2 + O2 2NO_2.工业合成氨:_ N2 + 3H2催化剂高温高压2NH3_3.一氧化氮与氧气反应:2NO + O2= 2NO2_4.NO2溶于水:_3NO2 + H2O = 2HNO3 + NO_5.氨气溶于水: NH3 + H2O NH3·H2O氨水显弱碱性(电离方程式):NH3·H2O NH4+ + OH-6.浓氨水受热分解_ NH3·H2O △NH3↑+H2O __7.氨气和氯化氢:_ HCl + NH3 = NH4Cl _8.氨的催化氧化_4NH3 +5O2 4NO + 6H2O_9.氯化铵受热分解:_ NH4Cl NH3+HCl_10.碳酸氢铵受热分解:_ NH4HCO3NH3↑+ H2O↑ + CO2↑_11.硝酸铵和NaOH:NH4NO3 + NaOH NaNO3 + NH3↑+H2O_离子方程式:NH4++ OH-NH3↑+H2O12.实验室制氨气:_2NH4Cl + Ca(OH)2CaCl2 + 2NH3↑+2H2O13.浓硝酸与铜反应:4HNO3(浓)+Cu Cu(NO3)2+2NO2↑+2H2O离子方程式:4H++2NO3-+Cu Cu2++2NO2↑+2H2O14.稀硝酸与铜反应:8HNO3(稀)+3Cu 3Cu(NO3)2+2NO↑+4H2O离子方程式:8H++2NO3-+3Cu 3Cu2++2NO↑+4H2O15.硝酸见光分解:_4HNO3=4NO2↑+O2↑+2H2O(见光或受热分解)_16.NH4+的检验离子方程式:NH4++ OH-NH3↑+H2O17.NO2、O2混合气通入水中无剩余气体:4NO2 + O2 + 2H2O = 4HNO318.NO、O2混合通入水中无剩余气体:4NO+ 3O2 + 2H2O = 4HNO3放电。
1.镁在氧气中燃烧:现象:燃烧、放出大量的热、同时放出
2.铁在氧气中燃烧:现象:剧烈燃烧、火星四射、生成黑色的固体
3.铜在氧气中受热:
4.铝在空气中燃烧:
5.氢气在氧气中燃烧:现象:淡蓝色的火焰
6.红磷在空气中燃烧:现象:生成白烟
7.硫粉在氧气中燃烧:现象:空气中是的火焰;纯氧中是的火焰;同时都生成有刺激性气味的气体。
8.碳在氧气中充分燃烧:
9.汞(水银)在氧气中燃烧:
1双氧水催化制氧气:现象:溶液里冒出大量的气泡2.水在直流电的作用下分解:
3
4.
5..加热氧化汞:
6
现象:
7碳酸钠和盐酸反应:
8煅烧石灰石
姓名时间:5min
1.镁在氧气中燃烧:现象:燃烧、放出大量的热、同时放出
2.铁在氧气中燃烧:现象:剧烈燃烧、火星四射、生成黑色的固体
3.铜在氧气中受热:
4.铝在空气中燃烧:
5.氢气在氧气中燃烧:现象:淡蓝色的火焰
6.红磷在空气中燃烧:现象:生成白烟
7.硫粉在氧气中燃烧:现象:空气中是的火焰;纯氧中是的火焰;同时都生成有刺激性气味的气体。
8.碳在氧气中充分燃烧:
9.汞(水银)在氧气中燃烧:
姓名时间:5min
1双氧水催化制氧气:
2.水在直流电的作用下分解:
3加热氯酸钾(有少量的二氧化锰):
4加热高锰酸钾:
5铁和硫酸铜溶液:
现象:铁表面色物质生成,色溶液变为色
6硫酸铜和氢氧化钠反应
写出以下物质化学式:
氢氧化铝硝酸铵碳酸钠赤铁矿(主要成分氧化铁)
姓名时间:5min
1碳酸钠和盐酸反应:
2 实验室制备CO2原理:
3工业制备二氧化碳原理
4碳还原氧化铜,现象:色粉末变为色,生成的气体能使澄清石灰水
5一氧化碳还原氧化铜
6向装有CO2集气瓶中加水,再滴加紫色石蕊试剂,则紫色石蕊变为色,原理
写出以下物质化学式:
氧化锌氢氧化钙硝酸银硫酸亚铁
姓名时间:5min
1氢气还原氧化铜:
2 一氧化碳还原氧化铁:
3一氧化碳还原四氧化三铁:
4 煤炉的中层反应:
5澄清石灰水变浑浊原理:
6工业制备二氧化碳:
写出以下物质化学式:
硫酸钡盐酸氢氧化镁氧化亚铁。