抗体的基本结构(精制甲类)
- 格式:doc
- 大小:312.00 KB
- 文档页数:24

简述抗体的基本结构抗体(又称免疫球蛋白)是一类重要的免疫分子,具有识别和中和病原体的能力。
抗体的基本结构由四个亚单位组成,包括两个轻链和两个重链。
本文将以简述抗体的基本结构为标题,详细介绍抗体的组成和结构特点。
1. 抗体的重链和轻链抗体的重链和轻链是由氨基酸序列组成的多肽链。
在人类的抗体中,重链有五种亚型,分别为IgM、IgG、IgA、IgD和IgE,而轻链有两种亚型,分别为kappa和lambda。
重链和轻链通过二硫键相连形成抗体的骨架结构。
2. 抗体的结构域抗体的结构域是指抗体分子上具有特定功能和结构的区域。
抗体的结构域包括可变区(variable region)和恒定区(constant region)。
可变区负责与抗原结合,决定了抗体的特异性;而恒定区则决定了抗体的功能和效应。
3. 抗体的可变区抗体的可变区由重链和轻链的氨基酸序列组成,其中包含了抗体的抗原结合位点。
可变区的序列在不同的抗体中表现出较高的变异性,这是由于免疫系统的基因重组和突变机制所致。
可变区的变异使得抗体能够识别多样性的抗原。
4. 抗体的恒定区抗体的恒定区在不同的抗体中表现出较低的变异性,这是由于恒定区的序列由基因家族所决定。
恒定区的序列决定了抗体的功能和效应,如中和病原体、激活免疫细胞和促进免疫效应等。
5. 抗体的抗原结合位点抗体的抗原结合位点是指抗体与抗原结合的区域,也称为抗体的亲和位点。
抗原结合位点由可变区的氨基酸序列决定,具有高度的特异性。
抗体通过与抗原结合来识别和中和病原体,从而发挥免疫效应。
6. 抗体的异构型抗体的异构型是指抗体分子中恒定区的结构差异。
在不同的抗体亚型中,恒定区的结构会发生变化,从而影响抗体的功能和效应。
例如,IgM抗体在结构上较大,能够聚集形成多价抗体,增强其中和病原体的效果。
7. 抗体的二级结构抗体的二级结构主要由α螺旋和β折叠构成。
重链和轻链中的可变区和恒定区都具有这种二级结构。
这种特殊的二级结构使得抗体能够具有稳定的空间构象,并保持其与抗原的特异性相互作用。

抗体的基本结构和功能介绍抗体(又称免疫球蛋白)是一种由免疫细胞产生的蛋白质,广泛存在于人体的血液和组织液中。
抗体在人体的免疫系统中起着至关重要的作用,能够识别和中和病原体、调节免疫反应、参与细胞间信号传导等。
本文将详细介绍抗体的基本结构和功能,以便更好地理解免疫过程和临床应用。
一、抗体的结构1.1 Fab和Fc区域抗体由两个相同的轻链(light chain)和两个相同的重链(heavy chain)组成。
每条轻链和重链都由一系列氨基酸残基连接而成,形成抗体的基本结构。
在抗体分子中,Fab(antigen binding fragment)区域负责与抗原结合,Fc(fragment crystallizable)区域则负责与免疫细胞相互作用。
1.2 IGH和IGL基因抗体的结构由基因编码决定,人体中有数百个IGH(immunoglobulin heavy chain)和IGL(immunoglobulin light chain)基因,它们通过基因重排和突变形成多样的抗体。
IGH基因编码重链的变量(V)区域、多样(D)区域、连接(J)区域和常规(C)区域,而IGL基因编码轻链的V区域和C区域。
1.3 亲和力成熟抗体的变量区域包含了可以识别和结合抗原的亲和力决定区(CDR, complementarity-determining region)序列,这些序列的组合能够使抗体与多种抗原结合并启动免疫反应。
亲和力的形成是通过基因突变和选择过程中的变异和筛选完成的,亲和力成熟是个体免疫系统应对病原体进化的重要机制。
二、抗体的功能2.1 识别和中和病原体抗体通过其变量区域与抗原结合,从而识别和中和潜在的致病病原体。
当抗体与抗原结合时,可以阻止病原体侵入宿主细胞、中和细菌毒素、聚集病毒颗粒等。
这一过程对于防御感染和预防疾病的发生起着重要作用。
2.2 调节免疫反应抗体不仅能够识别和中和病原体,还能够调节免疫反应的进程。


简述抗体的基本结构抗体是一种由蛋白质组成的分子,也称为免疫球蛋白。
它在免疫系统中起着至关重要的作用,能够识别并结合到体内外的抗原上,从而参与免疫应答的调节和效应。
抗体的基本结构可以分为四个区域:两个相同的轻链(light chain)和两个相同的重链(heavy chain)。
轻链和重链通过二硫键连接在一起,形成了Y形结构。
每个抗体分子都有两个臂和一个柄。
臂部位于抗体的顶端,具有抗原识别和结合的功能;柄部位于抗体的底部,具有效应分子结合的功能。
轻链是由单个多肽链组成的,重链则由两个多肽链组成。
轻链和重链都由一系列的可变区(variable region)和恒定区(constant region)组成。
可变区的序列在不同的抗体中具有高度的变异性,决定了抗体的特异性和亲和力。
恒定区的序列相对保守,决定了抗体的功能和效应。
抗体的可变区包括特异性决定区(hypervariable region),也称为CDR。
CDR位于可变区的末端,由三个短序列组成,分别命名为CDR1、CDR2和CDR3。
CDR通过氢键、疏水作用和范德华力等相互作用与抗原结合,形成抗原-抗体复合物。
抗体的恒定区在不同的抗体类别中有所不同,包括IgG、IgM、IgA、IgD和IgE等。
每种抗体类别具有不同的功能和在免疫反应中的作用。
例如,IgG是最常见的抗体类别,具有长时间的循环寿命和多种效应分子结合的能力;IgM是第一次免疫应答产生的主要抗体类别,具有较高的亲和力和多价结合能力。
在人体内,抗体由B淋巴细胞(B lymphocyte)产生。
当机体遇到外来的抗原时,B淋巴细胞会受到激活,开始分泌抗体。
这个过程称为免疫应答。
一旦抗体与抗原结合,它们可以通过多种机制来识别和清除抗原,包括中和病原体、激活补体系统、调节免疫细胞的活化等。
抗体的结构和功能使其成为疾病诊断和治疗的重要工具。
通过检测体液中的抗体水平,可以确定感染病原体的存在,并评估免疫系统对其的应答情况。

第一节抗体的结构一、抗体的基本结构抗体的基本结构是由两条较长的多肽链和两条较短的多肽链通过二硫键连接呈“Y”形构成。
每条肽链分别由2~5个约含110个氨基酸,序列相似但功能不同的结构域(又称功能区)组成。
结构域的二级结构是由几股多肽链折叠形成的两个反向平行的β片层经一个链内二硫键连接稳定的“β桶状”结构。
(一)重链和轻链1.重链(heavy chain,H) 两条相同的长链称为重链(H链),约由450~550个氨基酸组成,分子量大约为50~75kD。
不同的重链其抗原性存在着一定的差异,因此可将其分为5类:μ链、γ链、α链、δ链、ε链,这五类重链分别与轻链组成完整的抗体分子,各自被命名为IgM、IgG、IgA、IgE和IgD。
不同类的抗体分子具有不同的特征及功能,如链内二硫键的数目和位置、结构域的数目、连接寡糖的数量以及铰链区的长度等均不完全相同。
即使是同一类抗体,铰链区氨基酸组成和重链二硫键的数目、位置也不同,据此可将其分为不同的亚类。
如人IgA 可分为IgA1和IgA2;IgG可分为IgG1~IgG4;IgM、IgE和IgD尚未发现有亚类。
2.轻链(light chain,L) 两条相同的短链称为轻链(L链),约由214个氨基酸组成,分子量大约为25kD。
轻链分为κ链和λ链,这两种轻链决定了Ig的型别,可将抗体分为两型,即κ型和λ型。
一个天然抗体分子上两条轻链的型别总是相同的,但同一个体内可存在分别带有κ或λ链的抗体分子。
五类抗体中每类抗体的轻链中都可以有κ链或λ链,两型轻链的功能无差异。
不同种属生物体内两型轻链的比例不同,正常人血清免疫球蛋白κ:λ约为2:1,而在小鼠则为20:1。
κ:λ比例的异常可能反映免疫系统的异常,例如人类人类免疫球蛋白λ链过多,提示可能有产生λ链的B细胞肿瘤。
由于λ链恒定区个别氨基酸之间存在一定差异,又可将λ链分为四个亚型:λ1、λ2、λ3和λ4。
(二)可变区和恒定区通过分析不同抗体分子重链和轻链的氨基酸组成和排列顺序,发现重链和轻链靠近N端的约110个氨基酸的序列变化很大,其他部分氨基酸的组成和排列顺序则相对恒定。

抗体的名词解释微生物学在微生物学领域,抗体是研究免疫系统的关键组成部分。
抗体,也称免疫球蛋白,是机体免疫系统中一类具有高度特异性的蛋白质。
它们由免疫细胞分泌,并在机体中起到识别、结合和中和外来病原体的作用。
一、抗体的基本结构抗体是由两个基本结构单元组成的,即重链和轻链。
其中,重链分为四种类型:IgG、IgM、IgA和IgE,轻链分为两种类型:κ链和λ链,这些基本结构单元将不同组合形成丰富多样的抗体。
抗体还具有“Y”字形的三维结构,其中“Y”字的两端为抗原结合位点,而“Y”字的顶端则是抗体的效应位点。
二、抗体的功能抗体具有多种功能,对于攻击和保护机体免受外来微生物的侵害起到了重要作用。
首先,抗体能够通过识别外来微生物表面的抗原决定簇结合到病原体上,从而标记该病原体以便免疫系统进一步处理。
其次,抗体还能激活免疫系统中的巨噬细胞、自然杀伤细胞和补体系统等,引发炎症反应和细胞毒性作用,以消灭病原体。
此外,抗体还能参与免疫记忆和免疫调节等免疫过程,对于维持机体内部的免疫平衡起到重要作用。
三、抗体的产生抗体的产生主要依赖于机体的免疫细胞,特别是淋巴细胞。
当机体受到外来病原体感染时,抗原会被呈递到淋巴组织中的抗原呈递细胞上,这些抗原呈递细胞会将抗原信息传递给免疫细胞。
免疫细胞中的B淋巴细胞随即被激活,并开始产生和分泌抗体。
这一过程被称为体液免疫应答,产生的抗体会迅速进入血液循环,通过对病原体进行中和,起到阻止病原体侵入和扩散的作用。
四、抗体的应用抗体不仅在免疫系统中起到重要作用,在医学和生物工程等领域也具有广泛应用。
例如,抗体可以用于诊断某些病原体感染,通过检测抗体水平来判断是否感染。
此外,抗体还可以用于治疗某些疾病,如恶性肿瘤。
在生物工程领域,科学家们利用重组技术生产抗体药物,以满足临床上的需求。
五、抗体研究的发展随着科学技术的不断发展,抗体研究也在不断深入。
科学家们通过对抗体结构和功能的深入了解,不断探索新的抗体工程方法,以提高抗体的亲和力和特异性。

抗体的基本结构抗体是一种特殊的抗原分子,它与外界的其他微生物、抗原或毒素发生反应,对其进行抵抗和清除。
抗体的基本结构是指它的分子组成,即它的结构与功能,以及它们与其环境的相互作用。
抗体是分子组成的复杂结构,其中包含了大量的亚基(subunit)。
抗体由两个不同的抗原结合起来,形成一个双聚体,称为抗体双聚体(antibody dimer)。
每个单元都有其自身的特殊功能,它们在体内结合起来,共同发挥抗体的功能。
抗体双聚体由两个亚基(heavy chain subunit和light chain subunit)组成,它们互相错开,形成一个带有特殊形状的V字型结构。
重亚基包含了四个结构域:FCR、VH、VL和CDR,这四个域分别负责了抗体的活性、特异性、与受体的结合等功能。
轻亚基也由 FCR、VL和CDR三个域组成,分别负责多样性、受体结合和活性等功能。
抗体双聚体的结构非常稳定,而且它能够结合其他抗原,从而实现免疫反应。
在体内,抗体可以与抗原结合,并发生特异性的免疫反应。
该反应的特异性对于抗体的结构也有很大的影响,包括FV结构的稳定性、VH和VL的位置变化、CDR的变形以及FCR的连接方式等。
当抗体双聚体与抗原结合时,尤其是在FCR中,会发生位置变化,从而使抗体双聚体发生折叠改变,从而改变抗原抗体复合物的稳定性。
此外,抗体双聚体还能够与特定的受体结合,该受体可以有助于结合其他分子,从而发挥免疫反应的功能。
受体与抗体双聚体之间的结合依赖于受体上的特定序列,以及其与抗体双聚体之间的相互作用力。
该结合可以通过特异性结合(特异性结合)和非特异性结合(交联结合)两种方式发生,这种结合对于抗原抗体反应有着重要的作用。
抗体的基本结构功能在于它们与其他抗原之间协同发挥的功能,它们的特殊结构可以结合抗原,促进抗原与受体之间的相互作用,而这种相互作用可以促进抗体与抗原之间的免疫反应。
它们可以与受体结合,从而实现对外界抗原的识别,并发挥免疫功能。

抗体的结构组成抗体是人体免疫系统中的重要组成部分,它可以识别和结合抗原,从而参与免疫应答。
抗体的结构组成复杂多样,包括基本的单体结构、多样性区和亚类等。
本文将详细介绍抗体的结构组成。
1. 抗体的基本结构抗体分为五个类别,即IgM、IgD、IgG、IgA和IgE。
它们都由相似的基本结构单元组成,包括两个重链和两个轻链。
这两种链均具有一系列的区域,包括甲胎蛋白区(variable region,V区)和常规区(constant region,C区)。
重链有两类:“μ链”和“δ链”是IgM和IgD的特有重链;“γ链”是IgG的特有重链;“α链”是IgA的特有重链;“ε链”是IgE的特有重链。
轻链有两类:“κ链”和“λ链”。
2. 抗体的多样性区抗体的多样性区域是决定其特异性的关键部分。
抗体中的多样性区域包括重链和轻链的V区域。
抗体的V区域由多个互补决定区(complementarity-determining region,CDR)组成。
CDR是抗体中最具变异性的区域,决定了抗体与特定抗原结合的能力。
抗原结合位点通常位于抗体的VH和VL区域之间,也被称为互补决定区。
3. 抗体的细节结构(1)抗体的Fc区:抗体的Fc区是指抗体中的常规区(C区)和C区之间的一段区域。
Fc 区的结构差异决定了抗体亚类的差异。
例如,IgM和IgE的Fc 区有一个长的C 区段,而IgA的Fc 区有一个有四个C 区段的结构。
(2)抗体的Fab区:抗体的Fab 区是指抗体中的V区和C区的连接部分。
Fab 区包括两个抗原结合片段(F(ab’)2)。
每个Fab片段有一个抗原结合区和一个连接区。
4. 抗体的亚类抗体的重链的C区决定了抗体的亚类。
不同的抗体亚类在结构和功能上有所差异。
IgM是体液中第一次接触到抗原时产生的抗体。
它是由5个单体抗原片段(F(ab)2)加一个乳糖片段(Fc)组成的。
IgG是体液中最主要的抗体,也是体外免疫应答中最重要的抗体。
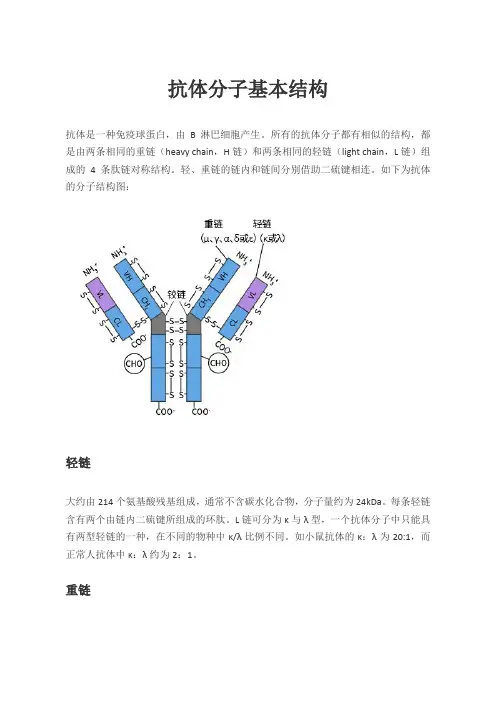
抗体分子基本结构抗体是一种免疫球蛋白,由B淋巴细胞产生。
所有的抗体分子都有相似的结构,都是由两条相同的重链(heavy chain,H链)和两条相同的轻链(light chain,L链)组成的4条肽链对称结构。
轻、重链的链内和链间分别借助二硫键相连。
如下为抗体的分子结构图:轻链大约由214个氨基酸残基组成,通常不含碳水化合物,分子量约为24kDa。
每条轻链含有两个由链内二硫键所组成的环肽。
L链可分为κ与λ型,一个抗体分子中只能具有两型轻链的一种,在不同的物种中κ/λ比例不同。
如小鼠抗体的κ:λ为20:1,而正常人抗体中κ:λ约为2:1。
重链重链大小约为轻链的2倍,含450~550个氨基酸残基,分子量约为55或75kDa。
根据H链抗原性的差异可将其分为5类:μ链、γ链、α链、δ链和ε链。
不同H链与L 链(κ或λ链)组成完整Ig的分子分别称之为IgM、IgG、IgA、IgD和IgE。
(抗体分类和亚型)可变区(V区)是抗体分子N端存在一段氨基酸序列变化较大的区域,由N端重链1/4和轻链1/2组成。
可变区存在可以与抗原特异性结合的部位,即抗原结合位点,用以决定抗体识别的特异性。
一个抗体有两个抗原结合位点,可以同时结合两个抗原分子。
某些特定位置的氨基酸残基的组成和排列顺序高度可变,称为超变区(HVR)又称为抗原互补决定区(CDR),共同组成Ig的抗原识别部位。
骨架区(FR)为于V区中除HVR以外的部位,此部分AA替换频率较低的部分,便于稳定HVR的结构。
可变区中CDR和FR的组成方式为“FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4”。
恒定区(C区)抗体分子C端氨基酸相对稳定的区域,占轻链1/2和重链3/4或4/5。
抗体轻链的恒定区由一个Ig结构域构成;重链的恒定区有3~4个串联的Ig结构域及一个用于增加灵活性的铰链区构成。
主要作用于免疫应答,具有许多重要的生物学功能。
铰链区在重链CH1尾部和CH2头部,有一个约30个氨基酸残基组成的柔性的铰链区(hinge region),其中脯氨酸含量极高,不形成α螺旋,易伸展弯曲,存在2~5个链间二硫键。

简述抗体的结构及其功能你想了解抗体的结构和功能吗?好的,我们来深入聊聊这个有趣的主题吧!首先,咱们得弄清楚什么是抗体。
抗体,简单来说,就是咱们身体里的“侦探”,专门识别和对付外来的坏家伙,比如病毒和细菌。
它们的结构就像个精巧的武器,有几个部分各司其职。
我们来分几个部分讲解一下。
1. 抗体的结构1.1 抗体的基本构造抗体的结构非常有趣。
想象一下,它们像一个Y字形的图标。
这Y字形的“手臂”就是抗体的两个“臂”,叫做“轻链”。
这两个臂在下端有一个地方特别神奇,叫做“抗原结合部位”。
它们就像是钥匙一样,专门找到并锁住“坏蛋”。
而Y字的“把手”部分,是叫做“重链”,它们负责和免疫系统里的其他部分合作,确保坏家伙被清除干净。
整个抗体的构造就像一把专门为捕捉坏蛋设计的高科技捕虫器。
1.2 抗体的种类抗体有很多种,通常分成几大类。
最常见的有IgG、IgM、IgA、IgE和IgD。
每一种都有自己的特别任务。
例如,IgG是我们身体的“主力军”,能在体内长期待着,守护我们免受各种侵害。
而IgM就像是第一时间赶到现场的警察,迅速反应。
IgA则是守护咱们的粘膜,比如口腔和肠道的“门卫”。
而IgE则主要对付过敏反应,比如花粉过敏。
IgD的任务还不太清楚,但也不闲着,它有助于调节免疫反应。
2. 抗体的功能2.1 识别和中和抗体的首要功能就是识别并中和外来物质。
当病毒或者细菌入侵体内,抗体们立刻行动起来。
它们会飞快地找到入侵者,然后“抱住”它们,像是给坏家伙打个紧箍咒,让它们动不了。
同时,抗体还会帮助招来其他免疫细胞,形成联合作战的局面,把这些坏家伙彻底干掉。
可以说,抗体就是咱们身体里的超级英雄,一直在守护着我们!2.2 免疫记忆另外,抗体还有一个特别牛的功能,那就是“免疫记忆”。
当抗体第一次对付完一个坏家伙后,它们会记住这次战斗的细节。
如果以后再遇到同样的敌人,它们能快速识别并处理。
这就像是有了一个完美的战斗计划,不用每次都从头来过。

抗体知识点总结一、抗体的基本概念抗体(antibody),也称免疫球蛋白,是机体免疫系统中的一种重要蛋白质,由免疫球蛋白和其他蛋白质组成。
抗体主要由B细胞产生,在免疫系统中起着重要的作用,可以识别并结合到抗原分子,并进行中和、沉淀、激活补体等免疫反应。
抗体的结构复杂,可以分为五个类别(IgM、IgG、IgA、IgD、IgE),每种类别具有不同的功能和特点。
二、抗体的结构1. 抗体的总体结构抗体的基本结构由两条重链和两条轻链组成,重链和轻链通过二硫键连接在一起,形成一条“Y”形的结构。
每个抗体分子上有两个抗原结合位点,可以与抗原特异性结合。
2. 抗体的免疫球蛋白结构每个抗体分子由一个具有特异性的抗原结合区域和一个常规结构的Fc区域组成。
抗原结合区域由重链和轻链上的可变区域共同组成,具有高度的多样性,可以与不同的抗原结合。
Fc区域由重链上的常规区域组成,具有一定的生物学功能。
3. 抗体的多样性抗体的多样性主要来源于其抗原结合区域的可变区域,每个抗体分子可以结合不同的抗原。
三、抗体的功能1. 中和作用抗体可以结合到细菌、病毒等病原微生物上,阻止其进入宿主细胞,从而起到中和病原微生物的作用。
2. 激活补体抗体结合到抗原上可以激活补体系统,引发细胞溶解、炎症反应等生物学效应。
3. 免疫沉淀抗体与抗原结合形成免疫复合物,可以沉淀在组织中,起到清除抗原的作用。
4. 刺激B细胞抗体与抗原结合后可以刺激B细胞产生更多的抗体,从而增强免疫反应。
5. 细胞毒作用某些抗体可以结合到靶细胞表面,引发细胞毒作用,促使细胞凋亡或溶解。
四、抗体的生成过程1. 抗原识别当机体内部或外部出现抗原刺激时,B细胞中的抗原受体可以识别并结合到抗原,激活B 细胞。
2. B细胞激活被激活的B细胞会开始增殖并分化成浆细胞和记忆B细胞。
3. 浆细胞产生抗体浆细胞是产生抗体的细胞,它可以大量合成和分泌特异性抗体。
4. 记忆B细胞记忆B细胞可以长期存留在机体内,当再次遇到相同的抗原时,可以迅速产生抗体,加强免疫反应。
简述抗体的基本结构和生物学功能抗体,也被称为免疫球蛋白(immunoglobulin, Ig),是一种由免疫系统产生的特殊蛋白质,主要作用是识别和中和体内外的病原体,保护机体免受感染。
抗体的基本结构和生物学功能是免疫系统最重要的组成部分之一抗体的基本结构包括四个多肽链,分为两对相同的轻链(light chains)和重链(heavy chains)。
每条轻链和重链由一系列不同的氨基酸组成,通过二硫键链接在一起形成抗体的Y形结构。
轻链分为κ(kappa)和λ(lambda)两种类型,重链则分为五个不同的类别:IgG、IgM、IgA、IgD和IgE。
抗体的Y形结构由两个抗原结合部位(Fab)和一个结构相同的晶体抗体组(Fc)组成。
Fab部分是抗体与抗原特异性相互作用的区域,每个Fab部分都包含一个完整的轻链和一半的重链。
Fab与抗原结合后,可以阻止病原体进入机体细胞或标记其以便被免疫系统识别和消除。
Fc区域位于抗体的尾部,包含另一半的重链,不直接与抗原相互作用,但是可以与其他细胞或分子结合,介导一系列生物学效应,如调理细胞介导的毒杀(ADCC)和补体激活。
抗体的生物学功能主要包括以下几个方面:1. 识别和结合抗原:抗体可以通过它的Fab区域与抗原(比如细菌、病毒、肿瘤细胞等)结合。
抗体与抗原之间的结合是高度特异性的,由抗体的可变区决定。
抗体与抗原的结合可以阻止病原体进入机体细胞,中和病原体毒素或标记它们以被免疫系统识别和清除。
2.补体激活:抗体的Fc区域可以识别和结合补体蛋白,进而激活免疫系统中的补体级联反应。
补体激活可以引发炎症反应和细胞溶解,直接杀伤病原体或增强其他免疫细胞的杀伤作用。
3.调理细胞介导的毒杀:抗体的Fc区域可以结合调理细胞上的Fc受体,如自然杀伤细胞(NK细胞)。
这种结合可以激活调理细胞,使其释放细胞毒性因子,直接杀伤抗原表达的细胞。
4.免疫记忆:抗体参与免疫系统的记忆反应。
当机体第一次暴露在特定抗原时,B淋巴细胞会产生和分泌相应的抗体。
抗体的基本结构和功能
一、引言
抗体是一种重要的免疫分子,具有广泛的生物学功能。
本文将介绍抗体的基本结构和功能。
二、抗体的基本结构
1. 抗体的种类
抗体分为五种类别:IgG、IgM、IgA、IgD和IgE。
2. 抗体的基本结构
抗体由两个重链和两个轻链组成,每条链都包含一个可变区域和一个恒定区域。
可变区域决定了抗体与特定抗原结合的能力,恒定区域则决定了抗体的生物学活性。
3. 抗原结合部位
每个抗体分子都有一个特异性决定区(CDR),也称为互补决定区
(CDR)。
CDR是由可变区域组成的,其序列决定了抗体与特定抗原结合的能力。
三、抗体的功能
1. 中和作用
中和作用是指通过与病毒或细菌表面上的特异性受体相互作用,阻止
它们进入宿主细胞并进行复制。
2. 凝集作用
凝集作用是指通过与多个细胞或颗粒相互作用,使它们聚集在一起形
成大块,从而更容易被免疫系统识别和清除。
3. 激活补体系统
抗体可以激活补体系统,引起炎症反应和细胞溶解。
4. 识别和标记作用
抗体可以识别和标记它们所结合的细胞或颗粒,从而被免疫系统清除。
5. 调节免疫反应
抗体可以调节免疫反应的强度和方向,从而保持机体内部环境的稳定性。
四、结论
抗体是一种重要的免疫分子,具有广泛的生物学功能。
通过了解其基本结构和功能,我们可以更好地理解免疫系统如何工作,并为开发新型治疗方法提供指导。
试述抗体的结构和分类抗体是一类特殊的蛋白质分子,也被称为免疫球蛋白。
它们在机体的免疫系统中起着至关重要的作用,可以识别和结合各种病原体,如细菌、病毒和其他外来物质。
抗体具有复杂而精确的结构,这使它们能够执行它们的生物学功能。
1. 抗体的结构抗体的基本结构由两个重链和两个轻链组成,形成了类似于Y形的分子。
每个抗体分子由四个部分组成,包括两个相同的Fab片段(抗原结合片段)和一个Fc片段(晶体片段)。
Fab片段包含了抗体与抗原结合的部分,而Fc片段则是抗体的效应部分。
抗体的重链和轻链由一系列不同的氨基酸残基组成。
它们通过非共价键(如二硫键)相连,并形成了一个稳定的结构。
在抗体的结构中,有一些区域是高度保守的,这意味着它们在不同的抗体中具有相似的序列和结构。
而其他区域则是高度变异的,这决定了抗体的特异性。
2. 抗体的分类根据其结构和功能的差异,抗体可以被分为不同的类别。
最常见的抗体类型包括IgG、IgM、IgA、IgD和IgE。
每种抗体类别都有其独特的特征和功能。
- IgG:IgG抗体是最常见的抗体类型,占人体内总抗体的75%。
它们在机体中起着重要的作用,通过中和病毒、调节免疫反应和促进细胞毒性等方式来保护我们免受感染。
- IgM:IgM抗体是第一种被产生的抗体类型,也是体液免疫中最有效的类别。
它们可以聚集形成五聚体,以提高其结合能力。
IgM抗体主要参与早期免疫反应,如血液中的病原体清除。
- IgA:IgA抗体主要存在于粘膜表面,如呼吸道、消化道和泌尿生殖道。
它们起着抵御病原体侵入的重要作用,并参与乳汁和泪液的免疫防御。
- IgD:IgD抗体的功能尚不完全清楚,但它们可能参与调节其他免疫细胞的活性,并影响抗体产生。
- IgE:IgE抗体主要与过敏反应相关。
当机体暴露在过敏原上时,IgE 抗体会结合到肥大细胞和嗜酸性粒细胞上,释放出一系列引发过敏反应的化学物质。
3. 对抗体的个人观点和理解抗体作为免疫系统的重要组成部分,对保护人体免受病原体侵害起着关键的作用。
简述抗体的结构及其功能1. 抗体的结构概述1.1 抗体的基本形态抗体,听起来是不是很高大上?其实,它们也不过是一群非常聪明的“免疫小卫士”。
它们的外形看起来像个字母“Y”,两条“手臂”加上一条“杆子”,这个形象有点像古代神话里的神杖。
不过,这个“Y”不仅仅是为了好看,它其实是抗体功能的关键所在。
每个抗体都有两个“手臂”,这两个手臂叫做“重链”和“轻链”,它们就像超级好搭档,一个负责抓捕敌人,另一个则负责汇报情况。
抗体的两条手臂末端有特殊的区域叫做“抗原结合部位”,就像每个警察都有一个专门的证件,抗体则有它们专属的“证书”,可以精准地识别并绑定到特定的入侵者身上。
这种“锁和钥匙”的关系,简直就是科学界的经典搭档。
1.2 抗体的结构细节抗体的“杆子”部分被称为“恒定区”,它的主要工作是支撑整个抗体的结构,稳定而牢固。
这个部分就像是抗体的“基石”,确保抗体不会像没有支撑的建筑一样崩溃。
而抗体的“手臂”部分则是“可变区”,这里的每一个小细节都可能有所不同,让每个抗体都能独特地识别各种入侵者。
简直就是免疫系统的“特工”,随时准备迎接不同的挑战。
2. 抗体的功能2.1 抗体的识别与中和抗体的主要功能之一就是识别外来的入侵者,比如病毒和细菌。
想象一下,抗体就像是精明的侦探,专门在体内寻找那些不速之客。
一旦找到,抗体就会通过它们的“手臂”紧紧地抓住这些入侵者。
然后,它们会把这些入侵者“锁住”,或者把它们送去“接受审判”。
这个过程称为“中和”,就是把入侵者搞定的意思。
抗体可以帮助消灭病毒,阻止它们在体内繁殖,简直是“天降神兵”。
2.2 抗体的标记与清除除了直接中和,抗体还有另一个重要功能,就是给入侵者打上“标签”,让其他免疫细胞更容易找到它们。
抗体会在入侵者的表面附上标记,这样那些专业的“清理工”就能迅速识别并处理这些入侵者了。
这个过程就像是给坏人贴上了“通缉令”,让他们无处遁形。
免疫系统的“清理队”会迅速行动,确保体内环境干净利索。
抗体的结构一、单体Porter等对血清IgG抗体的研究证明:Ig分子的基本结构是由四肽链组成的。
即:由二条相同的分子量较小的肽链(轻链)和二条相同的分子量较大的肽链(重链)组成。
轻链与重链是由二硫键连接形成一个四肽链分子称为Ig分子的单体;单体是构成所有免疫球蛋白分子的基本结构;所有抗体的单体都是四条肽链的对称结构,即:两条糖基化重链(H)和两条非糖基化轻链(L);每条重链和轻链分为氨基端(N端)和羧基端(C端)。
二、轻链和重链1、轻链(light chain,L链)由214个氨基酸残基组成,通常不含碳水化合物,分子量为24kD,有两个由链内二硫键组成的环肽,L链可分为:Kappa(κ)与 lambda(λ)2个亚型。
2、重链(heavy chain,H链)由450-550个氨基酸残基组成,分子量55-75kD,含糖数量不同,4-5个链内二硫键,可分为5类,μ、γ、α、δ、ε链,不同的H链与L链(κ或λ)组成完整的Ig分子。
分别称为:IgM,IgG,IgA,IgD和IgE。
三、可变区和恒定区通过对H链或L链的氨基酸序列比较分析,发现:其N-末端序列变化很大,称此区为可变区(V区);C-末端氨基酸则相对稳定,变化很小,称此区为恒定区(C区)。
1、可变区(Variable region,V区)L链N端1/2处(VL)108-111个氨基酸残基,H链N端1/5-1/4处(VH)118个氨基酸残基,V区有一个肽环65-75个氨基酸残基。
可变区可分为高变区(hypervariable region,HVR)和骨架区(framework region,FR),VL的HVR在24-34,50-56,89-97氨基酸位置。
VH的HVR在31-35,50-56,95-102氨基酸位置。
分别称为VL和VH的HVR1,HVR2,HVR3。
高变区为抗体与抗原的结合位置,称为决定簇互补区(complementarity- determining region,CDR),VL和VH的HVR1,HVR2,HVR3又分别称为CDR1,CDR2,CDR3,其中CDR3具有更高的高变程度,H链在与抗原结合中起重要的作用。
免疫球蛋白目录1. 拼音2. 英文参考3. 概述4. 免疫球蛋白分子的基本结构1. 轻链和重链2. 可变区和恒定区3. 功能区4. J链和分泌成分5. 单体、双体和五聚体6. 酶解片段5. 免疫球蛋白分子的功能1. 特异性结合抗原2. 活化补体3. 结合Fc受体4. 通过胎盘6. 免疫球蛋白分子的抗原性1. 同种型2. 同种异型3. 独特型7. 免疫球蛋白分子的超家族1. 免疫球蛋白超家族的组成2. 免疫球蛋白超家族的特点8. 各类免疫球蛋白的生物学活性1. IgG2. IgA3. IgM4. IgD5. IgE9. 免疫球蛋白基因的结构和抗体多样性1. Ig重链基因的结构和重排2. Ig轻链基因的结构和重排3. 抗体多样性的遗传学基础10. 药理作用11. 药品说明书1. 适应症2. 用量用法12. 相关文献具有抗体活性的血清蛋白称为免疫球蛋白,又称为抗体。
是由机体的B淋巴细胞在抗原的刺激下分化、分裂而成的一组特殊球蛋白。
人和动物的免疫血清中的免疫球蛋白极不均一,其组成、结构、大小、电荷、生物学活性等都有很大差异,约占机体全部血清蛋白的20~25%。
目前已在人、小鼠等血清中先后分纯得到5类免疫球蛋白,1968年,世界卫生组织统一命名为免疫球蛋白G(IgG)、免疫球蛋白M(IgM)、免疫球蛋白A(IgA)、免疫球蛋白D(IgD)、免疫球蛋白E(IgE)。
免疫球蛋白分子的基本结构Porter等对血清IgG抗体的研究证明,Ig单体分子的基本结构是由四条肽链组成的。
即由二条相同的分子量较小的肽链称为轻链和二条相同的分子量较大的肽链称为重链组成的。
轻链与重链是由二硫键连接形成一个四肽链分子称为Ig分子的单体,是构成免疫球蛋白分子的基本结构。
Ig单体中四条肽链两端游离的氨基或羧基的方向是一致的,分别命名为氨基端(N端)和羧基端(C端)。
图2-3 免疫球蛋白分子的基本结构示意图轻链和重链由于骨髓瘤蛋白(M蛋白)是均一性球蛋白分子,并证明本周蛋白(BJ)是Ig分子的L链,很容易从患者血液和尿液中分离纯化这种蛋白,并可对来自不同患者的标本进行比较分析,从而为Ig分子氨基酸序列分析提供了良好的材料。
1.轻链(lightchain,L)轻链大约由214个氨基酸残基组成,通常不含碳水化合物,分子量约为24kD。
每条轻链含有两个链内二硫键所组成的环肽。
L链共有两型:kappa(κ)与lambda(λ),同一个天然Ig分子上L链的型总是相同的。
正常人血清中的κ:λ约为2:1。
2.重链(heavychain,H链)重链大小约为轻链的2倍,含450~550个氨基酸残基,分子量约为55或75kD。
每条H链含有4~5个链内二硫键所组成的环肽。
不同的H链由于氨基酸的排列顺序、二硫键的数目和们置、含糖的种类和数量不同,其抗原性也不相同,根据H链抗原性的差异可将其分为5类:μ链、γ链、α链、δ链和ε链,不同H链与L链(κ或λ链)组成完整Ig的分子分别称之为IgM、IgG、IgA、IgD和IgE。
γ、α和δ链上含有4个环肽,μ和ε链含有5个环肽。
重链(heavy chain,H链)由450~570个氨基酸残基组成,分子量约为50~70kD。
不同的H链因氨基酸的排列顺序、二硫键的数目和位置、含糖的种类和数量不同,其抗原性也不相同,可将其分为μ链、γ链、α链、δ链、ε链五类,这些H链与L链(κ链或λ链)组成的完整Ig分子分别称为IgM(μ)、IgG(γ)、IgA (α)、IgD(δ)和IgE(ε可变区和恒定区通过对不同骨髓蛋白或本周蛋白H链或L链的氨基酸序列比较分析,发现其氨基端(N-末端)氨基酸序列变化很大,称此区为可变区(V),而羧基末端(C-末端)则相对稳定,变化很小,称此区为恒定区(C区)。
1.可变区(variableregion,V区)位于L链靠近N端的1/2(约含108~111个氨基酸残基)和H链靠近N端的1/5或1/4(约含118个氨基酸残基)。
每个V区中均有一个由链内二硫键连接形成的肽环,每个肽环约含67~75个氨基酸残基。
V区氨基酸的组成和排列随抗体结合抗原的特异性不同有较大的变异。
由于V区中氨基酸的种类、排列顺序千变万化,故可形成许多种具有不同结合抗原特异性的抗体。
L链和H链的V区分别称为VL和VH。
在VL和VH中某些局部区域的氨基酸组成和排列顺序具有更高的变休程度,这些区域称为高变区(hypervariable region,HVR)。
在V 区中非HVR部位的氨基酸组面和排列相对比较保守,称为骨架区(framework region)。
VL中的高变区有三个,通常分别位于第24~34、50~65、95~102位氨基酸。
VL和VH 的这三个HVR分别称为HVR1、HVR2和HVR3。
经X线结晶衍射的研究分析证明,高变区确实为抗体与抗原结合的位置,因而称为决定簇互补区(complementarity-determining region,CDR)。
VL和VH的HVR1、HVR2和HVR3又可分别称为CDR1、CDR2和CDR3,一般的CDR3具有更高的高变程度。
高变区也是Ig分子独特型决定簇(idiotypic determinants)主要存在的部位。
在大多数情况下H链在与抗原结合中起更重要的作用。
图2-4 与抗原表位结合高变区(HVR)示意图(G表示相对保守的甘氨酸)2.恒定区(constantregion,C区)位于L链靠近C端的1/2(约含105个氨基酸残基)和H链靠近C端的3/4区域或4/5区域(约从119位氨基酸至C末端)。
H链每个功能区约含110多个氨基酸残基,含有一个由二锍键连接的50~60个氨基酸残基组成的肽环。
这个区域氨基酸的组成和排列在同一种属动物Ig同型L链和同一类H链中都比较恒定,如人抗白喉外毒素IgG与人抗破伤风外毒素的抗毒素IgG,它们的V区不相同,只能与相应的抗原发生特异性的结合,但其C区的结构是相同的,即具有相同的抗原性,应用马抗人IgG第二体(或称抗抗体)均能与这两种抗不同外毒素的抗体(IgG)发生结合反应。
这是制备第二抗体,应用荧光、酶、同位毒等标记抗体的重要基础。
功能区Ig分子的H链与L链可通过链内二硫键折叠成若干球形功能区,每一功能区(domain)约由110个氨基酸组成。
在功能区中氨基酸序列有高度同源性。
1.L链功能区分为L链可变区(VL)和L链恒定区(CL)两功能区。
2.H链功能区IgG、IgA和IgD的H链各有一个可变区(VH)和三个恒定区(CH1、CH2和CH3)共四个功能区。
IgM和IgE的H链各有一个可变区(VH)和四个恒定区(CH1、CH2、CH3和CH4)共五个功能区。
如要表示某一类免疫蛋白H链恒定区,可在C(表示恒定区)后加上相应重链名称(希腊字母)和恒定区的位置(阿拉伯数字),例如IgG重链CH1、CH2和CH3可分别用Cγ1、Cγ2和Cγ3来表示。
IgL链和H链中V区或C区每个功能区各形成一个免疫球蛋白折叠(immunoglobulin fold,Ig fold),每个Ig折叠含有两个大致平行、由二硫连接的β片层结构(betapleated sheets),每个β片层结构由3至5股反平行的多肽链组成。
可变区中的高变区在Ig折叠的一侧形成高变区环(hypervariable loops),是与抗原结合的位置。
3.功能区的作用(1)VL和VH是与抗原结合的部位,其中HVR(CDR)是V区中与抗原决定簇(或表位)互补结合的部位。
VH和VL通过非共价相互作用,组成一个FV区。
单位Ig分子具有2个抗原结合位点(antigen-bindingsite),二聚体分泌型IgA具有4个抗原结合位点,五聚体IgM可有10个抗原结合位点。
(2)CL和CH上具有部分同种异型的遗传标记。
(3)CH2:IgGCH具有补体Clq结合点,能活化补体的经典活化途径。
母体IgG借助CH2部分可通过胎盘主动传递到胎体内。
(4)CH3:IgGCH3具有结合单核细胞、巨噬细胞、粒细胞、B细胞和NK细胞Fc 段受体的功能。
IgMCH3(或CH3因部分CH4)具有补体结合位点。
IgE的Cε2和Cε3功能区与结合肥大细胞和嗜碱性粒细胞FCεRI有关。
4.铰链区(hingeregion)铰链区不是一个独立的功能区,但它与其客观存在功能区有关。
铰链区位于CH1和CH2之间。
不同H铰链区含氨基酸数目不等,α1、α2、γ1、γ2和γ4链的铰链区较短,只有10多个氨基酸残基;γ3和δ链的铰链区较长,约含60多个氨基酸残基,其中γ3铰链区含有14个半胱氨酸残基。
铰链区包括H链间二硫键,该区富含脯氨酸,不形成α-螺旋,易发生伸展及一定程度的转动,当VL、VH与抗原结合时此氏发生扭曲,使抗体分子上两个抗原结合点更好地与两个抗原决定簇发生互补。
由于CH2和CH3构型变化,显示出活化补体、结合组织细胞等生物学活性。
铰链区对木瓜蛋白酶、胃蛋白酶敏感,当用这些蛋白酶水解免疫球蛋白分子时常此区发生裂解。
IgM和IgE缺乏铰链区。
J链和分泌成分1.J链(joining chain)存在于二聚体分泌型IgA和五聚体IgM中。
J链分子量约为15kD,由于124个氨基酸组成的酸性糖蛋白,含有8个半胱氨酸残基,通过二硫键连接到μ链或α链的羧基端的半胱氨酸。
J链可能在Ig二聚体、五聚体或多聚体的组成以及在体内转运中的具有一定的作用。
2.分泌成分(secretorycomponent,SC)又称分泌片(secretory piece),是分泌型IgA上的一个辅助成分,分子量约为75kD,糖蛋白,由上皮细胞合成,以共价形式结合到Ig分子,并一起被分泌到粘膜表面。
SC的存在对于抵抗外分泌液中蛋白水解酶的降解具有重要作用。
单体、双体和五聚体1.单体由一对L链和一对H链组成的基本结构,如IgG、IgD、IgE血清型IgA。
2.双体由J链连接的两个单体,如分泌型IgA(secretory IgA,SIgA)二聚体(或多聚体)IgA结合抗原的亲合力(avidity)要比单体IgA高。
图2-5 分泌型IgA结构示意图3.五聚体由J链和二硫键连接五个单体,如IgM。
μ链Cys414(Cμ3)和Cys575(C 端的尾部)对于IgM的多聚化极为重要。
在J链存在下,通过两个邻近单体IgMμ链Cys之间以及J链与邻μ链Cys575之间形成二硫键组成五聚体。
由粘膜下浆细胞所合成和分泌的IgM五聚体,与粘膜上皮细胞表面pIgR(poly-Ig receptor,pIgR)结合,穿过粘膜上皮细胞到粘膜表面成为分泌型IgM(secretory IgM)。
酶解片段1.本瓜蛋白酶的水解片段Porter等最早用木瓜蛋白酶(papain)水解兔IgG,从而区划获知了Ig四肽链的基本结构和功能。