ⅵ 物质的标准摩尔生成焓、标准摩尔生成吉
- 格式:doc
- 大小:116.50 KB
- 文档页数:7

标准摩尔焓变与标准摩尔生成焓的关系
标准摩尔焓变是指在常压常温下,物质在化学反应中释放或吸收的热量,表示为ΔH。
标准摩尔生成焓是指在标准状态下,一个摩尔化合物由其组成元素在标准状态下生成的过程中释放的热量,表示为ΔH^⁰_formation。
两者之间的关系可以通过以下公式表示:
ΔH = ∑(ΔH^⁰_formation产物 - ΔH^⁰_formation反应物)
也就是说,标准摩尔焓变可以通过反应物和产物的标准摩尔生成焓之差求得。
这是因为焓是一个状态函数,它只依赖于起始和终止的状态,所以在反应过程中,每个产生或消耗的化学键的生成焓之和等于反应的焓变。

标准摩尔焓变和标准摩尔生成焓
标准摩尔焓变和标准摩尔生成焓是化学中常用的概念,它们用于描述化学反应的热力学特征。
标准摩尔焓变指在标准状态下,1摩尔物质从一种物态转化为另一种物态所伴随的焓变化。
标准状态是指温度为298K、压力为1 atm 的状态。
标准摩尔生成焓指在标准状态下,1摩尔化合物从其构成元素在标准状态下的状态转化为该化合物的生成反应所伴随的焓变化。
标准摩尔生成焓是化合物的稳定性指标,它越低表示该化合物越稳定。
标准摩尔焓变和标准摩尔生成焓都可以通过测量反应热进行实
验测定。
它们的值可以用于计算化学反应的热力学参数,例如反应焓、反应熵和反应自由能等。
需要注意的是,在实际化学反应中,反应物和产物的物态、温度和压力等条件可能与标准状态不同,因此需要进行修正计算。
- 1 -。

物质的标准摩尔生成焓物质的标准摩尔生成焓是指在标准状态下,1摩尔物质生成的焓变化量。
它是描述化学反应过程中物质生成或消耗热量的重要物理量,也是研究化学反应热力学性质的重要参数之一。
首先,我们来了解一下摩尔生成焓的概念。
摩尔生成焓是指在标准状态下,1摩尔物质生成时所吸收或释放的热量。
在化学反应中,物质的生成焓可以通过化学方程式中反应物和生成物的生成焓之差来计算。
生成焓为负值表示放热反应,反之为吸热反应。
摩尔生成焓的计算通常需要考虑反应物和生成物的物态、温度、压强等因素。
在标准状态下,摩尔生成焓的计算更为简单,因为标准状态下的物质状态已经确定,压强为1大气,温度为25摄氏度。
对于气体的标准摩尔生成焓,通常以气态的生成焓为基准。
例如,氧气的标准生成焓为0,氢气的标准生成焓也为0。
而对于液体和固体的标准摩尔生成焓,通常以元素的稳定形态为基准。
例如,钻石的标准生成焓为0,液态水的标准生成焓也为0。
在化学反应中,摩尔生成焓的大小可以反映出反应的放热或吸热程度。
放热反应的摩尔生成焓为负值,表示反应放出热量;吸热反应的摩尔生成焓为正值,表示反应吸收热量。
这对于工业生产和实验室研究都有重要意义。
在实际应用中,我们可以通过实验测定化学反应的放热或吸热量,从而计算出摩尔生成焓。
这对于确定化学反应的热力学性质、优化工艺条件等都具有重要意义。
总之,物质的标准摩尔生成焓是描述化学反应热力学性质的重要物理量,它可以反映出反应的放热或吸热程度,对于工业生产和实验室研究都具有重要意义。
通过实验测定和计算,我们可以准确地确定化学反应的热力学性质,为工程技术和科学研究提供重要参考。
希望本文对您了解物质的标准摩尔生成焓有所帮助,谢谢阅读!。

物质的标准摩尔生成焓在化学领域中,摩尔生成焓是一个重要的概念,它用来描述在标准状态下,1摩尔物质在生成过程中吸收或释放的热量。
摩尔生成焓是一个与化学反应相关的热力学量,它可以帮助我们理解化学反应的热力学性质,以及预测反应的热效应。
本文将对物质的标准摩尔生成焓进行详细的介绍和解释。
首先,我们需要了解什么是标准状态。
在化学中,标准状态是指物质的温度为298K(25摄氏度),压强为1个大气压时的状态。
在标准状态下,物质的摩尔生成焓通常用ΔH°表示。
ΔH°的正负值表示了反应是吸热还是放热的,正值表示吸热,负值表示放热。
摩尔生成焓可以通过实验测定得到,也可以通过热力学数据计算得到。
实验测定摩尔生成焓通常需要进行燃烧实验或者溶解实验,通过测定反应前后的温度变化和压强变化,再结合热容和热容量的数据,可以计算出摩尔生成焓的数值。
而通过热力学数据计算摩尔生成焓,则需要使用标准生成焓的数据,结合反应的化学方程式,利用热力学公式进行计算。
摩尔生成焓的数值对于化学反应的研究和应用具有重要意义。
它可以帮助我们预测反应的热效应,判断反应是放热还是吸热的,从而指导工业生产和化学实验的进行。
在工业生产中,了解反应的热效应可以帮助我们设计反应装置,控制反应条件,提高反应的效率和产率。
在化学实验中,摩尔生成焓的数值可以帮助我们理解反应的特性,指导实验的进行,以及解释实验现象。
除了对化学反应有着重要的意义之外,摩尔生成焓还可以帮助我们理解物质的热力学性质。
通过比较不同物质的摩尔生成焓,我们可以了解它们在化学反应中的活性和稳定性,从而为物质的应用提供参考。
同时,摩尔生成焓也可以帮助我们理解物质的结构和键合特性,揭示物质内部的微观过程和规律。
总之,物质的标准摩尔生成焓是一个重要的热力学量,它可以帮助我们理解化学反应的热力学性质,预测反应的热效应,指导工业生产和化学实验的进行,以及揭示物质的热力学性质和微观规律。
通过对摩尔生成焓的研究和应用,我们可以更好地认识和理解化学世界,为化学领域的发展和应用提供重要的支持和指导。

标准摩尔生成焓和反应的标准摩尔焓变标准摩尔生成焓和反应的标准摩尔焓变摩尔生成焓是化学反应中产生1摩尔物质所释放或吸收的热量。
标准状况下,摩尔生成焓又称为标准摩尔生成焓,表示在标准温度和压力下,1摩尔物质在其稳定态产生的热量变化。
而反应的标准摩尔焓变则表示化学反应1摩尔物质参与反应时的热量变化。
这两个概念在化学热力学中具有重要意义。
【主要概念】1. 标准摩尔生成焓:在标准状况下,1摩尔物质从其元素标准状态形成的热量变化。
2. 反应的标准摩尔焓变:在标准状况下,1摩尔反应物参与反应时的热量变化。
【深度探讨】1. 标准摩尔生成焓的计算方法标准摩尔生成焓可以通过实验测定得到,也可以通过化学反应焓的推导来计算。
标准状况下,摩尔生成焓的计算通常基于热力学性质和反应的热平衡条件。
对于气体物质,可以利用热力学数据手册中提供的标准生成焓值进行计算。
而对于固体或液体物质,则需要通过实验测定反应热量得出。
2. 反应的标准摩尔焓变的影响因素反应的标准摩尔焓变受到多种因素的影响,例如反应的类型、反应物的物态和温度等。
在化学反应中,放热反应的标准摩尔焓变为负值,表示反应放出热量;而吸热反应的标准摩尔焓变为正值,表示反应吸收热量。
3. 标准摩尔生成焓和反应的意义和应用标准摩尔生成焓和反应的标准摩尔焓变是研究化学反应热力学性质的重要工具,有着广泛的应用。
在工业生产和实验室研究中,常常需要通过这些参数来评价反应的热力学稳定性,优化反应条件,设计催化剂和控制反应过程。
【总结回顾】在化学反应中,标准摩尔生成焓和反应的标准摩尔焓变是化学热力学重要的概念。
通过对这两个概念的深入理解,我们可以更好地理解化学反应的热力学性质,提高生产和研究中反应条件的控制和设计能力。
在实际应用中,标准摩尔生成焓和反应的标准摩尔焓变也为化学工程带来了许多便利和创新。
【个人观点】对于化学热力学感兴趣的我来说,学习和掌握标准摩尔生成焓和反应的标准摩尔焓变是非常重要的。

物质的标准摩尔生成焓
标准摩尔生成焓是指在标准状态下,将1摩尔物质从其元素的稳定形态生成所需的焓变化。
标准状态指的是25℃(298K)
和1个大气压下。
由于不同物质的生成焓与反应过程有关,因此标准摩尔生成焓的值也因物质而异。
在化学反应中,物质的生成或分解通常与能量变化有关,根据热力学第一定律,焓变化可以表示为反应物的焓减少与产物的焓增加的和。
标准摩尔生成焓可以通过实验测量或计算方法来确定。
例如,对于氧气(O2)的生成焓,可以通过以下反应来计算:1/2 O2(g) → O(g) ΔH° = ΔHf°(O(g))
在该反应中,氧气分解为氧原子,生成焓即为氧原子的标准摩尔生成焓。
该值通常通过实验测量得出,并被定义为0。
因此,氧气的标准摩尔生成焓为0。
对于其他物质的生成焓,可以通过类似的方法进行测量或计算,以确定其标准摩尔生成焓的值。
这些值对于理解和预测化学反应的能量变化非常重要。

标准摩尔生成焓和标准摩尔反应焓的关系
标准摩尔生成焓和标准摩尔反应焓是热力学中的两个重要概念,它们之间有紧密的关系。
标准摩尔生成焓是指在标准状况下,将1摩尔的化学物质由其组成元素的标准态生成的反应焓变。
标准态是指物质在1个大气压和一定温度下的最稳定形态。
标准摩尔生成焓表示了化学物质形成过程中的热变化,可以用来表征物质的热稳定性和反应热力学性质。
标准摩尔反应焓是指在标准状况下,1摩尔反应物完全参与一定化学反应后的反应热变化。
标准摩尔反应焓可以通过实验测量或计算得出,用来描述化学反应的热力学性质和热能变化。
这两个概念的关系可以通过以下方式表示:
1. 标准摩尔生成焓是指将化学物质由其元素标准态生成的焓变,因
此它可以被看作是反应物参与反应时的焓变(取负值)。
2. 标准摩尔反应焓是指化学反应中的焓变,包括反应物和生成物之
间的差异。
如果化学反应是生成物减去反应物,那么标准摩尔反应焓就等于标准摩尔生成焓的和。
总之,标准摩尔生成焓可以视为反应的初始热变化,而标准摩尔反应焓则是考虑了反应物和生成物之间的差异的热变化。
它们之间的关系使我们能够从不同的角度研究和描述化学反应的热力学特性。

标准摩尔生成热和标准摩尔生成焓的关系《标准摩尔生成热与标准摩尔生成焓的关系》摩尔生成热和摩尔生成焓是化学中重要的概念,用于描述化学反应中物质生成的热效应。
两者有着密切的关联,互为衡量化学反应放热或吸热程度的指标。
摩尔生成热是指在标准条件下,一摩尔的物质由其组成元素的标准摩尔形态生成的热量变化。
它通常用ΔHr表示。
标准条件下,气体的压强为1 atm,温度为298 K,液体和固体的浓度为1 mol/L。
摩尔生成热是物质生成的整个热效应,既包括因化学键形成而释放的热量,也包括因杂质和非完全反应导致的热损失。
摩尔生成焓是指在标准条件下,一摩尔的物质生成时吸收或释放的热量。
它通常用ΔHf表示。
标准条件下,物质的摩尔生成焓等于其标准摩尔生成热。
杜鹃效应表明,在标准状态下,理想气体的摩尔生成焓等于其摩尔生成热。
摩尔生成热与摩尔生成焓之间的关系可以用下式表示:ΔHf = ΔHr + ΔH***lr、其中,ΔH***lr为反应热的热损失。
这意味着摩尔生成焓等于摩尔生成热加上反应热的热损失。
一般情况下,ΔH***lr可以被忽略不计。
摩尔生成热和摩尔生成焓的具体数值对于化学反应的研究和工程应用具有重要意义。
通过测量物质生成或燃烧时的热效应,我们可以了解反应的热力学性质以及反应的放热或吸热能力。
这有助于我们理解反应机理、优化反应条件并设计高效的化学反应工艺。
总之,摩尔生成热和摩尔生成焓是化学反应中的重要概念,它们之间有着密切的关联。
摩尔生成焓等于摩尔生成热加上反应热的热损失,用于描述化学反应中物质生成的热效应。
通过研究这些热效应,我们可以更好地理解化学反应的热力学特性,并在实际应用中做出有意义的决策。

反应的标准摩尔焓变等于生成物的标准摩尔生成焓反应的标准摩尔焓变等于生成物的标准摩尔生成焓,这是热化学中一个非常重要的定理。
在化学反应中,反应物与生成物之间的能量转化是不可避免的。
而标准摩尔焓变和标准摩尔生成焓则是描述这种能量转化的两个重要概念。
首先,我们来了解一下标准摩尔焓变的概念。
标准摩尔焓变是指在标准状态下,化学反应中所有反应物和生成物的摩尔焓之差。
其中,标准状态指的是 1 atm气压、298K温度下的状态。
因此,标准摩尔焓变可以表示为:ΔH° = ΣnH°(生成物) - ΣmH°(反应物)其中,ΔH°表示标准摩尔焓变,n和m分别表示生成物和反应物的摩尔数,H°表示标准摩尔生成焓或标准摩尔燃烧焓。
接下来,我们来了解一下标准摩尔生成焓的概念。
标准摩尔生成焓是指在标准状态下,生成1摩尔化合物时所释放或吸收的热量。
例如,将1摩尔氢气与1/2摩尔氧气在标准状态下完全燃烧生成1摩尔水时,所释放出的热量为-285.8 kJ/mol。
因此,水的标准摩尔生成焓为-285.8 kJ/mol。
根据反应的热力学定律,化学反应中所有反应物和生成物的能量总和保持不变。
因此,在化学反应中,反应物的标准摩尔焓变等于生成物的标准摩尔生成焓。
这个定理被称为“热力学基本定律”。
这个定理的意义非常重大。
通过测量反应物和生成物的标准摩尔生成焓,我们可以推算出反应的标准摩尔焓变。
这对于研究化学反应机理、计算燃料的热值、优化工业生产过程等方面都有着重要的应用价值。
总之,反应的标准摩尔焓变等于生成物的标准摩尔生成焓是一个非常重要的热力学定律。
它在化学反应研究、工业生产、能源计算等方面都有着广泛的应用。
物质的标准摩尔生成焓物质的标准摩尔生成焓是指在标准状态下,1摩尔物质生成的焓变化。
它是研究物质生成、反应热力学性质的重要参数,对于理解物质的热力学过程具有重要意义。
在化学反应中,物质的生成焓变化直接影响着反应的进行方向和速率。
因此,了解物质的标准摩尔生成焓对于化学工程、材料科学等领域具有重要意义。
在研究物质的标准摩尔生成焓时,我们需要了解一些基本概念。
首先,标准状态是指物质的温度为298K(25摄氏度),压强为1大气压时的状态。
其次,生成焓是指在标准状态下,1摩尔物质生成的焓变化。
生成焓可以是正值,表示生成物质时释放热量,也可以是负值,表示生成物质时吸收热量。
物质的标准摩尔生成焓可以通过实验测定得到,也可以通过计算获得。
实验测定通常采用反应热量计或燃烧热量计等仪器进行,通过测量反应前后系统的热量变化来确定生成焓的数值。
而计算方法则是利用热力学原理和化学键能的概念,通过结合反应方程式和标准生成焓的已知数值,来推导出所需物质的标准摩尔生成焓。
物质的标准摩尔生成焓与物质的性质密切相关。
例如,在化学工程中,了解不同物质的标准摩尔生成焓可以帮助工程师设计合适的反应条件,提高反应的效率和产率。
在材料科学领域,物质的标准摩尔生成焓也对于材料的热稳定性、燃烧性能等有重要影响。
此外,物质的标准摩尔生成焓还可以用于计算反应的热力学参数,例如反应焓、反应熵等。
这些参数对于研究反应的进行方向、平衡常数等有着重要的指导作用。
总之,物质的标准摩尔生成焓是研究物质热力学性质的重要参数,它对于理解化学反应、研究材料性能等具有重要意义。
通过实验测定和计算方法,我们可以准确地获得物质的标准摩尔生成焓,进而深入研究物质的热力学特性,为化学工程、材料科学等领域的发展提供重要的理论支持。
物质的标准摩尔生成焓
首先,我们来了解一下摩尔生成焓的定义。
摩尔生成焓是指在
标准状态下,1摩尔物质在化学反应中生成的焓变化。
在标准状态下,物质的温度为298K,压强为1atm。
摩尔生成焓通常用ΔH表示,单位是千焦或千卡。
摩尔生成焓的计算方法主要有两种,一种是利用热化学方程式,另一种是利用反应热的数据。
对于第一种方法,我们可以根据化学
方程式中反应物和生成物的摩尔数以及其对应的摩尔生成焓来计算
反应的总摩尔生成焓。
而对于第二种方法,我们可以利用已知物质
的标准摩尔生成焓数据,通过反应的摩尔数比例来计算出所需物质
的摩尔生成焓。
摩尔生成焓在化学反应中扮演着非常重要的角色。
首先,它可
以帮助我们预测化学反应的放热或吸热性质。
当反应的摩尔生成焓
为负值时,表示反应放热,释放能量;当反应的摩尔生成焓为正值时,表示反应吸热,吸收能量。
其次,摩尔生成焓还可以用来计算
化学反应的热效率,从而指导工业生产中的能量利用。
除此之外,摩尔生成焓还可以帮助我们理解物质的热力学性质。
通过对不同物质的摩尔生成焓进行比较,我们可以了解它们在化学反应中的稳定性和活性,从而为化学实验和工业生产提供参考。
总之,物质的标准摩尔生成焓是化学领域中一个重要的概念,它不仅可以帮助我们理解化学反应释放或吸收能量的过程,还可以为化学实验和工业生产提供指导。
希望本文的介绍能够帮助读者更好地理解和应用摩尔生成焓这一概念。
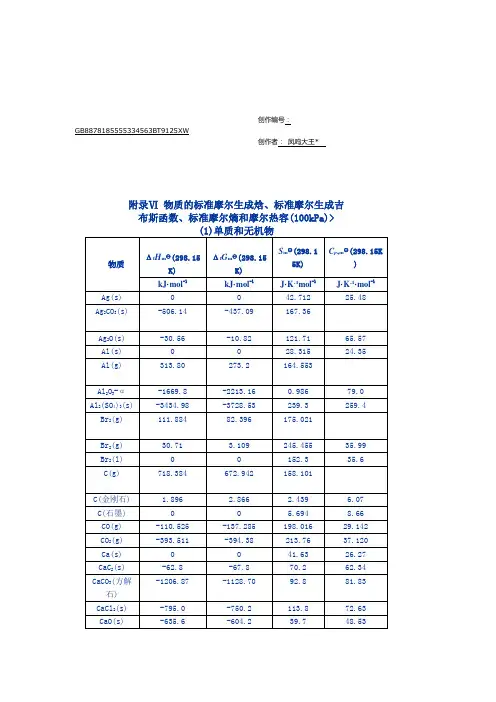
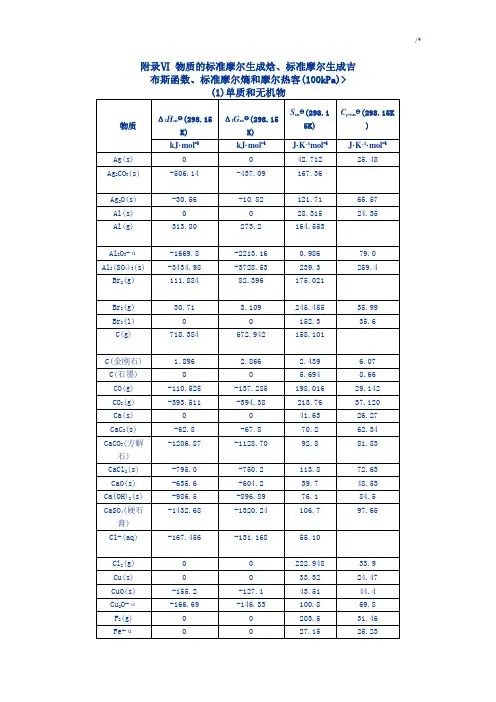
物质的标准摩尔生成焓的定义
标准摩尔生成焓是化学计量单位的一种。
定义为:在温度T (若为298.15K时则可不标出)下,由标准状态的单质生成物质B (νB=+1)反应的标准摩尔焓变。
即在标准状态下(反应物和产物都是处于100KPa,通常温度选定298.15K),由指定单质生成单位物质的量(1mol)的化合物的化学反应热(即恒压反应热),称为该物质的标准摩尔生成焓或标准生成热。
在标准压强和指定温度下,由最稳定的单质生成1mol该物质时的反应焓变。
标准摩尔生成焓的单位:kJ/mol。
简称生成热。