环己烷构象
- 格式:ppt
- 大小:359.50 KB
- 文档页数:9


环烷烃的构象链状化合物的构象是由基团绕C—Cσ键旋转产生的;而环状化合物的构象至少涉及到两个C—Cσ键和其键角的转动和变化,有时还涉及到键长和键角的变化,比较复杂,常称环的翻转。
一、环丙烷的构象环丙烷是三个碳的环,只能是平面构象,即它的构型。
尽管只有一种构象,但这个环极不稳定,主要因为:1、所有C-H键都是重叠构象,扭转张力大。
2、C原子是不等性杂化或弯曲键,有“角张力”存在。
二、环丁烷的构象环丁烷有两种极限构象:动画演示:平面式构象:象环丙烷一样,不稳定,存在扭转张力和“角张力”。
蝶式构象:能缓解扭转张力和角张力,呈蝶式构象。
通过平面式构象,由一种蝶式翻转成为另一种蝶式构象,处于动态平衡。
蝶式是优势构象。
也有扭转能力和角张力存在。
三、环戊烷的构象环戊烷的构象主要是信封式和半椅式构象。
两者处于平衡。
因为平面构象能量较大,一般认为环戊烷采取这种构象可能性很少。
E相对=19kJ/mol 信封式半椅式四、环己烷的构象环己烷的构象经过近百年的努力才建立起来。
Baeyer 1885年提出张力学说,认为环状化合物是平面构型Sachse 1889年质疑张力学说只适合小环,提出环已烷有船式、椅式两种构象。
Hassel 1930年利用偶极矩测定法和电子衍射法研究环已烷构象,∠CCC=109.5°,气相、液相中环已烷几乎全是椅式构象。
Barton 1950年发展了构象理论,以甾族化合物为对象提出构象分析,把构象分析明确地引入有机化学中。
Hassel 和Barton获1969年Nobel化学奖1、椅式和船式构象环已烷保持碳原子的109.5°键角,提出了椅式和船式构象.1)椅式构象:C1、C2、C4、C5在一个平面上,C6和C3分别在平面的下面和平面的上面,很象椅脚和椅背,故称“椅式”。
2)船式构象:C1、C2、C4、C5在一个平面上,C3和C6在平面上面。
形状象只船,C3和C6相当船头和船尾,故称“船式”。

环烷烃的构象链状化合物的构象是由基团绕C—Cσ键旋转产生的;而环状化合物的构象至少涉及到两个C—Cσ键和其键角的转动和变化,有时还涉及到键长和键角的变化,比较复杂,常称环的翻转。
一、环丙烷的构象环丙烷是三个碳的环,只能是平面构象,即它的构型。
尽管只有一种构象,但这个环极不稳定,主要因为:1、所有C-H键都是重叠构象,扭转张力大。
2、C原子是不等性杂化或弯曲键,有“角张力”存在。
二、环丁烷的构象环丁烷有两种极限构象:动画演示:平面式构象:象环丙烷一样,不稳定,存在扭转张力和“角张力”。
蝶式构象:能缓解扭转张力和角张力,呈蝶式构象。
通过平面式构象,由一种蝶式翻转成为另一种蝶式构象,处于动态平衡。
蝶式是优势构象。
也有扭转能力和角张力存在。
三、环戊烷的构象环戊烷的构象主要是信封式和半椅式构象。
两者处于平衡。
因为平面构象能量较大,一般认为环戊烷采取这种构象可能性很少。
E相对=19kJ/mol 信封式半椅式四、环己烷的构象环己烷的构象经过近百年的努力才建立起来。
Baeyer 1885年提出张力学说,认为环状化合物是平面构型Sachse 1889年质疑张力学说只适合小环,提出环已烷有船式、椅式两种构象。
Hassel 1930年利用偶极矩测定法和电子衍射法研究环已烷构象,∠CCC=109.5°,气相、液相中环已烷几乎全是椅式构象。
Barton 1950年发展了构象理论,以甾族化合物为对象提出构象分析,把构象分析明确地引入有机化学中。
Hassel 和Barton获1969年Nobel化学奖1、椅式和船式构象环已烷保持碳原子的109.5°键角,提出了椅式和船式构象.1)椅式构象:C1、C2、C4、C5在一个平面上,C6和C3分别在平面的下面和平面的上面,很象椅脚和椅背,故称“椅式”。
2)船式构象:C1、C2、C4、C5在一个平面上,C3和C6在平面上面。
形状象只船,C3和C6相当船头和船尾,故称“船式”。

环己烷构象本文由南通润丰石油化工整理椅型环己烷分子。
红色为直键氢原子,蓝色为平键氢原子。
历史背景很早就有人提出环己烷可能不是平面型结构。
1890年,德国人赫尔曼·萨克森(Hermann Sachse)提出通过折纸来构建环己烷“对称”和“非对称”结构(即现椅型和船型结构)的方法,从他的文章可以感受出,他已经知晓这些构象有两种不同的氢原子(即现直键氢和平键氢)以及两种椅型结构可能会相互转化,甚至还意识到两种椅型结构的分布可能受环上某些取代基的影响。
不过他的文章没有获得化学家的足够重视,一方面是文章的数学成分太多,难以理解,另一方面则是他的文章没有发表到主要的期刊上。
1893年仅31岁的萨克森去世,他的研究也就此结束。
直到1918年恩斯特·摩尔(Ernst Mohr)用新问世的X射线晶体学技术测定金刚石结构时,才发现所得结构中的基础结构单元正是萨克森预测过的椅型结构,才使环己烷构象研究重新进入焦点之中。
椅型构象sp3杂化的碳原子是四价的,键间角度为109.5°,所以环己烷不是平面的键角120°的正六边形结构,而是采取多种三维的构象。
椅型构象描述的是普通状态环己烷最稳定的构象,25度时99.99%的环己烷分子都是这种构象。
德里克·巴顿和奥德·哈塞尔因对环己烷和其他分子构象的研究而获得诺贝尔化学奖。
能量最低的椅型构象中,12个氢原子中有6个处于竖直方向(红色)——这些碳-氢键互相平行,呈轴向排列,分列环上下,称为直键。
另6个氢处于近似水平方向(蓝色)——这些碳-氢键大致平伏,分别稍向下和向上翘起,称为平键。
对于同一碳原子来说,若与它相连的直键氢是向上的,则平键氢稍向下,反之亦然。
观察可知,对于连有向上直键、稍向下平键的碳原子,与其相邻的两个碳原子必然连有向下直键和稍向上平键。
而且环中相对碳原子所连平键和直键的方向也必然是分别相反的(如H1和H4)。
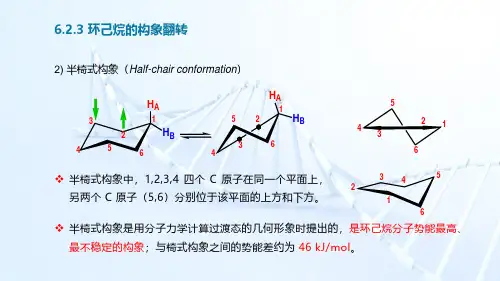
H AH BH AH B123456123456234613456半椅式构象中,1,2,3,4四个C 原子在同一个平面上,另两个C 原子(5,6)分别位于该平面的上方和下方。
半椅式构象是用分子力学计算过渡态的几何形象时提出的,是环己烷分子势能最高、最不稳定的构象;与椅式构象之间的势能差约为46kJ/mol 。
2)半椅式构象(Half-chair conformation )H A H B H A H B 123456123563) 扭船式构象(Twist-boat or skew-boat conformation )AB123561245H AH B扭船式构象中,所有的二面角都是30℃,所有的对边都是交叉的。
由椅式构象转变为扭船式构象,需要经历一个半椅式构象。
H H HHH143256123456扭船式构象比椅式构象不稳定,能量差为23.5kJ/mol 。
A H 123456124A B4)船式构象(Boat conformation )1,3,4,6四个C 原子共平面;另两个C 原子(2,5)在这一平面的同一侧;123456123564123456H HHH HH H H H HH H1456321,6和3,4分别为全重叠;1,2、2,3、4,5、5,6分别为邻位交叉。
因此,船式构象不如椅式构象稳定,两者之间的势能差约为29kJ/mol 。
船式构象中,2、5上两个H 原子(称为“旗杆氢”原子)相距较近(183pm ),存在非键空间张力;无键角张力。
1,6和3,4为全重叠式,存在键扭转张力。
H HHH HH HHHH 1234566.2.3 环己烷的构象翻转扭船式构象中,两个“旗杆”H 原子间的距离相对较远,非键空间张力小,因此比船式构象稳定,两者之间的势能差为5.4kJ/mol 。
H H H H HHH1432566.2.3 环己烷的构象翻转H AH BH AB123456123561245A B6312356235641234561245A B63123456AB12356H AH B6.2.3 环己烷的构象翻转船式椅式椅式扭船式半椅式半椅式扭船式势能23.5kJ/mol 46 kJ/mol6.2.3 环己烷的构象翻转6.2.3 环己烷的构象翻转总结:环己烷的椅式构象可以通过C–C键的旋转变成另一个椅式构象,a键和e键随之转换;此过程称为“构象翻转”(Conformational inversion),相应的两个椅式构象互称为“构象转换体”。

环己烷的构象
环己烷是一种六元环有机化合物,化学式为C6H12,它由六个碳原子和十二个氢原子构成,其中每个碳原子都与两个相邻的碳原子和两
个氢原子共形成四个共价键。
环己烷的最稳定的构象为椅形结构,在该结构中,六个碳原子组
成一个六角形,并且在这个六角形的上方和下方各有三个碳原子,这
些碳原子呈现出交错排列的形式。
椅形结构的环己烷分子如同一个椅子,因此称之为“椅状构象”,这种构象下的环己烷稳定性最高,且
相对地容易被取代反应,因此被广泛应用于有机合成中。
另一种环己烷构象是船形结构,其中碳原子按照类似船底的形状
排列。
这种构象相对于椅形结构来说不太稳定,因为其中两个碳原子
太近,容易引起反式构型相互作用的影响。
此外,环己烷还可能形成
扭曲构象,在这种构象下,环己烷分子呈现出扭曲的形状。
环己烷的构象对于它的性质和应用具有重要影响。
例如,在某些
有机化学反应中,需要采用椅形构象才能有效进行反应。
此外,环己
烷还可以作为溶剂、润滑剂、燃料等应用于许多领域。
总之,环己烷所具有的不同构象对它的性质和应用有着重要影响,了解环己烷的构象,有助于研究其在有机合成和其他领域中的应用。

环己烷的构象翻转是指分子在空间中通过原子旋转的方式改变构象的过程。
具体来说,环己烷有两种主要的椅式构象:椅式Ⅰ和椅式Ⅱ。
在构象翻转过程中,碳原子会围绕分子轴线旋转,从而改变分子的构象。
这个过程涉及到一系列的中间状态,包括过渡态和过渡间隔态。
构象翻转的过程中,碳原子的旋转会引起分子内部键角的变化,从而影响分子的性质和反应活性。
影响环己烷构象翻转的因素包括环己烷分子的结构、温度、溶剂和外界影响等。
在室温下,环己烷分子更倾向于保持椅式构象,因为椅式结构比船式结构更为稳定。
然而,当温度升高时,环己烷分子的热运动会增加,从而促进构象翻转的发生。
溶剂的极性和溶解能力也会影响构象翻转的速率,极性溶剂可以与环己烷分子形成氢键或离子偶极相互作用,从而加速构象翻转的发生。
此外,外界的压力和扰动也会影响构象翻转的速率。
在化学合成和生物学研究中,环己烷的构象翻转具有广泛的应用。
例如,在有机合成中,可以通过控制构象翻转的发生来合成具有特定构象的化合物。
在生物学研究中,观察和控制构象翻转的发生可以帮助揭示分子的结构和功能之间的关系。
以上内容仅供参考,如需更全面准确的信息,可以查阅化学领域的专业书籍或咨询相关学者。
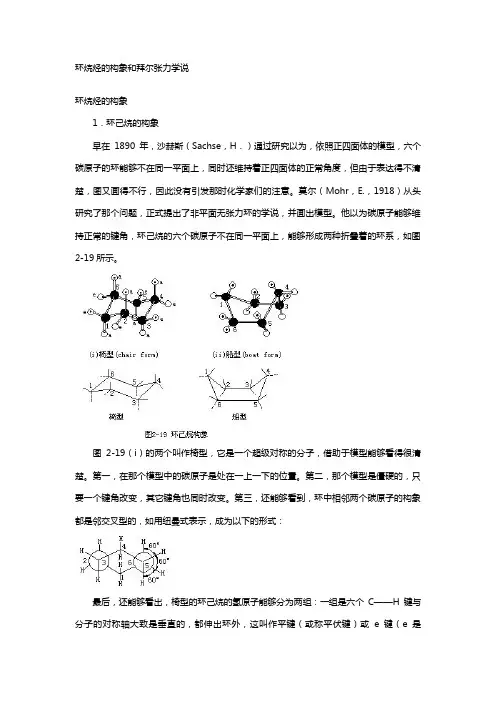
环烷烃的构象和拜尔张力学说环烷烃的构象1.环己烷的构象早在1890年,沙赫斯(Sachse,H.)通过研究以为,依照正四面体的模型,六个碳原子的环能够不在同一平面上,同时还维持着正四面体的正常角度,但由于表达得不清楚,图又画得不行,因此没有引发那时化学家们的注意。
莫尔(Mohr,E.,1918)从头研究了那个问题,正式提出了非平面无张力环的学说,并画出模型。
他以为碳原子能够维持正常的键角,环己烷的六个碳原子不在同一平面上,能够形成两种折叠着的环系,如图2-19所示。
图2-19(i)的两个叫作椅型,它是一个超级对称的分子,借助于模型能够看得很清楚。
第一,在那个模型中的碳原子是处在一上一下的位置。
第二,那个模型是僵硬的,只要一个键角改变,其它键角也同时改变。
第三,还能够看到,环中相邻两个碳原子的构象都是邻交叉型的,如用纽曼式表示,成为以下的形式:最后,还能够看出,椅型的环己烷的氢原子能够分为两组:一组是六个C——H键与分子的对称轴大致是垂直的,都伸出环外,这叫作平键(或称平伏键)或e键(e是equatorial的字首,赤道的意思),三个e键略往上伸,三个e键略向下伸;另六个氢的键都是与轴平行的,这叫作直键(或称直立键)或a键(a是axial的字首,轴的意思),三个伸在环的下面,三个伸在环的上面。
图2-19(i)中带点的白球都在环的上面,不带点的白球都在环的下面。
这种关系在斯陶特模型图2-20中能够表示得更清楚一些:在图2-20中,a键的氢原子都用带黑点的球表示,e键的氢原子用白球表示。
由于成环的碳链是封锁的,因此沿着碳碳键不管如何旋转,在环上面的不可能转到环的下面来,老是维持着原先各个氢原子的空间关系。
这种构象,既无角张力,也无扭转张力,代表一个最稳固的形式,是优势构象。
另一种维持正常键角的环己烷模型如图2-19(ii)的两个,叫作船型,可用纽曼式表示如下:第一可看到,2、3和5、6两对碳原子的构象是重叠型的,这种构象虽无角张力,但有扭转张力,相当于能量高的构象。


环己烷构象翻转-回复"环己烷构象翻转"环己烷是一种有机化合物,化学式为C6H12。
它是由六个碳原子和十二个氢原子组成的六元环烷烃,具有多种不同的构象。
当其中一个碳原子周围有两个碳原子时,环己烷就发生了构象翻转。
本文将一步一步回答环己烷构象翻转的过程。
首先,让我们了解一下环己烷的基本结构。
环己烷分子由六个碳原子组成,形成了一个环状结构。
每个碳原子周围都有两个氢原子,总共有十二个氢原子。
环己烷的构象可以用希尔伯特投影式表示,其中每个碳原子以垂直和水平的方式表示。
环己烷的构象翻转是指环状结构中的一个碳原子在平面内旋转180度。
这个过程可以通过两个不同的中间构象进行。
让我们一步一步地了解这个过程。
首先,我们考虑环己烷的正常构象,其中所有的碳原子都处于平面上,氢原子位于平面之上或之下。
这个构象被称为"椅形"构象,因为它看起来像是一个椅子。
接下来,我们需要将其中一个碳原子周围的化学键旋转180度。
这个碳原子通常被称为“轴向碳原子”,因为它的化学键是沿着烷环的轴线延伸的。
在构象翻转过程中,轴向碳原子的化学键需要转到与轴线相反的位置。
为了达到这个目标,我们需要将环己烷分子进行一些旋转和重新排列。
首先,我们将椅形构象的一个氢原子移到轴线的下方。
这个过程导致环烷烃分子发生旋转,直到另一个相邻的碳原子变成新的轴向碳原子。
现在,新的轴向碳原子周围的化学键需要以180度旋转,使其化学键朝向椅形构象中原先的轴向碳原子。
最后,我们将之前下方的氢原子移到轴线上方,使其成为新构象的轴向碳原子的氢原子。
同时,之前的轴向碳原子也成了新构象中周围的碳原子之一。
通过这个过程,环己烷的构象成功发生翻转。
最初处于下方的轴向碳原子现在位于上方,而最初位于上方的轴向碳原子现在位于下方。
这个过程可以转变为另外一种称为"反椅形"构象的构象。
值得注意的是,环己烷的构象翻转只发生在碳原子周围具有特定的取向的情况下,即只有当其中一个碳原子周围正好有两个碳原子时才会发生。
环己烷构象翻转-回复环己烷是一种有机化合物,化学式为C6H12,具有六个碳原子的环状结构。
它的构象翻转是指环的两个形式之间的转变。
在环己烷的构象翻转过程中,分子的结构发生了变化,原子的位置也发生了改变。
本文将一步一步地回答关于环己烷构象翻转的问题。
第一步:什么是构象?构象是指分子在空间中的不同排列方式,而其分子式不发生改变。
一个分子可以有多种不同的构象,这取决于原子之间的相对位置。
第二步:环己烷的构象有哪些?环己烷拥有两种主要的构象:椅式构象和船式构象。
椅式构象是最稳定的构象。
在椅式构象中,环中的碳原子呈现出两个凹陷和两个突起。
船式构象相对不稳定,其中环中的两个碳原子形成一个微小的船形结构。
第三步:环己烷构象翻转的机理是什么?环己烷的构象翻转是通过碳氢键的旋转实现的。
在椅式构象中,每个碳原子都与两个碳原子和两个氢原子连接。
构象翻转是通过旋转碳氢键来改变碳原子的相对位置的。
第四步:环己烷的构象翻转是如何发生的?环己烷的构象翻转可以通过两种方式进行:轴向构象翻转和孔洞构象翻转。
轴向构象翻转是指环中两个相邻的碳原子交换它们的位置,这会导致环中两个氢原子的位置也发生变化。
孔洞构象翻转是指环中两个相对的碳原子交换它们的位置,这不会改变环中氢原子的位置。
第五步:环己烷构象翻转的影响是什么?环己烷的构象翻转对于其物理性质和化学性质都有一定的影响。
不同构象的环己烷在空间上有不同的几何结构,这会导致它们的熔点、沸点和密度等物理性质的差异。
此外,在化学反应中,不同构象的环己烷也会表现出不同的反应性质。
第六步:如何确定环己烷的主要构象?环己烷的主要构象是指在一定条件下最稳定的构象。
椅式构象是环己烷的主要构象,因为它相对于船式构象来说更稳定。
椅式构象中,碳原子周围的键角最接近理想值,使分子处于较低的能量状态。
第七步:环己烷构象翻转的应用领域有哪些?环己烷构象翻转在有机化学、药物研究和材料科学等领域具有重要的应用价值。
通过研究环己烷构象翻转的机理和影响因素,可以更好地理解和预测有机化合物的行为和性质。
环己烷的船式构象好啦,今天咱们来聊聊环己烷的船式构象,说起来它这个名字听着挺吓人是不是?其实没那么复杂,就像咱们平时说的“环环相扣”,指的就是分子中那一圈圈相连的碳原子。
环己烷呢,其实是一个挺有趣的小家伙。
它是由六个碳原子组成的环状分子,每个碳原子上都有氢原子相连,就像六个人站成一圈,手拉着手,不时地绕着自己的中心跳个舞。
别看它看起来简单,实际上它是个不折不扣的“小戏精”,有着好多“造型”和“姿势”,其中最经典的就是“船式构象”。
想象一下吧,如果你手里有一个纸杯,然后把它弯成一个类似U型的形状,底部和边缘像是船的船底。
是不是突然觉得有点像你小时候做的纸船?环己烷的船式构象也就这么回事,六个碳原子按照一定的规律“摆出”了一个弯曲的姿势。
就好像它们有自己的小秘密,趁着没人注意,悄悄地做了一下“船”的动作。
这种“船式构象”就像是它打破了原本的平面,开始用一种更舒适的姿态呈现自己。
要是咱们把它比作人类的话,它就是打破了传统站着的姿势,给自己换了个舒服的姿势躺下了。
有趣的是,这个船式构象并不是最初的“原生状态”。
环己烷其实在另一个构象里是平的,那时候它就像一块平板,所有的碳原子都在同一平面上,大家靠得很紧,互相压抑,怎么看都不太自在。
但它一旦弯曲起来,形成船式构象后,整个分子就像是找到了更轻松的角度。
船式构象让其中两个碳原子处于“稍微”高的状态,像是船的两边翘起来了一样,其他的碳原子则低伏在中间,这种姿势看上去舒服多了。
不过,环己烷可不是只有一个姿势哦,它还能随时“换装”!船式构象可以转化成另一种叫做“椅式构象”的状态。
别误会,椅式构象可不是让它像坐椅子一样,而是它的形状像一张椅子一样,两个碳原子站得很直,像椅子的靠背一样,剩下的四个则像座位,形成了一个椅子的框架。
环己烷这种形态的转换就像是它在剧本里不停地换角度,哪种更舒服就演哪种,真是让人看得眼花缭乱。
而可能有些朋友心里在想,这船式构象就算再怎么漂亮,也有它的缺点吧?嗯,确实有!尽管它给环己烷带来了一些舒适的姿势,但它也并不完美。
环己烷构象翻转简介环己烷是一种有机化合物,分子式为C6H12,属于脂环烃的一种。
它是一个六元环,由六个碳原子和十二个氢原子组成。
环己烷具有构象翻转的特性,即在空间中可以通过旋转碳原子的方式改变分子的构象。
本文将详细介绍环己烷的构象翻转过程、影响因素以及应用领域等相关内容。
构象翻转的定义构象翻转是指分子在空间中通过原子旋转的方式改变分子的构象。
在环己烷中,构象翻转是指环己烷分子中的两个椅面构象之间的转变。
环己烷有两种椅面构象,分别为椅式构象和船式构象。
构象翻转的过程构象翻转的过程涉及到环己烷分子中碳原子的旋转。
具体过程如下:1.初始状态:环己烷分子处于椅式构象或船式构象之一。
2.碳原子旋转:在构象翻转过程中,碳原子会围绕分子的轴线旋转,从而改变分子的构象。
3.中间状态:在构象翻转的过程中,环己烷分子会经过一系列中间状态,其中包括过渡态和过渡间隔态。
4.最终状态:构象翻转完成后,环己烷分子的构象从椅式构象变为船式构象,或者从船式构象变为椅式构象。
构象翻转的过程中,碳原子的旋转会引起分子内部键角的变化,从而影响分子的性质和反应活性。
影响构象翻转的因素构象翻转的过程受到多种因素的影响,包括环己烷分子的结构、温度、溶剂和外界影响等。
1.结构:环己烷分子的结构决定了构象翻转的能量差异。
由于椅式构象比船式构象更为稳定,因此在室温下,环己烷分子更倾向于保持椅式构象。
2.温度:温度的升高可以增加环己烷分子的热运动,从而促进构象翻转的发生。
在高温下,构象翻转的速率更快。
3.溶剂:溶剂的极性和溶解能力会影响构象翻转的速率。
极性溶剂可以与环己烷分子形成氢键或离子偶极相互作用,从而加速构象翻转的发生。
4.外界影响:外界的压力和扰动也会影响构象翻转的速率。
高压和机械振动可以促进构象翻转的发生。
应用领域环己烷的构象翻转在化学和生物领域有着广泛的应用。
1.化学合成:在有机合成中,构象翻转可以用于合成具有特定构象的化合物。
通过控制构象翻转的发生,可以合成具有特定立体结构的药物和材料。