电离平衡常数
- 格式:ppt
- 大小:874.50 KB
- 文档页数:20

电离常数1 概念在一定条件下,当弱电解质的电离达到平衡时,溶液里各组分的浓度之间存在一定的关系。
对一元弱酸或一元弱碱来说,溶液中弱电解质电离所生成的各种离子浓度的乘积,与溶液中未电离分子的浓度之比是个常数,这个常数叫做电离平衡常数,简称电离常数。
弱酸、弱碱的电离常数通常分别用K a 、K b 表示。
2 表示方法ABA ++B -K =()()()A B AB c c c +-⋅(1)一元弱酸、一元弱碱的电离常数 CH 3COOHCH 3COO -+H +()()()3a 3CH COO H CH COOH c c K c -+⋅=NH 3·H 2ONH + 4+OH -()()()4b 32NH OH NH H O c c K c +-⋅⋅=(2)多元弱酸、多元弱碱的电离常数多元弱酸的电离分步进行,各步的电离常数通常分别用K a1、K a2、K a3等来表示。
如: H 3PO 4H ++24H PO -()()()24a134H PO H H PO c c K c -+⋅=24H PO -H ++HPO 2- 4 ()()()24a224HPO H H PO c c K c -+-⋅=HPO 2- 4H ++PO 3- 4 ()()()34a324PO H HPOc c K c -+-⋅=一般多元弱酸各步电离常数的大小为K a1>>K a2>>K a3,因此,多元弱酸的酸性主要由第一步电离决定(八字口诀:分步进行,一步定性)。
多元弱碱的电离比较复杂,因此,一般不讨论多元弱碱的一级电离常数、二级电离常数等。
3 影响因素影响因素————⎧⎨⎩内因(决定因素)弱电解质本身的性质外因温度(随温度升高而增大)同化学平衡常数一样,对于同一弱电解质的稀溶液来说,电离常数只与温度有关,而不受粒子浓度的影响。
由于电解质的电离过程吸热,故电离常数随着温度的升高而增大。
4 意义教材P59·实验3-2 CH3COOH的K a和H2CO3的K a1的大小比较如图3-1-4所示,向盛有2 mL 1 mol/L醋酸的试管中滴加1 mol/L Na2CO3溶液实验操作图3-1-4实验现象有气泡产生反应生成了CO2,化学方程式为2CH3COOH+Na2CO3===2CH3COONa+H2O+解释CO2↑实验结论CH3COOH的酸性比H2CO3的强,K a(CH3COOH)>K a1(H2CO3)总结:(1)相同温度下,等浓度的弱酸(或弱碱)的电离常数[对于多元弱酸(或弱碱)来说,通常只考虑第一步电离的电离常数]越大,其酸性(或碱性)越强;同样,相同温度下,弱酸(或弱碱)的酸性(或碱性)越强,其电离常数或第一步电离的电离常数越大。

化学物质的电离度与电离平衡常数化学物质的电离度与电离平衡常数是化学反应中重要的概念,它们对于理解溶液中物质的行为以及酸碱反应等过程具有重要意义。
本文将从电离度的定义、电离平衡常数的计算以及影响电离度和电离平衡常数的因素等方面进行探讨。
一、电离度的定义电离度是指在溶液中溶解的物质分子或离子的离解程度。
当物质溶解时,其中的分子或离子会与溶剂分子发生相互作用,部分分子或离子会发生离解,形成溶液中的离子。
电离度可以用来描述溶液中溶质的离解程度,它通常用符号α表示,取值范围在0到1之间。
二、电离平衡常数的计算电离平衡常数是指在一定温度下,溶液中物质的电离反应的平衡常数。
对于一般的电离反应,可以用离子浓度的比值来表示电离平衡常数。
以酸碱反应为例,对于弱酸HA的电离反应:HA ⇌ H+ + A-电离平衡常数Ka可以用下式表示:Ka = [H+][A-]/[HA]其中[H+]表示氢离子(质子)的浓度,[A-]表示阴离子的浓度,[HA]表示酸分子的浓度。
电离平衡常数的值越大,说明酸的电离程度越大。
三、影响电离度和电离平衡常数的因素1. 温度:温度对电离度和电离平衡常数有显著影响。
一般情况下,温度升高会使电离度和电离平衡常数增大。
这是因为温度升高会增加反应物分子的动能,使得反应速率增加,促进电离反应的进行。
2. 溶液浓度:溶液中物质的浓度对电离度和电离平衡常数也有影响。
一般来说,溶液浓度越高,电离度和电离平衡常数越大。
这是因为溶液浓度的增加会增加反应物分子之间的碰撞频率,从而促进电离反应的进行。
3. 溶剂性质:溶剂的性质对电离度和电离平衡常数也有一定影响。
不同溶剂对物质的电离程度有不同的影响。
例如,极性溶剂通常会增加物质的电离度和电离平衡常数,而非极性溶剂则相反。
4. 分子结构:物质的分子结构也会影响其电离度和电离平衡常数。
分子中的官能团以及原子间的键的强度等因素都会影响电离度和电离平衡常数的大小。
综上所述,化学物质的电离度与电离平衡常数是描述溶液中物质行为的重要指标。


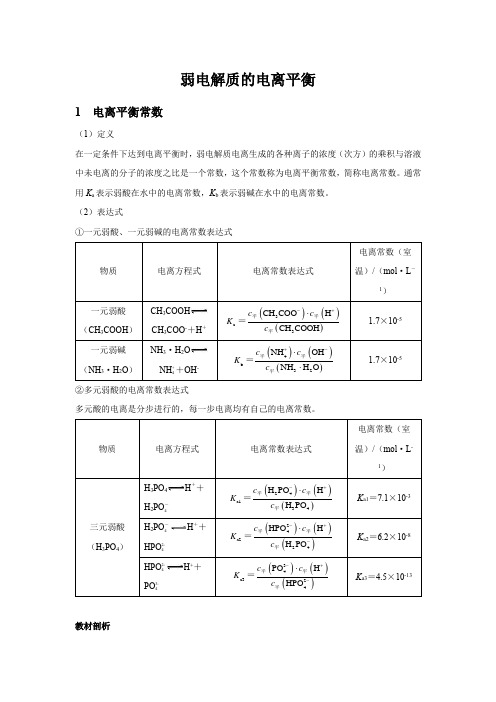
弱电解质的电离平衡1 电离平衡常数(1)定义在一定条件下达到电离平衡时,弱电解质电离生成的各种离子的浓度(次方)的乘积与溶液中未电离的分子的浓度之比是一个常数,这个常数称为电离平衡常数,简称电离常数。
通常用K a表示弱酸在水中的电离常数,K b表示弱碱在水中的电离常数。
(2)表达式①一元弱酸、一元弱碱的电离常数表达式CH3COOHCH3COO-+H+NH3·H2ONH ++OH-4②多元弱酸的电离常数表达式多元酸的电离是分步进行的,每一步电离均有自己的电离常数。
H3PO4H++H2PO-4H2PO-H++4HPO2-4H++HPO2-4PO3-4教材剖析【教材P98】 “多元弱酸的各级电离常数逐级减小。
对于各级电离常数相差很大的多元弱酸,其水溶液中的H +主要是由第一步电离产生的。
”【教材剖析】 多元弱酸第一步电离出H +后,剩余的酸根离子带负电荷,对H +的吸引力增强,使其电离出H +更困难,故一般K a1>>K a2>>K a3……。
因此计算多元弱酸溶液中的c (H+)或比较弱酸酸性的相对强弱时,通常只考虑第一步电离。
(3)意义电离常数表征了弱电解质的电离能力,根据相同温度下电离常数的大小可以判断弱电解质电离能力的相对强弱。
弱酸的电离常数越大,弱酸电离出H +的能力就越强,酸性也就越强;反之,酸性越弱。
如:名师提醒(1)电离常数服从化学平衡常数的一般规律,只受温度的影响。
(2)电离常数相对较大、电离能力较强的弱电解质,其溶液的导电能力不一定强。
这是因为溶液的导电能力与溶液中的离子浓度和离子所带电荷数有关。
(3)相同温度下,等浓度的多种一元弱酸溶液,弱酸的电离常数越大,溶液中c (H +)越大,溶液的导电能力也就越强。
2 电离度(1)定义弱电解质在水中的电离达到平衡状态时,已电离的溶质的分子数占原有溶质分子总数(包括已电离的和未电离的)的百分率称为电离度,通常用α表示。

电离平衡常数的概念定义电离平衡常数是指在一定温度下,当气体或溶液中的化学物质发生电离反应时,反应体系达到动态平衡时,离子浓度的乘积与反应物浓度的乘积之比的常数。
通常用K表示。
对于一般的电离反应: A + B ⇌ C + D其电离平衡常数可以表示为: K = [C][D] / [A][B]其中,方括号表示物质的浓度。
重要性电离平衡常数是研究化学反应平衡的重要工具,具有以下重要性:1.揭示反应趋势:电离平衡常数能够反映反应体系中化学物质的相对浓度,从而揭示反应的趋势。
当K > 1时,反应偏向生成物的生成;当K < 1时,反应偏向反应物的生成;当K = 1时,反应物与生成物浓度相等,反应体系处于平衡状态。
2.影响反应速率:电离平衡常数与反应速率密切相关。
当反应体系处于平衡状态时,正反应和逆反应的速率相等,反应速率与电离平衡常数有关。
3.预测反应方向:通过比较反应物和生成物的浓度与电离平衡常数的大小,可以预测反应的方向。
如果反应物浓度大于电离平衡常数,反应向反应物方向进行;如果反应物浓度小于电离平衡常数,反应向生成物方向进行。
4.优化化学工艺:通过调节反应条件,如温度、压力、浓度等,可以改变电离平衡常数,从而优化化学工艺的产率和效率。
应用电离平衡常数的应用广泛,涉及多个领域,包括化学、生物、环境等。
以下是一些常见的应用:1.酸碱平衡:电离平衡常数在酸碱反应中起着重要作用。
对于弱酸和弱碱的电离反应,可以通过电离平衡常数来判断酸碱的强弱,以及酸碱溶液的pH值。
2.配位化学:电离平衡常数在配位化学中也有重要应用。
配位反应中的络合物的形成常数可以通过电离平衡常数来确定,从而了解配位反应的平衡情况。
3.溶解度平衡:电离平衡常数在溶解度平衡中起着关键作用。
通过电离平衡常数,可以确定溶解度积,进而预测溶液中某物质的溶解度。
4.化学反应平衡:电离平衡常数在一般化学反应中也有应用。
通过电离平衡常数,可以预测反应的平衡位置和方向,优化反应条件,提高反应产率和效率。

06. 电离平衡常数一、知识梳理1、概念:在一定条件下达到电离平衡时,弱电解质电离形成的各种离子浓度的乘积与溶液中未电离的分子浓度之比为一常数,叫电离平衡常数。
2、符号:K(弱酸Ka,弱碱Kb)3、表示方法:AmBn mA n+ + nB m—K = [A n+]m [B m—]n[AmBn]如:CH 3COOH CH3COO-+H+Ka = [H+][CH3COO—] [CH3COOH]NH 3•H2O NH4+ + OH—Kb = [OH—][NH4+] [NH3•H2O]4、影响因素:电离平衡常数的大小主要由物质的本性和温度决定,T ,K5、K的意义:K值越大,弱电解质较易电离,其对应弱酸、弱碱较强K值越小,弱电解质较难电离,其对应弱酸、弱碱较弱比如说:Ka的意义:Ka ,达电离平衡时电离出的[H+] ,酸性;Kb的意义:Kb ,达电离平衡时电离出的[OH—] ,碱性。
Ka(HCN)= 6.2×10—10mol•L—1Ka(CH3COOH)= 1.7×10—5mol•L—1Ka(HF)= 6.8×10—4mol•L—1酸性:HF >CH3COOH >HCN6、电离度(α):电离平衡常数表示电离的程度有时不够直观,为了更好的比较电解质的电离程度,人们又定义了“电离度”这个概念,相当于化学平衡中反应物的转化率。
表示已电离的溶质的分子数占原有溶质分子总数(包括已电离的和未电离的)的百分率。
α= 已电离的溶质的分子数/原有溶质分子总数×100%二、典例分析6、已知25℃时,下列酸的电离常数:物质/酸醋酸氢氰酸氢氟酸甲酸电离常数/K a 1.75×10—5 4.93×10—107.2×10—4 1.77×10—4则物质的量浓度均为0.1 mol·L-1的上述溶液酸性最强的是()A.醋酸 B.氢氰酸C.氢氟酸D.甲酸考点:弱电解质在水溶液中的电离平衡.分析:相同浓度的酸,酸的电离常数越大,电解质的酸性越强,据此分析解答.解答:相同浓度的酸,酸的电离常数越大,说明酸的电离程度越大,则酸的酸性越强,根据题意知,氢氟酸的电离平衡常数最大,所以氢氟酸的酸性最强,故选C.点评:本题考查弱电解质的电离,题目难度不大,本题注意电离平衡常数与酸性的强弱判断.三、实战演练1、物质的量浓度相同的下列物质的水溶液,酸性最强的是()A.HCl B.H2SO4C.CH3COOH D.NaCl。



电离的平衡常数全文共四篇示例,供读者参考第一篇示例:电离反应是化学反应中一种非常重要的过程,它涉及到溶液中的电解质分子在水中失去或者得到电子,形成离子的过程。
在电离反应中,会产生一种平衡状态,这就是所谓的电离的平衡常数。
电离的平衡常数是指在特定条件下,溶液中电离产生的正、负离子的浓度的乘积与电离反应物的浓度的乘积的比值。
电离反应一般可以用以下示例来表示:A+B ⇌ C+D,其中A和B是反应物,C和D是电离产物。
在该反应过程中,A和B的浓度乘积除以C和D的浓度乘积,所得的比值就是电离的平衡常数,用K表示。
电离的平衡常数K是和反应条件有关系的。
当反应发生在不同温度、压力或浓度下时,K的数值会发生变化。
电离的平衡常数提供了化学反应过程中离子产生的平衡状态的信息,可以帮助我们更好地了解反应过程。
电离平衡常数的大小对于化学反应的进行具有重要意义。
在电离产生的正、负离子的浓度较高时,K的值较大,说明电离的反应偏向产生离子。
在反应过程中,当K的值大于1时,说明正反应占优势;当K 的值小于1时,说明反应逆反应占优势。
这对于研究反应速率、化学平衡等都有着重要的作用。
电离的平衡常数的计算通常需要进行一些物理化学实验,比如测定反应物和产物的浓度,通过实验数据得到K的数值。
电离平衡常数的计算也可以通过数学模型来推导得到,比如在封闭系统中的反应平衡条件下,可以利用动力学和热力学原理来推导电离的平衡常数。
电离平衡常数的应用非常广泛,不仅仅局限于化学实验和理论研究,还涉及到生物化学、环境化学等领域。
在生物化学中,电离的平衡常数可以帮助我们更好地了解生物分子的电解质性质,进而研究细胞膜的通透性和电位平衡等生物过程。
在环境化学中,电离的平衡常数可以帮助我们研究水体中溶解物和离子的浓度变化,进而了解水质的污染程度和环境的变化。
电离的平衡常数是化学反应平衡状态的重要参数,它可以反映反应过程中离子生成的平衡状态,为我们研究化学反应提供了重要的参考依据。

电离平衡常数1.表达式(1)一元弱酸HA 的电离常数:根据HA H ++A -,可表示为K a =c (A -)·c (H +)c (HA )。
(2)一元弱碱BOH 的电离常数:根据BOH B ++OH -,可表示为K b =c (B +)·c (OH -)c (BOH )。
2.特点(1)电离平衡常数与温度有关,与浓度无关,升高温度,K 值增大。
(2)电离平衡常数反映弱电解质的相对强弱,K 越大,表示弱电解质越易电离,酸性或碱性越强。
(3)多元弱酸的各级电离常数的大小关系是K 1≫K 2≫K 3……,故其酸性取决于第一步电离。
3.电离平衡常数的应用(1)判断弱酸(或弱碱)的相对强弱,电离常数越大,酸性(或碱性)越强。
例1 相同温度下,根据三种酸的电离常数,酸 HX HY HZ 电离平衡常数9×10-79×10-61×10-2则三种酸的强弱关系:HZ>HY>HX 。
(2)定量判断电离平衡移动的方向、解释移动的原因。
例2 0.1 mol·L -1的CH 3COOH 溶液加水稀释,平衡移动方向的判断,溶液中c (H +)的变化情况。
答案CH 3COOHH ++CH 3COO -原平衡: c (CH 3COOH) c (H +) c (CH 3COO -) 假设稀释 c (CH 3COOH )n c (H +)n c (CH 3COO -)n至n 倍后:Q =c (H +)n ·c (CH 3COO -)n c (CH 3COOH )n =c (H +)·c (CH 3COO -)n ·c (CH 3COOH )=K an <K a (n >1)所以电离平衡向电离方向移动。
移动的结果使c (CH 3COOH)减小,由于平衡常数不变,故c (H +)和c (CH 3COO -)都必然减小。


电离平衡常数的计算公式:K=C^x·C。
溶液中的电离出来的各离子浓度乘积(c(A+)*c(B-))与溶液中未电离的电解质分子浓度(c(AB))的比值是一个常数,叫做该弱电解质的电离平衡常数。
这个常数叫电离平衡常数,简称电离常数。
电解质是溶于水溶液中或在熔融状态下就能够导电的化合物。
根据其电离程度可分为强电解质和弱电解质,几乎全部电离的是强电解质,只有少部分电离的是弱电解质。
电解质都是以离子键或极性共价键结合的物质。
化合物在溶解于水中或受热状态下能够解离成自由移动的离子。
离子化合物在水溶液中或熔化状态下能导电;某些共价化合物也能在水溶液中导电,但也存在固体电解质,其导电性来源于晶格中离子的迁移。

考点43 电离平衡常数及相关计算1.表达式(1)对于一元弱酸HA :HAH ++A −,电离常数K =H A HA c c c +-⋅()()()。
(2)对于一元弱碱BOH :BOHB ++OH −,电离常数K =B OH BOH c c c +-⋅()()()。
(3)对于二元弱酸,如H 2CO 3:H 2CO 3H ++3HCO -,K 1=323H HCO H CO c c c +-⋅()()();3HCO-H ++23CO -,K 2=233H CO HCO c c c +--⋅()()();且K 1>K 2。
2.意义:相同条件下,K 越大→越易电离→酸(或碱)性越强3.特点:多元弱酸是分步电离的,各级电离常数的大小关系是K 1≫K 2……,所以其酸性主要决定于第一步电离。
4.影响因素5.电离常数的三大应用(1)判断弱酸(或弱碱)的相对强弱,电离常数越大,酸性(或碱性)越强。
(2)判断盐溶液的酸性(或碱性)强弱,电离常数越大,对应的盐水解程度越小,碱性(或酸性)越弱。
(3)判断复分解反应能否发生,一般符合“强酸制弱酸”规律。
6.电离平衡常数相关计算(以弱酸HX 为例)(1)已知c (HX)和c (H +),求电离常数 HXH + + X −起始(mol·L −1):c (HX) 0 0 平衡(mol·L −1):c (HX)−c (H +) c (H +) c (H +)则:K=H XHXc cc+-⋅()()()=2HHX Hcc c++()()-()。
由于弱酸只有极少一部分电离,c(H+)的数值很小,可做近似处理:c(HX)−c(H+)≈c(HX),则K=2HHXcc+()(),代入数值求解即可。
(2)已知c(HX)和电离常数,求c(H+)HX H++X−起始:c(HX)00平衡:c(HX)−c(H+)c(H+) c(H+)则:K=H XHXc cc+-⋅()()()=2HHX Hcc c++()()-()。

电离平衡常数表达式是AxBy⇋ xA+ + yB-。
则,K(电离)=C[A+]^x·C[B-]^y/ C[AxBy] 式中C[A+]、C[B-]、C[AB]分别表示A+、B-和AxBy在电离平衡时的物质的量浓度。
电离平衡常数的大小反映弱电解质的电离程度,不同温度时有不同的电离常数。
在同一温度下,同一电解质的电离平衡常数相同,但随着弱电解质浓度的降低.转化率会增大。
由该温度下的解离度a=(K/起始浓度)的算术平方根,可得知弱电解质浓度越低电离程度越大。
扩展资料
具有极性共价键的弱电解质(例如部分弱酸、弱碱。
水也是弱电解质)溶于水时,其分子可以微弱电离出离子;同时,溶液中的相应离子也可以结合成分子。
一般地,自上述反应开始起,弱电解质分子电离出离子的速率不断降低,而离子重新结合成弱电解质分子的速率不断升高,当两者的反应速率相等时,溶液便达到了电离平衡。
此时,溶液中电解质分子的浓度与离子的浓度分别处于相对稳定状态,达到动态平衡。
弱酸的电离常数越大,达到电离平衡时电离出的H+越多,酸性越强;反之,酸性越弱。
多元弱酸的电离是分步进行的,每一步电离都有各自的电离常数,且各级电离常数逐级减小,一般相差较大,所以其水溶液中的 H+主要是由第一步电离产生的。
弱电解质分子电离与离子结合成为分子,二者共同构成一组可逆反应。
常以弱电解质分子电离出离子的反应方向为正反应方向,以离子重新结合成弱电解质分子的反应方向为逆反应方向。
与化学平衡一样,电离平衡是可以因为条件变化(如浓度、温度、酸碱性等)而移动的,并且也遵循勒夏特列原理。
