九年级初三化学酸和碱的中和反应
- 格式:ppt
- 大小:3.11 MB
- 文档页数:28



初中酸碱中和反应化学方程式(全)
在化学中,酸碱中和反应是一种常见的化学反应,目的是将酸和碱混合在一起,使它们彼此中和,生成盐和水。
在这个过程中,酸的氢离子和碱的氢氧根离子结合,形成了水分子。
酸碱中和反应的化学方程式可以简洁地表示为:
酸 + 碱→ 盐 + 水
以下是一些常见的酸碱中和反应的化学方程式:
1. 盐酸和氢氧化钠的中和反应:
HCl + NaOH → NaCl + H2O
2. 硫酸和氢氧化钾的中和反应:
H2SO4 + 2KOH → K2SO4 + 2H2O
3. 硝酸和氢氧化钙的中和反应:
2HNO3 + Ca(OH)2 → Ca(NO3)2 + 2H2O
4. 磷酸和氢氧化铵的中和反应:
H3PO4 + NH4OH → (NH4)3PO4 + 3H2O
5. 碳酸和氢氧根离子的中和反应:
H2CO3 + 2OH- → CO3^2- + 2H2O
这些只是一些酸碱中和反应的例子,实际上有很多不同的酸和
碱可以进行中和反应。
通过了解和研究这些化学方程式,我们可以
更好地理解酸碱中和反应的原理和过程。
总结:酸碱中和反应是将酸和碱混合在一起,使它们彼此中和
生成盐和水的化学反应。
有很多不同的酸碱中和反应的化学方程式,通过研究这些方程式,我们可以更好地理解这个过程的原理。
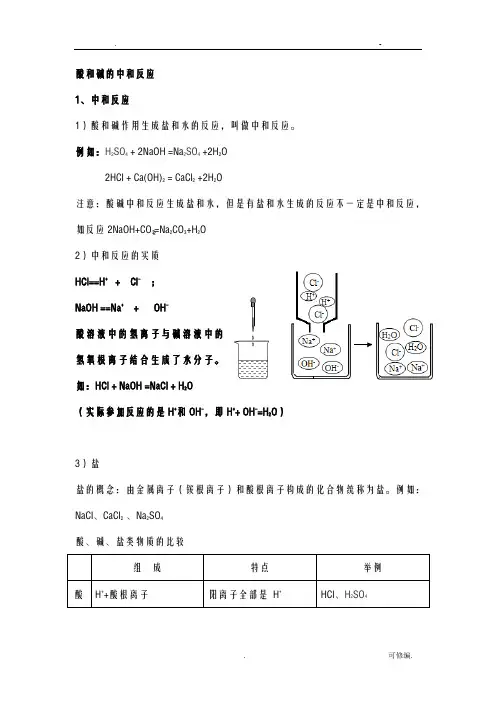
酸和碱的中和反应 1、中和反应1)酸和碱作用生成盐和水的反应,叫做中和反应。
例如:H 2SO 4 + 2NaOH =Na 2SO 4 +2H 2O2HCl + Ca(OH)2 = CaCl 2 +2H 2O注意:酸碱中和反应生成盐和水,但是有盐和水生成的反应不一定是中和反应,如反应2NaOH+CO 222=Na 2CO 3+H 2O 2)中和反应的实质 HCl==H + + Cl - ; NaOH ==Na + + OH -酸溶液中的氢离子与碱溶液中的氢氧根离子结合生成了水分子。
如:HCl + NaOH =NaCl + H 2O(实际参加反应的是H +和OH -,即H ++ OH -=H 2O ) 3)盐盐的概念:由金属离子(铵根离子)和酸根离子构成的化合物统称为盐。
例如:NaCl 、CaCl 2 、Na 2SO 4酸、碱、盐类物质的比较组 成特点举例酸 H ++酸根离子阳离子全部是 H +HCl 、H 2SO 4碱金属离子(或NH4+)+OH-阴离子全部是OH-NaOH、NH3.H2OCa(OH)2盐金属离子(或NH4+)+酸根离子除金属离子和酸根离子外可能还含有其他离子NaH SO4、CaCl2、Na2CO3【习题巩固】如图所示,小田同学在进行酸碱中和反应的实验时,向烧杯中的氢氧化钠溶液滴加稀盐酸一会儿后,发现忘记了滴加指示剂。
为了确定盐酸与氢氧化钠是否恰好完全反应,小田从烧杯中取了少量反应后的溶液于一支试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到酚酞试液不变色。
于是她得出“两种物质已恰好完全中和”的结论。
(1)你认为她得出的结论是否正确________,理由是_____________________。
(2)请你设计一个实验,探究上述烧杯中的溶液是否恰好完全中和.填写下表:实验方法可能观察到的现象结论2、中和反应在实际中的应用调节土壤的酸碱性、处理工厂的废水、用于医药【习题巩固】如图是某种胃药的部分标识。

酸和碱的中和反应(基础)撰稿:熊亚军审稿:于洋【学习目标】1.掌握酸和碱之间发生的中和反应。
2.了解酸碱性对生命活动和农作物的影响,以及中和反应在实际中的应用。
3.会用pH试纸检测溶液的酸碱性,了解溶液的酸碱度在实际中的意义。
【要点梳理】要点一、中和反应1.概念:酸与碱作用生成盐和水的反应,叫做中和反应。
2.实质:酸溶液中的H+和碱溶液中的OH-结合生成了中性的水。
表达式为:H+ + OH-=H2O。
3.现象:有些中和反应进行时有明显的现象,生成的盐以沉淀的形式析出;有些中和反应没有明显的实验现象,所以要判断中和反应是否发生或是否恰好完全反应需要借助酸碱指示剂。
【要点诠释】1.向滴有酚酞试液的氢氧化钠溶液中滴加稀盐酸时,一定要用滴管慢慢滴入稀盐酸,并不断搅拌溶液,直到溶液颜色恰好变成无色为止,否则容易使稀盐酸过量。
从指示剂的变色情况分析,当红色恰好变为无色时,溶液由碱性变为中性,因此,可以利用中和反应改变溶液的酸碱性。
2.注意理解中和反应的概念。
生成盐和水的反应不一定是中和反应,例如:2NaOH+CO2=Na2CO3+H2O,生成盐和水但不是中和反应。
要点二、中和反应在实际中的应用1.用于医药(1)人的胃液呈酸性,当胃液的pH为0.9~1.5时,有助于食物消化。
如果饮食过量时,胃会分泌出大量的胃酸,胃酸过多就会使人感到不适,这时医生就会让你口服某些含有碱性物质的药物,使碱和胃酸反应生成无毒的中性物质。
俗语“烧心”其实是“烧胃”也就是胃酸过多了,一般服用小苏打或胃舒平,它们均可以降低胃酸的浓度,但一旦并发有胃溃疡或胃穿孔症状,那么用小苏打就不合适了,因为反应产生的二氧化碳会刺激胃粘膜,反而使胃酸分泌更多;气体的存在也有加剧胃穿孔的危险。
氢氧化铝与胃酸反应不产生二氧化碳气体,同时生成具有收敛作用的氯化铝,治疗效果好一些。
Al(OH)3 + 3HCl = AlCl3 + 3H2O(2)我们可能都被蚊虫叮咬过。

乐乐课堂化学九下酸和碱的中和反应
酸和碱是化学中常见的两种物质,它们在很多化学反应中扮演着
重要的角色。
其中,酸和碱的中和反应是一种常见的化学反应,也是
我们生活中经常接触到的反应之一。
在化学九下的学习中,我们学习了很多关于酸和碱的知识,其中
酸和碱的中和反应就是其中之一。
酸和碱在中和反应中会产生盐和水,化学方程式通常可以表示为:酸 + 碱→ 盐 + 水。
中和反应的过程通常伴随着放热现象,即反应会释放出热量。
这
是因为酸和碱中的氢离子(H+)和氢氧根离子(OH-)结合形成水分子(H2O),释放出能量。
一个常见的中和反应是氢氧化钠(NaOH)和盐酸(HCl)的反应。
当它们混合在一起时,会发生中和反应,生成氯化钠(NaCl)和水。
这个反应不仅是一个典型的酸碱中和反应,也是我们日常生活中用来
清洁和消毒的一种方式。
通过学习化学九下关于酸和碱的知识,我们可以更好地理解中和
反应的原理和应用。
在实际生活中,我们可以通过合理运用这些知识,来解决一些与酸碱中和有关的问题,如环境保护、废水处理等。
总的来说,酸和碱的中和反应是化学中一个重要而有趣的话题,
我们应该努力学习并理解其中的原理和应用,以便更好地运用这些知
识解决实际问题。
通过不断地学习和实践,我们可以更好地掌握酸碱
中和反应的相关知识,为我们的学习和生活带来更多的乐趣和可能性。

酸和碱的中和反应
实验仪器:烧杯、胶头滴管、玻璃棒
实验试剂:氢氧化钠溶液、稀盐酸、酚酞溶液
实验开始
实验步骤
一、在烧杯中加入氢氧化钠溶液,并滴入几滴酚酞溶液,用玻璃棒搅拌。
现象:溶液由无色变为红色
二、用胶头滴管慢慢滴加稀盐酸,并不断搅拌,直至溶液恰好变为无色。
实验现象:滴加稀盐酸的过程中,溶液由红色逐渐变为无色。
注意事项
指示剂的选择:选择酚酞是由于氢氧化钠滴入无色酚酞溶液,溶液变红,滴入盐酸恰好中和时溶液呈中性,变为无色(酚酞遇碱变红,遇酸不变色)。
若用紫色石蕊溶液,紫色石蕊溶液在碱性溶液中呈蓝色,在中性溶液中呈紫色,在酸性溶液中变红。
蓝色、紫色、红色间没有明显的区别。
实验结论
氢氧化钠能与盐酸反应,反应的化学式为:
HCl + NaOH == NaCl + H2O
酸碱盐水
2.中和反应的通式:酸 + 碱 == 盐 + 水。

酸和碱的中和反应(提高)【学习目标】1.掌握酸和碱之间发生的中和反应。
2.了解酸碱性对生命活动和农作物的影响,以及中和反应在实际中的应用。
3.会用pH试纸检测溶液的酸碱性,了解溶液的酸碱度在实际中的意义。
【要点梳理】要点一、中和反应1.概念:酸与碱作用生成盐和水的反应,叫做中和反应。
2.实质:酸溶液中的H+和碱溶液中的OH-结合生成了中性的水。
表达式为:H+ + OH-=H2O。
3.现象:有些中和反应进行时有明显的现象,生成的盐以沉淀的形式析出;有些中和反应没有明显的实验现象,所以要判断中和反应是否发生或是否恰好完全反应需要借助酸碱指示剂。
【要点诠释】1.向滴有酚酞试液的氢氧化钠溶液中滴加稀盐酸时,一定要用滴管慢慢滴入稀盐酸,并不断搅拌溶液,直到溶液颜色恰好变成无色为止,否则容易使稀盐酸过量。
从指示剂的变色情况分析,当红色恰好变为无色时,溶液由碱性变为中性,因此,可以利用中和反应改变溶液的酸碱性。
2.注意理解中和反应的概念。
生成盐和水的反应不一定是中和反应,例如:2NaOH+CO2=Na2CO3+H2O,生成盐和水但不是中和反应。
要点二、中和反应在实际中的应用1.用于医药(1)人的胃液呈酸性,当胃液的pH为0.9~1.5时,有助于食物消化。
如果饮食过量时,胃会分泌出大量的胃酸,胃酸过多就会使人感到不适,这时医生就会让你口服某些含有碱性物质的药物,使碱和胃酸反应生成无毒的中性物质。
俗语“烧心”其实是“烧胃”也就是胃酸过多了,一般服用小苏打或胃舒平,它们均可以降低胃酸的浓度,但一旦并发有胃溃疡或胃穿孔症状,那么用小苏打就不合适了,因为反应产生的二氧化碳会刺激胃粘膜,反而使胃酸分泌更多;气体的存在也有加剧胃穿孔的危险。
氢氧化铝与胃酸反应不产生二氧化碳气体,同时生成具有收敛作用的氯化铝,治疗效果好一些。
Al(OH)3 + 3HCl = AlCl3 + 3H2O(2)我们可能都被蚊虫叮咬过。
被蚊虫叮咬后,叮咬处会很快肿成大包,这是因为蚊虫能在人的皮肤内分泌出蚁酸,从而使皮肤肿痛。

酸和碱的中和反应1、中和反应1)酸和碱作用生成盐和水的反应,叫做中和反应。
例如:H2SO4 + 2NaOH =Na2SO4 +2H2O2HCl + Ca(OH)2 = CaCl2 +2H2O注意:酸碱中和反应生成盐和水,但是有盐和水生成的反应不一定是中和反应,如反应2NaOH+CO222=Na2CO3+H2O2)中和反应的实质HCl==H+ + Cl- ;NaOH ==Na++ OH-酸溶液中的氢离子与碱溶液中的氢氧根离子结合生成了水分子。
如:HCl + NaOH =NaCl + H2O(实际参加反应的是H+和OH-,即H++ OH-=H2O)3)盐盐的概念:由金属离子(铵根离子)和酸根离子构成的化合物统称为盐。
例如:NaCl、CaCl2 、Na2SO4酸、碱、盐类物质的比较组成特点举例酸H++酸根离子阳离子全部是H+HCl、H2SO4碱金属离子(或NH4+)+OH- 阴离子全部是OH-NaOH、NH3.H2OCa(OH)2盐金属离子(或NH4+)+酸根离子除金属离子和酸根离子外可能还含有其他离子NaH SO4、CaCl2、Na2CO3【习题巩固】如图所示,小田同学在进行酸碱中和反应的实验时,向烧杯中的氢氧化钠溶液滴加稀盐酸一会儿后,发现忘记了滴加指示剂。
为了确定盐酸与氢氧化钠是否恰好完全反应,小田从烧杯中取了少量反应后的溶液于一支试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到酚酞试液不变色。
于是她得出“两种物质已恰好完全中和”的结论。
(1)你认为她得出的结论是否正确________,理由是_____________________。
(2)请你设计一个实验,探究上述烧杯中的溶液是否恰好完全中和.填写下表:实验方法可能观察到的现象结论2、中和反应在实际中的应用调节土壤的酸碱性、处理工厂的废水、用于医药【习题巩固】如图是某种胃药的部分标识。
胃药中所含物质能中和胃液里过多的胃酸(主要是盐酸)。
某患者按标识上的服用方法服药,服药三天后病情好转。

中考化学复习:《酸和碱的中和反应》考点汇总+精练!《酸和碱的中和反应》考点汇总1.中和反应的实质酸中的H+和碱中的OH-结合生成水的过程,即H++OH-=H2O。
2.实验操作、现象及结论3.实验拓展(1)指示剂的选择:酸碱中和反应的指示剂一般选用无色酚酞溶液,不选用紫色石蕊溶液,因为紫色石蕊溶液在碱性溶液中显蓝色,在中性溶液中显紫色,两种颜色的转化没有明显界限。
(2)滴定终点的判断:酸滴定碱时,酚酞作指示剂,当滴入最后一滴酸时,溶液颜色恰好由红色变为无色且半分钟内不再变色,则此时为滴定终点,酸和碱恰好完全反应。
二、知识+例题讲解知识点1.酸碱反应1.酸和碱发生反应的证据利用酸碱指示剂的变色反应进行判断,或用PH试纸测量。
如:在氢氧化钠溶液中滴加酚酞,溶液呈红色,逐渐滴加盐酸,直到红色刚好褪去,说明酸碱发生了反应;酸碱反应时,当溶液的PH等于7时,说明酸碱恰好完全反应。
2.氢氧化钠与盐酸反应生成氯化钠和水,与硫酸反应生成硫酸钠和水。
氯化钠和硫酸钠都属于盐,所以碱跟酸之间发生反应能生成盐和水。
NaOH +HCl=NaCl +H2O2NaOH +H2SO4=Na2SO4 +2H2O【注意】向滴有酚酞试液的氢氧化钠溶液中滴加盐酸时,一定要用滴管慢慢注入稀盐酸,并不断搅拌溶液,直到溶液颜色恰好变成无色为止,否则非常容易使稀盐酸过量,从指示剂的变色情况分析,当红色恰好变为无色时,溶液由碱性变为中性,说明中和反应常常伴随溶液酸碱性的改变,因此,可以利用中和反应改变溶液的酸碱性。
【例题1】下列各组物质的反应,需要加入酸碱指示剂才能判断反应是否发生的是()A.Fe和CuSO4溶液B.Zn和稀H2SO4C.NaOH溶液和稀盐酸D.澄清石灰水和CO2答案:C知识点2 酸碱反应的应用酸碱中和反应的实质是H++OH-→H2O,这一反应会放出热量。
酸碱发生反应时,溶液中的H+和OH-都减少,因而溶液的酸碱性也发生改变,因此常利用酸碱中和反应改变溶液的酸碱性并广泛应用于实际中。

导学案
酸和碱的中和反应班级姓名
一、知识复习
电离出的阳离子都是的化合物叫酸
电离出的阴离子都是的化合物叫碱
二、探究酸和碱的反应
实验探究过程
三、完成下列方程式
KOH + H2SO4
Ca(OH)2 + HCl
Ca(OH)2 +H2SO4
四、叫盐。
的反应叫中和反应。
五,中和反应在实际生活中的应用
1,改变土壤的酸碱性
如经常下酸雨形成的酸性土壤可以加入中和酸性。
(如土壤中含硫酸)反应方程式为
2,处理工厂的废水:如硫酸厂的污水可以用进行中和处理 3,用于医药
如胃酸过多时可服用含等碱性物质的药物,夏天蚊虫叮咬后可涂氨水、牙膏等碱性物质中和蚊虫分泌的蚁酸。
(如胃酸为盐酸)反应方程式为
六、课堂练习
1.下列关于中和反应的说法错误的是( )。
A.中和反应要放热 B.中和反应一定有盐生成
C.有盐和水生成的反应都是中和反应
D.中和反应一定有水生成
2.小烧杯中盛有含石蕊的氢氧化钠溶液,逐滴加入稀盐酸至过量,烧杯中溶液颜色变化的顺序是( )
A.紫色—红色—蓝色 B.蓝色—紫色—红色
C.蓝色—红色—紫色 D.紫色—蓝色—红色
七,小结本课知识归纳整理。
酸碱中和反应知识点九年级酸碱中和反应是化学领域中一个重要的概念,它涉及到酸碱的性质以及化学反应的平衡。
在九年级化学学科中,学生需要对酸碱中和反应有所了解。
本文将介绍酸碱中和反应的知识点。
1. 定义和概念:酸碱中和反应是指在化学反应中,酸和碱互相中和,生成盐和水的过程。
酸是指能够释放出H+(氢离子)的化合物,而碱则是能够释放出OH-(氢氧根离子)的化合物。
在中和反应中,H+和OH-结合成水,同时生成一种盐。
2. 中和反应的化学方程式:中和反应的化学方程式通常可以表示为:酸 + 碱→ 盐 + 水例如,硫酸(H2SO4)与氢氧化钠(NaOH)的中和反应可以表示为:H2SO4 + 2NaOH → Na2SO4 + 2H2O。
这个方程式表示了硫酸和氢氧化钠中和反应生成硫酸钠和水这两种物质。
3. 中和反应的pH值:在中和反应中,酸和碱的pH值将趋于中性,即7。
这是因为酸和碱的氢离子和氢氧根离子结合生成水,而水的pH值是7。
因此,中和反应后的溶液将是中性的。
4. 中和反应的应用:中和反应在日常生活中有着广泛的应用。
例如,我们可以使用碳酸氢钠(NaHCO3)来中和胃酸,以减轻胃部不适。
另外,中和反应还被广泛应用于水处理过程中,用来调节水的酸碱度。
此外,中和反应也可用于制备化肥、药品等工业产品。
5. 中和反应的实验:学生可以通过实验来观察中和反应,了解其特性。
一种常见的实验是使用酸碱指示剂来观察酸碱的中和反应过程。
酸碱指示剂可以根据溶液的酸碱性质而发生颜色变化,从而反映溶液的酸碱性。
例如,酚酞指示剂在酸性溶液中呈现红色,在碱性溶液中呈现黄色,而在中性溶液中则呈现橙色。
6. 酸碱中和反应的平衡:酸碱中和反应通常是一个可逆反应,在溶液中,可以同时存在酸、碱、盐和水。
这个平衡状态可以通过化学方程式:酸 + 碱⇌盐 + 水来表示。
反应的正向和逆向方向都可以发生,取决于反应物和产物的浓度。
当酸的浓度等于碱的浓度时,反应处于中和状态。