免疫扩散实验(双向双扩散) PPT
- 格式:ppt
- 大小:450.00 KB
- 文档页数:14


双相免疫扩散试验
实验原理:抗原和抗体在含有电解质的琼脂凝胶板的对应孔中,各自向四周凝胶中扩散,当二者发生特异性反应时,在浓度比例合适处形成可见的白色沉淀线。
本实验用于检测免疫成功与否及所产生的抗体的效价,抗体效价以出现明显沉淀线时的抗体的最高稀释度为判定终点。
一般来说,当效价≥1:16时(可在1:64以上),即可放血收集血清。
试剂和器材:
1.待测血清(抗体)
2.0.4%BSA(抗原)
3.琼脂粉、生理盐水
4.载玻片、吸管、滴管、打孔器、湿盒等
步骤和方法:
1.制备琼脂凝胶:生理盐水配制浓度为12g/L的琼脂,完全溶化至澄清
2.浇板:将载玻片置于水平台上,吸取琼脂加在玻片上,盖满、平整、无气泡
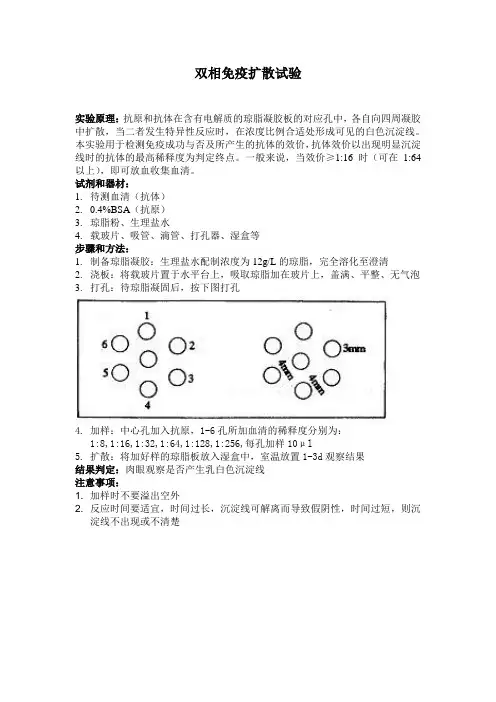
3.打孔:待琼脂凝固后,按下图打孔
4.加样:中心孔加入抗原,1-6孔所加血清的稀释度分别为:
1:8,1:16,1:32,1:64,1:128,1:256,每孔加样10μl
5.扩散:将加好样的琼脂板放入湿盒中,室温放置1-3d观察结果
结果判定:肉眼观察是否产生乳白色沉淀线
注意事项:
1. 加样时不要溢出空外
2. 反应时间要适宜,时间过长,沉淀线可解离而导致假阴性,时间过短,则沉
淀线不出现或不清楚。

实验七免疫双扩散检测抗GFP血清抗体[实验原理] 在溶液中的可溶性多价抗原与血清抗体相遇,当两者的比例适当时可以形成一种网状的不溶性的大分子复合物,这叫作免疫沉淀反应。
当这样的抗原和相应的抗体在含有电解质的琼脂凝胶中相对扩散时,在抗原与抗体的比例适当处会形成可见的沉淀线,这叫免疫双扩散实验,是免疫沉淀反应的一种。
免疫双扩散常用于动物免疫效果的检测和血清抗体效价的测定。
本实验使用的粗抗原是大肠杆菌表达的GFP的抽提物,抗体是GFP免疫兔子后得到的抗血清。
[仪器、试剂和材料]1、磷酸盐缓冲液(PBS),pH 7.42、1.5%琼脂,PBS配置3、兔抗GFP血清4、GFP粗提物5、微波炉6、恒温培养箱7、载玻片8、自制打孔器9、小塑料盒10、针头、牙签11、“枪”、“枪头”[实验操作]1、1.5%琼脂的配制:pH 7.4的PBS 100mL中加1.5克琼脂,微波炉中小功率加热,使琼脂完全溶化。
2、取干净的载玻片,平放于实验台(台面要水平),将融化的琼脂趁热加在载玻片上(约加4mL),使琼脂铺满整个玻片的表面(注意勿使琼脂流出玻片之外)。
令其在室温下冷却凝固。
3、将载玻片放在画好的打孔式样的样板上,用自制打孔器(内径2-3毫米)在琼脂上照样板打孔,做两朵“花”。
用针头小心地将打好的孔中的琼脂挑出,当心不要碰伤了孔周围的琼脂。
打好孔后,把凝胶的右下角切掉一小块,作为标记。
4、GFP抗原的稀释:用上次实验得到的GFP粗提物的饱和硫酸铵沉淀,加100mL的PBS使溶解,此为抗原的原液。
取出原液15mL,在一小块封口膜上用PBS做系列的倍比稀释,直到稀释为1:16。
5、在左边一朵花的中央孔中加约15mL的免疫后兔血清,周围孔加不同稀释度的GFP粗提物。
右边的一朵花除中央孔中加免疫前的兔血清外其余的与左边的相同。
加样时将每孔加满即可,注意不要使溢出孔外。
6、在小塑料盒中铺一块滤纸,加少量水将滤纸浸湿,上面放两根牙签,将加好样的载玻片放在牙签上,盖好盒盖,放37℃温箱中过夜。

沉淀试验一一双向免疫扩散试验一、目的要求1.掌握双向免疫扩散试验的原理和用途;2.熟悉双向免疫扩散试验的操作方法。
二、实验原理可溶性抗原(如细菌的外毒素、内毒素、菌体裂解液、病毒、组织浸出液等)与相应的抗体结合后,在适量电解质存在下,形成肉眼可见的白色沉淀线,称为沉淀试验(precipitation)。
在生理条件下,抗原抗体均带负电荷,使极化的水分子在其周围形成水化膜,成为亲水胶体。
当抗原与抗体结合后,表面电荷减少,水化膜变薄;而且由于抗原抗体复合物形成后,与水接触的表面积减少,由亲水胶体转化为疏水胶体。
在电解质作用下,各疏水胶体之间靠拢,形成可见的抗原抗体复合物。
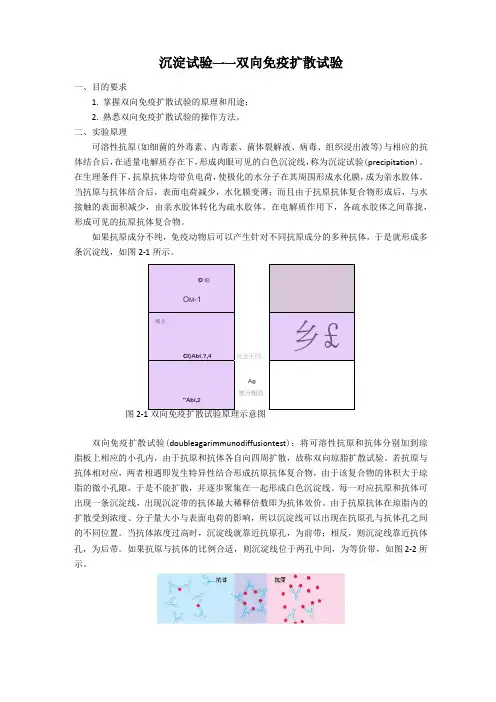
如果抗原成分不纯,免疫动物后可以产生针对不同抗原成分的多种抗体,于是就形成多条沉淀线,如图2-1所示。
图双向免疫扩散试验(doubleagarimmunodiffusiontest):将可溶性抗原和抗体分别加到琼脂板上相应的小孔内,由于抗原和抗体各自向四周扩散,故称双向琼脂扩散试验。
若抗原与抗体相对应,两者相遇即发生特异性结合形成抗原抗体复合物,由于该复合物的体积大于琼脂的微小孔隙,于是不能扩散,并逐步聚集在一起形成白色沉淀线。
每一对应抗原和抗体可出现一条沉淀线,出现沉淀带的抗体最大稀释倍数即为抗体效价。
由于抗原抗体在琼脂内的扩散受到浓度、分子量大小与表面电荷的影响,所以沉淀线可以出现在抗原孔与抗体孔之间的不同位置。
当抗体浓度过高时,沉淀线就靠近抗原孔,为前带;相反,则沉淀线靠近抗体孔,为后带。
如果抗原与抗体的比例合适,则沉淀线位于两孔中间,为等价带,如图2-2所示。
图2-2抗原-抗体结合的沉淀带形成原理示意图三、实验用途:沉淀试验广泛应用于病毒抗原、细菌毒素或寄生虫抗原等的诊断(图2-3),以及各种免疫血清效价和毒素、抗毒素的测定等。
四、材料:(1)耗材:小平皿、1.5mL 的离心管、吸头;(2)试剂:琼脂糖、8.5%高渗盐水、待检血清、鸡卵白素(ovalbumin,OVA )、兔抗OVA 阳性血清;(3)仪器:高压锅、打孔器、移液器、湿盒、恒温箱。


免疫双扩散法的基本原理免疫双扩散法(Immune Double Diffusion)是一种常用的免疫学实验方法,用于检测特定抗原与抗体之间的相互作用。
该方法基于抗原和抗体在凝胶中扩散的原理,通过观察扩散过程中形成的免疫沉淀线来确定样品中是否存在目标抗原。
免疫双扩散法的基本原理是基于抗原与抗体之间的可逆结合。
在实验中,首先将待测抗原和已知抗原分别与相应的抗体混合,形成抗原-抗体复合物。
然后,将这些混合物分别加入含有琼脂糖的凝胶孔中,使其扩散。
当抗原-抗体复合物扩散到凝胶孔中时,它们会与在凝胶中预先添加的相应抗体结合。
这种结合会导致免疫沉淀的形成,形成可见的沉淀线。
沉淀线的长度和密度与待测抗原的浓度成正比,可以通过比较不同样品中沉淀线的形成情况来定量测定目标抗原的含量。
免疫双扩散法的优势在于其简单性和灵敏性。
无需复杂的仪器和设备,只需一些基本的实验器材即可进行实验。
此外,该方法可以同时检测多个样品中的抗原,因此在高通量的实验中具有一定的优势。
在实际应用中,免疫双扩散法被广泛用于医学诊断、生物学研究和药物研发等领域。
例如,通过检测血清中特定抗原的含量,可以帮助医生诊断某些疾病。
在疫苗研发中,该方法可以用于检测疫苗中抗原的含量和纯度。
此外,免疫双扩散法还可以用于检测抗体的结合特异性以及抗原的相互作用。
然而,免疫双扩散法也存在一些局限性。
首先,该方法对于低浓度的抗原检测较为困难,因为低浓度的抗原很难与抗体有效结合形成免疫沉淀。
其次,该方法的定量结果受到多种因素的影响,如温度、孔的大小和凝胶的浓度等。
因此,在实验过程中需要进行严格的控制和标准化操作。
免疫双扩散法是一种简单而有效的免疫学实验方法,可以用于检测特定抗原与抗体之间的相互作用。
通过观察免疫沉淀线的形成情况,可以定量测定抗原的含量。
尽管存在一些局限性,但免疫双扩散法仍然被广泛应用于医学和生物学领域,为科学研究和临床诊断提供了有力的工具。



双向扩散法一抗原分析【原理】双向扩散法是指可溶性抗原与相应抗体在琼脂介质中相互扩散而形成—定类型沉淀线的方法。
沉淀线的特征与位置不仅取决于抗原抗体的特异性与相互间浓度比例,而且与其分子大小与扩散速度相关。
当抗原抗体存在多种系统时,可呈现多条沉淀线以至交叉反应。
【材料】生理盐水丄%琼脂管(每管约4rnl)载玻片打孔器与打孔模板微量加样器与塑料吸头抗体与抗原丄、2、3、4、5、6o湿盒【方法】1.将已溶化的丄%琼脂盐水管放56~60C。
水浴箱中平衡温度备用。
2将载玻片置于水平桌面上倾注已溶化琼脂35〜4讯使成厚度约1.5mm 琼脂板。
3•凝固后,将打孔模板置于琼脂板下,然后用打孔器打孔,根据不同需要可制成三角型、方阵型或梅花型。
本次实验采用三角型,即每一个三角型的三个孔为一组。
(因本次实验所制备的琼脂板均以载玻片为底板故根据其大小只能采用三角型同时每一琼脂板也只能制成两组。
否则,如采用方阵型或梅花型则因琼脂板边缘琼脂厚度不够而使周边各孔所加抗原或抗体量不足或溢出,如制成三角型三组,因各孔相距过近相互渗透扩散而难于正确判定结果)。
4•用微量加样器加抗体各10^o各组所余两孔各按抗原丄、2为一组,3、4为二组.5、6为三组.分别各加入丄0山。
注意每加一样品均需更换加样器塑料吸头,以防止交叉现象影响实验结果。
5•作好记录,放湿盒中,置37C。
温箱,24小时后观察结果。
【结果】说明:(1)融合性沉淀弧,说明两孔中抗原相同,为同一性反应。
(2)两沉淀线独自形成并形成交叉,说明两孔中的抗原完全不同,为非同一性反应。
(3)融合性沉淀弧出现支线,或同时有另一条或两条沉淀线,说明两孔中抗原有相同部分又有不同部分,此为部分同一性反应。
单向免疫扩散法(Single radii immunodiffusion)—正常人群IgG正常值检测【原理】在含有特异抗体的琼脂板中打孔,并在孔中加入定量的抗原,当抗原向周围扩散后与琼脂中抗体相结合,既形成白色沉淀环,其直径或面积与抗原浓度呈正相关。