中考化学 第一轮 基础知识过关 第二部分 身边的化学物质 第1讲 空气和氧气(精讲)
- 格式:ppt
- 大小:3.66 MB
- 文档页数:41

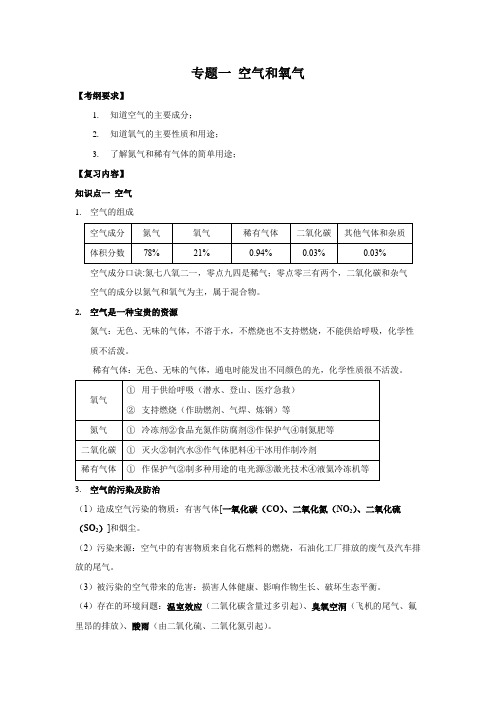
专题一空气和氧气【考纲要求】1.知道空气的主要成分;2.知道氧气的主要性质和用途;3.了解氮气和稀有气体的简单用途;【复习内容】知识点一空气1.空气的组成空气成分口诀:氮七八氧二一,零点九四是稀气;零点零三有两个,二氧化碳和杂气空气的成分以氮气和氧气为主,属于混合物。
2.空气是一种宝贵的资源氮气:无色、无味的气体,不溶于水,不燃烧也不支持燃烧,不能供给呼吸,化学性质不活泼。
稀有气体:无色、无味的气体,通电时能发出不同颜色的光,化学性质很不活泼。
3.空气的污染及防治(1)造成空气污染的物质:有害气体[一氧化碳(CO)、二氧化氮(NO2)、二氧化硫(SO2)]和烟尘。
(2)污染来源:空气中的有害物质来自化石燃料的燃烧,石油化工厂排放的废气及汽车排放的尾气。
(3)被污染的空气带来的危害:损害人体健康、影响作物生长、破坏生态平衡。
(4)存在的环境问题:温室效应(二氧化碳含量过多引起)、臭氧空洞(飞机的尾气、氟里昂的排放)、酸雨(由二氧化硫、二氧化氮引起)。
(5)防止空气污染的措施:加强大气质量监测,改善环境状态、植树造林、使用清洁能源。
(6)目前空气污染指数包括:一氧化碳、二氧化氮、二氧化硫、可吸入颗粒物、臭氧。
(7)未来化学将朝着“绿色化学”——“绿色消毁”和“绿色生产”的方向发展。
核心是利用化学原理从源头消除污染。
特点:①充分利用资源和能源,原料无毒无害②减少向环境排放废物③原料中的原子全部被消纳,实现零排放(在化合反应中体现)④生产出环境友好产品4.空气中氧气的测定实验(1)装置图:(2)实验现象:A、红磷燃烧发出黄白色火焰,放出热量,冒出白色浓烟B、(过一会儿白烟消失,装置冷却到室温后打开弹簧夹)烧杯内的水倒流入集气瓶,约占瓶子容积的1/5。
(3)实验结论:说明空气不是单一的物质;氧气约占空气总体积的1/5。
点燃(4)化学方程式:4P + 5O22P2O5(5)注意事项:A、所用的红磷必须过量,过少则氧气没有全部消耗完B、要等集气瓶(装置)冷却后才能打开弹簧夹,C、装置的气密性要好,(否则测量结果偏小),D、要先夹住橡皮管,然后再点红磷(否则测量结果偏大)。


精心整理《第二章身旁的化学物质 》知识重点一、氧气(一)、氧气的物理性质1、色、味、态:往常状况下,是无色无味的气体;2、密度:标准状况下,密度为 1.429g/L ,略大于空气 。
(可用向上排空气法)3、溶解性:氧气 不易溶于 水。
(可用排水法采集),4、三态变化:降温后,氧气能够变为淡蓝色的液体,甚至淡蓝色雪花状固体。
(二)、氧气的化学性质(1)与非金属的反响 1、木炭(黑色)与氧气反响实验现象 :在空气中焚烧发出红光;在氧气中:①强烈焚烧,发出白光②放出热量③ 产生使澄清石灰水变污浊的气体文字表达式 :碳 +氧气 点燃二氧化碳点燃CO 2符号表达式 : C+O 2 2、硫(淡黄色)与氧气反响实验现象 :在空气中发出轻微的淡蓝色火焰; 在氧气中①强烈焚烧, 发出光亮的蓝紫色火焰②放出热量③产生有刺激性气味的气体(瓶底放水汲取,防备污染空气)点燃文字表达式 :硫 +氧气 二氧化硫点燃符号表达式 : S+O 2 SO 2 3、磷与氧气反响实验现象: 磷在氧气中焚烧比在空气中焚烧更旺,放出热量,产生大批的白烟点燃文字表达式 :磷 +氧气 五氧化二磷点燃符号表达式 : P+O 2 P 2O 54、蜡烛与氧气反响实验现象 :在空气中焚烧产生黄色火焰,放热,稍有黑烟。
在氧气中强烈焚烧,发出白光,集气瓶内壁出现水珠,有使澄清石灰水变污浊的无色无味气体产生。
(2)与金属反响1、铁丝(银白色) [铁粉:黑色 ]与氧气反响实验现象 :在空气中不可以焚烧;在氧气中①强烈焚烧,火星四射②放出热量③生成黑色固体( Fe 3O 4)注意:集气瓶里要早先装少许水或细沙, 防备高温熔融物溅落瓶底,使其炸裂 。
点燃文字表达式 :铁 +氧气 四氧化三铁点燃符号表达式 : Fe+O 2 Fe 3O 4注意:(1)细铁丝绕成 螺旋状 且在尾端系上火柴梗: 集中热量,提升局部温度 ,有益于铁丝连续焚烧(2)火柴梗的作用: 引燃2、镁带(银白色)在空气中焚烧实验现象 :强烈焚烧,发出刺眼的白光,放出热量,生成白色粉末状固体。


专题二空气和氧气【复习目标】1、说出空气的主要成分,并了解各成分的用途;2、了解空气的污染的原因和防治措施;3、掌握空气中氧气含量的测定方法;4、说出氧气的物理性质和化学性质,认识氧气可以与多种物质发生氧化反应;5、了解催化剂、催化作用的概念;6、掌握实验室制取氧气的方法。
【命题解读】1、空气的组成及有关空气质量的题目常以选择题的形式考查,考查命题点有:空气各成分的含量、用途的判断;提高空气质量的措施;空气污染物的判断等,常以文字的形式出现。
2、氧气的性质主要以选择题和填空题的形式考查,考查命题点有:常见物质如:硫、木炭、铁丝、镁条等与氧气发生反应的实验现象和对氧气的认识的判断。
3、空气中氧气含量的测定常以选择题和填空题的形式考查,考查命题点有:实验药品的判断;实验原理化学方程式的书写;实验现象和结论的判断;实验误差的分析等。
4、实验室制取氧气主要以实验与探究题的形式考查,并且常与二氧化碳的制取及气体的检验与净化结合在一起考查,考查命题点有,药品的选择,仪器的名称及选择,药品的反应原理,实验步骤及注意事项,气体的检验与验满,气体的除杂净化等。
【考点梳理】考点1:空气的成分及用途1、法国化学家拉瓦锡用定量的方法研究空气成分,得出结论:空气由氧气和氮气组成,其中氧气约占空气总体积的1/5。
2、空气的成分及其体积分数(大约)和用途3、分离液态空气制取各成分降温加热氧气该过程是物理变化空气液态空气氮气(石油蒸馏同这里的原理一样)加压原理:各成分沸点不同稀有气体4、空气质量:(1)空气中的有害物:SO2、CO、NO2、O3和可吸入颗粒物、总悬浮颗粒物;(2)空气污染指数越高,污染越严重;(3)CO2不属于空气污染物,但含量增多会引起温室效应。
考点2:测定空气中氧气的含量1、基本思路:通过化学反应,除去混合物中的一种成分,再测定混合物在反应前后的体积或质量的变化。
2、药品选择要求:生成物是固体,只与氧气反应。