物理化学
- 格式:doc
- 大小:3.41 MB
- 文档页数:78
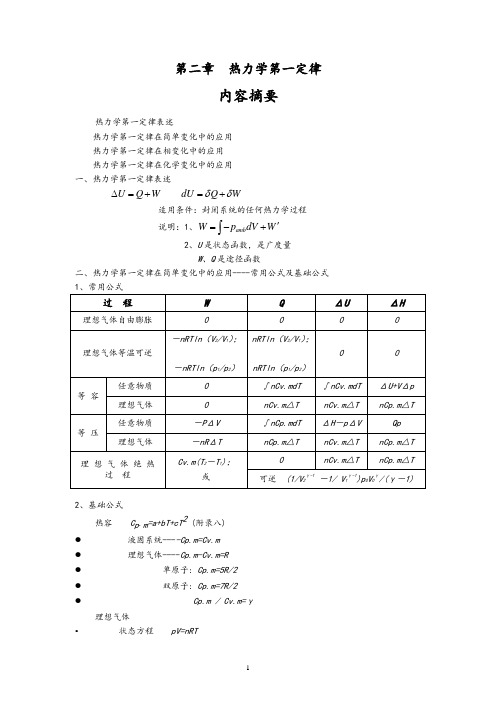
第二章热力学第一定律内容摘要热力学第一定律表述热力学第一定律在简单变化中的应用 热力学第一定律在相变化中的应用 热力学第一定律在化学变化中的应用 一、热力学第一定律表述U Q W ∆=+ dU Q W δδ=+适用条件:封闭系统的任何热力学过程 说明:1、amb W p dV W '=-+⎰2、U 是状态函数,是广度量W 、Q 是途径函数 二、热力学第一定律在简单变化中的应用----常用公式及基础公式 过 程WQΔUΔH理想气体自由膨胀理想气体等温可逆-nRTln (V 2/V 1); -nRTln (p 1/p 2) nRTln (V 2/V 1);nRTln (p 1/p 2)0 0等 容任意物质0 ∫nCv.mdT ∫nCv.mdT ΔU+V Δp 理想气体 0 nCv.m △T nCv.m △T nCp.m △T 等 压任意物质-P ΔV ∫nCp.mdT ΔH -p ΔV Qp 理想气体-nR ΔT nCp.m △TnCv.m △T nCp.m △T 理 想 气 体 绝 热过 程 Cv.m(T 2-T 1);或nCv.m △TnCp.m △T可逆 (1/V 2γ-1-1/ V 1γ-1)p 0V 0γ/(γ-1)2、基础公式热容 C p .m =a+bT+cT 2 (附录八) ● 液固系统----Cp.m=Cv.m ● 理想气体----Cp.m-Cv.m=R ● 单原子: Cp.m=5R/2 ● 双原子: Cp.m=7R/2 ● Cp.m / Cv.m=γ理想气体• 状态方程 pV=nRT• 过程方程 恒温:1122p V p V = • 恒压: 1122//V T V T = • 恒容: 1122/ / p T p T =• 绝热可逆: 1122 p V p V γγ= 111122 T p T p γγγγ--=111122 TV T V γγ--= 三、热力学第一定律在相变化中的应用----可逆相变化与不可逆相变化过程1、 可逆相变化 Q p =n Δ相变H m W = -p ΔV无气体存在: W = 0有气体相,只需考虑气体,且视为理想气体ΔU = n Δ相变H m - p ΔV2、相变焓基础数据及相互关系 Δ冷凝H m (T) = -Δ蒸发H m (T)Δ凝固H m (T) = -Δ熔化H m (T) Δ凝华H m (T) = -Δ升华H m (T)(有关手册提供的通常为可逆相变焓)3、不可逆相变化 Δ相变H m (T 2) = Δ相变H m (T 1) +∫Σ(νB C p.m )dT 解题要点: 1.判断过程是否可逆;2.过程设计,必须包含能获得摩尔相变焓的可逆相变化步骤;3.除可逆相变化,其余步骤均为简单变化计算.4.逐步计算后加和。

物理化学的知识点总结一、热力学1. 热力学基本概念热力学是研究能量转化和传递规律的科学。
热力学的基本概念包括系统、环境、热、功、内能、焓、熵等。
2. 热力学第一定律热力学第一定律描述了能量守恒的原理,即能量可以从一个系统转移到另一个系统,但总能量量不变。
3. 热力学第二定律热力学第二定律描述了能量转化的方向性,熵的增加是自然界中不可逆过程的一个重要特征。
4. 热力学第三定律热力学第三定律表明在绝对零度下熵接近零。
此定律是热力学的一个基本原理,也说明了热力学的某些现象在低温下会呈现出独特的特性。
5. 热力学函数热力学函数是描述系统状态和性质的函数,包括内能、焓、自由能、吉布斯自由能等。
二、化学热力学1. 热力学平衡和热力学过程热力学平衡是指系统各个部分之间没有宏观可观察的能量传输,热力学过程是系统状态发生变化的过程。
2. 能量转化和热力学函数能量转化是热力学过程中的一个重要概念,热力学函数则是描述系统各种状态和性质的函数。
3. 热力学理想气体理想气体是热力学研究中的一个重要模型,它通过状态方程和理想气体定律来描述气体的性质和行为。
4. 热力学方程热力学方程是描述系统热力学性质和行为的方程,包括焓-熵图、温度-熵图、压力-体积图等。
5. 反应焓和反应熵反应焓和反应熵是化学热力学研究中的重要参数,可以用来描述化学反应的热力学过程。
三、物质平衡和相平衡1. 物质平衡物质平衡是研究物质在化学反应和物理过程中的转化和分配规律的一个重要概念。
2. 相平衡相平衡是研究不同相之间的平衡状态和转化规律的一个重要概念,包括固相、液相、气相以及其之间的平衡状态。
3. 物质平衡和相平衡的研究方法物质平衡和相平衡的研究方法包括热力学分析、相平衡曲线的绘制和分析、相平衡图的绘制等。
四、电化学1. 电解质和电解电解质是能在水溶液中发生电离的化合物,电解是将电能转化为化学能或反之的过程。
2. 电化学反应和电势电化学反应是在电化学过程中发生的化学反应,电势是描述电化学系统状态的一个重要参数。



物理化学的主要内容包括
:
1. 动力学:运动的原理,能的定义,熵的概念,热力学,动力学等。
2. 化学平衡:溶液的溶解度、能量障碍及改变,静态及动态平衡,平
衡常数及平衡常数的改变,萃取平衡,反应化学平衡,皿热反应等。
3. 电离和离子竞争:电解反应、离子竞争、活性空穴及电荷构型的调节,吸附反应及calvin- wheeler竞争,体系电荷分布及滴定反応等。
4. 化学催化:催化原理及作用机制,原位及连续催化,非权衡催化反
应的特性,络合催化,分子催化等。
5. 固体表面和电场:表面状态及表面电荷,消散电荷谱,电场及偏振,极化材料及表面电荷型复合物等。
6. 分子量和热力学:分子量及其热力学特性,热力学不平衡性及能量
分配,分子结构,热量放射,热电材料等。

物理化学试题及答案一、选择题(每题2分,共20分)1. 根据热力学第一定律,下列哪种情况下系统与外界无能量交换?A. 系统对外做功B. 系统吸收热量C. 系统与外界无功交换D. 系统与外界无热交换2. 在理想气体状态方程 PV=nRT 中,下列哪个变量与气体的体积成反比?A. 温度B. 压力C. 气体的摩尔数D. 气体的常数R3. 根据玻尔理论,氢原子的能级跃迁时,会伴随哪种现象?A. 电子的轨道半径变化B. 电子的自旋方向变化C. 电子的质子数变化D. 电子的轨道周期变化4. 根据热力学第二定律,下列哪种情况是不可能发生的?A. 自然界中的热能自发地从低温物体传递到高温物体B. 气体自发膨胀C. 热机的效率达到100%D. 热机的效率小于100%5. 在化学动力学中,反应速率常数与下列哪个因素无关?A. 反应物的浓度B. 反应的活化能C. 温度D. 催化剂6. 根据分子间作用力理论,下列哪种分子间作用力最强?A. 范德华力B. 氢键C. 离子键D. 共价键7. 在电解质溶液中,离子的迁移率与下列哪个因素有关?A. 离子的电荷数B. 离子的半径C. 离子的浓度D. 离子的摩尔质量8. 根据吉布斯自由能变化(ΔG)的定义,下列哪种情况下反应是自发的?A. ΔG > 0B. ΔG < 0C. ΔG = 0D. ΔG 无法确定9. 在相变过程中,下列哪种相变是不可逆的?A. 固体到液体B. 液体到气体C. 气体到固体D. 固体到气体10. 根据勒夏特列原理,下列哪种情况可以增加反应的平衡常数?A. 增加反应物的浓度B. 降低反应物的浓度C. 升高反应体系的温度D. 降低反应体系的温度答案:1-5 DBBCC;6-10 DBBBD二、填空题(每空1分,共10分)1. 根据热力学第一定律,能量守恒可以表示为ΔU = ____ + W。
2. 理想气体的内能只与____有关。
3. 根据玻尔理论,氢原子的能级公式为 E_n = - ____ / n^2。

结构化学物理化学结构化学物理化学是研究物质的分子结构和物理化学性质的学科。
它通过对物质的组成和结构进行分析和研究,揭示物质的物理性质和化学反应机理,为实现物质的功能设计和制备提供理论基础和指导。
本文将从分子结构、物理性质和化学反应机理三个方面介绍结构化学物理化学的基本概念和研究方法。
分子结构是物质的基本组成单位,也是物质性质的基础。
结构化学物理化学通过实验和理论研究,揭示了不同物质的分子结构。
例如,通过光谱学和X射线衍射等实验手段,可以确定有机分子的化学键类型和空间构型,从而推断分子的立体结构。
通过分子力场计算和量子化学计算等理论方法,可以预测和优化分子的结构。
分子结构的研究有助于理解物质的性质和反应机理。
物理性质是物质在物理条件下所表现出的特征。
结构化学物理化学通过实验和理论研究,揭示了物质的物理性质与其分子结构之间的关系。
例如,通过测量物质的熔点、沸点、密度、折射率等物理性质,可以了解物质的分子间相互作用力和分子运动方式。
通过分子动力学模拟和量子力学计算等理论方法,可以预测和解释物质的物理性质。
物理性质的研究有助于揭示物质的宏观性质和应用特性。
化学反应机理是物质在化学条件下发生变化的过程。
结构化学物理化学通过实验和理论研究,揭示了化学反应的机理和动力学。
例如,通过反应动力学实验和理论模拟,可以确定化学反应的速率方程和活化能。
通过红外光谱、质谱和核磁共振等实验手段,可以探测和鉴定反应中的中间体和过渡态。
化学反应机理的研究有助于优化化学反应条件和提高反应效率。
结构化学物理化学的研究方法包括实验和理论两个方面。
实验方法主要包括光谱学、热分析、电化学、表面分析和物理性质测量等。
理论方法主要包括分子力场计算、量子化学计算、分子动力学模拟、反应动力学模拟和电子结构计算等。
实验和理论相互结合,可以更全面地揭示物质的结构和性质,为物质的功能设计和制备提供理论基础和指导。
总结起来,结构化学物理化学是研究物质的分子结构和物理化学性质的学科。

物理化学重要知识点总结及其考点说明
一、化学热力学
1、化学热力学的定义:化学热力学是研究化学反应中物质的热量及能量变化的学科。
2、热力学三定律:第一定律:能量守恒定律;第二定律:热力学第二定律确定有序
能可以被有度能转化;第三定律:热力学第三定律始终指出热力学反应的可能性和温度有关。
3、焓的概念:焓是衡量物质的热力学状态的量,它是物质的热力学特性连续变化的
测量,是物质拥有的热量能量,也可以视为物质拥有的有序能。
4、热力学平衡:热力学平衡是指在不变的温度、压力和其他条件下,恒定的化学反
应发生,直至反应物和生成物的物质形式和化学结构保持不变,热量吸积也变得稳定,这
种状态称为热力学平衡。
二、物理化学
1、物理化学的概念:物理化学是一门融合了物理学和化学的学科,通过应用物理方法,来研究化学性质的变化和分子间的作用及反应,其研究具有多学科的性质。
2、气体的特性:气体的物理性质有很多,如压强、体积、温度、熵、焓等。
质量和
体积的关系为:在一定温度下,气体的质量和体积都成正比。
3、溶质的溶解度:溶解度是衡量溶质溶解在溶剂中的性质,它是指在一定温度、压
力下,溶质在溶剂中的最高溶解量。
溶质的溶解度与温度,压强及溶剂特性有关。
4、化学均衡:化学均衡是指在特定温度和压强下,混合物中物质的各种浓度比例,
产物与原料之间的反应紊乱程度,变化状态的一种稳定平衡状态。

物理化学总分-回复物理化学总分:物理化学是研究物质的性质及其变化规律的科学,它是化学中的一门重要分支。
在物理化学的学习过程中,我们需要了解和掌握一系列的基础知识和实验技能。
本文将从物理化学的基本概念、主要内容和实验技巧三个方面,一步一步回答关于物理化学总分的问题。
一、物理化学的基本概念物理化学(Physical Chemistry)是将物理学与化学相结合的学科,它研究的是物质的基本性质、物质与能量的相互关系以及物质的组成和变化规律。
物理化学主要包括热力学、量子化学、统计力学和动力学等内容。
热力学是研究物质能量转化和能量转移的学科,它主要关注物质在不同条件下的热力学性质,如温度、压力和能量等。
热力学通过研究物质的热力学函数和热力学过程的定性和定量关系,揭示了物质在不同能量状态下的变化规律。
量子化学是研究微观领域的学科,它主要关注原子和分子的量子力学性质。
量子化学通过求解薛定谔方程来描述原子和分子的行为,并通过计算方法和模型来预测化学反应和化学性质。
量子化学的发展对于理论和计算化学的发展具有重要意义。
统计力学是研究物质组成和热力学性质之间关系的学科,它通过统计方法和概率模型描述了大量微观粒子的行为规律。
统计力学的研究可以帮助我们理解物质的宏观性质,如熵、热容和相变等。
动力学是研究物质变化速率和反应机制的学科,它可以揭示物质的化学反应过程中的速率规律和反应途径。
动力学通过实验数据和理论模型来研究物质的反应速率和反应机理,为实验和工业应用提供了理论支持。
二、物理化学的主要内容物理化学的主要内容包括热力学、量子化学、统计力学和动力学等。
这些内容相互关联、相互支撑,构成了物理化学的基础理论体系。
热力学是物理化学的基础,它研究物质的能量和热力学性质。
热力学通过热力学函数和热力学过程的关系,描述了物质在不同条件下的热现象。
热力学不仅揭示了物质热力学性质的基本规律,还为工程和实验提供了指导原则。
量子化学是研究微观粒子行为的学科,它可以预测原子和分子的光谱性质和反应行为。

第0章绪论§0.1 物理化学的定义、形成和发展1. 物理化学的定义化学变化种类繁多,但从本质上说都是原子或原子团的重新组合。
在原子或原子团重新组合的过程中,总是伴随着温度、压力、体积等物理性质的变化和热效应、光效应、电效应等物理现象的发生;反过来,物理性质的变化和物理效应对化学反应发生、进行和限度均可产生重要的影响。
科学发展的经验证明,深入探讨化学现象和物理现象之间的关系,是揭示化学变化规律的重要途径。
物理化学便是借助化学现象和物理现象之间的联系,利用物理学原理和数学手段研究化学现象基本规律的学科。
2. 物理化学的形成和发展俄国科学家罗蒙诺索夫(M. V. Lomomnocov,1771~1765)在十八世纪中叶首先使用了“物理化学”这个名词,但物理化学学科是在1804年道尔顿(J. Dalton, 1766~1844)提出原子论、1811年阿佛伽德罗(A. A vogadro,1776~1886)建立分子论、以及热力学第一定律、第二定律建立并应用于化学过程之后才得以形成。
一般认为,1887年德国科学家奥斯瓦尔德(W. Ostwald,1853~1932)和荷兰科学家范霍夫(J. H. van't Hoff, 1852~1911)创办《物理化学杂志》是物理化学成为一个学科的标志。
进入二十世纪后,随着现代物理学、数学、计算机科学的进展和现代测试方法的大量涌现,物理化学的各个领域均取得了突飞猛进的发展。
量子力学的创立和发展,使物理化学的研究由宏观进入微观领域;飞秒激光技术和交叉分子束技术的出现,使化学动力学的研究由静态扩展到动态;不可逆过程热力学理论、耗散结构理论、协同理论及突变理论的提出,使化学热力学的研究由平衡态转向非平衡态;低能离子散射、离子质谱、X-射线、紫外光电子能谱等技术的发展,促进了界面化学、催化科学的研究;而共振电离光谱、原子力显微镜和扫描隧道显微镜等技术的发展,促进了纳米材料和纳米结构的研究。

物理化学学科分类
物理化学是一门研究物质的物理和化学性质以及它们之间的关系的学科,具有广泛的应用和科学价值。
根据研究的重点和方法,物理化学可以分为以下几个学科:
1. 热力学:研究物质内部热能的变化和转化规律,包括热力学第一定律和第二定律等基本原理。
2. 动力学:研究物质内部化学反应的速率和机理,包括反应速率常数、反应机理和反应动力学等内容。
3. 量子化学:运用量子力学原理研究分子和原子的结构、能量、振动和光谱等性质,有助于解释化学反应的基本机制。
4. 分子热力学:研究分子之间的相互作用和热力学性质,包括物质的热力学性质、相变和溶解等问题。
5. 电化学:研究电荷和电流对物质性质的影响和作用,包括电解质溶液、电化学反应和电化学能等内容。
6. 物理化学测量:利用仪器和技术手段研究物质的物理化学性质和反应机理,包括光谱学、色谱分析、质谱学等。
以上这些学科相互交织、互为依赖,构成了物理化学这一学科体系,为我们认识物质的本质、掌握物质的变化规律、开发新材料和新技术提供了重要的理论基础和实验支持。
- 1 -。

热力学第一定律1、热力学第一定律:△U=Q+W2、体积功:(1)气体向真空膨胀:W=0(2)气体恒外压膨胀:W=—P外*△V(3)外压比内压差无限小膨胀:W=—∫p*dV 若气体为理想气体时,W=—nRTln(p1/p2)=—nRTln(v2/v1)(4)可逆相变的体积功:W=—nRT3、定容及定压下的热:(焓)△H=△U+△(PV)4、定压下:Q=△H=nCp,m*△T定容下:Q=△U=nCv,m*△T (Cp,m=Cv,m+R)5、理想气体的绝热过程:pV^γ=常数(γ=Cp,m/Cv,m)6、实际气体的节流膨胀(等焓膨胀)△H=07、定容与定压反应热:△H=△U+RT△n (Qp=Qv+RT△n)8、反应进度ζ:ζ=(n2-n1)/v9、任意一反应的反应焓等于产物生成焓之和减去反应物生成焓之和任意一反应的反应焓等于反应物燃烧焓之和减去产物燃烧焓之和10、反应焓与温度的关系(基尔霍夫方程):△H2-△H1=△Cp(T2-T1)热力学第二定律1、克劳休斯不等式:△S>=Q/T2、卡诺热机的效率:η=(T2-T1)/T23、定温过程的熵变:△S=nRln(p1/p2)4、定压熵变:△S=nCp,m*ln(T2/T1)5、定容熵变:△S=nCv,m*ln(T2/T1)6、绝热可逆过程为等熵过程(△S=0)7、定温定容系统:亥姆霍兹函数A=U—TS8、定温定压系统:吉布斯函数G=H—TS=A+pV (可逆相变:△G=0)9、热力学函数之间的关系:dU=TdS-p*dVdH=TdS+VdpdA=-SdT-p*dVdG=-SdT+Vdp10、吉布斯-亥姆霍兹公式:(△G/T2)-(△G/T1)=△H(1/T2-1/T1)。

什么是物理化学
物理化学是一门研究物理和化学之间相互关系的学科,它涉及到物质的性质、结构、状态以及能量等方面的研究。
物理化学在很大程度上依赖于实验,通过实验手段来探索和验证物理化学规律。
物理化学的发展可以追溯到19世纪初,当时科学家们开始注意到化学反应过程中的一些物理现象,如热量、电能等。
随着科学技术的不断进步,物理化学得到了迅猛发展,研究领域也逐渐拓展。
物理化学的主要研究内容包括:
1.物质的结构与性质:研究物质的组成、构造、性质以及它们之间的相互关系。
这包括原子、分子和晶体等的基本结构,以及物质在不同条件下的性质表现。
2.化学反应:研究化学反应的机理、动力学、热力学等方面。
这有助于揭示反应过程中物质的转化规律,以及能量的转换和传递。
3.能量与物质转化:研究物质在不同形式间的能量转换,如化学能、热能、电能等。
这涉及到能量守恒定律的应用,以及能量高效利用的技术创新。
4.材料科学:研究材料的制备、性能、应用及其与物理、化学原理的联系。
这包括新型材料的研发,以及材料在工程、生物、能源等领域的应用。
5.环境与催化:研究环境污染的成因、监测、治理技术,以及催化剂的作用原理和应用。
这有助于解决当今社会面临的环境问题,以
及提高化学工业的绿色化水平。
物理化学在科学技术的发展中发挥着重要作用,为人类社会的进步提供了有力支持。
通过研究物理化学原理,我们可以更好地理解和利用自然界中的物质和能量,为人类的可持续发展创造条件。

物理化学主要公式及使用条件1.气体混合物(1) 组成摩尔分数 y B (或x B ) = ∑AA B /n n体积分数/y B m,B B *=V ϕ∑*AVy Am,A式中∑AA n 为混合气体总的物质的量。
Am,*V 表示在一定T ,p 下纯气体A 的摩尔体积。
∑*AAm,A Vy 为在一定T ,p 下混合之前各纯组分体积的总和。
(2) 摩尔质量∑∑∑===BBBB B BB mix //n M n m M y M式中 ∑=BB m m 为混合气体的总质量,∑=BB n n 为混合气体总的物质的量。
上述各式适用于任意的气体混合物。
(3) V V p p n n y ///B B B B*=== 式中p B 为气体B ,在混合的T ,V 条件下,单独存在时所产生的压力,称为B 的分压力。
*BV 为B 气体在混合气体的T ,p 下,单独存在时所占的体积。
2.道尔顿定律 p B = y B p ,∑=BB p p上式适用于任意气体。
对于理想气体 V RT n p /B B =第二章 热力学第一定律1. 热力学第一定律的数学表示式W Q U +=∆或 'amb δδδd δdU Q W Q p V W =+=-+ 规定系统吸热为正,放热为负。
系统得功为正,对环境作功为负。
式中 p amb 为环境的压力,W ’为非体积功。
上式适用于封闭体系的一切过程。
2. 焓的定义式3. 焓变(1) )(pV U H ∆+∆=∆式中)(pV ∆为pV 乘积的增量,只有在恒压下)()(12V V p pV -=∆在数值上等于体积功。
(2) 2,m 1d p H nC T ∆=⎰此式适用于理想气体单纯pVT 变化的一切过程,或真实气体的恒压变温过程,或纯的液体、固体物质压力变化不大的变温过程。
4. 热力学能(又称内能)变此式适用于理想气体单纯pVT 变化的一切过程。
(有相变或化学变化时,T 不变,但理想气体的热力学能改变值不为0)5. 恒容热和恒压热V Q U =∆p Q H =∆ (d 0,'0)p W ==6. 热容的定义式 (1)定压热容和定容热容δ/d (/)p p p C Q T H T ==∂∂δ/d (/)V V V C Q T U T ==∂∂(2)摩尔定压热容和摩尔定容热容,m m /(/)p p p C C n H T ==∂∂ ,m m /(/)V V V C C n U T ==∂∂pVU H +=2,m 1d V U nC T∆=⎰上式分别适用于无相变变化、无化学变化、非体积功为零的恒压或恒容过程。



第一章 气体的pVT 关系1-1物质的体膨胀系数V α与等温压缩系数T κ的定义如下:1 1TT p V p V V T V V⎪⎪⎭⎫ ⎝⎛∂∂-=⎪⎭⎫⎝⎛∂∂=κα 试导出理想气体的V α、T κ与压力、温度的关系? 解:对于理想气体,pV=nRT111 )/(11-=⋅=⋅=⎪⎭⎫⎝⎛∂∂=⎪⎭⎫ ⎝⎛∂∂=T TVV p nR V T p nRT V T V V p p V α 1211 )/(11-=⋅=⋅=⎪⎪⎭⎫ ⎝⎛∂∂-=⎪⎪⎭⎫ ⎝⎛∂∂-=p p VV pnRT V p p nRT V p V V T T T κ 1-2 气柜内有121.6kPa 、27℃的氯乙烯(C 2H 3Cl )气体300m 3,若以每小时90kg 的流量输往使用车间,试问贮存的气体能用多少小时?解:设氯乙烯为理想气体,气柜内氯乙烯的物质的量为mol RT pV n 623.1461815.300314.8300106.1213=⨯⨯⨯== 每小时90kg 的流量折合p摩尔数为 133153.144145.621090109032-⋅=⨯=⨯=h mol M v Cl H Cn/v=(14618.623÷1441.153)=10.144小时1-3 0℃、101.325kPa 的条件常称为气体的标准状况。
试求甲烷在标准状况下的密度。
解:33714.015.273314.81016101325444--⋅=⨯⨯⨯=⋅=⋅=m kg M RT p M V n CH CH CHρ 1-4 一抽成真空的球形容器,质量为25.0000g 。
充以4℃水之后,总质量为125.0000g 。
若改用充以25℃、13.33kPa 的某碳氢化合物气体,则总质量为25.0163g 。
试估算该气体的摩尔质量。
解:先求容器的容积33)(0000.10010000.100000.250000.1252cm cm V l O H ==-=ρn=m/M=pV/RTmol g pV RTm M ⋅=⨯-⨯⨯==-31.301013330)0000.250163.25(15.298314.841-5 两个体积均为V 的玻璃球泡之间用细管连接,泡内密封着标准状况条件下的空气。
若将其中一个球加热到100℃,另一个球则维持0℃,忽略连接管中气体体积,试求该容器内空气的压力。
解:方法一:在题目所给出的条件下,气体的量不变。
并且设玻璃泡的体积不随温度而变化,则始态为)/(2,2,1i i i i RT V p n n n =+=终态(f )时 ⎪⎪⎭⎫⎝⎛+=⎪⎪⎭⎫ ⎝⎛+=+=f f ff f f f f ffT T T T R Vp T V T V R p n n n ,2,1,1,2,2,1,2,1 kPaT T T T T p T T T T VR n p f f f f i i ff f f f 00.117)15.27315.373(15.27315.27315.373325.1012 2,2,1,2,1,2,1,2,1=+⨯⨯⨯=⎪⎪⎭⎫ ⎝⎛+=⎪⎪⎭⎫ ⎝⎛+=1-6 0℃时氯甲烷(CH 3Cl )气体的密度ρ随压力的变化如下。
试作ρ/p —p 图,用外推法求氯甲烷的相对分子质量。
P/kPa 101.325 67.550 50.663 33.775 25.331ρ/(g ·dm -3)2.3074 1.5263 1.1401 0.75713 0.56660解:将数据处理如下:P/kPa101.32567.55050.66333.775 25.331(ρ/p)/(g ·dm -3·kPa ) 0.022770.022600.022500.02242 0.02237作(ρ/p)对p 图0.02220.02230.02240.02250.02260.02270.02280.022920406080100120pρ/pρ/p线性 (ρ/p)当p →0时,(ρ/p)=0.02225,则氯甲烷的相对分子质量为()10529.5015.273314.802225.0/-→⋅=⨯⨯==mol g RT p M p ρ1-7 今有20℃的乙烷-丁烷混合气体,充入一抽真空的200 cm 3容器中,直至压力达101.325kPa ,测得容器中混合气体的质量为0.3879g 。
试求该混合气体中两种组分的摩尔分数及分压力。
解:设A 为乙烷,B 为丁烷。
molRT pV n 008315.015.293314.8102001013256=⨯⨯⨯==-B A B B A A y y mol g M y M y n m M 123.580694.30 867.46008315.03897.01+=⋅==+==- (1) 1=+B A y y (2)联立方程(1)与(2)求解得401.0,599.0==B By ykPap y p kPa p y p B B A A 69.60325.101599.063.40325.101401.0=⨯===⨯==1-8 如图所示一带隔板的容器中,两侧分别有同温同压的氢气与氮气,二者均克视为理想气体。
H 2 3dm 3 p TN 21dm 3 p T(1)保持容器内温度恒定时抽去隔板,且隔板本身的体积可忽略不计,试求两种气体混合后的压力。
(2)隔板抽去前后,H 2及N 2的摩尔体积是否相同?(3)隔板抽去后,混合气体中H 2及N 2的分压力之比以及它们的分体积各为若干? 解:(1)抽隔板前两侧压力均为p ,温度均为T 。
p dmRT n p dmRT n p N N H H ====33132222 (1)得:223N Hn n =而抽去隔板后,体积为4dm 3,温度为,所以压力为3331444)3(2222dm RT n dm RT n dm RTn n V nRT p N N N N ==+==(2)比较式(1)、(2),可见抽去隔板后两种气体混合后的压力仍为p 。
(2)抽隔板前,H 2的摩尔体积为p RT V H m /2,=,N 2的摩尔体积p RT V N m /2,=抽去隔板后22222222223n 3 /)3(/H ,,N N N N N N m N H m H n pRT n p RT n p RT n n p nRT V n V n V =+=+==+= 总所以有 p RT V Hm /2,=,p RT V N m /2,=可见,隔板抽去前后,H 2及N 2的摩尔体积相同。
(3)41 ,433322222==+=N N N N Hy n n n y p p y p p p y p N N H H 41;432222==== 所以有1:341:43:22==p p p p N H 33144134432222dm V y V dm V y V N N H H =⨯===⨯== 1-9 氯乙烯、氯化氢及乙烯构成的混合气体中,各组分的摩尔分数分别为0.89、0.09和0.02。
于恒定压力101.325kPa 条件下,用水吸收掉其中的氯化氢,所得混合气体中增加了分压力为2.670 kPa 的水蒸气。
试求洗涤后的混合气体中C 2H 3Cl 及C 2H 4的分压力。
解:洗涤后的总压为101.325kPa ,所以有kPa p p H C Cl H C 655.98670.2325.1014232=-=+(1)02.0/89.0///423242324232===H C Cl H C H C Cl H C H C Cl H C n n y y p p(2)联立式(1)与式(2)求解得kPa p kPa p H C Cl H C 168.2 ;49.964232==1-10 室温下一高压釜内有常压的空气。
为进行实验时确保安全,采用同样温度的纯氮进行置换,步骤如下向釜内通氮直到4倍于空气的压力,尔后将釜内混合气体排出直至恢复常压。
这种步骤共重复三次。
求釜内最后排气至年恢复常压时其中气体含氧的摩尔分数。
设空气中氧、氮摩尔分数之比为1∶4。
解: 高压釜内有常压的空气的压力为p 常,氧的分压为常p p O 2.02=每次通氮直到4倍于空气的压力,即总压为 p=4p 常,第一次置换后釜内氧气的摩尔分数及分压为常常常常p y p p p p p p y O O O O ⨯=⨯=====05.005.042.042.01,1,1,2222第二次置换后釜内氧气的摩尔分数及分压为常常常常p y p p p p p p y O O O O ⨯=⨯====405.0405.0405.02,2,1,2,2222所以第三次置换后釜内氧气的摩尔分数%313.000313.01605.04)4/05.0(2,3,22=====常常p p pp y O O 1-11 25℃时饱和了水蒸汽的乙炔气体(即该混合气体中水蒸汽分压力为同温度下水的饱和蒸气压)总压力为138.7kPa ,于恒定总压下泠却到10℃,使部分水蒸气凝结成水。
试求每摩尔干乙炔气在该泠却过程中凝结出水的物质的量。
已知25℃及10℃时水的饱和蒸气压分别为3.17kPa 和1.23kPa 。
解:p y p B B =,故有)/(///B B A B A B A B p p p n n y y p p -=== 所以,每摩尔干乙炔气含有水蒸气的物质的量为 进口处:)(02339.017.37.13817.3222222mol p p n n H C O H H C O H =-=⎪⎪⎭⎫⎝⎛=⎪⎪⎭⎫ ⎝⎛进进 出口处:)(008947.01237.138123222222mol p p n n H C O H H C O H =-=⎪⎪⎭⎫⎝⎛=⎪⎪⎭⎫⎝⎛出出 每摩尔干乙炔气在该泠却过程中凝结出的水的物质的量为 0.02339-0.008974=0.01444(mol )1-12 有某温度下的2dm 3湿空气,其压力为101.325kPa ,相对湿度为60%。
设空气中O 2和N 2的体积分数分别为0.21和0.79,求水蒸气、O 2和N 2的分体积。
已知该温度下水的饱和蒸气压为20.55kPa (相对湿度即该温度下水蒸气分压与水的饱和蒸气压之比)。
解:水蒸气分压=水的饱和蒸气压×0.60=20.55kPa ×0.60=12.33 kPa O 2分压=(101.325-12.33 )×0.21=18.69kPa N 2分压=(101.325-12.33 )×0.79=70.31kPa33688.02325.10169.18222dm V p p V y V O O O =⨯=== 33878.12325.10131.70222dm V pp V y V N N N =⨯=== 32434.02325.10133.12222dm V pp V y V O H O H O H =⨯=== 1-13 一密闭刚性容器中充满了空气,并有少量的水,当容器于300K 条件下达到平衡时,器内压力为101.325kPa 。