
第三章水文地球化学作用过程中
的反应动力学
在水文地球化学作用的研究中仅有化学平衡的概念是不够的,在许多情况下还需要有反应动力学的概念。本节介绍有关反应动力学的概念和原理,阐明为什么必须要考虑反应动力学,并讨论在什么情况下必须将化学平衡学和反应动力学两种概念结合起来考虑。加深对于水-岩体系中的平衡和动力学概念的了解,对提高我们对地下水的化学成分和同位素组成的理解是十分有益的。只有掌握这些知识才能更好地管理好水资源,更好地解决生产工作中的各种与地球化学有关的问题。
化学平衡的原理可以用来确定水文地球化学作用的方向、程度和边界条件,预测水溶液中某种化学成分的平衡浓度。而化学动力学的原理可以用来确定该水文地球化学反应达到平衡状态所需要的时间及其反应途径,反应所处位置,各反应途径所需的时间。只有当地下水在水-岩体系中所停留的时间大于水文地球化学作用达到平衡状态时所需要的时间,化学平衡的概念足以用来理解和确定该体系的水化学性质,例如,深层承压水盆地可归属这类体系。当水文地球化学作用达到平衡状态时所需要的时间,明显地长于地下水在水-岩体系中所停留的时间,则仅依靠反应平衡原理来研究地下水的化学性质是不够的,此时需同时应用化学平衡和反应动力学的原理,例如,地下水位很浅的体系就属于此类情况。由于生产和环境工作中的需要,人们注意到必须对地球化学中的反应动力学进行研究,八十年代以来开始做了大量工作。目前在运用化学平衡(包括吸附作用)来解释天然水的化学行为方面已相当有效,但对水-岩体系中的化学动力学的理解相对较为不足,目前在水文地球化学研究中仅应用了最为简单的反应动力学的概念。
第一节 化学动力学的某些基本概念
一、体系状态
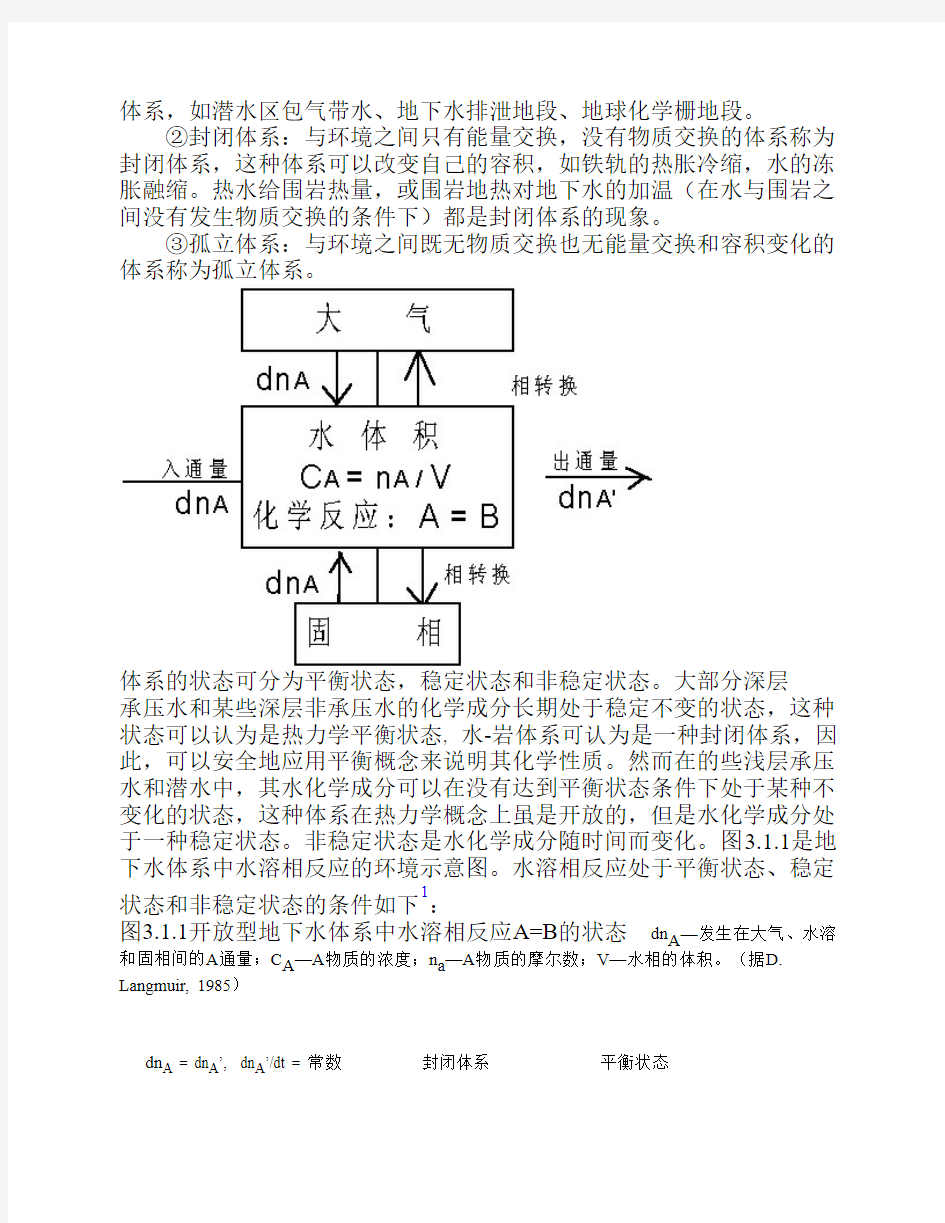
根据体系与环境的关系,热力学体系可分为三类:
①开放体系:与环境既有物质交换,又有能量交换的体系称为开放
体系,如潜水区包气带水、地下水排泄地段、地球化学栅地段。
②封闭体系:与环境之间只有能量交换,没有物质交换的体系称为封闭体系,这种体系可以改变自己的容积,如铁轨的热胀冷缩,水的冻胀融缩。热水给围岩热量,或围岩地热对地下水的加温(在水与围岩之间没有发生物质交换的条件下)都是封闭体系的现象。
③孤立体系:与环境之间既无物质交换也无能量交换和容积变化的体系称为孤立体系。
体系的状态可分为平衡状态,稳定状态和非稳定状态。大部分深层
承压水和某些深层非承压水的化学成分长期处于稳定不变的状态,这种状态可以认为是热力学平衡状态, 水-岩体系可认为是一种封闭体系,因此,可以安全地应用平衡概念来说明其化学性质。然而在的些浅层承压水和潜水中,其水化学成分可以在没有达到平衡状态条件下处于某种不变化的状态,这种体系在热力学概念上虽是开放的,但是水化学成分处于一种稳定状态。非稳定状态是水化学成分随时间而变化。图3.1.1是地下水体系中水溶相反应的环境示意图。水溶相反应处于平衡状态、稳定状态和非稳定状态的条件如下1:
图3.1.1开放型地下水体系中水溶相反应A=B的状态 dn A—发生在大气、水溶和固相间的A通量;C A—A物质的浓度;n a—A物质的摩尔数;V—水相的体积。(据D. Langmuir, 1985)
dn A = dn A’, dn A’/dt = 常数封闭体系平衡状态
dn A dn A’, dn A’/dt =常数开放体系稳定状态
dn A dn A’, dn A’/dt = 变量开放体系非稳定状态
二、反应半寿命和水的滞留时间
水的停留时间是指水进入体系至由该体系中出来所经历的那段时间。在开放的均一的体系中,水的停留时间的计算公式如下
T R= (3.1.1)
式中T R—水的滞留时间,V—混合均一的水的体积,r—水流的速率。假设一个简单的一阶反应,
A B (3.1.2)当达平衡状态时,
K AB= (3.1.3)式中k+,k- 是正向和逆向反应的速率常数。
反应的半寿命期是指反应进行到反应物的被消耗为其初始浓度一半所需要的时间。一阶反应的半寿命期的计算公式为,
T1/2= (3.1.4)式中T1/2—反应的半寿命期。假如B的初始浓度=0,则可写成:
(3.1.5)
当T R T1/2,式(3.1.5)便变成为平衡表达式,因而在这种条件下,平衡概念可被采用。与此相反,当T R≤T1/2,必须采用反应动力学概念方能对一个反应的状态作出解释。
大部分地下水的化学反应的半寿命期处于10-10~106秒,也有以年为计,或更长。所以,热力学和反应动力学对研究水-气体系的化学成分和同位素来说都是极需要的。
图3.1.2表示了不同水体的滞留时间和某些反应的反应速率(度)之间的关系。表3.1列出了某些反应的半寿命期的例子。
图3.1.2 水圈中某些水体的半反应期(T1/2)和滞留时间(T R) (据D. Langmuir,
1985)
表3.1.1 某些反应的例子和它们的近似反应半周期 (据D. Langmuir,
1985)
反应类型半反应近似值
1水合
H2O+CO2(aq)=H2CO3 K eq=[H2CO3]/[CO2]~1秒
2酸碱反应(包括离解反应)
H2CO3 = H+ HCO3 K eq = [H+][HCO-3]/[H2CO3]~IO-6sec.
HCO3- = H+ + CO2-3 K eq = [H+][CO2-3]10-6 sec.
3络合反应
Cu2+ + H2O = CuOH+ + H+~10-10 sec.
Fe(H2O)62+ = Fe(H2O)52+ + H2O~10-7 sec.
4聚合和水解
Al(OH)n3-n+(3-n)H2O → Al(OH)3+(3-n)H+数月
5放射性衰变
14C→14N+e-5,570年
6同位素交换
34SO2-
+H32S2—→H34S-+32SO2-4数月—数年
4
7气体溶解和逸出
CO2(g)=CO2(aq) K eq=[CO2]/P CO2T正向 数小时 8氧化还原 Fe2++1/4O2(g)+5/2H2O=Fe(OH)3+2H+ Keq = 数分—数小时 [H+]2 /[Fe2+][P O2]1/4 9吸附—解吸 Cd2++CaX = Ca2++CdX 数秒 10沉淀—溶解 Ca2++HCO- = CaCO3 + H+Keq = [H+] / [Ca2+] 大于数周 [HCO-3] 11矿物结晶(针铁矿) Fe(OH)3·nH2O(隐晶状)→α-FeOOH〗(针铁矿)+ 数年 (n+1)H2O 图3.1.2说明在雨水中很少反应能达到平衡状态,温度和压力仅在几秒中或更短的时间内处于不变状态。在雨水中可能处于平衡状态的只有某些溶质-溶质或溶质-水之间的反应,如酸-碱反应和离子化学反应。雨水与小颗粒之间的吸附反应可能处于平衡状态。吸附作用的T1/2线右边是虚线箭头,指示T1/2可达几天。这种时间较长的吸附作用是由于它包括有进入岩石碎屑中的扩散作用,所以扩散作用的T1/2控制了吸附平衡的实现。 地下水的滞留时间的主要范围从岩溶型碳酸盐和具高渗透性的浅层砾石层中的几天到深埋的承压水盆地中的几个百万年。显然可以设想大部分在深部沉积盆地地下水中的化学反应是处于平衡状态的。放射性衰变率(一般是不可逆的)的时间范围由不到1秒至数十亿年。同位素交换的速率的分布范围也相当宽广。 三、反应动力学概念 反应动力学在水-岩体系中的应用不如化学平衡原理应用得好,而且应用反应动力学原理并不那样容易,有些作用受矿物颗粒的表面特征,矿物表面上被吸附的痕量物质和有机物活动的影响很大(Berner 1978)。由于在实验室中配制的矿物颗粒的活性比天然状态强,所以实验室中矿物溶解的速率要快几个数量级;天然水中不溶的(Salution in hibit)微量物种(如磷酸盐)的吸附作用也是很快的,实验室中的氧化还原反应,例如Fe(Ⅱ)要比自然状态慢许多,因为自然界中有微生物的催化 作用。但是人们还是很关心解决水岩作用过程中的化学动力学问题。Claassen 1981,Paces 1983曾对地下水体系中矿物/沉淀/溶解的反应动力学原理进行过研究。以下对反应类型、速率定律、速率常数与温度的关系及绝对速率等问题予讨论。 1. 反应类型 在动力学中单元反应和全反应是有原则性差别的。反应物、生成物在分子水平上发生的反应称为单元反应,单元反应是不能再分解的反应。全反应则是由两个以上的单元反应组成的。例如, H++OH-= H2O CO2(aq)+OH-=HCO-3 H4SiO4=SiO2(石英)+2H2O 它们都是单元反应(elementary reactvon),单元反应的反应物和生成物可以是离子,分子,离子团或自由原子。 臭氧的分解是全反应, 2O33O2 k+1 k+2 它包括二个单元反应, O3O2+O及 O+O32O2 k-1 k-2 式中中间形式之一是自由氧原子(Lasaga 1981)。人们经常假定中间反应具有很灵活的过渡形式,在全过程中,它们形成和消失的速率很快变为相等。这对臭氧分裂也是正确的,对k-2< d(O)/dt = k+1(O3)-k-1(O2)(O)-k+2(O)(O3) = 0 稳定状态的假设可以帮助和求解氧原子的浓度,因而可以在下一步的速率公式计算将它排除(Lasaga 1981)。 另一个有关假定是当全反应(overall reaction)处于平衡状态时,则该全反应中的正向单元反应和逆向单元反应的速率必定相等,这一原则称为微观可逆性。 单元反应的途径可由反应式清楚地知道,但全反应的途径则不然。全反应的速率是由它的组成部分单元反应的速率所决定的,只有组成它的单元反应的速率知道后,全反应的速率才能被确定。单元反应的速度总是与其反应物的浓度成正比,而全反应的速度则不然,全反应的速度 一般是由决定性反应阶段的速率所控制的。 全反应有两种:串联反应和并联(平行)反应。对串联全反应(Sequential reaction),如 HCO-3+H+=H2O+CO2(aq) CO2(aq)=CO2(g) 第一个反应十分快,不到一秒钟就已完成,而第二个反应要慢几个数量级,所以后者是速率决定性的反应。 对平行反应来说,最快的反应是速率决定性反应。例如,黄铁矿被溶解氧的氧化相对较慢, FeS2(s)+7/2O2(aq)+H2O=Fe2++2SO2-4+2H+ 但被Fe3+离子的氧化速率相对快, FeS2(s)+14Fe3++8H2O=15Fe2++2SO2-4+16H+ 因此,第二个反应式是速率决定性的反应。由于速率决定于浓度,所以速率决定性反应可以随浓度的变化而变化。 又如,在酸性水中碳酸钙的溶解速率从属于pH值,但在高pH值介质中它的溶解速率从属于H2CO3的浓度。(Plummer 1979) 2. 速率定律: 对理想单元反应A=B,其正向反应A→B的速率R+= dA/dt = k+(A),逆反应B→A的速率R- = dB/dt = k-(B),则单元反应的速率在总体上为,正向速率 R+ = k+∏ (A i)n(A—反应物) (3.1.6) 逆向速率: R-=k-∏ (B i)n (B—生成物) (3.1.7) 当反应平衡时, k+/k-=∏ (A i)n eq=K eq, (A—反应物和生成物) (3.1.8) 单元反应速率的阶数是由参于反应的原子和分子的当量数所决定的,例如反应, A+2B=C 反应速率-dC/dt = k+(A)(B)2,所以该反应速率是三阶。 某些对地球化学有关的反应速率的经验公式列于表3.1.2 。表3.1.2总结了一些速率公式的积分和微分形式,零阶反应的半寿命公式 t1/2=0.5A0/k+ 一阶反应的半寿命公式为: t1/2=0.695A0/k+ 表3.1.2 某些简单阶数反应的速率公式及其积分形式(据: D. .Langmuir, 1985) 零阶反应: A0(aq)→A(g或s) -dA/dt = k-dA/dt = k+A = A0+k-t A = A0-k+t 一阶反应: A(aq)→B(aq) -dA/dt = k+A dA/dt = k+(A s-A) lnA = lnA0-k+t ln(A s-A) / (A s-A0) = -k+t 二阶反应: A+B→C (1/v A)(dA/dt) = k+A2 (V A= -1或 -2) -dA/dt = k+(A)(B) 1/A=1/A0-V A k+t ln[(A0)(B)/(B0)(A)] = (B0-A0)k+t 注:上标‘o’表示时间为零时的初始状态;下标‘s’表示反应达到平衡时的饱和状态 3. 速率常数从属于温度 速率常数与活化能有关。Arrhenuis根据实验测量的结果得出: k=Aexp(-E a/RT) (3.1.9) 式中A—称为A因子,A与T稍微有关,可以忽略T的影响。E a—活化能,它总是正值,这说明随T增高,反应速率也相应增高。 dlogk/dt = E a/2.30RT 著名的大姆指法则是在温度为25℃左右时,每(增高)10°C,速率翻倍与此相应在25°C时活化能为12kcal/mol。 对公式3.1.9取对数: lnk = lnA-E a/RT 或 logk = logA-E a/2.30RT (3.1.10)一般评估Ea的方法是作logK与1/T的座标图,图3.1.3,3.1.4是硅酸盐 岩和矿物的溶解—沉淀速率图和石英、隐晶SiO2的沉淀图2。 图3.1.4 石英和隐晶二氧化硅的logk对1/T图(据Rimstidt和Barnes, 1980) 活化能有益于理解矿物溶解和沉淀反应机理的实质,水扩散控制的反应活化能<5~6kcal/mol (Berner 1978,Rimstidt 1981),由表面反应控制的矿物溶解—沉淀作用的E a一般为10~20kcal/mol (Lasaga 1981)。矿物固体态扩散的E a在低温条件下为20~120kcal/mol,一般在20~ 80kcal/mol之间。Apps1983测得透辉石(obsidin)和玄武岩玻璃由扩散作用形成的蚀变作用具有E a≈22—130kcal/mol,物理吸附作用的E a=2— 6kcal/mol,但化学吸附的Ea一般都大20kcal/mol。Lasags 1981年指出,因断键或生成键所引起的表面反应而控制的矿物溶解和沉淀作用,可以预料它们的活化能与固相扩散作用相仿。吸附作用的活化能是如此低,故化学吸附—解析作用将比矿物的溶解和沉淀作用优先进行。换句话说,化学吸附热将降低表面作用控制的矿物作用所需要的E a。 图3.1.3 各种硅酸盐岩石和矿物的logk对1/T图(据D. Langmuir, 1985) 4. 绝对速率(过渡态)理论和活化的络合物 深入思考反应机理得出绝对速率理论的概念。这一理论基于二个假定: (1)在一个反应中的反应物与生成物之间存在着一个最大能量垒,而活化的络合物存在于这最高能量垒上(图3.1.5); (2)在反应物生成物和活化的络合物(C±)之间存在有一定的化学平衡状态,反应速率决定性阶段相应于活化的络合物的形成和瓦解, k+ A+BC±AB k R = (k B T/h)K±[A][B] k o’ = (k B T/h)K± 式中k B,h为Boltzman和Planck常数; k o’为经活度校正的绝对速率。k’是没有进行离子力校正的反应速率常数。 图3.1.5 在A+B=C±时,AB反应中被活化的络合物的自由能(据D. Langmuir, 1985) 应用活度系数计算公式可以预测离子力对二阶反应速率常数的影 响, (3.1.11) 简化或得, (3.1.12) 假如A、B其相同的价态符号,则k'随I增高而增高,图3.1.6表示,当I=6×10-3m时,包括二价离子A和B二价反应的速率,将是纯水中的两倍。 图3.1.6 在反应物A和B的不同价态的乘积时(即Z A×Z B), 离子力对二阶速率常数影响的预计(在I=0时,k’=k o’ 据D. Langmuir 1985) 第二节 SiO2沉淀作用的反应动力学计算实例 运用化学动力学原理解释水中高浓度超饱和SiO2含量在两年内没有发生沉淀的原因。水溶相化合物之间的反应速率是较快的,因此很容易达到平衡状态。水溶相与固相之间的反应(溶解和沉淀作用)和氧化-还原作用的反应速率较慢,有时甚至需要很长时间才能达到平衡状态。水中SiO2的沉淀作用便是个典型例子。 例如,有个水样中SiO2浓度达150mg/l,水样的pH=3。水中SiO2与结晶石英之间的平衡含量1.2mg/l,与隐晶质SiO2之间的平衡含量较高,为116mg/l,低于水中SiO2浓度,即该水中SiO2样浓度处于超饱和状态。但是水样中SiO2浓度在室温25℃条件下保持了两年没有发生变化。在分析测试等方面无差错的情况下,其原因只能从化学动力学方面予以探索。 SiO2溶于水的反应方程为: SiO2(am)+2H2O=H4SiO o4 logk+=-0.369-7.89×10-4T-3438/T logk-=0.707-2598/T 当t=25℃时,k+=10-12.14sec-1 , k-=10-9.42sec-1(Morey, Foutnier和Rowe's,1964)。 按Langmuir和Mahoney(1985)关于SiO2(an)的溶解”沉淀动力学计算公式: 式中:A-暴露于溶液中固相的相对表面积,m2; M-水的质量,kg。 假设A/M=1,则按上式可算得: ·L 假设A/M=100,则, 以上计算所得仅仅是SiO2的初始沉淀速度。Rimstidt和Barnes于1980年提出了计算SiO2沉淀时间的公式。 [H4SiO04]是时间等于t时的浓度,而[H4SiO04]0是时间为零时的浓度, 则 根据上式计算在温度=25℃时,[H4SiO04]浓度从150mg/L变化至 115mg/L所需要的时间。 当A/m=1时, t=1.28×1010 t=407yr 而当A/m=100时, t=1.28×108 t=4.07yr 以上计算可以用来解释为什么上述水样中SiO2的浓度保持了两年而没有发生明显的SiO2沉淀作用。 小 结 地球化学作用可以改变岩石的性质,也可使地下水的变得更有用或不适用。对化学平衡和动力学的理解可大大提高人们对地下水的化学成分和同位素成分的预测能力,因而更好地管理水资源。因此,水文地质工作者需要对地下水的地球化学有所了解。化学平衡决定了反应条件的边界,例如,某个存在形式的最高或最低浓度是多少?化学动力可用来决定一个反应需要多长时间才能达到平衡状态,及通过哪些反应途径达到平衡状态的。只有当反应速率快于地下水停留时间时,单一平衡原理才能有效,它对深层承压水的研究最有应用价值,当反应速率与地下水停留时间相当或小于它时,则需要同时应用平衡学和动力学两套原理,这对水位浅的水-岩体系特别重要,水化平衡概念(包括吸附),已成功地应用于假释地下水体系的许多化学现象,但对动力学的理解相对不足,目前只有简单的动力学概念在地下水研究中得以成功地应用。反应速率常数受温度和矿化度(离子力)的影响。 复习思考题 1. 为什么在水文地球化学中要研究反应动力学? 2. 在什么条件下必须采用反应动力学的原则? 3. 平衡状态与稳定状态有何不同? 4. 叙述各种天然水在体系中的滞留时间。 5. 利用图2和表1说明那些反应的速率较快,那些反应的速率慢。 6. 什么叫单元反应,什么是全反应? 7. 决定全反应的速率是那种单元反应? 8. 反应速率的阶数是根据什么确定的?14C→14N + e的反应阶数? 9. 写出零阶和一阶反应的浓度与时间的关系式。 10. 说明反应速率与温度的关系。回答为什么? 11. 说明反应速率与矿化度的关系。回答为什么? 12. 什么是绝对速率? 参考文献 描述 [←1] D. Langmuir,Aqueous Environmental Geochemistry, Prentice Hall Upper Saddle River, NJ07458, p.50~58 [←2] https://www.doczj.com/doc/ff14927980.html,ngmuir, J. Mahoney, Chemical Equilibrium and Kinetics of Geochemical Processes in Groind Water Studies, Practical Applications of Ground Water Geochemictry, Proc. First Canadian/American Conf. On Hydrogeology, 1985 第十章化学动力学基础(一) 返回上一页 1. 298 K时N2O5(g)分解反应半衰期t1/2为5.7 h,此值与N2O5的起始浓度无关,试求: (1) 该反应的速率常数. (2) 作用完成90%时所须的时间. 2. 某人工放射性元素放出α粒子,半衰期为15 min ,试问该试样有80%分解,需时若干? 3. 把一定量的PH3(g)迅速引入温度为950 K的已抽空的容器中,待反应物达到该温度时开始计时(此时已有部分分解),测得实验数据如下: t/s 0 58 108 ∞ P/kPa 35.00 36.34 36.68 36.85 已知反应 4pH3(g) P4(g) + 6H2(g) 为一级反应,求该反应的速率常数k值(设在t=∞时反应基本完成) 4. 在某化学反应中随时检测物质A的含量,1小时后,发现A已作用了75%,试问2小时后A还剩余多少没有作用?若该反应对A 来说是: (1) 一级反应. (2) 二级反应(设A与另一反应物B起始浓度相同) (3) 零级反应(求A作用完所用时间) 5. 在298 K时, NaOH与CH3COOCH3皂化作用的速率常数k2与NaOH与CH3COOC2H5皂化作用的速率常数k2' 的关系为k2=2.8k2' .试问在相同的实验条件下,当有90% CH3COOCH3被分解时, CH3COOC2H5的分解百分数为若干? 6. 对反应2NO(g) +2H2(g)---> N2(g) +2H2O(l) 进行了研究,起始时NO与H2的物质的量相等.采用不同的起始压力相应的有不同的半衰期,实验数据为: p0 /kPa 47.20 45.40 38.40 33.46 26.93 t1/2/min 81 102 140 180 224 求该反应级数为若干? 7. 反应A+B P的动力学实验数据如下, [A]0/(mol·dm-3) 1.0 2.0 3.0 1.0 1.0 [B]0/(mol·dm-3) 1.0 1.0 1.0 2.0 3.0 r0/(mol·dm-3·s-1) 0.15 0.30 0.45 0.15 0.15 若该反应的速率方程为 ,求x和y的值. 8. 碳的放射性同位素在自然界树木中的分布基本保持为总碳量的 1.10×%.某考古队在一山洞中发现一些古代木头燃烧的灰烬,经分析的含 量为总碳量的9.87×%,已知的半衰期为5700年,试计算这灰距今约有多少年? 9. 某抗菌素在人体血液中呈现简单级数的反应,如果给病人在上午8点注射一针抗菌素,然后在不同时刻t测定抗菌素在血液中的浓度c(以mg/100 cm3表示),得到以下数据 t/h 4 8 12 16 c /(mg/100 cm3) 0.480 0.326 0.222 0.151 (1) 确定反应的级数. (2) 求反应的速率常数k和半衰期t1/2. 第二章 反应动力学基础 一、填空题 1. 生成主产物的反应称为 主反应 ,其它的均为 副反应 。 2. 化学反应的总级数为n ,如用浓度表示的速率常数为C K ,用逸度表示的速率常数f K ,则C K =n f K 。 3. 化学反应的总级数为n ,如用浓度表示的速率常数为C K ,用气体摩尔分率表示的速率常数y K , 则C K = n p RT ???? ?? y K 。 4. 化学反应速率式为βαB A C A C C K r =-,用浓度表示的速率常数为C K ,假定符合理想气体状态方程,如用压力表示的速率常数P K ,则C K =____)()(βα+RT ___P K 。 5. 反应A + B → C ,已知115.0-=s k ,则反应级数n= 1 。 6. 反应3A → P ,已知s l mol k ?=/15.0,则反应级数n=___0____。 7. 活化能的大小直接反映了 反应速率 对温度的敏感程度。 8. 对于一非恒容均相化学反应B A B A αα?,反应组分A 的化学反应速率=-A r Vdt dn r A A -=- 。( V d t dn r A A -=-、 Vdt dn r B A -=-、dt dC r A A -=-、dt dC r B A -=-) 9. 气相反应A + B → 3P + S 进料时无惰性气体,A 与B 以1∶1摩尔比进料,则膨胀因子A δ=____2___。 10. 气相反应3A + B → P + S 进料时无惰性气体,A 与B 以2∶1摩尔比进料,则膨胀因子A δ=___-2/3____ 11. 在一间歇恒容反应器中进行如下平行反应12k k A P A S ??→??→,P 为目的产物,已知0A c 的单位为[]/mol L ,1k 的单位为1s -????,2k 的单位为[]/L mol s ?,活化能12E E >。则R A = )(221A A C k C k +- 。目的产物P 的瞬时选择性P S = 1212A A A k c k c k c + ,为了提高P S ,A c 要控制得较 低 ,T 要控制得较 高 。 化学反应速率和化学平衡综合练习 一、选择题(包括15个小题,每小题4分,共60分。每小题有只一个选项符合题意。) 1. 设反应C+CO 22CO(正反应吸热)反应速率为v1,N2+3H22NH3(正反应放热), 反应速率为v2。对于上述反应,当温度升高时,v1、v2的变化情况为 A. 同时增大 B. 同时减小 C. v1增大,v2减小 D. v1减小,v2增大 2. 在一密闭容器内发生氨分解反应:2NH 3N2+3H2。已知NH3起始浓度是2.6 mol·L-1, 4s末为1.0 mol·L-1,若用NH3的浓度变化来表示此反应的速率,则v(NH3)应为 A. 0.04 mol·L-1·s-1 B. 0.4 mol·L-1 ·s-1 C. 1.6 mol·L-1·s-1 D. 0.8 mol·L-1·s-1 3. 在温度不变的条件下,密闭容器中发生如下反应:2SO 2+O22SO3,下列叙述能够说 明反应已经达到平衡状态的是 A. 容器中SO2、O2、SO3共存 B. SO2与SO3的浓度相等 C. 容器中SO2、O2、SO3的物质的量之比为2∶1∶2 D. 反应容器中压强不随时间变化 4. 反应2A(g)2B(g)+E(g)(正反应为吸热反应)达到平衡时,要使正反应速率降低,A 的浓度增大,应采取的措施是 A. 加压 B. 减压 C. 减少E的浓度 D. 降温 5. 一定温度下,浓度均为1mol·L-1的A2和B2两种气体,在密闭容器内反应生成气体C, 反应达平衡后,测得:c(A2)=0.58 mol·L-1,c(B2)=0.16 mol·L-1,c(C)=0.84 mol·L -1,则该反应的正确表达式为 A. 2A 2+B22A2B B. A2+B22AB C. A 2+B2A2B2 D. A2+2B22AB2 6. 一定条件下的反应:PCl 5(g)PCl3(g)+Cl2(g)(正反应吸热)达到平衡后,下列情况 使PCl5分解率降低的是 A. 温度、体积不变,充入氩气 B. 体积不变,对体系加热 C. 温度、体积不变,充入氯气 D. 温度不变,增大容器体积 7. 在一定温度下,把2. 0体积的N2和6. 0体积的H2通入一个带活塞的体积可变的容器 中,活塞的一端与大气相通,容器中发生如下反应:N 2+3H22NH3。已知平衡时NH3的浓度是c mol·L-1,现按下列四种配比作为起始物质,分别充入上述容器,并保持温度不变,则达到平衡后,NH3的浓度不为 ..c mol·L-1的是 A. 1.0体积的N2和3.0体积的H2 B. 2.0体积的N2、6.0体积的H2和4.0体积的NH3 C. 4.0体积的NH3和1.0体积的H2 D. 2.0体积的NH3 8. 将 3 mol O2加入到V L的反应器中,在高温下放电,经t1 s建立了平衡体系: 3O 22O3,此时测知O2的转化率为30%,下列图象能正确表示气体的物质的量浓度(m) 化学动力学基础(习题课) 1. 某金属的同位素进行β放射,经14d(1d=1天后,同位素的活性降低6.85%。求此同位素的蜕变常数和半衰期;要分解 90.0%,需经多长时间? 解:设反应开始时物质的质量为100%,14d后剩余未分解者为100%-6.85%,则 代入半衰期公式得 一、是非题 下列各题中的叙述是否正确?正确的选“√”,错误的选“×”。 √× 1.反应速率系数k A与反应物A的浓度有关。 √× 2.反应级数不可能为负值。 √× 3.对二级反应来说,反应物转化同一百分数时,若反应物的初始浓度愈低,则所需时间愈短。 √× 4.对同一反应,活化能一定,则反应的起始温度愈低,反应的速率系数对温度的变化愈 敏感。 √× 5. Arrhenius活化能的定义是。 √× 6.若反应A?Y,对A为零级,则A的半衰期。 二、选择题 选择正确答案的编号: 某反应,A → Y,其速率系数k A=6.93min-1,则该反应物A的浓度从1.0mol×dm-3变到0.5 mol×dm-3所需时间是: (A)0.2min;(B)0.1min;(C)1min;(D)以上答案均不正确。 某反应,A → Y,如果反应物A的浓度减少一半,它的半衰期也缩短一半,则该反应的级数 为: (A)零级;(B)一级;(C)二级;(D)以上答案均不正确。 三、填空题 在以下各小题的“ 1.某化学反应经证明是一级反应,它的速率系数在298K时是k=( 2.303/3600)s-1,c0=1mol×dm-3。 (A)该反应初始速率u0为 (B)该反应的半衰期t1/2 (C)设反应进行了1h,在这一时刻反应速率u1为 2.只有一种反应物的二级反应的半衰期与反应的初始浓度的关系为 3.反应A → B+D中,反应物A初始浓度c A,0=1mol×dm-3,初速度u A,0=0.01mol×dm-3×s-1,假定该反 应为二级,则其速度常数k A为t1/2为。 4.某反应的速率系数k=4.62′10-2min-1,则反应的半衰期为 5.反应活化能E a=250kJ×mol-1,反应温度从300K升高到310K时,速率系数k增加 第七章化学反应动力学 一.基本要求 1.掌握化学动力学中的一些基本概念,如速率的定义、反应级数、速率系数、基元反应、质量作用定律和反应机理等。 2.掌握具有简单级数反应的共同特点,特别是一级反应和a = b的二级反应的特点。学会利用实验数据判断反应的级数,能熟练地利用速率方程计算速率系数和半衰期等。 3.了解温度对反应速率的影响,掌握Arrhenius经验式的4种表达形式,学会运用Arrhenius经验式计算反应的活化能。 4.掌握典型的对峙、平行、连续和链反应等复杂反应的特点,学会用合理的近似方法(速控步法、稳态近似和平衡假设),从反应机理推导速率方程。学会从表观速率系数获得表观活化能与基元反应活化能之间的关系。 5.了解碰撞理论和过渡态理论的基本内容,会利用两个理论来计算一些简单反应的速率系数,掌握活化能与阈能之间的关系。了解碰撞理论和过渡态理论的优缺点。 6.了解催化反应中的一些基本概念,了解酶催化反应的特点和催化剂之所以能改变反应速率的本质。 7.了解光化学反应的基本定律、光化学平衡与热化学平衡的区别,了解光敏剂、量子产率和化学发光等光化反应的一些基本概念。 二.把握学习要点的建议 化学动力学的基本原理与热力学不同,它没有以定律的形式出现,而是表现为一种经验规律,反应的速率方程要靠实验来测定。又由于测定的实验条件限制,同一个反应用不同的方法测定,可能会得到不同的速率方程,所以使得反应速率方程有许多不同的形式,使动力学的处理变得比较复杂。反应级数是用幂函数型的动力学方程的指数和来表示的。由于动力学方程既有幂函数型,又有非幂函数型,所以对于幂函数型的动力学方程,反应级数可能有整数(包括正数、负数和零)、分数(包括正分数和负分数)或小数之分。对于非幂函数型的动力学方程,就无法用简单的数字来表现其级数。对于初学者,要求能掌握具有简单级数的反应,主要是一级反应、a = b的二级反应和零级反应的动 化学动力学基础(一) 一、简答题 1.反应Pb(C 2H 5)4=Pb+4C 2H 5是否可能为基元反应?为什么? 2.某反应物消耗掉50%和75%时所需要的时间分别为t 1/2和 t 1/4,若反应对该反应物分别是一级、二级和三级,则t 1/2: t 1/4的比值分别是多少? 3.请总结零级反应、一级反应和二级反应各有哪些特征?平行反应、对峙反应和连续反应又有哪些特征? 4.从反应机理推导速率方程时通常有哪几种近似方法?各有什么适用条件? 5.某一反应进行完全所需时间时有限的,且等于k c 0(C 0为反应物起始浓度),则该反应是几级反应? 6. 质量作用定律对于总反应式为什么不一定正确? 7. 根据质量作用定律写出下列基元反应速率表达式: (1)A+B→2P (2)2A+B→2P (3)A+2B→P+2s (4)2Cl 2+M→Cl 2+M 8.典型复杂反应的动力学特征如何? 9.什么是链反应?有哪几种? 10.如何解释支链反应引起爆炸的高界限和低界限? 11.催化剂加速化学反应的原因是什么? 二、证明题 1、某环氧烷受热分解,反应机理如下: 稳定产物?→??+?+??→??++??→??? +??→?432134 33k k k k CH R CH R CH RH CO CH R H R RH 证明反应速率方程为()()RH kc dt CH dc =4 2、证明对理想气体系统的n 级简单反应,其速率常数()n c p RT k k -=1。 三、计算题 1、反应2222SO Cl SO +Cl →为一级气相反应,320℃时512.210s k --=?。问在320℃ 加热90min ,22SO Cl 的分解百分数为若干?[答案:11.20%] 2、某二级反应A+B C →初速度为133105---???s dm mol ,两反应物的初浓度皆为 32.0-?dm mol ,求k 。[答案:11325.1---??=s mol dm k ] 3、781K 时22H +I 2HI →,反应的速率常数3-1-1HI 80.2dm mol s k =??,求2H k 。[答 案:113min 1.41---??=mol dm k ] 4、双光气分解反应32ClCOOCCl (g)2COCl (g)→可以进行完全,将反应物置于密 闭恒容容器中,保持280℃,于不同时间测得总压p 如下: [答案: 1.1581a =≈;-14-12.112h 5.8710s k -==?] 5、有正逆反应均为一级反应的对峙反应: D-R 1R 2R 32L-R 1R 2R 3CBr 已知半衰期均为10min ,今从D-R 1R 2R 3CBr 的物质的量为1.0mol 开始,试计算10min 之后,可得L-R 1R 2R 3CBr 若干?[答案:0.375mol] 6、在某温度时,一级反应A →B ,反应速率为0.10mol ·dm -3·s -1时A 的转化率 为75%,已知A 的初始浓度为0.50mol ·dm -3,求(1)起始反应初速率;(2)速率常数。[答案:r 0=0.40s -1 ; k = 0.80 dm 3·mol -1·s -1 ] 7、在某温度时,对于反应A+B →P ,当反应物初始浓度为0.446和0.166mol ·dm -3 时,测 得反应的半衰期分别为4.80和12.90min ,求反应级数。[答案:2] 8、某二级反应,已知两种反应物初始浓度均为0.1mol ·dm -3,反应15min 后变 3.少量铁粉与100 mL 0.01 mol·L-1的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的( ) ①加H2O ②加NaOH固体③滴入几滴浓盐酸④加CH3COONa固体⑤加NaCl 溶液⑥滴入几滴硫酸铜溶液⑦升高温度(不考虑盐酸挥发)⑧改用10 mL 0.1 mol/L 盐酸 A.①⑥⑦B.③⑤⑧C.③⑦⑧D.⑤⑦⑧ 4.已知反应:A(g)+ 3B(g) 2C(g) + D(g),在某段时间内以A的浓度变化表示的化学 反应速率为1mol·L-1·min-1,,则此段时间内以C的浓度变化表示的化学反应速率为( ) A.0.5 mol·L-1·min-1B.1mol·L-1·min-1 C.3 mol·L-1·min-1D.2 mol·L-1·min-1 5.反应3A(g)+B(g) 2C(g)+2D(g),在不同情况下测得反应速率如下,其中反应速率最 快的是( ) A.v (D)=0.4 mol·L-1·s-1 B.v (C)=0.5 mol·L-1·s-1 C.v (C)=0.6 mol·L-1·s-1 D.v (A)=0.15 mol·L-1·s-1 6.一定温度下,可逆反应2NO 2NO+O2在体积固定的密闭容器中反应,达到平衡状 态标志是() ①单位时间内生成n mol O2 ,同时生成2n mol NO2 ②单位时间内生成n mol O2 ,同时生成2n mol NO ③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2 :2 :1 ④混合气体的压强不再改变⑤混合气体的颜色不再改变⑥混合气体的平均摩尔质量 不再改变 A.①④⑤⑥B.①②③⑤C.②③④⑥D.以上全部 7.把镁条投入到盛有盐酸的敞口容器中,产生H2的速率如右图所示, 在下列因素中,①盐酸的浓度,②镁条的表面积,③溶液的温度, ④氯离子的浓度,影响反应速率的因素是() A.①④B.③④C.①②③D.②③ 8.等温等压过程,在高温下不自发进行,而在低温时可自发进行的 条件是() A.△H<0 △S<0B.△H>0 △S<0C.△H<0 △S>0D.△H>0 △S>0 2.下列事实不能用勒夏特列原理解释的是〔〕 A.开启啤酒瓶后,瓶中马上泛起大量泡沫 B.由H2、I2(g)、HI组成的平衡体系,加压后颜色加深 C.滴加酚酞的氨水中加入氯化铵固体后红色变浅 D.工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率 9.NO和CO都是汽车尾气中的物质,它们能很缓慢地反应生成N2和CO2,对此反应有关的叙述不正确的是() 化学动力学的研究及其应用 1110712 胡景皓 摘要: 化学动力学研究的对象包括化学反应进行的条件(温度、压强、浓度、介质)对化学过程速率的影响,反应的历程(反应机理),物质的结构与化学反应能力之间的关系。 关键词:放射性测定,蜕变速率,半衰期,放射性同位素 1.化学动力学的研究领域 化学动力学作为物理化学学科的一个分支已有很久的历史,并概括为研究化学反应的机理与速率的科学。化学动力学的发展经历了从现象的观察到理论的分析,从宏观的测量到微观的探索,因而它又分为宏观化学动力学和微观反应动力学,后者又称分子反应动力学。1928年M. Polanyi研究Na_2+Cl_2反应的机理,相继建立了多维势能面来研究反应的进程,被誉为微观反应动力学诞生的里程碑。七十年代以来,分子束和激光技术的发展并在动力学研究中广泛应用,促使反应动力学的研究得到长足进步。1986年诺贝尔化等奖授予这个领域的三位著名化学家D. R. Herschbach,Y. T. Lee和J. C. Polanyi,标志着化学反应动力学的重要性,以及目前已经取得的进展和达到的水平。 2.化学动力学的研究方法 2.1.唯象动力学研究方法 也称经典化学动力学研究方法,它是从化学动力学的原始实验数据──浓度c与时间t的关系──出发,经过分析获得某些反应动力学参数──反应速率常 数k、活化能E a、指前因子A。用这些参数可以表征反应体系的速率特征,常用的关系式有: 式中r为反应速率;A、B、C、D为各物质的浓度;α、β、γ、δ称为相对于物质A、B、C、D的级数;R为气体常数;T为热力学温度。 化学动力学参数是探讨反应机理的有效数据。20世纪前半叶,大量的研究工作都是对这些参数的测定、理论分析以及利用参数来研究反应机理。但是,反应机理的确认主要依赖于检出和分析反应中间物的能力。20世纪后期,自由基链式反应动力学研究的普遍开展,给化学动力学带来两个发展趋向:一是对元反应动力学的广泛研究;二是迫切要求建立检测活性中间物的方法,这个要求和电子学、激光技术的发展促进了快速反应动力学的发展。对暂态活性中间物检测的时间分辨率已从50年代的毫秒级变为皮秒级。 2.1.1分子反应动力学研究方法 从微观的分子水平来看,一个元化学反应是具有一定量子态的反应物分子间的互相碰撞,进行原子重排,产生一定量子态的产物分子以至互相分离的单次反应碰撞行为。用过渡态理论解释,它是在反应体系的超势能面上一个代表体系的质点越过反应势垒的一次行为。原则上,如果能从量子化学理论计算出反应体系的正确的势能面,并应用力学定律计算具有代表性的点在其上的运动轨迹,就能计算反应速率和化学动力学的参数。 第二章化学反应速率练习题 一、填空题 1.某反应,当升高反应温度时,反应物的转化率减小,若只增加体系总压时,反应物的转化率提高,则此反应为热反应,且反应物分子数(大于、小于)产物分子数。 2.对于反应,其反应级数一定等于反应物计量系数,速度常数的单位由决定,若k的单位为L2·mol-2·S-1,则对应的反应级数为。 3.可逆反应A(g)+ B(g)?C(g)+Q达到平衡后,再给体系加热正反应速度,逆反应速度,平衡向方向移动。 4.在500K时,反应SO2(g)+1/2O2(g)?SO3(g)的K p = 50,在同一温度下,反应2SO3(g)?2SO2(g)+O2(g)的K p = 。 5.反应:HIO3+3H2SO3HI+3H2SO4,经实验证明,该反应分两步完成;(1)HIO3+H2SO3 HIO2+H2SO4(慢反应),(2) HIO2+2H2SO3 HI+2H2SO4(快反应),因此反应的速度方程式是。 6.在298K温度下,将1摩尔SO3放入1升的反应器内,当反应2SO3(g)?2SO2(g)+O2(g)达到平衡时,容器内有摩尔的SO2,其K C是,K p是。(R = kPa·L·K -1 ·mol-1)。 7.已知下列反应的平衡常数:H2(g)+S(s)?H2S(g),K c= × 10-3;S(s)+O2(g) ?SO2(g),K c = × 106;H2(g) + SO2(g) ?H2S(g) + O2(g)的平衡常数K c为。 8.简单反应A = B + C,反应速度方程为,反应级数为,若分别以A、B两种物质表示该反应的反应速度,则V A与V B 。 9.阿仑尼乌斯公式中e-Ea/RT的物理意义是。 10.催化剂能加快反应速度的原因是它改变了反应的,降低了反应的,从而使活化分子百分数增加。 二、判断题(正确的请在括号内打√,错误的打×) 11.某温度下2N2O5 = 4NO2 + O2该反应的速度和以各种物质表示的反应速度的关系为:V = 1/2V N2O5= 1/4V NO2= V O2 。() 12.化学反应平衡常数K值越大,其反应速度越快。() 13.因为平衡常数和反应的转化率都能表示化学反应进行的程度,所以平衡常数即是反应的转化率。() 14.在2SO2 + O2?2SO3的反应中,在一定温度和浓度的条件下,无论使用催化剂或不使用催化剂,只要反应达到平衡时,产物的浓度总是相同的。() 15.增加温度,使吸热反应的反应速度加快,放热反应的反应速度减慢,所以增加温度使平衡向吸热反应方向移动。() 16.化学平衡常数K c等于各分步反应平衡常数K c1,K c2……之和。() 17.催化剂可影响反应速度,但不影响热效应。() 18.化学反应平衡常数K值越大,其反应速度越快。() 19.在一定温度下反应的活化能愈大,反应速度亦愈大。() 20.催化剂将增加平衡时产物的浓度。() 21.一个气体反应的标准自由能变△GΘ298,是指反应物和产物都处于且混合气体的总压力为100kPa时反应的自由能变。() 22.体系由状态1→状态2的过程中,热(Q)和功(W)的数值随不同的途径而异。( ) 23.体系发生化学反应后,使产物温度回到反应前的温度时,体系与环境交换的热量称 5202 反应 2O 3→ 3O 2的速率方程为 - d[O 3]/d t = k [O 3]2[O 2]-1 , 或者 d[O 2]/d t = k '[O 3]2[O 2]-1,则速率常数 k 和 k ' 的关系是: ( ) (A) 2k = 3k ' (B) k = k ' (C) 3k = 2k ' (D) -k /2 = k '/3 5203 气相反应 A + 2B ─→ 2C ,A 和 B 的初始压力分别为 p A 和 p B ,反应开始时 并无 C ,若 p 为体系的总压力,当时间为 t 时,A 的分压为: ( ) (A) p A - p B (B) p - 2p A (C) p - p B (D) 2(p - p A ) - p B 5204 对于反应 2NO 2= 2NO + O 2,当选用不同的反应物和产物来表示反应速率时,其相互关系为:( ) (A) -2d[NO 2]/d t = 2d[NO]/d t = d[O 2]/d t (B) - d[NO 2]/2d t = d[NO]/2d t = d[O 2]/d t = d ξ /d t (C) - d[NO 2]/d t = d[NO]/d t = d[O 2]/d t (D) - d[NO 2]/2d t = d[NO]/2d t = d[O 2]/d t = 1/V d ξ /d t 5207 气相基元反应 2A k 1 B 在一恒容的容器中进行,p 0为 A 的初始压力, p t 为时间 t 时反应 体系总压,此反应速率方程 d p t / d t = 。 - k (2p t - p 0)2 5208 有一反应 mA → nB 是一简单反应,其动力学方程为 -d c A / d t = kc A m , c A 的单位为 mol ·dm -3, 时间单位为 s ,则: (1) k 的单位为 ___________ mol 1- m ·dm 3( m -1)·s -1 (2) 以d c B /d t 表达的反应速率方程和题中给的速率方程关系为 B A A A 1d 1d 'd d m m c c k c k c n t m t m =-== 5209 反应 2N 2O 5─→ 4NO 2+ O 2 在328 K 时,O 2(g)的生成速率为0.75×10-4 mol ·dm -3·s -1。 如其间任一中间物浓度极低, 难以测出, 则该反应的总包反应速率为 _______________mol ·dm -3·s -1, N 2O 5之消耗速率为__________ mol ·dm -3·s -1,NO 2之生成速率为_______________mol ·dm -3·s -1 。0.75×10-4, 1.50×10-4, 3.00×10-4 5210 O 3分解反应为 2O 3─→3O 2 ,在一定温度下, 2.0 dm 3容器中反应。实验测出O 3每秒消耗1.50×10-2 mol, 则反应速率为_______________mol ·dm -3·s -1氧的生成速率为_______________mol ·dm -3·s -1, d ξ /d t 为_______________ 0.75×10-2, 2.25×10-2, 1.50×10-2.。 5211 2A +B =2C 已知反应某一瞬间, r A =12.72 mol ·dm -3·h -1, 则 r B = , r C =_____________r B =6.36 mol ·dm -3·h -1, r C =12.72mol ·dm -3·h -1 5212分别用反应物和生成物表示反应A +3B =2C 的反应速率, 并写出它们间关系为: 。r A = 13r B =1 2 r C 5222 有关基元反应的描述在下列诸说法中哪一个是不正确的: ( ) (A) 基元反应的级数一定是整数 (B) 基元反应是“态-态”反应的统计平均结果 (C) 基元反应进行时无中间产物,一步完成 (D) 基元反应不一定符合质量作用定律 5223 400 K 时,某气相反应的速率常数k p = 10-3(kPa)-1·s -1,如速率常数用 k C 表示,则 k C 应为: (A) 3.326 (mol ·dm -3)-1·s -1 k C = k p (RT ) (B) 3.0×10-4 (mol ·dm -3)-1·s -1 (C) 3326 (mol ·dm -3)-1·s -1 (D) 3.0×10-7 (mol ·dm -3)-1·s -1 5224 如果反应 2A + B = 2D 的速率可表示为: 化学反应速率练习题 一、选择题(每小题只有1个正确答案) 1.在2L 密闭容器中,发生3A (气)+B (气)=2C (气)的反应,若最初加入A 和B 都是mol 4,A 的平均反应速率为)/(12.0s L mol ?,则10秒钟后容器中含的B 是( ) A .1.6mol B .mol 8.2 C .mol 2.3 D .mol 6.3 2.反应A (g )+3B (g ) 2C (g )+ 2D (g ),在四种不同情况下用不同物质表示的反应速率分别如下,其中反应速率最大的是( ) A .v (C )= 0.04 mol /(L·s ) B .v (B )= 0.06 mol /(L·min ) C .v (A )= 0.15 mol /(L·min ) D .v (D ) = 0.01 mol /(L·s ) 3.3 CaCO 与稀盐酸反应(放热反应)生成2CO 的量与反应时间的关系如下图所示.下列 结论不正确的是( ) A .反应开始2分钟内平均反应速率最大 B .反应4分钟后平均反应速率最小 C .反应开始4分钟内温度对反应速率的影响比浓度大 D .反应在第2min 到第4min 间生成2CO 的平均反应 速率最大 4.把mol 6.0气体X 和mol 4.0气体Y 混合于2L 容器中,发生反应:)()(3气气Y X + )(2)(气气W nZ +,5分钟末已生成molW 2.0,若测知以Z 浓度变化来表示的平 均速率为min)/(01.0?L mol ,则:上述反应在5分钟末时,已用去的Y 占原有量的物质的量分数是( ) A .20% B .25% C .33% D .50% 5.在一定条件下,将22B A 和两种气体通入密闭容器中,反应按22yB xA + C 2进行, 2秒钟后反应速率如下: )/(5.0) (2 s L mol v A ?=, )/(5.1)(2s L mol v B ?=,)/(1)(s L mol v C ?=,则x 、y 的值分别为( ) A .3和2 B .1和3 C .3和1 D .4和5 6.对于反应M + N P ,如果温度每升高C 10化学反应速率增大为原来的3倍。在 C 10时完成反应10%需81min ,则在C 30时完成反应10%所需的时间为( ) A .27min B .9min C .13.5min D .3min 7.反应4NH 3(气)+5O 2(气)= 4NO (气)+6H 2O (气)在10L 密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45r n ol ,则此反应的平均速率v (x )(反应物的消耗速率或产物的生成速率)可表示为( ) A .v (NH 3)=0.010mol/(L ·s ) B .v (O 2)=0.0010mol/(L ·s ) C .v (NO )=0.0010mol/(L ·s ) D .v (H 2O )=0.0045mol/(L ·s ) 化学反应动力学练习题 1 https://www.doczj.com/doc/ff14927980.html,work Information Technology Company.2020YEAR 2 化学反应动力学练习题 一、计算题 1.340K 时N 2O 5分解反应有如下实验数据 时间 0 60 120 180 240 c (N 2O 5)/mol ·L -1 求60s 内和120s 到240s 的平均速率。 2.某基元反应A(g)+2B(g) D(g)+E(g),某温度下,将一定量的A 和B 通入一定体积的容器中。(1)当A 和B 各消耗50%时反应速率为起始率的几倍(2)在恒温下,将容器的体积减少一半时反应速率是起始速率的多少倍 3.一定温度下反应CO(g)+Cl 2 (g) COCl 2 有下列实验数据 时间 初始速率/mol -1·ls -1 CO Cl 2 ×10-2 ×10-3 ×10-3 求(1)反应级数;(2)速率方程;(3)速率常数。 4.反应N 2O 52NO 2+2 1 O 2速率常数随温度变化的实验数据如下,求该 T/K 273 298 308 318 328 338 k/s -1 ×10-7 ×10-5 ×10-4 ×10-4 ×10-3 ×10-3 5.反应CO(CH 2COOH) 2 CH 3COCH 3+2CO 2,在283K 时速率常数k 为 × 10-3 mol ·L -1·min -3,在333K 时速率常数k 为·L -1·min -1。求303K 时 反应的速率常数。 6.密闭容器中进行的某基元反应A(g)+2B(g) 2C(g)当反应物的起始浓度分别为c A=·L-1,c B=·L-1时的反应速率为·L-1·s-1,若温度不变增大反应物浓度,使 c A=·L-1,c B=·L-1,此时反应速率多大为原来反应速率的多少倍 722 初始浓度/mol·L-1初始速率/mol·L-1·s- 1 c(NO)C(O2) 1 2 3×10-2×10-3×10-3 (1)写出该反应的速率方程式并指出反应级数;(2)计算速率常数;(3)当c(NO)=·L-1,c(O2)= mol·L-1时反应速率是多少 8.反应C2H6 → C2H4 + H2,开始阶段反应级数近似为3/2级,910 K时速率 常数为 dm3/2·。试计算C2H6 (g) 的压强为×104 Pa 时的起始分解速率υ0 9.295K时,反应 2 NO + Cl2 → 2 NOCl,反应物浓度与反应速率关系的数据如下: [NO]∕mol·dm-3[Cl2]∕mol·dm-3υ(Cl2)∕mol·dm-3· s- 1 ×10-3 ×10-1 ×10-2 (2)写出反应的速率方程。 (3)反应速率常数k(Cl2)为多少 3 首页→第七章化学反应速率 一、化学动力学简史与诺贝尔化学奖 1850威廉米(Ludwig Ferdinand Wilhelmy, 1812-1864, 德国物理学家) 研究在酸性条件下蔗糖分解(水解为D-(+)-果糖和D-(-)-果糖)的反应速率,发现反应速率正比于蔗糖和酸的浓度。 1864 古德博格(Cato Maximillian Guldberg, 1836-1902, 挪威数学家,理论化学家) 和瓦格(Peter Waage, 1833-1900,挪威化学家) 给出“质量作用定律”的公式。按照这个公式,反应“推动力”正比于反应物浓度的乘积:K=[R]r [S]s/([A]a [B]b) 其中,a, b, r, s分别为化学反应A+B = R+S的整比系数。因此,前向反应速率正比于[A]a[B]b,而后向反应速率整比于[R]r [S]s。 1865 Harcourt 和Esson (英) 分析了H2O2和HI、KMnO4和(COOH)2的反应。他们写出了相应的微分方程,通过积分得到浓度-时间关系。他们也提出了反应速率与温度的关系式k = A T C 1884 范特霍夫(Jacobus Henricus van’t Hoff, 1852-1911, 荷兰物理化学家。提出碳原子价键的空间结构学说;提出稀溶液理论。)的《化学动力学研究》(“Studies of Chemical Dynamics”,“études de dynamique chimique”)出版。在这本书中,van’t Hoff 推广和继续发展了Wilhelmy, Harcourt 和Esson 的工作。特别是,他引入了微分解析方法。他也分析了平衡常数以及正向、反向反应速度与温度的依赖关系。(平衡常数与温度的关系现在称为van’t Hoff 方程)。van’t Hoff由于对化学动力学和溶液渗透压 的首创性研究而荣获了1901年的首届诺贝尔化学 奖 1887 奥斯特瓦尔德(Wilhelm Ostwald, 1853-1932, 生于拉脱维亚的德国化学家,唯能论者。发现电解质解离的稀化定律。长期反对原子论,但终于公开认输。)在他的著作《Lehrbuch der allgemeinen Chemie》的引入“反应级数”和“半衰期”的概念。 1909年,Ostwald因研究催化和化学平衡、反应速率的基本原理而荣获诺贝尔化学奖,并被人们誉为“物理化学之父”。 1889 阿伦尼乌斯(Svante August Arrhenius, 1859-1927, 瑞典化学家,物理学家。建立电解质电离的理论。) 进一步分析了反应速率对温度的依赖关系,k=A exp(-B/T),并提出一个“能垒”解释;这个方程后来被称为Arrhenius 方程。1903年,Arrhenius因提出电离学说获得了第3届诺贝尔化学奖。 在20世纪,化学动力学理论有了显著的发展(从“第一原理”确定速率常数和反应级数)。但是,目前还不能预测实际化学过程的动力学参数。 实用文库汇编之研究生课程考试成绩单 (试卷封面) 任课教师签名: 日期: 注:1. 以论文或大作业为考核方式的课程必须填此表,综合考试可不填。 “简要评语”栏缺填无效。 2. 任课教师填写后与试卷一起送院系研究生秘书处。 3. 学位课总评成绩以百分制计分。 第一部分 1.简答题 (1)简述化学反应动力学与化学反应热力学、化学反应工程的关系。 答:化学反应动力学与化学反应热力学是综合研究化学反应规律的两个不可缺少的重要组成部分。由于二者各自的研究任务不同,研究的侧重而不同,因而化学反应动力学与化学反应热力学既有显著的区别又互有联系。 化学反应热力学特别是平衡态热力学是从静态的角度出发研究过程的始态和终态,利用状态函数探讨化学反应从始态到终态的可能性,即变化过程的方向和限度,而不涉及变化过程所经历的途径和中间步骤。所以,化学反应热力学不考虑时间因素,不能回答反应的速率历程。因此,即使一个反应在热力学上是有利的,但如果在动力学上是不利的,则此反应事实上是不能实现的。因此,要开发一个新的化学过程,不仅要从热力学确认它的可能性,还要从动力学方面研究其反应速率和反应机理,二者缺一不可。从研究程序来说,化学反应热力学研究是第一位的,热力学确认是不可能的反应,也就没有必要再进行动力学的研究。显然只有对热力学判定是可能的过程,才有进行动力学研究的必要条件。 (2)简述速控步、似稳态浓度法、似平衡浓度法的适用条件及其应用。 答:速控步:连续反应的总反应的速率决定于反应速率常数最小的反应步骤——最难进行的反应,称此为决定速率的步骤。此结论也适应于一系列连续进行的反应;而且要满足一个条件即反应必须进行了足够长的时间之后。 似稳态浓度法:是对于不稳定中间产物的浓度的一种近似处理方法,视之近似看作不随时间变化,不仅常用于连续反应,对于其他类似的反应只要中间物不稳定,也可适用。 似平衡浓度法:在一个包括有可逆反应的连续反应中,如果存在速控步,则可以认为其他各反应步骤的正向、逆向间的平衡关系可以继续保持而不受速控步影响,且总反应速率及表观速率常数仅取决于速控步及它以前的反应步骤,与速控步以后的各步反应无关。 对于综合反应进行简化处理的方法有:①对于平行反应,总反应速率由快步反应确定;②对于连续反应,总反应速率由慢步反应确定,一般把中间物质视为不稳定化合物,采用似稳态浓度法处理;③对于可逆反应,总反应速率即为净反应速率,由正、逆反应速率确定,在反应进行足够长时间后,假定反应达到平衡,采用似平衡法处理。 化学反应动力学 第二章习题 1、The first-order gas reaction SO 2Cl 2 → SO 2 + Cl 2 has k = 2.20 ? 10-5 s -1 at 593K, (1) What percent of a sample of SO 2Cl 2 would be decomposed by heating at 593K for 1 hour? (2) How long will it take for half the SO 2Cl 2 to decompose? 解:一级反应动力学方程为: t k e Cl SO Cl SO ?-?=ο][][2222 ? t k e Cl SO Cl SO ?-=ο ][] [2222 (1) 反应达1小时时:60 601020.222225][][???--=e Cl SO Cl SO ο =0.924=92.4% 已分解的百分数为:100%-92.4%=7.6% (2) 当 21][][2222=οCl SO Cl SO 时,7.315062 1 ln 1=-=k t s 5 21102.2693 .0-?= t = 31500 s = 8.75 hour 2、T-butyl bromide is converted into t-butyl alcohol in a solvent containing 90 percent acetone and 10 percent water. The reaction is given by (CH 3)3CBr + H 2O → (CH 3)3COH + HBr The following table gives the data for the concentration of t-utyl bromide versus time: T(min) 0 9 18 24 40 54 72 105 (CH 3)CBr (mol/L) 0.1056 0.0961 0.0856 0.0767 0.0645 0.0536 0.0432 0.0270 (1) What is the order of the reaction? (2) What is the rate constant of the reaction? (3) What is the half-life of the reaction? 解: (1) 设反应级数为 n ,则 n A k dt A d ][] [=- ? kt A A n n =---1 1][1][1ο 若 n=1,则 ] [][ln 1A A t k ο = t = 9 01047.00961.01056.0ln 91==k , t = 18 01167.00856.01056 .0ln 181==k t = 24 01332.00767.01056.0ln 241== k , t = 40 01232.00645 .01056.0ln 401==k t = 54 01256.0=k , t = 72 01241.0=k , t = 105 01299.0=k南京大学《物理化学》练习 第十章 化学动力学基础(一)
第二章 化学反应动力学基础(答案)
化学反应速率和化学平衡练习题(含详细答案)
化学反应动力学习题
第七章--化学反应动力学
第十一章 化学动力学基础(一)习题
化学反应速率测试题
化学动力学的研究与应用
化学反应速率练习题及答案
化学反应动力学基础(一)-学生
化学反应速率练习题
化学反应动力学练习题1
化学反应速率化学动力学简史与诺贝尔化学奖1850威廉
实用文库汇编之化学反应动力学考题及答案
化学反应动力学第二章习题答案