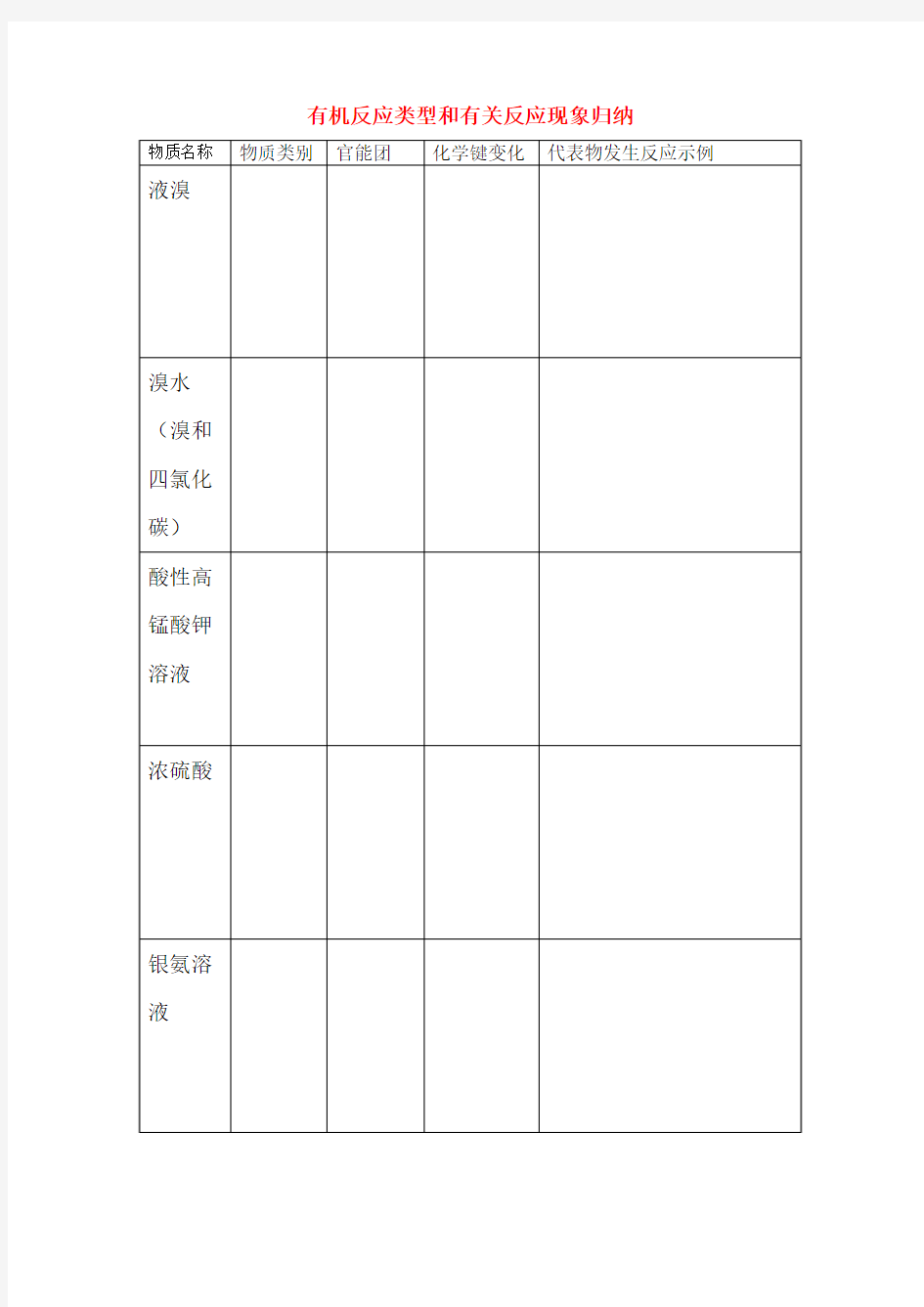
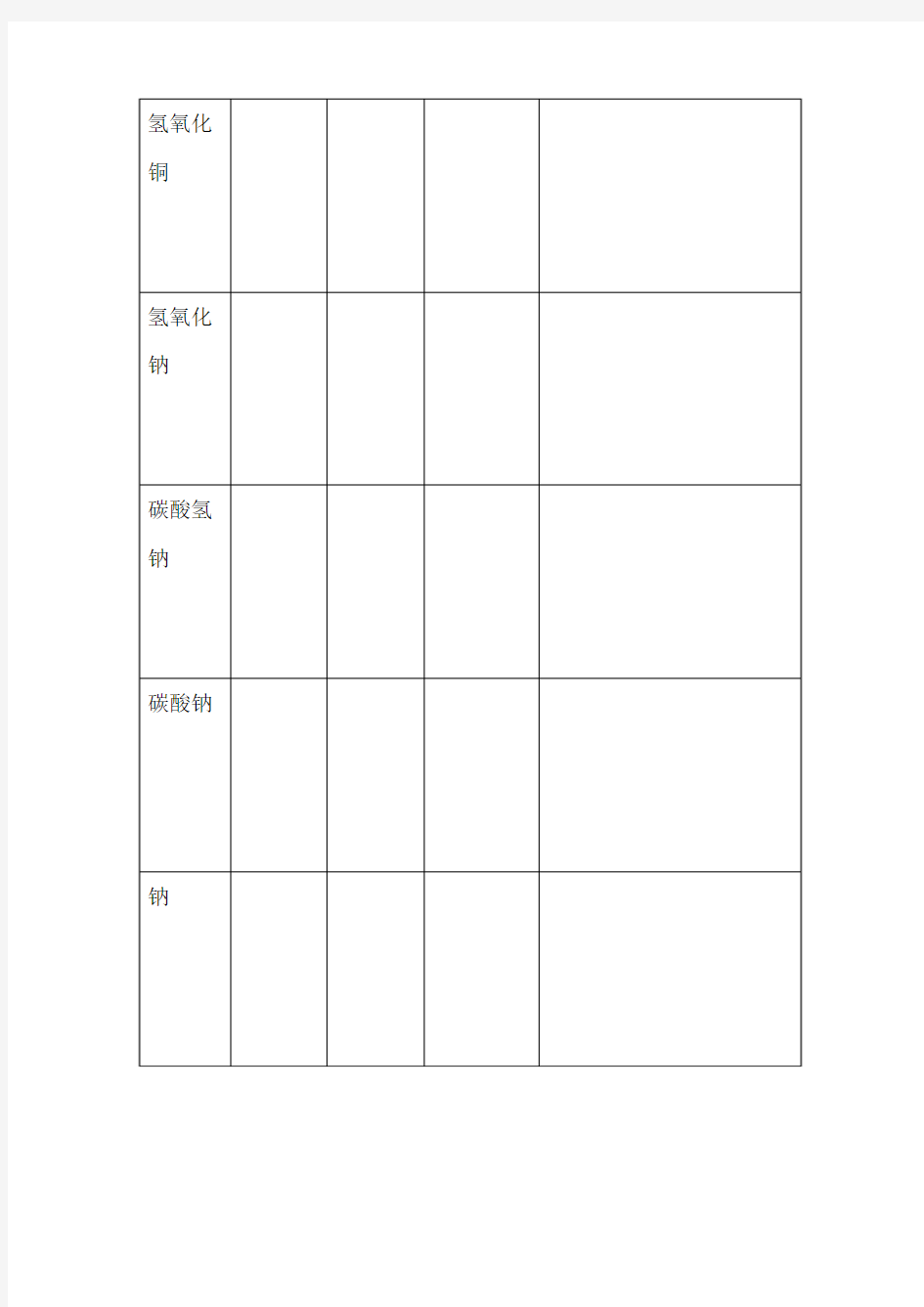
有机反应类型和有关反应现象归纳
常见有机反应类型总结 1.常见有机反应类型与有机物类型的关系 基本类型有机物类别 取代 反应 卤代反应饱和烃、苯和苯的同系物、卤代烃等 酯化反应醇、羧酸、糖类等 水解反应卤代烃、酯、低聚糖、多糖、蛋白质等 硝化反应苯和苯的同系物等 磺化反应苯和苯的同系物等 加成反应烯烃、炔烃、苯和苯的同系物、醛等 消去反应卤代烃、醇等 氧化 反应 燃烧绝大多数有机物 酸性KMnO4溶液烯烃、炔烃、苯的同系物等 直接(或催化)氧化酚、醇、醛、葡萄糖等 还原反应醛、葡萄糖等 聚合 反应 加聚反应烯烃、炔烃等 缩聚反应苯酚与甲醛、多元醇与多元羧酸等与浓硝酸的颜色反应蛋白质(含苯环的) 与FeCl3溶液的显色反应酚类物质 2.判断有机反应类型的常用方法 (1)根据官能团种类判断发生的反应类型。 (2)根据特定的反应条件判断反应类型。 (3)根据反应物和产物的结构不同判断反应类型。 1.化合物E是一种医药中间体,常用于制备抗凝血药,可以通过下图所示的路线合成:
(1)指出下列反应的反应类型。 反应1:______________; 反应2:________________; 反应3:______________; 反应4:________________。 (2)写出D 与足量NaOH 溶液反应的化学方程式:________________________________ ________________________________________________________________________。 答案 (1)氧化反应 取代反应 取代反应(或酯化反应) 取代反应 (2)+3NaOH ――→ △ +CH 3COONa +CH 3OH +H 2O 2.请观察下图中化合物A ~H 的转化反应的关系(图中副产物均未写出),并填写空白: 已知:①――→400 ℃ R —CH==CH 2+CH 3COOH ; ②―――――→ 稀NaOH 溶液 。 (1)写出图中化合物C 、G 、H 的结构简式: C______________________,G_____________________________, H______________________。 (2)属于取代反应的有________(填数字代号)。 (3)属于消去反应的是____________。 (4)写出⑨的化学方程式并指明其反应类型:________________________________,________________________________________________________________________。 答案 (1)C 6H 5CH==CH 2 C 6H 5C ≡CH (2)①③⑥⑧ (3)②④⑦ (4) +2H 2――→催化剂 加成反应
有机反应类型的总结 1、取代反应 (1)能发生取代反应的官能团有:醇羟基(-OH)、卤原子(-X)、羧基(-COOH)、酯基(-COO-)、肽键(-CONH-)等。 (2)能发生取代反应的有机物种类如下图所示: 2、加成反应 1.能发生加成反应的官能团:双键、三键、苯环、羰基(醛、酮)等。 2.加成反应有两个特点: ①反应发生在不饱和的键上,不饱和键中不稳定的共价键断裂,然后不饱和原子与其它原子或原 子团以共价键结合。 ②加成反应后生成物只有一种(不同于取代反应)。 说明: 1.羧基和酯基中的碳氧双键不能发生加成反应。 2.醛、酮的羰基只能与H2发生加成反应。 3.共轭二烯有两种不同的加成形式。 3、消去反应 (1)能发生消去反应的物质:醇、卤代烃;能发生消去反应的官能团有:醇羟基、卤素原子。(2)反应机理:相邻消去 发生消去反应,必须是与羟基或卤素原子直接相连的碳原子的邻位碳上必须有氢原子,否则不能发生消去反应。如CH3OH,没有邻位碳原子,不能发生消去反应。 4、聚合反应 (1)加聚反应: 烯烃加聚的基本规律: (2)缩聚反应: (1)二元羧酸和二元醇的缩聚,如合成聚酯纤维: (2)醇酸的酯化缩聚:
此类反应若单体为一种,则通式为: 若有两种或两种以上的单体,则通式为: (3)氨基与羧基的缩聚 (1)氨基酸的缩聚,如合成聚酰胺6: (2)二元羧酸和二元胺的缩聚: 5、氧化反应与还原反应 1.氧化反应就是有机物分子里“加氧”或“去氢”的反应。 能发生氧化反应的物质和官能团:烯(碳碳双键)、醇、酚、苯的同系物、含醛基的物质等。 烯(碳碳双键)、炔(碳碳叁键)、苯的同系物的氧化反应都主要指的是它们能够使酸性高锰 酸钾溶液褪色,被酸性高锰酸钾溶液所氧化。 含醛基的物质(包括醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖等)的氧化反应,指银镜反应及这些物质与新制氢氧化铜悬浊液的反应。要注意把握这类反应中官能团的变化及化学方程式的基本形式。 2.还原反应是有机物分子里“加氢”或“去氧”的反应,其中加氢反应又属加成反应。 还原反应具体有:与氢气的加成(如醛、酮)、硝基苯的还原。 6、酯化反应 (1)酯化反应的脱水方式:羧酸和醇的酯化反应的脱水方式是:“酸脱羟基醇脱氢”,羧酸分子中羧基上的羟基跟醇分子中羟基上的氢原子结合成水,其余部分结合成酯。这种反应的机理可 通过同位素原子示踪法进行测定。 (2)酚酯的形成不要求掌握,但在书写同分异构体的时候需要考虑酚酯;酚酯的水解也要求掌握。 (3)酯的种类有:小分子链状酯、环酯、聚酯、内酯、硝酸酯、酚酯。 7.水解反应 (1)能发生水解反应的物质:卤代烃、酯、油脂、二糖、多糖、蛋白质等 (2)从本质上看,水解反应属于取代反应。 (3)注意有机物的断键部位,如乙酸乙酯水解时是与羰基相连的C-O键断裂。(蛋白质水解,则是肽键断裂) 8、中和反应、裂化反应及其它反应 (1)醇、酚、酸分别与Na、NaOH、Na2CO3、NaHCO3的反应;显色反应等。 (3).显色反应主要掌握:FeCl3遇苯酚显紫色;浓硝酸遇含苯环的蛋白质显黄色(黄蛋白实验);碘水遇淀粉显蓝色。
初中化学反应类型归纳 一、分解反应 1、水在直流电的作用下分解 2、加热碱式碳酸铜 3、加热氯酸钾(有少量的二氧化锰) 4、加热高锰酸钾 5、碳酸不稳定而分解 6、高温煅烧石灰石 二、化合反应 (1)活泼金属+ 氧气 ------- 金属氧化物 1、镁与氧气 2、铁与氧气 3、铜与氧气 4、铝与氧气 (2)非金属单质+ 氧气 ------- 非金属氧化物 1、碳与氧气 2、硫与氧气 3、磷与氧气
(1)金属单质 +酸 -------- 盐+氢气(置换反应) 1、锌和稀硫酸 2、铁和稀硫酸 3、镁和稀硫酸 4、铝和稀硫酸 5、锌和稀盐酸 6、铁和稀盐酸 7、镁和稀盐酸 8、铝和稀盐酸 (2)金属单质 + 盐(溶液) ------- 另一种金属 + 另一种盐 1、铁和硫酸铜溶液反应 2、锌和硫酸铜溶液反应 3、铜和硝酸汞溶液反应 (3)非金属单质+ 金属氧化物=== 金属单质+ 非金属氧化物 1、氢气还原氧化铜 2、木炭还原氧化铜 3、焦炭还原氧化铁 4、焦炭还原四氧化三铁
(1)酸 + 碱 -------- 盐+ 水 1、盐酸和烧碱起反应 2、盐酸和氢氧化钾反应 3、盐酸和氢氧化铜反应 4、盐酸和氢氧化钙反应 5、盐酸和氢氧化铁反应 6、氢氧化铝药物治疗胃酸过多 7、硫酸和烧碱反应 8、硫酸和氢氧化钾反应 9、硫酸和氢氧化铜反应 10、硫酸和氢氧化铁反应 11、硝酸和烧碱反应 (2)酸 + 盐 -------- 另一种酸+ 另一种盐 1、石与稀盐酸反应 2、碳酸钠与稀盐酸反应 3、碳酸镁与稀盐酸反应 4、盐酸和硝酸银溶液反应 5、硫酸和碳酸钠反应 6、硫酸和氯化钡溶液反应
有机化学复习总结 有机化学复习总结 一.有机化合物的命名 1. 能够用系统命名法命名各种类型化合物: 包括烷烃,烯烃,炔烃,烯炔,脂环烃(单环脂环烃和多环置换脂环烃中的螺环烃和桥环烃),芳烃,醇,酚,醚,醛,酮,羧酸,羧酸衍生物(酰卤,酸酐,酯,酰胺),多官能团化合物(官能团优先顺序:-COOH >-SO3H >-COOR >-COX >-CN >-CHO >>C =O >-OH(醇)>-OH(酚)>-SH >-NH2>-OR >C =C >-C ≡C ->(-R >-X >-NO2),并能够判断出Z/E 构型和R/S 构型。 2. 根据化合物的系统命名,写出相应的结构式或立体结构式(伞形式,锯架式,纽曼投影式,Fischer 投影式)。 立体结构的表示方法: 1 )伞形式:COOH 3 2)锯架式:CH 3 OH H H OH 2H 5 3) 纽曼投影式: 4)菲舍尔投影式:COOH 3 OH H 5)构象(conformation) (1) 乙烷构象:最稳定构象是交叉式,最不稳定构象是重叠式。 (2) 正丁烷构象:最稳定构象是对位交叉式,最不稳定构象是全重叠式。 (3) 环己烷构象:最稳定构象是椅式构象。一取代环己烷最稳定构象是e 取代的椅 式构象。多取代环己烷最稳定构象是e 取代最多或大基团处于e 键上的椅式构象。 立体结构的标记方法 1. Z/E 标记法:在表示烯烃的构型时,如果在次序规则中两个优先的基团在同一 侧,为Z 构型,在相反侧,为E 构型。 CH 3C H C 2H 5 CH 3 C C H 2H 5 Cl (Z)-3-氯-2-戊烯(E)-3-氯-2-戊烯 2、 顺/反标记法:在标记烯烃和脂环烃的构型时,如果两个相同的基团在同一侧,则为顺式;在相反侧,则为反式。 CH 3C C H CH 3H CH 3C C H H CH 3顺-2-丁烯 反-2-丁烯3 3 3顺-1,4-二甲基环己烷反-1,4-二甲基环己烷 3、 R/S 标记法:在标记手性分子时,先把与手性碳相连的四个基团按次序规则排序。然后将最不优先的基团放在远离观察者,再以次观察其它三个基团,如果优先顺序
说明:“﹡”代表了解,“★”代表重中之重,反复记忆 一、化合反应: 1、镁带燃烧:2Mg+O2===2MgO 现象:发出耀眼的强光,放出大量的热,生成白色固体。 2、铁丝在氧气中燃烧:3Fe+2O2===Fe3O4 现象:在氧气中剧烈燃烧,火星四射;生成黑色固体 > 3、铝在空气中与氧气反应:4Al+3O2===2Al2O3 4、木炭燃烧: 氧气充足:C+O2===CO2 现象:⑴木炭在空气中燃烧发红热; ⑵在氧气中剧烈燃烧发出白光,生成无色气体使澄清石灰水变浑浊。 氧气不充足:2C+O2===2CO 5、硫燃烧:S+O2===SO2 现象:⑴在空气中燃烧发出微弱的淡蓝色火焰; ⑵在氧气中剧烈燃烧,发出明亮的蓝紫色火焰,生成一种有刺激性气味的气体。 6、红磷燃烧:4P+5O2===2P2O5 现象:在氧气中剧烈燃烧,生成大量白烟,发出黄色火焰。 ) 7、氢气燃烧:2H2+O2===2H2O 现象:纯净的氢气在空气中安静燃烧,发出淡蓝色火焰,生成无色液滴。 8、一氧化碳燃烧:2CO+O2===2CO2 现象:产生蓝色火焰,生成无色气体使澄清石灰水变浑浊。 9、二氧化碳与水反应:CO2+H2O===H2CO3 现象:二氧化碳使紫色石蕊试剂变为红色。 10.氧化钙和水反应:CaO+H2O===Ca(OH)2 放热 | (CaO可用作干燥剂) 二、分解反应: 11、电解水:2H2O===2H2↑+ O2↑ 现象:两极都产生气泡 正极产生的气体和负极产生的气体体积比为1 :2; 12、实验室制氧气的反应原理:★ ⑴加热氯酸钾和二氧化锰的混合物:2KClO3===2KCl+3O2↑ ⑵加热高锰酸钾:2KMnO4===K2MnO4+MnO2+O2↑ ⑶双氧水分解:2H2O2=== 2H2O +O2↑ 13、碳酸不稳定分解:H2CO3===H2O+CO2↑ 。 三、置换反应: 14、实验室制氢气的反应原理:Zn+H2SO4===ZnSO4+H2↑ 15、金属与酸生成氢气的反应:(条件:金属活动性顺序中氢之前的金属) Fe+H2SO4===FeSO4+H2↑Fe+2HCl===FeCl2+H2↑ 现象:产生气泡,金属逐渐减少,溶液由无色变为浅绿色 Mg+H2SO4===MgSO4+H2↑Mg+2HCl===MgCl2+H2↑ 现象:产生气泡,金属逐渐减少 》 ﹡16、氢气还原氧化铜:H2+CuO===Cu+H2O 现象:黑色固体变为红色,生成无色液滴。 17、碳还原氧化铜:C+2CuO===2Cu+CO2↑ 现象:黑色固体变为红色,生成无色气体使澄清石灰水变浑浊。18、碳还原氧化铁:2Fe2O3+3C=== 4Fe+3CO2↑ 点燃 点燃 点燃 ~ 点燃 点燃 点燃 Δ Δ Δ 高温 # 高温 通电 MnO2 点燃
初中化学方程式分类总结 (一)化合反应A+B→C 多变一木炭完全燃烧:C+O2 CO2 (还记得什么情况下生成CO2 )木炭不完全燃烧:2C+O22CO 什么情况下生成CO吗?硫在氧气或者空气中燃烧:S+O2 SO2铁在氧气中燃烧:3Fe +2O2 Fe3O4 (黑)磷在氧气中燃烧:4P+5O22P2O5 (白)铜在空气中加热:2Cu+O22CuO(黑)一氧化碳在空气中燃烧:2CO+O22CO2二氧化碳通过灼热的碳层:CO2 +C2CO二氧化碳与水反应:CO2 +H2O===H2CO3氧化钠溶于水:Na2O +H2O ===2NaOH氧化钾与水反应:K2O + H2O===2KOH生石灰和水化合:CaO+H2O ===Ca(OH)2三氧化硫溶于水:SO3+H2O ===H2SO4 【SO3是H2SO4的酸酐二氧化硫溶于水:SO2+H2O===H2SO3 注意S元素化合价未变哦】 氢气在氧气中燃烧:2H2 +O22H2O氢气在氯气中燃烧:H2 + Cl22HCl铁在氯气中燃烧:2Fe +3 Cl22FeCl3铁生锈4Fe +3O2 +2n H2O===2Fe2O3nH2O铜生锈2Cu + O2 + H2O + CO2 ===Cu2(OH)2CO3白色无水硫酸铜遇水变蓝:CuSO4+5H2O ===CuSO45H2O (蓝)铝在纯氧中燃烧4Al+3O22Al2O3 铝在空气耐腐蚀的原因:4Al +3O2 ===2Al2O3 (不用写条件)镁条可以与氮气反应:3Mg + N2 Mg3N2镁在空气中燃烧:2Mg+O22MgO (白)(二)分解反应:
C→A+B 一变多氯酸钾与二氧化锰共热实验室制O22KClO32KCl +3O2↑加热高锰酸钾制O2 :2KMnO4 K2MnO4+MnO2+O2↑(注意会画这三种制取氧气方法的实验装置图)MnO2催化分解双氧水制 O2 :2H2O22H2O +O2↑加热铜绿:Cu2(OH)2CO32CuO+H2O +CO2 ↑电解水:2H2O2H2 ↑+ O2↑碳酸不稳定分解:H2CO3===H2O+CO2↑高温煅烧石灰石:CaCO3 CaO+CO2 ↑硫酸铜晶体受热失水: CuSO45H2O CuSO4 +5H2O氢氧化铜受热分解:Cu(OH)2 CuO + H2O 加热分解氧化汞:2HgO2Hg + O2↑工业制铝:2Al2O32Al +3O2 ↑碳酸氢铵的分解 NH4HCO3 NH3 ↑ + H2O +CO2 ↑碳酸氢钙的分解Ca(HCO3)2 CaCO3 ↓ + CO2 ↑ + H2O (三)置换反应 A + BC → B + AC 单质和化合物反应生成 另一种单质和另一种化合物 B的位置被A替换了(注意定义和观察置换的位置)注意置换反应是两种反应物两种生产物,近几年来,在物质推断题中经常考察置换反应,基本的设置是两种反应物,两种生产物,反应物中有种是单质,生产物有种是单质,那 就是置换嘛。但涉及到置换反应的分类。 1、金属与液态物质的置换反应①活波金属与酸(溶液)实验室用锌和硫酸制H2:Zn+H2SO4 = ZnSO4+H2↑ (为什么用锌呢?)锌和稀盐酸的:Zn+2HCl=ZnCl2+H2↑(因为锌的速度适中 那为什么不用盐镁与稀硫酸:Mg + H2SO4 = MgSO4 + H2↑ 酸 呢?盐酸挥发出HCl气体)镁与稀盐酸:Mg + HCl== MgCl2+ H2↑铁和稀盐酸:Fe+2HCl=FeCl2+H2↑ (注意是+2价的铁)铁和
常见有机反应的十大类型 1. 取代反应 有机物分子里的某些原子或原子团被其他原子或原子团所代替的反应。(1)卤代: (2)硝化: (3)磺化: (4)卤代烃水解: (5)酯水解: (6)羟基()取代: (7)分子间脱水:
2. 加成反应 有机物分子中双键(或三键)两端的碳原子与其他原子或原子团直接结合生成新的化合物的反应。 (1)碳碳双键的加成: (2)碳碳三键的加成: (3)醛基的加成: (4)苯环的加成: 3. 加成聚合(加聚)反应 相对分子质量小的不饱和化合物聚合成相对分子质量大的高分子化合物的反应。 (1)丙烯加聚: (2)二烯烃加聚:
4. 缩合聚合(缩聚)反应 单体间相互反应而生成高分子化合物,同时还生成小分子(如水、氨、氯化氢等)的反应(又叫逐步聚合反应)。 (1)制酚醛树脂: (2)缩聚制酯: (3)氨基酸缩聚: 5. 消去反应 有机化合物在一定条件下,从一个分子中脱去一个小分子(如水、卤化氢等)而生成不饱和(含双键或三键)化合物的反应。 6. 氧化还原反应 在有机化学中,通常把有机物得氧或去氢的反应称为氧化反应;反之,加氢或去氧的反应称为还原反应。 (1)氧化反应:
(2)还原反应: 7. 酯化反应(亦是取代反应) 酸和醇起作用,生成酯和水的反应 8. 水解反应(亦是取代反应,其中卤代烃、酯的水解见取代反应部分) 化合物和水反应生成两种或多种物质的反应(有卤代烃、酯、酰胺、糖等)。 麦芽糖葡萄糖 9. 脱水反应(又叫碳化) 有机物分子脱去相当于水的组成的反应。
10. 裂化反应 在一定条件下,把相对分子质量大、沸点高的长链烃,断裂为相对分子质量小、沸点低的短链烃的反应。 (责任编辑:化学自习室)
有机化学十种反应类型详细小结 复习方法提示: 1、全面了解有机物所具有得反应类型有哪些?熟记相关名词,确保表达准确。 2、把握准每一类反应得概念,牢牢掌握反应中得结构变化特点。这就是分析判断得依据! 3、认识相似得同一种反应类型得“归属”关系,如取代反应可以包括什么?区分相近得不同反应类型在结构变化上得“差异”性及规律,如消去反应与氧化反应,加成反应与加聚反应等等。 以下概要回顾有机得五大反应,包括:取代反应、加成反应、消去反应、聚合反应(包括加聚反应与缩聚反应),以及氧化-还原反应。 一、取代反应 定义:有机物分子里得某些原子或原子团被其它原子或原子团所代替得反应称为取代反应。 在中学化学中,取代反应包括卤代、酯化、水解、硝化与磺化等很多具体得类型。分例如下: 1、与卤素单质得取代------发生该类反应得有机物包括:烷烃、烯烃、芳香烃、醇、酚等。例如: (1).(在适当得条件下,烷烃得取代反应就是可以逐步进行得,得到一系列得混合物)。 (2). (3).CH 2=C H-CH 3 + Cl 2CH 2=CH-CH 2-Cl + HCl (4). (5).+ 2HCl 2、与混酸得硝化反应(苯及其同系物、苯酚、烷烃等均能发生硝化反应)。如: (1). + HNO 2 -NO 2 + H 2O (2). (3). 环己烷对酸、碱比较稳定,与中等浓度得硝酸或混酸在低温下不发生反应,与稀硝酸在100℃以上得封管中发生硝化反应,生成硝基环己烷。在铂或钯催化下,350℃以上发生脱氢反应生成苯。环己烷与氧化铝、硫化钼、古、镍-铝一起于高温下发生异构化,生成甲基戌烷。与三氯化铝在温与条件下则异构化为甲基环戊烷。 低碳硝基烷得工业应用日益广泛。在使用原料上,以丙烷硝化来制取就是合理得途径。在工艺方面,国外较多得就是以硝酸为硝化剂得气相硝化工艺,已积累了较丰富得工业经验。有代表性得反应器则就是多室斯登该尔反应器。国内迄今有关硝基烷得生产与应用研究均进行得不多,这就是应该引起我们充分注意得。 (4).CH 3-CH 2-CH 3(气) + H NO 3(气) CH 3-CH2-CH 2-N O2 + H 2O 3、与硫酸得磺化反应(苯、苯得衍生物, 几乎均可磺化)。如: (1). (2). (邻、对位产物为主) 4、羧酸与醇得酯化反应 (1).羧酸与醇:CH 3COOH + CH 3CH 2OH CH 3C OOCH 2C H3 + H 2O + 浓硫酸 △ + 100℃ 浓硫酸 △ 光照
Cu/O △ 根据反应条件判断有机反应类型和有机物的类别 1.A B; 类型:氧化反应;类别:反应物A :伯醇(或仲醇);生成物:醛(或酮)和水。 辨析:如果B 还能与银氨溶液反应或与斐林试剂反应,说明B 一定是醛,而A 一定是 伯醇,否则,说明B 一定是酮,而A 一定是仲醇。 2CH 3CH 2OH + O 2??→?Cu 2CH 3CHO + 2H 2O ; CH 3CH 2OH + CuO ?→? ?CH 3CHO + H 2O 2.A B 类型:氧化反应;类别:反应物A :醛,生成物:羧酸和水。 CH 3CHO+2Cu(OH)2?→? ?CH 3COOH+Cu 2O ↓+2H 2O 3.A B 类型1:消去反应;类别:反应物:醇,生成物:烯烃和水。 CH 3CH 2OH CH 2=CH 2↑+H 2O 类型2:取代反应;类别:反应物:醇,主要生成物:醚和水。 2CH 3CH 2OH CH 3CH 2OCH 2CH 3+H 2O 类型3:酯化反应;类别:反应物:羟基羧酸,生成物:链酯、环酯、聚链酯和水。 HOCH(CH 3)COOH+HOCH(CH 3)COOH HOCH(CH 3)COOCH(CH 3) COOH+H 2O n HOCH(CH 3)COOH OCH(CH 3)CO n + n H 2O 说明:α―羟基羧酸反应生成六元环酯(分子间酯)或三元环酯(分子内酯);β―羟 基羧酸反应生成八元环酯(分子间酯)或四元环酯(分子内酯)。 4.A B 类型:消去反应;类别:反应物:卤代烃,生成物:烯烃、卤化钠和水。 CH 3CH 2Br+NaOH CH 2=CH 2↑+NaBr+H 2O 5.A B 类型1:取代反应(水解反应);反应物:卤代烃,生成物:醇和卤化钠。 特点:碳原子数没有减少。 CH 3CH 2Br+NaOH CH 3CH 2OH+NaBr 类型2:取代反应(水解反应);反应物:羧酸酯,生成物:醇和羧酸钠。 特点:碳原子数减少。 新制Cu(OH)2 △ 浓H 2SO 4 △ 浓H 2SO 4 170℃浓H 2SO 4 140℃ 浓H 2SO 4 △ 浓H 2SO 4 △ NaOH 、醇 △ 醇 △ NaOH 、水 △ 水 △
★取代反应 烷:CH4+Cl2→(光)CH3Cl+HCl 苯:苯+Br2→(Fe)苯-Br+HBr(液溴) 苯+HO-NO2→(浓H2SO4;△)苯-NO2+H2O(硝化反应) 甲苯:苯-CH3+3HO-NO2→(浓H2SO4;△)三硝基甲苯(TNT)+3H2O 苯-CH3+Cl2→(光)苯-CH2Cl+HCl 醇:2CH3CH2OH+2Na→2CH3CH2ONa+H2↑ 卤代烃:CH3CH2Br+NaOH→(△)CH3CH2OH+NaBr(水解反应) 另有酯化,硫化,水解等 ★加成反应 烯:CH2=CH2+Br2→CH2BrCH2Br CH2=CH2+H2O→(催化剂;△)CH3CH2OH CH2=CH2+H2→(Ni)CH3CH3 炔:CH≡CH+2Br2→CHBr2CHBr2 苯:苯+3H2→(Ni)C6H6(环已烷) 苯+3Cl2→C6H6Cl6(六六六) 醛:CH3CHO+H2→(Ni;△)CH3CH2OH(加氢还原) 另有加聚 ★消去反应 卤代烃:CH3CH2Br+NaOH→(醇;△)CH2=CH2↑+NaBr+N2O 醇:CH3CH2OH→(浓H2SO4;△)CH2=CH2↑+H2O (乙醇为170℃,其它醇不用记) ★水解反应(取代反应)
卤代烃:CH3CH2Br+H2O→(NaOH)CH3CH2OH+HBr 酯:CH3COOC2H5+H2O(可逆;稀H2SO4;△)CH3COOH+C2H5OH 另有多糖二糖蛋白质的水解 ★氧化反应 1 燃烧:CxHyOz+(x+y/4-z/2)O2→(点燃)xCO2+y/2H2O (有机物燃烧通式) 2 催化反应 醇:2CH3CH2OH+O2→(Cu;△)2CH3CHO+2H2O CH3CH2OH+CuO→(△)CH3CHO+H2O+Cu 醛:2CH3CHO+O2→(催化剂;△)2CH3CHO 烯:2CH2=CH2+O2→(催化剂)2CH3CHO 烷:2CH3CH2CH2CH3+5O2→(催化剂)4CH3COOH+2H2O 3 被酸性KMnO4氧化 烯炔苯的同系物(与苯环相连的C上要有H)醇醛 4 与新制Cu(OH)2反应 醛:CH3CHO+2Cu(OH)2→(△)CH3COOH+Cu2O↓+2H2O 5 银镜反应 (1)甲醛甲醛过量时:HCHO+2[Ag(NH3)2]OH→(△)HCOONH4+2Ag↓+3NH3+H2O 银氨溶液过量:HCHO+4[Ag(NH3)2]OH→(△)(NH4)2CO3+4Ag↓+6NH3↑+2H2O (2)乙醛 CH3CHO+2[Ag(nh3)2]OH→(△)CH3COONH4+2Ag↓+3NH3+H2O 另有HCOOR(甲酸盐甲酯某酯)葡萄糖麦芽糖果糖 ★还原反应 1 加H2加成:醛:CH3CHO+H2→(Ni;△)CH3CH2OH
1、卤代反应:有烃与卤素单质反应 如423CH Cl CH Cl HCl +?? →+光(烷烃:光照) 2Fe Br +?? →Br -HBr +(芳香烃:催化剂) 醇与氢卤酸反应 例:25252C H OH HBr C H Br H O +→+ 2、硝化反应: 如 3|CH 2433H SO HNO +????→浓2O N -2 NO -2| NO 3 | CH 23H O + 3、碘化反应: 如:()24H SO ?+??→浓3SO H -2H O + 4、有机物的水解(卤代烃水解和酯的水解) 例:25225C H Br H O C H OH HBr ?+?? →+ 3252325H CH COOC H H O CH COOH C H OH + ++垐垎噲垐 5、分子间脱水(酯化反应,醇分子间脱水) 例如:24 3253252H SO CH COOH C H OH CH COOC H H O ?+????→+浓 24025252521402H SO C C H OH C H OC H H O ????→+浓
1、不饱和烃与H 2、X 2、HX 、H 2O 等加成 如2332Ni CH CH H CH CH ? ≡+??→ 22222|| CH CH Br CH CH Br Br =+→- 2、芳香烃与X 2、H 2加成 例: 23Ni H ?+??→ 3、||O C --与H 2加成(包括醛、酮单糖与H 2加成) 如3232Ni CH CHO H CH CH OH ? +??→ 三、消去反应: 1、卤代烃消去:X 所连碳原子上连有H 原子的卤代烃才能消去(NaOH 醇溶液)。 如:322322CH CH CH X NaOH CH CH CH NaX H O ? -+??→=++醇 2、醇消去:羟基所连碳原子上的相邻碳原子上必须连有H 原子的醇才能消去(浓H 2SO 4,加热)。 如:2403232217033 ||| H SO C CH CH CH CH C CH H O CH CH OH --????→-=+浓 四、聚合反应: 1、加聚反应:不饱和有机物彼此加成而生成高分子化合物的反应。
有机化学反应类型总结 1、取代反应 定义:有机物分子里的某些原子或原子团被其它原子或原子团所代替的反应称为取代反应。 (1)能发生取代反应的官能团有:醇羟基(-OH)、卤原子(-X)、羧基(-COOH)、酯基(-COO-)、肽键(-CONH-)等。 (2)能发生取代反应的有机物种类如下图所示: 2、加成反应 定义:有机物分子里不饱和的碳原子跟其他原子或原子团直接结合,生成别的物质的反应,叫加成反应。分子结构中含有双键或三键的化合物,一般能与H2、X2(X为Cl、Br、I)、HX、H2O、HCN等小分子物质起加成反应。 1.能发生加成反应的官能团:双键、三键、苯环、羰基(醛、酮)等。 2.加成反应有两个特点: ①反应发生在不饱和的键上,不饱和键中不稳定的共价键断裂,然后不饱和原子与其它原子或原子团以共价键结合。 ②加成反应后生成物只有一种(不同于取代反应)。 说明: 1.羧基和酯基中的碳氧双键不能发生加成反应。 2.醛、酮的羰基只能与H2发生加成反应。 3.共轭二烯有两种不同的加成形式。 3、消去反应 定义:有机化合物在适当条件下,从一个分子相邻两个碳原子上脱去一个小分子(如H2O、HX等)而生成不饱和(双键或三键)化合物的反应称为消去反应。发生消去反应的化合物需具备以下两个条件: (1)是连有—OH(或—X)的碳原子有相邻的碳原子。 (2)是该相邻的碳原子上还必须连有H原子。
(1)能发生消去反应的物质:醇、卤代烃;能发生消去反应的官能团有:醇羟基、卤素原子。 (2)反应机理:相邻消去 发生消去反应,必须是与羟基或卤素原子直接相连的碳原子的邻位碳上必须有氢原子,否则不能发生消去反应。如CH3OH,没有邻位碳原子,不能发生消去反应。 4、聚合反应 定义:有许多单个分子互相结合生成高分子化合物的反应叫聚合反应。 聚合反应有两个基本类型:加聚反应和缩聚反应 (1)加聚反应: 由许多单个分子互相加成,又不缩掉其它小分子的聚合反应称为加成聚合反应。烯烃、二烯烃及含C=C的物质均能发生加聚反应。 烯烃加聚的基本规律: (2)缩聚反应: 单体间相互结合生成高分子化合物的同时,还生成小分子物质的聚合反应,称为缩合聚合反应。 酚和醛、氨基酸(形成多肽)、葡萄糖(形成多糖)、二元醇与二元酸、羟基羟酸等均能发生缩聚反应。 (1)二元羧酸和二元醇的缩聚,如合成聚酯纤维: (2)醇酸的酯化缩聚: (3)氨基与羧基的缩聚 (1)氨基酸的缩聚,如合成聚酰胺6: (2)二元羧酸和二元胺的缩聚: nHOOC-(CH2)4-COOH+nNH2(CH2)6NH2 =[CO(CH2)4CONH(CH2)6NH]n+2nH2O 5、氧化反应与还原反应 1.氧化反应就是有机物分子里“加氧”或“去氢”的反应。 能发生氧化反应的物质和官能团:烯(碳碳双键)、醇、酚、苯的同系物、含醛基的物质等。
初中化学反应类型的总结(三大块复习法) 一、四种基本反应类型 1、化合反应(A+B=AB) (1)、单质+氧气→氧化物 单质有:C、S、P、H2;Mg、Fe、Al、Cu、Hg (2)、某些氧化物+水→酸或碱 氧化物有:CO2、SO2、SO3、CaO (3)、其它化合反应 ①、H2+Cl2 ===2HCl ②、CO和CO2的转化: 点燃高温 2CO+O2 == 2CO2 CO2+C == 2CO 2、分解反应(AB==A+B) (1)、有氧气生成的分解反应 如:KclO3、KMnO4、H2O、H2O2、HgO (2)、有二氧化碳生成的分解反应 如:Cu2(OH)2CO3、CaCO3、H2CO3、NaHCO3、NH4HCO3 3、置换反应(A+BC ==B+AC) (1)、活泼金属+酸→盐+氢气 活泼金属指在金属活动性顺序里排在氢之前的金属,但钾、钠钙除外。 如:Zn+H2SO4 == ZnSO4+H2↑ Fe+2HCl == FeCl2+H2↑ (2)、金属+盐→新盐+新金属 Fe+CuSO4 ==Cu+FeSO4 Cu+2AgNO3 ==2Ag+Cu(NO3)2 (3)、H2(或C)+金属氧化物→金属+H2O(或CO2↑) H2+CuO == Cu+H2O 高温 C+CuO == Cu+CO2↑ 4、复分解反应(AB+CD == AD+CB) (1)、金属氧化物+酸→盐+水 Fe2O3+6HCl == 2FeCl3+3H2O CuO+H2SO4 == CuSO4+H2O (2)、酸与碱;酸与盐反应 酸+碱→盐+水 HCl+NaOH ==NaCl+H2O
Cu(OH)2+H2SO4 ==CuSO4+2H2O 酸+盐→新酸+新盐 HCl+AgNO3 ==AgCl↓+HNO3 H2SO4+BaCl2 ==BaSO4↓+2HCl 3、盐与碱;盐与盐反应 盐+碱→新盐+新碱 CuSO4+2NaOH == Cu(OH)2+Na2SO4 盐+盐→新盐+新盐 BaCl2+Na2SO4 ==BaSO4↓+2NaCl 二、不属于四种基本反应类型的化学反应 1、CO +金属氧化物→金属+ CO2 高温 CO + Cu == Cu + CO2 2、有机物+O2→ CO2+H2O 点燃 CH4 + O2 == CO2 + H2O 点燃 C2H5OH + O2 == CO2 + H2O 3、非金属氧化物+碱→盐+水 CO2+NaOH ==Na2CO3+H2O CO2+Ca(OH)2 ==CaCO3+H2O
有机化学复习总结 一.有机化合物的命名 1. 能够用系统命名法命名各种类型化合物: 包括烷烃,烯烃,炔烃,烯炔,脂环烃(单环脂环烃和多环置换脂环烃中的螺环烃和桥环烃),芳烃,醇,酚,醚,醛,酮,羧酸,羧酸衍生物(酰卤,酸酐,酯,酰胺),多官能团化合物(官能团优先顺序:-COOH >-SO3H >-COOR >-COX >-CN >-CHO >>C =O >-OH(醇)>-OH(酚)>-SH >-NH2>-OR >C =C >-C ≡C ->(-R >-X >-NO2),并能够判断出Z/E 构型和R/S 构型。 2. 根据化合物的系统命名,写出相应的结构式或立体结构式(伞形式,锯架式,纽曼投影式,Fischer 投影式)。 立体结构的表示方法: 1)伞形式:C COOH OH H 3C H 2)锯架式:CH 3 OH H H OH C 2H 5 3) 纽曼投影式: H H H H H H H H H H H H 4)菲舍尔投影式:COOH CH 3 OH H 5)构象(conformation) (1) 乙烷构象:最稳定构象是交叉式,最不稳定构象是重叠式。 (2) 正丁烷构象:最稳定构象是对位交叉式,最不稳定构象是全重叠式。 (3) 环己烷构象:最稳定构象是椅式构象。一取代环己烷最稳定构象是e 取代的椅 式构象。多取代环己烷最稳定构象是e 取代最多或大基团处于e 键上的椅式构象。 立体结构的标记方法 1. Z/E 标记法:在表示烯烃的构型时,如果在次序规则中两个优先的基团在同一 侧,为Z 构型,在相反侧,为E 构型。 CH 3 C C H Cl C 2H 5CH 3C C H C 2H 5Cl (Z)-3-氯-2-戊烯 (E)-3-氯-2-戊烯 2、 顺/反标记法:在标记烯烃和脂环烃的构型时,如果两个相同的基团在同一侧, 则为顺式;在相反侧,则为反式。 CH 3C C H CH 3H CH 3C C H H CH 3顺-2-丁烯 反-2-丁烯CH 3 H CH 3 H CH 3 H H CH 3顺-1,4-二甲基环己烷反-1,4-二甲基环己烷 3、 R/S 标记法:在标记手性分子时,先把与手性碳相连的四个基团按次序规则排序。然后将最不优先的基团放在远离观察者,再以次观察其它三个基团,如果优先顺序
有机化学10种反应类型 一、取代反应 定义:有机物分子里的某些原子或原子团被其它原子或原子团所代替的反应称为取代反应。在中学化学中,取代反应包括卤代、酯化、水解、硝化和磺化等很多具体的类型。 分例如下: 1、与卤素单质的取代------发生该类反应的有机物包括:烷烃、烯烃、芳香烃、醇、酚等。例如: 2、与混酸的硝化反应(苯及其同系物、苯酚、烷烃等均能发生硝化反应)。如: (3)注:环己烷对酸、碱比较稳定,与中等浓度的硝酸或混酸在低温下不发生反应,与稀硝酸在100℃以上的封管中发生硝化反应,生成硝基环己烷。在铂或钯催化下,350℃以上发生脱氢反应生成苯。环己烷与氧化铝、硫化钼、古、镍-铝一起于高温下发生异构化,生成甲基戌烷。与三氯化铝在温和条件下则异构化为甲基环戊烷。 低碳硝基烷的工业应用日益广泛。在使用原料上,以丙烷硝化来制取是合理的途径。在工艺方面,国外较多的是以硝酸为硝化剂的气相硝化工艺,已积累了较丰富的工业经验。有代表性的反应器则是多室斯登该尔反应器。国内迄今有关硝基烷的生产和应用研究均进行得不多,这是应该引起我们充分注意的。
3、与硫酸的磺化反应(苯、苯的衍生物,几乎均可磺化)。如: 4、羧酸和醇的酯化反应 5、水解反应(卤代烃、酯、多糖、二糖、蛋白质都能在一定条件下发生水解反应)。如: 6、与活泼金属的反应:(醇、酚、羧酸等均能与活泼金属如钠反应生成氢气)。如: 7、醇与卤化氢(H X)的反应。如: 8、羧酸或醇的分子间脱水。如:
二、加成反应 定义:有机物分子里不饱和碳原子跟其它原子或原子团直接结合生成化合物的反应叫加成反应。 在中学化学中,分子结构中含有“双键”或“叁键”的化合物均能发生加成反应。如烯烃、二烯烃、炔烃、苯及其同系物、醛、酮、不饱和高级脂肪酸及其甘油脂、单糖等。通常参与加成反应的无机试剂包括H2、X2(X为C l、B r、I)、H X、H2O、H C N等小分子(对称或不对称试剂)起加成反应。 说明:i.羧基和酯基中的碳氧双键不能发生加成反应。i i.醛、酮的羰基只能与H2发生加成反应。i i i.共轭二烯有两种不同的加成形式。 1、和氢气加成 2、和卤素加成 3、和卤化氢加成 4、和水加成 三、消去反应 定义:有机化合物在适当条件下,从一个分子相邻两个碳原子上脱去一个小分子(如:H2O、H X等)而生成不饱和(双键或叁键)化合物的反应称为消去反应,又称消除反应。 发生消去反应的化合物需具备以下两个条件: i.是连有一O H(或一X)的碳原子有相邻的碳原子;i i.是该相邻的碳原子上还必须连有H原子。中学里常见的两类有机物是醇和卤代烃。1、醇的消去反应
有机化学反应类型全总结一、取代反应 定义:有机物分子里的某些原子或原子团被其它原子或原子团所代替的反应称为取代反应. 取代反应的类型很多, 中学化学中主要有下面几类: 1.卤代反应烷烃、芳香烃、苯酚等均能发生卤代反应如: 。 2.硝化反应苯及其同系物、苯酚、烷烃等均能发生硝化反应如:
3.磺化反应苯、苯的衍生物, 几乎均可磺化.如: ; (邻、对位产物为主) 4. 酯化反应 (1)羧酸和醇的反应.如: (2)无机含氧酸和醇的反应.如: 5.水解反应: 卤代烃、酯、多糖、二糖、蛋白质都能在一定条件下发生水解反应.如: , 6. 与活泼金属的反应: 醇、酚、羧酸等均能与活泼金属如钠反应生成氢气.如:
, 7.醇与卤化氢(HX)的反应.如: 8.羧酸或醇的分子间脱水.如: 二、加成反应 定义有机物分子里不饱和的碳原子跟其它原子或原子团直接结合, 生成别的物质的反应, 叫加成反应分子结构中含有双键或叁键的化合物, 一般能与H2、X2(X为Cl、Br、I)、HX、H2O、HCN等小分子物质起加成反应. 如烯烃、二烯烃、炔烃、苯及其同系物、醛、酮、不饱和高级脂肪酸及其甘油脂、单糖等. 说明: 1.羧基和酯基中的碳氧双键不能发生加成反应。 2.醛、酮的羰基只能与H2发生加成反应。 3.共轭二烯有两种不同的加成形式。 1.和氢气加成. — 2.和卤素加成
3.; 4.和卤化氢加成 5.和水加成 三、消去反应 定义:有机化合物在适当条件下, 从一个分子相邻两个碳原子上脱去一个小分子(如H2O、HX等)而生成不饱和(双键或叁键)化合物的反应称为消去反应, 又称消除反应发生消去反应的化合物需具备以下两个条件: (1)是连有一OH(或一X)的碳原子有相邻的碳原子; — (2)是该相邻的碳原子上还必须连有H原子. 1.醇的消去反应.如: 2.卤代烃的消去反应.如: 四、聚合反应 定义:由许多单个分子互相结合生成高分子化合物的反应叫聚合反应. 聚合反应有两个基本类型:加聚反应和缩聚反应. 1.加聚反应. 由许多单个分子互相加成, 又不缩掉其它小分子的聚合反应称为加成聚合反应简称加聚反应. ! 烯烃、二烯烃及含的物质均能发生加聚反应.如:
酸碱盐化学方程式(练习) 一.两个置换反应规律 1.酸+金属==盐+氢气 反应条件:①酸不能用强氧化性酸,如硝酸、浓硫酸,(常用稀硫酸、盐酸) ②金属必须位于氢以前(常用Mg、Al、Zn、Fe) Mg+ HCl== Mg+ H2SO4== Al+ HCl== Al+ H2SO4== Zn+ HCl== Zn+ H2SO4== Fe+ HCl== Fe+ H2SO4=== 2.盐+金属==新盐+新金属 反应条件:①盐(反应物)必须溶于水 ②金属单质(反应物)比盐中金属活泼,不用钾、钙、钠 Fe+CuSO4== Al+ CuSO4== Zn+CuSO4== Cu+ AgNO3== Cu+Hg(NO3)2== 二.三个分解反应规律 1.酸(含氧酸)==非金属氧化物+水 === H2O+CO2↑ 2.碱(难溶性)== 金属氧化物+水 Cu(OH)2Fe(OH)3 3.碳酸盐(难溶性)==金属氧化物+二氧化碳 CaCO3 三.四个化合反应规律 1.金属+氧气== 金属氧化物 Mg+O2Fe+ O2Cu+ O2 2.金属氧化物+水== 碱(可溶性) CaO+H2O== Na2O+H2O== 3.非金属+氧气==非金属氧化物 S+O2P+O2C+O2(碳充分燃烧) C+O2(碳不充分燃烧) H2+O2 4.非金属氧化物+水==酸 CO2+H2O== SO3+H2O== SO2+H2O== 四.五个复分解反应规律(亚硫酸) 1.酸+碱==盐+水 Cu(OH)2+ HCl== Al(OH)3+ HCl== Cu(OH)2+H2SO4== Mg(OH)2+ HNO3== 2.酸+盐==新酸+新盐反应条件:符合复分解反应发生的条件(实际反应条件很复杂)CaCO3+ HCl== Na2CO3+ HCl==
常见有机反应的十大类型 李勇 1. 取代反应 有机物分子里的某些原子或原子团被其他原子或原子团所代替的反应。(1)卤代: s (2)硝化: s (3)磺化: (4)卤代烃水解: (5)酯水解:
(6)羟基( OH)取代: (7)分子间脱水: 2. 加成反应 有机物分子中双键(或三键)两端的碳原子与其他原子或原子团直接结合生成新的化合物的反应。 (1)碳碳双键的加成: (2)碳碳三键的加成: (3)醛基的加成: (4)苯环的加成: 3. 加成聚合(加聚)反应 相对分子质量小的不饱和化合物聚合成相对分子质量大的高分子化合物的反应。
(1)丙烯加聚: (2)二烯烃加聚: 4. 缩合聚合(缩聚)反应 单体间相互反应而生成高分子化合物,同时还生成小分子(如水、氨、氯化氢等)的反应(又叫逐步聚合反应)。 (1)制酚醛树脂: (2)缩聚制酯: (3)氨基酸缩聚: 5. 消去反应 有机化合物在一定条件下,从一个分子中脱去一个小分子(如水、卤化氢等)而生成不饱和(含双键或三键)化合物的反应。
6. 氧化还原反应 在有机化学中,通常把有机物得氧或去氢的反应称为氧化反应;反之,加氢或去氧的反应称为还原反应。 (1)氧化反应: (2)还原反应: 7. 酯化反应(亦是取代反应) 酸和醇起作用,生成酯和水的反应 s 8. 水解反应(亦是取代反应,其中卤代烃、酯的水解见取代反应部分)
化合物和水反应生成两种或多种物质的反应(有卤代烃、酯、酰胺、糖等)。 麦芽糖葡萄糖 9. 脱水反应(又叫碳化) 有机物分子脱去相当于水的组成的反应。 10. 裂化反应 在一定条件下,把相对分子质量大、沸点高的长链烃,断裂为相对分子质量小、沸点低的短链烃的反应。