
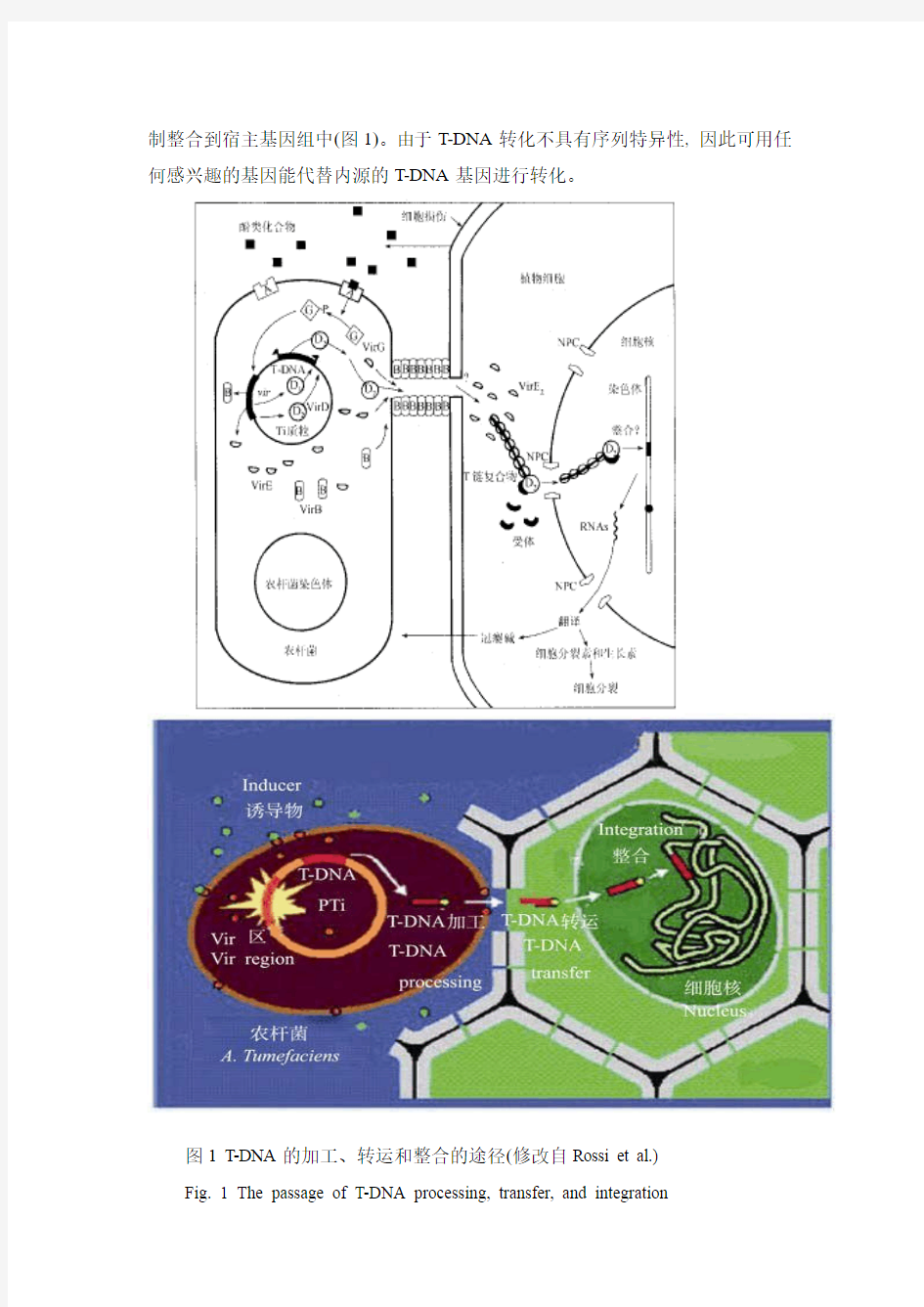
农杆菌转化机理
农杆菌是从土壤中分离出来的革兰氏阴性细菌, 根据宿主范围和致病症状
可分为5种,其中研究最多也最透彻的是根癌农杆菌(Agrobacterium tumefaciens), 它能将自身Tumor-inducing(Ti)质粒的一段DNA(T-DNA)转移到植物细胞中, 从而使植物损伤部位形成冠瘿瘤。
T-DNA的转化是在Ti质粒上Vir区一系列Vir基因的作用下产生的。T- DNA 是质粒上一段10~30 kb的序列, 编码5个与致瘤有关的生长素和细胞分裂素合成酶基因。其左右边界各有一段高度保守的25 bp的同向重叠序列(Direct repeat)与T-DNA的转化有关。其中右边界是VirD2的共价结合序列及VirD1/VirD2内切的靶序列, VirD2与右
边界的共价结合及
邻近右边界的过度
驱动(Overdrive)序
列导致了单链
T-DNA由右边界剪
切并转移的极性,
而VirD2与左边界
的结合可能导致了
载体骨架序列的转
移。
农杆菌侵染时, 在单糖转运蛋白ChvE的配合下, 双元组分系统的VirA作为感受信号的天线分子受到植物伤口产生的酚类物质和糖类的诱导而自动磷酸化, 并且随后使双元组分系统的另一组分VirG磷酸化为活性状态, 进而通过vir-box 激活其他Vir基因的表达, 最后由VirD1/VirD2剪切的单链VirD2-T-DNA复合体由VirB和VirD4蛋白组装成的Type IV Secretion System(T4SS)运送到宿主细胞, 另外的几个Vir蛋白VirE2、VirE3、VirF、VirD5也同时通过这个通道运送到宿主细胞质中。VirD2-T-DNA复合体在进入宿主细胞质中不久, VirE2就结合上去, 通过VirD2核定位信号的引导并在几个宿主蛋白和农杆菌因子的协助下向细胞核转运, 最后结合在T-DNA上的蛋白被降解, 而T-DNA通过一种尚不清楚的机
制整合到宿主基因组中(图1)。由于T-DNA转化不具有序列特异性, 因此可用任何感兴趣的基因能代替内源的T-DNA基因进行转化。
图1 T-DNA的加工、转运和整合的途径(修改自Rossi et al.)
Fig. 1 The passage of T-DNA processing, transfer, and integration
影响农杆菌转化的因素
1、菌株及载体
遗传转化中常用的农杆菌菌株有3种类型: 胭脂碱型(以C58菌株为代表)、章鱼碱型(以LBA4404菌株为代表)和琥珀碱型(以EH101、EHA105菌株为代表), 菌株选择的合适与否直接影响了最终的转化效率。另外, 菌株和载体的组合对转化至关重要, 其中超双元载体pSB131和pTOK233一般用LB4404进行转化。Hiei 等的实验表明, 菌株和载体搭配不合适如超强菌株和超双元载体组合的转化效率比普通农杆菌与双元载体组合的效率还要低。
2、Vir基因的活化
酚类物质或酚类物质含量低而不能诱导Vir基因的活化
另外, 在共转化其间还有许多因素与Vir基因的表达有关, 这些因素包括: 酸性pH值、低温培养、高渗透压等。一些小分子量的糖类如半乳糖、葡萄糖等也能诱导Vir基因的表达, 当酚类物质的水平较低时, 糖类诱导Vir基因表达的效果更明显, 这些研究结果通过Hiei等的GUS瞬时表达系统得到了进一步证实。
3、受体材料、生长状况及基因型
不同来源、不同发育状态和不同基因型的受体材料对农杆菌的敏感性虽然不尽相同, 但保持旺盛的细胞分裂和DNA复制是T-DNA整合所必需的。
4、培养基成分
农杆菌介导的玉米遗传转化大致可以分为侵染、共培养、恢复培养、筛选培养和再生等几个过程
除基本培养基外, 根据农杆菌转化的机制, 一般还在培养基中加一些特殊组分来提高农杆菌的附着能力、Vir基
因的活性和受体材料的感受态。
5、选择性标记基因
除了有效的遗传转化以外, 高效
的选择标记系统也是农杆菌转化所
必须的。常用的选择标记基因主要有
新霉素磷酸转移酶基因nptⅡ(卡那霉
素、G418及新霉素抗性)、潮霉素磷
酸转移酶基因hpt(潮霉素B抗性)、修饰的草丁膦乙酸转移酶pat(草丁膦和双丙氨膦的抗性)、草丁膦乙酸转移酶bar(双丙氨膦抗性)、5-烯醇丙酮莽草酸-3-磷酸合酶基因epsps(草甘膦抗性)。以上通过抗生素或除草剂杀死未转化细胞进行筛选的系统都属于负向选择系统。在这种选择系统中, 虽然阳性转基因株具有抵抗筛选剂的能力, 但是标记基因的产物在一定程度上还是对阳性转基因株有一定的毒性, 因此目前人们更倾向于使用转化频率更高的正向筛选系统: 即标记基因产物通过促进特殊底物的代谢使阳性转基因株“脱颖而出”, 从而达到筛选的目的。目前, 磷酸甘露糖异构酶mpi基因(甘露糖抗性)已用于玉米的正向选择系统。另外, 还需要开发新的选择标记以适应多基因转化的转基因后代和高通量筛选的需要, 原卟啉原氧化酶基因ppo(英拜除草剂抗性)也许是能满足此要求的标记基因。
除以上几个主要的影响因素以外, 还有一些因素也影响转化农杆菌转化的效率。如农杆菌的生长状态、菌液浓度、侵染方式、共培养时间和温度、pH值、超声波、表面活性剂Silwet L-77等。
农杆菌电击感受态的制备及电击转化 表达载体pB-2mb-FRO-1.7A和pB-2mb-1.7A空载体的农杆菌(EHA105)电击转化 (1)抽提纯化pB-2mb-FRO-1.7A和pB-2mb-1.7A空载体的重组质粒 pB-2mb-FRO-1.7A重组载体和pB-2mβ-1.7A空载体的(DH5α)菌种接种于5ml LB(含卡那霉素50mg/L)液体培养基中,37℃,200rpm震荡培养过夜。按V-GENE公司的质粒提取试剂盒提取pB-2mb-FRO-1.7A重组质粒。 (2)取200ml型号的电击杯用无水乙醇浸泡,晾干。 (3)农杆菌EHA105电击预备处理。 I. 接种于5ml YEP(含链霉素Sm50mg/L)液体培养基中,28℃,200rpm震荡培养过夜至OD600值为0.4。EHA105 II. 离心管中收集1ml菌液,4℃,8000rpm,离心30s。1.5ml III. 去残液,沉淀用200μl ddH2O充分悬浮,4℃,8000rpm,离心30s。 IV. 重复步骤ⅲ三次。 V. 去残液,沉淀用200ml ddH2O充分悬浮,即为电击用农杆菌EHA105感受态。加入200μl灭菌甘油混匀后置于-80℃备用。 (4)电击 I. 分别取10ml pB-2mb-FRO1-1.7A和pB-2mb-1.7A重组质粒至200μl EHA105感受态中,轻打混匀,然后转移至电击杯中,置冰上。 II. 准备好电击装置(BioRad),电压为2.5V,用手按住电击按钮,直到啪的一声电击完毕。 III. 室温静置2min后加入800ml YEP培养液,28℃静置1h,然后28℃,200rpm培养2h。IV. 离心30s,收集菌液,沉淀用200ml ddH2O悬浮,用玻璃棒涂布含含卡那霉素50mg/L 和含链霉素Sm50mg/L的YEP固体培养基平板,28℃培养48h。8000rpm 1.制备农杆菌电转感受态 (1)挑取根癌农杆菌EHA 105单菌落,接种于5mlLB〔含利福平(Rif) 50mg/L,;链霉素 100mg/L)液体培养基中,28'C, 220rpm震荡培养过夜。 (2)将2m1过夜培养的菌液加到50ml含同样抗生素的LB培养基中,28'C, 220rpm震荡 3-4小时,至OD560=0.5左右。 (3) 5000rpm离心5分钟,去上清。 (4) 加入40m1 10%甘油悬浮菌体,冰浴30min. (5) 4'C, 5000rpm离心5分钟,去上清。 (6 加入30mL10%甘油重悬浮菌体,4'C, 5000rpm离心5分钟, (7)重复步骤6一次,去上清,加入2ml10%甘油悬浮,分装于1.5ml的离心管中(200 p 1/ 管)备用。 2 农杆菌感受态的电转化 〔I)取2 ul质粒加到200 u I EHA 105感受态细胞中,轻轻混匀,冰浴 30分钟。 (2)把质粒和感受态混合液吸入电极杯,电击转化。 (3)马上加入lml新鲜的LB液体培养基,28'C, 150rpm轻摇4-6小时。 (4)收集菌体涂布于含有链霉素100mg/L),利福平(50mg/L)及质粒所含的抗性的LB固体培
农杆菌侵染拟南芥花序的转化方法 制备转化用的农杆菌菌液 准备: 1.灭菌试管 400毫升细长烧杯2瓶,离心瓶4-6个(250ml)。 2.试剂:YEP 1200ml(每瓶300ml 共4瓶)+Kan 1;1000,Rif1:500。 1/2MS+2%蔗糖(灭菌115度20分钟),Silwet在-20℃贮存。 3.步骤: 共转化农杆菌:于中午12点接菌于有YEP培养液的试管中10ul:10ml接种。28℃,3000rpm摇过夜,约30小时,次日下午6点将已摇活的菌按(1:400)及750ul菌液转至汉300毫升YEP+K50+Rif中培养28℃,300rpm约14小时,次日上午8点测OD值,用YEP+Rif作为空白对照,当菌液达到OD600为1.5~3.0之内时,可收集菌体于250ml离心瓶(灭菌),4℃,4000g 离心10min 。用10%蔗糖(含0.02%silwet)稀释至OD600 约为0.8-- 1.0左右即,用10%蔗糖作对照。转化时将花在溶液中浸泡50s左右,于弱光下生长。 4.浇水:转化前一天将需要做转化的野生型拟南芥苗子浇水浇透。 (注意:选取上述配好的溶液2ml,充分打碎管底部的菌体,在将混匀的菌体溶入600ml溶液中,混匀后再加入Silwet(100%)120ul终浓度为0.02%)。 2.先将浇透水用于转化的苗子的夹全部剪掉,再用宽胶带把花盆的土封好。3.转化的准备工作:2个400细长烧杯,宽胶带,记号笔,表等。 4.转化过程略,视苗的长势弱 0.8 Pa 3`,长势好的0.8 Pa 5`。 5.标记好,将转化好的苗平放于盒子内,上盖封口膜封好,避光培养24hrs 2天后,将植株立起正常培养,浇水,3天1次。 花序浸泡(flower-dipping)法转化拟南芥
方法1 NB基本培养基(右边的为N6,大量相同,加glycine甘氨酸2 mg/L) KNO3 2830 mg/L (NH4)2SO4 463 mg/L KH2PO4 400 mg/L MgSO4.7H2O 185 mg/L CaCl2.2H2O166 mg/L FeSO4.7H2O 27.8mg/L 5.6 Na2EDTA 37. 5 mg/L 7.5 MnSO4.4H2O 10 mg/L 27.8 H3BO3 3 mg/L 1.6 ZnSO4.7H2O 2 mg/L 1.5 Na2MoO4.2H2O 0.25 mg/L 0.25 CuSO4.5H2O 0.025 mg/L 0.025 CoCl2.6H2O 0.025 mg/L 0.025 KI 0.75 mg/L 0.8 盐酸硫胺素thiamine CHL VB1 10 mg/L 0.1 盐酸吡哆醇pyridoxine-CHL VB6 1 mg/L 0.5 烟酸nicotinic acid 1 mg/L 0.5 肌醇myo-inositol 100 mg/L 100 水解酪蛋白300 mg/L 谷氨酰胺500 mg/L 脯氨酸500 mg/L 蔗糖30,000 mg/L PHytagel 2.6 mg/L pH 5.8 Basic培养基 B N6(大量)50ml (20倍) A Ms-Fe盐10-20ml(100倍)CH 0.3g/L S B5 macro 10ml (100倍)phytogel 4g/L或agar 8g/L I B5 vita 10ml (100倍)sucrose 30g/L C proline 0.5g/L glutamine 0.5g/L N6 (大量梗稻种子) 终浓度母液(20倍) 终浓度母液(20倍)培KNO32830mg/L56.6g/L Mg SO4.7H2O185 mg/L 3.7 g/L 养(NH4)2SO4463 mg/L9.26 g/L CaCl2.2H2O 166 mg/L 3.32 g/L 基KH2PO4400 mg/L8.00 g/L 制备1 KNO3, (NH4)2SO4, KH2PO4同时倒入烧杯,加水搅拌, 使之完全溶解.
农杆菌转化法原理 This manuscript was revised on November 28, 2020
农杆菌转化法原理: 农杆菌是普遍存在于土壤中的一种革兰氏阴性细菌,它能在自然条件下趋化性地感染大多数双子叶植物的受伤部位(受伤处的细胞会分泌大量酚类化合物,从而使农杆菌移向这些细胞),并诱导产生冠瘿瘤或发状根。 根癌农杆菌和发根农杆菌中细胞中分别含有Ti质粒和Ri质粒,其上有一段T-DNA,农杆菌通过侵染植物伤口进入细胞后,可将T-DNA插入到植物基因组中,并且可以通过减速分裂稳定的遗传给后代,这一特性成为农杆菌介导法植物转基因的理论基础。 人们将目的基因插入到经过改造的T-DNA区,借助农杆菌的感染实现外源基因向植物细胞的转移与整合,然后通过细胞和组织培养技术,再生出转基因植株。农杆菌介导法起初只被用于双子叶植物中,近年来,农杆菌介导转化在一些单子叶植物(尤其是水稻)中也得到了广泛应用。 农杆菌转化植物细胞涉及一系列复杂的反应,主要包括:①受伤的植物细胞为修复创伤部位,释放一些糖类、酚类等信号分子。②在信号分子的诱导下,农杆菌向受伤组织集中,并吸附在细胞表面。③转移DNA上的毒粒基因被激活并表达,同时形成转移DNA的中间体。④转移DNA进入植物细胞,并整合到植物细胞基因组中。 方法:(根据不同受体环境基因要求而不同) 1.农杆菌准备 2.外植体的准备(愈伤组织、悬浮细胞系、幼嫩茎段或叶片); 3.用 MS-AS液体培养基稀释原菌液15倍(1.5ml / 20ml)或离心后稀释3倍; 4.外植体与菌液共培养20 分钟; 5.放置在带滤纸的培养皿上(注意充分吸干多余的菌液); 6.将外植体接种到MS-AS固体诱导培养基,培养2-3天 ; 7.移至含卡那霉素(Kan)300mg/L和羧苄青霉素(Cb 300mg/L)的固体筛选培养基上进行Kan抗性愈伤组织的筛选; 8.隔20天,进行第二次筛选; 9.抗性愈伤组织在固体筛选培养基上分化成苗; 10 在生根培养基上生根,获得完整的再分化植株。
农杆菌介导转基因的原理? 转基因技术的飞速发展为生物定向改良和分子育种提供了一种较佳的方法,并使其成为基因工程和育种的最有效途径,目前应用较广泛的转基因技术有农杆菌介导法、花粉通道法、显微注射法、基因枪法、离子束介导法等等,其中农杆菌介导法以其费用低、拷贝数低、重复性好、基因沉默现象少、转育周期短及能转化较大片段等独特优点而备受科学工作者的青睐。农杆菌介导法主要以植物的分生组织和生殖器官作为外源基因导入的受体,通过真空渗透法、浸蘸法及注射法等方法使农杆菌与受体材料接触,以完成可遗传细胞的转化,然后利用组织培养的方法培育出转基因植株,并通过抗生素筛选和分子检测鉴定转基因植株后代。 农杆菌是普遍存在于土壤中的一种革兰氏阴性细菌,它能在自然条件下趋化性地感染大多数双子叶植物的受伤部位,并诱导产生冠瘿瘤或发状根。根癌农杆菌和发根农杆菌中细胞中分别含有Ti质粒和Ri质粒,其上有一段T-DNA,农杆菌通过侵染植物伤口进入细胞后,可将T-DNA插入到植物基因组中。因此,农杆菌是一种天然的植物遗传转化体系。人们将目的基因插入到经过改造的T-DNA区,借助农杆菌的感染实现外源基因向植物细胞的转移与整合,然后通过细胞和组织培养技术,再生出转基因植株。 农杆菌转化的详细机理已有大量综述, 并介绍新进展. 野生型根癌农杆菌能够将自身的一段DNA转入植物细胞. 因为转入的这一段DNA含有一些激素合成基因, 因而导致转化细胞自身激素的不平衡从而产生冠瘿瘤. 这些致瘤菌株都含有一个约200 kb的环状质粒, 被称为Ti(tumor inducing)质粒, 包括毒性区(Vir 区)、接合转移区(Con区)、复制起始区(Ori区)和T-DNA区4部分. 其中与冠瘿瘤生成有关的是Vir区和T-DNA区. 前者大小为30 kb, 分virA~J等至少10个操纵子, 决定了T-DNA的加工和转移过程. T-DNA可以将携带的任何基因整合到植物基因组中, 但这些基因本身与T-DNA的转移与整合无关, 仅左右两端各25 bp的同向重复序列为其加工所必需, 其中14 bp是完全保守的, 分10和4 bp不连续的两组. 两边界中以右边界更为重要. VirA作为受体蛋白接受损伤植物细胞分泌物的诱导, 自身磷酸化后进一步磷酸化激活VirG蛋白; 后者是一种DNA 转录活化因子, 被激活后可以特异性结合到其他vir基因启动子区上游的一个叫vir框(vir box)的序列, 启动这些基因的转录. 其中, virD基因产物对T-DNA进行剪切, 产生T-DNA单链. 然后以类似于细菌接合转移过程的方式将T-DNA与VirD2组成的复合物转入植物细胞], 在那里与许多VirE2蛋白分子(为DNA单链结合蛋白)相结合, 形成T链复合物(T-complex). 在此过程中VirE1作为VirE2的一个特殊的分子伴侣具有协助VirE2转运和阻止它与T-DNA链结合的功能. 实验表明, 转基因植物产生的VirE2蛋白分子也能在植物细胞内与VirD2-T-DNA形成T链复合物. 之后, 这一复合物在VirD2和VirE2核定位信号(NLS)引导下以VirD2为先导被转运进入细胞核. 转入细胞核的T-DNA以单或多拷贝的形式随机整合到植物染色体上. 研究表明T-DNA优先整合到转录活跃区, 而且在T-DNA的同源区与DNA的高度重复区T-DNA的整合频率也比较高. 整合进植物基因组的T-DNA也有一定程度的缺失、重复、填充和超界等现象发生, 例如在用真空渗透法转化的拟南芥中有66%出现超界现象, 甚至有整个Ti质粒整合进植物基因组的报道, T-DNA超界转移现象的机理尚不完全清楚, 可能与其左边界周边序列有关. 现在, 对农杆菌感染过程中其本身因子的转录与调控已研究得相当深入, 但
农杆菌介导法转基因杨树 摘要: 杨树品种已发展为一种植物转化和再生系统。叶植,从稳定发芽培养的一个杨树杂交NC - 5339(银白杨标本),被共培养用于农杆菌遗传转化关于一个烟草的看护培养。致瘤的和无防备的农杆菌株隐藏包含一个双元载体,其中包含两个新霉素磷酸转移酶II(NPT II')和细菌5莽草酸3-磷酸合酶(EPSP)(AROA)嵌合基因融合。没有开发芽,叶外植体时,双元缴械拉力的根癌农杆菌菌株共培养。然而,转化的植物,没有野生型的T-DNA获得使用农杆菌株原癌基因的二进制。NPT II '酶的活性检测,Southern印迹法分析和免疫学检测证实了遗传转化成功细菌EPSP合酶Western印迹。这是首次报道成功收回转化植株森林树,也是第一个记录的插入和重要农艺性状的外源基因的表达成木本植物物种。 关键词:白杨;转化;农杆菌 前言 基因工程树种的能力将是特别有用的遗传改良,如大型成熟的植物并长期有性世代倍(Nelson and Haissig 1984; Sederoff and Ledig 1985)。森林树种的应用重组DNA技术的一个先决条件是发展的基因转移系统。方法,例如显微注射(Crossway et al.1986)和直接DNA摄入(Paszkowski et al. 1985; Fromm et al. 1986) 已被用于外源基因引入到草本作物物种,但是,最有效的基因转移的方法,利用自然感染冠瘿病的机制造成的有机体,农杆菌(Bevan et al. 1983 ; Fraley et al. 1983 ; Herrera-Estralla, 1983). 。根癌农杆菌的自然感染周期期间,细菌的T-DNA 整合到宿主植物的染色体,从而导致肿瘤对植物的生产(奇尔顿等人,1980)。可以删除和替换而不影响根癌农杆菌的T-DNA转移到植物(DeGreve等,1982)的能力,由异源基因的肿瘤诱导基因。这些修改后的根癌农杆菌菌株的原生质体,悬浮细胞,外植体组织的共培养,可导致转化植物缺乏致癌基因性状的隔离。因此,我们着手开发一个混合型杨树无性系,银白杨x grandidentata的(NC - 5339 )作为载体的农杆菌转化体系。 有许多特征能使杨树NC-5339得到理想的转化研究首先,杨树是一个重要的全球森林树种。这是一个快速增长的落叶阔叶树,栽培主要用于纸浆生产。对
一、目的及要求 了解和掌握农杆菌感受态细胞制备的原理和方法。 二、实验原理 在利用根癌农杆菌介导的基因转化中,首先要获得含有目的基因的农杆菌工程菌株。 在基因工程操作中,感受态细胞的制备和质粒的转化是一项基本技术。感受态是细菌细胞具有的能够接受外源DNA 的一种特殊生理状态。农杆菌的感受态可用CaCl2 处理而诱导产生。将正在生长的农杆菌细胞在加入到低渗的氯化钙溶液中,0℃下处理便会使细菌细胞膜的透性发生改变,此时的细胞呈现出感受态。 制备好的农杆菌感受态细胞迅速冷冻于70℃可保存相当一段时间而不会对其转化效率有太大影响。 三、实验仪器、材料和试剂 仪器:超净工作台,恒温摇床,冷冻高速离心机,高压灭菌锅,冰箱,70℃超低温冰柜,分光光度计,接种针,10ml 试管,50ml 离心管,1.5ml 离心管,冰浴,微量进样器及吸头。以上玻璃仪器和离心管需在用前灭菌,灭菌条件:120℃,15分钟。 材料:土壤农杆菌LBA4404菌株或其它农杆菌菌株 试剂: YEB 液体培养基(1升):酵母提取物1g ,牛肉膏5g ,蛋白胨5g ,蔗糖 5g , MgSO4.7H2O 0.5g, pH7.0,高压灭菌; 链霉素(Sm )储液:125mg/ml
0.15 N NaCl,高压灭菌。 20mM CaCl2,高压灭菌。 四、实验步骤 1. 挑取根癌农杆菌LBA4404 单菌落于3ml 的YEB 液体培养基(含Sm 125mg/l)中,28°C 振荡培养过夜; 2. 取过夜培养菌液0.5ml 接种于50mlYEB(Sm 125mg/l液体培养基中,28°C 振荡培养至OD600为0.5; 3. 5000rpm, 离心5min ; 4. 加入10ml 0.15N NaCl,使农杆菌细胞充分悬浮,5000rpm, 离心5min ; 5. 弃上清,置于冰上,加入1ml 预冷的20mM CaCl2,充分悬浮细胞,冰浴中保存,24小时内使用,或分装成每管200ml ,液氮中速冻1 分钟,置70°C 保存备用。
二、农杆菌介导植物转化的机制及影响转化效率的因素 转化机制: 与植物基因转化有关的农杆菌有两种类型:根癌农杆菌(Agrobacterium tumefaciens)和发根农杆菌(Agrobacterium rhizogenes)。根癌农杆菌含有Ti 质粒。发根农杆菌含有Ri 质粒。根癌农杆菌的Ti 质粒和发根农杆菌Ri 质粒都具有一段转移DNA (transfer DNA,又称T-DNA),在农杆菌侵染植物时,T-DNA 可以插入到植物基因组中,使其携带的基因在植物中得以表达。由于T-DNA 能够进行高频率的转移,而且Ti 质粒和Ri 质粒上可插入大到甚至150kb 的外源基因,因此,Ti 质粒和Ri 质粒成为植物基因转化中的理想载体系统。 1 与农杆菌转化相关的基因 与转化相关的基因主要包括农杆菌染色体上的基因和Ti 质粒上T-DNA 以外Vir 区的基因。染色体基因包括chvA、chvB、att、pscA、chvD 以及chvB。它们大多编码一些膜相关蛋白,负责细菌向植物受伤细胞趋化移动和帮助细菌附着于植物受伤细胞上。ChvD 蛋白可能在低pH 和磷酸饥饿情况下提高VirG 蛋白的合成水平。ChvE 与VirA 蛋白共同对virG 起激活作用。 原始的Ti质粒根据其功能的不同,可分为4个区: (1)T-DNA区:是在农杆菌侵染细胞时,从Ti质粒上切割下来转移到植物基因组中的一段DNA,其携带的基因与肿瘤的形成有关,但与T-DNA本身的转移与整合无关。T-DNA 上最重要的是两端的2个边界(LB和RB),它们是T-DNA转移所必需的。只要其存在,T-DNA可以将携带的任何基因转移并整合到植物基因组中, T-DNA的右边界在T-DNA的整合中对于靶DNA位点的识别具有重要作用,因此,尤以右边界更为重要. (2)毒性区:位于T-DNA以外的1个30~40 kb的区域内,该区段编码的基因但对T-DNA 的转移和整合非常重要.这些基因也称为Ti质粒编码毒性基因(vir)。 (3)接合转移区:该区段存在有与细菌间接合转移有关的基因(tra),调控Ti质粒在农杆菌间转移。 (4)复制起始区:该区段调控Ti质粒的自我复制。在遗传转化过程中除了Ti质粒上的基因参与外,还有农杆菌染色体基因。染色体基因包chvA、chvB、att、pscA、chvD 以及chvB。它们大多编码一些膜相关蛋白,负责细菌向植物受伤细胞趋化移动和帮助细菌附着于植物受伤细胞上。延伸因子P对于农杆菌的生长非常重要,但非必需.高水平的糖结合蛋白一ChvE可以扩大VirA蛋白对酚类物质的识别范围。结合ATP盒式转运体类似物蛋白ChvD,参与Vir区基因的表达调控,chvD基因座中插入无启动子的lacZ,农杆菌侵染力以及Vir区基因表达量大大下降,ChvD突变体中virG组成型表达侵染力则得以恢复,这一现象说明ChvD通过影响virG表达控制毒性。 2 Vir 基因的诱导表达机制 在植物受到创伤后,创伤组织的细胞释放出创伤信号——酚类化合物,如乙酰丁香酮。
实验一农杆菌感受态细胞的制备 [目的及要求] 了解和掌握农杆菌感受态细胞制备的原理和方法。 [实验原理] 在利用根癌农杆菌介导的基因转化中,首先要获得含有目的基因的农杆菌工程菌株。 在基因工程操作中,感受态细胞的制备和质粒的转化是一项基本技术。感受态是细菌细胞具有的能够接受外源DNA的一种特殊生理状态。农杆菌的感受态可 用CaCl 2处理而诱导产生。将正在生长的农杆菌细胞加入到低渗的CaCl 2 溶液中, 0℃下处理便会使细菌细胞膜的透性发生改变,此时的细胞呈现出感受态。制备好的农杆菌感受态细胞迅速冷冻于-70℃可保存相当一段时间而不会对其转化效率有太大的影响。 [实验仪器、材料和试剂] 一、仪器:超净工作台,恒温摇床,冷冻高速离心机,高压灭菌锅,冰箱, -70℃超低温冰柜,分光光度计,接种针,10ml试管,50ml离心管,1.5ml 离心管,冰浴,微量进样器及吸头。 以上玻璃仪器和离心管需在用前灭菌,灭菌条件:120℃,15分钟。 二、材料:土壤农杆菌LBA4404菌株或其它农杆菌菌株 三、试剂:YEB液体培养基(1L):酵母提取物1g,牛肉膏5g,蛋白胨5g, 蔗糖5g,MgSO 4·7H 2 O 0.5g,pH7.0,高压灭菌。 利福平(Rif)储液:50mg/ml 20mM CaCl 2 ,高压灭菌。 [实验步骤] 1、挑取根癌农杆菌LBA4404单菌落于3ml的YEB液体培养基(含Rif 50mg/l)中,28℃振荡培养过夜; 2、取过夜培养菌液1ml接种于50mlYEB(Rif 50mg/l)液体培养基中, 28℃振荡培养至OD 600 为0.5;
3、取2ml菌液,13000rpm,离心30sec, 弃上清; ,使农杆菌细胞充分悬浮,冰浴30min; 4、加入1000μl 20mM CaCl 2 5、13000rpm,离心30sec,弃上清,置于冰上,加入500μl预冷的20mM CaCl ,充分悬浮细胞,冰浴中保存,24hr内使用,或液氮中速冻1min,置-70℃ 2 保存备用。 实验二质粒DNA直接导入农杆菌 [目的及要求] 了解和掌握质粒DNA转化农杆菌细胞的原理和方法,获得能用于植物转化的工程菌。 [实验原理] 在低温下,外源DNA(质粒)可吸附到感受态细胞表面,诱导细胞吸收DNA。(加入热激原理)转化了质粒DNA的农杆菌随后28℃恢复培养,可使质粒上携带的编码抗生素的抗性基因得到表达,因此,转化了质粒的农杆菌细胞可在含有相应抗生素的培养基上生长,而没有转化的细胞则无法生长。
农杆菌感受态细胞的制备原理和实验步骤发布日期:2010-04-28 发布 人:technew最后更新时间:2010-04-28 浏览次数:889 一、目的及要求 了解和掌握农杆菌感受态细胞制备的原理和方法。 二、实验原理 在利用根癌农杆菌介导的基因转化中,首先要获得含有目的基因的农杆菌工程菌株。 在基因工程操作中,感受态细胞的制备和质粒的转化是一项基本技术。感受态是细菌细胞具有的能够接受外源DNA 的一种特殊生理状态。农杆菌的感受态可用CaCl2 处理而诱导产生。将正在生长的农杆菌细胞在加入到低渗的氯化钙溶液中,0℃下处理便会使细菌细胞膜的透性发生改变,此时的细胞呈现出感受态。 制备好的农杆菌感受态细胞迅速冷冻于70℃可保存相当一段时间而不会对其转化效率有太大影响。 三、实验仪器、材料和试剂 仪器:超净工作台,恒温摇床,冷冻高速离心机,高压灭菌锅,冰箱,70℃超低温冰柜,分光光度计,接种针,10ml 试管,50ml 离心管,1.5ml 离心管,冰浴,微量进样器及吸头。以上玻璃仪器和离心管需在用前灭菌,灭菌条件:120℃,15分钟。 材料:土壤农杆菌LBA4404菌株或其它农杆菌菌株 试剂: YEB液体培养基(1升):酵母提取物1g,牛肉膏5g,蛋白胨5g,蔗糖5g, MgSO4.7H2O 0.5g, pH7.0,高压灭菌; 链霉素(Sm)储液:125mg/ml 0.15 N NaCl,高压灭菌。 20mM CaCl2,高压灭菌。
四、实验步骤 1. 挑取根癌农杆菌LBA4404 单菌落于3ml 的YEB液体培养基(含Sm 125mg/l)中,28°C振荡培养过夜; 2. 取过夜培养菌液0.5ml接种于50mlYEB(Sm 125mg/l)液体培养基中,28°C振荡培养至OD600为0.5; 3. 5000rpm, 离心5min; 4. 加入10ml 0.15N NaCl,使农杆菌细胞充分悬浮,5000rpm, 离心5min; 5. 弃上清,置于冰上,加入1ml预冷的20mM CaCl2,充分悬浮细胞,冰浴中保存,24小时内使用,或分装成每管200ml,液氮中速冻1 分钟,置70°C保存备用。 一.农杆菌感受态细胞的制备 二.双元载体转化农杆菌EHA105 三.杆菌转化子的鉴定 A.农杆菌转化子的PCR鉴定 B.农杆菌转化子的酶切鉴定 关键词:农杆菌感受态细胞转化子 一.农杆菌感受态细胞的制备(同大肠杆菌质粒DNA的提取),然后将其转化大肠杆菌,再提取大肠杆菌的质粒DNA进行酶切鉴定。 取-70℃保存的EHA105于含有50μg/ml链霉素平板划线,28℃培养2天。挑单 菌落接种于5ml YM(0.5g/L KH 2 PO 4 ,10 g/L Mannitol,2 g/L L-Glutamine,0.2 g/L NaCL,0.2 g/L MgSO 4,0.3 g/L Yeast extract,PH 7 .0)液体培养基中,220rpm, 28℃振荡培养18 hr 左右。将5ml菌液转接于100ml YM液体培养基中, 28℃,220rpm,振荡培养至OD 600 =0.5。转入无菌1.5ml的EP管,5000g离心5min, 去上清液。加入1ml预冷的0.1M的CaCl 2 溶液,轻轻悬浮细胞,冰上放置20min, 4℃下,5000g离心5min,去上清。加入200μl预冷的含15%甘油的0.1M的CaCl 2溶液,轻轻悬浮。混匀后立即冻存于-80℃。 二.双元载体转化农杆菌EHA105 取1μg左右的质粒DNA加入到200μl EHA105感受态细胞中,混匀后,冰浴30min;-70℃放置10min ;取出后37℃水浴5min或42℃水浴1min;冰浴2min;加入800μl YM液体培养基,28℃,175rpm摇培3hr;取出后涂在含50μg/ml Kanamycin 的YM平板上,28℃培养到形成单菌落。
农杆菌转化法原理: 农杆菌是普遍存在于土壤中的一种革兰氏阴性细菌,它能在自然条件下趋化性地感染大多数双子叶植物的受伤部位(受伤处的细胞会分泌大量酚类化合物,从而使农杆菌移向这些细胞),并诱导产生冠瘿瘤或发状根。 根癌农杆菌和发根农杆菌中细胞中分别含有Ti质粒和Ri质粒,其上有一段T-DNA,农杆菌通过侵染植物伤口进入细胞后,可将T-DNA插入到植物基因组中,并且可以通过减速分裂稳定的遗传给后代,这一特性成为农杆菌介导法植物转基因的理论基础。 人们将目的基因插入到经过改造的T-DNA区,借助农杆菌的感染实现外源基因向植物细胞的转移与整合,然后通过细胞和组织培养技术,再生出转基因植株。农杆菌介导法起初只被用于双子叶植物中,近年来,农杆菌介导转化在一些单子叶植物(尤其是水稻)中也得到了广泛应用。 农杆菌转化植物细胞涉及一系列复杂的反应,主要包括:①受伤的植物细胞为修复创伤部位,释放一些糖类、酚类等信号分子。②在信号分子的诱导下,农杆菌向受伤组织集中,并吸附在细胞表面。③转移DNA上的毒粒基因被激活并表达,同时形成转移DNA的中间体。④转移DNA进入植物细胞,并整合到植物细胞基因组中。 方法:(根据不同受体环境基因要求而不同) 1.农杆菌准备 2.外植体的准备(愈伤组织、悬浮细胞系、幼嫩茎段或叶片); 3.用MS-AS液体培养基稀释原菌液15倍(1.5ml / 20ml)或离心后稀释3倍; 4.外植体与菌液共培养20 分钟; 5.放置在带滤纸的培养皿上(注意充分吸干多余的菌液); 6.将外植体接种到MS-AS固体诱导培养基,培养2-3天; 7.移至含卡那霉素(Kan)300mg/L和羧苄青霉素(Cb 300mg/L)的固体筛选培养基上进行Kan抗性愈伤组织的筛选; 8.隔20天,进行第二次筛选; 9.抗性愈伤组织在固体筛选培养基上分化成苗; 10 在生根培养基上生根,获得完整的再分化植株。
农杆菌介导的高效水稻遗传转化体系的研究A Highly Efficient Agrobacterium - mediated Rice Transformation Method 水稻是基因组研究的模式植物 ,近年来水稻基因组研究取得了很大进展 ,构建了遗传图谱和物理图 谱 ,完成了籼稻和粳稻的全基因组草图测2 - 3序 ,以及第 1 号和第 4 号染色体的精细测4 - 5序 ,并对第 10 号染色体的结构进行了详细分析。在此基础上 ,各实验室大规模地 ,系统地进行水稻功能基因研究 ,普遍采用的研究手段是基因标签技术。基因标签技术包括 T - DNA 和转座子标签 ,创建大量的基因标签体是功能基因研究的材料平台。而根癌农杆菌介导的水稻遗传转化是水稻基因标签技术中的重要步骤之一。本研究完善了根癌农杆菌介导的水稻转化方法 ,以期为水稻功能基因研究提供丰富材料 , 为水稻重要农艺性状的改良开辟途径。 1材料 以水稻品种日本晴(Oryza sativa L. ssp.japonica)为试验材料。菌株类型为 EHA105 超毒力菌株 ,载体为增强子捕获载体 pFX- E24. 2 - 15R(见图 1) ,载体上带有 GUS报告基因、35 S的 CaMV 启动子序列和潮霉素选择标记基因(HYG) 。农杆菌菌株为EHA105。 2方法 2.1水稻愈伤组织的诱导诱导方法参照 HIEI7等。将日本晴水稻种子去壳 ,用 75 %乙醇灭菌 5min ,再用2. 5 %的次氯酸钠灭菌处理不同时间(40min ,37 min ,30 min 和 25 min) ,以确定最佳灭菌时间 ,灭菌后用无菌水冲洗 6~8 次 ,于 MS 固体培养基上28 ℃避光培养 ,30 d 后 ,将愈伤组织进行继代培 养 ,得到胚性愈伤组织。 2.2农杆菌转化愈伤组织用 AB 固体培养基+氯霉素 25 mg/L + 利福平 20 mg/L + AS 20 mg/L培养农杆菌 ,在20 ℃下培养5~6 d。用无菌勺子轻轻刮下培养的农杆菌 ,放入 AAM液体培养基中(加有2 mg/L 2 ,4
实验九植物遗传转化——农杆菌介导法 一、目的 了解农杆菌转化的机理;掌握农杆菌介导转化水稻的技术 二、原理 根癌农杆菌(Agrobacterium tumefaciens)具有跨界转移DNA的能力。下列因子与转化过程有关: 1. Ti 质粒(tumor-inducing plasmid)上的T-DNA (transferred DNA) T-DNA是农杆菌Ti质粒上能够转移到植物基因组的一段DNA序列。T-DNA含有RB和LB两个边界,它们是25bp的正向重复序列,是T-DNA 转移的顺式作用元件。不同类型的农杆菌其边界序列有所不同,但划线部分为完全保守序列。置于该边界内的任何外源基因均可被转化。LB缺失突变后农杆菌仍能致瘤,但RB缺失会导致致瘤能力丧失,这时几乎完全没有T-DNA的转移。 LB(-链)5’GT TTACACCACAA TA TATCCTG CCA 3’ RB(+链)5’TGA CAGGA TA TA TTGGCGGGTAA AC 3’ 2. Ti质粒上的Vir区(virulence region)操纵子 转化所必需的基因有vir A、B、C、D、E、G。其中蛋白VirD1/D2识别T-DNA边界RB和LB;VirC识别T-DNA右边界的超驱增强子;VirD2在T-DNA底链起内切酶作用造成切刻,并与T-链5’ 共价结合,带有1个核定位信号NLS;VirB形成转移复合通道;VirE2为单链DNA 结合蛋白,有2个NLS。该操纵子的表达顺序如下: vir A和vir G组成型表达形成VirA和VirG蛋白→VirA被植物创伤信号分子激活→激活的VirA使VirG激活→激活的VirG 诱导vir C、D、E、B、F、H表达。 3. 农杆菌染色体基因组相关基因:chv A、chv B(农杆菌运动、附着)、chv D、chv E(编码单糖结合蛋白、趋化性)、psc A、att、cel(合成纤维素丝,附着)。它们与农杆菌的趋化性和识别附着植物细胞有关。 4. 寄主细胞表面受体 5.诱导条件: 小分子酚类化合物:如乙酰丁香酮(AS,acetosyringone)、羟基乙酰丁香酮(OH-AS,hydroxyacetosyringone);它们是植物细胞创伤反应的一部分,或创伤细胞合成木质素的一部分,是莽草酸合成途径的产物。植物细胞必须在创伤和活跃的代谢状态下才能产生AS及OH-AS。农杆菌对一系列植物酚类化合物具有趋化性,同时高浓度的AS又可使农杆菌的vir 基因活化表达。这些化合物是双子叶植物细胞壁合成的前体,通常不存在于单子叶植物中,这正说明了为什么根癌农杆菌不易感染单子叶植物。若要实现农杆菌对水稻的转化,必须添加这类诱导物。 糖类:如D-葡萄糖、D-木糖等。它们在Vir区基因诱导和农杆菌毒力上起一定作用。 高浓度的肌醇可促进vir基因的表达。 低pH:pH 5.1-5.8 时Vir区基因的诱导达到最高水平。
农杆菌电击感受态的制备,转化及验证 1.制备农杆菌电转感受态 (1)挑取根癌农杆菌EHA 105单菌落,接种于5mlLB〔含利福平(Rif) 50mg/L,;链霉素 100mg/L)液体培养基中,28'C, 220rpm震荡培养过夜。 (2)将2m1过夜培养的菌液加到50ml含同样抗生素的LB培养基中,28'C, 220rpm震荡 3-4小时,至OD600=0.8左右。 (3) 5000rpm离心5分钟,去上清。 (4) 加入40m1 10%甘油悬浮菌体,冰浴30min. (5) 4'C, 5000rpm离心5分钟,去上清。 (6 加入30mL10%甘油重悬浮菌体,4'C, 5000rpm离心5分钟, (7)重复步骤6一次,去上清,加入2ml10%甘油悬浮,分装于1.5ml的离心管中(200 p 1/ 管)备用。 2 农杆菌感受态的电转化 〔I)取2 ul质粒加到200 u I EHA 105感受态细胞中,轻轻混匀,冰浴 30分钟。 (2)把质粒和感受态混合液吸入电极杯,电击转化。 (3)马上加入lml新鲜的LB液体培养基,28'C, 150rpm轻摇4-6小时。 (4)收集菌体涂布于含有链霉素100mg/L),利福平(50mg/L)及质粒所含的抗性的LB固体培 养基平板上, 28℃培养2-3天。其实和大肠杆菌电转化差不多,只不过培养温度是28度,摇的时间长一些,还有就是链霉素和利福平两种抗生素要加上,目的是防止根癌脓杆菌自带质粒的丢失,不过具体要加哪些抗生素还得看你是那种根癌脓杆菌非常感谢我用的不是电转化是把茎和叶浸在农杆菌液里30秒..想知道为什么不是把菌液直接滴在土里?可以采用注射法导入农杆菌还有就是把植株取出放入侵染液中用真空渗透法导入 感受态制备及转化方案二 1、农杆菌选择:LBA4404、EHA105、GV3101 2、农杆菌活化:将保存的农杆菌在固体LB培养基上画线(或加或不加抗生素,LBA4404:Rif 或Str;EHA105:Rif或Str;GV3103:庆大霉素。如果不加抗生素就有可能造成这些菌株的Ti质粒丢失,导致农杆菌缺乏侵染性),抗生素浓度为:50μg/ml。28℃培养。 3、农杆菌感受态细胞的制备: 1)挑取单菌落接种于3ml LB液体培养基中,220rpm 28℃振荡培养至OD600 =0.5。 2)吸取1.5ml菌液于离心管中,冰浴10min; 3)5000(13000)rpm离心30s,弃去上清液; 4)沉淀用1.5 ml 0.5M NaCl悬浮,冰浴20min; 5)5000(13000)rpm离心30s,弃去上清液; 6)每管用100μl 20mMCaCl2悬浮,用于转化;
农杆菌介导转化法的概述 自从1983年转基因植物诞生以来,植物基因工程成为发展最快、应用潜力最大的生物技术领域之一。植物转基因技术是指把从动物、植物或微生物中分离到的目的基因,通过各种方法转移到植物的基因组中,使之稳定遗传并赋予植物新的农艺性状,如抗虫、抗病、抗逆、高产、优质等。[1] 目前,应用于植物转基因较多的方法有基因枪轰击法和农杆菌介导法。由于基因枪轰击的随机性,容易出现突变、丢失和引起基因沉默等不利于外源基因在宿主植物的稳定表达的缺点,而农杆菌介导法是一种天然的植物遗传转化系统,外源基因在转基因植物中的拷贝数低、遗传稳定,是最常用的转基因技术[2]。农杆菌介导法起初只被用于双子叶植物中,近年来,农杆菌介导转化法在一些单子叶植物(尤其是水稻)中也得到了广泛应用。本文对农杆菌介导转化法进行综述。 1 关于农杆菌 农杆菌[3-5]是普遍存在于土壤中的一种革兰氏阴性细菌,它能在自然条件下趋化性的感染大多数双子叶植物的受伤部位,并诱导产生冠瘿瘤或发状根。与植物基因转化有关的有根瘤农杆菌和发根农杆菌这两种类型。 1.1根癌农杆菌 根癌农杆菌(Agrobacterium tumefaciens)含有Ti质粒,能诱导被侵染的植物细胞形成肿瘤,即诱发冠瘿瘤;Ti质粒是农杆菌染色体外的遗传物质,为双链共价闭合环状DNA分子,大小约200-250kb。 依据Ti质粒诱导的植物细胞产生的冠瘿碱的种类不同,根癌农杆菌可分为4种类型:章鱼碱型(Octopine)、胭脂碱型(Nopaline)、农杆碱型(Agropine)和琥珀碱型(Succinamopine)。 原始的Ti质粒根据其功能的不同可分为4个区: 1.1.1T-DNA区(Transfer—DNA region):不同来源的菌株,T-DNA的长度在12~24 kb,它是在农杆菌侵染细胞时,从Ti质粒上切割下来转移到植物基因组中的一段DNA,其携带的基因与肿瘤的形成有关,但与T-DNA本身的转移与整合无关.T-DNA上最重要的是T-DNA区两端的边界各为25 bp的重复序列.其中14 bp 是完全保守的,分10 bp(CAGGAATATAT)和4 bp(GTAA)不连续的2组.左右2个
农杆菌感受态制备与转化 普通农杆菌感受态制备与转化:方案一 1. 挑单菌落于2ml YEP培养基(含Rif20mg/ml)中28℃过夜活化。 2. 取2ml过夜菌液接种于50ml YEP培养基中28℃生长至OD600约等于0.5左右(4hr)。 3. 5k rpm离心5分钟。 4. 在10ml 0.15M NaCl中悬浮细胞。 5. 5 krpm离心5分钟,悬浮细胞于20ml冰预冷的CaCl2。 如不是马上使用,可以将之按200ul分裝储存于-80℃待用。 6. 加1ug DNA于200ul感受态细胞中,冰上放置30分钟。 7. 液氮中冷冻1分钟。 8. 37℃水浴溶化细胞。 9. 加1ml YEP培养基,28℃摇床培养2-4hr(低速)。 10.离心1分钟,悬浮细胞在100ul YEP培养基中。 11.涂板,28℃培养2-3天。 电转农杆菌感受态细胞制备与转化方案二 1. 挑取单克隆接种于2mlYEP(含50mg/l链霉素)液体培养基,28℃,250rpm,振荡培养过夜。(如用5mlYEP,需培养36h) 2. 将菌液按1:100转移至200mlYEP(含50mg/l链霉素)培养液中,28℃,250rpm,振荡培养至OD=0.3(约4~5h)。 3. 转入50ml的无菌离心管,4℃,4000rpm离心10min,弃上清。 4. 用20ml冰浴的HEPES(1mM,PH-7.0)重悬。 5. 4℃,4000rpm离心10min,弃上清。 6. 重复4、5步骤2~3次。 7. 用2ml冰浴的10%甘油重悬。 8. 每管100ul1.5ml无菌的Eppendorf管中,-70℃保存。 1mM HEPES的配制:称取0.119gHEPES(MW 238.3)粉末,加水溶解,定容至500ml,用NaOH调pH至7.0,灭菌后待用。 注: HEPES需现用现配。 电击法转化农杆菌感受态细胞 1. 取出农杆菌感受态细胞于冰上冻融。 2. 加2μl质粒DNA于100μl感受态细胞中,用枪头轻轻搅拌混匀。 3. 取出细胞与质粒的混合物转入电击杯中(电击杯-20℃预冷),在2500V高压下电击。 4.取出电击杯,加入500μl预冷的YEP培养液(不含抗生素),轻轻吹打混匀,吸出菌液转入1.5ml离心管中,28℃,200rpm振荡培养5h。 5. 取30-40μl菌液涂在含相应抗生素的YEP平板上,28℃倒置培养1.5~2d。注: 1. 细胞与质粒的混合物应沿槽壁慢慢加入电击杯中,避免产生气泡。
农杆菌转化法及转基因植物检测方法 摘要:近年来,植物基因工程技术飞速发展,转基因植物在很多领域的研究推广取得了令人瞩目的成绩。植物基因工程中常用的转化方法一般是通过土壤农杆菌系统、植物病毒系统和DNA直接导入法这三种方法进行。另外,转基因技术快速发展的同时转基因植物检测技术也在不断地进歩和完善,目前被广泛应用的转基因植物检测方法有三类:整合水平上的检测、转录水平上的检测和表达水平上的检测。本文着重对农杆菌介导的植物转化方法和转基因植物的检测两方面进行综述。 关键词:农杆菌,转化,转基因植物,检测方法 伴随着生命科学的飞速发展,植物组织培养技术以及植物组织分化、植物基因重组等技术发展迅速并得到广泛应用。1984年转基因烟草的诞生[1],使外源基因导入植物细胞从而获得转基因新品种的设想成为现实。随后,转基因技术被广泛应用于各个方面如:植物新品种的改良、植物性状改良、植物抗性的提高以及植物基因功能的研究等[2-4]。新型转基因大豆、转基因番茄及转基因玉米等转基因新品种陆续面世[5]。植物转基因技术不但能够打破植物的物种界限,还能够使物种基因彼此进行交流。使植物育种年限缩短,植物育种进程加快,植物抗性也在一定程度上得到很大提高,使来自于不同生物种类的优良目的基因导入植物并得到优良植物新品种。同时,运用转基因技术研究植物自身基因结构组成及其基因功能调控等方面也取得了一定成果;运用转基因技术还研制出生物反应器和雄性不育系[6]。 目前,利用转基因技术将目的基因导入植物基因组中的常用方法主要有:土壤农杆菌介导的基因转化、DNA直接导入和植物病毒系统介导法。本文着重介绍土壤农杆菌介导的目的基因转化法,同时也对目前转基因植物的检测进行适当总结。 1 土壤农杆菌介导系统的种类 土壤农杆菌中的发根农杆菌和根癌农杆菌能够侵染植物伤口并形成与土壤农杆菌中大质粒有关的植物肿瘤和冠瘿。能够诱发此类肿瘤的根瘤农杆菌中常常