仪器分析实验 循环伏安法测定电极反应参数
- 格式:pdf
- 大小:932.01 KB
- 文档页数:8

循环伏安法判断电极过程实验报告循环伏安法判断电极过程实验报告引言:循环伏安法是一种常用的电化学测试方法,用于研究电极材料的电化学行为。
本实验旨在通过循环伏安法测定电极材料的氧化还原反应特性,并分析实验结果,探讨其在电化学领域的应用前景。
实验材料与方法:实验所用材料为铂电极和铜电极,实验仪器为循环伏安仪。
首先,将铂电极和铜电极分别清洗并抛光,以确保电极表面的纯净度和光滑度。
然后,将电极插入电解质溶液中,并设置循环伏安仪的扫描速度和电位范围。
接下来,进行循环伏安法测试,记录电流与电位之间的关系曲线。
实验结果与分析:通过循环伏安法测试,我们得到了铂电极和铜电极的电流-电位曲线。
根据曲线的形状和特点,我们可以得到以下结论和分析:1. 铂电极的电流-电位曲线呈现出典型的双电极峰形状,其中一个峰对应氧化反应,另一个峰对应还原反应。
这说明铂电极在测试条件下发生了氧化还原反应,具有良好的电化学活性。
这一特性使得铂电极在催化剂、电池等领域有着广泛的应用前景。
2. 铜电极的电流-电位曲线呈现出单峰形状,没有出现双电极峰。
这说明铜电极在测试条件下只发生了一种氧化还原反应,具有较低的电化学活性。
然而,铜电极在电化学合成、电镀等领域仍然有着重要的应用,其特殊的电化学行为可以被利用。
3. 通过对电流-电位曲线的分析,我们可以得到电极反应的动力学参数,如峰电位、峰电流等。
这些参数可以进一步用于计算电极的表面积、电荷转移速率等重要参数,为电极材料的性能评价提供参考。
结论:本实验通过循环伏安法测试了铂电极和铜电极的电流-电位曲线,并对实验结果进行了分析。
通过曲线的形状和特征,我们可以了解电极材料的氧化还原反应特性和电化学活性。
这对于电化学领域的研究和应用具有重要意义。
循环伏安法作为一种常用的电化学测试方法,具有广泛的应用前景,可以用于研究各种电极材料的性能,并为相关领域的发展提供支持。
总结:循环伏安法是一种重要的电化学测试方法,通过测定电流-电位曲线,可以研究电极材料的氧化还原反应特性和电化学活性。
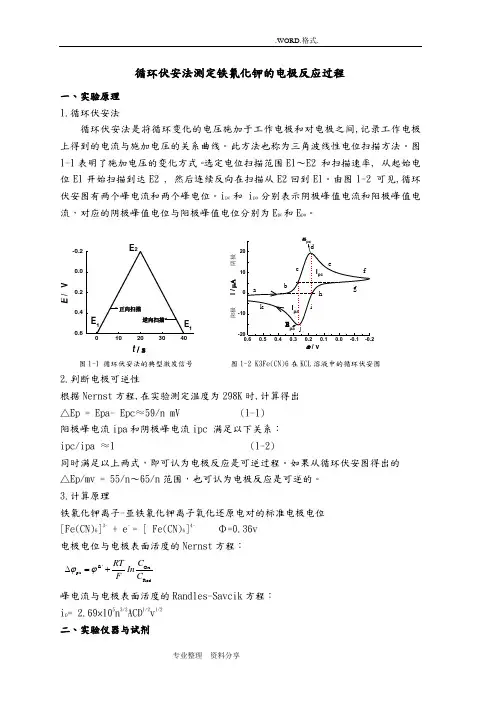
循环伏安法测定铁氰化钾的电极反应过程一、实验原理 1.循环伏安法循环伏安法是将循环变化的电压施加于工作电极和对电极之间,记录工作电极上得到的电流与施加电压的关系曲线。
此方法也称为三角波线性电位扫描方法。
图1-1表明了施加电压的变化方式。
选定电位扫描范围E1~E2 和扫描速率, 从起始电位E1开始扫描到达E2 , 然后连续反向在扫描从E2回到E1。
由图1-2 可见,循环伏安图有两个峰电流和两个峰电位。
i pc 和 i pa 分别表示阴极峰值电流和阳极峰值电流,对应的阴极峰值电位与阳极峰值电位分别为E pc 和E pa 。
图1-1 循环伏安法的典型激发信号 图1-2 K3Fe(CN)6在KCL 溶液中的循环伏安图2.判断电极可逆性根据Nernst 方程,在实验测定温度为298K 时,计算得出 △Ep = Epa- Epc ≈59/n mV (1-1) 阳极峰电流ipa 和阴极峰电流ipc 满足以下关系: ipc/ipa ≈1 (1-2)同时满足以上两式,即可认为电极反应是可逆过程。
如果从循环伏安图得出的 △Ep/mv = 55/n ~65/n 范围,也可认为电极反应是可逆的。
3.计算原理铁氰化钾离子-亚铁氰化钾离子氧化还原电对的标准电极电位 [Fe(CN)6]3- + e - = [ Fe(CN)6]4- Φ=0.36v 电极电位与电极表面活度的Nernst 方程:峰电流与电极表面活度的Randles-Savcik 方程: i p = 2.69×105n 3/2ACD 1/2v 1/2 二、实验仪器与试剂0'Ox pa RedC RTIn F C ϕϕ∆=+E / Vt / s阳极 i / μA 阴极ϕ / v仪器: CHI660电化学工作站,电解池铂盘工作电极铂丝辅助电极Ag/AgCl参比电极。
试剂:铁氰化钾溶液:0.1mol/L;硝酸钾溶液:1.0mol/L三、实验步骤1.Pt工作电极预处理不同粒度的α-Al2O3粉,抛光,洗去表面污物,再超声水浴中清洗,每次2-3分钟,重复三次,得到平滑光洁和新鲜的电极表面。


一、循环伏安法(Cyclic Voltammetry)一种常用的电化学研究方法。
该法控制电极电势以不同的速率,随时间以三角波形一次或多次反复扫描,电势范围是使电极上能交替发生不同的还原和氧化反应,并记录电流-电势曲线。
根据曲线形状可以判断电极反应的可逆程度,中间体、相界吸附或新相形成的可能性,以及偶联化学反应的性质等。
常用来测量电极反应参数,判断其控制步骤和反应机理,并观察整个电势扫描范围内可发生哪些反应,及其性质如何。
对于一个新的电化学体系,首选的研究方法往往就是循环伏安法,可称之为“电化学的谱图”。
本法除了使用汞电极外,还可以用铂、金、玻璃碳、碳纤维微电极以及化学修饰电极等。
1.基本原理如以等腰三角形的脉冲电压加在工作电极上,得到的电流电压曲线包括两个分支,如果前半部分电位向阴极方向扫描,电活性物质在电极上还原,产生还原波,那么后半部分电位向阳极方向扫描时,还原产物又会重新在电极上氧化,产生氧化波。
因此一次三角波扫描,完成一个还原和氧化过程的循环,故该法称为循环伏安法,其电流—电压曲线称为循环伏安图。
如果电活性物质可逆性差,则氧化波与还原波的高度就不同,对称性也较差。
循环伏安法中电压扫描速度可从每秒种数毫伏到1伏。
工作电极可用悬汞电极,或铂、玻碳、石墨等固体电极。
2.循环伏安法的应用循环伏安法是一种很有用的电化学研究方法,可用于电极反应的性质、机理和电极过程动力学参数的研究。
但该法很少用于定量分析。
(1)电极可逆性的判断循环伏安法中电压的扫描过程包括阴极与阳极两个方向,因此从所得的循环伏安法图的氧化波和还原波的峰高和对称性中可判断电活性物质在电极表面反应的可逆程度。
若反应是可逆的,则曲线上下对称,若反应不可逆,则曲线上下不对称。
(2)电极反应机理的判断循环伏安法还可研究电极吸附现象、电化学反应产物、电化学—化学耦联反应等,对于有机物、金属有机化合物及生物物质的氧化还原机理研究很有用。
3、循环伏安法的用途(1)、判断电极表面微观反应过程(2)、判断电极反应的可逆性(3)、作为无机制备反应“摸条件”的手段(4)、为有机合成“摸条件”(5)、前置化学反应(CE)的循环伏安特征(6)、后置化学反应(EC)的循环伏安特征(7)、催化反应的循环伏安特征二、循环伏安法相关问题:1、利用循环伏安确定反应是否为可逆反应(一般这两个条件即可)①.氧化峰电流与还原峰电流之比的绝对值等于1.[有时对同一体系,扫描速率不同也会在一定程度上影响其可逆性的一般而言,扫描速度对峰电位没有影响,但扫描速率越大其电化学反应电流也就越大.]②.氧化峰与还原峰电位差约为59/n mV, n为电子转移量(温度一般是293K).[但是一般我们实验时候不是在这个温度下,因此用这个算是有误差的,一般保证其值在100mv以下都算合理的误差.]2、判断扩散反应或者是吸附反应:改变扫描速率,看峰电流是与扫描速率还是它的二次方根成正比。

线性扫描伏安法与循环伏安法实验**大学本科实验报告专用纸课程名称 仪器分析实验 成绩评定 实验项目名称 线性扫描伏安法与循环伏安法实验 指导教师 实验项目编号 实验项目类型 实验地点 学生姓名 学号 学院 系 化学系 专业 实验时间2015年11月13日下午~11月13日下午 温度 ℃湿度一.实验目的1.掌握线性扫描伏安法及循环伏安法的原理;2.掌握微机电化学分析系统的使用及维护。
3.掌握利用线性扫描伏安法进行定量分析及利用循环伏安法判断电极反应过程。
二.实验原理1. 线性扫描伏安法:线性扫描伏安法是在电极上施加一个线性变化的电压,记录工作电极上的电解电流的方法。
记录的电流随电极电位变化的曲线称为线性扫描伏安图。
⑴可逆电极反应的峰电流如下:c v AD n i p 121351069.2⨯=式中,n 为电子交换数;A 为电极有效面积;D 为反应物的扩散系数;v 为电位扫描速度;c 为反应物(氧化态)的本体浓度。
当电极的有效面积A 不变时,上式可简化为:c Kv i p 1=即峰电流与电位扫描速度v 的1/2次方成正比,与反应物的本体浓度成正比。
这就是线性扫描伏安法定量分析的依据。
⑵可逆电极反应,峰电位与扫描速度无关,nF RT E E p /1.121±=电极反应为不可逆时,峰电位p E 随扫描速度v 增大而负(或正)移。
2. 循环伏安法:循环伏安法的原理与线性扫描伏安法相同,只是比线性扫描伏安法多了一个回扫,所以称为循环伏安法。
循环伏安法是电化学方法中最常用的实验技术,也是电化学表征的主要方法。
循环伏安法有两个重要的实验参数,一是峰电流之比,二是峰电位之差。
对于可逆电极反应,峰电流之比pa pc i i /(阴极峰电流pc i 与阳极峰电流pa i 之比)的绝对值约等于1。
峰电位之差p E ∆(阴极峰电位pc E 与阳极峰电位pa E 之差)约为60mV(25℃),即 nF RT E p /22.2=∆。

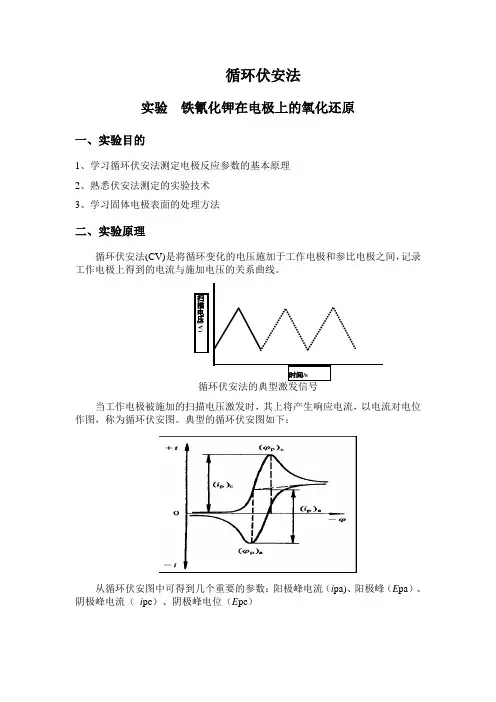
循环伏安法实验 铁氰化钾在电极上的氧化还原一、实验目的1、学习循环伏安法测定电极反应参数的基本原理2、熟悉伏安法测定的实验技术3、学习固体电极表面的处理方法二、实验原理循环伏安法(CV)是将循环变化的电压施加于工作电极和参比电极之间,记录工作电极上得到的电流与施加电压的关系曲线。
循环伏安法的典型激发信号当工作电极被施加的扫描电压激发时,其上将产生响应电流,以电流对电位作图,称为循环伏安图。
典型的循环伏安图如下:从循环伏安图中可得到几个重要的参数:阳极峰电流(i pa)、阳极峰(E pa )、阴极峰电流( i pc )、阴极峰电位(E pc )扫描电压(V)时间/s对可逆氧化还原电对的式量电位E θ’与E pc 和E pa 的关系为:(1)而两峰之间的电位差值为:(2)对铁氰化钾电对,其反应为单电子过程,ΔE p 是多少?从实验求出来与理论值比较。
对可逆体系的正向峰电流,由Randles –Savcik 方程可表示为:i p = 2.69×105n 3/2AD 1/2υ1/2c (3)其中:i p 为峰电流(A ),n 为电子转移数, A 为电极面积(cm 2), D 为扩散系数(cm 2/s),υ为扫描速度(V / s ), c 为浓度(mol/L)。
根据上式,i p 与υ1/2和c 都是直线关系,对研究电极反应过程具有重要意义。
在可逆电极反应过程中,(4)对一个简单的电极反应过程,式(2)和式(4)是判别电极反应是否可逆体系的重要依据。
三、仪器与试剂仪器 CHI660电化学工作站;三电极系统:铂盘电极为工作电极,Ag/AgCl 电极(或饱和甘汞电极)为参比电极,铂电极为对极(铂丝、铂片、铂柱均可); 试剂 1.0x10-3,2.0 x10-3,4.0 x10-3,6.0 x10-3,8.0 x10-3,1.0 x10-2mol/L K 3[Fe(CN)6](铁氰化钾)溶液(含0.2mol/L KCl )。

循环伏安法观察抗坏血酸的电极反应Revised by BETTY on December 25,2020应过程【摘要】循环伏安法(CV)是最重要的电分析化学研究方法之一。
仪器简单、操作 方便、图谱解析直观,在电化学、无机化学、有机化学、生物化学等许多研究领域 被广泛应用,在反应产物的稳定性、电化学-化学偶联反应吸附等方面也是一种有 效的研究手段。
本实验中利用循环伏安法观察Fe (CN) 和抗坏血酸的电极反 应过程,通过实验所得的循环伏安图进行分析两者的电极反应过程,研究二者的可 逆性。
【关键词】循环伏安法、Fe (CN) J _/,_、抗坏血酸、电极反应1、引言循环伏安法就是将线性扫描电位扫到某电位Em 后,再回扫至原来的起始电位 值Ei,电位与时间的关系如图所示。
电压扫描速度可从每秒毫伏到伏量级。
所用的指示电极有悬汞电极、釦电极或 玻璃碳电极等。
当溶液中存在氧化态物质0时,它在电极上可逆地还原生成还原态 物质R :当电位方向逆转时,在电极表面生成的R 则被可逆地氧化为0:循环伏安法一般不用于定量分析,主要用于研究电极反应的性质、机理和电 极过程动力学参数等。
在循环伏安法中,阳极峰电流ipa 、阴极峰电流ipc 、阳极峰电位Epa 、阴极 峰电位Epc 是最重要的参数,对可逆电极过程来说,2FC 时:即阳极峰电势(Epa)与阴极峰电势(Epc)之差为57/n 至63/nmV 之间,确 切地值与扫描过阴极峰电势之后多少毫伏再回扫有关。
一般在过阴极峰电势之后有 足够的毫伏数再回扫,Ep 值为58/nmVo正向扫描的峰电流ip 为:式中,ip 为峰电流(A) : n 为电子转移数;A 为电极面积(cm 2) ; D 为扩散系 数(cm 2/s) ;v 为扫描速度(V/s) ; c 为浓度(mol/L)从ip 的表达式看:ip 与和诂和c 都呈线性关系,对研究电极过程具有重要 意义。
标准电极电势为:所以对可逆过程,循环伏安法是一个方便的测量标准电极电位的方法。

循环伏安法测定电极反应参数一、实验目的:1.学习循环伏安法测定电极反应参数的基本原理及方法2.熟悉循环伏安测定的实验技术以及应用;3.了解扫描速率和浓度对循环伏安图的影响4.掌握实验数据的处理方法二、实验原理循环伏安法(CV法)是最重要的电化学分析研究方法之一,在电化学、无机化学、有机化学、生物化学的研究领域广泛应用。
循环伏安法除了作为定量分析方法外,更主要的是作为电化学研究的方法,可用于研究电极反应的性质、机理及电极过程动力学参数等。
它是以固态电极作工作电极电解被分析物质的稀溶液,并根据电流-电压曲线进行分析的方法。
循环伏安是在工作电极上施加一个线性变化的循环电压(如图1),记录工作电极上得到的电流与施加电压的关系曲线,从而实现对溶液中的电活性物质进行分析。
扫描开始时,从起始电压扫描至某一电压后,再反向回扫至起始电压,构成等腰三角形电压(如图1所示),在选定电位扫描范围E1~E2 和扫描速率后,从起始电位E1(0.8V)开始扫描到达E2(-0.2V), 然后连续反向在扫描从E2(-0.2V)回到E1(0.8V)。
当电位负向扫描时发生反应:O + e == R,电位正向扫描时发生反应:R == O + e,一次扫描过程中完成一个氧化和还原过程的循环,故此法称为循环伏安法。
如图1所示:图1本实验采用循环伏安法测铁氰化钾电极反应参数。
图2为K3Fe(CN)6在KCL溶液中的循环伏安图该图中出现两个峰,负向扫描时发生还原反应:[Fe(CN)6]3-+ e-= [Fe(CN)6]4-,对应峰为阴极峰,所对应电位为阴极峰电位,表示为Epc,所对应电流为阴极峰电流,表示为ipc。
正向扫描时发生氧化反应:[Fe(CN)6]4- == [Fe(CN)6]3-+ e-,对应峰为阳极峰,所对应电位为阳极峰电位,表示为Epa。
所对应电流为阳极峰电流,表示为ipa。
测量确定ip的方法是:沿基线作切线外推至峰下,从峰顶作垂线至切线,其间高度即为ip(见图)。

循环伏安实验报告循环伏安实验报告引言:循环伏安(Cyclic Voltammetry,简称CV)是一种广泛应用于电化学研究的实验技术。
通过在电极上施加一定的电位扫描,测量电流与电位之间的关系,可以获得电极反应动力学和电化学行为的信息。
本实验旨在通过CV技术,研究某种化合物在不同电位下的氧化还原行为,并分析其电化学特性。
实验方法:1. 实验仪器:使用一台循环伏安仪进行实验。
2. 实验电极:选用玻碳电极作为工作电极,银/银氯化银电极作为参比电极,不锈钢电极作为对比电极。
3. 实验溶液:制备待测化合物溶液,并添加适量的电解质以提高电导性。
4. 实验条件:设置扫描速度、起始电位、终止电位等参数,保持实验条件一致。
实验结果与讨论:在实验过程中,我们对待测化合物进行了CV测试,并记录了电流-电位曲线。
通过对曲线的分析,我们得到了以下结论:1. 氧化还原峰的观察:在CV曲线中,我们可以观察到氧化还原峰的出现。
氧化峰对应着化合物从还原态转变为氧化态的过程,而还原峰则表示还原态到氧化态的反应。
通过测量氧化还原峰的位置、峰电流和峰电位差等参数,可以获得化合物的氧化还原反应动力学信息。
2. 电极反应机理的推测:通过分析氧化还原峰的形状和位置,我们可以初步推测化合物的电极反应机理。
例如,如果氧化还原峰对称且位置固定,可能说明电极反应是可逆的;而不对称的峰则可能暗示着化合物的电极反应是不可逆的。
进一步的实验和数据处理可以帮助我们验证这些推测。
3. 电化学活性的评估:CV实验还可以用来评估化合物的电化学活性。
电化学活性是指化合物在电极上发生氧化还原反应的能力。
通过比较不同化合物的峰电流大小,我们可以初步判断它们的电化学活性。
峰电流越大,表示化合物的电化学活性越高。
4. 影响实验结果的因素:CV实验的结果受到多种因素的影响,如扫描速度、电解质浓度、电极材料等。
这些因素会改变氧化还原峰的形状、位置和峰电流大小。
因此,在进行CV实验时,需要注意控制这些因素,以保证实验结果的准确性和可重复性。

实验十循环伏安法分析一、实验目的1.仔细阅读理解本讲义和相关资料,掌握循环伏安法的基本原理。
2.熟练使用循环伏安法分析的实验技术。
二、实验原理循环伏安法(Cyclic Voltammetry, 简称CV)往往是首选的电化学分析测试技术,非常重要,已被广泛地应用于化学、生命科学、能源科学、材料科学和环境科学等领域中相关体系的测试表征。
现代电化学仪器均使用计算机控制仪器和处理数据。
CV测试比较简便,所获信息量大。
采用三电极系统的常规CV实验中,工作电极(The Working Electrode, 简称WE)相对于参比电极(the Reference Electrode,简称RE)的电位在设定的电位区间内随时间进行循环的线表1. 图1的实验条件和一些重要解释零,所以RE的电位在CV实验中几乎不变,因此RE是实验中WE电位测控过程中的稳定参比。
若忽略流过RE上的微弱电流,则实验体系的电解电流全部流过由WE和对电极(The Counter Electrode,简称CE)组成的串联回路。
WE和CE间的电位差可能很大,以保证能成功地施加上所设定的WE电位(相对于RE)。
CE也常称为辅助电极(The Auxiliary Electrode, 简称AE)。
分析CV实验所得到的电流-电位曲线(伏安曲线)可以获得溶液中或固定在电极表面的组分的氧化和还原信息,电极|溶液界面上电子转移(电极反应)的热力学和动力学信息,和电极反应所伴随的溶液中或电极表面组分的化学反应的热力学和动力学信息。
与只进行电位单向扫描(电位正扫或负扫)的线性扫描伏安法(Linear Scan Voltammetry,简称LSV)相比,循环伏安法是一种控制电位的电位反向扫描技术,所以,只需要做1个循环伏安实验,就可既对溶液中或电极表面组分电对的氧化反应进行测试和研究,又可测试和研究其还原反应。
循环伏安法也可以进行多达100圈以上的反复多圈电位扫描。
循环伏安法测定亚铁氰化钾的电极反应过程一、实验目的(1) 学习固体电极表面的处理方法; (2) 掌握循环伏安仪的使用技术;(3) 了解扫描速率和浓度对循环伏安图的影响二、实验原理铁氰化钾离子[Fe(CN)6]3--亚铁氰化钾离子[Fe(CN)6]4-氧化还原电对的标准电极电位为[Fe(CN)6]3- + e -= [Fe(CN)6]4- φθ= 0.36V(vs.NHE) 电极电位与电极表面活度的Nernst 方程式为 φ=φθ+ RT/Fln(C Ox /C Red )-0.20.00.20.40.60.8-0.0005-0.0004-0.0003-0.0002-0.00010.00000.00010.00020.0003i pai pcI /m AE /V vs.Hg 2Cl 2/Hg,Cl-在一定扫描速率下,从起始电位(-0.20V)正向扫描到转折电位(0.80 V)期间,溶液中[Fe(CN)6]4-被氧化生成[Fe(CN)6]3-,产生氧化电流;当负向扫描从转折电位(0.80V)变到原起始电位(-0.20V)期间,在指示电极表面生成的[Fe(CN)6]3-被还原生成[Fe(CN)6]4-,产生还原电流。
为了使液相传质过程只受扩散控制,应在加入电解质和溶液处于静止下进行电解。
在0.1MNaCl 溶液中[Fe(CN) 6]4-]的扩散系数为0.63×10-5cm.s -1;电子转移速率大,为可逆体系(1MNaCl 溶液中,25℃时,标准反应速率常数为5.2×10-2cm·s -1)。
溶液中的溶解氧具有电活性,用通入惰性气体除去。
三、仪器与试剂MEC-16多功能电化学分析仪(配有电脑机打印机);玻碳圆盘电极(表面积0.025 cm 2)或铂柱电极;铂丝电极;饱和甘汞电极;超声波清洗仪;电解池;氮气钢瓶。
容量瓶:250 mL 、100mL 各2个,25 mL 7个。