
**大学本科实验报告专用纸
课程名称 仪器分析实验 成绩评定 实验项目名称 线性扫描伏安法与循环伏安法实验 指导教师 实验项目编号 实验项目类型 实验地点 学生姓名 学号 学院 系 化学系 专业 实验时间2015年11月13日下午~11月13日下午 温度 ℃湿度
一.实验目的
1.掌握线性扫描伏安法及循环伏安法的原理;
2.掌握微机电化学分析系统的使用及维护。
3.掌握利用线性扫描伏安法进行定量分析及利用循环伏安法判断电极反应过程。
二.实验原理
1. 线性扫描伏安法:
线性扫描伏安法是在电极上施加一个线性变化的电压,记录工作电极上的电解电流的方法。记录的电流随电极电位变化的曲线称为线性扫描伏安图。 ⑴可逆电极反应的峰电流如下:
c v AD n i p 121351069.2?=
式中,n 为电子交换数;A 为电极有效面积;D 为反应物的扩散系数;v 为电位扫描速度;c 为反应物(氧化态)的本体浓度。当电极的有效面积A 不变时,上式可简化为:c Kv i p 21=
即峰电流与电位扫描速度v 的1/2次方成正比,与反应物的本体浓度成正比。这就是线性扫描伏安法定量分析的依据。 ⑵可逆电极反应,峰电位与扫描速度无关,nF RT E E p /1.121±= 电极反应为不可逆时,峰电位p E 随扫描速度v 增大而负(或正)移。
2. 循环伏安法:
循环伏安法的原理与线性扫描伏安法相同,只是比线性扫描伏安法多了一个回扫,所以称为循环伏安法。循环伏安法是电化学方法中最常用的实验技术,也是电化学表征的主要方法。循环伏安法有两个重要的实验参数,一是峰电流之比,二是峰电位之差。对于可逆电极反应,峰电流之比pa pc i i /(阴极峰电流pc i 与阳极峰电流pa i 之比)的绝对值约等于1。峰电位之差p E ?(阴极峰电位pc E 与阳极峰电位pa E 之差)约为60mV(25℃),即 nF RT E p /22.2=?。
三.仪器与试剂
1.仪器:电化学分析系统,三电极系统:玻碳电极为工作电极,饱和甘汞电极为参比电极,铂电极为辅助电极。
2.试剂:3-
10
0.1?mol/L K3[Fe(CN)6]溶液(含0.1mol/L的KCl的支持电解质)。四.实验内容与步骤
选择仪器使用方法:电位扫描技术—线性扫描伏安法或循环伏安法。
参数设置:线性扫描伏安法—初始电位,0.60V;终止电位,-0.12V;扫描速度根据实验需要设定;灵敏度选择10-4A;滤波参数,50Hz;放大倍数,1。
循环伏安法—初始电位,0.60V;终止电位,0.60V;扫描速度根据实验需要设定;灵敏度选择10-4A;滤波参数,50Hz;放大倍数,1。
1.线性扫描伏安法实验:
⑴以3-
10
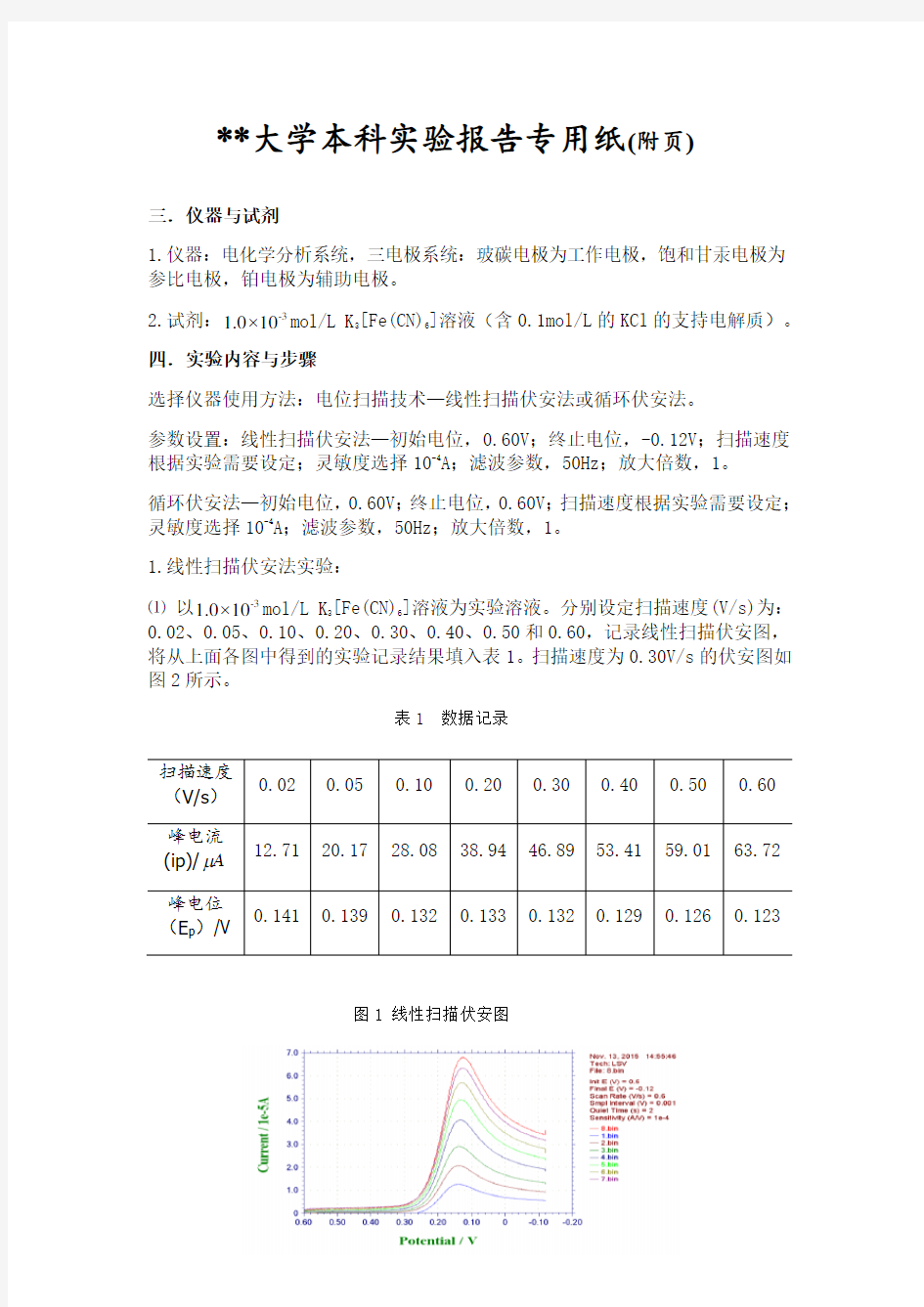
0.1?mol/L K3[Fe(CN)6]溶液为实验溶液。分别设定扫描速度(V/s)为:0.02、0.05、0.10、0.20、0.30、0.40、0.50和0.60,记录线性扫描伏安图,将从上面各图中得到的实验记录结果填入表1。扫描速度为0.30V/s的伏安图如图2所示。
表1 数据记录
图1 线性扫描伏安图
扫描速度
(V/s)
0.02 0.05 0.10 0.20 0.30 0.40 0.50 0.60
峰电流
(ip)/Aμ12.71 20.17 28.08 38.94 46.89 53.41 59.01 63.72 峰电位
(E p)/V
0.141 0.139 0.132 0.133 0.132 0.129 0.126 0.123
图2 0.30V/s线性扫描伏安图
⑵配制系列浓度的K
3[Fe(CN)
6
]溶液(mol/L)(含0.1mol/L的KCl):3-
10
0.1?、
3-
10
0.2?、3-
10
0.4?、3-
10
0.6?、3-
10
0.8?、2-
10
0.1?。固定扫描速度为0.10V/s,记录各个溶液的线性扫描图。将各实验结果填入表2中。
表2 数据记录
图3 0.10V/s线性扫描伏安图
浓度/
(mol/L)
3-
10
0.1?3-
10
0.2?3-
10
0.4?3-
10
0.6?3-
10
0.8?2-
10
0.1?
峰电流
(ip)/Aμ
28.08 55.23 105.1 151.4 194.0 234.3
2.循环伏安法实验:
以3-100.1?mol/L K 3[Fe(CN)6]溶液为实验溶液,改变扫描速度,将实验结果填入
表3中。扫描速度为0.10V/s 的循环伏安图如图5所示。
图4 循环伏安图
表3 数据记录
图5 0.10V/s 循环伏安图 扫描速度
(V/s ) 0.02
0.05 0.10 0.20 0.30 0.40 0.50 0.60 峰电流之比
(i p /i pa )/A μ
1.008 1.015 1.013 1.012 1.013 1.022 1.019 1.016 峰电位之差
(p E ?)/mV 68 68 76 81 86 94 98 96
五.数据处理及结果分析
1.将表1中的峰电流对扫描速度v的2/1次方作图(21v
)得到一条直线,说
i
p
明什么问题?
峰电流与扫描速度v的2/1次方成正比,说明电极电流是扩散控制。
-v),并根据曲线解释电极过程。
2.将表1中的峰电位对扫描速度作图(E
P
峰电位E P随扫描速度增大而负移,说明电极反应为不可逆过程。
3.将表2中的峰电流对浓度作图(ip-c)将得到一条直线。试解释之。
在一定的扫描速度下,峰电流与浓度成正比,灵敏度高。
4.表3中的峰电流之比值几乎不随扫描速度的变化而变化。并且接近于1,为什么?
还原峰电流i pc 与氧化峰电流i pa 之比i pc /i pa ≈1,可判断此反应为可逆反应。
5.以表3中的峰电位之差值对扫描速度作图(p E ?-v ),从图上能说明什么问题?
p E ?远大于60mV ,故判断此反应不可逆。
六.思考题
1.请就图5简述循环伏安法的原理,步骤及各部分曲线的含义。
答:电流电压曲线包括两个分支,前半部分电位向阴极方向扫描,电活性物质在电极上还原,产生还原波,后半部分电位向阳极方向扫描时,还原产物又重新在电极上氧化,产生氧化波。因此一次三角波扫描,完成一个还原和氧化过程的循环,该法称为循环伏安法,其电流—电压曲线称为循环伏安图。如果电活性物质可逆性差,则氧化波与还原波的高度就不同,对称性也较差。
2.简述可逆电极过程的诊断标准。
答:还原峰电流i pc 与氧化峰电流i pa 之比i pc /i pa ≈1,氧化峰与还原峰峰电位之
差p E ?约为60mV (25℃),则电极反应为可逆过程。
3.简述利用线性扫描伏安法进行定量分析的理论依据。 答:可逆电极反应的峰电流如下:c v AD n i p 21212351069.2?= 式中,n 为电子交换数;A 为电极有效面积;D 为反应物的扩散系数;v 为电位扫描速度;c 为反应物(氧化态)的本体浓度。当电极的有效面积A 不变时,上式可简化为:c Kv i p 21=
即峰电流与电位扫描速度v 的1/2次方成正比,与反应物的本体浓度成正比。这就是线性扫描伏安法定量分析的依据。