
无机化学习题参考答案(II)
第一章
1.4.解:
(1)H 2O 2
2C
(2)S 2O 32
3v C
(3)N 2O (N
N O 方式) v C ∞
(4)Hg 2Cl 2
h D ∞
(5)H 2C=C=CH 2 2d D (6)UOF 4 C 5v (7)BF 4
d T (8)SClF 5
4v C (9)反-Pt(NH 3)2Cl 2 2h D
(10)PtCl 3(C 2H 4)
2v C
1.B(CH 3)3和BCl 3相比,哪一个的Lewis 酸性强,为什么?
一般来说,CH 3为推电子基团,Cl 为吸电子基团,因此的Lewis 酸性强。 (BCl 3易水解;B(CH 3)3不溶于水,在空气中易燃)
2.BH 3和BF 3都可和(CH 3)2NPF 2生成加合物,在一种加合物中,B 原子和N 相连,另一种则和P 相连,绘出两种结构式,并说明形成两种结构的原因。
P
F
F
H 3C CH 3
N
P
F F H 3C
CH 3
N
B B
H 3F 3
(该题可参考史启桢等翻译的"无机化学",作者Shriver 等,由高教社出版, 其中关于热力学酸度参数的部分,p.190-191; 或者该书的英文原版第5章的相关内容)
3. 无水AlCl 3可作为傅-克烷基化反应的催化剂, 而吸水后则失效, 原因何在? 配位饱和(6配位),失去Lewis 酸性
4. 吸水后失效 的AlCl 3有什么方法可以脱水?
因为Al 3+是典型的硬酸,与氧的亲合力很强,因此实验室不能在HCl ,NH 4Cl ,SOCl 2等气氛下加热脱水。(只能加强热生成 Al 2O 3后,用高温下用加C 和Cl 2用还原氯化法制备,这就不是脱水方法了)。
第二章
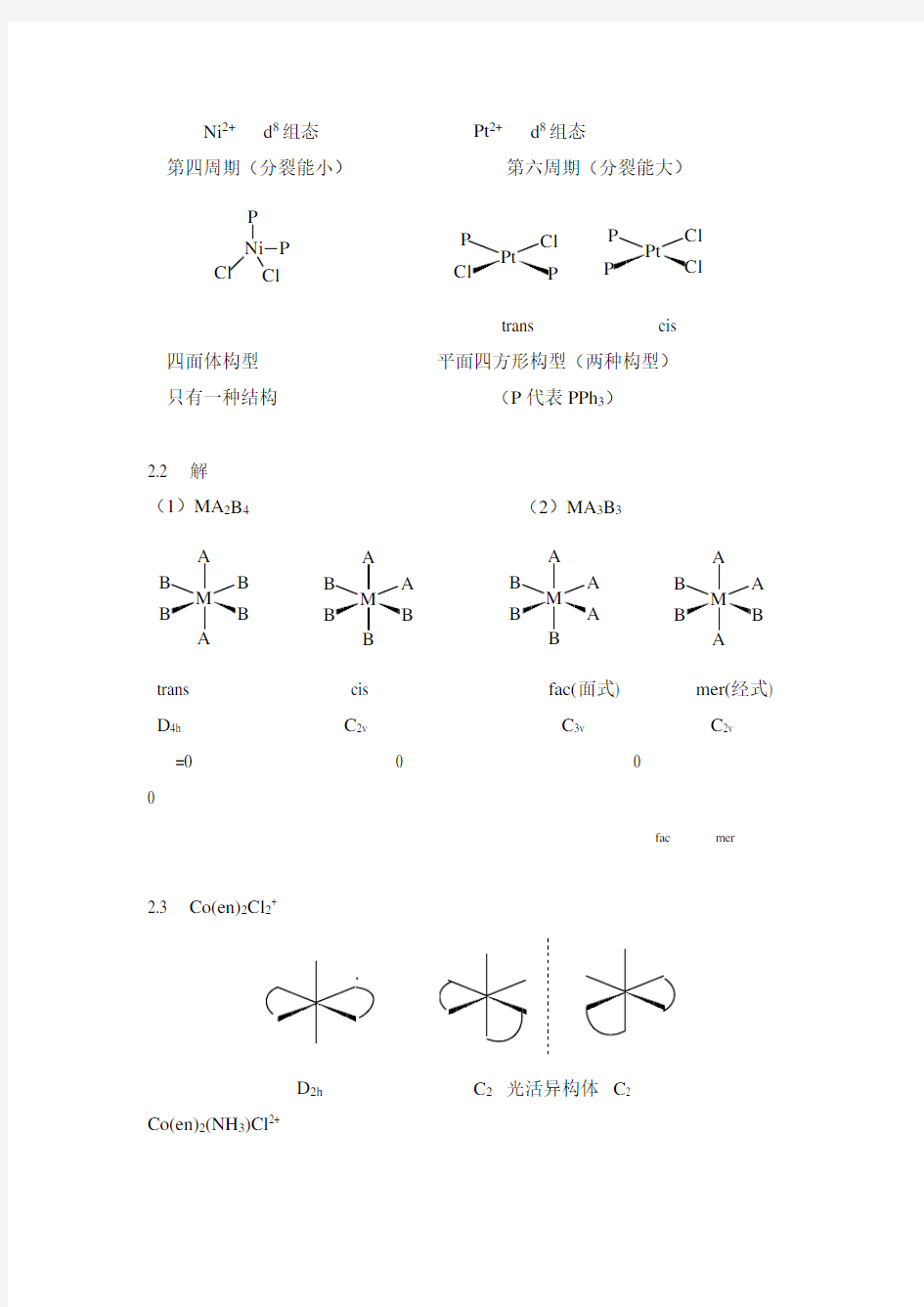
2.1 解:
Ni 2+ d 8组态
Pt 2+ d 8组态 第四周期(分裂能小)
第六周期(分裂能大)
P Ni Cl
P Cl
Pt
Cl Cl
Pt
Cl Cl
P P
P
P
trans cis
四面体构型 平面四方形构型(两种构型) 只有一种结构 (P 代表PPh 3)
2.2 解 (1)MA 2B 4
(2)MA 3B 3
M A A
B B
B
B M A
B
A B
B
B M A
B
A A
B
B M A A
A B
B
B
trans cis fac(面式) mer(经式) D 4h C 2v C 3v C 2v =0 0 0
fac
mer
2.3 Co(en)2Cl 2+
D 2h
C 2 光活异构体 C 2
Co(en)2(NH 3)Cl 2+
Cl NH3Cl
NH 3
Cl
H3N
trans cis Co(en)(NH3)2Cl2+
NH3
NH3Cl
Cl
Cl
NH3
Cl
NH3
Cl
NH3
Cl
NH3
Cl
Cl
NH3
NH3
trans(1) trans(2) cis
2.4 Co(en)33+Ru(bipy)32+手性分子
D3D3
PtCl(dien)+
Cl
N
N N
dien HN
CH2
CH2CH2NH
2
NH2
CH2
基本上为平面分子,无手性
2.5 (1) 分别用BaCl2溶液滴入,有白色沉液出现的为[Co(NH3)5Br]SO4,或分别加入AgNO3溶液,产生浅黄色沉淀的为[Co(NH3)5SO4]Br。
(2)等物质量的异构体中分别加入过量AgNO3,产生少量沉淀(1molAgCl↓)的为前者(摩尔比为2:1),产生大量沉淀(2molAgCl↓)的为后者。
或用电导方法测量,前者和后者的电导比为2:3
(3)[Co(H2O)4Cl2]+
顺式C2v、反式D4h,对称性不同,偶极矩不同,可以用物理方法鉴别,例如红外或Raman光谱不同。
2.6 8个CN-基团在化合物中的化学环境是完全等同的,可能的结构是四方反
棱柱和四方棱柱构型,不可能是12面体(D2d点群),实验证明是四方反棱柱。
2.7 根据HSAB的协同作用(symbiotic)原理,软配体可使中心金属变软,反之亦然,CN是软配体,NH3是硬配体。桥连配体NCS中S比N软,因此分子结构为:
(H3N)5Co-NCS-Co(CN)5
2.8 同上题,桥连配体NC中C比N软,因此,分子结构为:
Co(NH3)5-NC-Co(CN)5
2.9 AgO晶体中的Ag(Ⅱ)实际上是Ag(Ⅰ)和Ag(Ⅲ)混合而成,
d10 的Ag(I)为sp杂化,直线型
d8的Ag(Ⅲ)倾向dsp2杂化,以获得更多的晶体场稳定化能,因此为平面四方。COL ICSD Collection Code 202055
DATE Recorded Dec 19, 1988; updated Aug 1, 1989
NAME Silver(I,III) oxide - tetragonal
FORM Ag O
= Ag O
TITL Structure and magnetic properties of tetragonal Silver(I,III)
oxide Ag O
REF Journal of Solid State Chemistry
JSSCB 65 (1986) 225-230
REF Journal of Solid State Chemistry
JSSCB 68 (1987) 380
AUT Yvon K, Bezinge A, Tissot P, Fischer P
CELL a=6.883(3) b=6.883(3) c=9.122(4) ?90.0 ?90.0 ?90.0
V=432.2 Z=16
SGR I 41/a Z (88) - tetragonal
CLAS 4/m (Hermann-Mauguin) - C4h (Schoenflies)
PRS tI32
ANX ABX2
PARM Atom__No OxStat Wyck -----X----- -----Y----- -----Z----- -SOF-
Ag 1 3.000 8c 0. 0. 0.
Ag 2 1.000 8d 0. 0. 1/2
O 1 -2.000 16f 0.0798(3) 0.0130(5) 0.2128(3)
WYCK f d c
ITF Ag 1 U=0.0168(8)
ITF Ag 2 U=0.0058(6)
ITF O 1 U=0.0066(4)
REM NDP (neutron diffraction from a powder)
RVAL 0.066
2.10 Mn(CO)5(NO) (1)C4v
(2)Co(PPh2Me)2(NO)Cl2
C2v C2v C1 C1 (对映体的点群不变,未给出)
(3)[Fe(CO)
4
(CN)]-
C2v C3v
(4)Ni(PPhMe2)2
Br3
C2v C s D3h
(5)Ru(PPh3)3Cl
2
D3h C s C2v
(6)VOCl42
Cl Cl
Cl
Cl
Cl
C3v C2v
第三章习题
3.1 3-6Fe(CN)
3+26Fe(H O)
3+Fe 为d 5,CN
-
强场配体 H 2O 为弱场配体
∴3-6Fe(CN)为LS
3+26Fe(H O)为HS
有一个未成对电子
有五个未成对电子
d 8 Ni(CN)42
NiCl 42
CN
-
强场 LS
Cl -
弱场 HS
平面四方
四面体
3.2 Ni 2+为d 8组态第四周期
Pt 2+ 为d 8组态,第六周期 按照g f ?=?
g 为金属离子的性属,周期数越高,g 因子越大 ∴Pt 2+的g 因子大于Ni 2+的g 因子。
?( PtCl 42) > ? (NiCl 42)
分裂能?大,容易形成平面四方构型,?小,则为四面体构型 3.5
(1)2p 1 L=1, 1
2
S =
, 基谱项 2P (2)2p 2 L=1, S=1, 基谱项 3P (3)2d 1
L=2, 1
2S =
, 基谱项 2D (4)2d 3 L=3, 3
2S =, 基谱项 4F
(5)3d 5 L=0, 5
2
S =, 基谱项 6S
(6)3d 9 与3d 1类似 L=2, 1
2S =, 基谱项 2D
3.6 CoF 63中,Co 3+的电子组态为d 6,高自旋(弱场配体)
∴在T -S 图中,允许在跃迁是5T 2g 5
E g ,只有一个吸收带。
3.7 1017600cm -?=
1918cm B -=
Cr(H 2O)63+中Cr 3+为d 3组态 从T -S 图上得到: 可能的两个允许跃迁为4A 2
4
T 2 4A 214T →
0/17600/91819.2B ?==
在横轴上找到19.2的点,作垂线与4T 2和4T 1分别相交于E/B=28.5和E/B=19.5两点。
∴E 1/B=28.5 E 1=28.5×918=26200(cm 1
)
E 2/B=19.5
E 2=19.5×918=17901(cm
1
)
3.8 (1)LS
Rh(NH 3)63+
d 6组态 强场
1
A 1g
(2)Ti(H 2O)63+
d 1
2
T 2g
(3)Fe(H 2O)63+
d 5
HS ,弱场
6
A 1g 3.9 CrL 6
d 3
LMCT 光谱
(a )4A 2g →4T 2g (4F)(低能量峰)
4
A 2g →4T 1g (4F)(高能量峰)
(b ) en
ox 2
F
配位场强度减弱
F 的配位场强度最弱,在T-S 图中偏左,∴有可能得4A 2g →4T 1g (4P)的跃迁 3.10 Mn 2+为d 5,H 2O 为弱场配体
d 5弱扬,基谱项为六重态的6A 1,而高能级谱项中没有相应的六重态谱项,∴没有自旋允许的跃迁。
Cr(aq)3+为d 3,弱场
允许的电子跃迁有4A 2→4T 1,4A 2→T 1,吸收光谱在能量较低的可见光区,∴有色。
3.11 d 2组态的金属含氧酸根离子
+4 +5 +6 +6
CrO 44, MnO 43,FeO 42和RuO 42, 四周期 四周期 四周期 五周期
氧化态和所在周期的位置对下列性质有影响 (1)RuO 42的t ?最大,CrO 44的t ?最小。
(2)FeO 42有最短的M -0键,∵Fe(Ⅵ)离子半径最小
r Fe(Ⅵ)< r Mn(Ⅴ)< r Cr(Ⅳ) (3)是LMCT
第四章习题
4.1 进入基团y 不同而反应速率相同,说明反应与y 无关,速控步为离去基团的解离,因此反应属于S N 1反应,即离解机理,或D 机理。 4.2
Pt
Cl
Cl Cl Cl
NH 3
Cl
Pt
NH 3Cl
Cl Pt
NO 2
Cl Cl
NH 3NO 2-NO 2-NO 2H 3N
Cl
Pt
Cl
Cl Cl Cl
Cl
Pt
NO 2Cl
Cl NH 3
Pt
Cl cis
trans
2-
--
-
2-2-
∵ 反位效应的顺序为: NO 2 Cl NH 3
4.3 (1)
PR 3PR 3
PR 3PR 3PR 3
Cl Cl
-
Cl
-
PR 3PR Cl cis
2+
+
cis- PtCl 2(PR 3)2 反位效应 PR 3>Cl -
(2) . trans-PtCl 2(PR 3)2 反位效应 PR 3>Cl -
Cl Cl Cl PR 3Cl PR 3PR 3
PR 3
trans
2--
反位效应PR 3>Cl - (3)
py Cl -Cl -NH 3
3
NH 3NH 3
Cl
Pt
NH 3Cl
Pt
py
2++
∵反位效应Cl->NH3≥py
4.5 速率=k1[Au(dien)Cl2+]+k2[Au(dien)Cl2+][Cl*-]
取代反应中存在两种机理①前一项表示S N1反应,即单分子反应的离解机理,②后一项表示双分子取代的缔合机理。
注:k1通常溶剂合作用的过程,表现为离解机理
(1)
Cl
N
Cl
N
+2
* S Cl*-
-S
-Cl-
+2(2)
Cl
N
Cl
N
+2*
Cl*
--Cl-+2
4.6 2+2+3+3+3+
2626363636
Mn(H O) > Ni(H O) > Ir(NH) > Rh(NH) > Co(NH)活性逐渐减小d5(HS) d8d6(LS) d6(LS) d6(LS)
第5章习题
5.1 o
250C
3343B(OCH )+4NaH NaBH +3NaOCH ???→
252(C H )O
342644BF +3NaBH 2B H +3NaBF ????→
由B 2H 6再制备其它高级硼烷和衍生物
例:o
120C
2641022B H B H +H ???→
o 120C
41051125 B H 4 B H +3 H ???→
4262121222 NaBH +5 B H Na [B H ]+13 H →
5.2 (n+x)中的x 骨架电子对数 (1) B 5H 9 B 5H 5+4 2 5+2 (2) B 5H 11
B 5H 5+6
3 5+3 (3) -1
38B H
-1
33+5B H 3 3+3 (4) Na 2[B 10H 10] 2-1010B H
1
10+1
(5) C 2B 4H 6
~B 6H 6+2
1
6+1
(1个C ≈1个B+1个e) (6) C 2B 4H 8
~B 6H 6+4
2
6+2
5.3 B 4H 10 B 4H 4+6
n+3 蛛网式
B 5H
9
B 5H 5+4 n+2 巢式
4个 3c -2e BHB 8e
B 5H 11 B 5H 5+6 n+3 开式
2个 3C -2e BBB 4e 3个 3C -2e BHB 6e 2个 BH 4e 3个 BH 2 12e
26e
5.4 21010B H -
n+1 闭式
2-1012B H n+2 巢式(开式)
21012B H -
n+3
蛛网式
参看表5.4, B 原子个数为10的横排 5.6
(1)1,5-C 2B 3H 5
n+1
闭式
(2)1,2-C 2B 4H 6
n+1
闭式
(3)2,3-C2B4H8
n+2 开式
(4)-13+2-
48
Cp Co B H
n+3 网式
问题:
H的位置
Co3+或Co+? B4H8n+2
面顶棱
F + V = E + 2
5.7 A S4类P4四面体4+4 = 6+2
4
6
Te 三枝柱5+ 6 = 9 + 2
C8H8立方烷 6 + 8 = 12 + 2
第6章习题
6.1
CH3
Al
3 CH33
Al H3C
H3C
Al
Me
Me
Me
Me
Me
Me
Me
Me
Me
3c-2e桥键空间位阻大,形成单体
6.3
(1) Si(CH 3)4 P b (CH 3)4
热分解较难
热分解较易
因为Si -C 键较强 Pb -C 键较弱
(2) Li 4(CH 3)4 B(CH 3)3
Si(CH 3)4
Si(CH 3)3Cl
Lewis 酸性 B(CH 3)3 > Li 4(CH 3)4 > Si(CH 3)3Cl >Si(CH 3)4
单体
多聚
错误较多。Li 4(CH 3)4多聚体缓和了缺电子性。
(3) N(CH 3)3和As(CH 3)3 Lewis 碱性:
对H +等硬酸,N(CH 3)3 > As(CH 3)3 ∵N 的电负性较大
对有机金属化合物等软酸,As(CH 3)3 > N(CH 3)3 ∵As 比N 软,与软酸的结合能力强。
错误较多。对于Lewis 酸碱,可根据物质的性质分为软性和硬性,因而在比较酸碱性时也需要分类进行对比。 6.5
V(CO)6 17e
不符合18e 规则
Cr(CO)6 18e Fe(CO)5 18e Ni(CO)4
18e
Mn(7e),Tc(7e),Re(7e),Co(9e),Rh(9e),Ir(9e),价电子数均为单数,要满足18e 构型,不可能为单核羰基化合物
6.6 CO 和d 区金属成键时,金属次外层轨道上有参与成键d 电子作为价电子,可以反馈到CO 的
*轨道上,而BF 3等p 区元素则没有价电子形成反馈键,因
此不能与CO 形成稳定化合物。
6.7 -6V(CO), +
6Mn(CO), 6Cr(CO)
反馈电子多 反馈电子最少 反馈电子越多,CO 的
*越强,C -O 越弱
∴ CO 的振动频率+-666Mn(CO)>Cr(CO)>V(CO)
6.9 由IR 吸收峰,推测其有端羰基,边桥羰基和面桥羰基
M 1-CO M 2-CO M 3-CO
平均每个Co 周围的价电子总数为18。 化学式为:Co 3(
1
CO)6(
2
CO)3(
3
CO)-
CO
CO CO Co
Co
Co
CO
CO CO CO
OC
OC -
*6.10 错误较多。许多学生从化学环境上分析,而不是根据对称性(点群)分析。 Cis -Mo(CO)4(P(OPh)3)2为C 2v 点群,前一个图,3个吸收峰
trans -Mo(CO)4[P(OPh)3]2为D 4h 点群,对称性高,1个吸收峰 具体推导如下: C 2v E C 2 v σ 'v σ
A 1 1 1 1 1 11
(4022)24A =+++=
A 2
1 1
-1
-1
21
(4022)04A =+--=
B 1
1 -
1
1 -1
11
(4022)14B =++-=
B 2
1 -
1
-1 1
21
(4022)14
B =+-+=
()Γ不动 4 0
2
2
1122A
B B Γ=++(不可约) IR 活性 三种表示可均为IR 活性,3个到4个吸收峰 同理可推出D 4h 点群
E 2C 4 C 2 '
22C ''
22C
i 2S 4 h σ 2v σ 2d σ
()Γ不动
4
2 0 0
4
2 0
11
(4444)116
g A =
+++= A 2g =0 B 1u =0 B 1g =1 B 2u =0 B 2g =0
En=1
Eg=0
11()g g u A B E Γ=++不可约表示
A 1u =0 x,y, IR A 2u =0
只有E u 表示有IR 活性
∴只有一个吸收峰 6.11 部分学生认为
1也表示桥键。
(1) 低温时1H 有两种不同的化学环境(顺、反),被“冻结”,因此应有二个
NMR 的信号,温度升高后,基团的转换速率加快,超过了NMR 的时标,因此只观察到一个峰。 (2) 结构图:
Mo Mo CO OC OC
OC
CO
CO
CO
OC
OC
OC Mo Mo
CO CO
cis
trans
6.12
N 2 可以有端基和侧基两种配位方式,与CO 相同,但配位能力比CO 弱得多。N 2是CO 的等电子体,配位时提供2个e ,与CO 相同
NO ,与金属形成直线型的M —N —O ,NO 提供3个电子;与金属形成弯曲
型的 M
N
O
,NO 提供1个电子
CN 是CO 的等电子体,配位能力很强,与CO 不同的是CN 主要与金属阳离子配位,因为CN 是带负电的阴离子。
错误较多。CN通常形成静电型的经典配合物。
RNC,异睛配体,类羰基配体,提供2个电子,可形成端基和桥基配体,RNC比CO极性强,形成的σ?π配键中,以σ键为主
第7章习题
7.1 (1)CpTa(CO)46+4+8=18e
(2)Cp2Ru2(CO)4Ru-Ru 8+1+5+4=18部分学生计算双核的电子数为34e,导出单核为17e。
(3)PtCl3(C2H4)116e
(4)CpFe(CO)2(C2H4)+18e
(5)Pt(PPh3)2(C2Ph2) 16e许多学生认为C2Ph2提供4e。
(6)(4-C7H8)Fe(CO)318e
(7)(CO)5W=CMe(OMe) 18e (亚甲基化学物)
(8)Cp2(Me)Ta=CH218e (亚甲基化合物)错误较多。考虑价态时出现错误。
7.2 画结构时错误较多。如:与是由差别的。表示5-Cp,
而表示1-Cp。
(1)(3-C7H7)( 5-C5H5)Fe(CO) 18e
Fe
CO
(2)(1-C5H5)( 5-C5H5)Be 8e和( 5-C5H5)2Be 12e 参考p.182
Be
Be
(3)(1-C 5H 5)2(5
-C 5H 5)2Ti 16e
(4)(
3
-C 3H 5)(
5
-C 5H 5)Mo(CO)2 18e
Mo CO
OC
(5)(CO)5MoCH(OH) 18e
H OC OC
CO
C CO
CO Mo OH OC OC
CO
CO
CO Mo OH H C
类亚甲基化合物 卡宾化合物
(6)(PMe 3)(CO)3ClCrCMe
OC OC
Cl CMe CO
PMe 3
Cr
类次甲基化合物或卡拜化合物
7.3 Fe(C 5H 5)2(CO)n 的结构式可能为
(1-C 5H 5)(
5
-C 5H 5)Fe(CO)2
1
H 的NMR 证明为此结构
(3-C 5H 5)2Fe(CO)2 (1-C 5H 5)( 3-C 5H 5)Fe(CO)3 (3-C 5H 5)( 5-C 5H 5)Fe(CO)
(
3
-C 5H 5)2(
1
-C 5H 5)2Fe(CO) 7.5 (1)FeCl 2+2(
1
-C 5H 5)MgBr
(
5
-C 5H 5)2Fe+MgCl 2+MgBr 2
(2)3+-3
4
65Li(SiPh )
Et O BF Mo(CO)(CO)Mo=????→C(OEt)(SiPh 3) (3)[Cp(CO)2Mn ≡CPh]++Cl
Cp(CO)ClMn ≡CPh + CO (p.190)
18e (取代 ) 18e 7.6 错误较多。成键类型与配体类型混淆。如:有人将6
-C 6H 6和
5
-C 5H 5的
成键类型写为“酸键”,或写成“
配键”。
(1)Fe(CO)4(C 2H 4) Fe -CO , σ-π配键
Fe
CH 2CH 2
σ-π配键
(2)(6-C 6H 6)2Cr Cr 与苯环为σ-π配键
(3)(
1
-C 5H 5)(
5
-C 5H 5)3Zr Zr -C(
1
-C 5H 5) 键
Zr -C(
5
-C 5H 5) σ-π配键 (4)Ni(CNCMe 3)2(C 2Ph 2)
Ni -CNCMe 3
σ-π配键
CPh CPh
Ni
σ-π配键 (5)(CO)5Cr=C(OMe)(Ph) Cr -CO
σ-π配健
Cr=C
双键 具有 σ-π配健的特征
7.7 错误较多。认为bipy ,phen 是 配体。没有认识到N 2既是配体也是
酸配体。
配体 C 5H 5,N 2,C 6H 6,C 2H 4,C 4H 6,给体 ( bonded )
酸配体 CO ,N 2,PR 3,[bipy(弱),phen(弱)], 电子受体( bonded) 经典配合物的配体 CN [bipy ,phen ]
7.9 (1)(
5
-C 5H 5)Fe(CO)23CH ←?→O
17e
与CH 3等瓣相似
(2)555(ηC H )Fe(CO)CH -←?→O
15e (3)5552(η-C H )Co(CO)CH ←?→O
16e (4)555(η-C H )Ni CH ←?→O
15e
第13章 氢和稀有气体 13-1 氢作为能源,其优点是?目前开发中的困难是什么? 1、解:氢作为能源,具有以下特点: (1)原料来源于地球上储量丰富的水,因而资源不受限制; (2)氢气燃烧时放出的热量很大; (3)作为燃料的最大优点是燃烧后的产物为水,不会污染环境; (4)有可能实现能量的储存,也有可能实现经济高效的输送。 发展氢能源需要解决三个方面的问题:氢气的发生,氢气的储备和氢气的利用 13-2按室温和常压下的状态(气态 液态 固态)将下列化合物分类,哪一种固体可能是电的良导体? BaH 2;SiH 4;NH 3;AsH 3;PdH 0.9;HI 13-3试述从空气中分离稀有气体和从混合气体中分离各组分的根据和方法。 3、解:从空气中分离稀有气体和从混合稀有气体中分离各组分,主要是利用它们不同的物理性质如:原子间不同的作用力、熔点沸点的高低以及被吸附的难易等差异达到分离的目的。 13-4试说明稀有气体的熔点 、沸点、密度等性质的变化趋势和原因? 4、解:氦、氖、氩、氪、氙,这几种稀有气体熔点、沸点、密度逐渐增大。 这主要是由于惰性气体都是单原子分子,分子间相互作用力主要决定于分子量。分子量越大,分子间相互作用力越大,熔点沸点越来越高。 密度逐渐增大是由于其原子量逐渐增大,而单位体积中原子个数相同。 13-5你会选择哪种稀有气体作为:(a )温度最低的液体冷冻剂;(b )电离能最低 安全的放电光源;(c )最廉价的惰性气氛。 13-6用价键理论和分子轨道理论解释HeH 、HeH + 、He 2+ 粒子存在的可能性。为什么氦没有双原子分子存在? 13-7 给出与下列物种具有相同结构的稀有气体化合物的化学式并指出其空间构型: (a) ICl 4- (b)IBr 2- (c)BrO 3- (d)ClF 7、 解: 4XeF 平面四边形 2XeF 直线形 3XeO 三角锥 XeO 直线形
北京大学招生简章-北大药理学考研招生简章、专业目录、报录比、分数线、参考书、真 题 北大药理学考研招生简章 一、推荐免试 按照教育部研究生招生工作的有关规定,北京大学通过推荐免试方式接收全国重点大学优秀应届本科毕业生攻读硕士学位研究生,包括学术型硕士研究生和专业学位硕士研究生。 (一)、申请与材料 教育部建立“全国推荐优秀应届本科毕业生免试攻读研究生信息公开暨管理服务系统”(以下简称“推免服务系统”,网址:https://www.doczj.com/doc/fa16132715.html,/tm),作为推免工作统一的信息备案公开平台和网上报考录取系统。 取得推荐学校推免资格及名额的应届优秀本科毕业生方可申请。申请者应按照教育部的要求,登录推免服务系统,在系统中注册和填写基本信息,完成网上报名、网上缴费、接受复试确认和待录取确认等环节。 此外,申请者还须按照我校的相关具体要求进行申请并提交书面申请材料,详见我校研究生院网站公布的《北京大学2015年接收推荐免试研究生的办法》(网址:https://www.doczj.com/doc/fa16132715.html,/zsxx/sszs/tjms/)。 (二)、初审与复试 1、各院系推免生遴选工作小组对申请材料初审后,通知通过初审的申请者来我校参加复试。 2、复试实行差额复试,择优录取。具体差额比例由各院系根据自身特点和生源状况自行确定。 3、选拔办法由各院系根据其学科特点制定,笔试或面试不及格者不予录取。选拔办法一经公布不得随意更改。 4、推免生的综合面试时间原则上不少于20分钟。北大药理学考研 (三)、待录取与公示 1、院系通过教育部推免服务系统向拟接收的申请者发送待录取通知,请申请者在院系规定的时间内在网上确认是否接受待录取。若在规定时间内未确认,则视为放弃。 2、我校不再另行向接收的推荐免试研究生(含硕士生和直博生)发送接收函。 3、2014年10月25日前,院系在网上公示待录取名单。推免生可登录院系网站查询公示名单,或在研究生院硕士、博士招生网页的“录取信息”查询。若有疑问,可于公示期内向院系提出,各院系予以及时答复。 (四)、复审与录取 在正式发出录取通知书之前,我校将对获得待录取资格的推免生,按照我校有关要求进行资格复审,未通过者将被取消录取资格。北大药理学考研 二、报名考试 (一)、报考条件 报名参加全国统一考试,须符合下列条件: 1、中华人民共和国公民。 2、拥护中国共产党的领导,品德良好,遵纪守法。 3、身体健康状况符合国家和我校规定的体检要求。 4、考生的学历必须符合下列条件之一:
第一章物质存在的状态………………………………………………………………2 一、气体 .......................................................................................................... 2 二、液体 .......................................................................................................... 3 ①溶液与蒸汽压 ................................................................................................ 3 ②溶液的沸点升高和凝固点的下降 ................................................................... 3 ③渗透压 .......................................................................................................... 4 ④非电解质稀溶液的依数性 .............................................................................. 4 三、胶体 .......................................................................................................... 4 第二章 化学动力学初步……………………………………………………………5 一、化学反应速率 ............................................................................................ 5 二、化学反应速率理论 ..................................................................................... 6 三、影响化学反应速率的因素 .......................................................................... 6 2、温度 ............................................................................................................ 7 第三章 化学热力学初步……………………………………………………………8 一、热力学定律及基本定律 .............................................................................. 8 二、化学热力学四个重要的状态函数 ................................................................ 9 4、自由能 ....................................................................................................... 10 ①吉布斯自由能 .............................................................................................. 10 ②自由能G ——反应自发性的判据 .................................................................. 11 ③标准摩尔生成自由能θ m f G ? (11)
天津大学无机化学考试试卷 (下册) 答案 一、是非题(判断下列叙述是否正确,正确的在括号中画√,错误的画X )(每小题1分,共10分) 1、( X )在周期表中,处于对角线位置的元素性质相似,这称为对角线规则。 2、( X )SnS 溶于Na 2S 2溶液中,生成硫代亚锡酸钠。 3、( X )磁矩大的配合物,其稳定性强。 4、( X )氧族元素氢化物的沸点高低次序为H 2O>H 2S>H 2Se>H 3Te 。 5、( √ )已知[HgCl 4]2-的K =1.010-16,当溶液中c (Cl -)=0.10mol ·L -1时,c (Hg 2+)/c ([HgCl 4]2-)的比 值为1.010-12。 6、( √ )如果某氢化物的水溶液为碱性,则此氢化物必为离子型氢化物。 7、( X )硼是缺电子原子,在乙硼烷中含有配位键。 8、( √ )在浓碱溶液中MnO 4-可以被OH -还原为MnO 42-。 9、( √ )配合物Na 3[Ag(S 2O 3)2]应命名为二硫代硫酸根合银(Ⅰ)酸钠。 10、( X )Pb(OAc)2是一种常见的铅盐,是强电解质。 二、选择题(在下列各题中,选择出符合题意的答案,将其代号填入括号内)(每小题1分,共20分) 1、在下列各种酸中氧化性最强的是............... ( B )。 (A)HClO 3;(B)HClO ;(C)HClO 4;(D)HCl 。 2、下列浓酸中,可以用来和KI(s)反应制取较纯HI(g)的是............... ( C )。 (A)浓HCl ;(B)浓H 2SO 4;(C)浓H 3PO 4;(D)浓HNO 3。 3、用于说明Pb(Ⅳ)具有强氧化性的是............... ( D )。 (A)熵效应;(B)螯合效应;(C)屏蔽效应;(D)惰性电子对效应。 4、美国的阿波罗飞船上的天线是用钛镍合金制成的,这是因为钛镍合金. ............... ( C )。 (A)机械强度大; (B)熔点高; (C)具有记忆性能; (D)耐腐蚀。 5、在一溶液中加入淀粉溶液和少量NaClO 溶液,得到蓝色溶液(a),继续加入NaClO 后得一无色溶液,然后加入适量Na 2SO 3溶液,又复原为(a),Na 2SO 3溶液逐渐过量时,蓝色褪去,成为一无色溶液(b)。由此可推断,(a)和(b)溶液含有............... ( B )。 (A)(a)I 2,(b)SO 42-、IO 3-; (B)(a)I 2,(b)SO 42-、I -; (C)(a)I -,(b)H 2S 、IO 3-; (D)(a)I -,(b)H 2S 、I -。 6、下列各组离子中每种离子分别与过量NaOH 溶液反应时,都不生成沉淀的是............... ( B )。 (A)Al 3+、Sb 3+、Bi 3+; (B)Be 2+、Al 3+、Sb 3+; (C)Pb 2+、Mg 2+、Be 2+; (D)Sn 2+、Pb 2+、Mg 2+。 7、在下列各盐溶液中通入H 2S(g)不生成硫化物沉淀的是............... ( D )。 (A)Ag +;(B)Cd 2+;(C)Pb 2+;(D)Mn 2+。 8、决定卤素单质熔点高低的主要因素是............... ( B )。 (A)卤素单质分子的极性大小; (B)卤素单质的相对分子质量的大小;
无机化学(上) 知识点总结 第一章 物质存在的状态 一、气体 1、气体分子运动论的基本理论 ①气体由分子组成,分子之间的距离>>分子直径; ②气体分子处于永恒无规则运动状态; ③气体分子之间相互作用可忽略,除相互碰撞时; ④气体分子相互碰撞或对器壁的碰撞都是弹性碰撞。碰撞时总动能保持不变,没有能量损失。 ⑤分子的平均动能与热力学温度成正比。 2、理想气体状态方程 ①假定前提:a 、分子不占体积;b 、分子间作用力忽略 ②表达式:pV=nRT ;R ≈8.314kPa 2L 2mol 1-2K 1- ③适用条件:温度较高、压力较低使得稀薄气体 ④具体应用:a 、已知三个量,可求第四个; b 、测量气体的分子量:pV=M W RT (n=M W ) c 、已知气体的状态求其密度ρ:pV=M W RT →p=MV WRT →ρMV RT =p 3、混合气体的分压定律 ①混合气体的四个概念 a 、分压:相同温度下,某组分气体与混合气体具有相同体积时的压力; b 、分体积:相同温度下,某组分气体与混合气体具有相同压力时的体积 c 、体积分数:φ= 2 1 v v d 、摩尔分数:xi= 总 n n i ②混合气体的分压定律 a 、定律:混合气体总压力等于组分气体压力之和; 某组分气体压力的大小和它在混合气体中体积分数或摩尔数成正比 b 、适用范围:理想气体及可以看作理想气体的实际气体 c 、应用:已知分压求总压或由总压和体积分数或摩尔分数求分压、 4、气体扩散定律 ①定律:T 、p 相同时,各种不同气体的扩散速率与气体密度的平方根成反比: 2 1 u u =21p p =2 1 M M (p 表示密度) ②用途:a 、测定气体的相对分子质量;b 、同位素分离 二、液体
第一章思考题 1.一气柜如下图所示: A 假设隔板(A)两侧N2和CO2的T, P相同。试问: (1)隔板两边气体的质量是否相等浓度是否相等物质的量不等而浓度相等 (2)抽掉隔板(假设不影响气体的体积和气柜的密闭性)后,气柜内的T和P 会改变?N2、CO2物质的量和浓度是否会改变T和P 会不变,N2、CO2物质的量不变而浓度会改变 2.标准状况与标准态有何不同标准状况指气体在27.315K和101325Pa下的理想气体,标准态是在标准压力下(100kPa)的纯气体、纯液体或纯固体 3.化学反应方程式的系数与化学计量数有何不同对某一化学反应方程式来说,化学反应方程式的系数和化学计量数的绝对值相同,但化学反应方程式的系数为正值,而反应物的化学计量数为 负值,生成物的化学计量数为正值 4.热力学能、热量、温度三者概念是否相同试说明之。 5.试用实例说明热和功都不是状态函数。 6.判断下列各说法是否正确: (1)热的物体比冷的物体含有更多的热量。× (2)甲物体的温度比乙物体高,表明甲物体的热力学能比乙物体大。× (3)物体的温度越高,则所含热量越多。× (4)热是一种传递中的能量。√ (5)同一体系: (a)同一状态可能有多个热力学能值。× (b)不同状态可能有相同的热力学能值。√ 7.判断下列各过程中,那个ΔU最大: (1)体系放出了60kJ热,并对环境做了40kJ功。 (2)体系吸收了60kJ热,环境对体系做了40kJ功。√ (3)体系吸收了40kJ热,并对环境做了60kJ功。 (4)体系放出了40kJ热,环境对体系做了60kJ功。 根据ΔU=Q+W, (1)ΔU=-60+(-40)=-100KJ (2) ΔU=+60+40=+100KJ ,(3) ΔU=+40+(-60)=-20KJ (4)ΔU=-40+60=+20KJ因此通过计算可以看出,(2)过程的ΔU最大. 8.下列各说法是否正确: (1)体系的焓等于恒压反应热。× (2)体系的焓等于体系的热量。× (3)体系的焓变等于恒压反应热。√ (4)最稳定的单质焓等于零。× (5)最稳定的单质的生成焓值等于零。×
考研有机化学专业就业方向及前景分析 一、专业介绍 1、学科简介 有机化学是一级学科化学下设的二级学科以天然有机产物和生物活性分子、金属与元素有机化合物为主要研究对象,从研究有机合成化学和物理有机化学着手,发展有机化学的反应、合成、方法和理论。 2、培养目标 依据研究生教育要"面向现代化、面向世界、面向未来"的要求,培养德、智、体全面发展的现代化建设所需要的有机化学专业的专门人才。 (1)硕士研究生应具有坚定正确的政治方向,热爱祖国,遵纪守法,具有严谨的科学态度,良好的素质。 (2)有机化学专业硕士研究生要掌握有机合成化学、金属有机化学、有机分析化学等方面的基础理论和系统的专门知识,了解本研究方向的国内外发展动态。 (3)较熟练地掌握一门外国语。能熟练地查阅本专业的外文文献,具有较强的外文写作能力。 (4)掌握本学科的现代实验技能,能独立的从事科学技术研究,具有新技术、新方法、新产品开发研究能力,毕业后能胜任高等院校、科研院所、企业和其他单位的教学、科研、技术管理工作。 3、专业方向 01物理有机化学 02有机合成化 03元素有机化学 04药物合成化 05有机大分子化学 06配位化学 4、考试科目 ①101思想政治理论 ②201英语一 ③721物理化学(含结构化学) ④837有机化学或838有机化学和分析化学(注:各个学校专业方向、考试科目,以上以复旦大学为例) 二、推荐院校 兰州大学、南开大学、北京大学、浙江大学、清华大学、四川大学、中国科学技术大学、武汉大学、山东大学、南京大学、吉林大学、华中师范大学、复旦大学、中山大学、厦门大学、苏州大学、徐州师范大学、湖南师范大学、云南大学、郑州大学、华东理工大学相近专业 与有机化学相近的一级学科下的其他专业有: 有机化学、分析化学、有机化学、物理化学、高分子化学和物理、材料物理与化学。 培养目标 依据研究生教育要"面向现代化、面向世界、面向未来"的要求,培养德、智、体全面发展的现代化建设所需要的有机化学专业的专门人才。
1、用H3PO4(pKa1= 2.16,pKa2= 7.21,pKa3= 12.32)和NaOH所配成的pH = 7.35的缓冲溶液中,抗碱成分是()(4 分)A.H3PO4 B.H2PO4- C.HPO42- D.PO43- 我的答案:B 得分:4分 2、对于一个化学反应,下列说法中正确的是()(4 分)
A.越负,反应速率越大 B.越负,反应速率越大 C.活化能越大,反应速率越大 D.活化能越小,反应速率越大 我的答案:D 得分:4分 3、蛋白质发生盐析的主要原因是()(4 分)A.电解质离子强烈的水化作用使大分子去水化 B.蛋白质所带的电荷发生了变化
C.由于电解质的加入,使大分子溶液处于等电点 D.蛋白质上基团的解离情况发生了变化我的答案:A 得分:4分 4、已知某蛋白的pI = 5.6,欲使该蛋白移向正极,则电泳液的pH应()(4 分)A.<5.6 B.=5.6 C.>5.6 D.无法确定
我的答案:C 得分:4分 5、聚沉As2S3负溶胶,下列电解质中聚沉能力最强的是()(4 分) A.Ca(NO3)2 B.K2SO4 C.Na3PO4 D.AlCl3 我的答案:D 得分:4分
6、溶胶在一定时间内能稳定存在而不聚沉,主要原因是()(4 分) A.溶胶的分散相粒子很小 B.溶胶的分散相粒子很大,扩散速度慢C.溶胶的胶粒呈均匀分布,是均相系统D.胶粒带电,相互排斥;胶粒带有水化膜保护,阻止彼此碰撞时聚结沉淀 我的答案:D 得分:4分 7、溶胶的丁铎尔(Tyndall)现象的本质是胶粒对光的()(4 分) A.透射作用
第十章P 333作业参考答案 思考题 1、(4)极化力与极化率 极化力:描述阳离子对阴离子变形的影响能力。 极化率:描述离子(主要指阴离子)本身变形性的大小。 13、离子的极化力、变形性与离子电荷、半径、电子层结构有何关系?离子极化对晶体结构和性质有何影响? 举例说明。 答:(1)离子极化力的影响因素: 阳离子的正电荷越高 半径越小极化力越大; 当阳离子的电荷相同和半径相近时,阳离子极化力大小与其最外电子层结构关系是18e、18+2 e->9~17 e- > 8 e-。 ⑵离子变形性的影响因素:阴离子半径愈大、变形性愈大;阳离子变形性与它最外层电子构型有关:18e、 18+2 e-> 9~17 e-> 8 e-。 (3)离子极化结果:使离子键向共价键过渡、阴阳离子间的配位数减小、溶解度减小、熔点降低、颜色加 深。 14、试用离子极化的概念讨论,Cu+与NV半径相近,但CuCI在水中的溶解度比NaCI小得多的原因。 答:Cu+最外层电子结构是18e而N6是8e。C1的极化力大于N6, CuCI中的离子键向共价键过渡、使离子键减弱,所以CuCI在水中的溶解度小于NaCI。 17、形成氢键具备的条件是:元素的电负性大、原子半径小、有孤对电子(F、O N三种元素具备条件)。 习题: 1、填充下表 7、下列物质中,何者熔点最低?NaCI KBr KCI MgO 答:KBr熔点最低(因为阴阳离子的半径均大,晶格能小) 8、熔点由高到低:(1)从NaF到Nal熔点降低。
9、下列离子的最外层电子构型属于哪种类型? Ba 2+8 e- Cr3+9~17 e- CcT 18 e- Pb 2+18+2 e- S 区d 区ds 区p 区 10*、I的半径最大、极化率最大。 11、写出下列物质极化作用由大到小顺序 SiCI 4> AICI 3> MgC2>NaCI 12、讨论下列物质的键型有何不同? (1)CI 2非极性共价键(2)HCI 极性共价键 (3)Agl离子键向共价键过渡(4)NaF 离子键 16、试用离子极化观点解释AgF易溶于水,而AgCI、AgBr、AgI难溶于水,并且由AgCI到AgBr再到AgI溶解度依次减小。 答:AgF是离子键,所以易溶于水。而AgCl-AgBr-AgI随着阴离子半径的增大,由离子键向共价键过渡程度增大,所以难溶于水,且溶解度减小。 第^一章P366作业参考答案 思考题 1、区别下列概念 (2)、d—d跃迁:在晶体场理论中,一个处于低能量轨道的电子进入高能量轨道,叫做 d —d跃迁。此过程吸收相当于分裂能的光能。 (3)、晶体场分裂能:中心离子5个能量相等的d轨道,在配体影响下分裂为两组(一组能量低、一组能量高),两组的能量差叫分裂能。 4、试述下列理论 (1)价键理论: A、形成体(M)价层有空原子轨道,配位体(L)有孤对电子; B、形成体的空轨道在配位体作用下进行杂化,用杂化轨道接受L的孤对电子,形成配位键M - : L ; C、杂化轨道不同,配合物空间构型不同。 (2)晶体场理论:
第二章物质的状态 习题 2.1 什么是理想气体?实际气体在什么条件下可用理想气体模型处理? 2.2 为什么家用加湿器都是在冬天使用,而不在夏天使用? 2.3 常温常压下,以气体形式存在的单质、以液体形式存在的金属和以液体形式存在的 非金属单质各有哪些? 2.4 平均动能相同而密度不同的两种气体,温度是否相同?压力是否相同?为什么? 2.5 同温同压下,N2和O2分子的平均速度是否相同?平均动能是否相同? 2.6试验测得683K、100kPa时气态单质磷的密度是2.64g·dm-3。求单质磷的分子量。2.71868年Soret用气体扩散法测定了臭氧的分子式。测定结果显示,臭氧对氯气的扩散速 度之比为1.193。试推算臭氧的分子量和分子式。 2.8常压298K时,一敞口烧瓶盛满某种气体,若通过加热使其中的气体逸出二分之一,则 所需温度为多少? 2.9氟化氙的通式为XeF x(x=2、4、6…),在353K、1.56×104Pa时,实验测得某气态氟 化氙的密度为0.899g·dm-3。试确定该氟化氙的分子式。 温度为300K、压强为3.0×1.01×105Pa时,某容器含,每升空气中水汽的质量。 (2)323K、空气的相对湿度为80%时,每升空气中水汽的质量。 已知303K时,水的饱和蒸气压为4.23×103Pa; 323K时,水的饱和蒸气压为1.23×104Pa。 2.10在303K,1.01×105Pa时由排水集气法收集到氧气1.00dm3。问有多少克氯酸钾按 下式分解? 2KClO3 === 2KCl +3O2 已知303K时水的饱和蒸气压为4.23×103Pa。 2.11298K,1.23×105Pa气压下,在体积为0.50dm3的烧瓶中充满NO和O2气。下列反 应进行一段时间后,瓶内总压变为8.3×104Pa,求生成NO2的质量。 2NO +O2 === 2NO2 2.12一高压氧气钢瓶,容积为45.0dm3,能承受压强为3×107Pa,问在298K时最多可 装入多少千克氧气而不致发生危险?
无机化学习题参考答案(II) 第一章 1.4.解: (1)H 2O 2 2C (2)S 2O 32 3v C (3)N 2O (N N O 方式) v C ∞ (4)Hg 2Cl 2 h D ∞ (5)H 2C=C=CH 2 2d D (6)UOF 4 C 5v (7)BF 4 d T (8)SClF 5 4v C (9)反-Pt(NH 3)2Cl 2 2h D (10)PtCl 3(C 2H 4) 2v C 1.B(CH 3)3和BCl 3相比,哪一个的Lewis 酸性强,为什么? 一般来说,CH 3为推电子基团,Cl 为吸电子基团,因此的Lewis 酸性强。 (BCl 3易水解;B(CH 3)3不溶于水,在空气中易燃) 2.BH 3和BF 3都可和(CH 3)2NPF 2生成加合物,在一种加合物中,B 原子和N 相连,另一种则和P 相连,绘出两种结构式,并说明形成两种结构的原因。 P F F H 3C CH 3 N P F F H 3C CH 3 N B B H 3F 3 (该题可参考史启桢等翻译的"无机化学",作者Shriver 等,由高教社出版, 其中关于热力学酸度参数的部分,p.190-191; 或者该书的英文原版第5章的相关内容) 3. 无水AlCl 3可作为傅-克烷基化反应的催化剂, 而吸水后则失效, 原因何在? 配位饱和(6配位),失去Lewis 酸性 4. 吸水后失效 的AlCl 3有什么方法可以脱水? 因为Al 3+是典型的硬酸,与氧的亲合力很强,因此实验室不能在HCl ,NH 4Cl ,SOCl 2等气氛下加热脱水。(只能加强热生成 Al 2O 3后,用高温下用加C 和Cl 2用还原氯化法制备,这就不是脱水方法了)。 第二章
北京中医药大学《无机化学》考试辅导试题及答案 用离子-电子法配平并完成下列反应 答:+ + 2I-= 2Fe2+ + I2 -+ 3SO32-+H2O = 2MnO2 + 3SO42-+ 2OH— + + Zn = Cu+ Zn2+ -+3S2-+14H+ =2Cr3++3S +7 H2O -+ 5SO32-+ 6H+= 2Mn2+ + 5SO42-+3 H2O — + SO32-+ 2OH—= 2MnO42—+ SO42-+ H2O 简答题 1. 一种钠盐A,在A的水溶液中加入稀盐酸产生刺激性气体B。A的水溶液在酸性中能使KMnO4溶液腿色,得到无色溶液C。若在A的水溶液中通入Cl2得溶液D,在D中加入AgNO3溶液产生白色沉淀E,若在E中加入NH3水,震荡后得到无色溶液F。指出A、B、C、D、E、F各为何物。 答:A、Na2SO3B、SO2C、Mn2+ D、Cl- E、AgCl F、[Ag(NH)2]+ 2.根据配合物的价键理论,指出下列配离子中,中心离子和配体的配位情况(即画出中心离子杂化后价电子排布、指出杂化轨道类型及空间构型)。 (1)[FeF6]3-μ= . (2)[Fe(CN)6]3-μ= . 答:(1)Fe3+ 3d53d轨道有5个单电子sp3d2杂化八面体 (2)Fe3+ 3d53d轨道有1个单电子d2sp3杂化八面体 3.有四种试剂:Na2SO4、Na2SO3、Na2S2O3、Na2S,它们的标签已脱落,请设计只加一种试剂的简便方法鉴别它们,并写出有关配平的离子反应方程式。 答:加稀HCl (略) 4.根据配合物的价键理论,确定下列配离子是内轨型还是外轨型,说明理由。 (1) [Fe(H2O)6]3-(Fe3+3d 5)μ= . (2) [Mn(CN)6] 4-(Mn2+3d 5)μ= . 答:(1)μ= 则n=5 Fe3+ 3d53d轨道有5个单电子sp3d2杂化八面体 (2)μ= 则n=1 Fe3+ 3d53d轨道有1个单电子d2sp3杂化八面体 5.现有一种含结晶水的淡绿色晶体A,将其配成溶液,若加入BaCl2溶液,则产生不溶于酸的白色沉淀B,若加入NaOH溶液,则生成白色胶状沉淀C并很快变成红棕色沉淀D,再加入盐酸,此红棕色沉淀又溶解,滴入硫氰化钾溶液显深红色溶液E。指出A、B、C、D、E各为何物。 答:A、Na2SO3B、SO2C、Mn2+ D、Cl- E、AgCl F、[Ag(NH)2]+
学院化学系第二学期期末考试 无机化学模拟试卷5 一、选择题(本题包括30小题,每小题1.5分,共45分,每小题只有一个正确答案) 1. 在热碱性溶液中,次氯酸根离子不稳定,它的分解产物是( ) (A) Cl-(aq)和Cl2 (g) (B) Cl-(aq)和ClO3-(aq) (C) Cl-(aq)和ClO2-(aq) (D) Cl-(aq)和ClO4-(aq) 2.下列叙述中正确的事( ) (A)卤素的最高氧化数均等于其族数 (B)卤素的电子亲合能随着原子序数的增大而变小 (C)卤素的电负性随着原子序数的增大而变小 (D)卤素的化学活泼性(氧化性)中以I2最弱,所以自然界中有单质碘 3.碘化钾与浓硫酸反应不适于用来制备HI,主要原因是( ) (A)反应太慢(B)碘化氢被氧化 (C)硫酸的酸性没有HI的强(C)获得的碘化氢不纯 4.氢卤酸酸性强弱的顺序是( ) (A)随着卤素原子序数的增大,酸性增强 (B)随着卤素原子序数的增大,酸性减弱 (C)除氢氯酸为强酸外,其余均为弱酸 (D)除盐酸为强酸外,其余氢卤酸的酸性随卤素原子序数的增大而减弱 5. 锌粉与亚硫酸氢钠反应生成( ) (A) Na2S2O4 (B) Na2S2O3(C) Na2S3(D) Na2S O4
6.H2S与SO2反应的主要产物是( ) (A)H2S2O3 (B)S (C)H2S2O4(D)H2SO3 7.加热下列硫酸盐能得到金属单质的是( ) (A)Na2SO4(B)CuSO4(C)Ag2SO4(D)Fe2(SO4)3 8.稀硝酸与铜反应的产物除Cu(NO3)2外,主要的是( ) (A) NH4+ (B) NO2(C) NO (D) N2 9.五氧化二磷的分子式为( ) (A) P2O5(B) P4O10(C) (P2O5)x(D) (P2O5)2 10. 下列各含氧酸中,三元酸是( ) (A) H3PO4(B) H3PO2(C) H3PO3(D) H3BO3 11. ⅣA族元素从Ge到Pb; 下列性质随原子序数的增大而增加的是( ) (A) +2氧化态的稳定性(B) 二氧化物的酸性 (C) 单质的熔点(D) 氢化物的稳定性 12. SiCl4在潮湿的空气中发“烟”,这种现象的正确解释是() (A)SiCl4不稳定而易分解为Cl2和Si (B)SiCl4发生水解,生成SiO2和HCl (C)SiCl4发生水解,生成H4SiO4和HCl (D)SiCl4被O2氧化为SiO2和OCl2
无机化学实验课大纲 2004年修订 目的和要求 在学生系统的学习了普通化学、分析化学、有机化学和物理化学等理论课程和实验课程的基础上,与主干基础课“中级无机化学”配套讲授,通过本实验课教学使学生以全新的视角对现代无机化学有一个比较深入和全面的了解,学习、掌握相关的实验技术。通过实验课的学习提高学生学习无机化学的兴趣,培养学生综合运用各方面的知识、各种实验技术、手段以及完整地解决实际问题的能力,培养学生养成良好的实验习惯,培养学生严谨、细致的科学作风和勇于探索的科学精神。 要求学生进行实验前,应认真阅读实验讲义和相关文献,对实验题目涉及的相关理论主题和研究领域做比较充分的了解。并通过预习对实验内容有一个正确、全面的理解,注意是理解而不仅仅是了解。因为预习不仅仅是看讲义、抄讲义。预习的主要目的是要求实验者对实验原理、内容和过程有比较充分的理解;能够有组织、有条理、有针对性的地完成实验,对实验中可能出现的现象、问题及相应的解决办法有所准备。所以无机实验的预习报告不要求抄实验讲义,而是要求学生对讲义提出的预习思考题进行分析、判断,做出比较正确的理解。任课教师应在实验前审阅学生的预习报告,然后组织学生就预习和实验中可能出现的问题进行讨论,在此基础上进行实验。 鼓励学生对实验过程中出现的问题做比较深入的,超出讲义要求的研究,以此培养学生的探索精神。 要求学生以规范的格式做原始记录,整理分析数据,对实验现象和结果进行讨论,并按规范书写实验报告。 要求学生学会使用有关的手册、文献资料及信息网络查阅相关的公式和常数。 要求学生在实验中进行规范的操作,保证学生的人身安全和实验室的安全。 要求学生保持实验室的整洁、卫生、节约药品,培养良好的科研道德。 学时:60 实验评分:预习20%,实验30%,报告40%,卫生5%,纪律5%。 实验讲义:自编 主要参考书: 1.项斯芬、姚光庆,“中级无机化学”,北京大学出版社,2003 2.Zvi Szafran, Ronald M.Pike,Mon M.Singh,“Microscale Inorganic Chemistry-a comprehensive laboratory experience”New York : J. Wiley, c1991. 3.北京大学化学系分析化学教学组,“基础分析化学实验”,北京大学出版社,1998年第二版 4.北京大学化学学院物理化学教学组,“物理化学实验”,北京大学出版社,2002年第4版 5.北京大学化学学院有机化学研究所编关烨第, 李翠娟, 葛树丰修订,“有机化学实验”,北 京大学出版社2002第2版 对实验大纲的说明: 1.强化学生对无机化学领域的深入了解。 同学们一进入实验室,最先接触的就是普通化学实验和部分元素性质实验,如果没有后续
第13章氢和稀有气体 13-1 氢作为能源,其优点是什么?目前开发中的困难是什么? 1、解:氢作为能源,具有以下特点: (1)原料来源于地球上储量丰富的水,因而资源不受限制; (2)氢气燃烧时放出的热量很大; (3)作为燃料的最大优点是燃烧后的产物为水,不会污染环境; (4)有可能实现能量的储存,也有可能实现经济高效的输送。 发展氢能源需要解决三个方面的问题:氢气的发生,氢气的储备和氢气的利用 13-2按室温和常压下的状态(气态 液态 固态)将下列化合物分类,哪一种固体可能是电的良导体? BaH 2;SiH 4;NH 3;AsH 3;PdH 0.9;HI 13-3试述从空气中分离稀有气体和从混合气体中分离各组分的根据和方法。 3、解:从空气中分离稀有气体和从混合稀有气体中分离各组分,主要是利用它们不同的物理性质如:原子间不同的作用力、熔点沸点的高低以及被吸附的难易等差异达到分离的目的。 13-4试说明稀有气体的熔点 、沸点、密度等性质的变化趋势和原因? 4、解:氦、氖、氩、氪、氙,这几种稀有气体熔点、沸点、密度逐渐增大。 这主要是由于惰性气体都是单原子分子,分子间相互作用力主要决定于分子量。分子量越大,分子间相互作用力越大,熔点沸点越来越高。 密度逐渐增大是由于其原子量逐渐增大,而单位体积中原子个数相同。 13-5你会选择哪种稀有气体作为:(a )温度最低的液体冷冻剂;(b )电离能最低 安全的放电光源;(c )最廉价的惰性气氛。 13-6用价键理论和分子轨道理论解释HeH 、HeH +、He 2+ 粒子存在的可能性。为什么氦没有双原子分子存在? 13-7 给出与下列物种具有相同结构的稀有气体化合物的化学式并指出其空间构型: (a) ICl 4- (b)IBr 2- (c)BrO 3- (d)ClF 7、 解: 4XeF 平面四边形 2XeF 直线形 3XeO 三角锥 XeO 直线形 13-8用 VSEPR 理论判断XeF 2 、XeF 4、XeF 6、XeOF 4及ClF 3的空间构型。 8、解: 2XeF 直线形 4XeF 平面四边形 6XeF 八面体 4XeOF 四方锥 4ClF 三角锥 13-9用化学方程式表达下列化合物的合成方法(包括反应条件): (a) XeF 2 (b) XeF 6 (c) XeO 3 9、解: )()()(21.0,4002g XeF g F g Xe MPa C ????→?+? )()(3)(66,3002g XeF g F g Xe MPa C ????→?+? HF XeO O H XeF 63326+=+
北大考研复试班-北京大学化学(化学基因组学)专业考研复试成功 经验分享 初试排名靠前并不等于录取,压线也并不等于没戏。考研复试,其实就是综合素质的竞争,包含学校,本科成绩,复试外语,个人自述,科研经历,论文,笔试,面试。 考研复试是初试过线学生关注的重中之重,因为复试决定着考研的成败,无论是初试中的佼佼者,还是压线者,大一或盲目自大,就意味着自我放弃改变命运的机会;相反,把握好复试机会,就能通过复试翻盘逆袭,成功实现自己人生目标。 但是,考研复试备考时间短,缺少学长导师及内部信息,个人自述及笔试面试无从下手,加上各校面试没有显性的统一标准,以及复试淘汰率较低,一般再1:1.2左右(具体还需根据学校及专业情况查证),造成复试难的局面。 面对这一情况,启道考研复试班根据历年辅导经验,编辑整理以下关于考研复试相关内容,希望能对广大复试学子有所帮助,提前预祝大家复试金榜题名! 专业介绍 化学基因组学是近年发展起来的有组合化学、细胞分子生物学和遗传学相结合并融合了高通量筛选技术的一门新兴交叉学科,是从一个全新的角度对生命科学的重要介入。 化学基因组学是近年发展起来的有组合化学、细胞分子生物学和遗传学相结合并融合了高通量筛选技术的一门新兴交叉学科,是从一个全新的角度对生命科学的重要介入。它通过小分子化合物探针与靶蛋白之间的特异性相互作用,在基因的转录、加工和翻译等水平上对细胞的某一特定生命过程进行调控,从而研究靶蛋白及相关目的基因的结构与功能,同时发现和确认新的药物作用靶点及药物先导化合物。化学基因组学因其可控制性,可检测性和可定量性而具有以全新的方式大规模的快速寻找和发现新基因和功能蛋白质,并研究其功能和调控网络的优势,因此它不仅是研究功能基因组学的一条捷径,而且也是药物发现的有效手段。 招生人数与考试科目 北京大学化学(化学基因组学)专业属于深圳研究生院,不区分研究方向,2019年计划招收全日制学生35人。 北京大学化学(化学基因组学)专业初试科目为: ① 101 思想政治理论
安顺学院化学系第二学期期末考试 无机化学模拟试卷1 一、选择题(本题包括30小题,每小题1.5分,共45分,每小题只有一个正确答案) 1.加热就能生成少量氯气的一组物质是() (A).NaCl和H2SO4(B).NaCl和MnO2 (C).KMnO4和HCl (D).HCl和Br2 2.下列氯的含氧酸中,氧化能力最强的是() A.HClO B.HClO2 C.HClO3 D.HClO4 3.下列有关卤素的论述,正确的是( ) (A)溴是由Cl-作氧化剂制得的(B)F-是最强的氧化剂 (C)所有卤素都可以通过电解熔融卤化物得到(D)碘是最强的还原剂 4.下列化合物与水反应放出HCl的是() (A)CCl4(B)NCl3(C)POCl3(D)Cl2O7 5.过氧化氢(H2O2)( ) (A)是一种碱(B)是一种酸 (C)是一种氧化剂(D)既是酸,又是碱,既是氧化剂,又是还原剂 6.既能溶于 2 22的硫化物是() NaS又能溶于NaS (A)ZnS(B)As2S3(C)HgS(D)CuS 7.硝酸盐热分解可以得到单质的是( ) (A)AgNO3(B)Pb(NO3)2(C)Zn(NO3)2(D)NaNO3 8.PCl3和水反应的产物是() (A)POCl3和HCl(B)H3PO3和HCl(C)H3PO4和HCl(D)PH3和HClO 第1页,共6页
9.有关H3PO4,H3PO3,H3PO2不正确的论述是() (A)氧化态分别是+5,+3,+1(B)P原子是四面体几何构型的中心 (C)三种酸在水中的离解度相近(D)都是三元酸 10.关于五氯化磷(PCl5),下列说法中不正确的是() (A)它由氯与PCl3反应制得(B)它容易水解生成磷酸(H3PO4) +- (C)它在气态时很稳定(D)它的固体状态是结构式为[PCl4][PCl6]的晶体 11.下列碳酸盐和碳酸氢盐中,热稳定性顺序正确的是( ) (A)NaHCO3<Na2CO3<BaCO3(B)Na2CO3<NaHCO3<BaCO3 (C)BaCO3<NaHCO3<Na2CO3(D)NaHCO3<BaCO3<Na2CO3 12.下列化合物中易水解的是( ) 2- (A)SiCl4(B)CCl4(C)CF4(D)SiF6 13. 下列氯化物中最不稳定的是() (A)SnCl4(B)SnCl2(C)GeCl4(D)PbCl4 14. 下列硫化物,能溶于NaS溶液生成硫代酸盐的是( ) 2 (A)SnS(B)SnS2(C)PbS(D)Bi2S3 15. 在下列无机含氧酸中,其酸性强弱次序正确的是() 24>HClO4>H3 4>H2 3 2 4>HClO 4>H2 3>H34 (A)HSO PO SiO(B)H SO SiO PO (C)HClO 4>H2 4>H3 4>H2 3 (D)HClO 4>H3 4>H2 3>H24 SOPO SiO PO SiO SO 16. 下列各对元素中化学性质最相似的是( ) (A)Na,Mg(B)Al,Si(C)Be,Al(D)H,Li 17.用氢氧化钠熔融法分解某矿石时最合适用( ) (A)铂坩埚(B)石英坩埚(C)镍坩埚(D)瓷坩埚 第2页,共6页
单选题 1、已知MnO2(s)=MnO(s) + ?O2(g)的=akJ?mol-1;Mn(s) + MnO2(s) = 2MnO(s)的=b kJ?mol-1,则MnO2(s)的标准摩尔生成焓为()kJ?mol-1 (4 分) A.2a – b B.b – 2a C.a – 2b D.a – b 我的答案:B 得分:4分 2、HA起始浓度为c,达解离平衡HA?H+ + A?时的解离度为α,则HA的Ka为()(4 分)A. B. C. D.
我的答案:A 得分:4分 3、某可逆反应,当温度由T1升高至T2时,标准平衡常数>,则该反应的等 压反应热()(4 分) A.大于零 B.小于零 C.等于零 D.无法判断 我的答案:A 得分:4分 4、某反应物在一定条件下的平衡转化率为36%,当加入催化剂,而反应条件不变时,其平衡转化率为()(4 分) A.大于36% B.等于36% C.小于36% D.无法确定 我的答案:B 得分:4分
5、反应A(s) + B2+(aq) ?A2+(aq) + B(s)在温度T时的标准平衡常数 = 1.0。若B2+和A2+的浓度分别为0.50mol?L-1和0.10mol?L-1,则反应()(4 分) A.正向自发进行 B.处于平衡态 C.逆向自发进行 D.无法判断方向 我的答案:A 得分:4分 6、反应aA(g) + bB(g) ?dD(g) + eE(g)达平衡后,在温度不变的情况下,增大压力,平衡向正反应方向移动,由此可知,下列各式中正确的是()(4 分) A.a + b=d + e B.(a + b)>(d + e) C.(a + b)<(d + e) D.a>b,d>e 我的答案:B 得分:4分 7、在某温度下,已知反应?N2(g) + 3?2H2(g) ?NH3(g)的标准平衡常数为a,该反应若写成2NH3(g) ?N2(g) + 3H2(g),则在相同温度下反应的标准平衡常数为()(4 分) A.a/2 B.2a