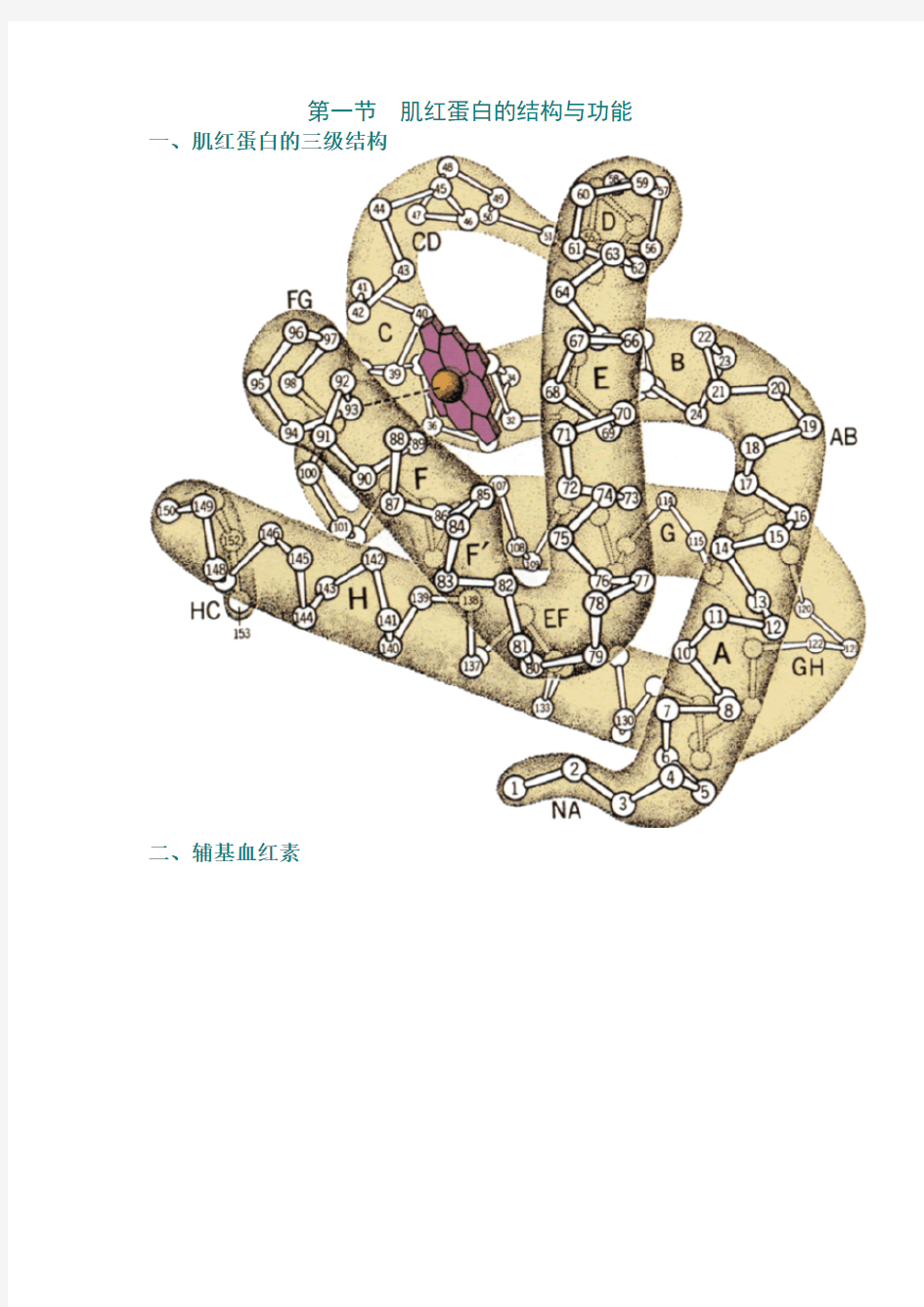

第一节肌红蛋白的结构与功能一、肌红蛋白的三级结构
二、辅基血红素
三、O2与肌红蛋白的结合
四、O2的结合改变肌红蛋白的构像
五、肌红蛋白结合氧的定量分析(氧结合曲线)
MbO2=Mb+O2
K={[Mb][O2]}/ [MbO2](1)
Y=[MbO2]/{[Mb]+[MbO2]}(2)
将(1)改写为:
[MbO2]={[Mb][O2]}/ K,并代入(2)得:
Y=[O2] / {[O2]+K}=p(O2)/{pO2}+K}
YK=p(O2)?Yp(O2)=p(O2)(1?Y)
Y/(1?Y)=p(O2)/K
log[Y/(1-Y)]=log p(O2)-log K
第二节血红蛋白的结构与功能一、血红蛋白的结构
二、氧结合引起的血红蛋白构像变化
三、血红蛋白的协同性氧结合(Hb氧结合曲线)
四、H+、CO2和BPG对血红蛋白结合氧的影响
(一)H+、CO2促进O2的释放(Bohr效应)
(二)BPG降低血红蛋白对氧的亲和力
第三节血红蛋白分子病
一、分子病是遗传的
二、镰刀状细胞贫血病
三、其他血红蛋白病
突变发生在关键部位会致病,突变发生在非关键部位则不会致病。
四、地中海贫血
(一)β地中海贫血
每条染色体有1个拷贝,杂合子症状较轻,纯合子会在童年夭折。
(二)α地中海贫血
每条染色体有2个拷贝,只要有1个拷贝正常,就不会有严重症状。4个拷贝均丢失会在出生前后死亡。
第四节免疫系统和免疫球蛋白
一、免疫系统
(一)免疫学的含义
免疫是指机体识别并清除从外环境中入侵的病原体及其毒素,和内环境中因基因突变产生的异常细胞,保持内环境稳定的功能。
免疫学是研究免疫系统结构,免疫的机制,及利用免疫的方法预防和治疗疾病的学科。
(二)非特异性免疫
1.上皮细胞及其附属成分
物理屏障:机械屏障;毛发的保护作用;分泌液的冲洗作用。
化学屏障:体液的抗菌作用。
微生物屏障:正常菌对病源菌的抑制作用。
2.吞噬细胞的作用
识别病原体糖蛋白和糖脂的糖基,可吞噬多种病原体。
巨噬细胞:由血液中单核细胞移行到各组织发育而成,可吞噬或杀伤微生物。
中性粒细胞:感染发生时,从血管移出,在感染部位吞噬病原体。
3.自然杀伤细胞(NK细胞)
其细胞表面有两种受体:
杀伤细胞活化受体(KAR):识别病毒感染细胞和肿瘤细胞表面的糖基,与其结合后生成穿孔素和水解酶使靶细胞死亡。同时产生干扰素-γ,肿瘤坏死因子β等细胞因子,激活特异性免疫系统。
杀伤细胞抑制受体(KIR):识别自身正常细胞表面由MHCI展示的,由自身蛋白分解产生的肽段,抑制杀伤作用。
(三)特异性免疫
1.特点
病原体及其分解产物刺激特定的免疫细胞增殖,清除特定的病原体。
通过分泌可溶性抗体清除特定抗原的途径称体液免疫。
通过免疫细胞与受感染细胞结合而清除受感染细胞的途径称细胞免疫。
2.体液免疫
由骨髓的多能造血干细胞发育而成的B细胞种类极多,每种B细胞含有一种多个特定的受体(BCR,实际是膜结合的抗体)。
抗原与BCR结合后,通过细胞内信号转导系统启动细胞的快速分裂,使细胞大量增殖。
增殖后的细胞大部分用来产生可溶性抗体,称作浆细胞,一小部分用来产生膜结合抗体,并长期生存,称记忆细胞。
同种抗原再次入侵时,记忆细胞可快速启动免疫系统,疫苗就是根据这一原理设计的。
抗体可结合抗原,并使其失活,称中和作用。
抗原-抗体复合物可以与吞噬细胞的Fc受体结合,促进吞噬作用,称调理作用。
抗原-抗体复合物可以与补体结合,补体使病原体穿孔崩裂,还可促进抗原-抗体复合物与吞噬细胞结合。
3.细胞免疫
由骨髓迁移到胸腺发育而成的T细胞种类极多,每种T 细胞含有一种多个特定的T细胞受体(TCR)。
T细胞按功能主要分为两个亚群:
T c细胞(细胞毒性T细胞)的受体与抗原肽-MHCI(主要组织相容性复合体I)复合物结合后,细胞被激活并大量增殖,增殖后的细胞产生穿孔素和颗粒酶,使受感染的细胞裂解,还可以使DNA内切酶激活,造成细胞凋亡。
T H细胞(辅助性T细胞)的受体与抗原肽-MHCII(主要组织相容性复合体II)复合物结合后,细胞被激活并大量增殖,产生多种细胞因子。细胞因子与T c细胞、T H细胞、B 细胞和吞噬细胞的特异性受体结合,促进其增殖。
T H细胞还可以促进一些抗原与B细胞结合,因此,T H细胞功能障碍会引起严重的疾病,如HIV引起的艾滋病。
(四)免疫组织和器官
骨髓和胸腺是B细胞和T细胞发育成熟的器官,称作中枢淋巴器官。
免疫细胞经血管和淋巴管网络在全身循环,并可在淋巴结和脾脏聚集,淋巴结和脾脏称
作外周淋巴器官。
上皮细胞下常有淋巴细胞聚集,因无包膜,称作淋巴组织。
二、免疫系统能识别自我和非我
存在于几乎所有细胞的表面,展示细胞内蛋白质分解产生的肽段,介导其与相应的Tc 细胞结合。能识别自身蛋白质分解产生的肽段的Tc细胞在发育过程中被清除。
存在于巨噬细胞和B细胞的表面,展示外来蛋白质分解产生的肽段。介导其与相应的Th细胞结合。
三、在细胞表面的分子相互作用引发免疫反应
四、免疫球蛋白的结构和类别
(一)免疫球蛋白的结构
免疫球蛋白G(IgG)是一类最简单的免疫球蛋白。IgG含有两条相同的重链(heavy chain)和两条相的轻链(light chain)。四条链通过二硫键共价联接成Y字形结构。每一免疫球蛋白分子含有二个抗原结合部位,它们位于Y形结构的二个顶点。
蛋白质结构与功能的关系 蛋白质的主要功能:已知有些蛋白质具有多种功能,也有些蛋白质功能至今尚未阐明。蛋白质在机体内几乎无处不发挥各种特有的功能。 1:构成细胞和生物体结构蛋白质是组成人体各种组织、器官、细胞的重要成分。人的肌肉,内脏、神经、血液、骨骼等,包括皮肤,毛发都含有丰富的蛋白质。蛋白质是细胞的重要结构组分,如膜蛋白质,细胞器的组成蛋白质,染色体蛋白质等。这些组织细胞每天都在不断的更新。因此,人体必须每天摄入一定量的蛋白质,作为构成和补充组织细胞的原料。 2:物质运输体内的各种物质主要通过血液进行运输。人体不断地从外界获取的营养物质和氧气运输到组织细胞,将代谢产生的废物排出体外。血红蛋白可以携带氧气到身体的各个部分,供组织细胞代谢使用。体内有许多营养素必须与某种特异的蛋白质结合,将其作为载体才能运转。例如血液中的载脂蛋白不仅运输脂质,还具有调节被运输脂质代谢的作用。清蛋白能与脂肪酸,ca2+.胆红素,磺酸等多种物质结合。此外,血浆中还有皮质激素传递蛋白,运铁蛋白,铜蓝蛋白等。 3:催化功能人体内每时每刻都进行着化学反应来实施新陈代谢。大量的酶类快速精准的催化化学反应,所有的生命活动都离不开酶和水的参与,没有酶就没有生命。这些各具特殊功能的酶,绝大多数是蛋白质。 4:信息交流存在于细胞膜上使细胞对外界刺激产生相应的效应的受体是蛋白质。信号转导通路中的衔接蛋白,含有各种能与其他蛋白质结合的结构域,能形成各种信号复合体。通过特异性的蛋白质—蛋白质相互作用形成蛋白质复合体来激活下游信号通路。 5:免疫功能保护机体抵抗相应病原体的感染的抗体、淋巴因子等免疫分子,都是蛋白质。6:氧化功能体内的蛋白质可以彻底氧化分解为水,二氧化碳,并释放能量。正常膳食情况下,机体首先利用糖提供能量。饥饿时,组织蛋白质分解增加,故氧化供能是蛋白质的生理功能。 7:维持机体的酸碱平衡机体内组织细胞必须处于合适的酸碱度范围内才能完成其正常的生理活动。机体的这种维持酸碱平衡的能力是通过肺,肾以及血液缓冲系统来实现的。蛋白质缓冲体系是血液缓冲系统的重要组成部分。因此,蛋白质在维持机体酸碱平衡方面起着十分重要的作用。 8:维持正常的血浆渗透压血浆胶体渗透压主要由蛋白质分子构成,其中,血浆清蛋白分子量较小,数目较多,决定血浆胶体渗透压的大小。血浆渗透压能使血浆和组织之间的物质交换保持平衡。如果血浆蛋白质特别是清蛋白的含量降低,血液内的水分便会过多地渗入周围组织,造成临床上的营养不良性水肿。
第一章蛋白质的结构与功能 【习题】 一、单项选择题 1. 蛋白质溶液的紫外吸收特征与下列哪组氨基酸有关: A. 甘氨酸、丙氨酸 B. 半胱氨酸、丝氨酸 C. 谷氨酸、天冬氨酸 D. 色氨酸、酪氨酸 E. 组氨酸、赖氨酸 2. 蛋白质变性时 , 下述哪项是错误的? A. 空间构象剧烈改变 B. 多肽链松散 C. 水中溶解度降低 D. 次级键破坏 E. 多肽链断裂 3. 下列哪项是利用蛋白质变性的原理 : A. 电泳分离蛋白 B. 盐析沉淀蛋白 C. 高温消毒物品 D. 稀释蛋白溶液 E. 低温保存蛋白 4. 下列哪种方法使蛋白质沉淀而不能使蛋白质变性 : A. 加热至沸 B. 加入 AgNO3 C. 加人 75% 乙醇 D. 加入三氯醋酸 E. 加入 (NH)2S04 5. 下列哪种氨基酸中含有巯基 :
A. 丙氨酸 B. 胱氨酸 C. 半胱氨酸 D. 蛋氨酸 E. 丝氨酸 6. 关于α螺旋的概念 , 下列哪项是错误的 : A. 一般为右手螺旋 B. 3.6 个氨基酸为一螺旋 C. 主要以氢键维系 D. 主要以二硫键维系 E. 氨基酸的侧链影响螺旋的形成 7. 关于蛋白质四级结构叙述 , 哪项是错误的: A. 亚基和亚基之间可以相同或不同 B. 亚基都具有生物学活性 C. 各亚基都具有三级结构 D. 亚基间以次级键相连 E. 蛋白质不一定都有四级结构 8.测得某血清标本的含氮量为 0.40g/L, 蛋白质的含量是 : A. 2.5g/L B .5g/L C. 2.0/L D. 6.25g/L E. 3g/L 9. 下列哪种氨基酸是环状亚氨酸: A. 苯丙氨酸 B. 色氨酸 C .脯氨酸 D. 酪氨酸 E. 组氨酸
蛋白质结构与功能的关系 (The relationship between protein structure and function) 摘要蛋白质特定的功能都是由其特定的构象所决定的,各种蛋白质特定的构象又与其一级结构密切相关。天然蛋白质的构象一旦发生变化,必然会影响到它的生物活性。由于蛋白质的构象的变化引起蛋白质功能变化,可能导致蛋白质构象紊乱症,当然也能引起生物体对环境的适应性增强!现而今关于蛋白质功能研究还有待发展,一门新兴学科正在发展,血清蛋白组学,生物信息学等!本文仅就蛋白质结构与其功能关系进行粗略阐述。 关键词:蛋白质结构;折叠/功能关系;蛋白质构象紊乱症;分子伴侣 Keywords:protein structure;fold/function relationship;protein conformational disorder;molecular chaperons 虽然蛋白质结构与生物功能的关系比序列与功能的关系更加紧密,但结构与功能的这种关联亦若隐若现,并不能排除折叠差别悬殊的蛋白质执行相似的功能,折叠相似的蛋白质执行差别悬殊功能的现象的存在。无奈,该领域仍不得不将100多年前Fisher提出的“锁一钥匙”模型(“lock—key”model)和50多年前Koshand提出的诱导契合模型(induce fitmodel)作为蛋白质实现功能的理论基础。这2个略显粗糙的模型只是认为蛋白质执行功能的部位局限在结构中的一个或几个小区域内,此类区域通常是蛋白质表面上的凹洞或裂隙。这种凹洞或裂隙被称为“活性部位(active site)”或“别构部位(fallosteric site)”,凹陷部位与配体分子在空间形状和静电上互补。此外,在酶的活性部位中还存在着几个作为催化基团(catalyticgroup)的氨基酸残基。对蛋白质未来的研究应从实验基本数据的归纳和统计入手,从原始的水平上发现蛋白质的潜藏机制【1】。 蛋白质结构与功能关系的研究主要是以力求刻画蛋白质的3D结构的几何学为基础的。蛋白质结构既非规则的几何形,又非完全的无规线团(randomcoil),而是有序(α一螺旋和β一折叠)与无序(线团或环域loop)的混合体。理解蛋白质3D结构的技巧是将结构简化,只保留某种几何特征或拓扑模式,并将其数字化。探求数字中所蕴含的规律,且根据这一规律将蛋白质进行分类,再将分类的结构与蛋白质的功能进行比较,以检验蛋白质抽象结构的合理性。如果一种对蛋白质结构的简化、比较和分类能与蛋自质的功能有较好地对应关系,那么这就是一种对蛋白质结构的有价值的理解。蛋白质结构中,多种弱力(氢键、范德华力、静电相互作用、疏水相互作用、堆积力等)和可逆的二硫键使多肽链折叠成特定的构象。从某种意义上说,共价键维系了蛋白质的一级结构;主链上的氢键维系了蛋白质的二级结构;而氨基酸侧链的相互作用和二硫桥维系着蛋白质的三级结构。亚基(subunit)内部的侧链相互作用是构象稳定的基础,蛋白质链之间的侧链的相互作用是亚基组装(四级结构)的基础,而蛋白质中侧链与配体基团问的相互作用是蛋白质行使功能的基础。 牛胰核糖核酸酶(RNase)变性和复性的实验是蛋白质结构与功能关系的很好例证。蛋白质空间结构遭到破坏;,可导致蛋白质的理比性质和生物学性质的变化,这就是蛋白质变性。变性的蛋白质,只要其一级结构仍然完好,可在一定条件下恢复其空间结构,随之理化性质和生物学性质也可重现,这被称为复性。RNase是由124个氨基酸残基组成的一条肽链,分子中8个半胱氨酸的巯基构成4对二硫键,进而形成具有一定空间构象的活性蛋白质。天然RNase遇尿素和β巯基乙醇时发生变性,其分子中的氢键和4个二硫键解开,严密的空间结构遭破坏,丧失了生物学活性,但一级结构完整无损。若去除尿素和β巯基乙醇,RNase又可恢复其原有构象和生物学活性。RNase分子中的8个巯基若随机排列成二硫键可有105种方式。有活性的RNase只是其中的一种,复性时之所以选择了自
蛋白质习题 一、是非题 1.所有蛋白质分子中N元素的含量都是16%。 2.蛋白质是由20种L-型氨基酸组成,因此所有蛋白质的分子量都一样。 3.蛋白质构象的改变是由于分子内共价键的断裂所致。 4.氨基酸是生物体内唯一含有氮元素的物质。 5.组成蛋白质的20种氨基酸分子中都含有不对称的α-碳原子。 6.用凝胶电泳技术分离蛋白质是根据各种蛋白质的分子大小和电荷不同。 7.蛋白质分子的亚基就是蛋白质的结构域。 8.在酸性条件下茚三酮与20种氨基酸部能生成紫色物质。 9.蛋白质变性是其构象发生变化的结果。 10.脯氨酸不能维持α-螺旋,凡有脯氨酸的部位肽链都发生弯转。 11.蛋日质的空间结构在很大程度上是由该蛋白质的一级结构决定的。 12.胶原蛋白在水中煮沸转变为明胶,是各种氨基酸的水溶液。 13.蛋白质和酶原的激活过程说明蛋白顺的一级结构变化与蛋白质的功能无关。 14.利用盐浓度的不同可以提高或降低蛋白质的溶解度。 15.血红蛋白比肌红蛋白携氧能力高.这是因为它有多个亚基。
二、填空题 1.20种氨基酸中是亚氨基酸.它可改变α-螺旋方向。 2.20种氨基酸中除外都有旋光性。 3.20种氨基酸中和分子量比较小而且不含硫,在折叠的多肽链中能形成氢键。 4.20种氨基酸中的一个环氮上的孤对电子,像甲硫氨酸一样,使之在血红蛋白分子中与铁离子结合成为配位体。 5.球蛋白分子外部主要是基团.分子内部主要是基团。 6.1953年英国科学家桑耳等人首次完成牛胰岛素的测定,证明牛胰岛素由条肽链共个氨基酸组成。 7.测定蛋白质浓度的方法有、、 8.氨基酸混合物纸层析图谱最常用的显色方法是 9.用紫外光吸收法测定蛋白质含量的依据是所有的蛋白质分子中都含有、、和三种氨 基酸。 10.1965年中国科学家完成了由53个氨基酸残基组成的的人工合成。 11.目前已知的蛋白质二级结构有、、、和几种基本形式。
蛋白质结构与功能的关系 蛋白质的结构包括一级结构、二级结构、三级结构、四级结构。 一级结构是蛋白质的一级结构指在蛋白质分子从N-端至C-端的氨基酸排列顺序。一级结构是蛋白质空间构象和特异生物学功能的基础,但不是决定蛋白质空间构象的唯一因素。 蛋白质的二级结构是指多肽链的主链骨架本身在空间上有规律的折叠和盘绕,它是由氨基酸残基非侧链基团之间的氢键决定的。常见的二级结构有α螺旋、三股螺旋、β折叠、β转角、β凸起和无规卷曲。α螺旋中肽链骨架围绕一个轴以螺旋的方式伸展,它可能是极性的、疏水的或两亲的。β折叠是肽链的一种相当伸展的结构,有平行和反平行两种。如果β股交替出现极性残基和非极性残基,那么就可以形成两亲的β折叠。β转角指伸展的肽链形成180°的U形回折结构而改变了肽链的方向。β凸起是由于β折叠股中额外插入一个氨基酸残基而形成的,它也能改变多肽链的走向。无规卷曲是在蛋白质分子中的一些极不规则的二级结构的总称。无规卷曲无固定走向,有时以环的形式存在,但不是任意变动的。从结构的稳定性上看,右手α螺旋>β折叠> U型回折>无规卷曲,但在功能上,酶与蛋白质的活性中心通常由无规卷曲充当,α右手螺旋和β折叠一般只起支持作用。 蛋白质的三级结构是指多肽链在二级结构的基础上,进一步盘绕、卷曲和折叠,形成主要通过氨基酸侧链以次级键以及二硫键维系的完整的三维结构。三级结构通常由模体和结构域组成。稳定三级结构的化学键包括氢键、疏水键、离子键、范德华力、金属配位键和二硫键。模体可用在一级结构上,特指具有特殊生化功能的序列模体,也可被用于功能模体或结构模体,相当于超二级结构。结构模体是结构域的组分,基本形式有αα、βαβ和βββ等。常见的模体包括:左手超螺旋、右手超螺旋、卷曲螺旋、螺旋束、α螺旋-环-α螺旋、Rossmann卷曲和希腊钥匙模体。结构域是在一个蛋白质分子内的相对独立的球状结构和/或功能模块,由若干个结构模体组成的相对独立的球形结构单位,它们通常是独自折叠形成的,与蛋白质的功能直接相关。一个结构域通常由一段连续的氨基酸序列组成。根据其占优势的二级结构元件的类型,结构域可分为五大类:α结构域、β结构域、α/β结构域、α+β 结构域、交联结构域。以上每一类结构域的二级结构元件可能有不同的组织方式,每一种组织就是一种结构模体。这些结构域都有疏水的核心,疏水核心是结构域稳定所必需的。 具有两条和两条以上多肽链的寡聚蛋白质或多聚蛋白质才会有四级结构。组成寡聚蛋白质或多聚蛋白质的每一个亚基都有自己的三级结构。蛋白质的四级结构内容包括亚基的种类、数目、空间排布以及亚基之间的相互作用。驱动四级结构形成或稳定四级结构的作用力包括
第一章蛋白质的结构与功能 一、填空题: 1、不同蛋白质的含量颇为相近,平均含量为____%。 2、蛋白质中存在种氨基酸,除了氨基酸外,其余氨基酸的α-碳原子上都有一个自由的基及一个自由的基。 3、在构成蛋白质的二十种基本氨基酸中,能形成二硫键的氨基酸是,分子量最小的氨基酸是,含有亚氨基的氨基酸是。 4、蛋白质具有两性电离性质,大多数在酸性溶液中带电荷,在碱性溶液中带负电荷。当蛋白质处在某一pH值溶液中时,它所带的正负电荷数,此时的蛋白质成为,该溶液的pH值称为蛋白质的________。 5、蛋白质的一级结构是指在蛋白质多肽链中的。 6、在蛋白质分子中,一个氨基酸的α碳原子上的与另一个氨基酸α碳原子上的_______脱去一分子水形成的键叫,它是蛋白质分子中的基本结构键。 7、一个四肽Lys-Val-His-Arg在pH=7溶液中进行电泳,它将向极方向移动。 8、蛋白质在280nm处有最大吸收峰,这是由于蛋白质分子中存在、和残基的缘故。 9、α—螺旋和β—折叠结构属于蛋白质的级结构,稳定其结构的作用力 是。 10、丝氨酸、苏氨酸及酪氨酸的极性是由侧链基团的基提供的;天冬酰胺和谷氨酰胺的极性是由其引起的,而半胱氨酸的极性则是因为含的缘故。 11、蛋白质颗粒表面的和是蛋白质亲水胶体稳定的两个因素。 12、蛋白质变性主要是因为破坏了维持和稳定其空间构象的各种键,使天然蛋白质原有的与性质改变。 13、.蛋白质分子二级结构常见的两种类型是和。 14、天然蛋白质分子中的α—螺旋都属于手螺旋。 15、核酸、蛋白质、淀粉的基本结构单元分别为:、 和。 16、20种常见蛋白质氨基酸中,含硫的是和__________;带有羟基的
举例说明蛋白质结构和功能的关系 答: 1.蛋白质的一级结构与功能的关系 蛋白质的一级机构指:肽链中氨基酸残基(包括二硫键的位置)的排列顺序。一级结构是蛋白质空间机构的基础,包含分子所有的信息,且决定蛋白质高级结构与功能。 ①一级结构的变异与分子病 蛋白质一级结构是空间结构的基础,与蛋白质的功能密切相关,一级机构的改变,往往引起蛋白质功能的改变。 例如:镰刀形细胞贫血病 镰刀形细胞贫血病的血红蛋白(HbS)与正常人的血红蛋白(HbA)相比,发现,两种血红蛋白的差异仅仅来源于一个肽段的位置发生了变化,这个差异肽段是位于β链N端的一个八肽。在这个八肽中,β链N端第6位氨基酸发生了置换,HbA中的带电荷的谷氨酸残基在HbS中被置换成了非极性缬氨酸残基,即蛋白质的一级机构发生了变化。 ②序列的同源性 不同生物中执行相同或相似功能的蛋白质称为同源蛋白质,同源蛋白质的一级机构具有相似性,称为序列的同源性。最为典型的例子, 例如:细胞色素C(Cyt c) Cyt c是古老的蛋白质,是线粒体电子传递链中的组分,存在于从细菌到人的所有需氧生物中。通过比较Cyt c的序列可以反映不同种属生物的进化关系。亲缘越近的物种,Cyt c中氨基酸残基的差异越小。如人与黑猩猩的Cyt c完全一致,人与绵羊的Cyt c有10个残基不同,与植物之间相差更多。蛋白质的进化反映了生物的进化。 2.蛋白质空间结构与功能的关系 天然状态下,蛋白质的多肽链紧密折叠形成蛋白质特定的空间结构,称为蛋白质的天然构象或三维构象。三维构象与蛋白质的功能密切相关。 ①一级结构与高级结构的关系: 一级结构决定高级机构,当特定构象存在时,蛋白质表现出生物功能;当特定构象被破坏时,即使一级构象没有发生改变,蛋白质的生物学活性丧失。例如:牛胰核糖核苷酸酶A(RNase A)的变性与复性 当RNase A处于天然构象是,具有催化活性; 当RNase A处于去折叠状态时,二硫键被还原不具有催化活性;当RNase A恢复天然构象时,二硫键重新形成,活性恢复。 ②变构效应 变构效应:是寡聚蛋白质分子中亚基之间存在相互作用,这种相互作用通过亚基构象的改变来实现。蛋白质在执行功能是时,构象发生一定变化。 例如:肌红蛋白、血红蛋白与氧的结合 两种蛋白质有很多相同之处,结构相似表现出相似功能。这两钟蛋白质都含有血红素 辅基,都能与氧进行可逆结合,因此存在着氧合与脱氧的两种结构形式。但是肌红蛋白几乎在任何氧分压情况下都保持对氧分子的高亲和性。血红蛋白则不同,在氧分压较高时,血红蛋白几乎被氧完全饱和;而在氧分压较低时,血红蛋白与氧的亲和力降低,释放出携带的氧并转移给肌红蛋白。
第一章蛋白质的结构与功能 [测试题] 一、名词解释:1.氨基酸 2.肽 3.肽键 4.肽键平面 5.蛋白质一级结构 6.α-螺旋 7.模序 8.次级键 9.结构域 10.亚基 11.协同效应 12.蛋白质等电点 13.蛋白质的变性 14.蛋白质的沉淀 15.电泳 16.透析 17.层析 18.沉降系数 19.双缩脲反应 20.谷胱甘肽 二、填空题 21.在各种蛋白质分子中,含量比较相近的元素是____,测得某蛋白质样品含氮量为15.2克,该样品白质含量应为____克。 22.组成蛋白质的基本单位是____,它们的结构均为____,它们之间靠____键彼此连接而形成的物质称为____。 23.由于氨基酸既含有碱性的氨基和酸性的羧基,可以在酸性溶液中带____电荷,在碱性溶液中带____电荷,因此,氨基酸是____电解质。当所带的正、负电荷相等时,氨基酸成为____离子,此时溶液的pH值称为该氨基酸的____。 24.决定蛋白质的空间构象和生物学功能的是蛋白质的____级结构,该结构是指多肽链中____的排列顺序。 25.蛋白质的二级结构是蛋白质分子中某一段肽链的____构象,多肽链的折叠盘绕是以____为基础的,常见的二级结构形式包括____,____,____和____。 26.维持蛋白质二级结构的化学键是____,它们是在肽键平面上的____和____之间形成。27.稳定蛋白质三级结构的次级键包括____,____,____和____等。 28.构成蛋白质的氨基酸有____种,除____外都有旋光性。其中碱性氨基酸有____,____,____。酸性氨基酸有____,____。 29.电泳法分离蛋白质主要根据在某一pH值条件下,蛋白质所带的净电荷____而达到分离的目的,还和蛋白质的____及____有一定关系。 30.蛋白质在pI时以____离子的形式存在,在pH>pI的溶液中,大部分以____离子形式存在,在pH 蛋白质结构与功能的关系 摘要:蛋白质特定的功能都是由其特定的构象所决定的,各种蛋白质特定的构象又与其一级结构密切相关。天然蛋白质的构象一旦发生变化,必然会影响到它的生物活性。由于蛋白质的构象的变化引起蛋白质功能变化,可能导致蛋白质构象紊乱症,当然也能引起生物体对环境的适应性增强!现而今关于蛋白质功能研究还有待发展,一门新兴学科正在发展,血清蛋白组学,生物信息学等!本文仅就蛋白质结构与其功能关系进行粗略阐述。 关键词:蛋白质分子一级结构、空间结构、折叠/功能关系、蛋白质构象紊乱症;分子伴侣正文: 1、蛋白质分子一级结构和功能的关系 蛋白质分子中关键活性部位氨基酸残基的改变,会影响其生理功能,甚至造成分子病(molecular disease)。例如镰状细胞贫血,就是由于血红蛋白分子中两个β亚基第6位正常的谷氨酸变异成了缬氨酸,从酸性氨基酸换成了中性支链氨基酸,降低了血红蛋白在红细胞中的溶解度,使它在红细胞中随血流至氧分压低的外周毛细血管时,容易凝聚并沉淀析出,从而造成红细胞破裂溶血和运氧功能的低下。 另一方面,在蛋白质结构和功能关系中,一些非关键部位氨基酸残基的改变或缺失,则不会影响蛋白质的生物活性。例如人、猪、牛、羊等哺乳动物胰岛素分子A链中8、9、10位和B链30位的氨基酸残基各不相同,有种族差异,但这并不影响它们都具有降低生物体血糖浓度的共同生理功能。 蛋白质一级结构与功能间的关系十分复杂。不同生物中具有相似生理功能的蛋白质或同一种生物体内具有相似功能的蛋白质,其一级结构往往相似,但也有时可相差很大。如催化DNA 复制的DNA聚合酶,细菌的和小鼠的就相差很大,具有明显的种族差异,可见生命现象十分复杂多样。 2、蛋白质分子空间结构和功能的关系 蛋白质分子空间结构和其性质及生理功能的关系也十分密切。不同的蛋白质,正因为具有不同的空间结构,因此具有不同的理化性质和生理功能。如指甲和毛发中的角蛋白,分子中含有大量的α-螺旋二级结构,因此性质稳定坚韧又富有弹性,这是和角蛋白的保护功能分不开的;而胶原蛋白的三股π螺旋平行再几股拧成缆绳样胶原微纤维结构,使其性质稳定而具有强大的抗张力作用 又如细胞质膜上一些蛋白质是离子通道,就是因为在其多肽链中的一些α-螺旋或β-折叠二级结构中,一侧多由亲水性氨基酸组成,而另一侧却多由疏水性氨基酸组成,因此是具有“两亲性”(amphipathic)的特点,几段α-螺旋或β-折叠的亲水侧之间就构成了离子通道,而其疏水侧,即通过疏水键将离子通道蛋白质固定在细胞质膜上。载脂蛋白也具有两亲性,既能与血浆中脂类结合,又使之溶解在血液中进行脂类的运输。 3、折叠/功能关系 体内各种蛋白质都有特殊的生理功能,这与空间构象有着密切的关系。肌红蛋门和血红蛋白是阐述空间结构与功能关系的典型例子。肌红蛋门(Mb))和血红蛋白(Hb)都是含血红素辅基的结合蛋白质。Mb有一条肽链,经盘曲折折叠形成三级结构,整条肽链由A~H8段α螺旋盘曲折叠成为球状,疏水氨基酸侧链在分子内部,亲水氨基酸侧链在分子外部,形成亲水的球状蛋白,血红素辅基位于Mb分子内部的袋状空穴中。Hb有四条肽链,两条β链也有与Mb 相似的A~H8段α螺旋,有两条α链只有7段α螺旋。Hb与Mb的折叠方式相似,也都能与氧进行可逆的结合。Hb的一个亚基与氧结合后可引起构象变化,是另一个亚基更易于与氧结合,这种带氧的亚基协助不带氧的亚基去结合氧的现象称为协同效应。氧与Hb结合后可 蛋白质预测分析网址集锦? 物理性质预测:? Compute PI/MW?? ?? SAPS?? 基于组成的蛋白质识别预测? AACompIdent???PROPSEARCH?? 二级结构和折叠类预测? nnpredict?? Predictprotein??? SSPRED?? 特殊结构或结构预测? COILS?? MacStripe?? 与核酸序列一样,蛋白质序列的检索往往是进行相关分析的第一步,由于数据库和网络技校术的发展,蛋白序列的检索是十分方便,将蛋白质序列数据库下载到本地检索和通过国际互联网进行检索均是可行的。? 由NCBI检索蛋白质序列? 可联网到:“”进行检索。? 利用SRS系统从EMBL检索蛋白质序列? 联网到:”,可利用EMBL的SRS系统进行蛋白质序列的检索。? 通过EMAIL进行序列检索? 当网络不是很畅通时或并不急于得到较多数量的蛋白质序列时,可采用EMAIL方式进行序列检索。? 蛋白质基本性质分析? 蛋白质序列的基本性质分析是蛋白质序列分析的基本方面,一般包括蛋白质的氨基酸组成,分子质量,等电点,亲水性,和疏水性、信号肽,跨膜区及结构功能域的分析等到。蛋白质的很多功能特征可直接由分析其序列而获得。例如,疏水性图谱可通知来预测跨膜螺旋。同时,也有很多短片段被细胞用来将目的蛋白质向特定细胞器进行转移的靶标(其中最典型的例子是在羧基端含有KDEL序列特征的蛋白质将被引向内质网。WEB中有很多此类资源用于帮助预测蛋白质的功能。? 疏水性分析? 位于ExPASy的ProtScale程序(?)可被用来计算蛋白质的疏水性图谱。该网站充许用户计算蛋白质的50余种不同属性,并为每一种氨基酸输出相应的分值。输入的数据可为蛋白质序列或SWISSPROT数据库的序列接受号。需要调整的只是计算窗口的大小(n)该参数用于估计每种氨基酸残基的平均显示尺度。? 进行蛋白质的亲/疏水性分析时,也可用一些windows下的软件如,bioedit,dnamana等。? 跨膜区分析? 有多种预测跨膜螺旋的方法,最简单的是直接,观察以20个氨基酸为单位的疏水性氨基酸残基的分布区域,但同时还有多种更加复杂的、精确的算法能够预测跨膜螺旋的具体位置和它们的膜向性。这些技术主要是基于对已知 生物化学名词解释 第一章蛋白质 1.amino acid:An organic acid with an α-carbon atom linked to a carboxylic acid, an amino group, a hydrogen atom, and a side chain (the R group). Twenty different amino acids are the building blocks of proteins. 2.peptide bond: A covalent linkage formed between the α-carboxyl group of one amino acid and the α- amino group of another. Also known as an amide bond. 3.peptide: Two or more amino acids covalently joined by peptide bonds. 4.polypeptide: A long chain of amino acids linked by peptide bonds; the molecular weight is generally less than 10,000. 5.Configuration. The spatial arrangement in which atoms are covalently linked in a molecule. 6.Conformation. The spatial arrangement of atoms in a protein is called its conformation. 7.primary structure :In a polymer, the sequence of amino acids and any interchain and intrachain disulfide bonds of a protein. This sequence is specified by genetic information. 8.secondary structure:The localized conformation of a protein. As the polypeptide chain folds, it forms certain localized arrangements of adjacent amino acids . 9.peptide unit: The six atoms of the peptide group (Cα1、C、O、N、H、Cα2) lie in a single plane, with the oxygen atom of the carbonyl group and the hydrogen atom of the amide nitrogen trans to each other. 10.T ertiary structure :The overall three-dimensional conformation of a protein in its native folded state. 11.The molecular chaperones are large, multisubunit proteins that accelerate the folding process by providing a protected environment where polypeptides fold into native conformations and form quaternary structures. 12.quaternary structure:In proteins containing more than one polypeptide chain, the spatial arrangements of those chains (subunits) and the nature of contacts among them. 13.subunit: The independently three-dimensional structure in a protein with quaternary structure. 14.allosteric effect:an effect that a small molecule, called an effector, noncovalently binds to a protein and alters its activity. 15.Bohr effect : increase in the concentration of H+ and Pco2 reduces oxygen affinity to hemoglobin 16.isoelectric point of protein: The pH at which a protein solute has no net electric charge and thus does not move in an electric field. 17.denaturation of protein : Many physical and chemical reagents (urea or SDS, etc.) that break noncovalent bonds disrupt secondary, tertiary, and quaternary structure of protein with attendant loss of biologic activity. 蛋白质的结构与功能概述 「考纲」 1.蛋白质的分子组成:①元素组成;②基本单位。 2.蛋白质的分子结构:①肽键与肽;②一级结构;③二级结构--α螺旋;④三级和四级结构概念。 3.蛋白质的理化性质:①等电点;②沉淀;③变性。 「考点」 1.蛋白质的含氮量平均为16%。 2.氨基酸是蛋白质的基本组成单位,除甘氨酸外属L-α-氨基酸。 3.酸性氨基酸:天冬氨酸、谷氨酸;碱性氨基酸:赖氨酸、精氨酸、组氨酸。 4.半胱氨酸巯基是GSH的主要功能基团。 5.一级结构的主要化学键是肽键。 6.维系蛋白质二级结构的因素是氢键 7.并不是所有的蛋白质都有四级结构。 8.溶液pH>pI时蛋白质带负电,溶液pH 9.蛋白质变性的实质是空间结构的改变,并不涉及一级结构的改变。 「试题」 (1~3题共用备选答案) A.蛋白质一级结构 B.蛋白质二级结构 C.蛋白质三级结构 D.蛋白质四级结构 E.单个亚基结构 1.不属于空间结构的是 答案:A 2.整条肽链中全部氨基酸残基的相对空间位置即是 答案:C 3.蛋白质变性时,不受影响的结构是 答案:A 4.维系蛋白质分子一级结构的化学键是 A.离子键 B.肽键 C.二硫键 D.氢键 E.疏水键 答案:B 5.变性蛋白质的主要特点是 A.不易被蛋白酶水解 B.分子量降低 C.溶解性增加 D.生物学活性丧失 E.共价键被破坏 答案:D 蛋白质二级结构是指分子中6. A.氨基酸的排列顺序 B.每一氨基酸侧链的空间构象 C.局部主链的空间构象 D.亚基间相对的空间位置 E. 每一原子的相对空间位置 答案: C 7.下列关于肽键性质和组成的叙述正确的是 A.由C α和 C-COOH组成 B.由Cα1 和Cα2组成 C.由 Cα和 N组成 D. 肽键有一定程度双键性质 E. 肽键可以自由旋转 答案: D ( 8~ 9题共用备选答案) A. 一级结构破坏 B.二级结构破坏 C. 三级结构破坏 D.四级结构破坏 E. 空间结构破坏 8.亚基解聚时 答案: D 9. 蛋白酶水解时 答案: A 10. 关于蛋白质二级结构的叙述正确的是指 A. 氨基酸的排列顺序 B.每一氨基酸侧链的空间构象 C.局部主链的空间构象 D.亚基间相对的空间位置 E.每一原子的相对空间位置 C 答案: 第一章蛋白质的结构和功能 1.有一混合蛋白质溶液,各种蛋白质的pI为4.6;5.0;5.3;6.7;7.3。电泳时欲使其中4种泳向正极,缓冲液的pH应该是 A.5.0B.4.0 C.6.0 D.7.0 E.8.0 2.下列蛋白质通过凝胶过滤层析柱时最先被洗脱的是 A.血清清蛋白(分子量68 500) B.马肝过氧化物酶(分子量247 500) C.肌红蛋白(分子量16 900) D.牛胰岛素(分子量5 700) E.牛β-乳蛋白(分子量35 000) 3.下列哪一物质不属于生物活性肽 A.胰高血糖素B.短杆菌素C.催产素D.胃泌素E.血红素 4.下列关于蛋白质结构叙述中,不正确的是 A.一级结构决定二、三级结构 B.二、三级结构决定四级结构 C.三级结构即具有空间构象 D.无规卷曲是在一级结构上形成的 E.α螺旋又称为二级结构 5. 在中性条件下混合氨基酸在溶液中的主要形式是 A 负电荷离子B.非极性分子C.正电荷离子D.疏水分子E.兼性离子 6.球蛋白分子中哪一组氨基酸之间可形成疏水键 A.Glu-Arg B.Tyr-Asp C.Ser-Thr D.Phe-Trp E.Asp-Glu 7.可以裂解肽链中蛋氨酸残基羧基末端的试剂有 A.羟胺B.溴化氰C.胃蛋白酶 D.中等强度的酸E.胰蛋白酶 8.有一血清清蛋白(pI=6.85)的混合物,在哪种条件下电泳、分离效果最好? A.pH4.9 B.pH5.9 C.pH6.5 D.pH8.6 E.pH3.5 9.使蛋白质和酶分子显示巯基的氨基酸是 A.蛋氨酸B.胱氨酸C.半胱氨酸D.谷氨酸E.赖氨酸 10.蛋白质分子引起280nm光吸收的最主要成分是 A.肽键B.半胱氨酸的一SH基 C.苯丙氨酸的苯环D.色氨酸的吲哚环 E.组氨酸的咪唑环(异吡唑环) 11.可用于测定多肽N端氨基酸的试剂有 A.丹磺酰氯B.β巯基乙醇C.溴化氰D.羟胺E.甲酸 第二章蛋白质的结构与功能 复习测试 (一)名词解释 1. 肽键 2. 结构域 3. 蛋白质的等电点 4. 蛋白质的沉淀 5. 蛋白质的凝固 (二)选择题 A型题: 1. 天然蛋白质中不存在的氨基酸是: A. 胱氨酸 B. 谷氨酸 C. 瓜氨酸 D. 蛋氨酸 E. 丝氨酸 2. 下列哪种氨基酸为非编码氨基酸: A. 半胱氨酸 B. 组氨酸 C. 鸟氨酸 D. 丝氨酸 E. 亮氨酸 3. 下列氨基酸中哪种氨基酸无 L型与D型氨基酸之分: A. 丙氨酸 B. 甘氨酸 C. 亮氨酸 D. 丝氨酸 E. 缬氨酸 4. 天然蛋白质中有遗传密码的氨基酸有: A. 8种 B. 61种 C. 12种 D. 20种 E. 64种 5. 测定100克生物样品中氮含量是2克,该样品中蛋白质含量大约为: A. 6.25% B. 12.5% C. 1% D. 2% E. 20% 6. 蛋白质分子中的肽键: A. 是一个氨基酸的α-氨基和另一个氨基酸的α-羧基形成的 B. 是由谷氨酸的γ-羧基与另一个氨基酸的α-氨基形成的 C. 氨基酸的各种氨基和各种羧基均可形成肽键 D. 是由赖氨酸的ε-氨基与另一分子氨基酸的α-羧基形成的 E. 以上都不是 7. 多肽链中主链骨架的组成是 A. –CNCCNCNCCNCNCCNC- B. –CCHNOCCHNOCCHNOC- C. –CCONHCCONHCCONHC- D. -CCNOHCCNOHCCNOHC- E. -CCHNOCCHNOCCHNOC- 8. 蛋白质的一级结构是指下面的哪一种情况: A. 氨基酸种类的数量 B. 分子中的各种化学键 C. 多肽链的形态和大小 D. 氨基酸残基的排列顺序 E. 分子中的共价键 9. 维持蛋白质分子一级结构的主要化学键是: A. 盐键 B. 氢键 C. 疏水键 D. 二硫键 E. 肽键 10. 蛋白质分子中α-螺旋构象的特点是: A. 肽键平面充分伸展 B. 靠盐键维持稳定 C. 螺旋方向与长轴垂直 D. 多为左手螺旋 E. 以上都不是 11. 下列哪种结构不属于蛋白质二级结构: A. α-螺旋 B. 双螺旋 C. β-片层 D. β-转角 E. 不规则卷曲 举例说明蛋白质的结构于其功能之间的关系。 1、蛋白质一级结构决定高级结构,高级结构决定生物功能。 2、在不同种属之间,有些 aa 发生变化,不影响他的生物功能,例如,胰岛素的种属差异十分明显,但不同种属间分离得到的胰岛素具有相同的将血糖作用,不同种属间胰分离得到的胰岛素具有相同的将血糖作用,不同种属间胰岛素的一级结构稍有不同,但功能相同,主要是不同种属间具有20个不变aa残基构成的保守区决定的。此外,还包括细胞色素c,肌红蛋白,血红蛋白等一级结构稍有不同,功能相似。 3、在不同种属之间,由于基因突变,有些 aa 发生微观变化就引起功能的明显变化。例如,人的镰刀状红细胞贫血病和地中海贫血病。人的血红蛋白 b 链中第 6 位 glu 被 val 代替,由一个 aa 的变化,导致红细胞呈镰刀状, 降低运氧能力一起细胞形态和功能的变化。力起细胞形态和功能的变化 4、总之,蛋白质一级结构中各 aa 贡献不同,不变残基在蛋白质高级结构和功能上起重要作用,可变残基发生改变,不引起功能变化。不变残基在功能上起作用,可变残基在蛋白质进化上起重要作用。 5、蛋白质高级结构与功能的高度统一,结构决定功能。如血红蛋白的变构效应。血红蛋白由 4 个亚基组成, 2 个 a 亚基 ,2 个 b 亚基,分子中的 a 亚基对氧的亲和力比 b 亚基大,能首先与第一个氧结合,导致 a 亚基构象发生变化,进而引起相邻的b 亚基的构象也发生变化进而引起相邻的 b 亚基的构象也发生变化,增强 b 亚基对氧的亲和力。由于导致整个血红蛋白分子构象发生改变,与氧的结合能力大大加强,在肺部充分利用氧,使氧分压不致过高,在血液流经组织内时,当第一个氧放出后,其余三个氧很快放出,供组织利用氧。 第二讲蛋白质的结构与功能(第二部份) Lecture 2 Structure and Function of Protein (Part II) (续) 2.5 升降β-筒(Up and Down β-barrel) 相邻及平行的β-链间以发卡连接形成升降形式的筒形结构。β-链间连接的β-转角常是底物结合位点(图34~35)。 图34 大豆胰蛋白酶抑制剂中的升降β-筒 Fig 34 The Up and Down β-barrel in Soybean Trypsin Inhibitor 图35 视黄醇结合蛋白中的升降β-筒 Fig 35 The Up and Down β-barrel in Retinol Binding Protein 2.6 β-三叶草折叠(β Trefoil Folds) “β-三叶草折叠”是β-折叠链盘绕形成近似的具有三重对称轴的“三叶草”样结构(图36)。 图36 刺酮胰蛋白酶抑制剂中的β-三叶草折叠 Fig 36 The β Trefoil Fold in Erythrina Trypsin Inhibitor 2.7 β-螺旋(β Helix) 由β-折叠链盘绕形成“螺旋”样结构,比较少见(图37)。 图37 果胶酸脂裂解酶C中的β-螺旋 Fig 37 The β Helix in Pectate Lyase C 3. 全α拓扑结构(All α Topologies) 此类拓扑结构全部由α-螺旋构成。α-螺旋常呈反平行排列或垂直连接。前述“EF手型模体”、“螺旋-转角-螺旋模体”、“同源结构域模体”以及“亮氨酸拉链模体”均属于此类拓扑结构。 3.1 升降螺旋束(Up and Down Helix Bundle) 相邻反向排列的αα模体首尾相连,每个螺旋向左倾斜18°,形成左手扭曲的筒形螺旋束。最常见的是4螺旋束,形成两层结合(图38~41)。 图38 细胞色素b562中的升降螺旋束 Fig 38 The Up and Down Helix Bundle in Cytochrome b562 图39 铁蛋白中的升降螺旋束 Fig 39 The Up and Down Helix Bundle in Ferritin 蛋白质组学 蛋白质是生物体的重要组成部分,参与几乎所有生理和细胞代谢过程。此外,与基因组学和转录组学比较,对一个细胞或组织中表达的所有蛋白质,及其修饰和相互作用的大规模研究称为蛋白质组学。 蛋白质组学通常被认为是在基因组学和转录组学之后,生物系统研究的下一步。然而,蛋白质组的研究远比基因组学复杂,这是由于蛋白质内在的复杂特点,如蛋白质各种各样的翻译后修饰所决定的。并且,研究基因组学的技术要比研究蛋白质组学的技术强得多,虽然在蛋白质组学研究中,质谱技术的研究已取得了一些进展。 尽管存在方法上的挑战,蛋白质组学正在迅速发展,并且对癌症的临床诊断和疾病治疗做出了重要贡献。几项研究鉴定出了一些蛋白质在乳腺癌、卵巢癌、前列腺癌和食道癌中表达变化。例如,通过蛋白质组学技术,人们可以在患者血液中明确鉴定出肿瘤标志物。表1列出了更多的蛋白质组学技术用于研究癌症的例子。 另外,高尔基体功能复杂。最新研究表明,它除了参与蛋白加工外,还能参与细胞分化及细胞间信号传导的过程,并在凋亡中扮演重要角色,其功能障碍也许和肿瘤的发生、发展有某种联系。根据人类基因组研究,约1000多种人类高尔基体蛋白质中仅有500~600种得到了鉴定,建立一条关于高尔基体蛋白质组成的技术路线将有助于其功能的深入研究。 蛋白质组学是一种有效的研究方法,特别是随着亚细胞器蛋白质组学技术的迅猛发展,使高尔基体的全面研究变为可能。因此研究人员希望能以胃癌细胞中的高尔基体为研究对象,通过亚细胞器蛋白质组学方法,建立胃癌细胞中高尔基体的蛋白质组方法学。 研究人员采用蔗糖密度梯度的超速离心方法分离纯化高尔基体,双向凝胶电泳(2-DE)分离高尔基体蛋白质,用ImageMaster 2D软件分析所得图谱,基质辅助激光解吸离子化飞行时间质谱(MALDI-TOF MS)鉴定蛋白质点等一系列亚细胞器蛋白质组学方法建立了胃癌细胞内高尔基体的蛋白图谱。 最后,人们根据分离出的纯度较高的高尔基体建立了分辨率和重复性均较好的双向电泳图谱,运用质谱技术鉴定出12个蛋白质,包括蛋白合成相关蛋白、膜融合蛋白、调节蛋白、凋亡相关蛋白、运输蛋白和细胞增殖分化相关蛋白。通过亚细胞器分离纯化、双向电泳的蛋白分离及MALDI-TOF MS蛋白鉴定分析,研究人员首次成功建立了胃癌细胞SGC7901中高尔基体的蛋白质组学技术路线。 3.1 蛋白质功能预测工具 也许生物信息学方法在癌症研究中最常用的就是基因功能预测方法,但是这些数据库只存储了基因组的大约一半基因的功能。为了在微阵列资料基础上完成功能性的富集分析,基因簇的功能注解是非常重要的。近几年生物学家研发了一些基因功能预测的方法,这些方法旨在超越传统的BLAST搜索来预测基因的功能。基因功能预测可以以氨基酸序列、三级结构、与之相互作用的配体、相互作用过程或基因的表达方式为基础。其中最重要的是基于氨基酸序列的分析,因为这种方法适合于微阵列分析的全部基因。 在表3中,前三项列举了三种同源搜索方法。FASTA方法虽然应用还不太广泛,但它要优于BLAST,或者至少相当。FASTA程序是第一个使用的数据库相似性搜索程序。为了达到较高的敏感程度,程序引用取代矩阵实行局部比对以获得最佳搜索。美国弗吉尼亚大学可以提供这项程序的地方版本,当然数据库搜索结果依赖于要搜索的数据库序列。如果最近的序列数据库版本在弗吉尼亚大学不能获得,那么就最好试一下京都大学(Kyoto University)的KEGG站点。PSI-BLAST(位点特异性反复BLAST)是BLAST的转化版本,PSI-BLAST的特色是每次用profile 搜索数据库后再利用搜索的结果重新构建profile,然后用新的profile再次搜索数据库,如此反复直至没有新的结果产生为止。PSI-BLAST先用带空位的BLAST搜索数据库,将获得的序列通过多序列比对来构建第一个profile。PSI-BLAST自然地拓展了BLAST方法,能寻找蛋白质序列中的隐含模式,有研究表明这种方法可以有效地找到很多序列差异较大而结构功能相似的相关蛋白,所以它比BLAST和FASTA有更好的敏感性。PSI-BLAST服务可以蛋白质的结构和功能的关系
蛋白质结构预测在线软件
名词解释 第一章 蛋白质的结构与功能
蛋白质的结构与功能概述
第一章蛋白质的结构和功能选择题
第1章 蛋白质结构与功能习题
蛋白质结构与功能关系
蛋白质的结构和功能
蛋白质功能-结构-相互作用预测网站工具合集