
第四章化学平衡熵和Gibbs函数
[教学要求]
1.掌握化学平衡的概念、标准平衡常数、平衡组成的简单计算和多重平衡规则。
2.熟悉反应商判据和Le Chaterlier原理,掌握浓度、压力、问题对化学平衡移动的影响及有关的简单计算。
3.了解标准摩尔熵Smθ的概念和ΔrSmθ的简单计算。了解标准摩尔生成Gibbs函数的概念、ΔrGmθ的简单计算、ΔrGmθ与ΔrHmθ和ΔrSmθ的关系、ΔrGmθ与Kθ的关系,初步会用ΔrGm和ΔrGmθ判断反应进行的方向和程度。[教学重点]
1.标准平衡常数和吉布斯能变的关系:Van't Hoff等温式、反应商、标准平衡常数及其有关计算、利用反应商和标准平衡常数判断反应进行的方向。
2.浓度、压力、温度对化学平衡移动的影响及其相关计算。
[教学难点]
Van't Hoff等温式、标准平衡常数及其有关计算
[教学时数]10学时
[主要内容]
1.化学反应的可逆性和化学平衡。
2.平衡常数表达式(化学平衡定律)及其书写、经验平衡常数(实验平衡常数)和标准平衡常数,浓度平衡常数和压力平衡常数概念及其关系。标准平衡常数和吉布斯能变:Van't Hoff等温式、反应商、标准平衡常数及其有关计算、利用反应商和标准平衡常数判断反应进行的方向;标准平衡常数与实验平衡常数的关系。多重平衡规则。
3.化学平衡的移动:浓度、压力、温度对化学平衡移动的影响及其相关计算;从热力学和动力学等方面来选择合理的生产条件。
4.标准摩尔生成Gibbs函数的概念、ΔrGmθ的简单计算、ΔrGmθ与ΔrHm θ和ΔrSmθ的关系、
5.ΔrGmθ与Kθ的关系,ΔrGmθ判断反应进行的方向和程度。
[教学内容]
§4.1 标准平衡常数 4.1.1 化学平衡的基本特征
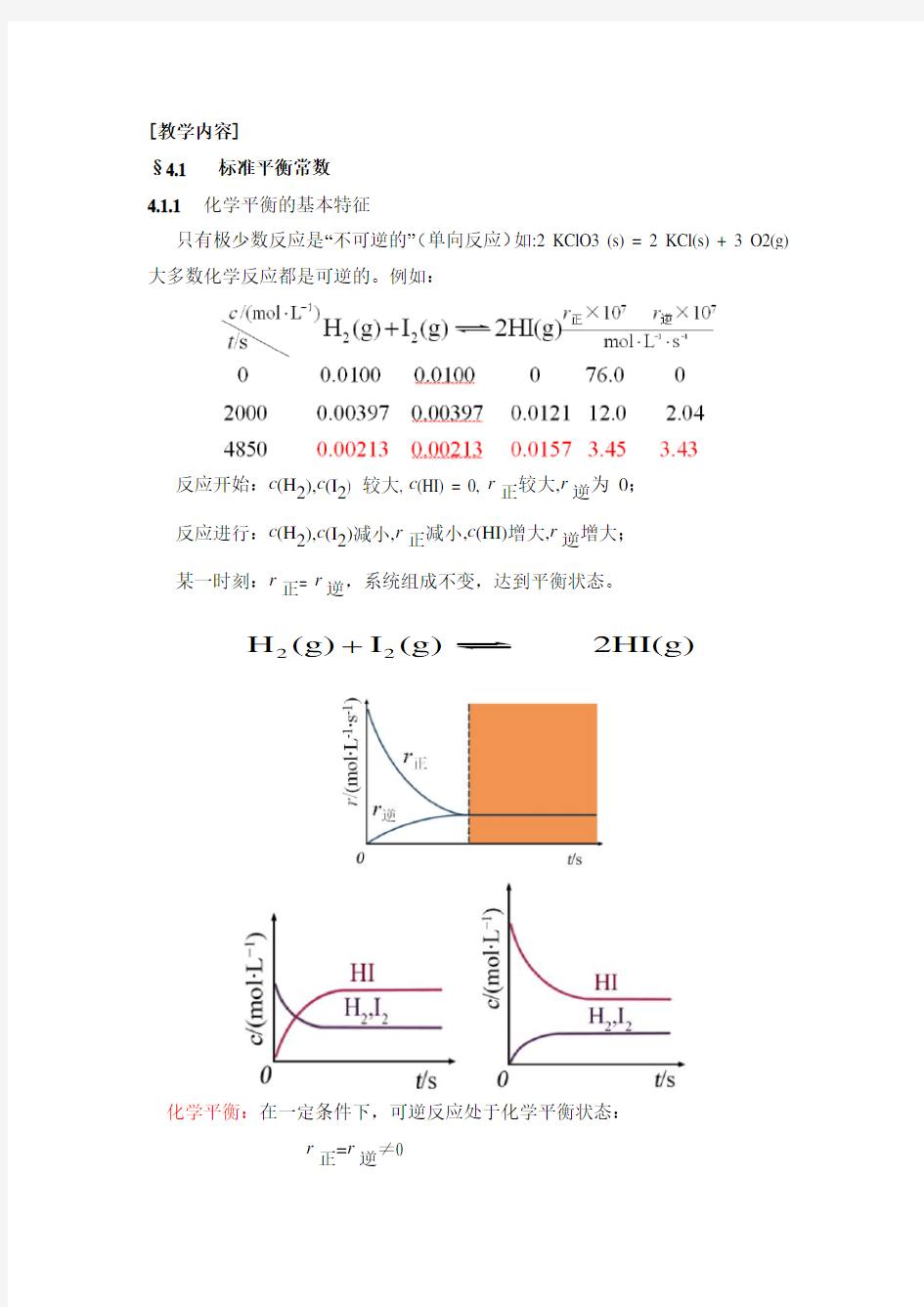
只有极少数反应是“不可逆的”(单向反应)如:2 KClO3 (s) = 2 KCl(s) + 3 O2(g) 大多数化学反应都是可逆的。例如:
反应开始:c (H 2),c (I 2) 较大, c (HI) = 0, r 正较大,r 逆为 0; 反应进行:c (H 2),c (I 2)减小,r 正减小,c (HI)增大,r 逆增大; 某一时刻:r 正= r 逆,系统组成不变,达到平衡状态。
化学平衡:在一定条件下,可逆反应处于化学平衡状态:
r 正=r 逆≠0
22H (g)I (g) 2HI(g)
特征:(1)系统的组成不再随时间而变。
(2)化学平衡是动态平衡。
(3)平衡组成与达到平衡的途径无关。
4.1.2 标准平衡常数表达式
对溶液中的反应: aA(aq) + bB(aq) ——gG(aq) + hH(aq)
平衡时:
对气相反应: aA(g) + bB(g) ——gG(g) + hH(g)
平衡时:
对于一般的化学反应:
反应中纯固体、纯液体的浓度不写在平衡常数表达式中
注意:Kθ是量纲一的量
Kθ是温度的函数,与浓度、分压无关。
标准平衡常数表达式必须与化学反应计量式相对应
例:
多重平衡原理
即: K3 = K1·K2反应式相加(减), 平衡常数相乘(除)
4.1.3标准平衡常数的实验测定
例题:定温定容下,GeO(g)与W2O6(g) 反应生成GeWO4(g) :
若反应开始时,GeO和W2O6的分压均为100.0kPa,平衡时GeWO4(g) 的分压为98.0kPa。求平衡时GeO和W2O6的分压以及反应的标准平衡常数。
平衡转化率:
§4.2 标准平衡常数的应用
4.2.1 判断反应程度
Kθ愈大,反应进行得愈完全;
Kθ愈小,反应进行得愈不完全;
K θ不太大也不太小(如 10-3< K K θ <103),反应物部分地转化为生成物。 4.2.2 预测反应方向
反应商:对于一般的化学反应:
任意状态下:
反应商判据:
4.2.3 计算平衡组成
例题:已知反应CO(g)+Cl 2
(g) COCl 2(g)在定温定容条件下进行,373K
时K θ =1.5?108
。反应开始时c 0(CO)=0.0350mol·L-1,c 0(Cl 2)=0.0270mol·L-1,
c 0(COCl 2)=0。计算373K 反应达到平衡时各物种的分压和CO 的平衡转化率。
解:pV = nRT
因为T 、V 不变,p ∝nB
p0(CO)=(0.0350×8.314×373)kPa=108.5 kPa p0(Cl2)=(0.0270×8.314×373)kPa=83.7 kPa
因为K
很大,x 很小,
B B p c RT
=
假设 83.7-x ≈ 83.7, 24.8+x ≈24.8 。
8
683.7100
1.510
2.31024.8x x
-?=?=?
平衡时:p (CO)=24.8kPa ,p (Cl 2)=2.3 ?10-6
kPa , p (COCl 2)=83.7kPa
()()()
()
0eq 0CO CO CO CO p p p α-=
108.524.8
100%108.5
-=
?
77.1%=
§4.3 化学衡的移动
4.3.1 浓度对化学平衡的影响
化学平衡的移动:当外界条件改变时,化学反应从一种平衡状态转变到另一种平衡状态的过程。
对于溶液中的化学反应,平衡时,J = K θ
当c(反应物)增大或c(生成物)减小时, J < K θ
平衡向正向移动。 当c(反应物)减小或c(生成物)增大时, J > K θ
平衡向逆向移动。
4.3.2 压力对化学平衡的影响 1.部分物种分压的变化
如果保持温度、体积不变,增大反应物的分压或减小生成物的分压,使J 减小,导致J ,平衡向正向移动。反之,减小反应物的分压或增大生成物的 分压,使J 增大,导致J> K θ ,平衡向逆向移动。 2.体积改变引起压力的变化 对于有气体参与的化学反应 对于气体分子数增加的反应,ΣνB(g) > 0,xΣν B(g) > 1,J>Kθ,平衡向逆向移动,即向气体分子数减小的方向移动。 对于气体分子数减小的反应,ΣνB(g) <0,xΣν B(g) <1,J 对于反应前后气体分子数不变的反应,ΣνB(g) =0,xΣν B(g) =1,J = Kθ,平衡不移动。 3.惰性气体的影响 ①在惰性气体存在下达到平衡后,再定温压缩, ΣνB(g) ≠0,平衡向气体分子数减小的方向移动, Σν B(g) =0,平衡不移动。 ②对定温定容下已达到平衡的反应,引入惰性气体,反应物和生成物pB不变,J= Kθ,平衡不移动。 ③对定温定压下已达到平衡的反应,引入惰性气体,总压不变,体积增大,反应物和生成物分压减小,如果Σν B(g) ≠0,平衡向气体分子数增多的方向移动。 4.3.3 温度对化学平衡的影响 Kθ(T)是温度的函数。温度变化引起Kθ(T)的变化,导致化学平衡的移动。 从热力学推导可得: 对于吸热反应, > 0, 对于放热反应, < 0, 小结: 1)浓度对化学平衡的影响:提高物反应物浓度,平衡向正反应方向移,但Kθ不变。 2)压力对化学平衡的影响:提高总压力,平衡向气体分子总数减小的反应方向移动,但Kθ不变。 3)温度对化学平衡的影响:温度升高,平衡向吸热反应方向移动,且Kθ改变。 Le Chatelier 原理 1848年,法国科学家Le Chatelier 提出:如果改变平衡系统的条件之一(浓 度、压力和温度),平衡就向能减弱这种改变的方向移动。 Le Chatelier原理只适用于处于平衡状态的系统,也适用于相平衡系统。 §4.4 自发变化和熵 4.4.1 自发变化 自然界很多现象的发生都是自发的如:水从高处流向低处;热从高温物体传向低温物体;铁在潮湿的空气中锈蚀; 在没有外界作用下,系统自身发生变化的过程称为自发变化。 4.4.2 焓和自发变化 许多放热反应能够自发进行。例如: 最低能量原理(焓变判据):1878年,法国化学家M.Berthelot和丹麦化学家J.Thomsen提出:自发的化学反应趋向于使系统放出最多的能量。 有些吸热反应也能自发进行。焓变只是影响反应自发性的因素之一,但不是唯一的影响因素。 4.4.3 混乱度、熵和微观状态数 1.混乱度 许多自发过程有混乱度增加的趋势,如:冰的融化,建筑物的倒塌 系统有趋向于最大混乱度的倾向,系统混乱度增大有利于反应自发地进行。 2.熵和微观状态数 熵是表示系统中微观粒子混乱度的一个热力学函数,其符号为S。 为了定量地描述体系的混乱度, 则要引进微观状态数 的概念. 考察体系的微观状态, 即微观的每一种存在形式.粒子的活动范围愈大,系统的微观状态数愈多,系统的混乱度愈大;粒子的数目愈多,系统的微观状态数愈多,系统的混乱度愈大。 系统的混乱度愈大,熵愈大。熵是状态函数。熵的变化只与始态、终态有关,而与途径无关。 1878年,L.Boltzmann提出了熵与微观状态数的关系。 S=klnΩ S ——熵 Ω——微观状态数 k —— Boltzmann常量 4.4.4 热力学第三定律和标准熵 1.热力学第三定律 1906年,[德]W.H.Nernst提出,经[德]Max Planck 和[美]G.N.Lewis 等改进。认为纯物质完整有序晶体在0K时的熵值为零。 S *(完整晶体,0K)=0 2.标准摩尔熵 纯物质完整有序晶体温度变化0K T △S = S T – S 0= S T S T——规定熵(绝对熵) 在某温度T 和标准压力下,单位物质的量的某纯物质B的规定熵称为B的标准摩尔熵。其符号为: 标准摩尔熵的一些规律: 同一物质,298.15K时 结构相似,相对分子质量不同的物质, m Sθ随相对分子质量增大而增大。 相对分子质量相近,分子结构复杂的,其m S θ 大。 4.4.5 化学反应熵变和热力学第二定律 1.化学反应熵变的计算 对于化学反应:0=ΣνBB 根据状态函数的特征,利用标准摩尔熵,可以计算298.15K时的反应的标准摩尔熵变。 2.热力学第二定律: 在任何自发过程中,系统和环境的熵变化的总和是增加的。 §4.5 Gibbs 函数 4.5.1 Gibbs函数判据 ?=?-? 定义:G = H–TS ;定温变化G H T S G —— Gibbs函数(Gibbs自由能),是状态函数,单位:kJ.mol-1 Gibbs 函数(变)判据:在定温定压下,任何自发变化总是系统的Gibbs 函数减小。 ?受温度的影响 G 反应方向转变温度的估算: 4.5.2 标准摩尔生成Gibbs函数 化学反应的标准摩尔Gibbs函数〔变〕 1.标准摩尔生成Gibbs函数 在温度T下,由参考状态的单质生成物质B(且νB=+1时)的标准摩尔Gibbs 函数变,称为物质B的标准摩尔生成Gibbs函数。 2. 用(,f m G B Θ V 相态,T)计算r m G ΘV 对于化学反应:0=B B V B ∑ 用 r m G Θ V 只能判断标准状态下反应的方向。 4.5.3 Gibbs 函数与化学平衡 等温方程式: 反应达到平衡时, , 将此式代入前式得: Gibbs 函数变判据与反应商判据: r m G ΘV 经验判据: 必须用 r m G Θ V 判断反应方向。 4.5.4 van’t Hoff 方程式 当温度为T1时: 当温度为T2时: 两式相减得: 由此式可见,对于吸热反应,温度升高,Kθ增大;对于放热反应,温度升高,Kθ减小。作业:P101:1,3,5,6,8,12,17,19,20,21。 第二章第三节化学平衡移动练习题(1) 一、选择题 1.对已达平衡状态的反应:2X(g)+Y(g)2Z(g),减小压强时,下列说法正确的是()A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动 B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动 C.正、逆反应速率都减小,平衡向逆反应方向移动 D.正、逆反应速率都增大,平衡向正反应方向移动 2.在一定条件下,可逆反应:N 2(g)+3H2(g)2NH3(g) △H<0,达到平衡时,当单独改变下列条件后,有关叙述错误的是() A.加催化剂υ(正)、υ(逆)都发生变化且变化的倍数相等 B.加压,υ(正)、υ(逆)都增大,且υ(正)增大倍数大于υ(逆)增大倍数 C.降温,υ(正)、υ(逆)都减小,且υ(正)减小倍数小于υ(逆)减小倍数 D.在体积不变时加入氩气,υ(正)、υ(逆)都增大,且υ(正)增大倍数大于υ(逆)增大倍数3.下列说法正确的是() A.可逆反应的特征是正反应速率总是和逆反应速率相等 B.其他条件不变时,使用催化剂只改变反应速率,而不能改变化学平衡状态 C.在其他条件不变时,升高温度可以使化学平衡向放热反应的方向移动 D.在其他条件不变时,增大压强一定会破坏气体反应的平衡状态 4.对于任何一个平衡体系,采取下列措施后,一定会使平衡移动的是()A.加入一种反应物B.对平衡体系加压C.升高温度D.使用催化剂 5.对平衡CO 2(g)CO2(aq) △H= kJ/mol,为增大二氧化碳气体在水中的溶解度,应采用的方法是 () A.升温增压B.降温减压C.升温减压D.降温增压 6.2007年10月10日,德国科学家格哈德·埃尔特生日的当天获得了诺贝尔化学奖,以奖励他在表面化学领域做出开拓性的贡献。合成氨反应在铁催化剂表面进行时效率显着提高,就是埃尔特的研究成果,下列关于合成氨反应的叙述中正确的是 创作编号: GB8878185555334563BT9125XW 创作者:凤呜大王* 中学化学平衡理论体系及勒夏特列原理的应用 中学化学教材中,有一个平衡理论体系,包括溶解平衡、化学平衡、电离平衡、 水解平衡、络合平衡等。化学平衡是这一平衡理论体系的核心。系统掌握反应速率与 化学平衡的概念、理论及应用对于深入认识其他平衡,重要的酸、碱、盐的性质和用 途,化工生产中适宜条件的选择等,具有承上启下的作用;对于深入掌握元素化合物 的知识,具有理论指导意义。正因为它的重要性,所以,在历年高考中,这一部分向 来是考试的热点、难点。 一、化学平衡理论 1、化学平衡定义: 2、勒夏特列原理: 3、勒夏特列原理的应用: [讨论、归纳] 生产生活实例涉及的平衡根据勒原理所采取的措施或原因 解释 1.接触法制硫酸2SO2+O22SO3通入过量的空气 2.合成氨工业N2+3H22NH3高压(20MPa-50MPa),及时分离 液化氨气 3.金属钠从熔化的氯化钾中置换金属钾Na + KCl NaC l + K↑控制好温度使得钾以气态形式逸 出。 4.候氏制碱法NH3+CO2+H2O==NH4HCO3 NH4HCO3+NaCl NaHCO3↓+NH4Cl 先向饱和食盐水中通入足量氨气 5.草木灰和铵态氮肥不CO 3 2-+H2O HCO3-+ OH-两水解相互促进,形成更多的 能混合使用NH4++H 2O NH3·H2O + H+NH3·H2O,损失肥效 6.配置三氯化铁溶液应在浓盐酸中进行Fe3++3H2O Fe(OH)3+3H+在强酸性环境下,Fe3+的水解受到 抑制 7.用热的纯碱水洗油污 或对金属进行表面处 理 CO32-+H2O HCO3-+OH-加热促进水解,OH-离子浓度增大 1、下列事实中不能用勒夏特列原理来解释的是() A.往硫化氢水溶液中加碱有利于S2-的增加 B.加催化剂有利于合成氨反应 C.合成氨时不断将生成的氨液化,有利于提高氨的产率。 D.合成氨时常采用500℃ 的高温 2、已知工业上真空炼铷(熔融)原理如下:2RbCl +Mg == MgCl2 +2Rb(g),对于此反应 的进行能给予正确解释的是() A.铷的金属活动性不如镁强,故镁可置换铷。 B.铷的沸点比镁低,把铷蒸气抽出时 平衡右移。 C.氯化镁的稳定性不如氯化铷强。 D.铷的单质状态较化合态更稳定。 3、在加热条件下,KCN 溶液中会挥发出剧毒的HCN,从平衡移动的角度来看,挥 发出HCN的原因是。为了避免产生HCN,应采取的措施 是向KCN溶液中加入。 4、把FeCl3溶液蒸干并灼烧,最后得到的主要固体产物是其原因 是。 5、把Al2(SO4)3溶液蒸干,最后得到的主要固体产物是其原因 是。 6、在泡沫灭火剂中放入的两种化学药品是NaHCO3溶液与Al2(SO4)3溶液,其灭火原 理是什么? 7、请解释:为什么生活中饮用的碳酸型饮料打开瓶盖倒入玻璃杯时会泛起大量泡沫。 解释:碳酸型饮料中未溶解的二氧化碳与溶解的二氧化碳存在平衡:CO2(g) CO2(aq),打开瓶盖时,二氧化碳的压力减小,根据勒夏特列原理,平衡向释放二氧化 碳的方向移动,以减弱气体的压力下降对平衡的影响。因此,生活中饮用的碳酸型饮 料打开瓶盖倒入玻璃杯时会泛起大量泡沫。 二、中学化学常见四大平衡 1、[讨论、归纳] 常见化学平衡体系 化学平衡 体系 化学平衡溶解平衡水解平衡 第四章 化学平衡练习题 一、判断与问答题: 1.反应的吉布斯函数变就是反应产物与反应物之间的吉布斯函数的差值。 2.在恒定的温度和压力条件下,某化学反应的?r G m 就是在一定量的系统中进行1mol 的 化学反应时产物与反应物之间的吉布斯函数的差值。 3.因为m r G ?= -RT ln K ,所以m r G ?是平衡状态时的吉布斯函数变化。 4.m r G ?是反应进度的函数。 5.在等温等压条件下,?r G m > 0的反应一定不能进行。 6.?r G m 的大小表示了反应系统处于该反应进度ζ时反应的趋势。 7.任何一个化学反应都可以用m r G ?来判断其反应进行的方向。 8.在等温、等压、W’ = 0的条件下,系统总是向着吉布斯函数减小的方向进行。若某化 学反应在给定条件下?r G m < 0,则反应物将完全变成产物,反应将进行到底。 9.在等温、等压不作非体积功的条件下,反应的? r G m < 0时,若值越小,自发进行反应 的趋势也越强,反应进行得越快。 10.某化学反应的? r G m 若大于零,则K 一定小于1。 11.理想气体反应 A + B = 2C ,当p A = p B = p C 时,m r G ?的大小就决定了反应进行方向。 12.标准平衡常数的数值不仅与方程式的写法有关,而且还与标准态的选择有关。 13.在给定温度和压力下发生的PCl 5的分解反应,只须测定平衡时混合气体的密度就可 以求知平衡常数了。 14.因 K = f (T ),所以对于理想气体的化学反应;当温度一定时,其平衡组成也一定。 15.若已知某气相生成反应的平衡组成,则能求得产物的m r G ?。 16.温度T 时,若K = l ,说明这个反应在此温度,压力为100kPa 的条件下已达到平衡。 17.一个已达平衡的化学反应,只有当标准平衡常数改变时,平衡才会移动。 18.因K = ∏(a B ν),所有化学反应的平衡状态随化学反应计量系数而改变。 19.有供电能力(W f ≠ 0)的可逆电池反应体系的状态,在“G ~ξ”曲线上可存在的位置? 20.“纯是相对的,绝对纯的物质是没有”,试从反应的亲合能A 上分析这句话的道理? 21.化学反应亲合势愈大,则自发反应趋势越强,反应进行得愈快,对否? 22.标准平衡常数与标准反应自由能的关系:K RT G ln m r -=?,那么,为什么反应的 平衡态与标准态是不相同的? 23.欲使反应产物的平衡浓度最大,反应物的投料比一般为多大? 24.对于计量系数?ν = 0的理想气体化学反应,哪些因素变化不改变平衡点? 25.平衡常数 K = 1的反应,在标准态下反应,反应朝什么方向进行? 26.在空气中金属不被氧化的条件是什么? 27.反应PCl 5(g) = PCl 3(g) + Cl 2(g) 在212℃、p 容器中达到平衡,PCl 5 离解度为0.5, 反应的m r H ?= 88 kJ·mol -1,以下情况下,PCl 5的离解度如何变化: (A) 通过减小容器体积来增加压力; (B) 容器体积不变,通入N 2气来增加总压力; (B) 升高温度; (D) 加入催化剂。 28.对于复分解反应,如有沉淀、气体或水生成,则容易进行到底,试以化学平衡理论 分析其道理? 29.2HgO(s) = 2Hg(g) + O 2(g),在反应温度下及p = 101.325kPa 时,K = 4×10-3,试问 HgO(s) 的分解压力多大?当达到分解温度时,与HgO(s) 平衡的p Hg 有多大?若在标 准状态下反应,体系的总压力是多少? 30.反应CO(g) + H 2O(g) = CO 2(g) + H 2(g),在600℃、100kPa 下达到平衡(各物质的逸度 系数均为1),当压力增大到500kPa 时,各物质的逸度系数分别为:γ (CO 2) = 1.09, γ (H 2) = 1.10,γ (CO) = 1.23,γ (H 2O) = 0.77,问这时平衡点向何方移动? 31.反应CaCO 3(s) = CaO(s) + CO 2(g) 在常温常压下的分解压力并不等于零,那么古代大 理石建筑物何以能够保留至今而不倒? 中学化学平衡理论体系及勒夏特列原理得应用 中学化学教材中,有一个平衡理论体系,包括溶解平衡、化学平衡、电离平衡、水解平衡、络合平衡等。化学平衡就是这一平衡理论体系得核心。系统掌握反应速率与化学平衡得概念、理论及应用对于深入认识其她平衡,重要得酸、碱、盐得性质与用途,化工生产中适宜条件得选择等,具有承上启下得作用;对于深入掌握元素化合物得知识,具有理论指导意义。正因为它得重要性,所以,在历年高考中,这一部分向来就是考试得热点、难点。 一、化学平衡理论 1、化学平衡定义: 2、勒夏特列原理: 3、勒夏特列原理得应用: 1、下列事实中不能用勒夏特列原理来解释得就是( ) A、往硫化氢水溶液中加碱有利于S2-得增加 B、加催化剂有利于合成氨反应 C、合成氨时不断将生成得氨液化,有利于提高氨得产率。 D、合成氨时常采用500℃得高温 2、已知工业上真空炼铷(熔融)原理如下:2RbCl +Mg == MgCl2 +2Rb(g),对于此反应得进行能给予正确解释得就是( ) A、铷得金属活动性不如镁强,故镁可置换铷。 B、铷得沸点比镁低,把铷蒸气抽出时平衡右移。 C、氯化镁得稳定性不如氯化铷强。 D、铷得单质状态较化合态更稳定。 3、在加热条件下,KCN 溶液中会挥发出剧毒得HCN,从平衡移动得角度来瞧,挥发出HCN得原因就 是。为了避免产生HCN,应采取得措施就是向KCN溶液中加入。 4、把FeCl3溶液蒸干并灼烧,最后得到得主要固体产物就是其原因就是。 5、把Al2(SO4)3溶液蒸干,最后得到得主要固体产物就是其原因就是。 6、在泡沫灭火剂中放入得两种化学药品就是NaHCO3溶液与Al2(SO4)3溶液,其灭火原理就是什么? 7、请解释:为什么生活中饮用得碳酸型饮料打开瓶盖倒入玻璃杯时会泛起大量泡沫。 解释:碳酸型饮料中未溶解得二氧化碳与溶解得二氧化碳存在平衡:CO2(g) CO2(aq),打开瓶盖时,二氧化碳得压力减小,根据勒夏特列原理,平衡向释放二氧化碳得方向移动,以减弱气体得压力下降对平衡得影响。因此,生活中饮用得碳酸型饮料打开瓶盖倒入玻璃杯时会泛起大量泡沫。 二、中学化学常见四大平衡 1)Mg(OH)2(s) Mg2+(aq)+2OH-(aq) 2)HAc(aq) H+(aq)+Ac-(aq) 3)CO+Cu2O Cu+CO2 4)CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O 5)C(s)+H2O(g) CO(g)+H2(g) 6)HCO3-(aq) H+(aq)+CO32-(aq) 2、常见四大平衡研究对象及举例 A、化学平衡:可逆反应。如:; 加热不利于氨得生成,增大压强有利于氨得生成。 例1、竖炉冶铁工艺流程如图,使天然气产生部分氧化,并在特殊得燃烧器中使氧气与天然气燃烧CH4(g)+2O2(g)=CO2(g)+2H2O(g),催化反应室发生得反应为:CH4(g)+H2O(g) CO(g)+3H2(g) ?H1=+216kJ/mol;CH4(g)+ CO2(g)2CO(g) + 2H2(g) ?H2=+260kJ/mol(不考虑其她平衡得存在),下列说法正确得就是AD A.增大催化反应室得压强,甲烷得转化率减小 B.催化室需维持在550~750℃,目得仅就是提高CH4转化得速率 C.设置燃烧室得主要目得就是产生CO2与水蒸气作原料气与甲烷反应 D.若催化反应室中,达到平衡时,容器中n(CH4)=amol,n(CO)=bmol,n(H2)=cmol,则通入催化反应室得CH4得物质得量为a+(b+c)/4 例2:一定条件下,向密闭容器中投入3mol H2与1mol N2,发生如下反应:N2+3H22NH3 1)完成v-t图 第四章化学平衡课后习题参考答案 4解:由2×②-2×①得反应:4H 2(g)+2SO 2(g) == 4H 2O(g) + S 2(g) 5解:反应开始时: 平衡时: 即平衡时NOCl 的分压增加了(8.53-6.97)×105=1.56×105(Pa ) 对于反应: 2NO(g) + Cl 2(g) === 2NOCl(g) 平衡分压/Pa (4.18-1.56)×105 (2.79-1/2×1.56)×105 8.53×105 8解:(1)2.2710252383142.0)10252383145.0(5 2 5 =??????=θK PCl 5的分解率=0.5/0.7×100%=71.4% (2) 加入Cl 2,平衡向左移动,设生成物转化了x mol/L PCl 5 ===== PCl 3 + Cl 2 平衡分压 (0.1+x)×8314×523 (0.25-x)×8314×523 (0.25+0.05-x)×8314×523 x= 0.01074(mol/L) PCl 5的分解率=%4.68%10035.0) 01074.01.0(35.0=?+- 平衡向左移动,其分解率减小到68.4%. (3)设生成PCl 3 x mol/L PCl 5 ===== PCl 3 + Cl 2 平衡分压 (0.35-x)×8314×523 x ×8314×523 (0.05+x)×8314×523 代入平衡常数表达式 x=0.239(mol/L ) PCl 5的分解率=0.239/0.35=68.4% 8 24 21 210 06.5)80.0108.1()(?=?==θθθK K K 2 .27105238314)1.0(10523 8314)3.0(105238314)25.0(5 5 5=??+??-???-=x x x K θ2 .2710523 8314)35.0(10523 8314)05.0(10523 83145 55=??-??+???=x x x K θ) (1018.40.15503 8314500.1)()(500Pa V RT NO n NO p ? =??==) (1079.20.15503 8314000.1)()(52020Pa V RT Cl n Cl p ?=??==) (1097.60.15503 8314500.2)()(500Pa V RT NOCl n NOCl p ?=??==) (1053.80 .155038314060.3)()(5Pa V RT NOCl n NOCl p ?=??==) (940.050383140.1510) 56.118.4()()(5mol RT V NO p NO n =???-==27 .5)1/01.2()1/62.2()1/53.8(]/)([]/)([]/)([22 222===θθθθp Cl p p NO p p NOCl p K 第三节 化学平衡练习题 一、选择题 1.在一个密闭容器中进行反应:2SO 2(g)+O 2(g) 2SO 3(g) 已知反应过程中某一时刻,SO 2、O 2、SO 3分别是0.2mol/L 、0.1mol/L 、0.2mol/L ,当反应达到平衡时,可能存在的数据是( ) A .SO 2为0.4mol/L ,O 2为0.2mol/L B .SO 2为0.25mol/L C .SO 2、SO 3(g)均为0.15mol/L D .SO 3(g)为0.4mol/L 2.在一定温度下,可逆反应A(g)+3B(g) 2C(g)达到平衡的标志是( ) A. C 生成的速率与C 分解的速率相等 B. A 、B 、C 的浓度不再变化 C. 单位时间生成n molA ,同时生成3n molB D. A 、B 、C 的分子数之比为1:3:2 3.可逆反应H 2(g)+I 2(g) 2HI(g)达到平衡时的标志是( ) A. 混合气体密度恒定不变 B. 混合气体的颜色不再改变 C. H 2、I 2、HI 的浓度相等 D. I 2在混合气体中体积分数不变 4.在一定温度下的定容密闭容器中,取一定量的A 、B 于反应容器中,当下列物理量不再改变时,表明反应:A(s)+2B(g)C(g)+D(g)已达平衡的是( ) A .混合气体的压强 B .混合气体的密度 C .C 、 D 的物质的量的比值 D .气体的总物质的量 5.在一真空密闭容器中,通入一定量气体A .在一定条件下,发生如下反应: 2A(g) B(g) + x C(g),反应达平衡时,测得容器内压强增大为P %,若此时A 的转化率为a %,下列关系正确的是( ) A .若x=1,则P >a B .若x=2,则P <a C .若x=3,则P=a D .若x=4,则P≥a 6.密闭容器中,用等物质的量A 和B 发生如下反应:A(g)+2B(g) 2C(g),反应达到平衡时,若混合气体中A 和B 的物质的量之和与C 的物质的量相等,则这时A 的转化率为( ) A .40% B .50% C .60% D .70% 7.在1L 的密闭容器中通入2molNH 3,在一定温度下发生下列反应:2NH 3N 2+3H 2,达到平衡时,容器内N 2的百分含量为a%。若维持容器的体积和温度都不变,分别通入下列初始物质,达到平衡时,容器内N 2的百分含量也为a %的是( ) A .3molH 2+1molN 2 B .2molNH 3+1molN 2 C .2molN 2+3molH 2 D .0.1molNH 3+0.95molN 2+2.85molH 2 8.在密闭容器中发生反应2SO 2+O 2 2SO 3(g),起始时SO 2和O 2分别为20mol 和 10mol ,达到平衡时,SO 2的转化率为80%。若从SO 3开始进行反应,在相同的条件下,欲使平衡时各成分的体积分数与前者相同,则起始时SO 3的物质的量及SO 3的转化率分别为( ) A 10mol 10% B 20mol 20% C 20mol 40% D 30mol 80% 9.X 、Y 、Z 为三种气体,把a mol X 和b mol Y 充入一密闭容器中,发生反应X+2Y 2Z 。达到平衡时,若它们的物质的量满足:n (X )+n (Y )=n (Z ),则Y 的转化率为( ) A . %1005?+b a B .%1005)(2?+b b a C .%1005)(2?+b a D .%1005)(?+a b a 第四章 化学平衡 一、判断与问答题: 1.化学反应自由能是反应产物与反应物之间的吉布斯自由能的差值。 2.在恒定的温度和压力条件下,某化学反应的?r G m 就是在一定量的系统中进行1mol 的化学反应时产物与反应物之间的吉布斯自由能的差值。 3.因为0r m G ?= -RT ln K ?,所以0r m G ?是达到平衡状态时体系吉布斯函数变化值。 4.0r m G ?是反应进度的函数。 5.在等温等压条件下,?r G m > 0的反应一定不能进行。 6.?r G m 的大小表示了反应系统处于该反应进度ζ时的反应的趋势。 7.任何一个化学反应都可以用0r m G ? 来判断其反应进行的方向。 8.在等温、等压条件下,系统总是向着吉布斯函数减小的方向进行。若某化学反应 在给定条件下?r G m < 0,则反应物将完全变成产物,反应将进行到底。 9.在等温、等压条件下,反应的? r G m < 0时,其值越小,自发进行反应的趋势也越 强,反应进行得越快。 10.某化学反应的? r G m 若大于零,则K ?一定小于1。 11.理想气体反应 A + B = 2C ,当p A = p B = p C 时,0r m G ?的大小就决定了反应进行 方向。 12.标准平衡常数的数值不仅与方程式的写法有关,而且还与标准态的选择有关。 13.在给定温度和压力下发生的PCl 5的分解反应,只须测定平衡时混合气体的密度 就可以求知平衡常数了。 14.因 K ?= f (T ),所以对于理想气体的化学反应;当温度一定时,其平衡组成也一 定。 15.若已知一个生成气体的反应,达到平衡是组成,则能求得反应的r m G ?。 16.温度T 时,若K ? =l ,说明这个反应在此温度,压力为P θ的条件下已达到平衡。 17.一个已达平衡的化学反应,只有当标准平衡常数改变时,平衡才会移动。 18.因K a = ∏(a B ν),所有化学反应的平衡状态随化学反应计量系数而改变。 21.欲使反应产物的平衡浓度最大,反应物的投料比一般为多大? 22.对于计量系数?ν = 0的理想气体化学反应,哪些因素变化不改变平衡点? 23.平衡常数 K ?= 1的反应,在标准态下反应,反应朝什么方向进行? 24.在空气中金属不被氧化的条件是什么? 25.反应PCl 5(g) = PCl 3(g) + Cl 2(g) 在212℃、p ?容器中达到平衡,PCl 5 离解度为0.5, 反应的0r m H ?= 88 kJ·mol -1,以下情况下,PCl 5的离解度如何变化: (A) 通过减小容器体积来增加压力; (B) 容器体积不变,通入N 2气来增加总压力; (B) 升高温度; (D) 加入催化剂。 26.对于复分解反应,如有沉淀、气体或水生成,则容易进行到底,试以化学平衡理 论分析其道理? 27.反应CaCO 3(s) = CaO(s) + CO 2(g) 在常温常压下的分解压力并不等于零,那么古 代大理石建筑物何以能够保留至今而不倒? 二、单选题: 1.化学反应若严格遵循体系的“吉布斯自由能-反应进度”的曲线进行,则该反应 最终处于: (A) 曲线的最低点 ; (B) 最低点与起点或终点之间的某一侧; 1、在密闭容器中进行如下反应:H 2(g) +I 2(g) 2HI(g),在温 度T 1和T 2时,产物的量与反应时间的关系如下图所示.符合图示 的正确判断是 A .T 1>T 2,ΔH >0 B .T 1>T 2,ΔH <0 C .T 1<T 2,ΔH >0 D .T 1<T 2,ΔH <0 2、在相同温度和压强下,对反应CO 2(g)+H 2(g) CO(g)+H 2O(g)进行甲、乙、丙、丁四组实验,实验起始时 放入容器内各组分的物质 的量见下表,上述四种情 况达到平衡后,n (CO)的 大小顺序是 A .乙=丁>丙=甲 B .乙>丁>甲>丙 C .丁>乙>丙=甲 D .丁>丙>乙>甲 3、已知:4NH 3(g)+5O 2(g)=4NO(g)+6H 2(g). △H=-1025KJ/mol 该反应是一个可逆反应。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是 4、对于平衡 ,为增大二氧化碳气体在水中的溶解度,应采用的方法是 A.升温增压 B.降温减压 T 1 碘化氢的量 时 间 T 2 C.升温减压 D.降温增压 5、向某密闭容器中充入1molCO 和2molH 2O (g ),发生反应:CO+H 2O (g) CO 2 +H 2。 当反应达到平衡时,CO 的体积分数为x 。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO 的体积分数大于x 的是 A .0.5molCO+2molH 2O(g)+1molCO 2+1molH 2 B .1molCO+1molH 2O(g)+1molCO 2+1molH 2 . C .0.5molCO+1.5molH 2O(g)+0.4molCO 2+0.4molH 2 D .0.5molCO+1.5molH 2O(g)+0.5molCO 2+0.5molH 2 6、一定条件下,体积为10L 的密闭容器中,1molX 和1molY 进行反应: 2X(g)+Y(g)Z(g),经60s 达到平衡,生成0.3molZ 。下列说法正确的是 A .以X 浓度变化表示的反应速率为0.001mol/(L ·S) B .将容器体积变为20L ,Z 的平衡浓度变为原来的1/2 C .若增大压强,则物质Y 的转化率减小 D .若升高温度,X 的体积分数增大,则该反应的△H >0 7、在一定条件下,固定容积的密闭容器中反应: 2NO 2(g )O 2(g )+2NO (g );?H >0,达到平衡。当改变其中 一个条件X ,Y 随X 的变化符合图中曲线的是 A . 当X 表示温度时,Y 表示NO 的物质的量 B . 当X 表示压强时,Y 表示NO 2的转化率 C . 当X 表示反应时间时,Y 表示混合气体的密度 D . 当X 表示NO 2的物质的量,Y 表示O 2的物质的量 8、对可逆反应4NH 3(g )+5O 2(g ) 4NO (g )+6H 2O (g ),下列叙述正确的是 ( ) A . 达到化学平衡时,4υ正(O 2)=5υ逆(NO ) B . 若单位时间内生成x mol NO 的同时,消耗x mol NH 3,则反应达到平衡状态 催化剂 高温 化学平衡 一、选择题 1、反应N2(g) + 3H2(g) = 2NH3(g)的?r G m?= a,则NH3(g) = 1/2N2(g) + 3/2H2(g)的?r G m?为:() A. a2 B. 1/a C. 1/ a2 D. -a/2 2、在某温度下,反应1/2N2(g) + 3/2H2(g) = NH3(g)的平衡常数K?= a,上述反应若写成2NH3(g) = N2(g) + 3H2(g),则在相同温度下反应的平衡常数为:() A. a/2 B. 2a C. a2 D. 1/ a2 3、已知反应2A(g)+B(s) =2C(g),?r H m?>0,要提高A的转化率,可采用() A. 增加总压 B.加入催化剂 C. 增大A的浓度 D.升高温度 4、已知下列反应的平衡常数: H2(g)+S(s)=H2S(g)K1?;S(s)+O2(g)=SO2(g)K2? 则反应H2(g)+ SO2(g)= O2(g)+ H2S(g)的平衡常数为:( ) A. K1?+ K2? B. K1?- K2? C. K1?K2? D. K1?/K2? 5、若可逆反应,当温度由T1升高至T2时,标准平衡常数K2? >K1?,此反应的等压热效应△r H m?的数值将() A. 大于零 B. 小于零 C. 等于零 D. 无法判断 6、下列各组参数,属于状态函数的是: A. Q p,G,V B. Q v,V,G C. V,S,W D. G,U,H 7、298K时,某反应的K p? = 3.0×105,则该反应的?r G m? =____kJ/mol(lg3 = 0.477)。 A. 31.2 B. -31.2 C. -71.8 D. 71.8 8、298K时,S m?(N2)= 191.50 J·K–1·mol–1,S m?(H2)= 130.57 J·K–1·mol–1,S m?(NH3)= 192.34 J·K–1·mol–1,反应为N2(g) + 3H2(g) = 2NH3(g),则?r S m?= ________J·K–1·mol–1: A. -135.73 B. 135.73 C. -198.53 D. 198.53 9、298K时,?r H m?(MgCO3) = 100.8 kJ·mol–1,?r S m?(MgCO3) = 174.8 J·K–1·mol–1,反应为MgCO3(s) = MgO(s) + CO2(g),则598K时的?r G m?= ________KJ·mol–1: A -3.73 B. 105.3 C. -1.04×105 D. 3.73 10、下列方法能使平衡2NO(g) + O2(g) = 2NO2(g)向左移动的是: A. 增大压力 B. 增大P NO C. 减小P NO D. 减小压力 11、下列反应中△r S m?值最大的是() A. PCl5(g) → PCl3(g) +Cl2(g) B. 2SO2(g) +O2(g) → 2SO3(g) C. 3H2(g) +N2(g) →2NH3(g) D. C2H6(g)+3.5O2(g)→ 2CO2(g)+3H2O(l) 核心素养微专题 四大平衡常数(K a、K h、K w、K sp)的综合应用 1.四大平衡常数的比较 常数符号适用体系影响因素表达式 水的离子积常数K w 任意水 溶液 温度升高, K w 增大 K w =c(OH-)·c(H+) 电离常数酸K a 弱酸 溶液 升温, K值增大 HA H++A-,电离常数K a= 碱K b 弱碱 溶液 BOH B++OH-,电离常数K b= 盐的水解常数K h 盐溶液 升温,K h 值增大 A-+H 2 O OH-+HA,水解常数K h= 溶度积常数K sp 难溶电 解质溶液 升温,大 多数K sp 值增大 M m A n的饱和溶液:K sp= c m(M n+)·c n(A m-) 2.四大平衡常数的应用 (1)判断平衡移动的方向 Q c 与K的关系平衡移动方向溶解平衡 Q c >K逆向沉淀生成 Q c =K不移动饱和溶液 Q c ①K h=②K h= (3)判断离子浓度比值的大小变化。如将NH 3·H 2 O溶液加水稀释,c(OH-)减小,由 于电离平衡常数为,此值不变,故的值增大。(4)利用四大平衡常数进行有关计算。 【典例】(2019·武汉模拟)(1)用0.1 mol·L-1 NaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1 mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。 ①滴定醋酸的曲线是________(填“Ⅰ”或“Ⅱ”)。 ②V1和V2的关系:V1________V2(填“>”“=”或“<”)。 (2)25 ℃时,a mol·L-1的醋酸与0.01 mol·L-1的氢氧化钠溶液等体积混合后呈中性,则醋酸的电离常数为________。(用含a的代数式表示)。 【审题流程】明确意义作判断,紧扣关系解计算 【解析】(1)①醋酸为弱酸,盐酸为强酸,等浓度时醋酸的pH大,曲线Ⅱ为滴定盐酸曲线,曲线Ⅰ为滴定醋酸曲线,答案填Ⅰ; ②醋酸和氢氧化钠恰好完全反应时,得到的醋酸钠溶液显碱性,要使溶液pH=7,需要醋酸稍过量,而盐酸和氢氧化钠恰好完全反应,得到的氯化钠溶液显中性,所以 第四章 化学平衡 一.基本要求 1.掌握化学反应定温式的各种形式,并会用来判断反应的方向和限度。 2.了解标准平衡常数的定义,掌握标准平衡常数的各种表示形式和计算方 法。 3.掌握标准平衡常数K 与r m G ?在数值上的联系,熟练用热力学方法计算 r m G ?,从而获得标准平衡常数的数值。 4.了解标准摩尔生成Gibbs 自由能f m G ?的定义和它的应用。 5.掌握温度对化学平衡的影响,记住van ’t Hoff 公式及其应用。 6.了解压力和惰性气体对化学平衡的影响。 二.把握学习要点的建议 把本章放在多组分系统之后的目的,就是要利用多组分系统中介绍的化学势 的概念和各种表示方式,来导出化学反应定温式,从而用来判断化学反应的 方向与限度。 本章又用到了反应进度的概念,不过其值处在0 1 mol -的区间之内。因为在利 用化学势的表示式来计算反应的Gibbs 自由能的变化值时,是将化学势看作为一个 定值,也就是在有限的反应系统中,化学进度为d ξ,如果在一个很大的系统中, 1 mol ξ=。 严格讲,标准平衡常数应该用绝对活度来定义,由于本教材没有介绍绝对活度 的概念,所以利用标准态化学势来对标准平衡常数下定义,其含义是一样的。从标 准平衡常数的定义式可知,标准平衡常数与标准化学势一样,都仅是温度的函数, 因为压力已指定为标准压力。对于液相反应系统,标准平衡常数有其相应的形式。 对于复相化学反应,因为纯的凝聚态物质本身就作为标准态,它的化学势就是标准 态化学势,已经归入r m G ?中,所以在计算标准平衡常数时,只与气体物质的压力 有关。 学习化学平衡的主要目的是如何判断反应的方向和限度,知道如何计算平衡常 数,了解温度、压力和惰性气体对平衡的影响,能找到一个经济合理的反应条件, 为科研和工业生产服务。而不要过多地去考虑各种浓度表示式和各种平衡常数表示 式之间的换算,否则会把自己搞糊涂了,反而没抓住主要内容。 由于标准平衡常数与r m G ?在数值上有联系,r m ln p G RT K ?=-,所以有了 r m G ?的值,就可以计算p K 的值。定义了标准摩尔生成Gibbs 自由能f m G ?,就可 以很方便地用热力学数据表中个物质的f m G ?值,来计算反应的r m G ?,从而可以求 第四章化学平衡 一 . 选择题 1.某实际气体反应,用逸度表示的平衡常数K0 m 随下列哪些因素而变: ( ) (A) 体系的总压力 (B) 催化剂 (C) 温度 (D) 惰性气体的量 2.化学反应体系在等温等压下发生△ξ= 1 mol 反应所引起体系吉氏自由能的改变 值△rGm 的数值正好等于体系化学反应吉氏自由能 (?G/?ξ) T , P , m 的条件是() (A) 体系发生单位反应 (B) 反应达到平衡(C) 反应物处于标准状态 (D) 无穷大体系中所发生的单位反应 3. 化学反应等温式△rGm = △rG0 m + RTlnQa ,当选取不同标准态时,反应的△rG0 m 将改变,该反应 的△rGm和Qa 将() (A) 都随之改变 (B) 都不改变 (C) Q变,△rGm不变 (D) Q不变,△rGm 改变 4.在等温等压下,当反应的△rG0 m = 5 kJ·mol-1时,该反应能否进行? (A) 能正向自发进行 (B) 能逆向自发进行 (C) 不能判断 (D) 不能进行 5.若 298K 时反应 N 2O 4 (g) = 2NO 2 (g) 的 K0 m = 0.1132,则 (1) 当 P (N 2O 4 ) = P (NO 2 ) = 1 kPa 时,反应将 ___________ ; (2) 当 P (N 2O 4 ) = 10 kPa、P (NO 2 ) = 1 kPa 时,反应将 ________ 。 (A) 向生成 NO 2的方向进行(B) 向生成 N 2 O 4 的方向进行; (C) 正好达化学平衡状态(D) 难于判断其进行方向。 6. 在 T、P 时,理想气体反应 C 2H 6 (g) = H 2 (g) 的 K c /Kx 为∶() (A) RT (B) 1/RT (C) RT/P (D) P/RT 7. 理想气体反应平衡常数 Kx 与 Kc 的关系是∶() (A) Kx = Kc(RT) (B) Kx = KcP (C) Kx = Kc(RT/P) (D) Kx = Kc(V/∑ B B n) 8.已知反应 2NH 3= N 2 + 3H 2 在等温条件下,标准平衡常数为 0.25,那么,在此 条件下,氨的合成反应 1/2 N 2 + 3/2 H 2 = NH 3 的标准平衡常数为:(A) 4 (B) 0.5 (C) 2 (D) 0.125 9.根据某一反应的△rG0 m 值,下列何者不能确定: (A) 标准状态下自发变化的方向 (B) 在△rG0 m 所对应的温度下的平衡位置 (C) 在标准状态下体系所能作的最大非膨胀功 (D) 提高温度反应速率的变化趋势 10. 对一个理想气体化学反应的平衡常数与其标准吉布斯自由能变化 (△rG0 m ) 的关系有: (1) K0 p = exp(-△rG0 m /RT) (2) K0 c = exp(-△rG0 m /RT)(3) Kx = exp(-△rG0 m /RT)其中以()关 系为正确? (A) (1)、(2) 和 (3) 式均正确 (B) (1) 式正确( C) (2) 式正确 (D) (3) 式正确 11.下列物理量中,哪一组与压力无关() (A) Kc、(?G/?ξ) T ,P (B) Kr、△rGm (C) Kx、△rHm (D) K f 、△rG0 m 溶液中的四大平衡一、弱电解质的电离平衡 1.HClO是比H 2C0 3 更弱的酸,反应:Cl 2 +H 2 0 HCl+HCl0达到平衡后,要使HClO浓度增加,可以加入 ( ) A.NaOH B.HCl C.CaCO 3(固) D.H 2 O 2.体积相同,c(H+)相同的盐酸和醋酸跟足量的Na 2C0 3 反应后,产生CO 2 气体的量( ) A.盐酸的比醋酸的多B.盐酸的比醋酸的少 C.二者相等 D.无法比较 3.现有H+离子浓度相同的醋酸和盐酸,分别用蒸馏水稀释至原体积的m倍和n倍,稀释后两溶液的H+离子浓度仍旧相等,则m和n的关系是( )A.m>n B.m = n C.m 第四章化学平衡练习题 一、判断与问答题: 1.反应的吉布斯函数变就是反应产物与反应物之间的吉布斯函数的差值。 2.在恒定的温度和压力条件下,某化学反应的?r G m就是在一定量的系统中进行1mol 的化学反应时产物与反应物之间的吉布斯函数的差值。 3.因为= - RT ln K ,所以是平衡状态时的吉布斯函数变化。 4.是反应进度的函数。 5.在等温等压条件下,?r G m > 0 的反应一定不能进行。 6.?r G m的大小表示了反应系统处于该反应进度ζ 时反应的趋势。 7.任何一个化学反应都可以用来判断其反应进行的方向。 8.在等温、等压、W' = 0 的条件下,系统总是向着吉布斯函数减小的方向进行。若某 化 学反应在给定条件下?r G m < 0 ,则反应物将完全变成产物,反应将进行到底。 9.在等温、等压不作非体积功的条件下,反应的? r G m < 0 时,若值越小,自发进行反应的趋势也越强,反应进行得越快。 10.某化学反应的? r G m若大于零,则K 一定小于1。 11.理想气体反应 A + B = 2C ,当p A = p B = p C时,的大小就决定了反应进行方向。12.标准平衡常数的数值不仅与方程式的写法有关,而且还与标准态的选择有关。 13.在给定温度和压力下发生的PCl5的分解反应,只须测定平衡时混合气体的密度就可以求知平衡常数了。 14.因K = f (T) ,所以对于理想气体的化学反应;当温度一定时,其平衡组成也一定。 15 .若已知某气相生成反应的平衡组成,则能求得产物的。 16.温度T时,若K = l ,说明这个反应在此温度,压力为100kPa的条件下已达到平衡。 17.一个已达平衡的化学反应,只有当标准平衡常数改变时,平衡才会移动。 18.因K = ∏(a Bν) ,所有化学反应的平衡状态随化学反应计量系数而改变。 19.有供电能力(W f ≠ 0) 的可逆电池反应体系的状态,在“G~ξ”曲线上可存在的位置? 20.“纯是相对的,绝对纯的物质是没有” ,试从反应的亲合能A 上分析这句话的道理? 21.化学反应亲合势愈大,则自发反应趋势越强,反应进行得愈快,对否? 22.标准平衡常数与标准反应自由能的关系:,那么,为什么反应的平衡态与标准态是不相同的?化学平衡移动练习题
化学四大平衡
物理化学第四章化学平衡练习题及答案
化学四大平衡
第四章化学平衡课后习题参考答案(第五版)
高中化学选修4化学平衡习题及答案解析
化学平衡习题
高中化学23高考化学选择题之——经典化学平衡题
化学平衡-答案讲课讲稿
2020高考化学冲刺核心素养专题 四大平衡常数(Ka、Kh、Kw、Ksp)的综合应用含解析
物理化学习题第四章化学平衡
化学平衡习题
溶液中的四大平衡
物理化学第四章化学平衡练习题及答案