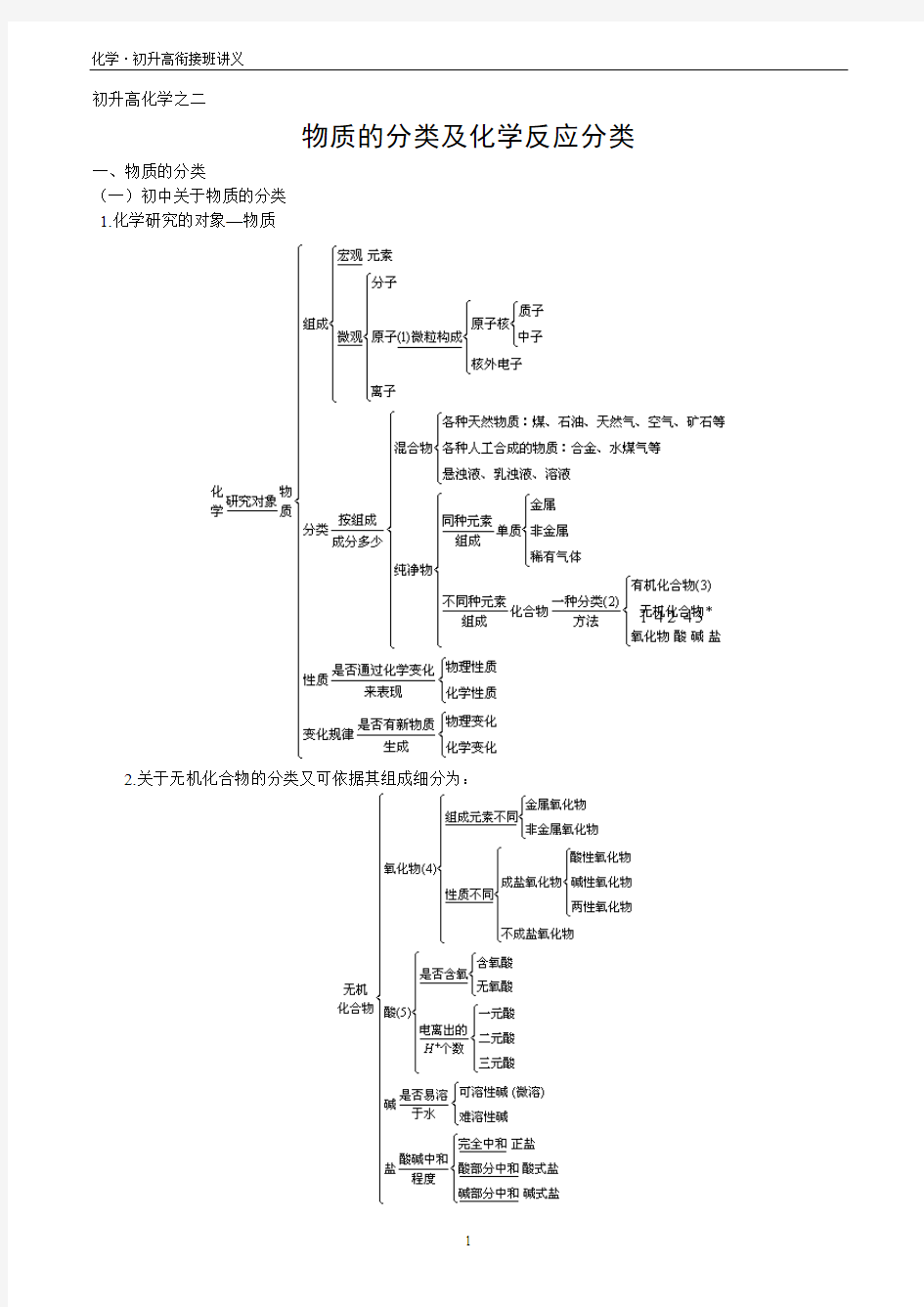

初升高化学之二
物质的分类及化学反应分类一、物质的分类
(一)初中关于物质的分类
1.化学研究的对象—物质
2.关于无机化合物的分类又可依据其组成细分为:
3.原子的构成
核外电子:每个电子带一个单位负电荷
原子质子:每个质子带一个单位正电荷
原子核
中子:不显电性
核电荷数=质子数=核外电子数
(二)高中关于物质的分类
1.根据物质在水溶液或熔融状态下能否导电分为电解质、非电解质;
2.根据形成过程分为离子化合物、共价化合物;
3.酸碱盐的分类(强弱,氧化性、非氧化性)。
4.溶液、交胶体、浊液
二、化学反应的分类
1. 四种基本反映类型
化合反应:
分解反应:
置换反应:
复分解反应:
2. 氧化反应与还原反应
氧化反应:
还原反应:
事实上,即使没有氧元素参加,同样可以发生氧化还原反应,有化合价升降的反应就是氧化还原反应。四种基本反应类型与氧化还原反应的关系可用图示表示为:
练习题(初中化学100个方程式)
物质与氧气的反应
1.氢气
2.碳完全燃烧
3.碳不完全燃烧
4.磷
5.硫
6.镁
7.铝
8.铁
9.铜
10.汞
11.一氧化碳
12.甲烷
13.乙烯(C2H4)
14.乙醇(C2H5OH)
15.葡萄糖(C6H12O6)
生成气体的分解反应
16.电解水
17.分解氧化汞
18.过氧化氢分解
19.氯酸钾分解
20.高锰酸钾分解
21.碳酸钙分解
22.碳酸分解
金属冶炼的有关反应
23.氧化铁与氢气
24.氧化铁与碳
25.氧化铁与一氧化碳
26.氧化铜与氢气
27.氧化铜与碳
28.氧化铜与一氧化碳
29.碳与二氧化碳
氧化物与水的反应
30.生石灰与水
31.二氧化碳与水
32.二氧化硫与水
33.三氧化硫与水
酸性氧化物与碱的反应
34.二氧化碳与氢氧化钠
35.二氧化碳与澄清的石灰水
36.二氧化硫与氢氧化钠
37.三氧化硫与氢氧化钠
碱性氧化物与酸的反应
38.氧化镁与盐酸
39.氧化镁与硫酸
40.氧化铝与盐酸
41.氧化铝与硫酸
42.氧化铜与盐酸
43.氧化铜与硫酸
44.氧化铁与盐酸
45.氧化铁与硫酸
46.氧化钙与盐酸
金属的置换反应
47.镁与盐酸
48.镁与硫酸
49.铝与盐酸
50.铝与硫酸
51.铁与盐酸
52.铁与硫酸
53.锌与盐酸
54.锌与硫酸
55.铁与硫酸铜溶液
56.铁与氯化铜溶液
57.锌与氯化铜溶液
58.锌与硫酸铜溶液
59.镁与硫酸铜溶液
60.镁与氯化铜溶液
61.铝与硫酸铜溶液
62.铝与氯化铜溶液
63.铜与硝酸银溶液
酸、碱、盐之间的复分解反应
酸—碱
64.盐酸与氢氧化钠
65.盐酸与氢氧化钾
66.硝酸与氢氧化钾
67.硫酸与氢氧化钠
68.盐酸与氢氧化镁
69.硫酸与氢氧化镁
70.盐酸与氢氧化钙
71.硫酸与氢氧化钙
72.盐酸与氢氧化铝
73.硫酸与氢氧化铝
74.盐酸与氢氧化铁
75.硫酸与氢氧化铁
76.盐酸与氢氧化铜
77.硫酸与氢氧化铜
酸—盐
78.盐酸与碳酸钠
79.硫酸与碳酸钠
80.盐酸与碳酸钾
81.硫酸与碳酸钾
82.盐酸与碳酸氢钠
83.盐酸与碳酸镁
84.硫酸与碳酸镁
85.盐酸与碳酸钙
86.盐酸与碳酸钡
87.盐酸与硝酸银溶液
88.硫酸与氯化钡溶液
89.硫酸与硝酸钡溶液
碱—盐
90.氢氧化钠与硫酸铜溶液
91.氢氧化钠与氯化铜溶液
92.氢氧化钙与碳酸钠溶液
盐—盐
93.氯化钠与硝酸银溶液
94.硝酸钡与碳酸钾溶液
95.碳酸钠与氯化钙溶液
96.硫酸铜与氯化钡溶液
97.硫酸铵与硝酸钡溶液
98.氯化铵与硝酸银溶液
溶洞形成的反应
99.碳酸钙与二氧化碳、水反应
100.碳酸氢钙受热分解
初中升高中衔接并不难 刚刚结束完中考的学生如今又该为新学期的到来忙碌了。初中升高中不仅是人生的一大转折,在学业上也有很大的变化。处在这一阶段的学生在学习进度、方法、习惯、心态等方面都要有一个逐渐适应的过程,如何做好初中升高中的衔接工作,成为当前一些学生和家长十分关注的问题。 昨日记者在采访时发现,许多家长为使孩子新学期尽快进入状态,除了为孩子准备学费、打点入学前的行装外,还为孩子选报预科班、找家教,有的家长甚至带孩子咨询心理医生,以期调整心态。 对此,市五中副校长李桂琴分析说,与初中相比,高中阶段学生所学知识的深度和广度发生变化,初中的知识相对浅显,重视知识的结果,而高中更重视知识内在联系和其形成过程,要求学生在理解记忆的基础上掌握知识的来龙去脉,对所学知识要融会贯通,对学生的抽象思维及逻辑思维都有较高的要求,所以,在从初中到高中的衔接工作中,提高学生自学能力和思维能力较为关键。 为此,李校长认为,高一新生应注重学习兴趣的培养,有明确的学习动机、目的和目标,要端正学习态度,逐步培养良好的学习习惯,对所学知识要进行系统复习,理清知识之间的内在联系。笔记、试卷、作业、小结要注意分类保存,尤其是对其中的重点、难点、易错点要反复思考和练习。对学习中遇到的问题不要轻易放过,要结合所学知识进行多方位、多角度思考和推敲。同时,学生在学习过程中必须保持不急不躁的平稳心态,按照学习计划稳步学习。其次,要正确对待学习成绩的起伏,不少初中成绩优秀的学生因为不适应高中的教学,找不到适合自己的学习方法而在学习上失去优势,从而一蹶不振,因此,学生应及时调整自己心态,不要盲目把自己定位在只能胜不能败上。同时,学生还应注意培养“临阵不乱”的良好心理素质。只要牢牢把握以上几个方面,就能很快适应高中生活。 https://www.doczj.com/doc/f118356083.html,.c
一. 初升高化学衔接班第5讲 专题五离子反应 二. 教学目标: 1. 了解并掌握电解质、非电解质,强、弱电解质等概念及其异同。 2. 掌握离子反应方程式的书写原则。 3. 会解相关的离子共存等题型。 三. 知识要点: (一)几对概念的辨析 1. 电解质与非电解质 (1)定义: 电解质:在水溶液里或熔融状态下能导电的化合物叫做电解质。如:酸、碱、盐非电解质:在水溶液里或熔融状态下都不能导电的化合物叫做非电解质。如:蔗糖、酒精。 (2)本质区别:在水溶液或熔融状态下能否导电。 (3)几点注意: ①电解质和非电解质都是化合物,单质既不属于电解质,也不属于非电解质。 ②电离是电解质溶液导电的前提。 ③能导电的物质不一定是电解质,如石墨等;电解质本身不一定能导电,如食盐晶体。 ④有些化合物的水溶液能导电,但因为这些化合物在水中或熔化状态下本身不能电离,故也不是电解质。如SO2、SO3、NH3、CO2等,它们的水溶液都能导电,是因为跟水反应生成了电解质,它们本身都不是电解质。 ⑤电解质溶液中,阳离子所带正电荷总数与阴离子所带负电荷总数是相等的,故显电中性,称电荷守恒。 2. 强电解质与弱电解质 (1)定义: 强电解质:在水溶液里全部电离成离子的电解质。如:NaCl、KOH、H2SO4 弱电解质:在水溶液里只有一部分电离成离子的电解质。如:CH3COOH、NH3·H-
2O (2)本质区别: 在水中的电离程度不同,强电解质全部电离,弱电解质仅部分电离且可逆。 (3)存在微粒: 强电解质中仅存在溶质电离出的离子(水合离子)。 弱电解质中存在溶质分子及部分电离出的离子(水合离子)。 (4)物质范围: 强电解质包括离子化合物与某些共价化合物。如:强酸(中学阶段有HCl 、HNO 3、H 2SO 4、HBr 、HI 、4HClO )强碱(KOH 、NaOH 、2)(OH Ba 、2)(OH Ca )及大多数盐(包括难溶的盐)。 弱电解质包括弱酸、弱碱、水及少数盐(有共价化合物倾向的盐)。 3. 导电性强弱:溶解度大小与电解质强弱 溶液导电性的强弱取决于在相同条件下溶液中自由离子的浓度及其所带的电荷。 溶液导电性的强弱与电解质在水中的溶解度及电离程度之间均没有必然联系。强电解质溶液的导电能力不一定强,溶解度大的电解质不一定是强电解质。如:COOH CH 3晶体(冰醋酸)易溶,但部分电离,为弱电解质,当浓度较大时,导电能力较强;4BaSO 晶体难溶,但溶解的部分全部电离,为强电解质,但其溶液导电能力较弱。 (二)离子反应及离子方程式 1. 离子反应:有离子参加或生成的反应。电解质在水溶液中的反应属于离子反应。 (1)离子反应的类型 ① 离子之间的交换反应 如:酸、碱、盐、氧化物之间的复分解反应等。 ② 离子参加的氧化还原反应 如:溶液中的置换反应等。 (2)离子反应发生的条件:向着降低某些离子的浓度或数目的方向进行,即有难溶物( )难电离的物质(O H 2等弱电解质、2CO 等非电解质、2H 金属及单质)生成时。 2. 离子方程式
前言 初中生经过中考的奋力拼搏,刚跨入高中,都有十足的信心、旺盛的求知欲,都有把高中课程学好的愿望。但经过一段时间,他们普遍感觉高中数学并非想象中那么简单易学,而是太枯燥、乏味、抽象、晦涩,有些章节如听天书。在做习题、课外练习时,又是磕磕碰碰、跌跌撞撞,常常感到茫然一片,不知从何下手。相当部分学生进入数学学习的“困难期”,数学成绩出现严重的滑坡现象。渐渐地他们认为数学神秘莫测,从而产生畏惧感,动摇了学好数学的信心,甚至失去了学习数学的兴趣。造成这种现象的原因是多方面的,但最主要的根源还在于初、高中数学教学上的衔接问题。下面就对造成这种现象的一些原因加以分析、总结。希望同学们认真吸取前人的经验教训,搞好自己的数学学习。 1 数学语言在抽象程度上突变。初、高中的数学语言有着显著的区别。初中的数学主要是以形象、通俗的语言方式进行表达。而高一数学一下子就触及抽象的集合语言、函数语言以及以后要学习到的逻辑运算语言、空间立体几何等。 2 思维方法向理性层次跃迁。高中数学思维方法与初中阶段大不相同。初中阶段,很多老师为学生将各种题建立了统一的思维模式,如解分式方程分几步;因式分解先看什么,再看什么。即使是思维非常灵活的平面几何问题,也对线段相等、角相等,分别确定了各自的思维套路。因此,初中学习中习惯于这种机械的、便于操作的定势方式。高中数学在思维形式上产生了很大的变化,数学语言的抽象化对思维能力提出了高要求。当然,能力的发展是渐进的,不是一朝一夕的。这种能力要求的突变使很多高一新生感到不适应,故而导致成绩下降。高一新生一定要能从经验型抽象思维向理论型抽象思维过渡,最后还需初步形成辩证型思维。 3现有初高中数学知识存在“脱节”。立方和与差的公式初中已删去不讲,而高中的运算还在用;因式分解初中一般只限于二次项且系数为“1”的分解,对系数不为“1”的涉及不多,但高中教材许多化简求值都要用到,如解方程、不等式等;二次根式中对分子、分母有理化初中不作要求,而分子、分母有理化是高中函数、不等式常用的解题技巧;二次函数、二次不等式与二次方程的联系,根与系数的关系(韦达定理)在初中不作要求,此类题目仅限于简单常规运算和难度不大的应用题型,而在高中二次函数、二次不等式与二次方程相互转化被视为重要内容,高中教材却未安排专门的讲授。 为了有效搞好初高中数学衔接,本篇讲义共28课时初高中课时比例约为1:5,并分为两部分:第一部分:方程与不等式;第二部分:集合与函数的概念。旨在为高中数学学习提供一个优良的基础。 1
初升高化学第十三讲 富集在海水中的元素—氯 一、氯元素的原子结构与自然界的存在 氯元素位于周期表周期族,在自然界中的主要存在形态:。全球海洋中含盐左右,主要为、。 二、活泼的黄绿色气体——氯气 1、氯气的物理性质:色有气味的体,毒,易, 溶于水,实验室中应怎样闻气体? 2、氯气的化学性质 由氯的原子结构示意图可知氯元素的性质如何?进而能否预测氯气的化学性质又怎样? 为什么? (1)与金属单质的反应: ①与钠反应方程式 现象: ②与铁反应方程式 现象: ③与铜反应方程式 现象: (2)与非金属单质反应: ①与氢气的反应:化学方程式:, 反应现象:氢气在氯气中燃烧; 氯气与氢气的爆炸实验。 ②Cl2和红磷反应:化学方程式:, 反应现象: 结论:分析以上反应中氯元素价态的变化也可得知:氯气是一种强氧化性物质,常氧化剂。 思考:在初中我们是如何定义燃烧的?现在通过氢气与氯气的燃烧实验,你有什么新的认识? (3)与水的反应: 与水反应的离子方程式:, 说明:氯气与水反应很微弱,且未可逆反应。 思考:1、氯水的成分?(氯水参加反应时,能表现多种性质) 2、氯水的保存方法?
(4)氯气与碱的反应及漂白粉 ①化学方程式:(常用于除去多余氯气) ②离子方程式: ③漂白液主要成分是。 ④漂白粉的制法:。其主要成分:,有效成 分:。漂粉精的有效成分:。 ⑤漂白原理: ClO-+ H+= HClO(实际漂白者), Ca(ClO)2 +_HCl(稀)= Ca(ClO)2 + CO2 + H2O = 三、次氯酸的性质 1、一元弱酸(比弱) 2、强氧化性(__、__、__) 3、不稳定(见光或受热分解):化学方程式:。 4、漂白性: 四、氯水和液氯的比较 液氯新制氯水久置氯水成分Cl2Cl2、HClO、H+、Cl-、ClO-、H2O、OH-H+、Cl-、H2O 分类纯净物混合物混合物 颜色黄绿色浅黄绿色无色 性质氧化性酸性、氧化性、漂白性酸性 五、氯离子的检验
初升高化学衔接班第1讲 一. 知识结构: ? ???? ? ????? ???? ? ?? ? ?? ??????????????????????? ??????????????????????????????? ????? ? ????? ? ???????????????????化学变化物理变化生成 是否有新物质变化规律化学性质物理性质来表现是否通过化学变化性质盐碱酸氧化物无机化合物有机化合物方法一种分类化合物组成 不同种元素稀有气体非金属金属单质组成同种元素 纯净物悬浊液、乳浊液、溶液合金、水煤气等各种人工合成的物质:石等 油、天然气、空气、矿各种天然物质:煤、石混合物成分多少 按组成分类离子核外电子中子质子原子核微粒构成原子分子微观元素宏观组成质 物研究对象 学 化 *)3()2()1( 关于无机化合物的分类又可依据其组成细分为:
???????? ?? ?? ? ????????????????????????????? ???????????? ? ? ? ??? ? ??????? ??????????+碱式盐碱部分中和酸式盐酸部分中和正盐完全中和程度 酸碱中和盐难溶性碱 微溶可溶性碱于水 是否易溶碱三元酸 二元酸一元酸个数电离出的无氧酸含氧酸 是否含氧酸不成盐氧化物两性氧化物碱性氧化物酸性氧化物成盐氧化物性质不同非金属氧化物金属氧化物 组成元素不同氧化物化合物 无机)()5()4(H 注: (1)高中将在此基础上进一步展开有关原子结构的学习。 (2)化合物的分类方法还有其他种,又如根据物质溶于水或熔化状态下能否导电可分为电解质、非电解质;根据其形成过程分为离子化合物、共价化合物等。 (3)有机化合物将作为高中化学的重要组成部分在以后学习中专项展开。 (4)氧化物:仅指两种元素组成其中一种是氧化物且氧元素的化合价为2-价的化合物,此外还有其他一些过氧化物,超氧化物等也将在高中陆续接触。 (5)酸(碱)也还有其他的分类方法,如:根据H 、O 以外元素是否有氧化性分为氧化性酸、非氧化性酸;根据酸在水溶液中是否完全电离分为强酸、弱酸等。 总之,以上总结是在初中学习的基础上,以后高中及未来的学习还要将这些知识进行加深,同学们对知识的理解要有发展的眼光,不要过于机械,应根据学习的深度和阶段及时修正自己的理解和认识。 二. 知识要点: 1. 把握概念间的关系。 化学基本概念及原理是学习化学的基础,对于初中化学而言,可以说是由概念组成的,概念之间有着密切的联系,也就构成了它们之间的关系。 从总体上看,化学概念间存在着以下三种关系: (1)排斥关系:即概念A 中包含的内容不属于概念B ,同时,概念B 中包含的内容也不属于概念A 。简述为是A 则非B ,是B 则非A 。可用图示表示为 A B ,初 中化学中属于这种关系的概念有很多组。 例如:纯净物和混合物、单质和化合物、氧化物与酸、碱、盐等。 (2)包含关系:即概念A (或B )中包含的内容全部属于概念B (或A ),而概念B (或A )中包含的内容不全属于概念A (或B )。简述为是A (或B )则一定是B (或A ),
新高一化学测试卷-暑假班 常见元素的相对原子质量: H-1,C-12,N-14,O-16,P-31,Na-23,Mg-24,Al-27,K-39 S-32,Cl-35.5,Ca-40,Fe-56,Cu-64,Zn-65,Ag-108,Ba-137; 一、单选题(共20题,每题2分,共40分) 1.碳的一种同位素14 6C可用于考古断代。下列关于14 6 C说法正确的是( B ) A.质子数为14 B.中子数为8 C.质量数为6 D.核外电子数为8 【解析】 根据14 6 C可知,质子数为6,质量数为14,中子数为14-6=8,核外电子数=质子数=6,B项正确。答案选B。 2.在任何原子里都具有的粒子是(C) A.质子、中子、电子 B.质子、中子 C.质子、电子 D.中子、电子 【解析】 原子是由居于原子中心带正电的原子核和核外带负电的电子构成,原子核是由质子和中子构成,但11H没有中子; 答案:C 3.下列各组微粒具有相同的质子数和电子数的是( D ) A.OH-、H2O B.NH3、NH4+ C.F-、NH4+ D.HCl、F2 【解析】 A.OH-的质子数为8+1=9,电子数为8+1+1=10;H2O的质子数为1×2+8=10,电子数为1×2+8=10,电子数相同质子数不相同,A不选; B.NH3的质子数为7+1?3=10,电子数为7+1?3=10;NH4+的质子数为7+1?4=11,电子数为 7+1?4-1=10,电子数相同质子数不同,B不选; C.F-的质子数为9,电子数为9+1=10;NH4+的质子数为7+1?4=11,电子数为7+1?4-1=10,电子数相同质子数不同,C不选; D.HCl的质子数为1+17=18,电子数为1+17=18;F2的质子数为9?2=18,电子数为9?2=18,电子数和质子数都相同,选D。 答案选D。 4.下列结构示意图所代表的微粒属于阴离子的是( A) A. B. C. D. 【解析】 核外电子数大于质子数即为阴离子,小于质子数则为阴离子,等于质子数,则不带电荷。根据结构示意图可判断, A是氧离子,B是氖原子,C是钠离子,D是镁原子, 答案选A。 5.下列有关物理量与其相应的单位不匹配的是( D ) A.摩尔质量:g /mol B.气体摩尔体积:L/mol C.物质的量:mol D.物质的量浓度:L/mol
初升高化学衔接班第1讲——物质的结构 一、知识回顾: 1.某饮料的标签上标有水质成分如下(mg/L):硒:锶:锌:钙:钠:。这里的硒、锶、锌、钙、钠是指() A、元素 B、原子 C、分子 D、离子 2.在化学知识抢答赛活动中,老师拿出一张卡片,标有“Cu“,要求学生说出其含义.下列说法中错误的是() 3.从分子、原子的观点分析,下列说法错误的是() A.1滴水中含有约×1021个水分子,说明水分子很小 B.墙内开花墙外香,说明分子在不断运动 ^ C.水蒸发变成水蒸气,水分子的化学性质发生了改变 D.25m3的石油气加压后可装入容积为的钢瓶中,说明分子间有一定的间隔 4.下列关于Fe、Fe2+、Fe3+的说法中,正确的是() ①它们的质子数不同 ②它们的核外电子排布不同 ③它们的最外层电子数不同 ④它们的相对原子质量相同 ⑤它们的化学性质相同 ⑥它们是同种元素. A.①③⑤B.②④⑤⑥C.②③④⑥D.①②③⑥ 5、在化学王国里,数字被赋予了丰富的内涵。对下列化学用语中数字“2”的说法正确的 是( ) ①2H ②2NH3③SO2④ 2 Cu O ⑤Mg2+⑥2OH-⑦H2O A.表示离子个数的是⑤⑥ B.表示离子所带电荷数的是④⑤ C.表示分子中原子个数的是③⑦ ; D.表示分子个数的是①② 6、指出下列化学符号中“2”所表示的含义
2 8 2 +12 , 2 8 7 +17 17 Cl 氯 12 Mg > 镁 (1) 2H ;(2) S 2– ; (3) 2Ca 2+ ; (4) H 2O 。 7、根据下图的有关信息判断,下列说法正确的是( ) A .镁离子(Mg 2+)核内有12个质子 B .镁的相对原子质量为 C .在化学反应中,氯原子容易失去1个电子 、 D .镁离子(Mg 2+)与氯离子(Cl - )的最外层电子数不相等 8.物质是由 、 、 等微粒构成的, 由 分 子 构 成 的 物 质 主 要 有 ; 由原子构成的物质主要有 ; 由 离 子 构 成 的 物 质 主 要 有 ; 二、课程精讲: 1911年,英国物理学家卢瑟福用一束带正电荷的α粒子轰击金箔时,发现大多数α粒子能穿透金箔,而且不改变原来的前进方向,但也有一小部分α粒子改变了原来的运动路径,甚至有极少数α粒子好像碰到了坚硬不可穿透的质点而被弹了回来。 卢瑟福提出了“核式原子模型”,较好的解释了原子核与核外电子的关系,那么,原
研究物质的实验方法(一) 一、考点清单 1. 了解分离、提纯的基本原理 2. 理解不同类型(固体与固体、固体与液体、液体与液体、溶液与胶体、气体与气体)混合物分离和提纯的方法 二、全面突破 知识点1:物质的分离和提纯 分离和提纯有什么不同? 分离——把混合物中几种物质分开,每一组分都要保留下来,若原来是固体,最后还是固体。 提纯——保留混合物中的某一主要组分,把其余杂质通过一定方法都除去。 分离提纯思想:用化学方法分离和提纯物质时要注意八个字“不增、不减、易分、复原” 不增:不加入新的物质 不减:不消耗被提纯的物质 易分:杂质转换为沉淀、气体等易分离除去。如:将NaCl溶液中可能存在的Na2SO4,转换为沉淀BaSO4分离的方法: 根据混合物中各物质溶解性、沸点、被吸附性能及在不同溶剂中溶解性的不同,可以选用过滤和结晶、蒸馏(或分馏)、纸上层析、萃取和分液等方法进行分离和提纯。 注意:不同的分离方法都有一定的适用范围,要根据不同混合物的性质选择合适的方法进行分离,且有时需要多种方法配合使用。 1. 过滤(注意点:一贴二低三靠) 原理:利用物质的溶解性差异,将液体和不溶于液体的固体分离开来。 实验用品:漏斗、滤纸、铁架台(铁圈)、烧杯、玻璃棒。通常用来分离液体和不溶的固体。
2. 蒸发 原理:利用加热的方法,使溶液中溶剂不断挥发的过程。 实验用品:蒸发皿、玻璃棒、酒精灯、铁架台(铁圈) 注意事项: a、蒸发皿中的溶液不超过容积的2/3; b、加热时要不断搅拌,防止局部温度过高而使溶液溅出; c、当析出大量晶体时就应熄灭酒精灯,利用余热蒸发至干。 d、不能把热的蒸发皿直接放在实验台上,应垫上石棉网。 3. 结晶 原理:使溶液过饱和,析出晶体,分离和提纯混合物的一种方法。 方法:减少溶剂,降温改变溶解度 通常适用于溶解度不同的固体混合物的分离:一种物质的溶解度受温度影响变化较大,而另一种物质溶解度受温度影响变化不大 4. 萃取 原理:利用溶质在不同溶剂里溶解度的不同,用一种溶剂把溶质从原来溶液中提取出来的方法 如:溴易溶于CCl4,溴难溶于H2O,所以CCl4可以把溴从溴和H2O组成的溶液中萃取出来 萃取剂选择条件: 1)萃取剂与原溶剂不混溶、不反应
【同步教育信息】 一. 本周教学内容: 初升高化学衔接班第1讲 二. 知识结构: ?????? ????? ????? ?? ??? ??????????????????????? ??????????????????????????????????????????? ???????????????????化学变化物理变化 生成是否有新物质变化规律 化学性质 物理性质 来表现是否通过化学变化性质盐碱酸氧化物无机化合物有机化合物方法一种分类化合物组成 不同种元素稀有气体非金属金属单质组成同种元素 纯净物悬浊液、乳浊液、溶液合金、水煤气等 各种人工合成的物质:石等 油、天然气、空气、矿各种天然物质:煤、石混合物成分多少 按组成分类离子核外电子中子质子原子核微粒构成原子分子微观元素宏观组成质 物研究对象学化 *)3()2()1( 关于无机化合物的分类又可依据其组成细分为:
???????? ?? ? ? ?????????????????? ????????? ??????????????? ??? ??? ???????? ????????? ?+碱式盐碱部分中和酸式盐 酸部分中和正盐完全中和程度酸碱中和盐难溶性碱 微溶可溶性碱于水 是否易溶碱三元酸二元酸一元酸个数电离出的无氧酸含氧酸是否含氧酸不成盐氧化物两性氧化物碱性氧化物酸性氧化物成盐氧化物性质不同非金属氧化物金属氧化物组成元素不同氧化物化合物无机) ()5()4(H 注: (1)高中将在此基础上进一步展开有关原子结构的学习。 (2)化合物的分类方法还有其他种,又如根据物质溶于水或熔化状态下能否导电可分为电解质、非电解质;根据其形成过程分为离子化合物、共价化合物等。 (3)有机化合物将作为高中化学的重要组成部分在以后学习中专项展开。 (4)氧化物:仅指两种元素组成其中一种是氧化物且氧元素的化合价为2-价的化合物,此外还有其他一些过氧化物,超氧化物等也将在高中陆续接触。 (5)酸(碱)也还有其他的分类方法,如:根据H 、O 以外元素是否有氧化性分为氧化性酸、非氧化性酸;根据酸在水溶液中是否完全电离分为强酸、弱酸等。 总之,以上总结是在初中学习的基础上,以后高中及未来的学习还要将这些知识进行加深,同学们对知识的理解要有发展的眼光,不要过于机械,应根据学习的深度和阶段及时修正自己的理解和认识。 三. 知识要点: 1. 把握概念间的关系。 化学基本概念及原理是学习化学的基础,对于初中化学而言,可以说是由概念组成的,概念之间有着密切的联系,也就构成了它们之间的关系。 从总体上看,化学概念间存在着以下三种关系: (1)排斥关系:即概念A 中包含的内容不属于概念B ,同时,概念B 中包含的内容也不属于概念A 。简述为是A 则非B ,是B 则非A 。可用图示表示为A B ,初中化学中属于这种关系的概念有很多组。 例如:纯净物和混合物、单质和化合物、氧化物与酸、碱、盐等。 (2)包含关系:即概念A (或B )中包含的内容全部属于概念B (或A ),而概念B (或A )中包含的内容不全属于概念A (或B )。简述为是A (或B )则一定是B (或A ),
教学资料—高一 一.高中常见的代数式恒等变形 知识点睛 1.我们在初中已经学习过了下列一些乘法公式 1)平方差公式 22))((b a b a b a -=-+; 平方和公式 6 ) 2)(1(3212222++= ++++n n n n 2)完全平方公式 2222)(b ab a b a +±=±。 我们还可以通过证明得到下列一些乘法公式: 1)立方和公式 3322))((b a b ab a b a +=+-+; 2)立方差公式 3322))((b a b ab a b a -=++-; 3)三数和平方公式 )(2)(2222ac bc ab c b a c b a +++++=++; 4)两数和立方公式 3223333)(b ab b a a b a +++=+; 5)两数差立方公式 3223333)(b ab b a a b a -+-=-; 6)常用公式 [] 222222)()()(2 1 c a c b b a ac bc ab c b a ±+±+±= ±±±++ 2.因式分解 因式分解的主要方法有:十字相乘法,提取公因式法,公式法,分组分解法,另外还应了解求根法及待定系数法,用求根法分解关于x 的二次三项式)0(02≠=++a c bx ax 。 若关于x 的方程)0(02≠=++a c bx ax 的两个实数根是21,x x ,则))((212x x x x a c bx ax --=++。 经典精讲 【例1】 1.已知1=+y x ,则xy y x 33 3++的值为________. 2.实数b a ,满足133 3 =++ab b a .则b a +=_________. 【例2】 因式分解 1. 673+-x x ; 2. 23323+++a a a 3. 12345-+-+-x x x x x
【同步教育信息】 一. 本周教学内容 初升高英语衔接班第6讲 再看宾语从句及初谈直接引语与间接引语 二. 重、难点 (一)宾语从句 宾语从句是名词性从句之一,在谓语动词、介词、动词不定式、分词、动名词之后都可带有宾语从句。某些形容词(如:sure , happy , glad , certain , pleased等)之后也可以带有宾语从句。 1. 由that引导的宾语从句:that引导的是一个陈述句,在宾语从句中只起连接的作用,没有含义,也不在从句中充当任何成份,因而在口语和非正式场合常可以省略,这一点请大家区分一下引导定语从句的that,这两种情况是很不相同的,不可混淆。 eg. I think that it is necessary for the people’s health to get rid of the pollution of noise . 我认为消除噪音污染对人们的健康是必要的。 Hearing that his son was badly wounded , he rushed to the hospital to see him . 他听说儿子受了重伤,急忙赶到医院去看望他。 The mother likes saying that she has a good daughter . 母亲喜欢说她有一个好女儿。 I am sure(that)she will like the present . 我确信她会喜欢这个礼物的。 We are glad(that)so many old friends will come to our party . 我们很高兴这么多老朋友要来参加我们的聚会。 The headmaster said that we would visit the science museum the next Sunday . 校长说下周日我们将去参观科学博物馆。 Our teacher of physics suggested that we(should)try to make some electronic toys ourselves . 我们的物理老师建议我们自己应试着做一些电动玩具。 注意:在suggest,demand,order,insist等表示“要求;建议”等的动词之后的宾语从句中,谓语用“动词原形或should+动词原形”结构。 2. 由whether,if引导的宾语从句,它们引导的是一般疑问句,在从句中有含义(是否),不充当成份,不可以省去。一般情况下,if和whether可以互换,但有的情况下只能用whether,不可用if: (1)当后接不定式时,只能用whether,不能用if。 (2)用于句首时不可用if,只能用whether表示“是否”。 (3)后面有or not时,只可以用whether,不能用if。 当然if还有“如果”之意,引导条件状语从句,而whether则无此功能。 eg. I want to know whether(if)you can repair the recorder for me . 我想知道你能否帮我修录音机。 She asked whether(if)there were any chemist’s shops in this street . 她问这条街上有没有药房。
初升高衔接并不难 刚刚结束完中考的学生如今又该为新学期的到来忙碌了。初中升高中不仅是人生的一大转折,在学业上也有很大的变化。处在这一阶段的学生在学习进度、方法、习惯、心态等方面都要有一个逐渐适应的过程,如何做好初中升高中的衔接工作,成为当前一些学生和家长十分关注的问题。 许多家长为使孩子新学期尽快进入状态,除了为孩子准备学费、打点入学前的行装外,还为孩子选报预科班、找家教,有的家长甚至带孩子咨询心理医生,以期调整心态。 对此,教育专家分析说,与初中相比,高中阶段学生所学知识的深度和广度发生变化,初中的知识相对浅显,重视知识的结果,而高中更重视知识内在联系和其形成过程,要求学生在理解记忆的基础上掌握知识的来龙去脉,对所学知识要融会贯通,对学生的抽象思维及逻辑思维都有较高的要求,所以,在从初中到高中的衔接工作中,提高学生自学能力和思维能力较为关键。 为此,我们认为,高一新生应注重学习兴趣的培养,有明确的学习动机、目的和目标,要端正学习态度,逐步培养良好的学习习惯,对所学知识要进行系统复习,理清知识之间的内在联系。笔记、试卷、作业、小结要注意分类保存,尤其是对其中的重点、难点、易错点要反复思考和练习。对学习中遇到的问题不要轻易放过,要结合所学知识进行多方位、多角度思考和推敲。同时,学生在学习过程中必须保持不急不躁的平稳心态,按照学习计划稳步学习。其次,要正确对待学习成绩的起伏,不少初中成绩优秀的学生因为不适应高中的教学,找不到适合自己的学习方法而在学习上失去优势,从而一蹶不振,因此,学生应及时调整自己心态,不要盲目把自己定位在只能胜不能败上。同时,学生还应注意培养“临阵不乱”的良好心理素质。只要牢牢把握以上几个方面,就能很快适应高中生活。 初中升高中思路变变变 小学升初中、初中升高中,不仅是人生的重大转折,在学业上也有了重大转变。小学与初中、初中与高中阶段的学生在学习进度、方法、习惯、心态等方面都将发生很大变化,如何做好各阶段的衔接,尤其是在即将到来的暑假里要做好哪些准备,本刊将陆续采访有关老师和专家,以便让小学进初中、初中进高中的新生们在各门功课方面适当做好衔接。 初中数学〉〉高中数学抽象理性复杂扔掉模式补好基础 —、高中数学与初中数学的不同之处: 1、高中数学内容抽象性、理论性更强,尤其是在高一代数中,首先碰到的就是理论性很强的函数,使一些初中数学很好的学生难以适应。 2、高中数学的思维方法向理性层次跃进,初中数学要简单些,按一定步骤就可解决,而高中数学的解题更复杂,要求学生多角度多方面思考。 3、知识内容有所增加,学生在同样时间内掌握知识的工作量要明显增多。 二、学生需要解决的问题: 1、依赖心理初中数学学习中,教师会列出中考各类型题目进行反复练习,学生易养成依赖老师、套用模式的习惯。高中这种模式就没有了。况且初中数学家长还可以稍加辅导,但到了高中,大多数家长局限水平已无法跟上。 2、思想松懈初中数学拔尖的学生,如果用初中方法学习高中,没有在思想上重视,方法上改变,容易跟不上。尤其是有的学生初一初二不努力,到了初三“临时抱佛脚”,也有可能成绩突飞猛进,但在高中数学中就很难办到,因为高一是高中三年中最关键、打基础的
以物质的量为桥梁的计算 一.质量、物质的量、微粒数目、气体体积、溶液的体积与浓度之间的相互计算 l .某气态氢化物H 2R 在标准状况下密度为1.52g/L ,R 的相对原子质量等于多少? (32) 2.ag 某气体在标准状况下的体积是bmL ,则该气体的式量为____。 3.在标准状况下: ①0.5molO 2占有的体积是多少? (11.L ) ②44.8LH 2的物质的量是多少? (2mol ) ③14gCO 的体积是多少? (11.2L ) ④33.6LN 2中含有的N 2分子数是多少? 4. 下列说法中正确的是( ) A. 摩尔既是物质的数量单位又是物质的质量单位 B. 物质的量既表示物质的数量又表示物质的质量 C. 阿伏加德罗常数是 C kg 1212中含有的碳原子数目 D. O molH 21中含有molH 2和molO 1 5. 气体的体积主要由以下什么因素决定的( ) ① 气体分子的直径 ② 气体物质的量的多少 ③ 气体分子间的平均距离 ④ 气体分子的相对分子质量 A. ①② B. ①③ C. ②③ D. ②④ 6. 将标准状况下的)(,1.0g aLHCl mol 溶于g 1000水中,得到盐酸密度为3 -?cm bg ,则该盐酸的物质的量浓度是( )
A. 1 4.22-?L mol a B. 122400-?L mol ab C. 1 5.3622400-?+L mol a ab D. 1 5.36224001000-?+L mol a ab 7. 与标准状况下VLCO 2所含氧原子数目相同的水的质量是( ) A. g V 4.2244 B. g V 4.22 C. g V 4.2236 D. g V 4.2218 8. 下列说法中正确的是( ) A. 1 1-?L mol 的NaCl 溶液是指此溶液中含有molNaCl 1 B. 从1L 15.0-?L mol 的NaCl 溶液中取出mL 100溶液,其物质的量浓度变为11.0-?L mol C. 0℃时,21molCl 的体积约为L 4.22 D. 11-?L mol 的2CaCl 溶液中,-Cl 的物质的量浓度为1 2-?L mol 9. 某元素1个原子的质量为a g ,1个C 12原子的质量为bg ,阿伏加德罗常数为A N ,则该元素的相对原子质量是( ) A. a b 12 B. b a 12 C. A N a D. A N a ? 10. 同温同压下,等质量的同组物质占有相同体积的是( ) A. CO 和CO 2 B. CO 和N 2 C. Cl 2和Br 2 D. HF 和HCl 11. 若20g 密度为3-?cm dg 的硝酸钙溶液中含有+21gCa ,则- 3NO 离子的物质的量浓度是( ) A. 1 400-?L mol d B. 120-?L mol d C. 15.2-?L dmol D. 125.1-?L dmol 12. 体积相同的2MgCl 溶液和3AlCl 溶液中的-Cl 个数若相同,则可推知2MgCl 和3 AlCl 溶液物质的量浓度之比为( ) A. 1:1 B. 2:1 C. 3:2 D. 2:3 13. mL 300某浓度的NaOH 溶液中含有g 60溶质。现欲配制NaOH L mol 11-?溶液,应取 原溶液与蒸馏水的体积比约为( )(设配成后体积为原液体体积和) A. 4:1 B. 5:1 C. 1:2 D. 3:2 14. 同温、同压下,某容器充满O 2重116g ,若充满CO 2重122g ,现充满某气体重114g , 则
一、分散系及其分类 1.概念 把 分散在 中所得到的体系,其中 的物质称为分散质; 的物质称为分散剂 2.分类 (1)按照分散系组成部分的状态分类 以分散质或分散剂所处的状态为标准,共有9种组合: (2)按照分散质粒子大小分类 二、胶体的制备 向中加入1~2mL FeCl 3饱和溶液,继续 至溶液呈 色,停止加热即制得Fe(OH)3胶体,胶体的分散质能通过 ,而浊液的分散质不能。当光束通过Fe(OH)3胶体时,可以看到 ,这是由于 形成的,这种现象叫做 。纳米粒子的尺寸与 的大致相当。 上面称为煮沸法,胶体还能用超声波法、喷雾法等。胶体提纯精制用渗析法,如食盐和淀粉胶体我们用半透膜进行分离。 三、胶体的性质 1.丁达尔现象:一束光线通过胶体时会看到一条光亮的 。常用于区别胶体。 2.布朗运动:胶体粒子不停地作无秩序运动。是胶体具有介稳性的原因之一。 3.电泳:胶团颗粒带有一定电荷,在电场的作用下胶粒会定向 。静电除尘、蛋白质氨基酸制取、血清电泳。带正电胶团有:金属氧化物和金属氢氧化物。带负电胶团有:硅酸盐、硫化物。既带正电又带负电有AgI 。 4.介稳性:胶体在一定的时间内能稳定存在,主要是因为胶粒带有同种电荷,相互 。 5.聚沉:对胶体加热、加电解质、加入带相反电荷的胶体时,胶粒会凝聚成大的颗粒而形成沉淀。聚沉能还原,胶体与重金属盐发生的凝聚则是不能还原的。 常用胶体知识解决的问题 河流入海、做豆腐、土壤胶体、明矾净水、墨水、血液、电泳除尘、陶瓷除去氧化铁 1.分散系的概念和分类 有关分散系的下列说法正确的是( ) ①悬浊液的分散质可以用过滤的方法从分散系中分离出来 ②任何物质在水中溶解时都有 0 1nm 100nm 分散质粒子直径 分散质 分散剂
初升高化学第六讲 离子反应及离子方程式 一、强电解质与弱电解质 1.常见的强电解质: ①强酸:HCl、HNO3、H2SO4、HBr、HI、HClO4等; ②强碱:NaOH、KOH等碱金属对应的碱、Ba(OH)2、Ca(OH)2等; ③绝大多数的盐(包括可溶的、微溶的、难溶的)。 2.常见的弱电解质:弱酸:H2CO3(分解)、HClO、HF、H2SO3(中强酸)、H2S、H2SiO3、 H3PO4(中强酸)、和CH3COOH等所有的有机酸; 弱碱:NH3·H2O、所有的难溶性碱;(还包括H2O)。 二、书写离子方程式的方法 1. 只有易溶的强电解质才能拆成离子形式。 2. 单质、氧化物、非电解质、弱电解质(包括H2O)以及难溶的强电解质都保留其化 学式。 3. 弱酸的酸式根离子不能分开写(如HCO3-),而强酸的酸式根离子要拆开写(如 NaHSO4写成离子形式:Na+ + H+ + SO42-)。 4. 对于微溶物,作为反应物若是溶液状态拆成离子形式,若是浑浊状态写化学式;作 为生成物写化学式。 5.书写时要注意检查等式两边的离子所带电荷总数是否相等,若是氧化还原反应还要检 查氧化剂得电子总数与还原剂失电子总数是否相等,此外还要检查原子是否守恒。 三、离子方程式书写的注意事项 1.要遵循反应事实,不能臆造化学反应 如:Cu+2H+=Cu2++H2↑(错) 2.要遵循元素原子守恒及电荷守恒,若是氧化还原反应要遵循电子守恒 3.要遵循拆写原则(反应物和生成物都一样) 4.不能违背约简原则 如:稀硫酸和氢氧化钡溶液反应:H++SO2- +Ba2++OH-=BaSO4↓+H2O(错) 4 解析:不能局部约去H+、OH-、H2O前面的计量数(系数)2,而忽视其他分子和离子。 正确的为:2H++SO2- +Ba2++2OH-=BaSO4+2H2O。 4 5.要注意题中有关量的关系(如过量、足量、少量等)
第一章物质及其变化 第五讲:氧化还原反应 “温故” 一、元素化合价口诀(背黑色部分,红色部分帮助理解) 钾钠氢银正一价(K Na H Ag均为+1价)钙镁锌钡正二价(Ca Mg Ba Zn 均为+2价) 铜一、二(Cu有+1、+2价) 铁二、三(Fe有+2、+3价) 二、四、六硫(硫有-2、+4、+6价) 二、四碳(碳有+2、+4价) 三铝四硅三五磷(Al+3、Si+4、P+3、+5价) 氮有负三一到五(N有—3、+1到+5) 锰有正二到正七(Mn有+2到+7价) 氯有一一五七价(Cl有-1、+1、+5、+7价) 通常氧是负二价(O为-2价)单质元素是零价 由定议变是原则记住定价全不怕 二、四种基本反应类型、氧化反应和还原反应 化合反应:由两种或两种以上的物质生成一种物质的反应。 A+B+…… C “多变一” 分解反应:由一种反应物生成两种或两种以上物质的反应。 C A+B+……“一变多” 置换反应:由一种单质与一种化合物反应生成另一种单质和另一种化合物的反应。 A+BC B+AC “单换单” 复分解反应:由两种化合物相互交换成分生成另外两种化合物的反应。
AB+ CD AD+CB “双交换,价不变” 氧化反应:物质与氧气发生的化学反应叫氧化反应。 如:3Fe+2O2Fe3O4 还原反应:物质在化学反应中失去氧的反应叫还原反应。 如:氧化铜氢气在加热时发生反应H2+CuO Cu+H2O 三、化学基本反应类型与氧化还原反应的关系 学以致用 1.下列图示是化学概念之间关系的形象表示,不正确的是() A B C D 2.提升“中国芯”的性能是我国信息产业的当务之急。“中国芯”的核心材料是高纯度的单质硅,工业上制取粗硅的化学方程式为:SiO2+2C 高温 Si+2CO↑,下列说法正确的是 A.硅元素在地壳中的含量比氧元素多B.该反应的基本类型为置换反应 C.在此反应中硅元素的化合价升高D.该反应体现了碳的氧化性 3.人们可从铁钛矿(主要成分FeTiO3)制取金属钛(Ti),其在一定条件下的主要反应有:①
20xx年xx初升高衔接班(补习班)招生 :漫长的暑假期间,对于孩子的学习,您可能会觉得力不从心,要么是自己工作太忙,没时间;要么自己有时间,却没有辅导能力,或是不能全面系统的辅导!孩子是您一生的事业,也是我们教育工作者的事业。可怜天下父母心!我们相信您绝不愿意您的孩子像您那样待在这个小城镇里生活一辈子!既然如此那就不要让孩子输在起跑线上,提前做好准备吧! 初中升高中这个关键阶段,是学生成长的非常时期。从初中过渡到高中,台阶很大,教材突然变难,知识容量大了几倍,知识逻辑性强了,更抽象了,对学生的能力要求更高了.高中学习强调运用,更灵活,能力要求高,稍不留神,学习就欠账了,一个地方卡住,别的地方也可能感到茫然.学习变得被动了,成绩就下降了,成绩越不好,学习越不感兴趣,于是形成了恶性循环,初中的前几名,就可能变成高中的后几名.初三毕业班的同学们,你们通过坚持不懈地努力和拼搏,顺利地完成初中的学业,完成了人生的又一次重大的转折,然而,等待你们的将是更为严峻的高中三年的挑战。俗说“万事开头难”,高一要是没有一个良好的开头更难。所以,何
不利用这个暑假参加百佳初升高衔接班,在巩固初中知识同时超前学习高一的数学,外语,物理,化学等科目,让你赢在起跑线上!切记:高一决定一切 !!!!为使广大学生掌握高中重点学科学习技能和方法,提高分析问题和解决问题的能力,打好良好的学习基础,不使自己的成绩输在起跑线上,扫清在学习过程中的拦路虎,从而取得理想的成绩,特举办这次学习班。 招生范围: 师资介绍:本培训班教师均为从事一线高中教学工作的有丰富实践教学经验的在职教师任教(只有一线教师才知道将考什么,孩子应该学什么,学习过程中孩子在想什么!!) 上课时间:(暂定)20xx 年7月5日-20xx 年8月5日(为期一个月) 周一至周五上课,上午8:30-11:30,下午15:00-17:30 收费标准:衔接班与提高班:600/人 一对一:80/小时 授课地点:麻城白果秦家湾 联系老师: 特色班级 适合群体 课程设置 1 初中升高中衔 接班 初中毕业生 高一数学、英语、物理和化学....... 2 高一升高二衔 接提高班 在校高一学生 高一、高二数学、英语、物理和化学....... 3 高中各级一对 一辅导 在校各级学生 高中各学科