
四种晶体类型的比较
物质熔沸点高低的比较方法 物质的熔沸点的高低与构成该物质的晶体类型及晶体内部粒子间的作用力有关,其规律如下: 1、在相同条件下,不同状态的物质的熔、沸点的高低是不同的,一般有:固体>液体>气体。例如:NaBr (固)>Br2>HBr(气)。 2、不同类型晶体的比较规律 一般来说,不同类型晶体的熔沸点的高低顺序为:原子晶体>离子晶体>分子晶体,而金属晶体的熔沸点有高有低。这是由于不同类型晶体的微粒间作用不同,其熔、沸点也不相同。原子晶体间靠共价键结合,一般熔、沸点最高;离子晶体阴、阳离子间靠离子键结合,一般熔、沸点较高;分子晶体分子间靠范德华力结合,一般熔、沸点较低;金属晶体中金属键的键能有大有小,因而金属晶体熔、沸点有高(如W)有低(如Hg)。例如:金刚石>食盐>干冰 3、同种类型晶体的比较规律 A、原子晶体:熔、沸点的高低,取决于共价键的键长和键能,原子半径越小,键长越短,键能越大共价键越稳定,物质熔沸点越高,反之越低。如:晶体硅、金刚石和碳化硅三种晶体中,因键长C—C
初中化学四大基本反应类型 一、化合反应 1、镁在空气中燃烧: 2Mg + O2 =点燃= 2MgO 现象:(1)发出耀眼的白光(2)放出热量(3)生成白色粉末 2、铁在氧气中燃烧:3Fe + 2O2 =点燃= Fe3O4 现象:(1)剧烈燃烧,火星四射(2)放出热量(3)生成一种黑色固体注意:瓶底要放少量水或细沙,防止生成的固体物质溅落下来,炸裂瓶底。 3、铜在空气中受热:2Cu + O2 =△= 2CuO 现象:铜丝变黑。 4、铝在空气中燃烧:4Al + 3O2 =点燃= 2Al2O3 现象:发出耀眼的白光,放热,有白色固体生成。 5、氢气中空气中燃烧:2H2 + O2 =点燃= 2H2O 现象:(1)产生淡蓝色火焰(2)放出热量(3)烧杯内壁出现水雾。 6、红(白)磷在空气中燃烧:4P + 5O2 =点燃= 2P2O5 现象:(1)发出白光(2)放出热量(3)生成大量白烟。 7、硫粉在空气中燃烧: S + O2 =点燃= SO2 现象:A、在纯的氧气中发出明亮的蓝紫火焰,放出热量,生成一种有刺激性气味的气体。 B、在空气中燃烧(1)发出淡蓝色火焰(2)放出热量(3)生成一种有刺激性气味的气体。 8、碳在氧气中充分燃烧:C + O2 =点燃= CO2 现象:(1)发出白光(2)放出热量(3)澄清石灰水变浑浊 9、碳在氧气中不充分燃烧:2C + O2 =点燃= 2CO 10、二氧化碳通过灼热碳层: C + CO2 =高温= 2CO(是吸热的反应) 11、一氧化碳在氧气中燃烧:2CO + O2 =点燃= 2CO2 现象:发出蓝色的火焰,放热,澄清石灰水变浑浊。 12、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2 + H2O === H2CO3 现象:石蕊试液由紫色变成红色。 注意:酸性氧化物+水→酸如:SO2 + H2O === H2SO3 SO3 + H2O === H2SO4 13、生石灰溶于水:CaO + H2O === Ca(OH)2(此反应放出热量)注意:碱性氧化物+水→碱氧化钠溶于水:Na2O + H2O =2NaOH 氧化钾溶于水:K2O + H2O=2KOH 氧化钡溶于水:BaO + H2O=Ba(OH)2 14、钠在氯气中燃烧:2Na + Cl2=点燃= 2NaCl 15、无水硫酸铜作干燥剂:CuSO4 + 5H2O ==== CuSO4?5H2O 二、分解反应: 1、水在直流电的作用下分解:2H2O= 通电= 2H2↑+ O2 ↑ 现象:(1)电极上有气泡产生。H2:O2=2:1 正极产生的气体能使带火星的木条复燃。负极产生的气体能在空气中燃烧,产生淡蓝色火焰 2、加热碱式碳酸铜:Cu2(OH)2CO3= △= 2CuO + H2O + CO2↑ 现象:绿色粉末变成黑色,试管内壁有水珠生成,澄清石灰水变浑浊。 3、加热氯酸钾(有少量的二氧化锰):2KClO3 =MnO2 △= 2KCl + 3O2 ↑ 4、加热高锰酸钾:2KMnO4 =△= K2MnO4 + MnO2 + O2↑ 5、实验室用双氧水制氧气:2H2O2= MnO2= 2H2O+ O2↑现象:有气泡产生,带火星的木条复燃。 6、加热氧化汞:2HgO =加热= 2Hg + O2↑ 7、锻烧石灰石:CaCO3=高温= CaO+CO2↑(二氧化碳工业制法)
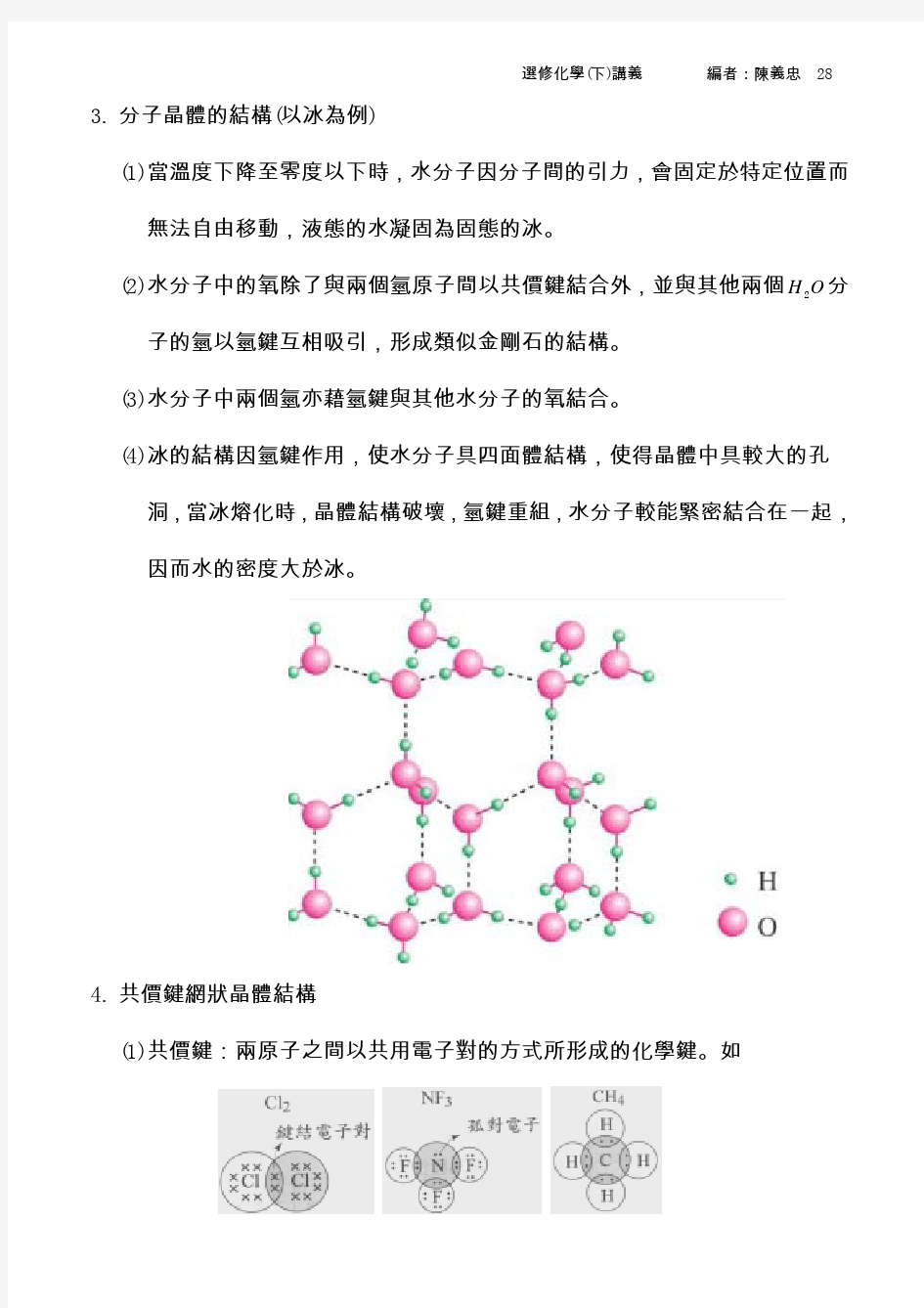
晶体结构与性质 一、晶体的常识 1.晶体与非晶体 得到晶体的途径:熔融态物质凝固;凝华;溶质从溶液中析出 特性:①自范性;②各向异性(强度、导热性、光学性质等) ③固定的熔点;④能使X-射线产生衍射(区分晶体和非晶体最可靠的科学方法) 2.晶胞--描述晶体结构的基本单元.即晶体中无限重复的部分 一个晶胞平均占有的原子数=1 8×晶胞顶角上的原子数+1 4×晶胞棱上的原子+1 2×晶胞面上的粒子数+1×晶胞体心内的原子数 思考:下图依次是金属钠(Na)、金属锌(Zn)、碘(I 2)、金刚石(C)晶胞的示意图.它们分别平均含几个原子? eg :1.晶体具有各向异性。如蓝晶(Al 2O 3·SiO 2)在不同方向上的硬度不同;又如石墨与层垂直方向上的电导率和与层平行方向上的电导率之比为1:1000。晶体的各向异性主要表现在( ) ①硬度 ②导热性 ③导电性 ④光学性质 A.①③ B.②④ C.①②③ D.①②③④ 2.下列关于晶体与非晶体的说法正确的是( ) A.晶体一定比非晶体的熔点高 B.晶体一定是无色透明的固体 C.非晶体无自范性而且排列无序 D.固体SiO 2一定是晶体 3.下图是CO 2分子晶体的晶胞结构示意图.其中有多少个原子?
二、分子晶体与原子晶体 1.分子晶体--分子间以分子间作用力(范德华力、氢键)相结合的晶体 注意:a.构成分子晶体的粒子是分子 b.分子晶体中.分子内的原子间以共价键结合.相邻分子间以分子间作用力结合 ①物理性质 a.较低的熔、沸点 b.较小的硬度 c.一般都是绝缘体.熔融状态也不导电 d.“相似相溶原理”:非极性分子一般能溶于非极性溶剂.极性分子一般能溶于极性溶剂 ②典型的分子晶体 a.非金属氢化物:H 2O、H 2 S、NH 3 、CH 4 、HX等 b.酸:H 2SO 4 、HNO 3 、H 3 PO 4 等 c.部分非金属单质::X 2、O 2 、H 2 、S 8 、P 4 、C 60 d.部分非金属氧化物:CO 2、SO 2 、NO 2 、N 2 O 4 、P 4 O 6 、P 4 O 10 等 f.大多数有机物:乙醇.冰醋酸.蔗糖等 ③结构特征 a.只有范德华力--分子密堆积(每个分子周围有12个紧邻的分子) CO 2 晶体结构图 b.有分子间氢键--分子的非密堆积以冰的结构为例.可说明氢键具有方向性 ④笼状化合物--天然气水合物
个六元环共有。每个六元环实际拥有的碳原子数为 ______个。C-C键夹角:_______。C原子的杂化方式是______ SiO2晶体中,每个Si原子与个O原子以共价键相结合,每个O原子与个Si 原子以共价键相结合,晶体中Si原子与O原子个数比为。晶体中Si原子与Si—O键数目之比为。最小环由个原子构成,即有个O,个Si,含有个Si-O键,每个Si原子被个十二元环,每个O被个十二元环共有,每个Si-O键被__个十二元环共有;所以每个十二元环实际拥有的Si原子数为_____个,O原子数为____个,Si-O键为____个。硅原子的杂化方式是______,氧原子的杂化方式是_________. 知该晶胞中实际拥有的Na+数为____个 Cl-数为______个,则次晶胞中含有_______个NaCl结构单元。 3. CaF2型晶胞中,含:___个Ca2+和____个F- Ca2+的配位数: F-的配位数: Ca2+周围有______个距离最近且相等的Ca2+ F- 周围有_______个距离最近且相等的F——。 4.如图为干冰晶胞(面心立方堆积),CO2分子在晶胞中的位置为;每个晶胞含二氧化碳分子的个数为;与每个二氧化碳分子等距离且最近的二氧化
碳分子有个。 5.如图为石墨晶体结构示意图, 每层内C原子以键与周围的个C原子结合,层间作用力为;层内最小环有 _____个C原子组成;每个C原子被个最小环所共用;每个最小环含有个C原子,个C—C键;所以C原子数和C-C键数之比是_________。C原子的杂化方式是__________. 6.冰晶体结构示意如图,冰晶体中位于中心的一个水分子 周围有______个位于四面体顶角方向的水分子,每个水分子通过 ______条氢键与四面体顶点上的水分子相连。每个氢键被_____个 水分子共有,所以平均每个水分子有______条氢键。 7.金属的简单立方堆积是_________层通过_________对 _________堆积方式形成的,晶胞如图所示:每个金属阳离子的 配位数是_____,代表物质是________________________。 8.金属的体心立方堆积是__________层通过 ________对________堆积方式形成的,晶胞如图: 每个阳离子的配位数是__________.代表物质是 _____________________。
07晶体的点阵结构和晶体的性质 【】若平面周期性结构系按下列单位并置重复堆砌而成,请画出它们的点阵素单位,并写出每个素单位中白圈和黑圈的数目。 解:用实线画出素单位示于图(a)。各素单位黑点数和圈数列于下表: 图(a) 号数1234567 黑点数目1111024 圈数目1112313 -键长为142pm,试根据它的结构画出层型石墨分子的原子分布【】层状石墨分子中C C 图,画出二维六方素晶胞,用对称元素的图示记号标明晶胞中存在的全部六重轴,并计算每 -键数。 一个晶胞的面积、晶胞中包含的C原子数和C C 解:石墨层型分子结构示于图(a),晶胞示于图(b),在晶胞中六重轴位置示于图(c),图中数字单位为pm。
图 石墨层型分子的结构 由图(a )可见,在层型石墨分子结构中,六元环中心具有六重轴对称性,而每个C 原子则具有六重反轴对称性。 晶胞边长a 和b 可按下式计算: 2142cos30246a b pm pm ==??= 晶胞面积可按下式计算; 4 2 sin 60246246sin 60 5.2410a b pm pm pm ??=??=? 晶胞中有2个C 原子,3个C -CN 键。 【】画出层状石墨分子的点阵素单位及石墨晶体的空间点阵素单位(参照图8.1.4),分别说明它们的结构基元。 解:按上题可得层型石墨分子的晶胞结构,示于图(a ),它的点阵素单位示于图(b ),结构基元中含2个C 原子。石墨晶体的晶胞示于图(c ),点阵单位示于图(d )。结构基元中含4个C 原子。 图 石墨的结构 【】有一AB 型晶体,晶胞中A 和B 的坐标分别为()0,0,0和()1/2,1/2,1/2。指明该晶体 的结构基元。 解:不论该晶体属于哪一个晶系,均为简单的空间点阵,结构基元为AB 。
初中化学《四种基本反应类型》专项考试题带解析 姓名:_____________ 年级:____________ 学号:______________ 题型选择题填空题简答题xx题xx题xx题总分 得分 一、选择题(共14题) 评卷人得分 1.对下列有水生成的四个化学方程式的反应类型,判断不正确的是() ①2H2+O22H2O②H2CO3=H2O+CO2↑ ③H2+CuO Cu+H2O④SO2+2NaOH=Na2SO3+H2O. A. ①是化合反应 B. ②是分解反应 C. ③是置换反应 D. ④是复分解反应 【答案】考点: 反应类型的判定. 专题: 化学反应的基本类型和能量变化. 分析: 化合反应:两种或两种以上物质反应后生成一种物质的反应,其特点可总结为“多变一”;分解反应:一种物质反应后生成两种或两种以上的物质,其特点可总结为“一变多”;置换反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的反应;复分解反应是两种化合物相互交换成分生成两种新的化合物的反应. 解答: 解:A、①2H2+O22H2O,该反应符合“多变一”的特征,属于化合反应,故选项说法正确. B、②H2CO3=H2O+CO2↑,该反应符合“一变多”的特征,属于分解反应,故选项说法正确. C、③H2+CuOCu+H2O,该反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的反应,属于置换反应,故选项说法正确. D、④SO2+2NaOH=Na2SO3+H2O,该反应不是两种化合物相互交换成分生成两种新的化合物的反应,不属于复
分解反应,故选项说法错误. 故选:D. 点评: 本题难度不大,掌握化合反应、分解反应、置换反应、复分解反应的特征并能灵活运用是正确解答本题的关键. 难度:容易知识点:如何正确书写化学方程式 2.工业制镁的方法为:将含碳酸钙的贝壳制成石灰乳;在海水中加入石灰乳,过滤;在氢氧化镁中加入盐酸,结晶;电解熔融氯化镁.该方法中的化学反应不包括() A. 化合反应 B. 置換反应 C. 分解反应 D. 复分解反应 【答案】考点: 反应类型的判定. 专题: 化学反应的基本类型和能量变化. 分析: 根据各步反应结合物质的性质判断所发生的反应,以此判断反应类型. 解答: 解:①把贝壳制成石灰乳,涉及的反应有分解、化合; ②在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物,发生复分解反应; ③将沉淀物与盐酸反应,结晶,过滤,得到含结晶水的晶体,发生复分解反应; ④将得到晶体在一定条件下加热得到无水氯化镁,涉及分解反应; ⑤电解熔融氯化镁,得到金属镁,为分解反应. 没有涉及的反应为置换反应, 故选B 点评: 本题考查镁的冶炼,题目难度不大,注意把握物质的性质,可不写化学方程式就能判断出. 难度:容易知识点:化学方程式单元测试 3.分析推理是学习化学常用的一种方法.下列推理正确的是() A.
初中化学四大基本反应类型知识清单? 一、初中常见化学反应类型 二、化学反应发生的条件 (1)金属活动性顺序表 金属的活动性顺序表: K Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au (2)排在氢前面的金属置换酸中的氢生成氢气。 (3)排在前面的金属能把排在后面的金属从它的盐溶液中置换出来。(一般不使用K、Ca、Na) (3)Fe与排在其后的金属的盐溶液反应也只能生成亚铁盐。 (4)复分解反应发生的条件:一般要有气体或沉淀或水生成。 三、常见化学反应方程式 (一)、化合反应 1、镁在空气中燃烧:2Mg + O2点燃2MgO 2、铁在氧气中燃烧:3Fe + 2O2点燃Fe3O4 3、铝在空气中燃烧:4Al + 3O2点燃2Al2O3 4、氢气在空气中燃烧:2H2 + O2点燃2H2O 5、红磷在空气中燃烧:4P + 5O2点燃2P2O5 6、硫粉在空气中燃烧:S + O2点燃SO2 7、碳在氧气中充分燃烧:C + O2点燃CO2 8、碳在氧气中不充分燃烧:2C + O2点燃2CO 9、二氧化碳通过灼热碳层:C + CO2高温2CO
10、一氧化碳在氧气中燃烧:2CO + O2点燃2CO2 11、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2 + H2O === H2CO3 12、生石灰溶于水:CaO + H2O === Ca(OH)2 13、无水硫酸铜作干燥剂:CuSO4 + 5H2O === CuSO4·5H2O 14、钠在氯气中燃烧:2Na + Cl2点燃2NaCl 15、氧化钠溶于水:Na2O + H2O === 2NaOH 16、三氧化硫溶于水:SO3 + H2O === H2SO4 ⒘Na2O+CO2==Na2CO3 (二)、分解反应 18、实验室用双氧水制氧气:2H2O2MnO22H2O + O2↑ 19、加热高锰酸钾:2KMnO4△K2MnO4 + MnO2 + O2↑ 20、水在直流电的作用下分解:2H2O 2H2↑ + O2↑ 21、碳酸不稳定而分解:H2CO3△H2O + CO2↑ 22、高温煅烧石灰石(二氧化碳工业制法):CaCO3高温CaO + CO2↑ 23、加热碱式碳酸铜:Cu2(OH)2CO3△2CuO + H2O + CO2↑ 24、加热氯酸钾(有少量的二氧化锰):2KClO MnO2和△2KCl + 3O2↑ 25、硫酸铜晶体受热分解:CuSO4·5H2O △CuSO4 + 5H2O (三)、置换反应 26、铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu 27、锌和稀硫酸反应(实验室制氢气):Zn + H2SO4 === ZnSO4 + H2↑ 28、镁和稀盐酸反应:Mg + 2HCl === MgCl2 + H2↑ 29、氢气还原氧化铜:H2 + CuO △Cu + H2O 30、木炭还原氧化铜:C + 2CuO 高温2Cu + CO2↑ 31、水蒸气通过灼热碳层:H2O + C 高温H2 + CO 32、焦炭还原氧化铁:3C + 2Fe2O高温4Fe + 3CO2↑ 33、Ca(HCO3)2==== CaCO3 + H2O + CO2↑
离子晶体 氯化钠晶体 (1)NaCl晶胞每个Na+等距离且最近的Cl-(即Na+配位数)为6个 NaCl晶胞每个Cl-等距离且最近的Na+(即Cl-配位数)为6个 (2)一个晶胞内由均摊法计算出一个晶胞内占有的Na+4_个; 占有的Cl-4个。 (3)在该晶体中每个Na+周围与之最接近且距离相等的Na+ 共有12个; 与每个Na+等距离且最近的Cl-所围成的空间几何构型为正八面体 CsCl晶体(注意:右侧小立方体为CsCl晶胞;左侧为8个晶胞) (1) CsCl晶胞中每个Cs+等距离且最近的Cl-(即Cs+配位数) 为8个 CsCl晶胞中每个Cl-等距离且最近的Cs+(即Cl-配位数) 为8个,这几个Cs+在空间构成的几何构型为正方体。 (2)在每个Cs+周围与它最近的且距离相等的Cs+有6个 这几个Cs+在空间构成的几何构型为正八面体。 (3)一个晶胞内由均摊法计算出一个晶胞内占有的Cs+ 1个;占有的Cl- 1个。 CaF 2 晶体 (1)) Ca2+立方最密堆积,F-填充在全部四面体空隙中。 (2)CaF 2 晶胞中每个Ca2+等距离且最近的F-(即Ca2+配位数) 为8个 CaF 2 晶胞中每个F-等距离且最近的Ca2+(即F-配位数)为4个 (3)一个晶胞内由均摊法计算出一个晶胞内占有的Ca2+4个; 占有的F-8个。ZnS晶体: (1)1个ZnS晶胞中,有4个S2-,有4个Zn2+。 (2)Zn2+的配位数为4个,S2-的配位数为 4个。 原子晶体 金刚石金刚石晶胞金刚石晶胞 (1)金刚石晶体 a、每个金刚石晶胞中含有8个碳原子,最小的碳环为6元环,并且不在同一平 面(实际为椅式结构),碳原子为sp3杂化,每个C以共价键跟相邻的_4_个C 结合,形成正四面体。键角109°28’ b、每个碳原子被12个六元环共用,每个共价键被6个六元环共用 c、12g金刚石中有2mol共价键,碳原子与共价键之比为 1:2
1、晶体类型判别: 分子晶体:大部分有机物、几乎所有酸、大多数非金属单质、所有非金属氢化物、部分非金属氧化物。 原子晶体:仅有几种,晶体硼、晶体硅、晶体锗、金刚石、金刚砂(SiC)、氮化硅 (Si3N4)、氮化硼(BN)、二氧化硅(SiO2)、氧化铝(Al2O3)、石英等; 金属晶体:金属单质、合金; 离子晶体:含离子键的物质,多数碱、大部分盐、多数金属氧化物; 2、分子晶体、原子晶体、金属晶体、离子晶体对比表 晶体类型分子晶体原子晶体金属晶体离子晶体 定义分子通过分子间 作用力形成的晶 体 相邻原子间 通过共价键 形成的立体 网状结构的 晶体 金属原子通 过金属键形 成的晶体 阴、阳离子通 过离子键形成 的晶体 组成晶体的粒子分子原子金属阳离子 和自由电子 阳离子和 阴离子 组成晶体粒子间的相互作用范德华力或氢键共价键 金属键(没 有饱和性方 向性) 离子键(没有 饱和性方向 性) 典型实例冰(H2O)、 P4、I2、干冰 (CO2)、S8 金刚石、晶 体硅、 SiO2、SiC Na、Mg、 Al、Fe NaOH、 NaCl、K2SO4 特征熔点、 沸点 熔、沸点较低熔、沸点高 一般较高、 部分较低 熔、沸点较高导热性不良不良良好不良 导电性 差,有些溶 于水可导电 多数差良好 固态不导电, 熔化或溶于水 能导电 机械加 工性能 不良不良良好不良 硬度硬度较小高硬度 一般较高、 部分较低 略硬而脆 溶解性相似相溶不溶 不溶,但有 的反应 多数溶于水, 难溶于有机溶 剂 3、不同晶体的熔沸点由不同因素决定: 离子晶体的熔沸点主要由离子半径和离子所带电荷数(离子键强弱)决定,分子晶体的熔沸点主要由相对分子质量的大小决定,原子晶体的熔沸点主要由晶体中共价键的强弱决定,且共价键越强,熔点越高。 4、金属熔沸点高低的比较: (1)同周期金属单质,从左到右(如Na、Mg、Al)熔沸点升高。
初中化学考点——四大基本反应类型 四大基本反应类型是:化合反应、分解反应、置换反应、复分解反应 一、化合反应:由两种或两种以上的物质生成另一种物质的反应,叫化合反应 1、非金属单质与氧气生成非金属氧化物。如2H 2+O 2点燃H 2O 2、金属与氧气反应生成金属氧化物。如3Fe+2O 2点燃Fe 3O 4 3、金属氧化物与水反应,生成相应的碱。如CaO+H 2O= Ca(OH)2 注:K 2O 、Na 2O 、BaO 、CaO 能与水反应,生成相应的碱,其他不能。 4、非金属氧化物与水反应,生成相应的酸。如CO 2+H 2O= H 2CO 3 注:能发生此反应的非金属氧化物有CO 2、SO 2、SO 3 5、其它如2CO+ O 2点燃2CO 2 二、分解反应:由一种物质生成两种或两种以上其他物质的化学反应叫做分解反应。 1、不溶性碳酸盐高温分解 如CaCO 3高温CaO+CO 2↑ 2、不溶性碱受热分解 如Cu (OH )2 △ CuO + H 2O 注:除KOH 、NaOH 、Ba (OH )2之外,都能分解生成相应的氧化物和水 3、某些酸式盐受热分解(了解)如 2NaHCO 3=====Na 2CO 3+CO 2↑+H 2O 4、某些碱式盐受热分解(了解)如 Cu 2(OH )2CO 3 △ 2CuO+CO 2↑+H 2O 其它如:水的电解、双氧水分解、高锰酸钾受热分解、氯酸钾受热分解 三、置换反应:一种单质和一种化合物生成另一种单质和另一种化合物的反应叫做置换反应。 1、活泼金属与酸反应(金属为金属活动顺序中氢以前的金属,酸不包括浓硫酸和硝酸) 例如:Fe +2HCl=FeCl 2+H 2↑ Mg+ 2HCl = MgCl 2+ H 2↑ H 2SO 4 + Fe = FeSO 4+ H 2↑ 2HCl + Zn = ZnCl 2 + H 2↑ H 2SO 4 + Zn = Z nSO 4+ H 2↑ 注:这里的酸,一般只稀盐酸和稀硫酸。硝酸与金属反应不生成氢气。 2、金属与盐反应,生成新盐与新金属。盐(含较不活泼金属)+金属(较活泼)——金属(较不活泼)+盐(含较活泼金属) 例如 :Fe +CuSO 4===FeSO 4+Cu 2AgNO 3 + Cu= Cu(NO 3)2 +2 Ag 注:反应物中的盐须溶于水,金属须比盐中金属活泼,钾、钙、钠三种金属不跟盐溶液发生置换反应。 3、氢气还原金属氧化物。例如:H 2 +CuO △ Cu+H 2 O 4、碳还原金属氧化物。例如:3C +Fe 2O 3 高温2 Fe+ 3CO 2↑ 四、复分解反应:两种化合物相互交换成分,生成另外两种化合物的反应,叫复分解反应。 1、酸+金属氧化物 ==== 盐+水
晶体类型与结构 知识梳理 一、晶体 1.定义: 晶体是指具有规则的几何外形的固体,它具有固定的熔点。 2.类型: 根据化学键的种类不同,我们把晶体分为_________________________ 二、离子晶体 1.定义:由_______形成的晶体是离子晶体,主要包括______________________________ 2.代表物 (1)氯化钠晶体 由图可知,在氯化钠晶体中,每个Na+周围有_____个Cl-,而每个Cl-周围也有____个Na+,它们之间通过离子键的作用结合,并在空间有规律地排列,形成规则的几何形状。 注:NaCl指的是化学式,而不是分子式,其晶体中不存在NaCl分子 (2)CsCl晶体 CsCl晶体是立方体结构,每个Cs+周围有____个Cl-与它距离相等且最近;每个Cl-周围有 ____个Cs+与它距离相等且最近;每个Cl-周围有_____个Cl-与它距离相等且最近。
【思考】构成氯化钠晶体和氯化铯晶体的微粒是什么? 3.离子晶体的构成微粒:____________________ 4.离子晶体的特点 在离子晶体中,由于阴阳离子间存在较强的离子键,所以离子晶体的结构一般比较____,密度____,且具有较_____的熔点、沸点和硬度。 【思考】如何判断某物质属于离子晶体? 三、分子晶体 1.定义 分子晶体的基本结构微粒是__________,是分子间通过___________形成的晶体。主要包括:__________________________________________________________________________________ 2.代表物 (1)干冰 干冰晶体中,二氧化碳分子分布于立方体的每个顶点和每个面心上。与每个二氧化碳分子最相邻的二氧化碳分子共有_____个。 (2)C60(富勒烯):1985年发现,荣获1996年度诺贝尔化学奖 分子中碳原子组成12个五元环和20个六元环,被称为足球烯。
四大基本反应类型中考变形题 1.下列化学方程式中属于复分解反应的是( ) A. C +O 2 CO 2 B. 2H 2O 2 H2↑+O 2↑ C.3CO +Fe 2O 3 2Fe +3CO 2 D, HCl +AgNO 3=AgCl ↓+HNO 3 2.在A +B =C +D 的反应中,下列叙述不正确的是( ) A.若C 和D 为盐和水,则该反应不一定是中和反应 B.此反应可能是复分解反应 C.若10gA 和15gB 恰好完全反应,则生成C 、D 的总质量为25 g D 、若A 是氧化铜、C 为铜,该反应一定是置换反应 5.如下图所示,X 溶液与AgNO 3、Na 2CO 3、Na 2SO 4三种溶液发生反应均生成白色沉淀。则X 可能是下列哪种物质的溶液( ) A 、HNO 3或KNO 3 B 、HCl 或H 2SO 4 C 、BaCl 2或CaCl 2 D 、NaOH 或Ca(OH)2 6.下列各组物质能在pH =1的无色溶液中大量共存的是( ) A 、K 2SO 4 Ba(OH)2 KCl B 、Cu(NO 3)2 NaCl KNO 3 C 、Na 2CO 3 KNO 3 NH 4Cl D 、MgSO 4 NaNO 3 KCl 7.在一密闭容器中,有甲、乙、丙、丁四种物质,在一定条件下存在某个反应,测得反应前后各物质的质量如下表: 对该反应,下列描述正确的是( ) A 、该反应中,甲、丙、丁的质量比为1∶16∶13 B 、乙在该反应中一定是催化剂 C 、待测质量一定为4 g D 、该反应是分解反应 二.随着经济的发展,能源与环境成为人们日益关注的问题。
第三章晶体结构与性质第一节晶体的常识知识归纳 一、晶体与非晶体 1.晶体与非晶体的本质差异: 2.获得晶体的三条途径 (1)______物质凝固; (2)______物质冷却不经液态直接凝固(______); (3)______从溶液中析出。 3.晶体的特点 (1)自范性 ①定义:在适宜的条件下,晶体能够自发地呈现规则的______,这称为晶体的______。非晶体物质没有这个特性。 ②形成条件:晶体______适当。 ③本质原因:晶体中粒子在______里呈现______的______排列。 (2)晶体在不同的方向上表现出不同的物理特质即______。 (3)晶体的______较固定。 (4)区分晶体和非晶体的最可靠的科学方法是对固体进行______实验。 二、晶胞 1.概念 晶胞是晶体中最小的______。 2.结构 晶胞一般都是______,晶体是由无数晶胞“______”而成。 (1)无隙:相邻晶胞之间无任何______。 (2)并置:所有晶胞都是______排列的,取向______。 (3)所有晶胞的______及内部的原子______及几何排列是完全相同的。
【答案】一、1.有周期性没有相对无序 2.(1)熔融态(2)气态凝华(3)溶质 3.(1)多面体外形性质自范性生长的速率三维空间周期性有序 (2)各向异性(3)熔点(4)X-射线衍射 二、1.结构重复单元 2.平行六面体无隙并置(1)间隙(2)平行相同(3)形状种类 知识重点 与晶体有关的计算 晶体结构的计算常常涉及如下数据:晶体密度、N A、M、晶体体积、微粒间距离、微粒半径、夹角等,密度的表达式往往是列等式的依据。解答这类题时,一要掌握晶体“均摊法”的原理,二要有扎实的立体几何知识,三要熟悉常见晶体的结构特征,并能融会贯通,举一反三。 1.“均摊法”原理 晶胞中任意位置上的一个原子如果被n个晶胞所共有,则每个晶胞对这个原子分得的份额就是1 n 。 非平行六面体形晶胞中粒子数目的计算同样可用“均摊法”,其关键仍然是确定一个粒子为几个晶胞所共 有。例如,石墨晶胞每一层内碳原子排成六边形,其顶点(1个碳原子)对六边形的贡献为1 3 ,那么一个六 边形实际有6×1 3 =2个碳原子。又如,在六棱柱晶胞(如下图所示的MgB2晶胞)中,顶点上的原子为6个 晶胞(同层3个,上层或下层3个)共有,面上的原子为2个晶胞共有,因此镁原子个数为12×1 6 +2×
晶体的七大晶系是十分专业的问题,它有时是鉴别晶体的关键,鉴藏矿晶的人多少应该知道一些。 概论 已知晶体形态超过四万种,它们都是按七种结晶模式发育生长,即七大晶系。晶体是以三维方向发育的几何体,为了表示三维空间,分别用三、四根假想的轴通过晶体的长、宽、高中心,这几根轴的交角、长短不同而构成七种不同对称、不同外观的晶系模式:等轴晶系,四方晶系,三方晶系,六方晶系,斜方晶系,单斜晶系,三斜晶系。请看图: 上图是七大晶系的理论模型,在同一水平面上,请大家仔细分辨它们的区别。面向观众的轴称x轴,与画面平行的横轴称y轴,竖直的轴称z 轴,也可叫“主轴”
一,等轴晶系简介 等轴晶系的三个轴长度一样,且相互垂直,对称性最强。这个晶系的晶体通俗地说就是方块状、几何球状,从不同的角度看高低宽窄差不多。如正方体、八面体、四面体、菱形十二面体等,它们的相对晶面和相邻晶面都相似,这种晶体的横截面和竖截面一样。此晶系的矿物有黄铁矿、萤石、闪锌矿、石榴石,方铅矿等。请看这种晶系的几种常见晶体的理论形态:
等轴晶系的三个晶轴(x轴y轴z轴)一样长,互相垂直。
常见的等轴晶系的晶体模型图 金刚石晶体
八面体和立方体的聚形的方铅矿 黄铁矿
二,四方晶系简介 四方晶系的三个晶轴相互垂直,其中两个水平轴(x轴、y轴)长度一样,但z轴的长度可长可短。通俗地说,四方晶系的晶体大都是四棱的柱状体,(晶体横截面为正方形,但有时四个角会发育成小柱面,称“复四方”),有的是长柱体,有的是短柱体。再,四方晶系四个柱面是对称的,即相邻和相对的柱面都一样,但和顶端不对称(不同形);所有主晶面交角都是九十度交角。请看模型图: 四方晶系的晶体如果z轴发育,它就是长柱状甚至针状;如果两个横轴(x 、y)发育大于竖轴z轴,那么该晶体就是四方板状,最有代表性的就是钼铅矿。请看常见的一些四方晶系的晶体模型:
晶体结构与性质 一、晶体的常识 1.晶体与非晶体 得到晶体的途径:熔融态物质凝固;凝华;溶质从溶液中析出 特性:①自范性;②各向异性(强度、导热性、光学性质等) ③固定的熔点;④能使X-射线产生衍射(区分晶体和非晶体最可靠的科学方法) 2.晶胞--描述晶体结构的基本单元,即晶体中无限重复的部分 一个晶胞平均占有的原子数=×晶胞顶角上的原子数+×晶胞棱上的原子+×晶胞面上 的粒子数+1×晶胞体心内的原子数 思考:下图依次是金属钠(Na)、金属锌(Zn)、碘(I 2 )、金刚石(C)晶胞的示意图,它们分别平均含几个原子? eg:1.晶体具有各向异性。如蓝晶(Al 2O 3 ·SiO 2 )在不同方向上的硬度不同;又如石墨与 层垂直方向上的电导率和与层平行方向上的电导率之比为1:1000。晶体的各向异性主要表现在() ①硬度②导热性③导电性④光学性质 A.①③ B.②④ C.①②③ D.①②③④ 2.下列关于晶体与非晶体的说法正确的是() A.晶体一定比非晶体的熔点高 B.晶体一定是无色透明的固体 C.非晶体无自范性而且排列无序 D.固体SiO 2 一定是晶体 3.下图是CO 2 分子晶体的晶胞结构示意图,其中有多少个原子? 二、分子晶体与原子晶体 1.分子晶体--分子间以分子间作用力(范德华力、氢键)相结合的晶体 注意:a.构成分子晶体的粒子是分子 b.分子晶体中,分子内的原子间以共价键结合,相邻分子间以分子间作用力结合 ①物理性质 a.较低的熔、沸点 b.较小的硬度 c.一般都是绝缘体,熔融状态也不导电 d.“相似相溶原理”:非极性分子一般能溶于非极性溶剂,极性分子一般能溶于极性溶剂 ②典型的分子晶体 a.非金属氢化物:H 2O、H 2 S、NH 3 、CH 4 、HX等 b.酸:H 2SO 4 、HNO 3 、H 3 PO 4 等 c.部分非金属单质::X 2、O 2 、H 2 、S 8 、P 4 、C 60 d.部分非金属氧化物:CO 2、SO 2 、NO 2 、N 2 O 4 、P 4 O 6 、P 4 O 10 等 f.大多数有机物:乙醇,冰醋酸,蔗糖等 ③结构特征 a.只有范德华力--分子密堆积(每个分子周围有12个紧邻的分子) CO 2 晶体结构图
高中化学晶体的结构与性质知识点及相关例题 讲解 自然界中的固体可以分为两种存在形式:晶体和非 晶体。晶体是经过结晶过程而形成的具有规则的几何外形的 固体。晶体中原子或分子在空间按一定规律周期性重复的排 列,从而使晶体内部各个部分的宏观性质是相同的,而且具 有固定的熔点和规则的几何外形。 一、晶体 固体可以分为两种存在形式:晶体和非晶体。 晶体的分布非常广泛,自然界的固体物质中,绝大多数 是晶体。气体、液体和非晶体在一定条件下也可转变为晶体。 晶体是经过结晶过程而形成的具有规则的几何外形的 固体。晶体中原子或分子在空间按一定规律周期性重复的排 列,从而使晶体内部各个部分的宏观性质是相同的,而且具 有固定的熔点和规则的几何外形。 二、晶体结构 1.几种晶体的结构、性质比较 2.几种典型的晶体结构: (1)NaCl晶体(如图1):每个Na+周围有6个Cl-,每个Cl-周围有6个Na+,离子个数比为1:1。 (2)CsCl晶体(如图2):每个Cl-周围有8个Cs+,每个Cs+周围有8个Cl-;距离Cs+最近的且距离相等的Cs+
有6个,距离每个Cl-最近的且距离相等的Cl-也有6个,Cs+和Cl-的离子个数比为1:1。 (3)金刚石(如图3):每个碳原子都被相邻的四个碳原子包围,以共价键结合成为正四面体结构并向空间发展, 键角都是109o28',最小的碳环上有六个碳原子。 (4)石墨(如图4、5):层状结构,每一层内,碳原子以正六边形排列成平面的网状结构,每个正六边形平均拥有 两个碳原子。片层间存在范德华力,是混合型晶体。熔点比 金刚石高。 (5)干冰(如图6):分子晶体,每个CO2分子周围紧邻其他12个CO2分子。
初中化学方程式(按四大基本反应类型) 一、化合反应:1、4 P + 5 O2 2 P2O52、S + O2SO24、3 Fe + 2 O2 Fe3O4 7、 2 H g + O2 2 H g O 9. H2+Cl22HCl 10、2 H2 + O2 2 H2O 13、2 Mg + O2 2 MgO 18、C + O2CO2 19、2 C + O2 2 CO 24、CO + H2O = H2CO3 29、4Al+ 3 O2 2 Al2O3 38. CaO+H2O=Ca(OH)260、C + CO2 2CO 61、2CO + O22CO2 二、分解反应:3、2 H2O2MnO2 2 H2O +O2↑5、2 KClO3 2 KCl +3 O2↑ 6、2KMnO4 K2MnO4+ MnO2+ O2↑8、2 H2O 2 H2↑+ O2↑ 16、CaCO3 CaO + CO2↑ 59、Ca(HCO3)2CaCO3↓+CO2↑+H2O 23、H2CO3=CO2 ↑+ H2O 62、2 H g O 2 H g + O2↑ 三、置换反应:11. Fe + CuSO4FeSO4 + Cu 14、H2 + CuO Cu + H2O 17、Zn + H2SO4ZnSO4 + H2↑20、C + 2 CuO 2 Cu + CO2↑ 21、3 C + 2 Fe2O3 4 Fe + 3 CO2 ↑30、Mg + 2 HCl =Mg Cl2 + H2↑ 31、Zn + 2 HCl =Zn Cl2 + H2↑ 32、Fe + 2 HCl FeCl2 + H2↑ Al2(SO4)3 + 3Cu 34、Cu + 2AgN O3Cu(NO3)2+ 2 Ag 33、2 Al + 3Cu SO 四、复分解反应: CO3+ 2 HCl2NaCl + CO2↑+ H2O 12、Na + 2NaOH Cu(OH)2↓+ Na2SO4 15、CuSO 22、CaCO3+ 2 HCl =CaCl2 + CO2↑+ H2O O 44. Ca(OH)2+H2SO4=CaSO4+2H2O 45、Cu(OH)2+2HNO3=Cu(NO3)2+2H2O 43、NaOH+HCl NaCl+H 36、Fe O3+6HCl2FeCl3+3H2O 37、Fe2O3+3H2SO4Fe2(SO4)3+3H2O 39、 46、Na H CO3+HCl=NaCl+H2O+CO2↑ 47、Na2CO3+Ca(OH)2=2NaOH+CaCO3↓ 48、2NaHCO3Na2CO3+H2O+CO2↑50. NH4Cl+NaOH=NaCl+NH3↑+H2O 51、NaCl+AgNO3=AgCl↓+NaNO3 52、BaCl2+Na2SO4BaSO4↓+2NaCl 53、BaCO3+2HNO3=Ba(NO3)+H2O+CO2↑ 54、CuSO 4+Ba(OH)2Cu(OH)2↓+BaSO4↓ 55、CuO+H 2SO4CuSO4+H2O56、CuO+2HCl CuCl2+H2O 57、Ca(OH)2+2HCl CaCl2+2H2O 58、2NaOH+H2SO4Na2SO4+2H2O
02 原子的结构和性质 【2.1】氢原子光谱可见波段相邻4条谱线的波长分别为656.47、486.27、434.17和410.29nm ,试通过数学处理将谱线的波数归纳成为下式表示,并求出常数R 及整数n 1、n 2的数值。 2 21211( )R n n ν=- 解:将各波长换算成波数: 1656.47nm λ= 1115233v c m - -= 2486.27nm λ= 1220565v cm - -= 3434.17nm λ= 1323032v cm - -= 4410.29nm λ= 1424373v cm - -= 由于这些谱线相邻,可令1n m =,21,2,n m m =++……。列出下列4式: ()2 2152331R R m m = - + ()22205652R R m m =- + ()2 2230323R R m m = - + ()2 2243734R R m m =- + (1)÷(2)得: ()()()2 3212152330.7407252056541m m m ++==+ 用尝试法得m=2(任意两式计算,结果皆同)。将m=2带入上列4式中任意一式,得: 1109678R cm -= 因而,氢原子可见光谱(Balmer 线系)各谱线的波数可归纳为下式: 221211v R n n - ??=- ? ?? 式中, 1 12109678,2,3,4,5,6R cm n n -===。 【2.2】按Bohr 模型计算氢原子处于基态时电子绕核运动的半径(分别用原子的折合质量和电子的质量计算并精确到5位有效数字)和线速度。 解:根据Bohr 提出的氢原子结构模型,当电子稳定地绕核做圆周运动时,其向心力与核和电子间的库仑引力大小相等,即: