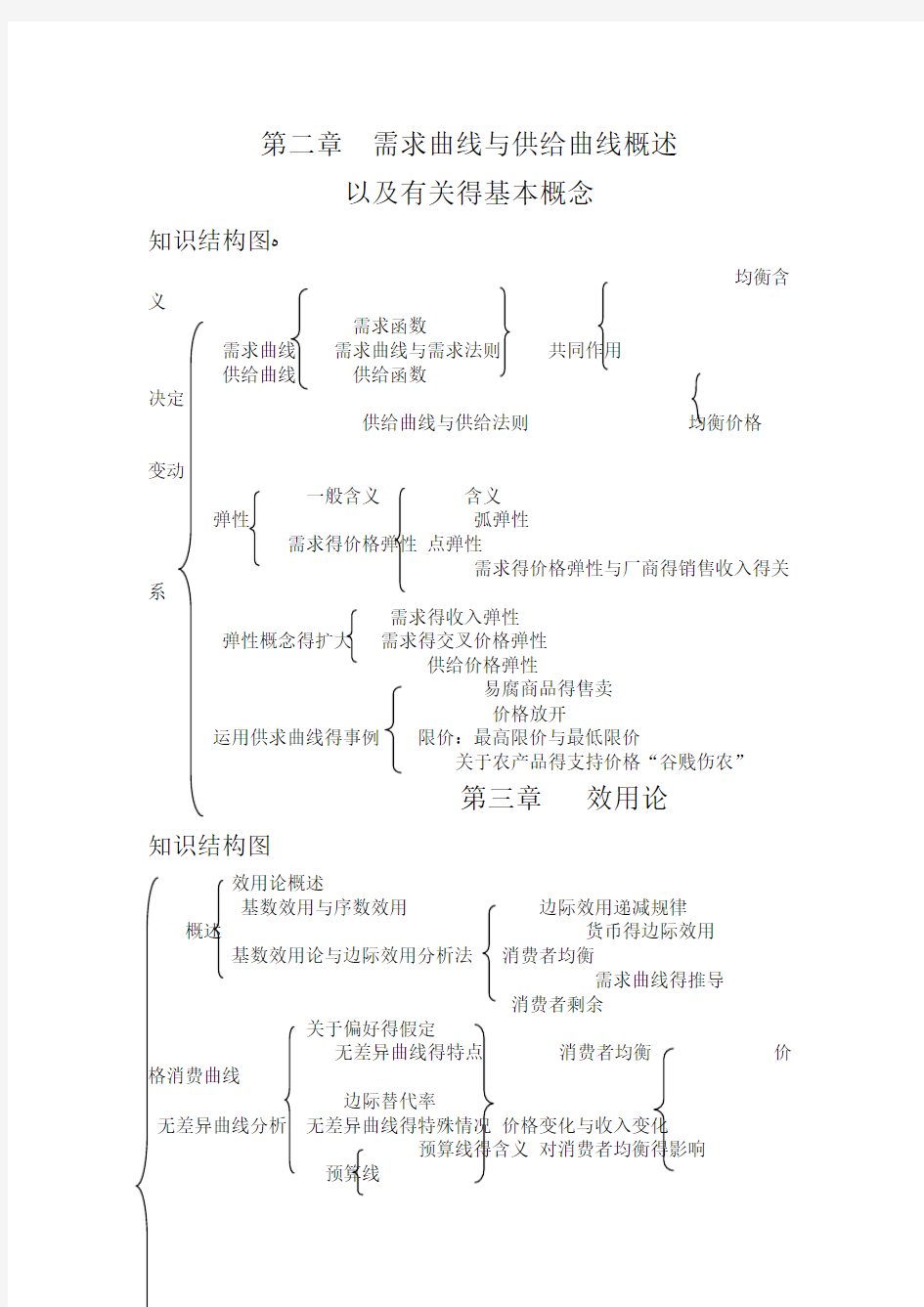

第二章需求曲线与供给曲线概述
以及有关得基本概念
知识结构图?
均衡含义
需求函数
需求曲线需求曲线与需求法则共同作用
供给曲线供给函数
决定
供给曲线与供给法则均衡价格
变动
一般含义含义
弹性弧弹性
需求得价格弹性点弹性
需求得价格弹性与厂商得销售收入得关系
需求得收入弹性
弹性概念得扩大需求得交叉价格弹性
供给价格弹性
易腐商品得售卖
价格放开
运用供求曲线得事例限价:最高限价与最低限价
关于农产品得支持价格“谷贱伤农”
第三章效用论
知识结构图
效用论概述
基数效用与序数效用边际效用递减规律概述货币得边际效用基数效用论与边际效用分析法消费者均衡
需求曲线得推导
消费者剩余
关于偏好得假定
无差异曲线得特点消费者均衡价格消费曲线
边际替代率
无差异曲线分析无差异曲线得特殊情况价格变化与收入变化
预算线得含义对消费者均衡得影响
预算线
预算线得变动收入消费曲线
含义
正常物品得替代效应与收入效应
替代效应与收入效应正常物品与低档物品得区别与收入效应
低档物品得替代效应与收入效应
吉芬物品得替代效应与收入效应从单个消费者需求曲线到市场需求曲线
不确定性
不确定性与风险
期望效用与期望值得效用
第四章生产论
知识结构图
生产要素
生产函数生产函数
固定替代比例得生产函数生产函数得几种具体形式固定投入比例得生产函数
柯布—道格拉斯生产函数
短期生产函数得形式
总产量、平均产量与边际产量
短期生产函数边际报酬递减规律(1)内容;(2)成因
总产量、平均产量与边际产量相互之间得关系
短期生产得三个阶段
长期生产函数得形式
等产量曲线(1)含义;(2)形状及特征
长期生产函数含义,表达式
边际技术替代率边际技术替代率递减规律
成因
含义,方程
等成本线
特征
既定成本条件下得产量最大化生产者最优要素投
最优得生产要素组合既定产量条件下得成本最小化入组合均衡条件
等斜线、扩展线得含义
规模报酬(1)含义;(2)类型;(3)规律
第五章成本论
知识结构图
机会成本
显成本
关于成本得几个概念
隐成本
利润
短期总成本与短期总产量:定义及表达式
短期成本得分类:TC、TVC、TFC、AFC、AVC、A C、MC
综合图及结论
边际报酬递减规律(1)含义;(2)与短期边际成本得关系
短期成本曲线TC、TVC与MC 曲线
短期成本曲线相互之间得关系AC、A VC、与M C曲线
A VC与TVC 曲线得关系
MP与MC
短期产量曲线与短期成本曲线之间得关系
AP与AVC
长期总成本函数与长期总成本曲线
含义
长期平均成本函数与长期平均成本曲线推导及形状长期成本曲线规模经济
含义
长期边际成本函数与长期边际成本曲线推导
形状
第六章完全竞争市场
知识结构图
市场得含义
市场及市场结构类型市场结构类型得划分标准
市场类型得划分与特征(图表形式)
完全竞争市场得特征
完全竞争厂商得需求曲线与收益曲线完全竞争厂商得需求曲线
完全竞争厂商得收益曲线
利润函数得表达式
厂商实现利润最大化得均衡条件
利润最大化均衡条件得形成过程
完全竞争厂商得短
期均衡
完全竞争厂商得短期均衡与短期供给曲线完全竞争厂商得短期供给曲线
生产者剩余
厂商对最优生产规模得选择
完全竞争厂商得长期均衡
厂商进入或退出一个行业
成本不变行业得长期供给曲线完全竞争行业得长期供给曲线成本递增行业得长期供给曲线
成本递减行业得长期供给曲线
第七章不完全竞争市场
知识结构图
垄断市场得含义、条件及成因
垄断厂商得需求曲线与收益曲线及其特征
垄断厂商得供给曲线
完全垄断市场垄断厂商得短期均衡
垄断厂商得长期均衡
价格歧视(1)一级价格歧视;(2)二、三级价格歧视
自然垄断企业得政府管制
垄断竞争市场得含义
d需求曲线
垄断竞争厂商得需求曲线D需求曲线
d需求曲线与D需求曲线得关系
垄断竞争市场垄断竞争厂商得短期均衡
垄断竞争厂商得均衡
垄断竞争厂商得长期均衡
垄断竞争与理想得产量
非价格竞争
寡头市场得概述(1)分类;(2)成因
假设条件
古诺模型产量与价格得决定
寡头市场古诺模型得推广及厂商反应函数得应用
基本假设条件
斯威齐模型寡头厂商弯曲得需求曲线与边际收益曲线
寡头厂商得供给曲线
含义
博弈论初步
占优策略均衡与纳什均衡
光的直线传播:光在同一种均匀介质中沿直线传播。 光线表示方法:用一条带箭头的直线来表示光的传播路径和方向。现象:影子的形成(手影,日食月食)﹑小孔成像等 光在真空中的传播速度最快,气体,液体,固体按顺序递减。 真空中的光速3× 8 10m/s,而在空气中传播速度也认为是3×108米/秒。 光现象 光 光 源 定义:自身发光的物体叫做光源。(注:月亮,发光屏幕不是光源)。 分类 天然光源:太阳﹑水母﹑闪电; 人造光源:火焰﹑灯光。 光 的 色 彩 光的色散:太阳光分解成红、橙、黄、绿、蓝、靛、紫等色光的现象。 光的三原色:红、绿、蓝;颜料的三原色是:红、黄、蓝。 物 光照到物体表面上时,有一部分光被物体反射,一部分光被吸收, 如果物体是透明的,还有一部分光会透过它。 不透明物体的颜色是由它反射的色光决定的。 透明物体的颜色是由它透过的色光决定的。 光具有的能量叫做光能。 人眼 看不 见的 光不 可见 光 红外线 紫外线 概念:太阳光色散区域中,红光外侧的不可见光叫做红外线。 性质:红外线能使被照射的物体发热,具有热效应(如太阳的 热就是以红外线传送到地球上的)所有物体都在不停的向外辐射红外线。 应用:红外探测器﹑红外照相机﹑红外夜视仪﹑追踪导弹 概念:太阳光色散区域中,紫光外侧的不可见光叫做紫外线。 性质:能使荧光物质发光,另外还可以灭菌。 应用:验钞机﹑紫外线杀菌﹑ 光的 直线 传播 光的直 线传播 光速 (1) 平面镜成的是虚像; (2) 像与物体大小相等; (3) 像与物体到镜面的距离相等; (4) 像与物体的连线与镜面垂直。 (5) 平面镜里成的像与物体左右倒置。 平 面 镜 平面镜应用:(1)成像;(2)改变光路。 平面镜成像特点: 的 色 彩 颜 色 体 的 颜 色
第一单元、走进化学世界 化学:是研究物质的组成、结构、性质以及变化规律的科学。 物理变化:没有新物质生成的变化。 化学变化:有新物质生成的变化。 物理性质:物质不需要通过化学变化就能表现出来的性质(包括:颜色、状态、气味、硬度、熔点、沸点、密度、水溶性) 化学性质:物质在化学变化中表现出来的性质(包括:可燃性、还原性、 氧化性、稳定性、活泼性) 化学变化:蜡烛燃烧; 区别: 化学性质:蜡烛能(可、易、是…的)燃烧。 对蜡烛燃烧的探究(P12—13) 对人体呼出气体和吸入空气的探究(P14—16) ①使用药品要做到“三不”:不能用手接触 药品,不要把鼻孔凑到容器口去闻药品的 气味,不得尝任何药品的味道。 ②取用药品应严格按照实验规定的用量取用,若没有说明用量,一般应按最小量, 即液体1~2ml ;固体只需盖满试管底部。 ③用剩的药品不能放回原瓶,也不要随意丢 掉、更不要拿出实验室。 粉末状:(药匙或纸槽)(一斜二放三直立) 块状:(镊子或药匙)(一横二放三慢竖) 大量:倾倒法(倾倒时瓶盖要倒放,标签向手心) 少量:用胶头滴管(注意胶头滴管的使用方法) 定量:量筒+胶头滴管(注意量筒的使用方法: 读数时量筒必须放平,视线与量筒内液体的凹液面最低处保持水平) 俯视:读数偏大,实际数偏小 仰视:读数偏小,实际数偏大 酒精灯的使用主要事项 能直接加热:试管、燃烧匙、蒸发皿 加热仪器 垫石棉网:烧杯、烧瓶 不能加热:量筒、集气瓶、滴管等 液体:管外干燥;先预热;试管内液体不超过1/3; 试管口向上倾斜45度,试管口不对人; 固体:试管口略向下倾斜 5、仪器的洗涤(干净标准:玻璃仪器内壁附着的水既不聚成水滴,也 不成股流下) 6.仪器连接:右插进左,先湿润,再慢慢转动插进。 变化 物质的变化与性质 性质 学习化学的一个重要途径——化学实验 1、药品取用的规则 2、固体药品的取用 3、液体药品的取用 4、给物质的加热 化学实验基本操作
八年级物理上册知识总结 →__ ____________→分析和论证→_______________→交流与合作 机械运动 一、长度和时间的测量 1、叫做单位。为方便交流,国际计量组织制定了一套国 际统一的单位,叫(简称SI)。 2、长度的单位:在国际单位制中,长度的基本单位,其他单位有:千 米(km)、分米(dm)、厘米(cm)、毫米(mm)、微米(μm)、纳米(nm)。1km=1 000m; 1dm=0.1m;1cm=0.01m;1mm=0.001m;1μm=0.000 001m;1nm=0.000 000 001m。测 量长度的常用工具:。刻度尺的使用方法:①注意刻度标尺的零刻度 线、、;②测量时刻度尺的,位置要放正,不得 歪斜,零刻度线应对准所测物体的一端;③读数时,并且对正观 测点,不能仰视或者俯视。 3、国际单位制中,时间的基本单位是。时间的单位还有小时(h)、分 (min)。1h=60min 1min=60s。 4、叫做误差,我们不能消灭误差,但应尽量减小误差。误 差的产生与测量仪器、测量方法、测量的人有关。减少误差方法:、 选用精密测量工具、改进测量方法。误差与错误区别:误差不是错误,错误不该 发生能够避免,误差永远存在不能避免。 二、运动的描述 1、运动是宇宙中最普遍的现象,物理学里把叫做机械运动。 2、在研究物体的运动时,叫做参照物。参照物的选择:任何 物体都可做参照物,应根据需要选择合适的参照物(不能选被研究的物体作参照物)。
研究地面上物体的运动情况时,通常选地面为参照物。选择不同的参照物来观察同一个物体结论可能不同。同一个物体是运动还是静止取决于所选的参照物,这就是 运动和静止的相对性。 三、运动的快慢 1、物体运动的快慢用 表示。在相同时间内,物体经过的路程越长,它的速度就越快;物体经过相同的路程,所花的时间越短,速度越快。在匀速直线运动中, 。在物理学中,为了比较物体运动的快慢,采用“相同时间比较路程”的方法,也就是将物体运动的路程除以所用时间。这样,在比较不同运动物体的快慢时,可以保证时间相同。 计算公式: 其中:s ——路程——米(m);t ——时间——秒(s);v ——速度——米/秒(m/s) 国际单位制中,速度的单位是 ,符号为 或 ,交通运 输中常用千米每小时做速度的单位,符号为 或 ,1m/s =3.6km/h 。v =s t ,变形可得: 。 2、快慢不变,沿着直线的运动叫匀速直线运动。匀速直线运动是最简单的机械运动。运动速度变化的运动叫变速运动,变速运动的快慢用平均速度来表示,粗略 研究时,也可用速度的公式来计算, 。 四 测平均速度 1、实验原理: 2、实验器材: 小车 斜面 3、实验时用 刻度尺 测出小车通过的路程,用 停表 测出小车通过这段路 程所用的时间,在用公式 计算出小车在这段路程的平均速度。 4、 探究小车沿斜面下滑的速度是否变化?如何变化? 具体测量过程和记录表格: 得出的结论: 小车从斜面滑下是越滑越快
第一章 走进细胞 走进细胞 从生物圈到细胞 生命活动离不开细胞 生命系统的结构层次 组织:由形态相似,结构、功能相同的细胞联合在一起的细胞群 器官:不同的组织按照一定的次序结合在一起而构成器官 系统:能够共同完成一种或几种生理功能的多个器官按照一定的次序组合在起而构成系统 个体:由各种器官(植物)或系统(动物和人)协调配合共同完成复杂的生命活动的生物。单细胞生物是由一个细胞构成的生物体。 种群:在一定的自然区域内,同种生物的所有个体是一个种群。 群落:在一定的自然区域内,所有的种群(生物)组成一个群落。 生态系统:生物群落与它的无机环境相互作用而形成的统一整体 生物圈:由地球上所有的生物和这些生物生活的无机环境共同组成 细胞的多样性和统一性 观察细胞(显微镜的使用) 原核细 胞与真核细胞 低倍镜的视野大(小),通过的光多(少),放大倍数小(大); 物镜放大倍数小(大),镜头较短(长) 显微镜放大倍数=目镜放大倍数×物镜放大倍数 先用低倍镜观察清楚,把要放大观察的移到视野中央,再换高倍镜观察 看到物像是倒像,因而物像移动的方向与实际材料(装片)移动方向相反 主要内容:(1)细胞是一个有机体,一切动植物都是由细胞发育而来,并由细胞和细胞产物所构成。(2)细胞是一个相对独立的单位,既有它自己的生命,又对与其他 细胞共同组成的整体的生命起作用。(3)新细胞可以从老细胞中产生 细胞学说 从学说的建立过程可以领悟到科学发现具有以下特点: 1、 科学发现是很多科学家的共同参与,共同努力的结果 2、 科学发现的过程离不开技术的 3、 科学发现需要理性思维和实验的结合 4、 科学学说的建立过程是一个不断开拓、继承、修正和发展的过程 细胞:细胞是生物体结构和功能的基本单位
初中化学必背知识点总结 1、化学是研究物质的组成、结构、性质以及变化规律的基础科学。 2、物理变化和化学变化的本质区别:有无新物质生成 变化和性质的区别:性质中有“能”“可以”“容易”等字眼 3、绿色化学-----环境友好化学(化合反应符合绿色化学反应) ①四特点(原料、条件、零排放、产品)②核心:利用化学原理从源头消除污染 4、蜡烛燃烧实验(描述现象时不可出现产物名称) (1)火焰:焰心、内焰(最明亮)、外焰(温度最高) (2)比较各火焰层温度:用一火柴梗平放入火焰中。现象:两端先碳化;结论:外焰温度最高 (3)检验产物H2O:用干冷烧杯罩火焰上方,烧杯内有水雾 CO2:取下烧杯,倒入澄清石灰水,振荡,变浑浊 (4)熄灭后:有白烟(为石蜡蒸气),点燃白烟,蜡烛复燃 5、吸入空气与呼出气体的比较 结论:与吸入空气相比,呼出气体中O2的量减少,CO2和H2O的量增多(吸入空气与呼出气体成分是相同的) 6、学习化学的重要途径——科学探究 一般步骤:提出问题→猜想与假设→设计实验→实验验证→记录与结论→反思与评价化学学习的特点:关注物质的性质、变化、变化过程及其现象; 7、化学实验(化学是一门以实验为基础的科学) 一、常用仪器及使用方法 (一)可以直接加热的仪器是--试管、蒸发皿、燃烧匙坩埚 只能间接加热的仪器是--烧杯、烧瓶、锥形瓶(垫石棉网—受热均匀) (二)测容器--量筒 量取液体体积时,量筒必须放平稳。读数时,视线与量筒内液体凹液面的最低点保持水平。 量筒不能用来加热,不能用作反应容器。量程为10毫升的量筒,一般只能读到0.1毫升。 选择合适的量程:所测液体不能超过量程,也不能比量程太小为宜 (三)称量器--托盘天平(用于粗略的称量,一般能精确到0.1克。) 注意点:(1)先调整零点(2)称量物和砝码的位置为“左物右码”。(3)称量物不能直接放在托盘上。 一般药品称量时,在两边托盘中各放一张大小、质量相同的纸,在纸上称量。潮湿的或具有腐蚀性的药品(如氢氧化钠),放在加盖的玻璃器皿(如小烧杯、表面皿)中称量。 (4)砝码用镊子夹取。添加砝码时,先加质量大的砝码,后加质量小的砝码(先大后小) (5)称量结束后,应使游码归零。砝码放回砝码盒。
第
第
一
一
章
节
幼
幼
儿
儿
教
教
育
育
的
的
产
概
生
念
与
和
发
意
展
义
教育的 起源
教育的 概念
教育学 的概念
幼儿教育 的概念
神话起源说
生物起源说
心理起源说
劳动起源说
教育是新生一代成长和人类社会延续、发展的必要手段,是人类社会特有的社 会现象。 广义:有目的、有意识地对人身心施加影响并促进人向社会要求的方向发展的 一种社会实践活动。包括家庭教育、社会教育和学校教育。 狭义:指学校教育,如幼儿园教育,小学、中学和大学教育以及其他人们为了 某种目的而特别组织的教育。
注意三点: 1、教育活动是人类社会特有的社会实践活动 2、教育活动是培养人的社会实践活动 3、学校教育活动是一种专门的培养人的社会实践活动
教育学是研究教育这一社会现象并揭示其规律的一门科学。
幼儿教育主要指的是对 3 到 6 岁年龄阶段的幼儿所实施的教育,是一个人教育与发 展的重要而特殊的阶段。 广义:凡是能够影响幼儿身体成长和认知、情感、性格等方面发展的活动,如幼儿 的家庭生活的形态,父母养育他的态度和方式,幼儿周围的人和事,他所读的书, 接触他的人,看电影、电视等等,都可说是幼儿教育。 狭义的幼儿教育则特指幼儿园和其他专门开设的幼教机构的教育。
幼儿教育 学的概念
幼儿教育 的意义
幼儿教育学是一门研究 3-6 岁幼儿教育规律和幼儿教育机构的教育工作规律的 科学,它是人们从教育幼儿的实践中总结提炼出来的教育理论
(1)促进幼儿在体、智、德、美诸方面全面和谐的发展。 (2)帮助幼儿适应学校生活,为入小学学习做好准备。 (3)减轻父母教养幼儿的负担并改善处境不利幼儿的状况。
幼儿教育对个体发展的意义 (一) 促进生长发育,提高身体素质,使幼儿健康、安全、愉快地成长 (二) 发展儿童的智力潜力和特点,识别和培养他们区别于他人的智能和兴趣, 帮助他们实现富有个性的发展 (三) 培养良好的品行和性格,促进个性、人格的完善和健康发展 (四) 激发幼儿感受美、表现美、创造美的情趣,丰富他们的审美经验,使之 体验到自由表达和创造的快乐
幼儿教育对社会发展的意义 (一) 幼儿教育对巩固提高“普九”水平,发展各类教育,构筑终身教育体系, 具有基础性、全局性和先导性的作用 (二) 幼儿教育的发展使人民群众日益增长的教育需求得到满足 (三) 幼儿教育的发展有力于国民素质的提高,有利于经济社会的持续、健康、 和谐的发展
第二章 光现象知识点总结 光源可分为天然光源(水母、太阳),人造光源(灯泡、火把) 月亮、钻石、镜子、影幕不是光源。 光在同种均匀介质中沿直线传播; 光的直线传播的应用: (1)小孔成像:像的形状与小孔的形状无关,像是倒立的实像(树阴下的光斑是太阳 的像) ① 小孔成像的条件:孔的大小必须 远远小于孔到发光的距 离及孔到光屏的距离。 ② 像的大小与发光体到孔的距离和像到孔的距离有关, 发光体到小孔的距离不变,光屏远离小孔,实像增大;光凭靠近小孔,实像减 小; 光屏到小孔的距离不变,发光体远离小孔,实像减小;发光体靠近小孔,实像增 大。 实像:由实际光线会聚而成的像。 (2)取得直线:激光准直(挖隧道定向);整队集合;射击瞄准; 3、光线:常用一条带有箭头的直线表示光的 径迹和方向;光线并不是真实存在的,而 是为了研究方便,假想的理想模型。 4、所有的光路都是可逆的,包括直线传播、反射、折射等。 5、真空中光速是宇宙中最快的速度; c=3 X 10 8m/s =3 X 105 Km/s: 6、光年:是光在一年中传播的 距离,光年是 长度单位;2.1 光的传播 1、 光源:能发光的物体叫做光源。 (3)限制视线:坐井观天、一叶障目; (4)影的形成:影子:日食、月食(要求会作图) 日食:太阳月球地球; 月食:月球太阳地球
声音在固体中传播得最快,液体中次之,气体中最慢,真空中不传 播; 光在真空中传播的最快,空气中次之,透明液体、固体中最慢 (二者刚好相反)。光在水中的速度约为真空中的3/4 ;光在玻璃中的速 度约为真空中的2/3。 光速远远大于声速(如先看见闪电再听见雷声;在跑100m时,声音传播时间不能忽略不计,但光传播时间可忽略不计)。 练习:☆为什么在有雾的天气里,可以看到从汽车头灯射出的光束是直的? 答:光在空气中是沿直线传播的。光在传播过程中,部分光遇到雾发生漫反射,射入 人眼,人能看到光的直线传播。 ☆早晨,看到刚从地平线升起的太阳的位置比实际位置 该现象说明:光在非均匀介质中不是沿直线传播的。 2.4光的折射 ㈠、光的折射1、光从一种介质斜射入另一种介质时,传播方向发生偏折。
第一章:有理数 ★知识结构图: 正分数 负分数 正整数 负整数 ★正数和负数 概念、定义:
1.大于0的数叫做正数(positive number)。 2.在正数前面加上负号“-”的数叫做负数(negative number)。 3.整数和分数统称为有理数(rational number)。 4.规定了原点、正方向和单位长度的直线叫做数轴(number axis)。 5.在直线上任取一个点表示数0,这个点叫做原点(origin)。 6.一般的,数轴上表示数a的点与原点的距离叫做数a的绝对值(absolute value)。 7.一个正数的绝对值是它本身;一个负数的绝对值是它的相反数;0的绝对值是0。 8.正数大于0,0大于负数,正数大于负数。两个负数,绝对值大的反而小。 ★有理数加法法则: 1.同号两数相加,取相同的符号,并把绝对值相加。 2.绝对值不相等的异号两数相加,取绝对值较大的加数的负号,并用较大的绝对值减去较小的绝对值,互为相反数的两个数相加得0。 3.一个数同0相加,仍得这个数。
4.有理数的加法中,两个数相加,交换交换加数的位置,和不变。 5.有理数的加法中,三个数相加,先把前两个数相加,或者先将后两个数相加,和不变。 6.有理数减法法则:减去一个数,等于加上这个数的相反数。 ★有理数乘法法则 1.两数相乘,同号得正,异号得负,并把绝对值向乘;任何数同0相乘,都得0。 2. 有理数中仍然有:乘积是1的两个数互为倒数。 3. 一般的,有理数乘法中,两个数相乘,交换因数的位置,积相等。 4.三个数相乘,先把前两个数相乘,或者先把后两个数相乘,积相等。 5.一般地,一个数同两个数的和相乘,等于把这个数分别同这两个数相乘,再把积相加。 ★有理数除法法则 1.除以一个不等于0的数,等于乘这个数的倒数。 2.两数相除,同号得正,异号得负,并把绝对值相除。0除以任何一个不等于0的数,都得0。★做有理数混合运算时,应注意以下运算顺序:
初中化学下册各单元知识网络结构图 金属和金属材料 纯金属 金属材料(铝、铁铜银等)合金与纯金属相比较优点是: 定义 合金生铁和钢。 常见 铜锌合金 物性:有光泽,质地,导电性,延展性,导热性。金金属与氧气反应: 性质化性:与酸反应:属于置换反应 与盐反应:反应的依据:。 ①可判断金属的化学活动性; 属金属活动顺序②可判断金属能否与酸反应生成氢气; 和(应用)③可判断金属能否与盐溶液反应; 金湿法炼铜原理:CuSO4 + Fe == FeSO4 + Cu 属原料: 材金属原理:(用方程式表示)。料冶炼冶炼铁的冶炼设备: 产品: 铁生锈的条件:铁与空气中的、等物质发生反应化学反应而生锈。 铁锈主要成分是:Fe2O3 金属资防止铁生锈措施:①保持铁制品表面的干燥和洁净;② 源保护
溶液 溶质和溶剂的体积之和,其质量溶质和溶剂质量之和。 。 H2SO4等溶于水。 概念: 影响因素:温度、溶质和溶剂的性质。 溶解度曲线。 概念: 气体溶解度影响因素温度:随温度升高 压强:随压强增大 溶质的质量分数的计算式:。 量分数一定溶液步 液体+ 固体(不溶于水) 过滤 混合物分离固体+ 固体(其一可溶) ①液体 + 固体(可溶于水) 结晶②KNO3 + NaCl 分离出NaCl采用蒸发结晶。 ③KNO3 + NaCl 分离出KNO3采用冷却结晶。
常见的酸和碱 酸浓硫酸常用作干燥剂。 酸使紫色石蕊试液变色。 酸使无色的酚酞试液色。 氢气例:; 属氧化物→盐+ 水 水例:; ⑤酸 + 盐→新盐 + 新酸例:; 氢氧化钠NaOH 物性:白色固体、极易溶于水(放热)、易潮解。 (火碱、烧碱、苛性钠) 用途:化工原料、制肥皂、造纸、纺织、印染; 物性及用途有吸水性可作某些气体干燥剂。 物性:白色固体、微溶于水 氢氧化钙Ca(OH)2 用途:用作建筑材料、检验二氧化碳。 (熟石灰、消石灰) 制法:用生石灰(CaO)与水作用 碱CaO + H2O = Ca(OH)2此反应放出大量热。 碱溶液使紫色石蕊溶液变色; ①与指示剂作用 碱的化学性碱溶液使无色酚酞溶液变色。 ②碱 + 非金属氧化物→盐 + 水例如: ③碱 + 酸→盐 + 水例如: ④碱 + 盐→新碱 + 新盐如; 2NaOH + CuSO4== Na2SO4 + Cu(OH)2↓ (符合复分解反应条件同时,反应物都溶于水) PH < 7 溶液呈酸性
Chapter 1 Invitations to Linguistics 1.1 Why Study Language? 1.Some myths about language 2.Some fundamental views about language 3.Some concrete demonstrations to show Linguistics’importance 1.2 What is Language? 1. Language “is not to be confused with human speech, of which it is only a definite part, though certainly an essential one. It is both a social product of the faculty of speech and a collection of necessary conventions that have been adopted by a social body to permit individuals to exercise that faculty”. --Ferdinand de Saussure (1857-1913): Course in General Linguistics (1916) 2. “Language is a purely human and non-instinctive method of communicating ideas, emotions and desires by means of voluntarily produced symbols.” --Edward Sapir (1884-1939): Language: An Introduction to the Study of Speech (1921) 3. “A language is a system of arbitrary vocal symbols by means of which a social group co-operates.” --Bernard Bloch (1907-1965) & George Trager (1906-1992): Outline of Linguistic Analysis (1942) 4. “A language is a system of arbitrary vocal symbols by means of which the members of a society interact in terms of their total culture.” --George Trager: The Field of Linguistics (1949) 5. “From now on I will consider language to be a set (finite or infinite) of sentences, each finite in length and constructed out of a finite set of elements.” --Noam Chomsky (1928- ): Syntactic Structures (1957) 6. Language is “the institution whereby humans communicate and interact with each other by means of habitually used oral-auditory arbitrary symbols.” --Robert A. Hall (1911-1997): Introductory Linguistics (1964) 7.“Language is a system of arbitrary vocal symbols used for human communication.” --Ronald Wardhaugh: Introduction to Linguistics (1977) 8. “Language is a means of verbal communication.” —It is instrumental in that communicating by speaking or writing is a purposeful act. —It is social and conventional in that language is a social semiotic and communication can only take place effectively if all the users share a broad understanding of human interaction including such associated factors as nonverbal cues, motivation, and socio-cultural roles. -- Our textbook (2006) 9. Language is a system of arbitrary vocal symbols used for human communication.
小屯一中化学 复 习 计 划
第一单元走进化学世界 1、锅炉爆炸、轮胎爆炸是物理变化,可燃性物质导致的爆炸是化学变化,如氢气爆炸,烟花爆炸等。 2、催化剂能加快和减慢反应速率,其质量和化学性质反应前后不变,物理性质,如形状、状态可能改变 3、由一种元素组成的物质可能为单质,也可能为混合物。如氧气O2和臭氧O3两种单质混合得到混合物,也只由氧(O)元素组成。金刚石C和石墨C的混合物,只由碳(C)元素组成等。只有说由一种元素组成的纯净物,才能说一定是单质。冰水混合物是纯净物,冰是水的固态,还是水。 4、原子是化学变化中的最小粒子。但不能说原子一定就比分子小。原子是化学变化中的最小粒子,在化学变化中不可再分。但是某些物理变化中是可再分(核裂变)的
第二单元我们周围的空气 测氧气含量实验失败原因:红磷量不足,装置漏气,未等到装置冷却就打开弹簧夹 不是所有的燃烧都需氧气参与。如氢气在氯气中能燃烧。着火点是物质的固有属性,不能说降低物质的着火点,只能说把温度升高到物质的着火点。燃烧需三个条件都具备,灭火只要破坏任一条件。
第三单元自然界的水 沉淀有静置沉淀和吸附沉淀。吸附沉淀是指加明矾生成胶体吸附大颗粒固体杂质,获得比静置沉淀更快的沉淀。过滤是在沉淀后,把不溶于水的沉淀和水分离的操作。若单独提到吸附,则是指加活性炭吸附色素和气体。蒸馏后得到的水净化程度最高,为蒸馏水,是纯净物。蒸馏操作可以使硬水软化
第四单元物质构成的奥秘 原子团的记忆找诀窍:如碳酸根CO3,就是二氧化碳CO2多1个O。硫酸根SO4,是三氧化硫SO3多1个O。硝酸根NO3,是二氧化氮NO2多1个O。铵根NH4,是氨气NH3多1个O.
单位: 基本工具:刻度尺 基本工具:停表 运动和静止的相对性 描述: 运动的快慢 速度 定义:路程与时间之比叫做速度 常用单位:千米/小时(km/h) 主单位:米/秒(m/s) 公式: t s v= 变速运动:速度变化的运动叫做变速运动,用平均速度表示变速运动的快慢 匀速直线运动:物体沿着直线速度不变的运动 测量平均速度 实验原理: t s v= 机 械 运 动 长度和时间的测量 长度的测量 时间的测量 长度的主单位:米(m),其他单位:千米(km)、分米(dm)、厘米(cm)、毫米(mm) 时间的主单位:秒(s),其他单位:小时(h)、分钟(min) 运动的描述 定义:物体位置的变化叫做机械运动 参照物:假定为不动的物体 实验器材:刻度尺、秒表 第一章机械运动
第二章声现象 声现象声音的产生与传播 声音的产生条件:发声体在振动 (3)声音在不同的介质中传播的速度一般不同(一般来说在固体 中传播速度最快、液体较慢、气体最慢) 声音的传播特点 (1)需要介质 (2)真空不能传播 (4)声音在同一介质中传播速度还与温度有关 (5)声音以波的形式向外传播 声音的三个特征 音调 音调表示声音的高低 音调与发声体的振动频率有关,频率越高,音调越高 响度 响度表示声音的强弱,用分贝来表示 响度与发声体的振幅有关,振幅越大,响度越大 决定于发声体的材料、结构 音色 又叫做音品,反映声音的品质与特色 噪声 噪声的来源和危害 在传播过程中减弱 减弱噪声的途径 在声源处减弱 在人耳处减弱 次声波:频率低于20Hz的声音被称为次声波 超声波和次声波 超声波:频率高于20KHz的声音被称为超声波 声音的利用 声音能传递信息:例如B超检查身体、回声定位等 声音能传递能量:例如超声波碎石
绪言化学使世界变得更加绚丽多彩 1、化学是研究物质的组成、结构、性质及变化规律的科学。 2、原子论(道尔顿)和分子学说(阿伏加德罗)的创立,奠定了近代化学的基础。——物质是由原子和分子构成的,分子的破裂和原子的重新组合是化学变化的基础。 3、1869年,俄国的化学家门捷列夫发现元素周期律和元素周期表。物质的种类繁多(达2000多万种),但组成它们的基本成分——元素只有100多种。水、氧气、二氧化碳的一个共同点:都含有氧元素。 4、我国的某些化学工艺像造纸、制火药、烧瓷器,发明很早,对世界文明作出过巨大贡献。 5、用高分子薄膜做的鸟笼:隔水、透气 6、用纳米技术制造出具有特定功能的产品(直径6mm的尼龙绳能吊起2t的汽车)(1nm=10-9m) 第一章走进化学世界 课题1 物质的变化和性质 考点要求: 认识化学变化的基本特征;理解反应现象和本质之间的联系 考点一、物质的变化 1、概念:物理变化——没有生成其它物质的变化。例:石蜡熔化、水结成冰、汽油挥发 化学变化——有其它物质生成的变化例:煤燃烧、铁生锈、食物腐败、呼吸 2、判断变化依据:是否有其它(新)物质生成。有则是化学变化,无则是物理变化 3、相互关系:常常伴随发生,有化学变化一定有物理变化,有物理变化不一定有化学变化。 4、化学变化伴随现象:放热、吸热、发光、变色、放出气体和生成沉淀。 考点二、物质的性质 物理性质:物质不需要化学变化就表现出的性质。包括:颜色、状态、气味、熔点、沸点、密度、硬度、溶解性、挥发性、延展性、导电性、吸水性、吸附性等。 化学性质:物质在化学变化中表现出来的性质。可燃性、氧化性、还原性、活泼性、稳定性、腐蚀性、毒性、金属活动性等。 它们的区别是:物理性质在静止状态中就能表现出来,而物质的化学性质则要在物质运动状态中才能表现出来 三、物理变化、化学变化、物理性质、化学性质之间的区别与联系。 联系:在变化语句中加“能”或“可以”或“易”“会”“难于”等词语,变成了相应的性质。 1、物理变化与化学变化
初中化学知识点全面 总结) 完整版(单元走进化学世界第1、化学是研究物质的组成、 结构、性质以及变化规律的基础科学。 1 、我国劳动人民商代会制造青 铜器,春秋战国时会炼铁、炼钢。 2) 化合反应符合绿色化学反应-----环境友好化学 ( 3、绿色化学②核心: 利用化学原理从头消除 P6(原料、条件、零排放、产品)①四特点污 染 4、蜡烛燃烧实验(描述现象时不 可出现产物名称))火焰:焰心、内焰(最明亮)、外焰(温度最高)(1) 比较各火焰层温度:用一火柴梗平放入火焰中。现象:两端先碳化;结论:2 (外焰温度最高 O:用干冷烧杯罩火焰上方,烧杯内有水雾)检验产物 (3 H2 CO:取下烧杯,倒入澄清石灰水,振荡, 变浑浊2 4)熄灭后:有白烟(为石蜡蒸气),点燃白烟,蜡烛复燃。 说明石蜡蒸气燃烧。( 5、吸入空气与呼出气体的比较 O的量 增多结论:与吸入空气相比,呼出气体中O的量减少,CO和H 222(吸入 空气与呼出气体成分是相同的) 6、学习化学的重要途径——科学探究提出问题→猜想与假设→设计实 验→实验验证→记录与结论→反思与评一般步骤:价化学学习的特 点:关注物质的性质、变化、变化过程及其现象; 7、化学实验(化学是一门以实验为基础的科学) 一、常用仪器及使用方法 (一)用于加热的仪器--试管、烧杯、烧瓶、蒸发皿、锥形瓶 可以直接加热的仪器是--试管、蒸发皿、燃烧匙
只能间接加热的仪器是--烧杯、烧瓶、锥形瓶(垫石棉网—受热均匀) 可用于固体加热的仪器是--试管、蒸发皿 可用于液体加热的仪器是--试管、烧杯、蒸发皿、烧瓶、锥形瓶 不可加热的仪器——量筒、漏斗、集气瓶 (二)测容器--量筒 (1)量取液体体积时,量筒必须放平稳。视线与刻度线及量筒内液体凹液面的最低点保持水平。(2)量筒不能用加热,不能用作反应容器。(3)量程为10毫升的量筒,一般只能读到0.1毫升。 (三)称量器--托盘天平(用于粗略的称量,一般能精确到0.1克。) 注意点:(1)先调整零点 (2)称量物和砝码的位置为“左物右码”。 1 3)称量物不能直接放在托盘上。(一般药品称量时,在两边托盘中各放一张大小、质量相同的纸,在纸上称量。潮 (,放在加盖的玻璃器皿(如小烧杯、表面皿)中湿的或具有腐蚀性的药品(如氢氧化钠)) 称量。)砝码用镊子夹取。添加砝码时,先加质量大的砝码,后加质量小的砝码(先(4 大后小))称量结束后,应使游码归零。砝码放回砝码盒。(5 (四)加热器皿--酒精灯 :①不可向燃着的酒精灯内添加酒精;②用火柴1)酒精灯的使用要注意“三不”(③熄灭酒精灯应用灯帽从侧面点燃酒精灯,不可用燃着的酒精灯直接点燃另一盏酒精灯;盖熄,不可吹熄。 1/4。)酒精灯内的酒精量不可超过酒精灯容积的2/3也不应少于(2 3)酒精灯的火焰分为三层,外焰、内焰、焰心。用酒精灯的外焰加热物体。()如果酒精灯在燃烧时不慎翻倒,酒精在实验台上燃烧时,应及时用沙子盖灭4 (或用湿抹布扑灭火焰,不能用水冲。(五)夹持器--铁夹、试管夹 试管夹的长柄,不要把拇(2)铁夹夹持试管的位置应在试管口近1/3处。 (1)试管夹夹持试管时,应将试管夹从试管底部往上套;夹持部位在距试(3)指按在短柄上。处;用手拿住管口近1/3 (六)分离物质及加液的仪器--漏斗、长颈漏斗 过滤时,应使漏斗下端管口与承接烧杯内壁紧靠,以免滤液飞溅。 (1) 长颈漏斗的下端管口要插入液面以下,以防止生成的气体从长颈漏斗口逸出。(2)二、化学实验基本操作 (一)药品的取用 1、药品的存放: 一般固体药品放在广口瓶中,液体药品放在细口瓶中(少量的液体药品可放在滴瓶中),金属钠存放在煤油中,白磷存放在水中。 2、药品取用的总原则 ①取用量:按实验所需取用药品。如没有说明用量,应取最少量,固体以盖满试管底部为宜,液体以1~2mL为宜。多取的试剂不可放回原瓶,也不可乱丢,更不能带出实验室,应放在指定的容器内。
高中化学基础知识网络图第一部分:物质的组成、分类、性质和变化 大纲要求(1)了解分子、原子、离子等概念的含义。了解原子团的定义。 (2)理解物理变化与化学变化的区别与联系。 (3)理解混合物和纯净物、单质和化合物、金属和非金属的概念。 (4)理解酸、碱、盐、氧化物的概念及其相互联系。
第二部分:基本理论(物质结构、化学反应速率、化学平衡、电解质溶液)大纲要求 物质结构和元素周期律 (1)了解元素、核素和同位素的含义。 (2)了解原子构成。了解原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系。 (3)了解原子核外电子排布。 (4)掌握元素周期律的实质。了解元素周期表(长式)的结构(周期、族)及其应用。 (5)以第3周期为例,掌握同一周期内元素性质的递变规律与原子结构的关系。 (6)以IA和VIIA族为例,掌握同一主族内元素性质递变规律与原子结构的关系。 (7)了解金属、非金属在元素周期表中的位置及其性质递变的规律。 (8)了解化学键的定义。了解离子键、共价键的形成。 化学反应与能量 (1)了解氧化还原反应的本质是电子的转移。了解常见的氧化还原反应。掌握常见氧化还原反应的配平和相关计算。 (2)了解化学反应中能量转化的原因,能说出常见的能量转化形式。 (3)了解化学能与热能的相互转化。了解吸热反应、放热反应、反应热等概念。 (4)了解热化学方程式的含义。 (5)了解能源是人类生存和社会发展的重要基础。了解化学在解决能源危机中的重要作用。 (6)了解焓变与反应热的含义。了解△H=H(反应产物)—H(反应物)表达式的含义。 (7)理解盖斯定律,并能运用盖斯定律进行有关反应焓变的简单计算。 (8)了解原电池和电解池的工作原理,能写出电极反应和电池反应方程式。了解常见化学电源的种类及其工作原理。 (9)理解金属发生电化学腐蚀的原因,金属腐蚀的危害,防止金属腐蚀的措施。 化学反应速率和化学平衡 (1)了解化学反应速率的概念、反应速率的定量表示方法。 (2)了解催化剂在生产、生活和科学研究领域中的重大作用。 (3)了解化学反应的可逆性。 (4)了解化学平衡建立的过程。了解化学平衡常数的含义,能够利用化学平衡常数进行简单的计算。 (5)理解外界条件(浓度、温度、压强、催化剂等)对反应速率和化学平衡的影响,认识并能用相关理论解释其一般规律。 (6)了解化学反应速率和化学平衡的调控在生活、生产和科学研究领域中的重要作用。 电解质溶液 (1)了解电解质的概念。了解强电解质和弱电解质的概念。 (2)了解电解质在水溶液中的电离,以及电解质溶液的导电性。
第1单元走进化学世界 1、化学是研究物质的组成、结构、性质以及变化规律的基础科学 2、我国劳动人民商代会制造青铜器,春秋战国时会炼铁、炼钢。________________________________ 3、绿色化学-----环境友好化学(化合反应符合绿色化学反应)_______________ ①四特点P6 (原料、条件、零排放、产品)②核心:利用化学原理从源头消除污染 4、蜡烛燃烧实验(描述现象时不可岀现产物名称) (1)火焰:焰心、内焰(最明亮)、外焰(温度最高) (2)比较各火焰层温度:用一火柴梗平放入火焰中。现象:两端先碳化;结论:外焰温度最高 (3)检验产物H0 :用干冷烧杯罩火焰上方,烧杯内有水雾2 -------------------------------------------------------------------- C O 取下烧杯,倒入澄清石灰水,振荡,变浑浊 4)熄灭后:有白烟(为石蜡蒸气),点 2 _________________________________________________________________________________________________________________________________ ( 燃白烟,蜡烛复燃。说明石蜡蒸气燃烧。_____________________________________ 5、吸入空气与呼岀气体的比较 结论:与吸入空气相比,呼岀气体中0的量减少,CO和H0的量增多222 ______________________________________________________________________________ (吸入空气与呼岀气体成分是相同的) 6、学习化学的重要途径——科学探究 一般步骤:提出问题-猜想与假设-设计实验-实验验证-记录与结论-反思与评价化学学习的特点:关注物质的性质、变化、变化过程及其现象; 7、化学实验(化学是一门以实验为基础的科学) 一、常用仪器及使用方法 (一)用于加热的仪器――试管、烧杯、烧瓶、蒸发皿、锥形瓶 可以直接加热的仪器是--试管、蒸发皿、燃烧匙____________ 只能间接加热的仪器是--烧杯、烧瓶、锥形瓶(垫石棉网一受热均匀) 可用于固体加热的仪器是――试管、蒸发皿_______________________ 可用于液体加热的仪器是--试管、烧杯、蒸发皿、烧瓶、锥形瓶 不可加热的仪器一一量筒、漏斗、集气瓶__________________________________ (二)测容器――量筒 量取液体体积时,量筒必须放平稳。视线与刻度线及量筒内液体凹液面的最低点保持水平 量筒不能用来加热,不能用作反应容器。量程为10毫升的量筒,一般只能读到0.1毫升 (三)称量器――托盘天平(用于粗略的称量,一般能精确到0.1克。)_________ 注意点:(1)先调整零点___________ (2 )称量物和砝码的位置为“左物右码”。______________
十一、元素及其化合物的知识重点 ?? ?? ? ??? ??????????????? ??? ?转炉,电炉,平炉))原料(生铁)设备(冶炼:原理(氧化反应%%--含碳量成分:主要成分是铁,钢),石灰石)设备(高炉)原料(铁矿石,焦炭冶炼:原理(还原反应含碳量成分:主要成分是铁,生铁生铁和钢)、、污染:有害气体(蒸气等有气体、二氧化碳、水成分:氮气、氧气、稀 空气混合物203.0-4.3%-2%NO CO SO 22 ?????????????????????? ???????????? ???????????????????????????????????? ??????????????????????????? ??????????????????????????+++?????????????????????????????????? ????? ? ? ? ???????????????????????????????????????????????????????????????+++???????????????????+++???????????????????? ?? ? ?????????????+=+?????↑+=+↑+=+???==+酸碱盐(见前面)还原性:=可燃性:化学性质:度比空气略小的气体,不溶于水,密物理性质:无色、无味一氧化碳制法(见后表) 用途:干冰作制冷剂。化学性质度比空气大的气体,易溶于水,密物理性质:无色、无味二氧化铜、农药化肥)(“三废”,生活污水水:组成、性质、污染氧化物化合物=还原性:=可燃性:化学性质、、、碳的几种化合物:的排列不同)、石墨等(它们碳原子碳的几种单质:金刚石碳后表)置、收集、检验等(见实验室制法:原理、装工业制法:分离水煤气制法: 太空气球。用途:高能燃料、充灌=还原性:=可燃性:化学性质:度最小的物质的气体,不溶于水,密物理性质:无色、无味氢气面)置、收集、检验(见后实验室制法:原理、装气(物理变化)工业制法:分离液态空制法:燃烧。用途:供给呼吸、支持提供氧具有氧化性较活泼,在化学反应中化学性质:化学性质比密度比空气的大的气体,不易溶于水,物理性质:无色、无味氧气非金属单质与硫酸铜溶液反应:与酸反应)成分氧化铁潮湿的空气中易生锈(纯氧中燃烧:与氧气反应化学性质:物理性质:金属单质(铁)单质△点燃△点燃△点燃 2222223232222224422244232432CO Cu CuO CO 2CO O CO 2CO Cu 2CuO C CO O C CO H CaCO CO CO O H Cu CuO H O 2H O 2H Cu FeSO CuSO Fe H FeCl 2HCl Fe H FeSO SO H Fe O Fe O Fe 2O 3Fe 十六、氢气、氧气、二氧化碳气体的制取装置 ⑷ ⑸ 十七、化学实验基本操作 常用仪器的名称、使用方法和主要用途 1. 可用于加热的仪器――试管、蒸发皿、燃烧匙、烧杯、石棉网 2. 不能用于加热的仪器――集气瓶、量筒、水槽、漏斗、胶头滴管 3. 称量仪器――托盘天平 4. 夹持、固定的仪器-试管夹、铁架台(带铁圈、铁夹)等 5. 加热仪器――酒精灯、酒精喷灯 6. 其它仪器――玻璃棒、药匙、水槽、毛刷等 药品的取用 1.固体药品的取用:固体药品不说明用量,一般盖满试管底部即可。粉末状的药品用药匙或纸槽取用;块状的药品要用镊子夹取,装入时一定要把试管横放,然后把药品放到试管口部,把试管慢慢的竖起,让药品缓缓的滑落到底部。 2.液体药品的取用:液体药品不说明用量,一般取1~2ml 。取用时注意:一定要把试剂瓶塞倒放在桌面上,倒液体时试剂瓶口要和容器口紧紧靠在一起,让液体慢慢的倒入容器中,如果浓硫酸溅到皮肤或衣服上一定要先用抹布擦拭,然后用水冲洗,最后涂上点碳酸氢钠溶液。 3.化学实验基本操作: 4.常见气体的检验 5、盐酸、硫酸的检验 6、用指示剂鉴别酸溶液和碱溶液 纯 净 物