
MnO2氧气的制备与性质实验探究报告
一实验目的
1、熟悉实验室制取氧气的反应原理,掌握实验室制取和收集氧气的方法及其性
质实验的操作技巧。
2、初步掌握本实验的演示教学方法。
3、练习药品的取用及装置气密性检查。
二实验原理
我们都知道,约占空气体积1/5的氧气与人类的生活、生产有着很密切的关系,是人类维持生命不可缺少的物质,动物和植物的生存也都离不开氧气。在通常情况下,O2为无色无味的气体。在标准情况下,O2比空气的密度大。不易溶于水(每升水溶解O2约30ml)
氧气的化学性质很活泼。它不仅可以助燃,而且在点燃或高温条件下可以和大多数金属(如铁、镁)、非金属(木炭、硫、磷、和石蜡等)发生反应,放出大量的热。
2KMnO4===K2MnO4 + MnO2 + O2↑
2H2O2 === 2H2O+O2↑
三仪器、材料与药品
硬质大试管、锥形瓶、分液漏斗、单孔橡皮塞、酒精灯、火柴、垫木、水槽、集气瓶、蒸发皿、研钵、毛玻璃片、橡皮软管、铁架台、玻璃棒、钥匙、脱脂棉、托盘天平、燃烧匙、·大烧杯、坩埚钳、砂纸、试管及试管架;
KMnO4、10﹪H2O2、硫磺、木炭、铁丝、蜡烛、澄清石灰水。
四实验内容
⑴KMnO4加热分解法
2KMnO4===K2MnO4 + MnO2 + O2↑
实验步骤
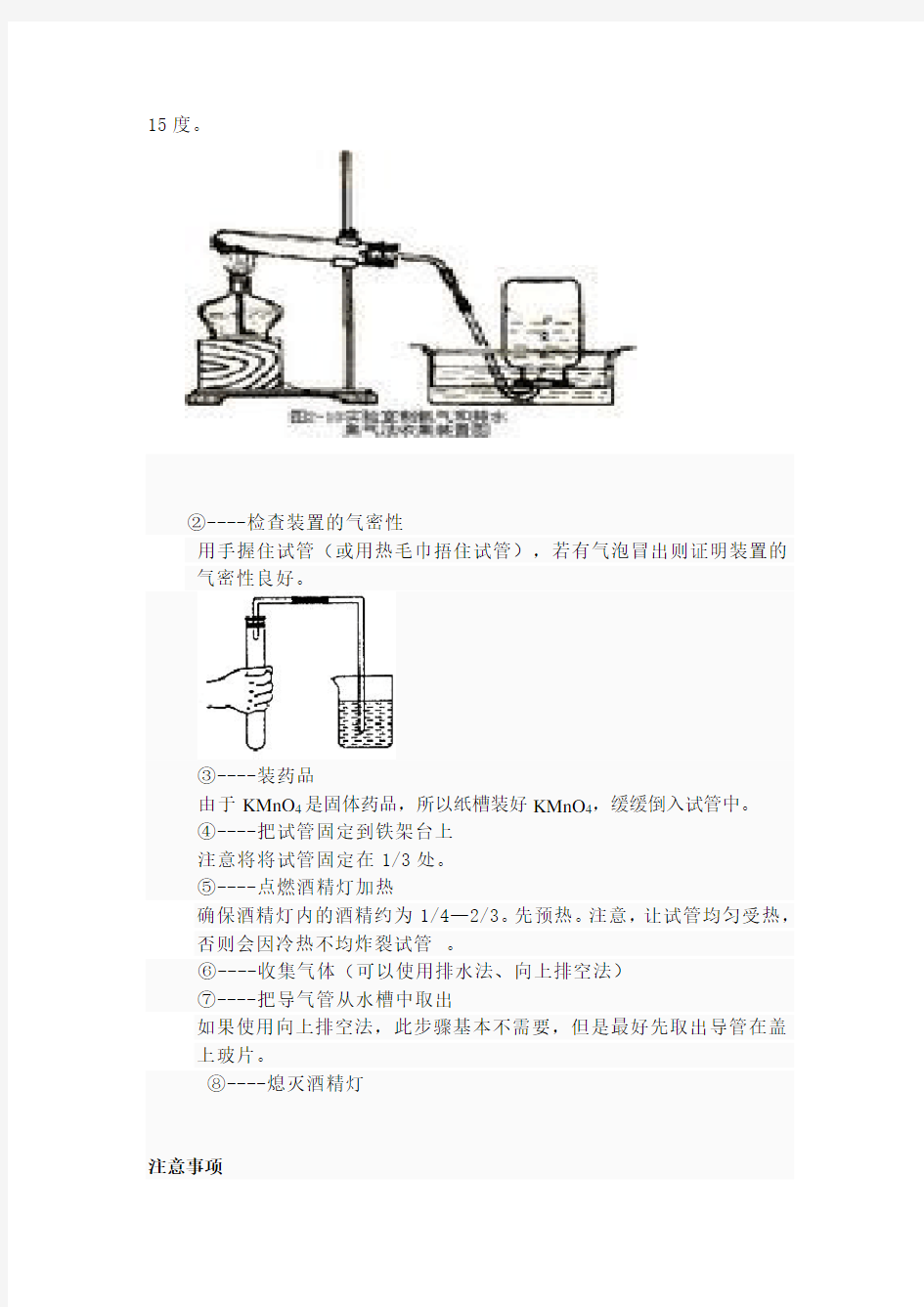
①----按照下图组装好仪器
组装仪器的顺序是从上到下,从左到右。注意:试管口略向下倾斜约
15度。
②----检查装置的气密性
用手握住试管(或用热毛巾捂住试管),若有气泡冒出则证明装置的气密性良好。
③----装药品
由于KMnO4是固体药品,所以纸槽装好KMnO4,缓缓倒入试管中。
④----把试管固定到铁架台上
注意将将试管固定在1/3处。
⑤----点燃酒精灯加热
确保酒精灯内的酒精约为1/4—2/3。先预热。注意,让试管均匀受热,否则会因冷热不均炸裂试管。
⑥----收集气体(可以使用排水法、向上排空法)
⑦----把导气管从水槽中取出
如果使用向上排空法,此步骤基本不需要,但是最好先取出导管在盖上玻片。
⑧----熄灭酒精灯
注意事项
MnO 2
① 实验前先检查装置的气密性。
② .试管口要略微向下倾斜:防止生成的水回流,使试管底部破裂。 ③ 导气管伸入发生装置内要稍露出橡皮塞(不要太长)有利于产生的气体排出。
④ 试管口塞一团棉花:防止高锰酸钾粉末进入导气管,污染制取的气体和水槽中的水。
⑤ 加热时先预热。
⑥ 排气法收集气体时,导气管要伸入接近集气瓶底部:有利于集气瓶内空气排出,使收集的气体更纯。
⑦ 实验结束后,先将导气管移出水面,然后熄灭酒精灯:防止水槽中的 水倒流,炸裂试管。
⑵ H 2O 2分解法
2H 2O 2 === 2H 2O+O 2↑
①如下图,连接实验装置,顺序为由左到右,由上到下。
②检查装置的气密性
用手捂住锥形瓶口,若有气泡冒出,证明仪器的气密性良好。
③装药品
将固体药品二氧化锰缓缓倒入锥形瓶中;用20ml10% H 2O 2与40ml H 2O 混合配成30% H 2O 2缓慢加入分液漏斗中。
④收集气体(同上高锰酸钾收集法)
注意事项
①如果用长颈漏斗,应注意其颈部应在液面以下:防止气体从长
颈漏斗泄露,可用分液漏斗代替(可随时控制反应的发生和停
止,以及反应的速度);
②导管应稍露出橡皮塞,便于气体排出;
③由于H2O2易分解,稀释时应当用蒸馏水,并在使用前稀释。
五氧气的性质实验
1 硫与氧气的反应
取一洁净的燃烧匙,放入少量硫粉,酒精灯上加热至燃烧,发出微弱的淡蓝色火焰。然后将燃烧着的硫匙由上往下缓缓伸进集有O2的集气瓶中,这时火焰呈现明亮的蓝紫色,并伴有刺激性气味的SO2产生。为避免污染空气,将燃烧匙取出后及时淬入盛有冷水的大烧杯中。
2 碳在O2中燃烧
用镊子夹取一小段木块碳,在酒精灯上烧至红热,再缓缓伸进盛满O2的集气瓶中,可看到木炭燃烧的更剧烈并发出白光。给集气瓶中倒入少量澄清石灰水,振荡,石灰水变浑浊。
3 铁在O2中燃烧
准备一条铁丝,砂纸擦亮后弯成螺旋状,系在火柴上。点燃火柴,伸入盛有水的集气瓶中,铁丝燃烧,火星四射,并生成一种黑色熔融物。
4 蜡烛在O2中燃烧
用小刀截取长约1cm的蜡烛,放入燃烧匙,点燃后伸入集气瓶。蜡烛的火焰更加亮白。给集气瓶中倒入少量澄清石灰水,振荡,石灰水变浑浊。
注意事项
以上关于做O2性质的实验,燃烧物一定要放置于集气瓶中央,切勿靠近瓶壁,以防集气瓶炸裂。
六讨论与研究
1、过氧化氢是液态,只需加入催化剂二氧化锰就可以反应,不需要加热,而且可以根据需要随开随停,并可以通过过氧化氢溶液的滴加速度来控制反应的速度和通过烧瓶内气体的冒出速度来判断反应速度,产物是水没有污染。
2、加热高锰酸钾制氧气的优点:能产生较为稳定的气流,反应速率适中,危险小。缺点:原料价格高,氧元素利用率低,反应装置复杂,操作不当容易引起试管炸裂,固体废弃物对环境有负面影响。
3、加热氯酸钾+二氧化锰优点:氧元素利用率高,分解过程中无粉末飞扬。缺点:原料价格高,反应装置复杂,操作不当容易引起试管炸裂,固体废弃物对环境有负面影响,制取的氧气中混有较多氯气而有异味等。
实验室制取氧气及其性质实验报告 实验者: 实验日期: 一、实验目的: 1、掌握实验室制取氧气的方法 2、掌握氧气的性质 二、实验器材:导气管,试管,集气瓶,酒精灯,水槽,燃烧匙 三、实验药品:氯酸钾,二氧化锰,木炭,硫粉,红磷,铁丝 四、实验原理:2KClO 3 2KCl+3O 2 五、实验步骤: 安装如图组装仪器。 查:检查装置气密性 ,双手握住试管,观察玻璃管内水柱变化。 装:将药品装入试管,在试管口放一小团棉花,装好带导管的软木塞。 定:将试管固定在铁架台,试管夹应夹在离试管口1/3处,试管口应向下。 点:点燃酒精灯,先来回移动,使试管均匀受热,然后将火焰集中在药品处加热。 收:采用排水法收集氧气,理由是氧气不溶于水。收集四瓶氧气。 离:收集满氧气后,先将导管移开水槽。 熄:再用灯帽熄灭酒精灯。 六、氧气性质实验操作: 1、观察氧气的颜色和气味:无色无味,能使带火星的木条复燃。 2、娶一小块木炭,在酒精灯上烧至发红,然后将木炭插入集气瓶内。 观察现象:剧烈燃烧,发出白光,放出热量,说明集气瓶中有纯净的氧气存在。反应完后,向集气瓶中加入澄清石灰水,振荡后,现象为澄清石灰水变浑浊,说明木炭跟氧气反应后产生CO 2。 化学方程式为:C +O 2CO 2 3、用细铁丝螺旋绕在燃烧匙是,另一端绕一根火柴,点燃火柴,待火柴燃烧尽时,立即放入留有水,充满氧气的集气瓶中。 观察现象:红热的铁丝剧烈燃烧,火星四射,放出大量热,生成黑色固体。化学方程式为: 3Fe +2O 2 Fe 3O 4 4、取少量硫粉在燃烧匙上,在酒精灯上加热,硫粉熔化,迅速将燃烧匙伸进充满氧气的集气瓶中。 S +O 2 SO 2 5、取少量磷粉在燃烧匙上,在酒精灯上加热至发红,迅速将燃烧匙伸进充满氧气的集气瓶中。 观察现象:剧烈燃烧,发出明亮光辉,放出热量,生成白烟。化学方程式为: 4P +5O 22P 2O 5
基础实验1 氧气的制取与性质 【教学目标】 1.知识与技能: (1)练习仪器装配、检查装置气密性、收集气体和检验气体等基本实验操作。 (2)学习实验室制取氧气的方法。 (3)加深对氧气性质的认识。 2.过程与方法: (1)知道反应原理决定实验装置,气体的性质决定气体的收集方法和验满方法。 (2)学会边实验、边分析、边讨论的方法。 3.情感态度与价值观:培养学生的科学的学习态度,养成良好的学习习惯。 【教学重点】氧气的制法与性质及实验操作。 【教学难点】细铁丝在氧气中燃烧的实验操作及实验现象的描述。 【教学方法】复习提问→实验探究→得出结论→拓展视野→提高兴趣。 【实验准备】 药品:高锰酸钾、水、木炭、细铁丝、蜡烛。 仪器、材料:铁架台、铁夹、大试管、单孔橡皮塞、橡皮管、导管、集气瓶、水槽、毛玻璃片、棉花、坩埚钳、燃烧匙、火柴、酒精灯、烧杯、木条、木块、纸片、砂纸等。【课时安排】1课时 【教学过程】 [引入]展示一盛满氧气的集气瓶和一空集气瓶。 [问]哪一瓶是氧气?如何检验? [复习提问] 实验室如何制取氧气呢? [回答]实验室可以用分解过氧化氢溶液、加热高锰酸钾或加热混有二氧化锰的氯酸钾固体的方法制取氧气。 [提问]为什么选择这样的方法而不选择氧化汞(氧化汞加热生成汞和氧气,汞有毒)、空气或者水(水通电生成氧气和氢气)? [回答]因为高锰酸钾或过氧化氢分解制取氧气的方法,具有反应快、操作简便、便于收集等优点,适合实验室制取少量气体。 [教师]那么又将选择什么样的装置呢?下面请同学们做好自学指导和[活动准备],各小组根据所提供的实验用品设计制取氧气的方案,看哪组设计的又快又合理?讨论后各小组:①板书反应原理;②展示连接好的发生装置并回答问题2;③收集装置并回答问题3。 [学生讨论] [教师巡视] [学生代表陈述讨论结果] [教师]我们设计好了实验方案。哪位同学愿意自己动手来体验做化学实验的乐趣? [学生]愿意。 [教师]各小组分好工,按方案规范操作亲自动手制取氧气,用一种方法收集三瓶氧气(其中一瓶底部留有少量水或铺层细砂)并验证它的性质并思考[问题与交流]。 [注意事项]
.正确的是( ) 7.(2019·永州)在进行实验室制取和收集 O2的过程中,有关做法不 A.选择装置①或②作为O2的发生装置 B.选择装置③或④作为O2的收集装置 C.装置④有气泡冒出时立即收集气体 D.将装置①中的长颈漏斗下端管口插入液面以下 答案 C 24.(2019·兰州)实验室使用一定质量的高锰酸钾加热分解制氧气,各物理量随加热时间变化的图像正确的是 【答案】D 【解析】刚开始加热时,温度未达到其分解温度,没有氧气放出;高锰酸钾加热分解生成锰酸钾、二氧化锰和氧气,固体质量逐渐减少,锰元素的质量分数逐渐增加,直到反应结束后不变;高锰酸钾是生成物,生成物质量随反应时间增加而增加;化学反应前后元素质量不变,生成的氧气中不含钾、锰元素,因此,高锰酸钾分解反应过程中,固体中钾元素和锰元素质量比不变。 10.(2019·兰州)下列物质在氧气中燃烧会产生蓝紫色火焰的是 A.铁 B.木炭 C.氢气 D.硫 【答案】D 【解析】铁在氧气中燃烧,火星四射,生成黑色固体;木炭在氧气中燃烧放热、发出白光,生成无色无味气体; 氢气在氧气中燃烧,放热、产生淡蓝色火焰;硫在氧气中燃烧发出明亮的蓝紫色的火焰。5.(2019·梧州)下列有关氧气的说法错误的是() A.能燃烧 B.无色 C.无味 D.能供给呼吸 【答案】A 【解析】在通常状况下,氧气是无色、无味气体,氧气能够供给呼吸、支持燃烧,氧气不具有可燃性,不能燃烧,不可作为燃料,所以,选项A错误。 2.(2019·宁波)某废旧干电池内有二氧化锰、炭黑、氯化锌、氯化铵等物质。某实验小组回收并利用其中的二氧化锰作催化剂制氧气,下列实验操作和装置中,错误的是()
氧气的实验室制取与性质教学设计 课题分析: 本课题是学生练习了实验操作后接触到的第一个系统的、综合的气体制取实验,是学生具体地从化学的角度出发,学习和研究制备物质的开始。通过制取氧气的原理和思路的分析,对于培养学生的实验设计探究能力和创新意识起到很好的作用,也有利于进一步熟悉常见仪器的使用,教学中通过对气体制取一般方法予以介绍,让学生对制取气体的方法有一定的认识,为学习“二氧化碳的制取的研究”打下基础。 本教学设计为此课题的第一课时的教学内容,内容主要有:1、研究实验室中如何制取氧气,在实验室里常用分解过氧化氢溶液或加热高锰酸钾的方法制取氧气,分解过氧化氢溶液用到催化剂,2、介绍了催化剂和催化作用。3、分解反应的概念。 学情分析: 1、本班学生基础较差,学习积极性不够,因此在教学中教师要特别注意引导和鼓励; 2、学生已经学习了“我们周围的空气”、“氧气的性质”等,对氧气有了一定的了解,但对如何得到氧气,特别是在实验室的条件下如何制取氧气还没有系统,深入地认识。 3、通过前面的探究学习活动,学生对科学探究已有一些体验。在本课题的探究学习活动中,在教师的引导下,学生对观察到的现象进行分析,后加以表达和交流,得出相关的结论。 教学目标: 1、知识与技能:(1)、了解实验室制取氧气的反应原理,培养学生的实验技能;(2)、认识催化剂、催化作用和分解反应等概念。 2、过程与方法: (1)、、通过探究氧气的制法,初步学习实验探究过程。 (2)、通过对分解反应与化合反应异同点的比较,让学生初步学会比较学习 3、情感态度与价值观:(1)、通过对催化剂的探究和阅读有关材料,培养学生自主探究,勇于创新的科学精神。(2)、激发学生学习化学的兴趣和探究的欲望。 教学重点、难点: 1、重点:实验室制取氧气的原理。 2、难点:催化剂的概念和催化作用。
实验活动1 氧气的实验室制取与性质 教学目标 教学过程 【实验用品】 大试管、试管夹、单孔橡皮塞、胶皮管、玻璃导管、集气瓶、水槽、铁架台(带铁夹)、酒精灯、玻璃片、坩埚钳、细铁丝、木条、棉花、火柴。 高锰酸钾、木炭、澄清石灰水。 合作探究 探究点一加热高锰酸钾或氯酸钾制取氧气 提出问题实验室加热高锰酸钾制取氧气的实验中,使用了哪些仪器?哪部分是气体发生装置?哪部分是气体收集装置?为什么可用排水法收集气体? 讨论交流结合化学实验基本操作和氧气的性质,讨论归纳。 归纳总结 1.反应原理: 高锰酸钾锰酸钾+ 二氧化锰+ 氧气 2.实验装置:(若药品为氯酸钾,则试管口不用放棉花) 3.收集方法:由于氧气不易溶于水,制取较纯净的氧气,可采用排水法收集。又因氧气的密度比空气的密度大,故制取较干燥的氧气,可用向上排空气法收集。 4.操作步骤: ①查——组装仪器,检查装置的气密性;②装——向试管中装入药品;③定——将试管固定在铁架台上;④点——点燃酒精灯,进行加热;⑤收——收集氧气;⑥离——
将导气管撤离水槽;⑦熄——熄灭酒精灯,冷却后拆除装置。 妙语巧记:以上制氧的实验步骤可概括为“查”“装”“定”“点”“收”“离”“熄”,谐音记忆为“茶”“庄”“定”“点”“收”“利”“息”。 5.检验方法:将带火星的木条伸入集气瓶中,若木条立即复燃,证明是氧气。 6.验满方法: (1)用向上排空气法收集氧气时:把一根带火星的木条放在集气瓶口,如果木条复燃,证明氧气已集满了。 (2)用排水法收集氧气时:如果集气瓶口有大量气泡逸出,证明瓶中没有水了,即氧气已集满。 7.注意事项: ①药品要平铺在试管底部,使其均匀受热; ②铁夹要在距离试管口1/3处; ③导管不宜伸入试管过长,不利于气体导出; ④试管口应略向下倾斜,防止冷凝水倒流,炸裂试管; ⑤如果实验所用药品为高锰酸钾,通常要在试管口塞上—团棉花,以防止加热时高锰酸钾随氧气进入导气管; ⑥排水法集气时,当气泡连续且均匀放出时再收集,否则收集的气体混有空气;氧气收集后,集气瓶应正放在桌面上。 ⑦排水法集气时,实验结束后,应先移出导气管,后撤离酒精灯,以防止水倒流造成试管炸裂。 课堂讨论(1)实验室用加热高锰酸钾制取氧气时,为什么常在试管口塞上—团棉花?(2)用排水法集气时,实验结束后,为什么要先移出导气管,后撤离酒精灯? (3)制取的氧气如果不纯,你认为可能的原因有哪些? 知识拓展⑴氯酸钾为白色固体,二氧化锰为黑色固体(可巧记为“白加黑,制氧气”)。高锰酸钾为暗紫色(或紫红色)固体。 (2)检查装置气密性的方法 方法①微热法:先将导管一端插入水中,然后用手握住容器外壁,可以观察到导管口有气泡产生,松手后,导管中的液面会升高,说明装置的气密性良好。 方法②降温法:如果气温较高,先将导管的一端插入水中,用沾有冷水的毛巾或将容器浸于冷水中,若观察到导管内液面升高,说明装置的气密性良好。 探究点二木炭和铁丝在氧气中燃烧 提出问题用以上方法制取两集气瓶氧气,将木炭和铁丝放在氧气中燃烧的现象是什么? 讨论交流实验基本操作讨论归纳。了解氧气的性质。 实验活动 1.用坩埚钳夹取木炭,在酒精灯上加热到发红,插入收集的氧气中,观察现象,停止后向集气瓶中加入澄清石灰水,振荡,观察现象。 2.点燃系在螺旋状细铁丝底端的火柴,插入盛有氧气的集气瓶中,观察现象。
化师二班黄小雪2221 氧气的实验室制取及性质 一、教材分析 本实验是学生学完第一、二单元后的实验活动,在学习了氧气的制法有了一定的理论基础后自己动手独立完成科学探究过程的实验课,是对化学实验基本操作、氧气的实验制取和氧气性质等实验的综合应用。本实验起着承前启后的作用,本节课既是对前面的基本操作、氧气的相关知识的一个小结性的实践活动也为以后系统地学习二氧化碳的制取奠定了理论和实践的基础。 二、学情分析 实验室制取氧气对学生来讲是进入实验室的开始,学生通过课题2的学习与探究对氧气的性质及用途有了较深刻的认识,对氧气产生了浓厚的探究欲望加之知识和实验技能的储备学生早已渴望制取一瓶纯净的氧气,并对氧气性质验证的实验现象充满了好奇。 三、教学目标 1.知识与技能 (1)学习实验室制取氧气的方法; (2)加深对氧气性质的认识; (3)练习仪器的装配,初步掌握检查装置气密性、收集和检验气体等操作。 2.过程与方法 (1)通过制取氧气及其性质检验的探究活动,增进学生对科学探究的体验; (2)在活动中激发学习兴趣,在兴趣中提出问题、分析问题、解决问题。 3.情感态度价值观 (1)通过实验探究激发学生学习化学的积极性和主动性; (2)在实验探究过程中培养学生合作与交流能力。 四、教学重难点 重点:学习实验室制取氧气的方法;加深对氧气性质的认识 难点:实验操作规范掌握 五、教学方法 讲授法、实验法、合作探究法 六、教学过程 1、教学准备:带铁圈的铁架台、胶塞、导管、分液漏斗、集气瓶、水槽、毛玻
璃片、木炭、酒精灯、抹布2、教学过程
MnO 2 MnO 2 七、板书设计 氧气的制取及性质 一、实验原理 KMnO 4 MnO 2+K 2MnO 4+O 2 2KClO 3 2KCl+3O 2 2H 2O 2 2H 2O+O 2 二、实验步骤 组、查、装、收、验、检 1、“组“装仪器; 2、“查“装置气密性:液封法、微热法; 3、“装“入药品,连接好实验装置; 4、“收“实验,制备并收集气体; 5、“验“满:带火星的小木条 5、“检”验氧气性质:木炭 气体收集 木炭燃烧 现象 结论 空气 氧气 向上排空气法(ρ气>ρ空) 排空气法 排水法(气体不/微溶于水) 向下排空气法(ρ气<ρ空)
考点2 氧气的性质与制备(包括催化剂) 一、选择题 (2018?辽宁葫芦岛)对下列物质在空气中燃烧的现象描述正确的是()A.红磷燃烧产生大量白雾 B.硫粉燃烧发出微弱的淡蓝色火焰 C.镁条剧烈燃烧,生成黑色固体 D.木炭燃烧发出白光,生成二氧化碳 【答案】B 11.(2018·广西北部湾)下列有关氧气的说法,错误的是() A.氧气能支持燃烧 B.细铁丝在氧气中燃烧,生成氧化铁 C.在通常状况下,氧气的密度比空气大 D.氧气的化学性质比较活泼,能跟许多物质发生反应 【答案】B 4. (2018·山东菏泽)对下列实验事实的解释错误 ..的是 A.硫在空气和氧气中燃烧现象不同——氧气浓度不同 B.硝酸钾在热水和冷水中溶解的快慢不同——温度不同,硝酸钾的溶解度不同 C.酒精和食醋的气味不同——不同分子性质不同 D.金刚石和石墨硬度不同——碳原子的排列方式不同 【答案】B (2018·内蒙古呼和浩特)3.下列说法正确的是 A.军事上用镁粉制作照明弹 B.煤的干馏与石油的分馏化学原理相同 C.用石蕊试纸测定橙汁的pH D.在实验室用稀硫酸和块状大理石制取二氧化碳 【答案】A (2018·广西桂林)12. 下列物质在空气中燃烧,发出耀眼白光的是() A.碳 B.镁条 C.氢气 D.蜡烛 【答案】B (2018·河南)4.下列物质在氧气里燃烧,生成物为白色固体的是() A.硫 B.镁条 C.铁丝 D.木炭 【答案】B 3. (2018?黑龙江齐齐哈尔)下列有关实验现象的描述正确的是 A.硫在空气中燃烧,发出蓝紫色火焰 B.红磷在空气中燃烧,产生白色烟雾 C.把打磨过的铝丝放入硫酸铜溶液中,铝表面出现红色物质,溶液由蓝色变为无色 D.电解水实验中,正、负极两端玻璃管内收集到的气体体积比为2:1 【答案】C
. 【考纲要求】掌握氧气的主要性质和用途;能用氧气的性质解释一些常见的现象。1. 铁等物质在氧气中燃烧的化学方程式,并能准确的描述这些反应的现象。 2.能正确写出木炭、红磷、硫、操作方法;了解氧气的工业制法。 3.掌握实验室 制氧气的原理、装置、【知识网络】 在通常状况下,氧气是无色无味的气体密度比空气大物理性质 不易溶于水 C+OCO 木炭在氧气中燃烧,发出白光,放出热量,生成可使澄22清石灰水变浑浊的气体 S+OSO硫在氧气中燃烧,发出明亮的蓝紫色火焰,放出热量, 2 2生成无色有刺激性气味的气体 2PO红磷在空气中燃烧,放出热量,产生大量的白烟氧气化学性质4P+5O25 2 FeO铁丝在氧气中剧烈燃烧,火星四射,放出热量,生3Fe+2O234 成黑色固体 2HO 2HO+O↑2222△反应原理 2KMnOKMnO+ MnO+ O↑222 44 MnO 22KCl+3O↑2KClO 实验室制法23△制取装置:①固、固加热型;②固、液常温型 收集装置:①排水法;②向上排空气法 检验方法;将带火星的木条伸入集气瓶中,若木条复燃,证明是氧气工业制法:①分离液态空气;②膜分离技术 用途:①供给呼吸;②支持燃烧 【考点梳理】 考点一、氧气的性质和用途 1.氧气的物理性质: (1)通常状况下,是无色、无味的气体,可液化和固化。
(2)不易溶于水。 (3)密度比空气略大。 2.氧气的化学性质: 文档Word party Committee nvironme nt facing higher standards a nd requir ements, provincial se achievemedvanced. Thents are hard w on and should be a ppreciated. Howev er, we are fully aware, the new period, and work in the countryside and t he eCity issued demolr, River waste, beginning of river ecological restoration effects. Three modified a split aspects: County total ition illegal area up 2.759 million square meters, completed City issue d annual task of 153%, split against are a ranking city se cond; completed hree modified area 4.846 million square meters, completed annual task of 403%, ranki ng city third, w hich village i n the a target compl eted total city ranking first; County Governme nt was named city level hree modified a split work aBla oug ution source on rate ra he city's first on of 4600 Yua living standards, poor farmers in less than complete eliminatin, 8949, 19008. Five waters rule: the County investe d 2.169 bi llion yua n, similar counties line t complete the 42 km of sewage pipe network construction, completinked first in t he city, won the provincial rural sewage treatment w ork better; key poll s such as electroplating, papermaking, chemica l industry management thrh verification and acceptance of the municipal g overnment, t he County removed ck and odor ous Rive ural labor forcestent look. Old is agi ng, r age governance is poor. Thirdly, farmers continued to be persi ng, construction of disorder, no drawi ngs, no constr uction, no vetting
年 月 日 年级 班 姓名 合作者 实验题目: 氧气的实验室制取和性质实验 探究实验目的:1.掌握实验室制取氧气的原理。 2.掌握实验室制取氧气和氧气性质实验的基本操作技能。 实验用品:集气瓶、水槽、玻璃片、带导管的单孔橡胶塞、试管、铁架台、燃烧匙、镊子 火柴、高锰酸钾、硫、木炭。 实验步骤与方法: 1.实验室制取氧气 实验原理: ( 分解反应 ) ( 分解反应 ) ( 分解反应 ) ① 查:检查 装置的气密性 ,双手握住试管,观察玻璃管内水柱变化。 ② 装:将药品 平铺 在试管的底部,在试管口放 一团棉花 ( 防止高猛酸钾粉末进入导管和水槽 ) 装好带导管的橡皮胶塞。 ③ 定:将试管固定在铁架台,铁夹应夹在离试管口的 1/3 处,试管口应 略向下倾斜 。 ④ 点:点燃酒精灯,用酒精灯的 外焰 加热,先 预热 试管,使试管 受热均匀 ,然后将火焰集中 在药品处加热。 ⑤ 收:采用排水法收集气体,理由是氧气不易溶于水。(当导管口放出的气泡连续而均匀时,才收集气体) ⑥ 离:将导管移开水槽。 ⑦ 熄:用酒精灯灯帽熄灭酒精灯。 注意:离,熄操作顺序不能颠倒,否则 防止试管内温度骤然降低,压强减小,水槽中的水倒吸到试管内,使试管炸裂。 KMnO 4K 2MnO 4O 2 +MnO 2+加热H 2O 2 H 2O O 2 M nO 2 +KClO 3 KCl O 2 M nO 2 +√
着的硫伸入到盛有氧气的集气瓶中,观察现象。(反应后生成二氧化硫有刺激性气味且是大气污染物之一,因此,盛有氧气的集气瓶中要留有少量的水,溶解吸收生成的二氧化硫,减少污染物的扩散。) 现象:(空气中) 发出微弱的淡蓝色火焰,放出有 刺激性气味的气体。 (氧气中) 发出明亮的蓝紫色火焰,放出有 刺激性气味的气体。 结论: (化合反应) (3)铁丝在氧气中燃烧 把铁丝用砂纸打亮,然后绕成螺旋状,一端系 在燃烧匙的柄上,另一端系在一根火柴上,点燃火柴后,待火柴梗快要烧完时,立即连通燃烧匙伸进盛有氧气的集气瓶中,观察现象。 现象: 剧烈燃烧,放出大量的热,火星四射,有黑色固体产生。 结论: (化合反应) 注意:盛有氧气的集气瓶中要留有 少量的细沙或水 ,理由 防止熔化物溅落下来炸裂瓶底。 S +O 2SO 2 点燃 Fe +O 2Fe 3O 4 点燃
初中化学教学导学案 【课题】氧气的性质与制备 【学习要求】 1.加强学生对氧气主要性质和用途的理解。 2.形成物质的结构决定物质的化学性质的认识。 3.掌握实验室制取氧气的原理、方法;学会如何选择发生装置、收集装置。 【重点】形成知识规律,并能初步运用。 一、自习反馈 二、氧气的性质: 1、〔情景探讨〕 2005年3月29日,京沪高速公路淮安段发生一起两辆货车相撞的交通事故,导致其中一辆槽罐车上的液氯(Cl2)大面积泄漏,造成公路旁居住村民重大伤亡。在事故现场可以看到地面上方有大量的黄绿色气体,并闻到一股刺鼻的气味。消防人员戴着防毒面具,身穿防毒服,用高压水枪向天空及沉降在地面的氯气喷洒水和碱液,以此消除Cl2的污染和伤害。(1)根据以上信息,请归纳出(Cl2)的物理性质:。 (2)如果当时你在现场,怎样做才能保证自身的安全? 2、〔问题组一〕 ①氧气是由元素组成的?元素的化学性质取决于。 ②请画出N、O、F三种原子结构示意图: ③根据示意图,我们可得出三种元素的活泼性顺序是:。 ④我们知道,O2可以与大多数金属单质反应,你能通过氧原子结构示意图来解释一下: 氧气为什么会发生这些反应吗? 3、〔同步练习〕 下图是元素周期表中1——20号元素的示意图。 请回答下列问题: ①请将示意图中 A、B上方的两处空格填上相应内容。 ②画出A、B原子的结构示意图的是。A、B两种元素形成的化合物的化学式为。 ③请你推断:O2可以与示意图中那些金属反应? 三、氧气的制备: 1、〔实验探究〕:利用桌面上的仪器,请你组装出制氧气的发生装置: ①②③④⑤⑥⑦ (1)实验室可以用加热固体高锰酸钾制氧气,反应原理是:2KMnO4K2MnO4 + MnO2 + O2↑;也可以用双氧水和二氧化锰制取氧气,写出反应方程式:。 (2)采用加热高锰酸钾的方法制氧气,你可以利用上述仪器组装的发生装置是:。 一 1 H 氢 2 He 氦 2 3 4 5 6 7 二 3 Li 锂 4 Be 铍 5 B 硼 6 C 碳 7 N 氮A 9 F 氟 10 Ne 氖三 11 Na 钠 12 Mg 镁B 14 Si 硅 15 P 磷 16 S 硫 17 Cl 氯 18 Ar 氩四 19 K 钾 20 Ca 钙 △
《实验活动1 氧气的实验室制取和性质》重难点分析 石家庄第二外国语学校欧阳贵宝 一、教材分析 本实验是学生学完第一、二单元后的第一个实验活动,是对化学实验的基本操作、氧气的实验室制取和氧气的性质实验的综合应用,将刚学过的各部分知识学习提升到一个新的阶段,有一定的难度。本实验需要落实实验操作中的药品取用、加热、仪器的连接、装置气密性的检查、气体的收集以及氧气性质实验等基本操作,学会对实验现象的多角度观察,并初步学会对实验现象的分析得出结论。 本节课的教学重点是实验室制取氧气的实验装置及其操作方法。本节课的教学难点是实验操作中的注意事项,细铁丝在氧气中燃烧的操作。 二、重难点分析 (一)制取氧气 1.突破建议:学生在经过氧气的性质和用途、制取的学习后,对氧气有了比较深刻的认识,由此对氧气制取产生了浓厚的探究欲望,很想自己亲手制取一瓶氧气。对大多数学生来说,利用化学变化以制取某种物质为目标的这类科学实验可能是第一次,可能会无从下手。学生应提前预习课本45-46页的内容,可根据具体情况,编写预习学案让学生完成。在学生动手实验前,教师应先通过视频或亲自演示,让学生清楚实验步骤,明确实验过程中的一些注意事项。在教学过程中,教师可以提前抛出这些注意事项并提问,让学生带着问题和思考完成实验。 2.突破样例: 【师】实验室制取氧气一般用的是什么药品?其反应原理的文字表达式怎样书写?看谁写得又快又准。(分小组竞赛) 【生】回答药品,书写并展示制取氧气的三个文字表达式。 【师】通过文字表达式,我们可以推知若要用高锰酸钾制取氧气,一定要用到酒精灯加热。实验室用高锰酸钾制取氧气需要用什么样的实验装置? 【设计意图】复习旧知,引出新课,初步学会选择装置的依据。 【投影】加热高锰酸钾制取氧气装置 【提问】使用了哪些仪器?哪部分是气体的发生装置和收集装置?为什么可以用排水法收集氧气?
《氧气的实验室制取与性质》教学设计 一、教学目标 1.知识与技能 (1)练习仪器装配、检查装置气密性、收集气体和检验气体等基本实验操作。 (2)学习实验室制取氧气的方法。 (3)加深对氧气性质的认识。 2.过程与方法 (1)知道反应原理决定实验装置,气体的性质决定气体的收集方法和验满方法。 (2)学会边实验、边分析、边讨论的方法。在活动中激发学习兴趣,在兴趣中提出问题、 分析问题、解决问题。 3.情感态度与价值观 培养学生的科学的学习态度,养成良好的学习习惯。 二、教学重点 氧气的制法与性质及实验操作。 三、教学难点 细铁丝在氧气中燃烧的实验操作及实验现象的描述。 四、教学方法 复习提问→实验探究→得出结论→拓展视野→提高兴趣。 五、实验准备 (1)大试管、试管夹、单孔橡胶塞、铁架台(带铁夹)及酒精灯、双孔塞和分液漏斗、 胶皮管、玻璃导管、集气瓶、水槽、玻璃片、坩埚钳、棉花、火柴。 (2)高锰酸钾、双氧水、氯酸钾、二氧化锰、木炭、细铁丝、澄清石灰水; 六、课时安排 1课时 七、教学过程 [引入]展示一盛满氧气的集气瓶和一空集气瓶。[问]哪一瓶是氧气? [复习提问] 实验室如何制取氧气呢? [回答] 实验室可以用分解过氧化氢溶液、加热高锰酸钾或加热混有二氧化锰的氯酸钾固体的方法制取氧气。 [提问]为什么选择这样的方法而不选择氧化汞(氧化汞加热生成汞和氧气,汞有毒)、空气或者水(水通电生成氧气和氢气)? [回答]因为高锰酸钾或过氧化氢分解制取氧气的方法,具有反应快、操作简便、便于收集等优点,适合实验室制取少量气体。 [教师]那么又将选择什么样的装置呢?下面请同学们做好自学指导和[活动准备],各小组根据所提供的实验用品设计制取氧气的方案,看那组设计的又快又合理。讨论 后各小组①板书反应原理②展示连接好的发生装置并回答问题2和③收集装置并 回答问题3)。 [学生讨论][教师巡视] [学生代表陈述讨论结果] [教师]我们设计好了实验方案。哪位同学愿意自己动手来体验做化学实验的乐趣? [学生]愿意。 [教师]各小组分好工,按方案规范操作亲自动手制取氧气,用一种方法收集三瓶氧气(其中一瓶底部留有少量水或铺层细砂)并验证它的性质并思考[问题与交流]。
氧气的性质和制取
氧气的性质和实验室制法 一.检验氧气的方法:把带火星的木条伸入集气瓶中, 木条复燃说明瓶中气体为氧气 检验空气、氧气、二氧化碳气体的方法:分别用燃着的木条伸入三瓶气体中,木条燃烧 更旺的为氧气;继续燃烧无明显变化的为空气;迅速熄灭的为二氧化碳。 二.(1)氧气的物理性质:常温下为无色无味的气体,密 度比空气大,不易溶于水,熔沸点低 氧气的化学性质:具有氧化性。用途:支持燃烧,供给呼吸 (2)氧气与下列物质反应现象
(3)铁燃烧要在集气瓶底部放少量水或细砂的目的:防止溅落的高温熔化物炸裂瓶底 *铁、铝在空气中不可燃烧。 硫在燃烧时集气瓶中加入少量的水或加入氢氧化钠 溶液目的是吸收生成二氧化硫避免污染空气。 为什么磷在氧气中燃烧时集气瓶中加入少量的水? (1)、防止磷燃烧放出热量使集气瓶破裂(2)、吸收产生的P2O5,防止污染 实验前应将铁丝用砂布打磨,除掉铁丝表面的铁锈和氧化膜,有利于铁丝燃烧。 夹持木炭和铁丝的坩埚钳要缓慢伸入集气瓶中目的 是与氧气充分反应,防止产生的热量使氧气逸出。 铁丝要绕成螺旋状目的是增大受热面积,有利于铁丝 持续燃烧。 铁丝末端要系一根火柴目的是引燃铁丝,使温度达到 着火点。 火柴要等到将要燃尽时在伸入集气瓶中目的尽量使 火柴少消耗氧气。 物质在空气中燃烧的现象与氧气中不同,氧气的浓度 越大燃烧越剧烈。 铁丝伸入集气瓶中没有看到火星四射的现象分析原 因:1.铁丝表面有铁锈或油漆 2.氧气的浓度太低 3.火柴没有将铁丝引燃。
三.氧气的制备: 工业制氧气——分离液态空气法(原理:氮气和氧气的沸点不同物理变化) 实验室制氧气原理 2H 2O 2 MnO22H 2 O + O 2 ↑ 2KMnO△K 2MnO 4 + MnO 2 + O 2 ↑ 2KClO 3MnO22KCl+3O 2 ↑ 四.气体制取与收集装置的选择 △ 发生装置:固固加热型、固液不加热型 由反应物的状态和反应条件决定的。高锰酸钾是紫黑色的固体,氯酸钾是白色的固体,二氧化锰是黑色的固体。过氧化氢溶液是无色液体。 收集装置:根据物质的密度、溶解性 排水集气法:氧气不易溶于水;向上排空气法:相同条件下氧气的密度略大于空气
初中化学《性质活泼的氧气》教案 学习目标: 1.认识氧气的主要物理性质; 2.观察和描述木炭、铁丝、蜡烛等在氧气中燃烧的现象,从中归纳出氧气的化学性质; 3.了解氧气的主要用途、氧气与人类的密切关系; 4.了解氧气的工业制法,学习实验室制备氧气的原理、装置和操作,一般性了解两套装 置的区别。 学习重点: 1.氧气的化学性质和获得 第一课时:氧气的性质与用途 课堂学习: 一、引入:地球上的一切生命体都离不开氧气。 [问题情景] 1.为什么各种生物在消耗氧气,而空气中的氧气含量却能几乎保持恒定? 2.你已知道氧气的哪些物理性质与化学性质? 3.有什么事实能证明自然界的水中溶有氧气? [学生交流] 同桌的同学间互相讨论与交流,然后回答问题。(教师进行相关的整理:将学生所描述的有关性质列于黑板上) 二、师生互动: [教师引导]观察身边的空气,并阅读课本33—34页的部分内容。 [师生整理] 一、氧气的物理性质 色、态、味、溶解性、密度(与空气比较)、三态变化 [问题情景] 大家知道,很多物质可以在空气中燃烧,你知道是空气中的什么成分支持这些物质燃烧?请举例说明。 [实验演示] 少量硫在空气和氧气中燃烧 [师生整理] 硫在空气和氧气中燃烧的现象和反应 [教师设疑] 硫在氧气中燃烧比在空气中更旺,那么能在空气中燃烧的木炭、蜡烛在氧气中燃烧的情况又是怎样呢? [实验演示] 木炭、蜡烛在空气和氧气中燃烧。 [师生整理]木炭、蜡烛在空气和氧气中燃烧的现象和反应 [教师设疑] 1.铁丝在空气中燃烧吗? 2.铁丝在纯氧中又能否燃烧? [实验演示] 铁丝在氧气中的燃烧 [学生整理] 将以上实验现象和反应的文字表达式进行整理,填入课本35页表格中。 [教师讲解] 物质与氧气所发生的反应属于氧化反应。
实验活动1 氧气的实验室制取与性质 本实验部分是活动与探究,由学生制取氧气并检验氧气的性质。学生通过亲自动手进行实验,明白了制取气体时应如何检查装置的气密性,如何连接装置、如何制取气体,以及如何验证气体并检验气体的性质。本课题是学生学化学以来遇到的第一种气体的制取,所以氧气的制法及实验操作是本课题的重点,如何引导学生亲自动手做好实验便成了重中之重。在教学过程中,主要从以下几个方面对重点和难点进行突破。 1.给学生提供更多的实验探究的机会,引导学生正确地连接装置。 2.引导学生讨论实验中应注意哪些问题:如怎样检查仪器的气密性?怎样装入固体试剂?试管口内为什么要放一团棉花?试管口为什么要稍向下倾斜?怎样用酒精灯给试管加热?为什么可以用排水法收集氧气?收集气体后为什么要先将导管从水中撤出,然后再移去酒精灯?木炭在氧气中燃烧应注意什么?为什么在做铁丝在氧气中燃烧实验时集气瓶内需留有少量水?等等。 3.采用边实验、边讲解、边讨论的方法,在活动中激发兴趣,在兴趣中提出问题、分析问题、解决问题。 【教学目标】 1.知识与技能 (1)学习实验室制取氧气的方法。 (2)加深对氧气性质的认识。 2.过程与方法 (1)通过让学生设计实验方案去制取氧气与探究氧气的性质,培养学生的实验设计能力,进一步提高学生动手操作能力和科学探究能力。 (2)初步学会运用实验自主探究的方法获得信息,加深学生对氧气制取与氧气性质的认识。 3.情感、态度与价值观 (1)通过实验探究,让学生参与到知识的形成过程中,从而获得成功的喜悦和对化学学习的持续兴趣。 (2)进一步激发学生乐于探究的情感和发扬互助合作的团队精神。 【教学重点】
实验三、氧气的制备及性质 【实验目的】 1. 了解实验室制备气体有哪几种制气装置,制取各类气体适合的仪器装置、收集方法及尾气的吸收。 2. 熟悉实验室制取氧气的几种方法,并能按绿色化学的理念判断、选择合适的实验室获得氧气的方法。 3. 探讨氧气性质实验鲜明、生动、直观的方法,熟练掌握氧气性质实验的操作技能。 4. 学习和研究氧气性质演示实验的教学技能。 【实验指导】 1. 根据实验题目明确实验目的、要求,查找相关资料,设计出实验方案及实验方法和步骤(所用仪器、试剂,装置和方法的改进等)。 2. 选择氧气性质研究中的一个内容写出演示试讲片断。 3. 选择所需要的实验仪器、试剂进行各项实验,实验过程中要求探讨并总结出最佳实验条件和操作方法。 4. 由2-3位学生分别进行3个氧气性质演示实验模拟教学,教师组织观摩评析。评析以实验的教学目的、演示实验教学方法、演示技能为主。 【讨论与研究】 1. 实验室制备气体有那几种制气体装置,收集气体的方法有哪些,为什么? 2. 铁丝在氧气中燃烧的实验是一个难度较大的实验,该实验对铁丝的性状、引发反应条件的装置、反应容器以及实验操作各有什么要求?提出这些要求的原因各是什么?你能否设计出一个铝在氧气中燃烧的演示实验? 3. 氧气性质演示实验成功的关键是什么?各应注意那些事项? 4. 中学教学中氧气性质演示实验的教学目的是什么?观察重点是什么?应引导学生观察那些现象? 5. 如何利用铁丝在氧气中燃烧的演示实验,培养学生的观察和推理能力? 【实验总结】 1. 教师小结,布置新的实验教学内容。 2. 结合实验报告重点总结: 1)从绿色化学的角度及直观、简单、安全、可靠等方面讨论实验室制取氧气的方法,及实验装置的要点。 2)保证氧气性质实验演示成功的条件、关键和注意事项。 3)利用演示实验培养学生观察能力的方法 4)本次实验最大的收获
考点2 氧气的性质与制备(包括催化剂)一、选择题 (2018?辽宁葫芦岛)对下列物质在空气中燃烧的现象描述正确的是()A.红磷燃烧产生大量白雾 B.硫粉燃烧发出微弱的淡蓝色火焰 C.镁条剧烈燃烧,生成黑色固体 D.木炭燃烧发出白光,生成二氧化碳 【答案】B 11.(2018·广西北部湾)下列有关氧气的说法,错误的是() A.氧气能支持燃烧 B.细铁丝在氧气中燃烧,生成氧化铁 C.在通常状况下,氧气的密度比空气大 D.氧气的化学性质比较活泼,能跟许多物质发生反应 【答案】B 4. (2018·山东菏泽)对下列实验事实的解释错误 ..的是 A.硫在空气和氧气中燃烧现象不同——氧气浓度不同 B.硝酸钾在热水和冷水中溶解的快慢不同——温度不同,硝酸钾的溶解度不同 C.酒精和食醋的气味不同——不同分子性质不同 D.金刚石和石墨硬度不同——碳原子的排列方式不同 【答案】B (2018·内蒙古呼和浩特)3.下列说法正确的是 A.军事上用镁粉制作照明弹 B.煤的干馏与石油的分馏化学原理相同 C.用石蕊试纸测定橙汁的pH D.在实验室用稀硫酸和块状大理石制取二氧化碳 【答案】A (2018·广西桂林)12. 下列物质在空气中燃烧,发出耀眼白光的是() A.碳 B.镁条 C.氢气 D.蜡烛 【答案】B (2018·河南)4.下列物质在氧气里燃烧,生成物为白色固体的是() A.硫 B.镁条 C.铁丝 D.木炭 【答案】B 3. (2018?黑龙江齐齐哈尔)下列有关实验现象的描述正确的是 A.硫在空气中燃烧,发出蓝紫色火焰 B.红磷在空气中燃烧,产生白色烟雾 C.把打磨过的铝丝放入硫酸铜溶液中,铝表面出现红色物质,溶液由蓝色变为无色 D.电解水实验中,正、负极两端玻璃管内收集到的气体体积比为2:1 【答案】C 3.(2018?湖南邵阳)下列有关实验现象描述正确的是 A.硫在氧气中燃烧产生淡蓝色的火焰 B.红磷在空气中燃烧产生大量的白烟
氧气的性质和实验室制法 一.检验氧气的方法:把带火星的木条伸入集气瓶中,木条复燃说明瓶中气体为氧气 检验空气、氧气、二氧化碳气体的方法:分别用燃着的木条伸入三瓶气体中,木条燃烧 更旺的为氧气;继续燃烧无明显变化的为空气;迅速熄灭的为二氧化碳。 二.(1)氧气的物理性质:常温下为无色无味的气体,密度比空气大,不易溶于水,熔沸点低 氧气的化学性质:具有氧化性。用途:支持燃烧,供给呼吸 (3)铁燃烧要在集气瓶底部放少量水或细砂的目的:防止溅落的高温熔化物炸裂瓶底 *铁、铝在空气中不可燃烧。 硫在燃烧时集气瓶中加入少量的水或加入氢氧化钠溶液目的是吸收生成二氧化硫避免污染空气。 为什么磷在氧气中燃烧时集气瓶中加入少量的水? (1)、防止磷燃烧放出热量使集气瓶破裂(2)、吸收产生的P2O5,防止污染 实验前应将铁丝用砂布打磨,除掉铁丝表面的铁锈和氧化膜,有利于铁丝燃烧。 夹持木炭和铁丝的坩埚钳要缓慢伸入集气瓶中目的是与氧气充分反应,防止产生的热量使氧气逸出。 铁丝要绕成螺旋状目的是增大受热面积,有利于铁丝持续燃烧。 铁丝末端要系一根火柴目的是引燃铁丝,使温度达到着火点。 火柴要等到将要燃尽时在伸入集气瓶中目的尽量使火柴少消耗氧气。 物质在空气中燃烧的现象与氧气中不同,氧气的浓度越大燃烧越剧烈。 铁丝伸入集气瓶中没有看到火星四射的现象分析原因:1.铁丝表面有铁锈或油漆2.氧气的浓度太低3. 火柴没有将铁丝引燃。 三.氧气的制备: 工业制氧气——分离液态空气法(原理:氮气和氧气的沸点不同物理变化) 实验室制氧气原理 2H2O2MnO22H2O + O2↑ 2KMnO4△K2MnO4 + MnO2 + O2↑ 2KClO3MnO22KCl+3O2↑ 四.气体制取与收集装置的选择△ 发生装置:固固加热型、固液不加热型 由反应物的状态和反应条件决定的。高锰酸钾是紫黑色的固体,氯酸钾是白色的固体,二氧化锰是黑色的固体。过氧化氢溶液是无色液体。 收集装置:根据物质的密度、溶解性 排水集气法:氧气不易溶于水;向上排空气法:相同条件下氧气的密度略大于空气
考点4 氧气的性质与制备(包括催化剂) 一、选择题 1、(2011年四川内江,13题)下列叙述正确的是 A.凡电离时能够产生氢氧根离子的一类化合物都称为碱 B.燃烧都是剧烈的发热发光的化合反应 C.催化剂在化学反应前后,其质量和化学性质都不发生变化 D.两种物质发生反应,生成盐和水,该反应一定是中和反应 2、(2011年四川达州,6题)下列有关实验现象的描述,正确的是 A.铁丝在氧气中剧烈燃烧、火星四射、生成白色固体 B.分别点燃一小块棉纤维和羊毛纤维,都产生了烧焦羽毛的气味 C.测定空气中氧气含量的实验里,铜丝加热变黑 D.木炭燃烧生成二氧化碳 3、(2011年山东烟台,4题)下列关于氧气的说法中错误的是 A.工业上可以利用分离液态空气法制氧气 B.氧气可以支持燃烧,说明氧气具有可燃性 C.氧气供给呼吸,它和体内物质反应,释放能量,维持生命活动 D.夏天鱼池内开启增氧泵,是因为温度升高,氧气在水中溶解量减少 4、(2011年重庆市,13题)下列关于O2的说法不科学的是 A.常用带火星的木条来检验空气中的O2 B.硫在O2里燃烧产生明亮的蓝紫色火焰 C.工业上将空气液化后再进行分离来制取O2D.加热KClO3制O2,可用MnO2作催化剂 5、(2011年浙江温州,20题)如图为实验室加热高锰酸钾制取氧气的装置。在实验过程中,当观察到气泡在导气管口连续、均匀地冒出时,才开始收集气 体,其目的是 A.为了检验该实验装置的气密性 B.为了提高收集到的氧气的纯度 C.防止水槽中的水倒吸使试管破裂 D.防止高锰酸钾颗粒进入导气管 6、(2011年四川眉山,16题)对资料或实验证据的分析是否正确,直接关系到科学探究是否符合客观事实。下图为实验室用等质量的高锰酸钾和 氯酸钾(另加少量的二氧化锰),分别制取氧气的数据 分析示意图。下列依据图示信息所得出的分析正确的是 () A、同时开始加热,先收集到氧气的是氯酸钾 B、用相同容积的试管制取较多量的氧气时,宜选择氯 酸钾为原料 C、加入少量的二氧化锰使氯酸钾产生的氧气质量增加 D、反应时间较长的是高锰酸钾 7、(2011年山东滨州,16题)下列图像能正确反映其对应操作中各量变化关系的是