
2008年第28卷有机化学V ol. 28, 2008第11期, 1849~1856 Chinese Journal of Organic Chemistry No. 11, 1849~1856
zhouzz@https://www.doczj.com/doc/e917025790.html,
*
E-mail:
Received November 27, 2007; revised March 31, 2008; accepted April 23, 2008.
1850
有 机 化 学 V ol. 28, 2008
Scheme 1
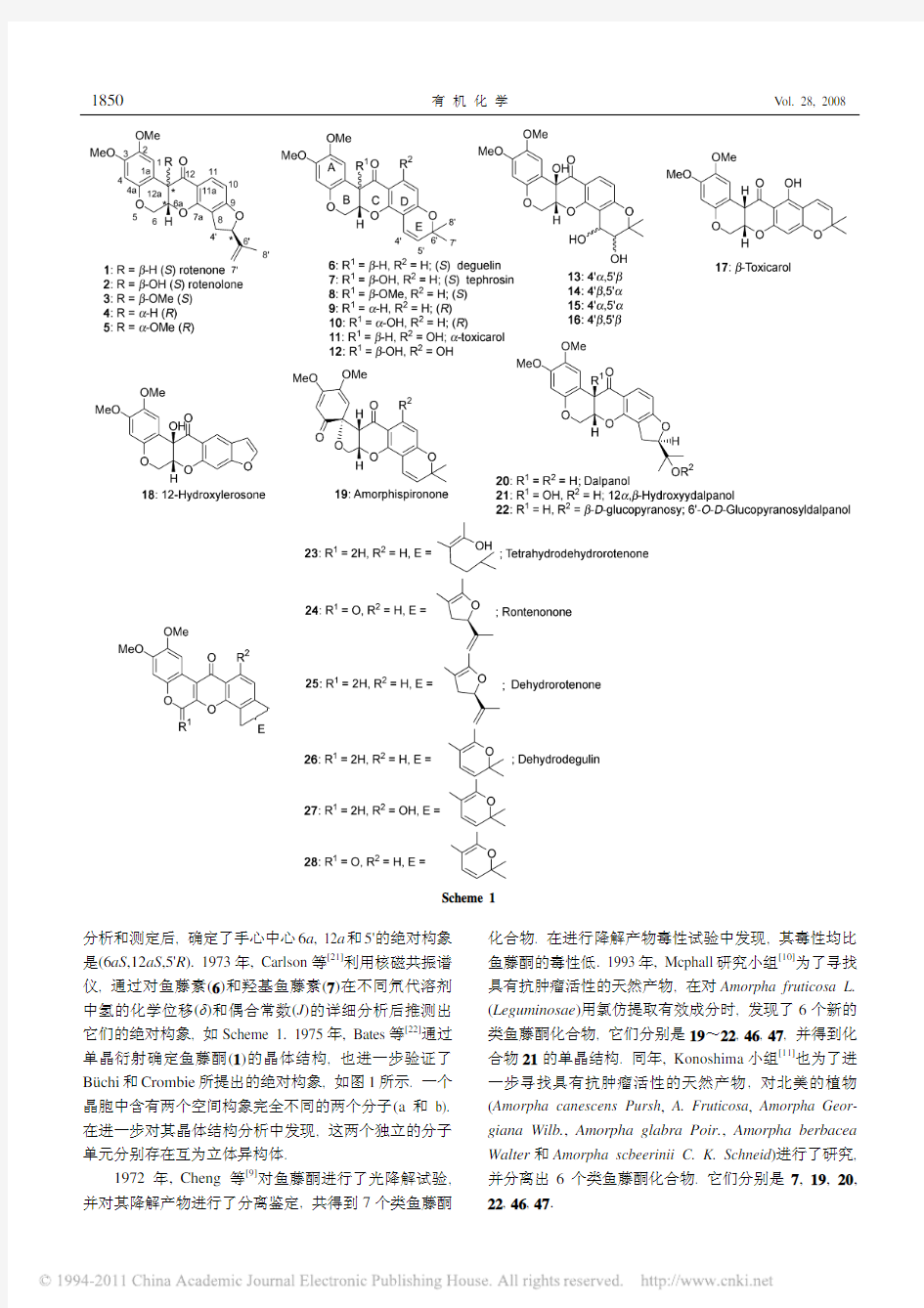
分析和测定后, 确定了手心中心6a , 12a 和5'的绝对构象是(6aS ,12aS ,5'R ). 1973年, Carlson 等[21]利用核磁共振谱仪, 通过对鱼藤素(6)和羟基鱼藤素(7)在不同氘代溶剂中氢的化学位移(δ)和偶合常数(J )的详细分析后推测出它们的绝对构象, 如Scheme 1. 1975年, Bates 等[22]通过单晶衍射确定鱼藤酮(1)的晶体结构, 也进一步验证了Büchi 和Crombie 所提出的绝对构象, 如图1所示. 一个晶胞中含有两个空间构象完全不同的两个分子(a 和b). 在进一步对其晶体结构分析中发现, 这两个独立的分子单元分别存在互为立体异构体.
1972年, Cheng 等[9]对鱼藤酮进行了光降解试验, 并对其降解产物进行了分离鉴定, 共得到7个类鱼藤酮化合物. 在进行降解产物毒性试验中发现, 其毒性均比鱼藤酮的毒性低. 1993年, Mcphall 研究小组[10]为了寻找具有抗肿瘤活性的天然产物, 在对Amorpha fruticosa L. (Leguminosae )用氯仿提取有效成分时, 发现了6个新的类鱼藤酮化合物, 它们分别是19~22, 46, 47, 并得到化合物21的单晶结构. 同年, Konoshima 小组[11]也为了进一步寻找具有抗肿瘤活性的天然产物, 对北美的植物(Amorpha canescens Pursh , A. Fruticosa , Amorpha Geor-giana Wilb., Amorpha glabra Poir., Amorpha berbacea Walter 和Amorpha scbeerinii C. K. Schneid )进行了研究, 并分离出6个类鱼藤酮化合物. 它们分别是7, 19, 20, 22, 46, 47.
No. 11
周中振等:鱼藤酮类衍生物的研究进展
1851
Scheme 2
图1 鱼藤酮(1)的晶体结构
Figure 1 The crystal structure of rotenone (1)
1997年, Casida 小组[12]在研究cubé resin 的有毒物质的成分时, 柱层析分离出5个类鱼藤酮化合物, 其中有2个是新的类鱼藤酮化合物(13-homo -13-oxa-6a ,12a - dehydrorotenoids) 29和30, 并得到化合物29的单晶结
构. 同年, Casida 小组[13]分析了从Lonchocarpus utilis 和urucu 的根部提取出来的cubé 树脂中的主要成分的含量, 发现树脂中主要由rotenone (1, 44.0%), deguelin (6, 22.0%), 12β-hydroxyrotenone (2, 6.7%) 和 12αβ-hydro-
1852有机化学V ol. 28, 2008
xydeguelin (7, 4.3%)组成.
1999年, Casida小组[14]接着对cubé树脂中的微量物质进行了分离并鉴定, 得到25个微量类鱼藤酮化合物. 其中, 13个是已知化合物, 另外12个是新化合物, 即化合物9, 10, 13~16, 23, 31, 33~36, 并得到了化合物13的晶体结构.
2 鱼藤酮的生物活性及其作用机制
鱼藤酮是高度脂溶性的化合物, 容易通过消化道和皮肤被吸收, 而且进入机体后容易穿透细胞膜, 与特定的细胞成分发生反应进而发挥它的效应. 因而, 鱼藤酮对害虫具有强烈的胃触杀毒作用, 其药理机制是抑制害虫的神经和肌肉组织中的细胞呼吸, 使害虫呼吸和心跳减弱、麻痹而死. 有研究表明, 鱼藤酮有着和类除虫菊酯相似的作用方式. 但是相对而言, 鱼藤酮具有更强活性和持久性[23]. 目前, 鱼藤酮对15个目, 137科的800多种害虫具有一定的防治效果, 作用谱广, 尤其对蚜螨类害虫效果突出. Nawrot等[24]在室内测定了鱼藤酮及其5种衍生物对谷象(Sitophilus granatius)和杂拟谷盗(Tribolium confusum)成虫以及杂拟谷盗和谷斑皮蠹(Trogoderma granarium)幼虫的拒食作用. 结果表明, 鱼藤酮对储粮害虫有一定的拒食活性. 当温度为26 ,℃相对湿度(RH)为64%时, 发现鱼藤酮对这3种害虫的拒食活性最高, 其类似物的拒食活性不如鱼藤酮本身, 但表现出一定的选择性. Bloszyk等[25]用6种拒食活性较高的化合物作为食品包装物, 以防治贮粮害虫谷蠹(Rhyzopertha dominica)和谷象的危害, 发现鱼藤酮对谷蠹的拒食活性比其它几种药剂都高.
现已证实, 鱼藤酮能与细胞内线粒体的线粒体复合物I (complex I, 如图2所示)即还原型烟酰胺腺嘌呤二核苷酸(NADH)脱氢酶结合并抑制其活性, 阻断细胞呼吸链的递氢功能和氧化磷酸化过程, 进而抑制细胞呼吸链对氧的利用, 造成内呼吸抑制性缺氧, 导致细胞窒息、死亡, 从而产生细胞毒作用[1,26~28]. 许多生物细胞中的线粒体、NADH脱氢酶、丁二酸、甘露醇以及其他物质对鱼藤酮都存在一定的敏感性. Setayria cervi线粒体中从NADPH到NADH这一过程的电子传递可被鱼藤酮高度抑制. 并且, 丝虫寄生物Setaria digitata线粒体颗粒中的反丁烯二酸还原酶系统的活性对鱼藤酮敏感. 鱼藤酮可抑制Trypanosoma brucei brucei线粒体内膜的电动势(EMT), 从而间接地影响NADH脱氢酶的活性;鱼藤酮还可抑制Trypanosoma brucei brucei线粒体呼吸链中的NADH到细胞色素C和NADH到辅酶Q还原酶的活性, 抑制率高达80%~90%[2]. Niehaus和Flynn[29]发现, 鱼藤酮可抑制Cryptococcusneoformans细胞中甘露醇的合成, 可能是影响了甘露醇合成酶的活性, 从而间接地对生物体产生影响.
此外, 鱼藤酮可抑制细胞中纺锤体微管的组装, 并在体外证明抑制微管的形成, Marshall推测鱼藤酮是以一种可逆的方式联接在微管蛋白上而抑制了微管的形成. 从遗传学的角度来看, 纺锤体形成受到抑制必然影响细胞的正常分裂, 从而可推论鱼藤酮可能通过这一途径影响虫体的生长. 此外, 鱼藤酮处理菜粉蝶幼虫会使虫体体壁蛋白质组成发生改变, 使总蛋白的量降低, 体壁蛋白的变化必定影响体壁结构. 莫美华和黄彰欣[30]进行了鱼藤酮及其混剂对蔬菜害虫的毒效研究. 鱼藤酮及其混剂均能抑制昆虫的呼吸作用, 它们还能破坏中肠和脂肪体细胞, 造成昆虫局部变黑; 严重地影响了中肠多功能氧化酶的活性, 使药剂不易被分解而有效地到达靶标器官, 从而使昆虫中毒致死. Zhong等[31]用鱼藤酮处理致倦库蚊后, 其中肠受到破坏. 鱼藤酮可影响昆虫体内ATP的产生, 由于ATP是昆虫生理活动的主要供能场所, 而在神经冲动传导过程中, Na+被离子泵喷出膜外和K+被吸入膜内的过程是耗能的, 如果ATP受到影响, 能量供应不上, 钠钾离子交换变慢, 从而恢复原来静止状态所需的时间延长, 膜内Na+、膜外K+浓度升高, 这就大大加强了拟除虫菊酯对Na+, K+电流的遏制作用, 使负后电位更加增大和延长. 另外, 鱼藤酮本身也能使细胞膜内Na+浓度上升, 这就更增强了负后电位
, 图2 NADH: 泛醌氧化还原酶(线粒体复合物I)在氧化磷酸化过程中的作用
Figure 2Role of NADH: ubiquinone oxidoreductase (complex I) on oxidative phosphorylation
No. 11
周中振等:鱼藤酮类衍生物的研究进展
1853
更容易使昆虫中毒.
鱼藤酮对NADH 的抑制是其产生细胞毒性过程的中心环节, 目前对其详细过程尚不十分清楚. 哺乳动物细胞的内呼吸是在线粒体内进行的, 线粒体呼吸链由脱氢酶、黄酶、复合物I 和细胞色素氧化酶共同组成. 复 合物I 包含有以核黄素单核苷酸(FMN)为辅基的黄素蛋白和以Fe-S 簇为辅基的铁硫蛋白. 在正常情况下, 复合物I 通过FMN 和Fe-S 簇中的Fe 原子将电子传给泛醌(ubiquinone), 即辅酶Q. 目前的研究表明, 鱼藤酮对复合物I 有较强的亲和力, 可选择性地阻断Fe-S 簇与辅酶Q 的作用, 从而终止线粒体呼吸链的正常运转, 使呼吸链不能将NADH 氧化为NAD; 此外, 当复合物I 功能受到抑制时, 还会使ATP 合成减少, 同时引发脂质过氧化和自由基的产生, 后者可进一步造成线粒体DNA 的突变和蛋白质的变性, 加重对细胞的损伤[1,32].
3 鱼藤酮类衍生物的合成
1958年, Miyano 等
[33,34]
以化合物49和50为原料,
通过缩合成环、还原和氧化后首次用有机合成的方法得到鱼藤酮(1)和类鱼藤酮(38), 如Scheme 3.
接着, Miyano 等[35,36]在此基础上对类鱼藤酮38 (dehydrorotnone)和49 (D ,L -nordihydrorotenone)进行了全合成, 如Scheme 4. 但是, Miyano 等[37]在对鱼藤酮进行全合成时, 他们发现, 当R 为CH 3C =CH 2的时候, 2,3-二氢-2-(异丙稀基)苯并呋喃-4-醇(60)并不能与化合物58直接得到中间体51, 如Scheme 5. 因而, 只有先合成中间体62, 然后再脱水得到中间体51. 所以, 中间体51的收率仅0.01%. 可想而知, 最终所得鱼藤酮的总产率极低.
1965年, Miyano [38]为了提高鱼藤酮的收率, 修改了合成路线, 如Scheme 6所示. 中间体63先与二环己基碳二亚胺(dicyclohexylcarbodiimide, DCC)反应得到中间体64, 中间体64继续和反应液中的化合物65反应一步得到25. 这样, dehydrorotenone (25)的收率提升至35.8%. 而且, 相对中间体51而言, 中间体65易得, 如
Scheme 7.
Scheme 3
Scheme 4
1854
有 机 化 学 V ol. 28, 2008
Scheme 5
Scheme 6
Scheme 7
1989年, Michael 等[39]对还原剂进行了改进, 用AlH(Bu-t )2替换NaBH 4, 这样可以得到单一构型的鱼藤酮(1), 如Eq. 1所示. 2003年, Pastine 和Sames [40]以3,4-二甲氧基苯酚为原料, 四步合成了鱼藤素, 总收率为68%. 至今为止, 这是合成类鱼藤酮化合物最简单有效的方法, 如Scheme 8.
1997年, Casida 小组[12]以鱼藤酮为原料合成了化合物29. 将鱼藤酮和乙酰氯加入无水DMF 中, 于60 ℃下通入纯氧气反应8 h, 柱层析分离即可得到化合物29,
如Scheme 9所示
.
2004年, Casida 研究小组[41]以鱼藤酮为原料合成deguelin (6), 如Scheme 10所示. 鱼藤酮(1)在三溴化硼的作用下开环生成化合物71, 然后在NaBH 3CN 的作用下脱去溴得化合物72, 接着关环生成deguelin (6).
No. 11
周中振等:鱼藤酮类衍生物的研究进展
1855
Scheme 8
Scheme 9
Scheme 10
4 结论与展望
从19世纪30年代确定鱼藤酮(1)的平面结构至今, 鱼藤酮研究者已经从豆类植物中分离鉴定出鱼藤酮类
衍生物47个. 其中, 部分鱼藤酮类衍生物对细胞内线粒体的线粒体复合物I (NADH)显示出良好的抑制活性. 鱼藤酮(1)的抑制活性最高, 其对NADH 的IC 50值为(4.4±1.4) nmol?L -
1. 而大多数鱼藤酮类化合物显示出
的抑制活性令人失望. 至今, 鱼藤酮类衍生物的生物合
成途径仍不是很清楚. 鱼藤酮类衍生物结构复杂, 从自然选择和生物进化的角度考虑, 其在生物体内的作用值得进一步研究. 而且, 鱼藤酮类衍生物的全合成仍是合成有机化学的一大挑战. 此外, Palazzino 等[42]发现鱼藤素(2)对TPA 诱导的鸟氨酸脱羧酶有抑制作用, 有望开发成抗癌制剂. 这表明, 鱼藤酮类衍生物不仅可以应用与农药, 还可以应用于医药. 因此, 应系统研究鱼藤酮类衍生物在抗肿瘤方面的活性.
References
1 (a) Hollingworth, R. M.; Ahammadsahib, K. I. Rev . Pestic .
Toxicol . 1995, 3, 277.
(b) Schuler, F.; Casida, J. E. Biochim . Biophys . Acta 2001, 79.
(c) Nicolaou, K. C.; Pfefferkorn, J. A.; Schuler, F.; Roecker, A. J.; Cao, G.-Q.; Casida, J. E. Chem . Biol . 2000, 7(12), 979.
2 LaForge, F. B.; Haller, H. L.; Smith, L. E. Chem. Rev. 1933,
12(2), 181.
3 Fukami, H.; Nakajima, M. In Naturally Occurring Insecti-cides , Eds.: Jacobson, M.; Crosby, D. G., Dekker, New York, 1971, p. 71.
4 Negherbon, W. O. Handbook of Toxicology , Vol. III, Saun-ders, Philadelphia, PA 1959, p. 661.
5 Tomlin, C. D. S. The Pesticide Manual , 11th ed., British
Crop Protection Council, Farnham, Surrey, UK, 1997, pp. 1097~1099.
6 Haller, H. L.; Goodhur, L. D.; Jones, H. A. Chem . Rev .
1941, 1, 33.
1856有机化学V ol. 28, 2008
7 Oberholzer, M. E.; Rall, G. J. H.; Rowx, D. G. J. Chem.
Soc., Perkin Trans. 11977, 423.
8 Norton, L. B.; Hansberry, R. J. Am. Chem. Soc. 1945, 67,
1609.
9 Cheng, H. M.; Yamamoto, I.; Casida, J. E. J. Agric. Food
Chem. 1972, 20(4), 850.
10 Li, L.; Wang, H. K.; Chen, J. J.; Mcphall, A. T.; Mcphall,
D. R.; Estes, J. R.; Lee, K. H. J. Nat. Prod. 1993, 56(5),
690.
11 Konoshima, T.; Terada, H.; Kokuma, M.; Kozuk, M.; To-
kuda, H.; Estes, J. R.; Li, L.; Wang, H. K.; Lee, K. H. J.
Nat. Prod. 1993, 56(5), 843.
12 Fang, N.; Casida, J. E. J. Org. Chem. 1997, 62, 350.
13 Fang, N.; Rowlands, J. C.; Casida, J. E. Chem. Res. Toxicol.
1997, 10, 853.
14 Fang, N.; Casida, J. E. J. Agric. Food Chem. 1999, 47,
2130.
15 Wright, G. M. A. J. Am. Chem. Soc. 1928, 50 (12); 3355.
16 Butenandt, A.; McCartney, W. Ann. 1932, 494, 17.
17 Laforg, F. B.; Haller, H. L. J. Am. Chem. Soc. 1932, 54, 810.
18 Takei, S.; Miyajima, S.; Ono, M., Ber. 1932, 65, 1041.
19 Büchi, G.; Crombie, L.; Godin, P. J.; Kaltenbronn, J. S.;
Siddalingalah, K. S.; Whiting, D. A. J. Chem. Soc. 1961, 2843.
20 Crombie, L.; Lown, J. W. J. Chem. Soc. 1962, 775.
21 Carlson, D. G.; Weisieder, D.; Tallent, W. Tetrahedron
1973, 29, 2731.
22 Arora, S. K.; Bates, R. B.; Grady, R. A.; Delfel N. E., J. Am.
Chem. Soc. 1975, 5752.
23 Crombie, L. Pestic. Sci. 1999, 55, 761. 24 Nawrot, J.; Harmatha, J.; Kostoval, I.; Ognyanov, I. Bio-
chem. Syst. Ecol. 1989, 17(1), 55.
25 Bloszyk, E.; Nawrot, J.; Harmatha, J.; Drozdz, B.;
Chmielewicz, Z. J. Appl. Entomol. 1990, 110(1), 96.
26 Grivennikova, V. G.; Kotlyar, A. B.; Karliner, J. S.; Cec-
chini, G.; Vinogradov, A. D. Biochemistry2007, 46, 10971.
27 Fang, J.; Beattie, D. S. Biochemistry 2002, 41, 3065.
28 Schuler, F.; Casida, J. E. Pest Manage. Sci. 2001, 57, 932.
29 Niehaus, W. G.; Flynn, T. J. Bacteriol. 1994, 176(3), 651.
30 Mo, M. H.; Huang, Z. X. J. South China Agric. 1994, 15(4),
58.
(莫美华, 黄彰欣, 华南农业大学学报, 1994, 15(4), 58.)
31 Zhong, Z. L.; Zhou G. L. Annu. Bull. Soc. Parasit. 1994, 18,
15.
32 Hollingworth, R. M.; Ahammadsahib, K. I.; Gadelhak, G.;
McLaughlin, J. L. Biochem. Soc. Trans. 1994, 22, 230.
33 Miyano, M.; Matsui, M. Agric. Biol. Chem. 1958, 22, 128.
34 Miyano, M.; Matsui, M. Chem. Ber. 1958, 91, 2044.
35 Miyano, M.; Matsui, M. Proc. Jpn Acad. 1959, 35, 175.
36 Miyano, M.; Matsui, M. Chem. Ber. 1959, 92, 2487.
37 Miyano, M.; Matsui, M. Agric. Biol. Chem. 1961, 22, 673.
38 Miyano, M. J. Am. Chem. Soc. 1965, 3958.
39 Michael, J. B.; Leslie, C. A.; Hamidbin, A. H.; Jonathan, L.
J. Chem. Soc., Perkin Trans. 11989, 204.
40 Pastine, S. J.; Sames, D. Org. Lett. 2003, 5(22), 4053.
41 Caboni, P.; Sherer, T. B.; Zhang, N.; Taylor, G.; Na, H. M.;
Greenamyre, J. T.; Casida, J. E. Chem. Res. Toxicol. 2004,
17(11), 1540.
42 Palazzino, G.; Rasoanaivo, P.; Federici, E.; Nicoletti, M.;
Galeffi, C. Phytochemistry2003, 63, 471.
(Y0711271 QIN, X. Q.; ZHAO, C. H.)
第一章、蛋白质的化学 肽键:一个氨基酸分子的α-羧基与另一个氨基酸分子的α-氨基经脱水缩合后形成的酰胺键。 氨基酸的等电点:在某一PH溶液中,氨基酸分子电离后带有相等正、负电荷时,此时溶液的PH值称为该氨基酸的等电点pI 结构域:指蛋白质多肽链在二级结构的基础上进一步卷曲折叠成几个相对独立的近似球形的组装体。 蛋白质复性:轻度变性的蛋白质在去除变性因素后,可恢复原有的构象和生物学活性。 Motif基序:基序又称超二级结构、模体或模序,是指在多肽内顺序上相邻的二级结构常常在空间折叠中靠近,彼此相互作用,形成有规律的、在空间上能辨认的二级结构聚集体。 蛋白质的分离方法:透析、沉淀(有机溶剂沉淀,盐析,免疫沉淀)、电泳、层析、超速离心。 第二章、核酸的结构与功能 简述Watson和Crick双螺旋结构特点。 (1)DNA分子由两条走向相反且平行的脱氧多核苷酸链共同围绕同一中心中心轴形成右手螺旋结构。 (2)磷酸与戊糖相间排列形成螺旋的骨架居于外侧,碱基位于螺旋的内侧。 (3)两条链上的碱基严格按照碱基互补配对的原则进行配对,即A =T,G=C,配对的碱基处于同一平面,相邻的两个碱基平面距离为
0.34nm,螺旋一周包含10个碱基对,螺旋直径为两2nm,角度为36°。(4)氢键维持双螺旋的横向稳定,碱基堆积力维持双螺旋的纵向稳定。 (5)双螺旋结构上有两条螺旋凹沟,一条较深称为深沟(大沟),一条较浅称为浅沟。 tRNA二级结构有何特点。 (1)tRNA是分子最小,但含有稀有碱基最多的RNA,其稀有碱基的含量可多达20%。 (2)tRNA是单店核算,但其实分子中的某些局部也可形成双螺旋结构,形成茎环结构。 (3)tRNA的结构上有一反密码环,中间有一反密码子能与密码子配对。 (4)tRNA的3'末端有一柄部结构—CCA-OH,可携带氨基酸。 简述三种RNA的功能。 (1)mRNA的功能是作为指导蛋白质合成的模板。 (2)tRNA的功能是在蛋白质合成中起搬运氨基酸作用。 (3)rRNA的作用是蛋白质的合成提供场所。 真核生物mRNA与原核生物mRNA在结构上有何区别。 (1)真核生物mRNA的3'-末端有一个多聚腺苷酸尾,称poly(A)n 尾巴,原核生物没有 (2)真核生物mRNA的5'-端有帽子结构m7GpppN,原核生物没有(3)真核生物mRNA分子中有编码区和非编码区,原核生物没有
课程论文 课程名称:植物化学保护 题目:浅谈中国植物性农药的现状和进展学院:植物保护学院 专业:植物保护 姓名:张艳荣 学号:13044010 完成日期:2012 年06 月29 日
浅谈我国植物性农药的现状和进展 摘要:植物性农药是指利用植物所含的稳定的有效成分,按一定的方法对受体植物进行使用后,使其免遭或减轻病、虫、杂草等有害生物为害的植物源制剂。各种植物性农药通常不是单一的一种化合物,而是植物有机体的全部或一部分有机物质,成分复杂多变,但一般都包含在生物碱、糖苷、有毒蛋白质、挥发性香精油、单宁、树脂、有机酸、酯、酮、萜等各类物质中。由于植物性农药物质性质的特殊性,有害生物难以对其产生抗药性。另外,植物性农药对受体植物相对于化学农药来说更不容易造成药害,而且也容易与环境中其他生物相协调。植物性农药是非人工化学结构的天然化学物质,一般在自然界有天然的微生物类群对其进行自然分解,在保护生态平衡方面大大优于化学农药,特别是在无公害农产品的生产和保证农业的可持续发展中扮演着重要角色。本文综述了我国植物性农药的现状和研究进展,同时介绍几种应用前景比较好的植物性农药 关键字:植物性农药;合成化合物;杀虫植物 1植物性农药研究发展概况 1.1植物性农药的发展历史 植物性农药的发展具有悠久的历史,我国古代早就用菊科艾属的艾蒿茎、叶熏蚊蝇,一直流传至今。公元前7-5世纪的古籍中已有用嘉草、莽草、枚菊杀虫的记述。在《齐民要术》、《本草纲目》中都不乏用植物性农药杀虫、防病的记载。17世纪后,世界各地陆续发现了一些杀虫力较强的药用农药,其中最著名的是烟草、鱼藤、除虫菊。在长期的实践中,人们早已发现楝科植物中的印楝、苦楝、川楝等具有抑制昆虫取食和生长发育的活性,人们还先后发现卫茅科雷公藤,豆科槐属的苦参、大戟科的乌柏、茄科茄属的龙葵等植物均具有杀虫活性。 1.2植物性农药的发展现状 目前,对植物性农药的研究面窄、深度不够,缺少系统的、成熟的理论指导。在研究内容方面,作为杀虫剂研究的较多,杀菌剂则较少,而植物生长调节剂和除草剂研究的更少。基本研究模式是发现有某种生理活性的植物后,先分离出活性有效成分,确定化学结构,再以活性化合物结构作为靶标,合成该化合物,开发农药品种。如以除虫菊和毒扁豆碱为先导,开发出的拟除虫菊酯类和氨基甲酸酯类系列农药,但通过仿生合成的这些农药,实际则属于化学合成农药。植物性农药的应用现状则是发现有生物活性的植物不少,但以植物为原料开发应用的却不多。现在农药的主导仍然是化学合成农药,生物农药只占整个农药的2%~3%,而植物性农药所占的比重更小。植物性农药的发展现状与其悠久的发展历史与自然界丰富的植物资源的存在显然是不相称的。
第23卷第2期西 南 农 业 大 学 学 报V ol.23,N o.2 2001年4月Journal of S outhwest Agricultural University Apr.2001 文章编号:1000-2642(2001)02-0140-04 鱼藤酮的研究进展 ① 徐汉虹,黄继光 (华南农业大学昆虫毒理研究室,广东广州 510642) 摘要:鱼藤酮是一种广谱性杀虫剂,对害虫高效且不易产生抗药性。该文对鱼藤酮的生物活性、作用机理以及组织培养技术在鱼藤酮类似物中的应用几个方面进行了比较详细的论述。关 键 词:鱼藤酮;研究进展 中图分类号:S 482.3+9 文献标识码:A ADVANCES I N THE RESE ARCH OF ROTE NONE XU H an -hong ,HUANG Ji -gu ang (Laboratory of Insect T oxicology ,S outh China Agricultural University ,G uangzhou ,G uangdong 510642,China )Abstract :A detailed review is presented in this paper of the advances in the research of the bioactivity ,pest -controlling mechanisms and tissue culture techniques of rotenone ,a broad -spectrum insecticide ,and its analogs.K ey w ords :rotenone ;advance in research 鱼藤酮是早期人们从鱼藤属等植物中提取分离出来的一种有杀虫活性的物质,是3大传统植物性杀 虫剂之一。它主要存在于豆科植物中,特别是在鱼藤属和灰叶属等植物中,且研究比较深入。其结构式如下: 鱼藤酮的作用方式较多。它对菜粉蝶幼虫等昆虫有强烈的触杀作用和胃毒作用,对日本甲虫有拒食作用,对某些鳞翅目害虫有生长发育抑制作用[1,2],鱼藤提取物能抑制某些病菌孢子的萌发和生长,或阻 止病菌侵入植株。 1 鱼藤酮的生物活性 鱼藤对15个目,137科的800多种害虫具有一定的防治效果,作用谱广,尤其对蚜螨类害虫效果突出。Nawrot 等[3]在室内测定了鱼藤酮及其5种衍生物对谷象(Sitophilus granatius )和杂拟谷盗(Tribolium con 2f usum )成虫以及杂拟谷盗和谷斑皮蠹(Trogoderma granarium )幼虫的拒食作用。结果表明,鱼藤酮对储 粮害虫有一定的拒食活性。当温度为26℃,相对湿度(RH )为64%时,发现鱼藤酮对这3种害虫的拒食活性最高,其类似物的拒食活性不如鱼藤酮本身,但表现出一定的选择性。Bloszyk 等[4]用6种拒食活性较高的化合物作为食品包装物,以防治贮粮害虫谷蠹(Rhyzopertha dominica )和谷象的危害,发现鱼藤酮对谷蠹的拒食活性比其他几种药剂都高。 斯里兰卡有一传统的植物药物“Pilamul ”,就是 ①收稿日期:2000-09-04 基金项目:中华农业科教基金(人才基金)和广东省自然科学基金(930841)资助项目 作者简介:徐汉虹(1961-),男,湖北仙桃人,华南农业大学教授,主要从事植物性杀虫剂和农药学研究。
鱼藤酮的应用现状及存在问题 姓名:郝瑶学号:20110801111 班级:11生工1班 摘要鱼藤酮是一种广谱性杀虫剂,对害虫高效且不易产生抗药性。它是一种天然的植物质杀虫剂和杀螨剂,为无公害农产品生产推荐使用品种,具有广阔的应用前景。该文简要介绍了鱼藤酮的产品及应用范围、鱼藤酮的应用开发现状以及应用过程中出现的问题和解决方法,并对今后进一步开发应用鱼藤酮提出建议。 关键词鱼藤酮;杀虫剂;应用现状;存在问题;综述 鱼藤酮 (rotenone) 具有触杀、胃毒、拒食和熏蒸作用,杀虫谱广,对果树、蔬菜、茶叶、花卉及粮食作物上的数百种害虫有良好的防治效果[1] ,对哺乳动物低毒,对害虫天敌和农作物安全,是害虫综合治理上较为理想的杀虫剂,被广泛应用于蔬菜、果树等农作物和园林害虫的防治。为了顺应绿色食品发展的要求,近年来我国鱼藤酮产品的发展十分迅速。本文就鱼藤酮的产品、应用开发现状及在应用过程中出现的一系列问题进行了综述。 1 鱼藤酮的产品及应用范围 近年来,鱼藤酮的产品的使用呈逐年递增的趋势,从1 9 9 1 年广东省广州农药厂从化市分厂登记第一个鱼藤酮产品到现在,共有11 家企业登记鱼藤酮产品18 个厂次,其中原药2 个,单剂4 个,复配制剂12 个。这些产品中,2.5%、7.5% 鱼藤酮乳油,3.5% 高渗鱼藤酮乳油,5% 除虫菊素·鱼藤乳油( 除虫菊素+ 鱼藤酮) 、18%辛·鱼藤乳油(辛硫磷+鱼藤酮)和 1.3%氰·鱼藤乳油 (氰戊菊酯+ 鱼藤酮) 用于防治十字花科蔬菜和番茄上的蚜虫;0.2% 苦参碱水剂+1.8% 鱼藤酮乳油桶混剂,25% 敌·鱼藤乳油 (敌百虫+ 鱼藤酮)、1.3% 氰·鱼藤乳油 (氰戊菊酯+ 鱼藤酮) 和2.5% 氰·鱼藤乳油 (氰戊菊酯+ 鱼藤酮) 用于防治菜青虫(Pieris rapae),7.5%氰·鱼藤乳油 (氰戊菊酯+ 鱼藤酮) 和1.8% 阿维·鱼藤乳油 (阿维菌素+鱼藤酮) 用于防治小菜蛾 (Plutella xylostella),25% 水胺·鱼藤乳油(水胺硫磷+ 鱼藤酮) 用于防治柑橘上的矢尖蚧 (Prontaspisyanonensis),21%辛·鱼藤乳油 (辛硫磷+鱼藤酮) 防治棉花上的棉铃虫 (Heliothiszea ) 。[2]这些产品主要以鱼藤为材料,其中大部分是复配产品,防治面积达几千万公顷。经研究表明鱼藤酮与其他化学或生物农药混配[ 3 - 4 ]高效、低毒,可以有效地延缓害虫的抗药性,减少环境污染,还能刺激植物生长,对天敌无杀伤作用,有利于促进生态平衡。 2 鱼藤酮的作用机制 早期的研究表明鱼藤酮的作用机制主要是影响昆虫的呼吸作用,主要是与NADH脱氢酶与辅酶Q之间的某一成分发生作用。鱼藤酮使害虫细胞的电子传递链受到抑制,从而降低生物体内的ATP水平,最终使害虫得不到能量供应,然后行动迟滞、麻痹而缓慢死亡。许多生物细胞中的线粒体、NADH脱氢酶、丁二酸、甘露醇以及其他物质对鱼藤酮都存在一定的敏感性。Setayria cervi线粒体中从NADPH到NADH这一过程的电子传递可被鱼藤酮高度抑制。并且,丝虫寄生物Setaria digitata线粒体颗粒中的反丁烯二酸还原酶系统的活性对鱼藤酮敏感。鱼藤酮和水杨氧肟酸可抑制Trypanosoma brucei brucei线粒体内膜的电动势(EMT),从而间
目录 摘要 (1) 关键词 (1) 1 前言 (1) 2 应用开发现状 (1) 2.1 资源 (1) 2.2 化学成分 (1) 2.2.1 酚性类成分 (2) 2.2.2 萜类化合物 (2) 2.3 检测现状 (2) 3 杀虫机理 (2) 3.1 毒理学性质 (2) 3.2 致死过程 (3) 3.3 导致细胞凋亡 (4) 4 对人体的潜在危害 (4) 4.1 对人有致死性 (4) 4. 2 造成环境污染 (4) 4.3 对健康的危害 (4) 参考文献: (5)
论述鱼藤酮的杀虫机理 XXX 摘要:鱼藤酮是一种毒性极强的杀虫剂,本文论述了鱼藤酮的发展状况,分析了其化学成分,主要论述了其杀虫机理,也辩证的讨论了鱼藤酮对人类的潜在危害。 关键词:鱼藤酮杀虫机理农药 1 前言 鱼藤酮目前是一种比较完善的植物源生物杀虫剂,具有对害虫的广谱作用大,对天敌干扰少,在环境中易于降解,资源丰富等特点。且可防治的有害生物种类多[1]。对果树、蔬菜、茶叶、花卉及粮食作物上的数百种害虫有良好的防治效果,对哺乳动物低毒,对害虫天敌和农作物安全,是害虫综合治理上较为理想的杀虫剂,被广泛应用于蔬菜、果树等农作物和园林害虫的防治。其市场发展空间极其广阔,为了顺应绿色食品发展的要求,近年来我国鱼藤酮产品的发展十分迅速[2]。目前市场中销售制剂中大多是乳油,也有少数是可湿性粉剂。本文就鱼藤酮的应用开发现状进行了论述,主要论述了鱼藤酮的毒理学性质,以及在及在长期的应用过程中对人和生态系统的潜在危害。 2 应用开发现状 2.1 资源 鱼藤酮的资源十分丰富,目前发现的总共有68种豆科植物含有鱼藤酮,主要分布于鱼藤属、尖荚豆属和灰叶属植物中。生长于东南亚各国的豆科鱼藤属植物毛鱼藤,毛鱼藤的根、茎中的鱼藤酮含量都很丰富。是目前我国鱼藤酮相关产业的主要原料。此外,生长于非洲的山毛豆是鱼藤酮的一种新资源。其植株的叶片、豆荚、根、种子、茎秆等多个部位都含有活性成分,是豆科植物中一种优秀的杀虫植物,对很多害虫具有生物活性。对这种植物有许多地方进行了栽培,比较成功的有秘鲁尖荚豆属植物基地,是目前世界上面积最大的[3]。 2.2 化学成分 据很多国内外的文献报道,鱼藤酮的化学成分主要以黄酮、异黄酮,鱼藤酮为主,还有萜类,单苯环类和脂肪族类化合物。
鱼藤酮杀虫活性及其应用研究 摘要:鱼藤酮是一种广谱性杀虫剂,对害虫高效且不易产生抗药性。本文对鱼藤酮的来源分布、杀虫活性及其在防治害虫的应用现状、存在问题和展望等几个方面进行了比较详细的论述。 关键字:鱼藤酮;杀虫活性;应用研究 Abstract:Is a broad spectrum insecticide rotenone,resistance to pests is efficientand easy.This paper on the distribution of sources of rotenone,insecticidal activity and its application in pest status,problems and prospects,and other aspects are discussed in detail. Key words:rotenone;insecticidal activity;applied research 前言 鱼藤酮主要来源于豆科的鱼藤属、灰毛豆属、合生果属、鸡血藤属、紫槐属、黄檀属、毒鱼豆属和蝶豆属等植物,迄今已发现的鱼藤酮类化合物在74种以上[1]-[3]。鱼藤酮是一种抑制神经组织和肌肉组织的选择性植物源杀虫剂,具有广谱的杀虫活性、良好的生态效益,并在自然界大量存在,而被广泛应用于蔬菜、果树等农作物害虫的防治[4]。 1 鱼藤酮的来源与分布 鱼藤,别名毒鱼藤。为豆科鱼藤属(Derris Lour.)豆科蝶形花亚科多年生木质藤本植物,产于亚洲热带和亚热带地区,如东印度半岛,菲律宾群岛,马来半岛等地。我国有20多种,产于西南部经中部至东南部。它是我国三大传统杀虫植物之一,其根部含有鱼藤酮,是主要的杀虫成分[5]。 2 鱼藤酮的产品和应用范围 近年来,鱼藤酮的产品的使用呈逐年递增的趋势,从1991年广东省广州农药厂从化市分厂登记第一个鱼藤酮产品到现在,共有11家企业登记鱼藤酮产品18个厂次,其中原药2个,单剂4个,复配制剂12个。这些产品中,7.5%氰·鱼藤乳油(氰戊菊酯+鱼藤酮)和1.8%阿维·鱼藤乳油(阿维菌素+鱼藤酮)用于防治小菜蛾(Plutella xylostella),25%水胺·鱼藤乳油(水胺硫磷+鱼藤酮)用于防治柑橘上的矢尖蚧(Prontaspis yanonensis),21%辛·鱼藤乳油(辛硫酸+鱼藤酮)防治棉花上的棉铃虫(Heliothiszea)。这些产品主要以鱼藤为材料,其中大部分是复配产品,防治面积达几千公顷[6]。经研究表明鱼藤酮与其他化学或生物农药混配[7]-[9]高效、低毒,可以有效地延缓害虫的抗药性,减少环境污染,还能刺激
植物化学保护题库 绪论 一、名词解释 植物化学保护学、IPM、持久性有机污染物(POPs)、事先知情同意程序(prior informed consent procedure)二、简答题: 简述农药的发展史 三、论述题 试述化学防治的利与弊及如何认识农药的一些弊病。 第一章植物化学保护基本概念 内容提要 1.农药、毒力、药效、毒性的概念。 2.农药按原料的来源及成分分类、按用途分类、按作用方式分类。 3.农药的毒力、药效、毒性。影响药害的农药因素、植物因素、环境因素。 4.农药中毒的急救办法。 同步练习题 一、单项选择题 1. 下列哪种农药属于无机农药()。 A 乐果 B 氯菊酯 C 硫磺 D 西维因 2. 下列哪种农药属于有机农药()。 A 石灰 B 波尔多液 C 磷化铝 D 敌敌畏 3. 杀虫剂、杀菌剂和除草剂按照()来分类。 A 原料的来源 B 成分 C 用途 D 机理 4. 下列哪种不属于植物性农药()。 A 除虫菊素 B 烟草 C 鱼藤酮 D 苏云金杆菌 5. 下列哪种农药属于杀虫剂()。 A 乐果 B 大隆 C 百菌清 D 2.4-滴 6. 下列哪种农药属于除草剂()。 A 草甘膦 B 功夫 C 硫磺 D 克百威 7. 下列哪种农药属于杀菌剂()。 A 敌敌畏 B 功夫 C 代森锰锌 D 呋喃丹 8. 低毒农药的LD50值()mg/ml。 A 小于50 B大于50 C小于500 D大于500 9. 下列哪类农药属于负温度系数的农药()。 A 有机磷 B 氨基甲酸酯 C 拟除虫菊酯 D 苯氧羧酸 10. 害虫()对农药敏感。 A 卵期 B 幼虫期 C 蛹期 D 成虫期 11. 慢性毒性的测定方法为() A.大白鼠口服LD50 B. 三致试验 C. Ames试验 D. 迟发性神经毒性试验 二、判断题(正确打“√”,错误打“×”) 1. 防治刺吸式口器的害虫使用胃毒剂效果好()。 2. 防治咀嚼式口器的害虫使用内吸剂效果好()。 3. 高温天气使用农药容易产生药害()。 4. 天敌生物、转基因生物属于农药管理的范畴()。 5. 调节植物、昆虫生长的物质属于农药,性引诱剂则不属于农药()。 6. 安全性指数K值越大,说明农药对作物越安全()。 7. LD50值越大,农药毒性越低()。 8. 施用农药24小时内下雨需要重新补喷。() 9. 内吸性药剂是指有害生物体吸收农药导致死亡的药剂。()
文章编号:1001-411X (2001)03-0023-03 鱼藤酮的晶体结构 杨仕平1,2,黄继光1,梁炳泉2,徐汉虹1 (1华南农业大学昆虫毒理教研室,广东广州510642;2南海里水科派企业有限公司,广东南海528244) 摘要:描述了鱼藤酮(C 3H 22O 6)的晶体结构,它属于正交晶系,P 212121空间群,a =018418(1),b =119869(3),c = 213618(4)nm ,V =31950(1)nm 3,Z =81在固态下,发现其以2种立体异构体的形式存在1 关键词:提取,晶体结构,鱼藤酮,生物农药中图分类号:S48213 文献标识码:A 鱼藤酮是从鱼藤属等植物中提取分离出的杀虫 活性物质,是三大传统植物性杀虫剂(鱼藤、除虫菊和烟草) 之一[1]1其化学结构简式如下: 已经查明,它是一种呼吸代谢抑制剂,抑制还原 型辅酶I (NADH )脱氢酶(NAD +,辅酶I )~辅酶Q 之间的过程,影响昆虫利用氧气的能力,造成昆虫体内C O 2的积累[2]1关于鱼藤酮和拟鱼藤酮的工作,主要讨论的是杀虫效能(鱼藤植物的直接提取物或提纯品)和作用机理,涉及鱼藤酮结构的研究很少报道[1,2]1最近笔者在研究怎样提高鱼藤酮的提取率时,测得了它的晶体结构,现报道如下1 1 实验部分 111 晶体培养 取鱼藤根若干,用溶剂萃取得鱼藤酮粉末1取其中鱼藤酮粉末2g ,加入到50m L φ为95%的乙醇溶剂中搅拌30min ,过滤,滤液放入盛有硅胶的干燥器中,7d 后析出适合于X 2ray 的无色晶体1其组成为C 23H 22O 61元素分析(w /%,括号里为理论值):C ,70103(70105);H ,5160(5158)1MS (FAB ):m/z 394(100%,C 23H 22O 6)1112 晶体结构的测定 X 射线数据采用Bruker Smart 1000CC DC 衍射仪 测定,用MoK α辐射(λ=01071nm ),ω扫描方式收集数据,并进行Lp 因子校正和半经验吸收校正1先用重原子法或直接法确定金属原子位置及部分其他非氢原子,然后用差值函数法和最小二乘法求出其余全部非氢原子坐标,并用理论加氢法得到氢原子位置或从差值傅立叶图上找到1用全矩阵最小二乘法基于F 2对结构进行修正1计算工作在PC -586微机上用SHE LXS -97和SHE LX L -97程序完成1其晶体结构参数见表11 表1 鱼藤酮的晶体结构参数 T ab 11 Crystal d ata and structure refinement for rotenone 分子式em pirical formula C 23H 22O 6μ/mm -101096分子量formula weight 394141F (000) 1664 晶系crystal system 正交晶系orthorhombic 晶体大小crystal size/mm 0123×01 13×0110空间群space group P 212121 θ/(° )2101~2417晶胞大小unit cell dimensions 总反射点reflections collected 12061a /nm 018418(1)独立反射点independent reflections 5967b /nm 119869(3)数据data /限制restraints/参数parameters 5976/0/524c /nm 213618(4)g oodness -of -fit on F 2010901 V /nm 3 31950(1)final R 1[I >2σ(I )]R 1=010485,wR 2=011250Z 8R 2(all data ) R 1=010974,wR 2=011500 ρ/g ?cm -311326 最大不同峰值和剩余电子larg 1diff 1peak and h ole (e nm -3) 385,-304 收稿日期:2000-12-26 作者简介:杨仕平(1969-),男,博士1 基金项目:中国博士后科学基金资助项目(中博基[2000]31) 第22卷第3期 2001年7月 华南农业大学学报 Journal of S outh China Agricultural University V ol.22,N o.3 Jul.2001
天然药化 1.pH梯度萃取法:是指在分离过程中,逐渐改变溶剂的pH酸碱度来萃取有效成分或去除杂质的方法。 2.有效成分:存在于生物体中,具有一定生物活性,具有防病治病作用,可以用分子式和结构式表示,并具有一定物理常数的单体化合物。 3.盐析法:在水提取液中加入无机盐(如氯化钠)达到一定浓度时,使水溶性较小的成分沉淀析出,而与水溶性较大的成分分离的方法。 5.渗漉法:将药材粗粉用适当溶剂湿润膨胀后(多用乙醇),装入渗漉筒中从上边添加溶剂,从下口收集流出液的方法。 6.原生苷:植物体内原存形式的苷。 次生苷:是原生苷经过水解去掉部分糖生成的苷。 7.酶解:苷类物质在酶催化下水解生成次生苷的一种水解方法。 8.苷类:又称配糖体,是糖和糖的衍生物与另一非糖物质通过糖的端基碳原子连接而成的化合物。 9.苷化位移:糖苷化后,端基碳和苷元α-C化学位移值均向低场移动,而邻碳稍向高场移动(偶而也有向低场移动的),对其余碳的影响不大,这种苷化前后的化学变化,称苷化位移。 10.香豆素:为顺式邻羟基桂皮酸的内酯,具有苯骈α-吡喃酮基本结构的化合物。 11.木脂素:由二分子的苯丙素氧化缩合而成的一类化合物,广泛存在于植物的木部和树脂中,故名木脂素。 12.醌类:指具有醌式结构的一系列化合物,包括邻醌、对醌。常见有苯醌、萘醌、蒽醌、菲醌。 13.大黄素型蒽醌:指羟基分布于两侧苯环的蒽醌。 14.黄酮类化合物:指两个苯环(A环和B环)通过中间三碳链相互联结而成的(6C-3C-6C)一系列化合物。 15.碱提取酸沉淀法:利用某些具有一定酸性的亲脂性成分,在碱液中能够溶解,加酸后又沉淀析出的性质,进行此类成分的提取和分离。 16.萜类化合物:是一类结构多变,数量很大,生物活性广泛的一大类重要的天然药物化学成份。其骨架一般以五个碳为基本单位,可以看作是异戊二烯的聚合物及其含氧衍生物。但从生源的观点看,甲戊二羟酸才是萜类化合物真正的基本单元。 19.SF/SFE:超临界流体(SF):处于临界度(Tc),临界压力(Pc)以上的流体。超临界流体萃取(SFE):利用一种物质在超临界区域形成的流体进行提取的方法称为超临界流体萃取。25.三萜皂苷是由三萜皂苷元和糖组成的。三萜皂苷元是三萜类衍生物,由30个碳原子组成。 26.甾体皂苷:是一类由螺甾烷类化合物衍生的寡糖苷。 27.次皂苷:皂苷糖链部分水解产物或双糖链皂苷水解成单糖链皂苷均称为次皂苷。28.中性皂苷:分子中无羧基的皂苷,常指甾体皂苷。 31.强心苷:是生物界中一类对心脏具有显著生物活性的甾体苷类化合物。 32.甲型强心苷元(强心甾烯):C17位连接的是五元不饱和内酯(△α、β-γ-内酯)环称为强心甾烯,即甲型强心苷元。由23个碳原子组成。 33.乙型强心苷元(海葱甾烯或蟾酥甾烯):C17位连接的是六元不饱和内酯(△α(β),γ(δ)-δ-内酯)环称为海葱甾烯或蟾酥甾烯。由24个碳原子组成。
鱼藤产品清塘说明 含有主要杀虫活性物质为鱼藤酮及其类似物。鱼藤酮主要存在于根部,具有广谱性杀虫效果,可防治800多种害虫,是三大传统杀虫植物之一,对害虫起触杀作用与胃毒作用。它进入虫体后干扰细胞的生长发育,使之呼吸减弱,害虫得不到能量供应,行动迟滞死亡。鱼藤酮在空气中容易氧化,对环境无污染,对人、畜安全,对农作物无药害,是一种理想的安全植物杀虫剂,是适于在蔬菜、水果、茶叶、花卉上使用的无公害农药。 鱼藤酮剂的制备物 鱼藤精将鱼藤晒干碾成粉末,用苯或三氯乙烯等有机溶剂,在50℃条件下浸提32小时,过滤去渣,在减压下蒸发浓缩,取底部鱼藤树脂,溶于樟脑油或苯中,加入乳化剂,稍加热至70℃,搅拌均匀即成透明液体鱼藤精。 鱼藤粉将鱼藤根切成薄片,干燥后粉碎成细末,过50目筛即成。 鱼藤乳剂用136.5升经乳化的石油,含6%鱼藤酮的根粉13.6公斤,倒入石油中搅匀,置于荫蔽处2至3天后使用。 鱼藤水剂 鱼藤根500克,清水5至6公斤,浸泡24小时,搓揉2至3次,过滤即成乳白色浸出渣,为鱼藤酮水剂。
鱼藤制剂防治害虫使用方法 1.用鱼藤根粉500克,加草木灰2.5至5公斤,混合均匀撒施,可防治黄条跳甲等害虫。 2.用0.5%至1%鱼藤乳剂喷洒,可防治柑橘蚜虫、粉虱、红蜘蛛等。 3.鱼藤粉500克放布袋内,加水150至300公斤进行搓揉,然后将袋内药粉倒入水中,加0.3%肥皂液,拌匀成悬浮液喷洒,防治柑橘、桃、蔬菜、桑树等的蚜虫、菜青虫、毛虫、红蜘蛛等。 4.1.5%鱼藤乳剂加水400至500倍喷雾,防治柑橘红蜘蛛、菜青虫、黄条跳甲、二十八星瓢虫等。 5.4%鱼藤粉500克,拌细掺土3至3.5公斤,在早晨露水未干时撒施或直接喷粉,可防治多种作物蚜虫。 6.用鱼藤水剂1.5至2公斤,加水50公斤及0.2%的洗衣粉液适量喷洒,防治柑橘红蜘蛛等。 7.鱼藤酮可与除虫菊酯、植物杀虫剂、矿物质杀虫剂、微生物农药等混合使用,可提高防效,减少药量,节省成本,兼治多种害虫,扩大防治范围,减少害虫抗药性。
广谱植物杀虫药鱼藤 豆科鱼藤属中的一种,学名Derris ellipitica Benth.,常绿藤本植物。野生分布于亚洲的热带地区。热带各地作为杀虫剂原料作物栽培。 鱼藤根中含有杀虫功能的主要成分为鱼藤酮,还有鱼藤毒、灰毛豆精和毒灰叶酚等。鱼藤可制成的粉剂、乳剂,可与硫磺合剂、除虫菊乳剂等混合作用,对昆虫主要起触杀剂作用,也有胃毒剂和忌避剂的效果,它的毒力主要是麻痹昆虫的呼吸中枢和血管运动神经中枢,对蚜虫、鳞翅目幼虫、甲虫的幼虫、狗蚤、牛蝇等都有疗效,并可以用于治疗人体疥癣。 鱼藤酮清塘 一、鱼、虾放养前要搞好清塘除害工作清塘除害是指清除养殖池中一切不利于鱼、虾生长和生存的因素。养鱼、虾池中大量的有机物、杂藻和小草、杂鱼及敌害鱼类都不同程度地影响鱼、虾的生长和生存,因此放养鱼、虾前必须严格的做好清塘处理工作。 二、杀除敌害。虾池中的敌害动物主要指猛鱼类及与虾争食的动物。如鲈、矛尾复虾虎鱼、黄姑鱼、蛹、鲷类、圆屯、四指发、鳗、弹深鱼、海蛇、寻类梭子蟹等都是对虾的天敌,它们能大量的捕食对虾。争食生物主要有梭鱼、鲻鱼、斑祭、鲻虾虎钱、吻虾虎鱼、弹深鱼等,它们与虾争夺空间,争夺食物。这些敌害生物主要是防止其幼体进入养殖池,所以在放苗前必须进行药物清理。
三、鱼藤酮清塘:豆科植物鱼藤根中的鱼藤酮对鱼有较强的杀伤力,而对虾类及虾的饵料生物毒性较低。经动物实验表明: 鱼藤酮能清除鱼塘杂鱼、虫害、杀菌作用效果明显。因此,适用于养虾池的清池除害。 四、清塘方法:鱼藤酮乳油。 如每亩塘水深1米,用2.5%鱼藤酮乳油,用药量1300毫升;用7.5%鱼藤酮乳油,用药量700毫升;用时将乳油加水10-15倍,装入喷雾器中全池喷洒,15天后可进行放养。 五、鱼藤使用注意事项 1.不能与碱性药物(如石灰、漂白粉等)混用; 2.不可用热水浸泡鱼藤精,药液要随配随用,防止久放失效。 3. 本品要密封,贮于阴凉干燥处,严格避光保存。 健康危害 1、不可口服!经口误服会中毒! 2、对眼睛、皮肤有刺激作用。 3、皮肤污染局部用肥皂水和清水冲洗,眼部污染用2%碳酸氢钠液冲洗。
1.糖酵解:是指在缺氧情况下葡萄糖分解成乳酸的过程。生理意义迅速提供能量这对肌肉收缩更为重要,当机体缺氧或剧烈运动局部血流不足,能量主要通过糖酵解获得,是某些组织获能的必要途径,,成熟的红细胞无线粒体,仅靠无氧酵解提供能量。关键酶:己糖激酶或葡萄糖激酶,6-磷酸葡萄糖激酶-1,丙酮酸激酶, 2.糖酵解途径葡萄糖分解成丙酮酸的过程称为葡萄糖途径,是有氧氧化与糖酵解共有过程。 3.底物水平磷酸化利用某种底物解释放能量促使ADP生成ATP,叫做 4.巴斯特效应有氧氧化抑制糖酵解的现象 5.Krebs(三羧酸循环) 由草酰乙酸和乙酰COA缩合生成柠檬酸开始,经反复脱氢脱羧再生称草酰乙酸的循环反应过程特点TAC是由草酰乙酸和乙酰COA缩合成柠檬酸开始,每循环一次消耗1分子乙酰基。反应过程中有4次脱氢(3分子DANH+H+,1分子FANDH2),两次脱羧,一次底物水平磷酸化,产生12分子ATP。在线粒体中进行,有三个不可逆反应的关键酶,分别是应柠檬酸脱氢酶,@-酮戊二酸脱氢酶复合体,柠檬酸合酶。 生理意义TAC是三大营养物质在体内彻底氧化最终代谢通路。是三大营养素互相转变的枢纽。是为其他物质合成提供小分子前体物质,为氧化磷酸化提供还原当量。 6.磷酸五糖途径6-磷酸葡萄糖经氧化反应合一系列集团转移反应,生成CO2 NADPH 磷酸核糖6-磷酸果糖和3-磷酸甘油醛而进入糖酵解途径生理意义提供5-磷酸核糖作为机体内合成各种核苷酸及核算的原料提供细胞代谢所需的还原性辅酶2 7.UDPG 即尿苷二磷酸葡萄糖,是葡萄糖合成糖原的过程中葡萄糖的活化形式,在体内作为葡萄糖的供体。糖原合成和分解的关键酶是糖原合酶和磷酸化酶 8.糖原累积症由于先天性缺乏与糖原有关的酶类,使体内某些器官组织中大量糖原积累而引起的一类遗传性疾病 9.糖异生由非糖物质乳酸甘油氨基酸等转变为葡萄糖或糖原的过程。生理功能;通过糖异生为此血糖浓度的相对恒定,糖异生是肝脏补充和恢复储备的重要途径,长期饥饿时,肾糖异生作用增强,有利于维持酸碱平衡。关键酶;丙酮酸羧化酶,磷酸烯醇式丙酮酸羧激酶,果糖二磷酸酶。部位;肝脏 10.Cori(乳酸循环)肌肉受收缩时经糖酵解产生乳酸,经过血液循环运输之肝,在肝脏异生成为葡萄糖进入血液,又被肌肉摄取利用,这一过程生理意义避免乳酸堆积而引起酸中毒。 11.有氧氧化的关键酶;6-磷酸果糖激酶-1,丙酮酸激酶,己糖激酶(葡萄糖激酶),丙酮酸脱氢酶复合体(丙酮酸脱氢酶,二氢硫氢酰胺转乙酰化酶,二氢硫氢酰胺脱氢酶),柠檬酸合酶,异柠檬酸脱氢酶,@-酮戊二酸脱氢酶复合体。 12.必需脂肪酸维持生命活动所必需,但不能在体内合成,必须有食物提供的脂肪酸。 13.脂肪动员储存在脂肪细胞中的脂肪,经脂肪酶逐步水解成脂肪酸和甘油并释放入血被组织利用的过程。 14.酮体;乙酰乙酸,B-羟丁酸,丙酮,是脂肪酸在肝内分解的特有产物。酮体是有乙酰COA经HMG-COA转化来的,肝脏不能运用酮体,在肝外组织酮体经乙酰乙酸硫激酶或琥珀酰COA转硫酶催化后,转变为乙酰COA并进入三羧酸循环而被氧化利用。特点;肝内合成肝外利用,其生理意义是肝脏为肝外组织提供了
水产禁用药物 据统计,我国目前渔药生产厂家有近百家,渔药品种也是多种多样,由于有些渔药生产厂家存在着缺乏技术含量和竞争力等问题,致使市场上渔药鱼龙混杂,有许多渔民甚至都弄不清楚市场上林林总总的渔药究竟哪些是安全的、环保的,哪些是禁用的。因此下面简单介绍一下现有渔药的分类,并列出各类常用渔药中的禁用种类,便于养殖户在实际生产中参照。 1.抗菌类药物 (1)抗生素类:常用的有土霉素、青霉素、强力霉素、金霉素、甲砜霉素、氟苯尼考等。(2)磺胺类:有磺胺嘧啶、磺胺甲基嘧啶、磺胺间甲氧嘧啶、甲氧苄氨嘧啶等。磺胺类药物在鳗鱼饲料添加剂中已禁止使用。(3)喹诺酮类:有氟哌酸(诺氟沙星)、氟嗪酸(氧氟沙星)、吡哌酸、噁喹酸、萘啶酸等。此类药物抗菌效果普遍较好,具有抗菌范围广、杀菌能力强等优点,是防治水产动物细菌病的有效药物。 在抗菌类药物中,抗生素类中的红霉素、氯霉素、泰乐菌素、杆菌肽锌已被禁止用于鱼病防治及作为饲料药物添加剂。磺胺类中的磺胺噻唑(消治龙)、磺胺咪(磺胺呱)被禁用。喹诺酮类中的环丙沙星已被禁用,恩诺沙星药残已作为限制鳗鱼出口日本的一主要因子。另一类抗菌药物硝基呋喃类中的呋喃唑酮(商品名为痢特灵)、呋喃西林
(又名呋喃新)、呋喃它酮、呋喃那斯也已被禁用。养殖户在生产过程中可用其它抗菌药物代替。 2.水体消毒剂 (1)卤素类:聚维酮碘(碘伏)、二氯异氰尿酸钠、三氯乙氰尿酸、溴氯海因、二溴海因、二氧化氯、漂白粉等。(2)醛类、醇类:甲醛溶液(福尔马林)、戊二醛、乙醇(酒精)等。(3)碱类:氧化钙(生石灰)、氢氧化铵溶液(氨水)等。(4)氧化剂:高锰酸钾、过氧化钙、过氧乙酸、双氧水(过氧化氢)等。(5)重金属盐类:螯合铜、硫酸铜等。高浓度的重金属盐有杀菌作用,低浓度具有抑制酶系统活性基团的作用,表现为抑菌效果。(6)表面活性剂:新洁尔灭、季铵盐类等。(7)染料类:甲紫、亚甲基蓝、吖啶黄等。染料可分为碱性和酸性两大类,影响生物代谢。 3.抗寄生虫药物: (1)染料类药物:常用的有亚甲基蓝等,可防治鱼卵的水霉病、幼鱼和成鱼的小瓜虫病、车轮虫病、斜管虫病等。(2)重金属类:硫酸铜、硫酸亚铁合剂。(3)有机磷杀虫剂:如敌百虫。 4)拟除虫菊酯杀虫药:如溴氰菊酯等。(5)咪唑类杀虫剂:甲苯咪唑、丙硫咪唑等。必须注意过量的铜可造成鱼体内重金属积累,而敌百虫在弱碱性条件下形成敌敌畏,其对人的危害极大。
化保试题2012 一、名词解释(20分) 1.POPs 持久性有机污染物,是指人类合成的能持久存在环境中,通过生物链累积,并对人类健康及环境造成有害影响的化学物质。 2. 毒力药剂本身对不同生物发生直接作用的性质和程度。 3. EC50:有效中浓度,抑制50%病菌菌丝生长或孢子萌发所需要的药剂浓度。 4. 分散度指药剂被分散的程度,是衡量制剂质量或喷洒质量的主要指标之一。 5. 治疗作用是在病原物侵入以后至寄主植物发病之前使用杀菌剂,抑制或杀死植物体内外的病原物,或诱导寄主产生抗病性,终止或解除病原物与寄主的寄生关系,阻止发病。 6. 交互抗性昆虫的一个品系由于相同抗性机理或相似作用机理或类似化学结构,对于选择药剂以外的其他从未使用过的一种药剂或一类药剂也产生抗药性的现象。 7. 安全间隔期:在不超过最大允许残留量的前提下,最后一次施药离作物收割的间隔天数,被称为安全间隔期。 8. ADI 每日允许摄入量(mg/kg),(0.5分)在人的一生中每日摄入该剂量不会产生明显的毒害。(1.5分) 9. 拒食剂可影响昆虫的味觉器官,使其厌食、拒食,最后因饥饿、失水而逐渐死亡,或因摄取营养不足而不能正常发育的药剂。 10. 原药:由化工厂合成的未经加工的高含量农药称为原药(technical material),多为有机合成物质,固体的称原粉,液体的称原油。 二、填空(20分) 1. 农药制剂的名称包括三部分:有效成分的百分含量、农药品种名称、剂型名称。 2.农药对高等动物的毒性可分为急性毒性、亚急性毒性、慢性毒性。 3. 2007年1月1日我国全面禁用列入“PIC”名单的5种高毒有机磷农药是:甲胺磷, 对硫磷,甲基对硫磷,久效磷和磷铵。 4. 我国常用农药剂型(至少5种)粉剂、可湿性粉剂、乳油、胶悬剂、粒剂。 5. 吡虫啉的英文通用名为 imidacloprid ,其作用靶标为乙酰胆碱受体。 6. 波尔多液的杀菌有效成分是 Cu2+,其主要防治对象是藻状菌(腐霉、疫霉、霜霉)。 三、选择题(20分) 1. 下列不属于润湿剂的是( B )。 A. 洗衣粉 B. 滑石粉 C. 拉开粉 D. 纸浆废液 2.下列农药为仿生合成农药的是( A C D )
1、营养不良的人饮酒,或者剧烈运动后饮酒,常出现低血糖。试分析酒精干预了体内糖代谢的哪些环节?(p141 3题) 答:酒精对于糖代谢途径的影响主要有:肝脏的糖异生与糖原分解反应,也就就是来源与去路的影响。 1)研究认为,酒精可以诱导低血糖主要取决于体内糖原储备就是否充足,然而在人营养不良 或者剧烈运动后,体内糖原过度消耗,酒精又能抑制肝糖原的分解,饮酒后容易出现低血糖。 2)抑制糖异生: ①酒精的氧化抑制了苹果酸/天冬氨酸转运系统,导致细胞间质中还原当量代谢紊乱,使丙酮酸浓度下降,从而抑制糖异生; ②酒精能影响糖异生关键酶活性-非活性的转换,酶总量,酶合成或降解,从而抑制糖异生,如果糖二磷酸酶-1活性的抑制,磷酸烯醇式丙酮酸羧基酶的表达降低等; 3)影响葡萄糖-6磷酸酶的活性,导致乳酸循环受阻,不利于血糖升高。 4)酒精使胰岛a细胞功能降低,促进胰岛素的分泌,抑制胰高血糖素的分泌,从而抑制糖原分解,促进糖酵解,造成低血糖。 5)酒精还会影响小肠对糖分的吸收,从而造成低血糖。 2、列举几种临床上治疗糖尿病的药物,想一想她们为什们有降低血糖的作用?(p141 4题) 答:1)胰岛素 它能增加组织对葡萄糖的摄取与利用,促进糖原的合成抑制糖异生,减少血糖来源,似血糖降低; 2)胰岛素促泌剂 ①磺脲类药物,格列苯脲等,通过刺激胰岛beta细胞分泌胰岛素,增加体内胰岛素水平而降低血糖;②格列奈类,如瑞格列奈,通过刺激胰岛素的早起合成分泌而降低餐后血糖。 3)胰岛素曾敏剂 如噻唑烷二酮类的罗格列酮可以通过增加靶细胞对胰岛素的敏感性而降低血糖。另外如双胍类药,如二甲双胍,它能降低血浆中脂肪酸的浓度而增加胰岛素的敏感性,增加周围组织对胰岛素的敏感性,增加胰岛素介导的葡萄糖的利用,也能增加非胰岛素依赖的组织对葡萄糖的摄取与利用。 4)a-糖苷酶抑制剂,如阿卡波糖,在肠道内竞争性的抑制葡萄糖苷水解酶,降低多糖或蔗糖分解成葡萄糖,抑制小肠对碳水化合物的吸收而降低餐后血糖。 3、治疗血浆胆固醇异常升高有哪些可能的措施?理论依据就是什么?(p174 3题) 答:1) 血浆胆固醇异常升高的治疗措施主要:有调整生活方式与饮食结构、降脂药物治疗、血浆净化治疗、外科治疗与基因治疗。具体的治疗方案则应根据患者的血浆LDL-胆固醇水平与冠心病的危险因素情况而决定。而且,降脂治疗的目标亦取决于患者的冠心病危险因素。一般而言,危险因素越多,则对其降脂的要求就越高(即目标血脂水平越低)。 2) 但就是继发型高脂血症的治疗主要就是积极治疗原发病,并可适当地结合饮食控制与降脂药物治疗。 A、控制理想体重。肥胖人群的平均血浆胆固醇与三酰甘油水平显著高于同龄的非肥胖者。除了体重指数(BMI)与血脂水平呈明显正相关外,身体脂肪的分布也与血浆脂蛋白水平关系密切。一般来说,中心型肥胖者更容易发生高脂血症。肥胖者的体重减轻后,血脂紊乱亦可恢复正常。 B、运动锻炼体育运动不但可以增强心肺功能、改善胰岛素抵抗与葡萄糖耐量,而且还可减轻体重、降低血浆三酰甘油与胆固醇水平,升高HDL胆固醇水平。 C、戒烟吸烟可升高血浆胆固醇与三酰甘油水平,降低HDL-胆固醇水平。停止
《现代植物生理学》 绪论 1、植物生理学:是研究植物生命活动规律及其与环境相互关系、揭示植物生命现象本质的科学。植物生理学的研究对象是高等植物。高等植物的生命活动主要分为生长发育与形态建成、物质与能量代谢、信息传递和信号转导3个方面。 2、萨克斯于1882年撰写出《植物生理学讲义》并开设课程,他的弟子费弗尔1904年出版三卷本《植物生理学》著作。这两部著作的问世,标志着植物生理学从植物学中脱胎而出,独立成为一门新兴的科学体系。 细胞生理 3、水势(Ψw ):同温同压下,每偏摩尔体积纯水与水的化学势差。(细胞水势由三部分组成:溶质势(ψs),衬质势(ψm)和压力势(ψp),即Ψw=ψs+ψm+ψp) 4、溶质势(ψs ):由于溶质的存在而使水势降低的值称为溶质势。 压力势(ψp):细胞壁对原生质体产生压力引起的水势变化值。 衬质势(ψm):由于亲水物质对水的吸引而降低的水势。 5、蒸腾作用的生理意义:a.水分吸收和运输的主要动力; b.是矿质元素和有机物运输的动力; c.降低叶温。 d.有利于气体交换 现已确定有17种元素是植物的必需元素:碳(C)、氢(H)、氧(O)、氮(N)、磷(P)、硫(S)钾(K)、钙(Ca)、镁(Mg)、铁(Fe)、锰(Mn)、锌(Zn)、铜(Cu)、硼(B)、钼(Mo)、镍(Ni)、氯(Cl)。 根据植物对必需元素需要量的大小,通常把植物必需元素划分为两大类,即大量元素和微量元素。 缺素症
9、单盐毒害:将植物培养在单一盐溶液中(即溶液中只含有一种金属离子),不久植物就会呈现不正常状态,最终死亡,这种现象称为单盐毒害。 离子对抗:在单盐溶液中若加入少量含有其他金属离子的盐类,单盐毒害现象就会减弱或消除,离子间的这种作用称为离子对抗。 (单盐毒害和离子对抗的内容也要看下及书上面的什么是“生理酸性盐”、“生理碱性盐”、“生理中性盐”也要看P81) 植物的光合作用过程 光合作用:是绿色植物大规模地利用太阳能把CO?和H2O合成富能的有机物,并释放出O2的过程。 12、C4植物比C3植物光合作用强的原因 ⑴结构原因:C3:维管束鞘细胞发育不好,无花环型,叶绿体无或少; 光合在叶肉细胞中进行,淀粉积累影响光合。 C4:维管束鞘细胞发育良好,有花环型,叶绿体较大; 光合在维管束鞘细胞中进行。有利于光合产物的就近运输,防止淀粉积累影响光合。⑵生理原因:①PEPC对CO2的Km(米氏常数)远小于Rubisico,所以C4对CO2的亲合力大,低CO2浓度(干旱)下,光合速率更高。 ②C4植物将CO2泵入维管束鞘细胞,改变了CO2/O2比率,改变了Rubisico的作用方向,降低了光呼吸。 13.光补偿点:当达到某一光强度时,叶片的光合速率与呼吸速率相等,净光合速率为零,这时的光强度称为光补偿点。 光饱和点:光合速率开始达到最大值时的光强度称为光饱和点。——P132 CO?补偿点:当光合速率与呼吸速率相等时,外界环境中的CO?浓度即为CO?补偿点(图中C点)。CO?饱和点:光合速率开始达到最大值时的CO?浓度被称为CO?饱和点。(图中S点)——P134