
南京工业大学有机化学试卷整理集吐血整
理必做
名
姓
号
学
级
班
仅供学习与交流,如有侵权请联系网站删除
仅供学习与交流,如有侵权请联系网站删除谢谢37
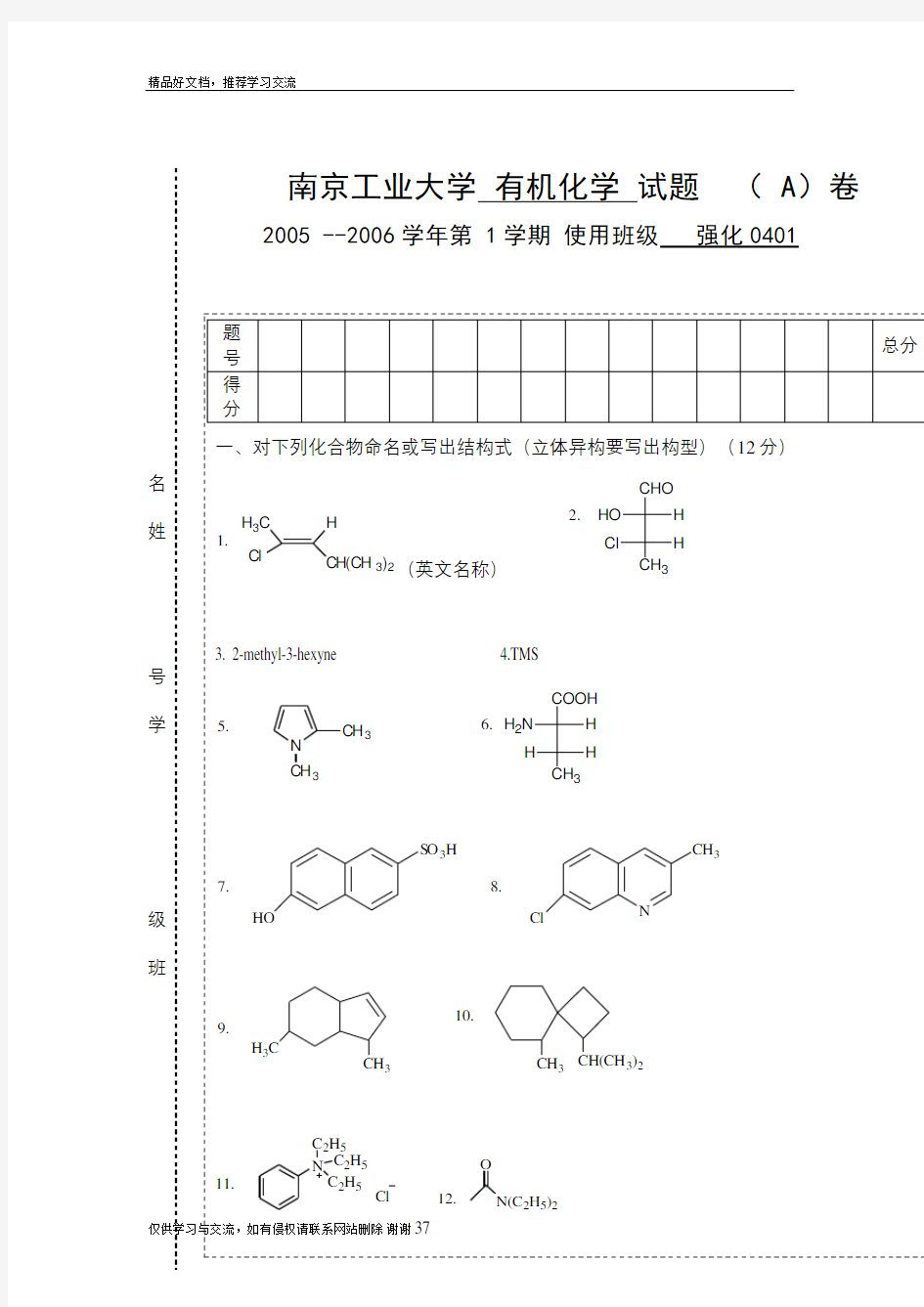
一:命名下列化合物或写出其结构:(10) C H 3C H 3CH 3 1 NH CH 3 O CH 3 2 CH 3 O 3 CH 3 SO 3H CH 3 C H 3Br 5 CHCH 2COOH CH 3 CH 3 OH NO 2 H OH CH 3 3 Br CH 3 8 O COOH 9 10. CH 3 二:完成下列反应(30 ) CH 3CH 2C= CH 2 CH 3 Br + 2, Cl 2 高温 OCH 2CH 3
+ 5, KM nO4 H2C C H C H3 (CH 3 ) 2 CHCHCH 3 OH NaOH 3 CH 2 CHCH(CH 3 ) 2 Cl 稀 (2)水 9,CH3CH2CH2CHO NaOH 4 10 O Cl+OH (CH3)2CHCHO Br2C2H 5 OH 干HCl 11. CH3 12+KM nO4 + O +2Br2 13 NH O KOH CH3CH2OH CH3CHBrCH3 14 NaNO2, HCl NH2 0-5℃ OH 15.
三:排序(10 ) 1.将下列化合物对亲电取代反应的容易程度排列成序 OH CHO Br 2.比较下列醇与卢卡氏试剂反应的相对速率的大小 CH 2OH CH 3 C H 33 OH C H 3CH 3 3.将下列化合物中羰基与同一亲核试剂加成反应的活性大小排列成序 C H 3CHO C H 3CHO CH 3 C H 3CH 3 O 4.比较下列羧酸的酸性 COOH COOH COOH COOH 3H NO 2 Cl 5. 比较下列卤代烃按S N 2反应的速度大小 CH 3CH 2CH 2CH 2Br (CH 3)3C Br CH 3CH 2CHBr CH 3 四、区别下列各组化合物:(6) 1 C H 3CH 3 CH C H 3C H 3CH 3 2 苯甲醛 苯甲酮 3-己酮 五 用化学方法分离下列各组化合物(6) OH CH 2OH 1 2 乙醚 乙烷 六 用指定的原料合成下列各化合物(小分子试剂任选)(20) 1.以丙烯为主要原料合成1-氯-2,3-二溴丙烷
第一章分析质量保证 1. 某人以差示光度法测定某药物中主成分的含量时,称取此药物0.0250g,最后计 算其主成分的含量为98.25%,此含量的正确值应该是______________ 。 (98%,因为仪器误差为2%) 2. 2. 某学生分析工业碱试样,称取含Na2CO3(Mr =106.0)为50.00%的试样0.4240g,滴定时消耗 0.1000mol/LHCl40.10ml ,该次测定的相对误差是 _______ 。(0.24%) 3. 3. 用高碘酸钾光度法测定低含量锰的方法误差约为2%。使用称量误差为0.001g的天平减量法称取 MnSO4,若要配制成0.2mg/ml的硫酸锰的标准溶液,至少要配制__________________ ml。 (0.002/m=0.02,m=0.1g,故配制500ml) 4. 4. 溶液中含有0.095mol/L的氢氧根离子,其pH值为 _________________ 。(12.98) 5. 5. 列有关置信区间的定义中,正确的是: A 以真值为中心的某一区间包括测定结果的平均值的几率 B 在一定置信度时,以测量值的平均值为中心的,包括真值在内的可靠范围 C 真值落在某一可靠区间的几率 D 在一定置信度时,以真值为中心的可靠范围(B) 6. 6. 有两组分析数据,要比较它们的精密度有无显著性差异,应当用______________ 检验法 7. 7. 滴定管的初读数为(0.05 0.01)ml,末读数为(22.10 0.01)ml,滴定剂的体积可能波动的范围是 _________________ 。(22.05 0.02ml) 8. 8. 某同学测定盐酸浓度为:0.2038、0.2042、0.2052和0.2039mol/L,按Q(0.90)检验法,第三份结 果应__________ -;若再测一次,不为检验法舍弃的最小值是______________ ;最大值是______________ 。 (Q=0.71<0.76,保留;0.2014; 0.2077) 9. _________________________________ 准确度是表示测得值与___________________________ 之间符合的程度;精密度是表示测得值与_____________ 之间符合的程 度。 准确度表示测量的____________ 性;精密度表示测量的____________ 性或_________ 性。(真值;平 均 值;正确;重复;再现) 10 10 .试样中含MgO约30%,用重量法测定时,Fe3+产生共沉淀,设试样中的Fe3+有1%进入沉淀, 从而导致误差,若要求测量结果的相对误差小于0.1%,则试样中Fe2O3允许的最高质量分数为 [ x=4.28%] 11. 根据有效数字的修约规则和计算规则解:5.856x106+2.8x103-1.71x104=? (5.842x106) 第二章第二章滴定分析概论 1. 1. 间接法制备标准溶液,常采用__ ___ 和_______ 两种方法来确定其准确浓度。 2. 2. 由于_____ 、_____ 或______ (用基准物标定;与其他标准溶液比较) 等原因不能直接滴定时,可采用回滴定的方式。 3. 3. 滴定分析中,指示剂变色时,称为 (反应速度慢、试样不易溶解、无合适指示剂)________________ 。(滴定终点) 4. 下列说法正确的是: A滴定管的初读数必须是“ 0.00” B 直接滴定分析中,各反应物的物质的量应成简单整数比 C 滴定分析具有灵敏度高的优点 D 基准物应具备的主要条件是摩尔质量大(B) 5. 使用碱式滴定管进行滴定的正确操作是 A 用左手捏稍低于玻璃珠的近旁 B 用左手捏稍高于玻璃珠的近旁 C 用左手捏玻璃珠上面的橡皮管 D 用右手捏稍低于玻璃珠的近旁(B) 6. 下列操作中错误的是 A 用间接法配制HCl 标准溶液时,用量筒取水稀释 B 用右手拿移液管,左手拿洗耳球 C 用右手食指控制移液管的液流 D 移液管尖部最后留有少量溶液及时吹入接受器中(D) 7. 用基准邻苯二甲酸氢钾标定NaOH 溶液时,下列情况对标定结果产生负误差的是 A 标定完成后,最终读数时,发现滴定管挂水珠 B 规定溶解邻苯二甲酸氢钾的蒸馏水为50ml,实际用量约为60ml C 最终读数时,终点颜色偏深
一.命名或写出结构式(12题×1分=12分): CH 3CH 2CH(CH 3)CHCH 2CH 2CH 3 CH(CH 3)2 CH 3 OH COCH 3 H 2C H 3C C COOCH 3 NOH SO 3H NO 2 O O O C H 2N H 3C H NH O C CH 3CH 3 O N O C H CH 2 H 2 C Cl 二、填空(每个空格填一个答案)(28分) 1、 ( ) ( ) ( ) ( ) H 3O+ CH 3CH 2CH 2CN SOCl 2 (CH 3)2NH LiAlH 4
2、 LiAlH 4CH 3CH 2CH 2CHO HCN OH-稀NaHSO 3 NHNH 2NO 2 O 2N Zn-Hg,HCl 干HOCH 2CH 2OH Cl H ( ) ( ) ( ) ( )( ) ( ) ( ) 4、 ( ) ( ) ( ) NH O O NaOH KOH BrCH 2COOCH 2CH 3 OH-O H 2 NaOH/H 2O Cl HNO 3,H 2SO 4 5 Cl Zn, HOAc 6 O 3 H 2O (1)(1) CH 3I N Ag 2O 7
8 H 2O, H (1)B 2H 6(2)H 2O 2, NaOH NaOH Cl OH CH 3OH 9 2 NO 2 Br Fe/HCl Br 2 /H 2 O (CH 3 CO) 2 O 稀盐酸 10 三、用化学方法区别下列各组化合物(10分) A) CH 3(CH 2)3NH 2 B) (CH 3CH 2CH 2)2NH C) (CH 3CH 2)3N 1. A) CH 3CH 2CH 2CH 2Br B) CH 3CHBrCH 2CH 3 C) (CH 3)3CBr 2. 四、简要回答问题(10分) 1.写出下述反应的机理: CH 2OH H ++
一、选择题(每题2分,共30分) 1 下列数据中有效数字是3位的是( ) (A) mol/L (B) pH = (C) mol/L (D) pH = 2 可以减小偶然误差的有效措施为( ) (A) 增加平行测定的次数 (B) 采用高纯水和高纯试剂 (C) 对测量仪器进行校正 (D) 做对照试验 3 用高锰酸钾法测定Ca 2+,Ca 2+与MnO 4-之间的化学计量关系为n (Ca)/n (KMnO 4)为( ) (A) 2 (B) 5/2 (C) 5 (D) 2/5 4 下列物质不能直接用NaOH 标准溶液准确滴定的是( ) (A) 邻苯二甲酸氢钾 (B) HAc (C) NH 4+ (D) H 2C 2O 4 5欲配制pH=3左右的缓冲溶液,应选择下列何种酸和它的共轭碱( ) (A) HAc (pK a = (B) 甲酸 (pK a = (C) 一氯乙酸 (pK a = (D) 二氯乙酸(pK a = 6 欲用EDTA 标准溶液滴定Bi 3+、Pb 2+混合液中的Bi 3+而使Pb 2+不干扰,下列哪种方法较好(94.27lg =BiY K ,04.18lg =PbY K ,4.303)(,=OH Bi sp pK ,93.143)(,=OH Bi sp pK )( ) (A) 适当降低pH 值,利用酸效应进行分别滴定 (B) 适当提高pH 值,利用酸效应进行分别滴定 (C) 将Bi 3+沉淀为Bi(OH)3,过滤分离出Bi(OH)3,用酸溶解后滴定Bi 3+ (D) 将Pb 2+沉淀为Pb(OH)2,过滤分离出Pb(OH)2后,滴定Bi 3+ 7 已知69.10lg =CaY K , pH )(lg H Y α 用L EDTA 滴定 mol/L Ca 2+,允许相对误差为%,则最低允许pH 值为( ) (A) pH ≈6 (B) pH ≈8 (C) pH ≈10 (D) pH ≈12 7 以MgY-EBT 为指示剂用EDTA 滴定Ca 2+,终点时的颜色变化为( ) (A) MgY → Mg-EBT (B) Ca-EBT → EBT (C) Mg-EBT → EBT (D) EBT → Ca-EBT 8 在含有Fe 3+和Fe 2+的溶液中,加入下述何种溶液,Fe 3+/Fe 2+电对的实际电位将上升( ) (A) 稀H 2SO 4 (B) 三乙醇胺 (C) NH 4F (D) K 2Cr 2O 7
Organic Chemistry Exercise 7Nov. 22th within 20 min 1.Predict the effect the substituent attached to the benzene ring below would have on electrophilic aromatic substitution reactions? A. ortho/para director, activator B. ortho/para director, deactivator C. meta director, activator D. meta director, deactivator 2.In the Friedel-Crafts alkylation of benzene, dialkylation is often a significant by-product. In the Friedel- Crafts acylation of benzene, diacylation is not a significant by-product. Which of the following is the primary reason for this difference? A. Alkyl groups activate the ring to further substitution, acyl groups deactivate it. B. Alkyl groups are less sterically hindered than acyl groups. C. Acyl cations are more difficult to make with Lewis acids. D. Unlike acyl cations, carbocations can undergo rearrangements. 3.Which isomer of dichlorobenzene gives a single mononitration product? A. ortho B. meta C. para D. none of them 4.Salicylic acid reacts with two equivalents of ICl to give one of the products below. Which one is it? (Hint: Cl is more electronegative than I.) A. A B. B C. C D. D 5.Identify the preferred site(s) of electrophilic attack on the following compound.
《有机化学》课程期末考试试卷 课程号:061B9010,开课学院:理学院 考试试卷:A卷√、B卷(请在选定项上打√) 考试形式:闭√、开卷(请在选定项上打√),允许带/ 入场 考试日期:2013 年 1 月16 日,考试时间:120 分钟 诚信考试,沉着应考,杜绝违纪。 考生姓名:学号:所属院系: 一按系统命名法命名下列化合物,有立体结构的请标明(10题,共10分)1 2 3 4 5 6 7 8 9 10
二选择题(20题,1-14,每题1分,15-20,每题2分,共26分) 1.与HBr发生亲电加成反应最快的是() 2.下列化合物可以只用NaBH4还原的是() (a) 乙烯(b) 乙炔(c) 亚胺(d) 乙腈 3.下列化合物中α-H酸性最强的是() 4.下列化合物碱性最强的是() (a) 甲醇钠(b) 氨基钠(c) 乙炔基钠(d) 正丁基锂 5.下列化合物发生SN1速度最快的是() 6.下列物质中具有光学活性的是() 7.下述化合物若与一摩尔质子酸形成盐,则该质子最可能在哪个氮原子上()
8.下列共轭二烯烃中,不能作为双烯体进行Diels–Alder反应的是() 9.在pH=5的水溶液中主要以阴离子形式存在的氨基酸是() 10.乙二醇的优势构象是() 11.根据休克尔规则,以下化合物中没有芳香性的是() 12.下列Baeyer-Villiger氧化反应的产物是() 13.下列试剂中亲核性最强的是()
14.下列化合物中,分子偶极矩最小的是() (a) 一氯甲烷(b) 二氯甲烷(c) 四氯化碳(d) 三氯甲烷(氯仿) 15.下列丙酸酯在碱性条件下进行水解反应,速度最快的是();最慢是() 16.比较下列胺类化合物的碱性,最强的是(),最弱的是( ) 17.以下化合物最容易进行芳基亲电取代反应的是(),最难的是() (a) 苯(b) 甲苯(c) 吡啶(d) 苯甲醚 18.分别指出下列两组共振式中,哪个极限结构更稳定 () () 19.比较下列自由基的稳定性,最稳定的是(),最不稳定的是() 20.下列化合物进行E2消去反应,反应速度最快的是(),最慢的是()
1. Pb-EDTA(无色)、Pb-二甲酚橙(红色)、二甲酚橙(黄色)。用EDTA滴定Pb2+,终点时,溶液的颜色如何突变 (A) 无色→红色 (B) 黄色→红色 (C) 红色→黄 色 (D) 红色→无色 2. 可与Cu2+形成螯合物的配体是: (A) CN- (B) EDTA (C) NO 2 - (D) CO 3. 欲使BaCO 3 在水溶液中溶解度增大,可采用的方法是: (A) 加入mol·L-1NaOH (B) 加入mol·L- 1Na 2CO 3 (C) 加入mol·L-1BaCl 2 (D) 降低溶液的pH值 4. EDTA与Ca2+、Fe2+、Fe3+配合物稳定常数的次序是: (A) Ca2+>Fe2+>Fe3+ (B) Fe3+>Ca2+>Fe2+ (C) Fe2+>Fe3+>Ca2+ (D) Fe3+>Fe2+>Ca2+ 5. 碘量法中所用的指示剂为: (A)二甲酚橙 (B) 淀粉溶液 (C) 亚甲基蓝 (D) 二苯胺磺酸钠 6. [FeF 6 ]3-为外轨型配合物。其中心原子的杂化轨道类型和理论磁矩为: (A) 4s14p34d2;μ B (B) 3d24s14p3; μB (C) 4s14p34d2;μ B (D) 3d24s14p3; μB 7. 在pH = 的溶液中,用EDTA滴定Ca2+和Mg2+混合液,测定的是: (A) Mg2+的量 (B) Ca2+的量 (C) Ca2+-Mg2+的 量 (D) Ca2++Mg2+的量 8. 从氧元素的电位图φo(V) O2 H2O2H2O | | 求φo(H2O2/H2O)为: (A) (B) (C) (D) 9. 已知M的lg K MY =,pH=5的氨缓冲溶液中,α Y(H) =;α M(L) =; α M(OH) =;则在此条件下,lgK' MY 为: (A) (B) (C) (D) 10. 在下列物质中,哪一个不能将KI氧化成I 2 : (A)KBrO 3 (B)FeNH 4 (SO 4 ) 2 (C)Fe(NH 4 ) 2 (SO 4 ) 2 (D) CuSO 4
1.CH 2=CHCH 2C O H O CH 2CHCH 2C OH HO O H O CH 2CHCH 2C 8 14 反应式参考答案章( )章小波 2. CH=NNH NO 2 NO 2 3. CHOMgI 3 CHOH 3 4. CH 3CH=CHCHO 5. OCH 3 CH 2OH +HCOO 6.+CH 3CH 2COO CHI 3 Na 7. +COONH 4Ag 8. CH 2OH 9. CH=CH 2 OMgBr CH=CH 2 OH 10. +CH 2COONa CHBr 3 11. CH 2OH 2OH +HCOO 12.OH CH 2CH 2CH 313. CH 3CH 2CHCHCH 3 OH 314. NNHCNH 2 NNHCNH 2 O
https://www.doczj.com/doc/e27521532.html, 2OH HO H H OH CN 2OH H OH H OH + 16.OMgBr OH 17.(CH 3)3CCOOMgBr (CH 3)3CCOH +18.CH 3CH 2COONa CHI 19.CH 2CHCH 2CH 3 OH CH=CHCH 2CH 3 20.CH 2 21.CH 3 OH 22. CHCOO CH 3 +Cu 2O H 2NOH 23. O NOH HOCH 2CH 2OH 24. O ( )O O HCl(g) 25. OH Cl 26. CH 3CHCH 2CH=CCHO 33)2 27.CH 2CH=CHCH(CH 3)228. CH 2CHCONH 2 CH 3CH 2CHNH 2 3 +29. CHCOO CH 3 COO Ag CH 322H 5 O O 30.31.O O 32. HOCH 2CH 2CH 2CH 2COONa
一、根据结构式命名或写出下列化合物的结构式(本大题共10小题,每小题1分,共10分) 二、单项选择题(本大题共15小题,每小题1分,共15分) 在每小题列出的四个备选项中只有一个是符合题目要求的,请将其代码填写在题后的括号内。错选、多选或未选均无分。 1. 下列各组化合物不属于同分异构体的是(A)。 A. 乙醇和乙醚 B. 环丙烷和丙烯 C. 环戊烯和戊炔 D. 1,3-丁二烯和丁炔 2. 下列化合物中若按S N1反应,反应速度最快的是( D ) A. 1-溴丁烷 B. 2-溴丁烷 C. 2-甲基-2-溴丁烷 D. 2-甲基-3-溴丁烷 3. 下述卤代烃中发生S N2反应速度最快的是( C )。
4. 下列化合物中不属于Lewis酸的是(A)。 A. 硫酸 B. 三氯化铝 C. 三氟化硼 D. 氯化锌 5. 下列化合物中与硝酸银溶液作用最快的是(A)。 A. 氯化苄 B. 氯苯 C. 溴苯 D. 氯乙烯 6. 化合物HOOCCH(OH)CH(OH)COOH中含有手性碳原子个数为( B )。 A. 1个 B. 2个 C. 3个 D. 4个 7. 下列化合物硝化反应速度最快的是( C )。 A. 硝基苯 B. 氯苯 C. 甲苯 D. 苯 8. 用卢卡氏试剂可鉴别下列哪组化合物?(A) A. 叔丁醇与丙醇 B. 苯与甲苯 C. 环己烷与己烯 D. 乙烯与乙炔 9. 能与2,4-二硝基苯肼反应生成黄色沉淀,但不能发生银镜反应和碘仿反应的是( D )。 A. 丁醛 B. 2-丁醇 C. 2-丁酮 D. 3-戊酮 10. 甲苯与氯气在光照下进行反应的反应机理是( C )。 A. 亲电取代 B. 亲核取代 C. 自由基取代 D. 亲电加成 11. 我们常用下列哪种试纸判断重氮化反应的终点。( C ) A. PH试纸 B. 刚果红试 C. 淀粉-碘化钾试纸 D. 石磊试纸 12. 下列乙酸衍生物中最容易发生水解反应的是 ( D )。 A. 乙酸乙酯 B. 乙酸酐 C. 乙酰胺 D. 乙酰氯 13. 下列化合物中酸性最强的是( B )。 A. 苯酚 B. 氯乙酸 C. 冰醋酸 D. 对硝基苯酚 14. 下述含氮化合物中碱性最强的是(A)。 A. 甲胺 B. 苯胺 C. 乙酰胺 D. 四丁基溴化铵 15. 下述手性化合物中互为对映异构体的一组是( B )。
南京工业大学无机与分析化学试卷(下、A)(一页开卷) 2012—2013学年第二学期使用班级:全校相关专业 学院专业学号姓名 题号一二三四五六七总分 得分 一、每题只有一个答案是正确的,请选择(每题2分,将答案填入答题表中) 题号12345678910 答案 题号11121314151617181920 答案 1. 取同浓度的Zn2+-EDTA配合物的溶液两份,分别用A:用NaOH溶液控制pH=10.0,其条 件稳定常数记作K'ZnY,A,B:用氨-氯化铵缓冲溶液控制pH= 10.0,条件稳定常数记作K'ZnY,B,。 正确的关系式是: 2. 佛尔哈德法测定Cl-时,使用的指示剂是: (A) Ag2CrO4(B) 二氯荧光黄(C) 甲基橙(D) FeNH4(SO4)2 3. 在下列物质中,不能将KI氧化成I2的是: (A) KIO 3 (B) FeNH4(SO4)2(C) Fe(NH4)2(SO4)2(D) CuSO4 4. 下列说法正确的是: (A) 非构晶离子的盐浓度越大,沉淀溶解度越大 (B) 非构晶离子的盐浓度越大,沉淀溶解度越小 (C) 两种沉淀的溶度积相比,溶度积小的溶解度也小 (D) 不同种类沉淀的溶解度越大,溶度积也越大 5. 从磷元素的电位图φo(V) H2PO2-____-2.25V____P4_______________PH3 |_____________-1.23V____________| 可计算电对P4/ PH3的标准电极电位φo P4/PH3为: (A) -1.02V (B) -1.74V (C) -0.89V (D) -1.16V 6. 在配离子[Co(C2O4)2(en)]-中(en为H2N-CH2-CH2-NH2),中心离子Co3+的配位数是: (A) 3 (B) 4 (C) 5 (D) 6 7. 用Na2C2O4标定KMnO4,加入第一滴KMnO4时,KMnO4的紫红色不会立即退去,这是因 为反应速度不够快,若使第一滴KMnO4很快退色,最有效的措施是: (A) 加大H2C2O4浓度(B) 加大酸度 (C) 事先加入Mn2+(D) 加快滴KMnO4的速度
第一章 绪论 1. 什么是有机化合物有机化合物有哪些特性 2. 什么叫σ键π键 3.什么叫“杂化轨道”碳的成键状态与杂化状态之间有什么关系 第二章 烷烃和环烷烃 烷烃 1. 用系统命名法命名下列化合物: CH 3CH 2CH 3CHCH 2CH 2CH 3 3)2 (1) (CH 3)2CHC(CH 3)2 3CH 3(2) CH 3CH 2CH CH 3CCH 2CH 2CH 3 CH(CH 3)2 (3) CH 23 CH 3 (4) (5) 2. 指出上述化合物中的伯、仲、叔、季碳原子。 3.试写出C 4H 9Br 、C 6H 13Br 所有的构造异构体。 4. 下列化合物的系统命名对吗如有错误,指出错误之处,幷给出正确命名。 2-乙基丁烷 (1) (5)2,4-2甲基己烷 5. 画出1,2-二溴乙烷最稳定及最不稳定的构象的纽曼投影式,幷写出该构象的名称。 6. 设想甲烷氯化反应的历程包括下列各步骤: Cl 2 Cl + +H HCl Cl +CH 4CH 3Cl +H Cl 22Cl (1)计算每一步反应的H ; (2)从能量方面看,这个反应可不可行 7. 在理论上,可以通过一些什么途径来生成自由基伯仲叔碳自由基的稳定性次序是怎么样的
环烷烃 1.命名下列化合物: CH3 F 3 F CHBrCH 3 OH HC CH2 O CH3 (a)(b)(c)(d)(f) (g) (h)(j) H CH3H CH3 (k) (l)(m) 2. 写出下列化合物的构象式: (1)(2)(3) 3. 完成下列反应式: CH3 ? ? ? 4. 画出环己烷的船式构象,解释为什么其稳定性比椅1构象差 5. 画出下列化合物的稳定构象: CH 3 3 3 CH H (1)(2)(3)
一:命名下列化合物(10) 1. F Br I Cl H 3C C O N CH 3CH 3 2 3 CH 3 NO 2 NO 2 O 2N 4 5. 6. COOCH 3 7 NH 2 HOOC 8 SO 3H 3 9. OH HO OH 10. 3 H 3C 二:完成下列反应(30) H 3C H C CH 2 H 2C H C H C CH 2 1NBS + Cl 2 光 2, CH C H 3[A g (N H 3)2]N O 3 3 O OH 4. SOCl 2CH 3OH
+ 5, KMnO4 H2C CHCH3 6 NaOH溶液 7, OH CH3CH2CHCH3 C2H5OH NaOH 8 稀 (2)水9,CH3CH2CH2CHO4 O N H2 CH3 +N a O H+Br2 10 (CH3)2CHCHO Br2CH3OH 干HCl 11. CH3 O H 2 O 12 13, NH O KOH C2H5OH CH3CHBrCH3 14 NaNO2, HCl NH 2 0-5℃ 15.
三:排序(10 ) 1.将下列化合物对亲电取代反应的容易程度排列成序 NO2Cl H CH3 2.比较下列化合物的碱性(气态条件下) 氨甲胺二甲胺 3.将下列化合物中羰基与同一亲核试剂加成反应的活性排列成序 COCH 3 CH 3CH 2 CHO CH3COCH3 4.比较下列化合物的酸性 C6H5OH CH3COOH ClCH2COOH 5.比较下列卤代烃按S N1反应的速度大小 CH 3CH 2 CH 2 CH 2 Br(CH3)3C Br CH3CH2CHBr CH 3 四、区别下列各组化合物:(6) 1 丙烷,丙烯,丙炔 22-丁醇苄醇正丙醇 五用化学方法分离下列各组化合物(10) 1.苯、苯酚 2. 2—丁醇与2—丁酮 六立体化学问题:用R/S标出下列手性碳原子的构型(4分) H3C C Cl Br C H C2H5 C3H7 2 3 3 HBr 6 H5 3
一、选择题(每小题2分,共40分) 1 下列物质中可以直接配制标准溶液的是………………………………………………………( ) (A) 浓硫酸 (B) 固体氢氧化钾 (C) 高锰酸钾 (D) 硝酸银 2 下列数据中有效数字是3位的是………………………………………………………………( ) (A) 1.030 mol/L (B) pH = 12.02 3 (C) 1.023 mol/L (D) pH = 1.23 3 下列措施中不能消除系统误差的是……………………………………………………………( ) (A) 增加平行测定的次数 (B) 采用高纯水和高纯试剂 (C) 对测量仪器进行校正 (D) 做对照试验 4 下列物质中能用NaOH 标准溶液直接滴定的是………………………………………………( ) (A) 苯胺(K b = 4.6×10-10) (B) NH 4NO 3(NH 3 的K b = 1.8×10-5) (C) 乳酸(K a =1.4×10-4) (D) Na 2SO 4 5 配制pH 3左右的缓冲溶液并使其缓冲容量较大,最好应选择下列何种酸及其共轭碱……( ) (A) HAc (p K a =4.74) (B) 甲酸(p K a =3.74) (C) 一氯乙酸(p K a =2.86) (D) 二氯乙酸(p K a =1.30) 6 H 3PO 4磷酸的三级酸式离解常数的对数值分别为2.12,7.20和12.36,当用NaOH 标准溶液滴定磷酸至第二化学计量点时,pH 约为……………………………………………………………( ) (A) 2.12 (B) 5.66 (C) 7.20 (D) 9.78 7 下列酸效应系数的表达式中正确的是…………………………………………………………( ) (A) ∑=++ =n i i a i K 1Y(H)]H [1α (B) ∑=++=n i i 1 Y(H)]H [1α (C) ∑=++ =n i i i 1 H Y(H)]H [1β α (D) ∑=++=n i a i i K 1Y(H) ]H [1α 8 欲用EDTA 标准溶液滴定Bi 3+、Pb 2+混合液中的Bi 3+而使Pb 2+不干扰,下列哪种方法较好(27.94lg BiY =K ,18.04lg PbY =K ,30.4p 3Bi(OH)sp,=K ,14.93p 3Bi(OH)sp,=K )……( ) (A) 加入强酸适当降低pH ,利用酸效应进行分别滴定 (B) 加入强碱适当提高pH ,利用羟基络合效应进行分别滴定 (C) 将Bi 3+沉淀为Bi(OH)3,过滤分离出Bi(OH)3沉淀,再用强酸溶解沉淀后滴定Bi 3+ (D) 将Pb 2+沉淀为Pb(OH)2后直接滴定Bi 3+ 9 已知5.16lg ZnY =K , 用0.02000 mol/L EDTA 标准溶液滴定浓度约为0.02 mol/L 的Zn 2+,允许相对误差为0.1%,则最高允许酸度为…………………………………………………………………………………( ) (A) pH ≈4 (B) pH ≈6 (C) pH ≈8 (D) pH ≈10 10 在含有Fe 3+和Fe 2+的溶液中,加入下述何种溶液将使Fe 3+/Fe 2+的实际电位上升…………( ) (A) 稀H 2SO 4 (B) 三乙醇胺 (C) NH 4F (D) K 2Cr 2O 7 11 已知44.10' /Ce Ce 34=+ + E V ,68.00' /Fe Fe 23=++E V ,反应Ce 4+ + Fe 2+ = Ce 3+ + Fe 3+达到化学计量点时,溶液中Fe 3+与Fe 2+的分析浓度之比为…………………………………………………………( ) (A) 1.08×10-18 (B) 92.5 (C) 36.2 (D) 2.76×106 12 用Cr 2O 72-滴定Fe 2+至化学计量点时,有关离子浓度的关系是………………………………( ) pH 4 5 6 7 Y(H)lg α 8.44 6.45 4.56 3.20
1.某化合物分子式为C 6H 12O ,不能起银镜反应,但能与羟胺作用生成肟,在铂催化下 加氢可生成一种醇,该醇经去水,臭氧分解后,得到两种液体,其中之一能起碘仿反应但不 能与菲林试剂反应,另一种则能起银镜反应,但不起碘仿反应。试写出该化合物结构式。 (CH 3)2CHCOCH 2CH 3 2.分子式为C 8H 14O 的化合物A ,与NH 2OH 作用、并可以很快使溴褪色。A 被热KMnO 4 氧化后可生成丙酮及另一化合物B 。B 具有酸性,和NaOCl 反应可生成氯仿及丁二酸,试 写出A 、B 的结构式。 A : (CH 3)2C=CCH 2CH 2CHO B : CH 3COCH 2CH 2COOH 3.某醇经氧化脱氢生成一种酮。该酮分子式为C 5H 10O ,经氧化后可生成乙酸和丙酸。 试推导该醇的结构。 CH 3CH 2CH(OH) CH 2CH 3 4.某化合物A 的分子式为C 5H 12O 、经K 2Cr 2O 7、H 2SO 4氧化后生成分子式C 5H 10O 的 化合物B 。B 不能起碘仿反应,亦不起银镜反应,B 与金属镁作用生成C 10H 22O 2化合物C , C 能与高碘酸作用又可生成B 。C 与浓H 2SO 4作用生成C 10H 20O 化合物 D 。 D 能与氨基脲 (NH 2NHCONH 2)作用生成结晶,D 不能起银镜反应。试写出A 、B 、C 、D 结构及相关反 应式。 CH 3CH 2CH(OH) CH 2CH 3 CH 3CH 2COCH 2CH 3 (CH 3CH 2)3CCOCH 2CH 3 5.分子式为C 12H 18N 2的苯腙用盐酸处理后生成的羰基化合物,不与多伦试剂、亚硫酸 氢钠作用。试写出该苯腙的可能结构。 6.分子式为C 8H 16化合物A ,经臭氧分解后生成B 、C 两种化合物。B 能起银镜反应,但不起碘仿反应。C 能与苯肼作用,但不与NaHSO 3作用。试推导A 、B 、C 的结构。 CH 3CH 2CHO 7.分子式为C 9H 16 O 化合物A ,经臭氧氧化后生成B 、C 两种化合物,B 能与NH 2OH 作用,但不与NaHSO 3作用,C 能起碘仿反应同时生成一种酸,酸的结构为CH 2(COOH)2 。试写出A 、B 、C 的结构。 HOOCCH 2COCH 3 8.一个化合物的分子式为C 7H 12,用KMnO 4氧化时生成环戊甲酸,当该化合物与浓 H 2SO 4反应后,经水解生成醇C 7H 14O ,该醇可以起碘仿反应。试推测该化合物结构。 CH 3 HIO 4 [ O ] Mg Or CH 3CH 2 CH 3CH 2 CH 2CH 3 CH 2CH 3 C C OH OH H 2SO 4 (CH 3)2CH CH 3CH 2 C=N NH CH 3CH 2CH CH 3CH 2 C=N NH A B C D CH 3CH 2 CH 3CH 2 C=CH CH 2CH 3 CH 3CH 2 CH 3CH 2 C=O A B C CH 3CH 2 CH 3CH 2 C=CHCH 2COCH 3 CH 3CH 2 CH 3CH 2 C=O A B C 2
水平测试一 一、用IUPAC 命名法命名下列化合物(10分): 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 二、是非题(正确的打“√”,错误的打“×”)(10分): 1. 含有手性碳的化合物都有光学活性。--------------------------------------------------( ) 2.共轭效应通过共轭体系传递,是一种长程的电效应,即其作用强度在共轭体系中几乎不受距离的影响;诱导效应通过σ 键传递,是一种短程的电效应,即其作用强度随距离远离而急剧减弱。-----------------------------------------------------------------------------------------( ) 3.共轭体系π 电子数符合4n+2的,该化合物具有芳香性。-----------------------( ) 4.亲核取代反应和消除反应是一对竞争反应,提高反应温度往往更有利于得到消除产物。-----------------------------------------------------------------------------------------------------( ) 5.α-D-吡喃葡萄糖和β-D-吡喃葡萄糖是一对对映异构体,也是一对差向异构体。--------------------------------------------------------------------( ) 6.变旋现象是指一种右旋转变成左旋,或左旋转变成右旋的旋光性发生改变的现象。例如右旋的蔗糖水解变成左旋的转化糖有此现象。---------------------------------------------( ) 7.自由基反应是一种连锁反应,其反应机理总是经过链引发、链增长和链终止三个阶段。发生自由基反应的一般情形有:自由基引发剂催化、光照或高温加热等。 --------------------------------------------------------------------( ) 8.硝基是极强的间位定位基,硝基苯与乙酰氯在三氯化铝催化下发生的亲电取代反应可高产率地得到间硝基苯乙酮。----------------------------------------------( ) 9. 在立体化学中S 表示左旋,R 表示右旋。------------------------------( ) C = C C H 3C H 2C H (C H 3)2C H 3 C H 2C H 2C H 3 C H 3 C H 3C H C H 3 C H 3C H 2C H C H 2C H 2C C H 2C H 3C H 3 C H 2=C H C ≡C H H C H 3 C H 3 N O 2 O H N O 2 N O 2 O 2N O C H 3C C H 2C C H 3O O NH O O
南京工业大学2016年硕士研究生《分析化学》考试大纲 一、考试的基本要求 要求学生系统地理解和掌握化学分析及仪器分析的基本理论知识和基本分析方法,建立起严格的“定性”和“定量”的概念。掌握化学分析及仪器分析的基本实验操作和数据处理方法,了解分析化学在各领域的实际应用,具有较宽的知识面,能够对实际的分析问题提出较为合理的解决方案。 二、考试方式和考试时间 闭卷考试,总分150,考试时间3小时。 三、参考书目 《分析化学》,陈国松、张莉莉.南京大学出版社,2014年 《仪器分析》,田丹碧.化学工业出版社,第二版,2015年 四、试题类型 主要题型有选择、填空、简答、计算等,根据每年的考试要求做相应调整。 五、考试内容及要求 第一部分定量化学分析概论 重点掌握:滴定分析法对化学反应的要求;标准溶液和基准物质;根据化学计量关系和滴定过程计算分析结果。 了解和熟悉:定量化学分析的一般步骤和原则;定量分析结果的计算和表达;滴定分析的过程及滴定方式的种类。 第二部分误差与分析数据的统计处理 重点掌握:各种误差指标的计算;误差类型的判别;置信区间的意义和计算;显著性检验,异常值的取舍及有效数字问题。 了解和熟悉:误差的基本概念;误差的分类及表征;各种误差统计指标;随机误差的分布;平均值的置信区间;显著性检验;误差的传递,有效数字及其运算规则;提高分析结果准确度的方法;Excel在实验数据处理与误差分析中的应用。 第三部分分析试样的采集和前处理 重点掌握:取样的代表性原则;固体试样的缩分方法;试样的各种分解方法;沉淀分离法、液-液萃取分离法、离子交换分离法、纸色谱分离法及薄层色谱分离法等。 了解和熟悉:试样的采集、制备和保存方法;试样的分解方法;待测组分的分离与富集方法。 第四部分酸碱滴定法 重点掌握:酸碱组分分布分数的计算和分布曲线的规律;质子条件式的写法;各类酸碱溶液pH的计算;缓冲溶液的配制及pH的计算;酸碱指示剂的作用原理和选用原则;酸碱滴定曲线的规律;酸碱滴定误差的估算;混合碱、极弱酸、磷、硅、有机物及铵盐中氮的测定和计算方法。 了解和熟悉:酸碱的定义和共轭酸碱的概念;酸碱组分的分布分数;溶液pH的计算;酸碱缓冲溶液;酸碱指示剂;酸碱滴定曲线;酸碱滴定误差的估算;酸碱滴定的常见应用;设计酸碱滴定方案的一般过程。 第五部分配位滴定法 重点掌握:累积稳定常数及其在平衡体系中各组分浓度计算中的应用;副反应系数的概念、计算和应用;条件稳定常数的影响因素和计算;配位滴定曲线的规律及化学计量点和滴定突跃范围的计算;金属离子指示剂的作用原理和选用原则;指示剂的封闭、僵化现象及其消除办法;提高配位滴定选择性的途径。 了解和熟悉:配合物及其稳定常数;副反应系数和条件稳定常数;配位滴定曲线的规律;金属离子指示剂;终点误差的计算;配位滴定条件的选择与控制,配位滴定的方式及应用。 第六部分氧化还原滴定法 重点掌握:条件电位的概念、影响因素和计算;条件电位与氧化还原反应平衡常数的关系;氧化还原
南京工业大学 有 机 化 学 试题(A )卷 (闭) 班级 学号 姓名 一.命名或写出化合物结构(立体结构需标记构型)(1.5’×10=15’): CH 3 CH 2CH 3 CH 3 CH 3 CH 3CHCH 2CHCH 2CCH 3 1. CH 2CHCH 3 CH 3 C= C CH 3 CH 3CH 2 CH 3 2. CH 3 CH 3 3. H Br H Cl CH 3 CH 2CH 3 4. CH 3 CH 3O 5. H 3C H N N 6. 7. O O O CH 2N(CH 3)2 8. 9. 9,10-蒽醌 10. 甘油
二.完成下列反应(只需写出主产物)(1.5’×20=30’): 2 CH 3 CH 3CH 2CHCH 3 1. hv ROOR HBr CHCH 3 CH 3C CH 3 2. 3. .O 3 2. 2 HBr 4. C CH H 2O 244 5. 6. CH 3CH 2CH 2Cl 3 HSO HNO OCH 3 7. OCH 2CH=CHCH 3 8. 9. 32CH 3 CH 3CHCH=CH 2CHO
HI OCH 3 10. 210%NaOH 11. CH 3 CH 3CH 2CHCH 2CHO CH 3CHCH 2CH 312. OH + 13. CONH 2 I 2 + NaOH 14. N NaNH 2 15. 2+ CH 2OH HO OH OH OH O 16. O CH 2=CHCH 2C CH 3