
《第三节 电解池》学案
学习目标:1、理解电解的基本原理,初步掌握一般电解反应产物的判断方法;
2、掌握电解溶液的变化分析、离子放电顺序;
学习重点:电解原理 学习难点:离子放电实质、氯碱工业反应原理
【学习过程】19世纪初,伏打发明第一个电池,但伏打认为是由于两个金属接触而产生的电流。英国人戴维经过研究后,在科学界第一个提出原电池是因为发生了化学反应而产生的电流。同时戴维认为既然化学能能转变成电能,那么电能也应该会转化成化学能。经过不断的研究,戴维利用电解的方法,发现了钾、钠、钙等新元素,从而成为化学史上发现新元素最多的人。尤其是发现钾的过程,当时以拉瓦锡为代表的科学界认为:苛性钾是一种单质,戴维通过无数实验,终于采用电解熔融苛性钾的方法,分离得到了单质钾。 【思考】1、为什么直到戴维采用电解的方法,才还原出了钾、钠、钙的单质?
2、为什么必须电解苛性钾的熔融物,才能得到单质钾?电解苛性钾溶液能否得到钾?
(可以推测,在后面的学习中能找到答案)
【回顾】初中学习的电解水试验:
1、写出反应方程式:_____________________________
2、思考电路中的电子移动:(在装置图上标出电子移动方向) 电子从外电源的_____极流出,经过导线进入_____极,又从 _____极流出,进入外电源的_____极。
3、水中含有哪些离子:___________。通电时它们各自朝哪个极移动?
4、根据阴极、阳极的产物,尝试书写电解水的电极方程式: 阴极:____________________________________ 发生_____反应 阳极:____________________________________ 发生_____反应
【阅读】教科书79—80页,回答:
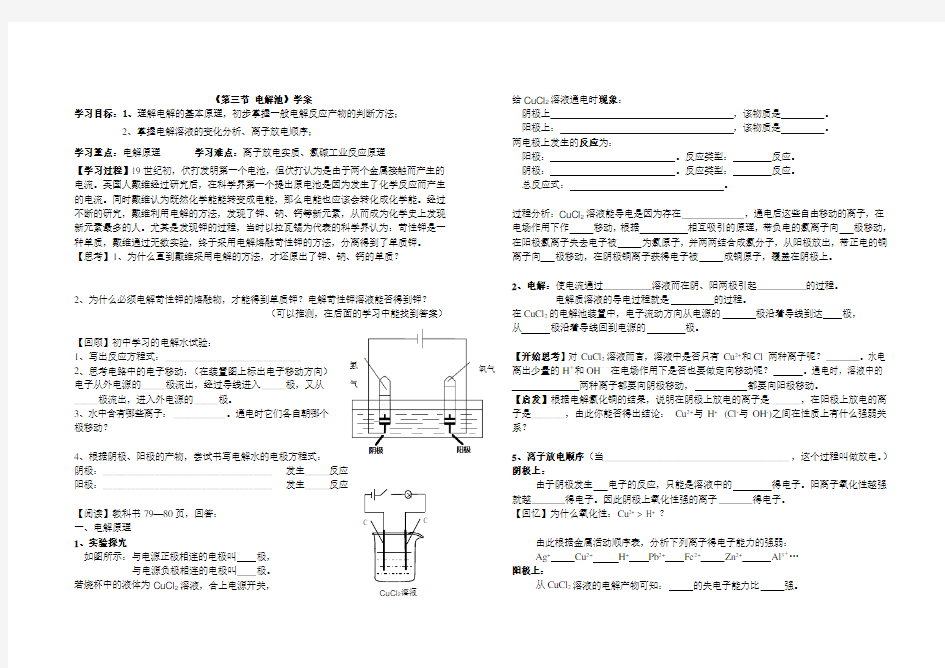
一、电解原理 1、实验探究
如图所示:与电源正极相连的电极叫 极,
与电源负极相连的电极叫 极。
若烧杯中的液体为CuCl 2溶液,合上电源开关,
给CuCl 2溶液通电时现象:
阴极上 ,该物质是 。 阳极上: ,该物质是 。 两电极上发生的反应为:
阳极: 。反应类型: 反应。 阴极: 。反应类型: 反应。 总反应式: 。
过程分析:CuCl 2溶液能导电是因为存在 ,通电后这些自由移动的离子,在电场作用下作 移动,根据 相互吸引的原理,带负电的氯离子向 极移动,在阳极氯离子失去电子被 为氯原子,并两两结合成氯分子,从阳极放出,带正电的铜离子向 极移动,在阴极铜离子获得电子被 成铜原子,覆盖在阴极上。
2、电解:使电流通过 溶液而在阴、阳两极引起 的过程。 电解质溶液的导电过程就是 的过程。
在CuCl 2的电解池装置中,电子流动方向从电源的 极沿着导线到达 极, 从 极沿着导线回到电源的 极。
【开始思考】对CuCl 2溶液而言,溶液中是否只有Cu 2+和Cl -
两种离子呢? 。水电
离出少量的H +和OH --
在电场作用下是否也要做定向移动呢? 。通电时,溶液中的 两种离子都要向阴极移动, 都要向阳极移动。
【启发】根据电解氯化铜的结果,说明在阴极上放电的离子是______,在阳极上放电的离子是_______,由此你能否得出结论: Cu 2+与H + (Cl -与OH -)之间在性质上有什么强弱关系?
5、离子放电顺序(当_______________________________________,这个过程叫做放电。) 阴极上:
由于阴极发生 电子的反应,只能是溶液中的 得电子。阳离子氧化性越强就越 得电子。因此阴极上氧化性强的离子 得电子。 【回忆】为什么氧化性:Cu 2+ > H + ?
由此根据金属活动顺序表,分析下列离子得电子能力的强弱:
Ag + Cu 2+ H + Pb 2+ Fe 2+ Zn 2+ Al 3+
… 阳极上:
从CuCl 2溶液的电解产物可知: 的失电子能力比 强。
CuCl 2溶液
练习:用惰性电极电解氯化钠饱和溶液,请你分析电极上离子放电的情况。书写: NaCl 溶液含有的离子:___________________
阴极反应: 阳极反应:
总方程式: ____________
电解一段时间后溶液的pH ,要把电解质溶液复原,应该加 。
【同理】推测电极上的放电离子,书写电解NaOH 溶液和HCl 溶液的电极方程式 1、NaOH 溶液
阴极: 阳极 总方程式: 电解质浓度 ,pH 2、HCl 溶液
阴极: 阳极 总方程式: 电解质浓度 ,pH
【填空】4、电极方程式的书写
①标出电极名称—阴极或阳极
②写出电极方程式:
阳极: ;反应类型: 反应。 阴极: ;反应类型: 反应。
阴、阳两极得失电子的总数要 ,总方程式可根据阴、阳两极的物质变化写出。
电解池练习题 1. 在原电池和电解池的电极上所发生的反应,同属氧化反应或同属还原反应的是 ( ) A .原电池正极和电解池阳极所发生的反应 B .原电池正极和电解池阴极所发生的 C .原电池负极和电解池阳极所发生的反应 D .原电池负极和电解池阴极所发生的反应 2.用石墨作电极,电解1 mol ·L -1
下列物质的溶液,溶液的pH 保持不变的是 ( ) A .HCl B .NaOH C .Na 2SO 4 D .NaCl
3、氢镍电池是近年开发出来的可充电电池,它可以取代会产生镉污染的镉镍电池。氢镍电
池的总反应式是NiO(OH)
H 2
1
2 2Ni(OH)。 根据此反应式判断,下列叙述中正确
的是:( ) A .电池放电时,电池负极周围溶液的pH 值不断增大 B .电池放电时,镍元素被氧化
C .电池充电时,氢元素被还原
D .电池放电时,H 2是负极
4.银锌电池广泛用作各种电子仪器的电源,它的充电和放电过程可以表示为2Ag+Zn(OH)
2
Ag 2O+Zn+H 2O ,在此电池放电时,负极上发生反应的物质是 ( ) A .Ag B .Zn(OH)2 C .Ag 2O D.Zn
5.用惰性电极电解M(NO 3)x的水溶液,当阴极上增重ag 时,在阳极上同时产生b L 氧气(标准状况),从而可知M 的相对原子质量是 ( )
A. b ax
4.22 B. b ax 2.11 C. b ax 6.5 D. b ax
5.2
6.用两支惰性电极插入500 mL AgNO 3溶液中,通电电解。当电解液的pH 从6.0变为3.0时(设电解时阴极没有氢气析出,且电解液在电解前后体积变化可以忽略),电极上析出银的质量大约是 ( )
A.27 mg
B.54 mg
C.108 mg
D.216 mg
7. 氢镍电池是近年来开发出来的可充电电池,它可以取代会产生镉污染的镉镍电池。氢镍电池的总反应式是:
根据此反应式判断,下列叙述中正确的是 ( ) (A )电池放电时,电池负极周围溶液的pH 不断增大
(B )电池放电时,镍元素被氧化 (C )电池充电时,氢元素被还原
8.电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a ;X 、Y 是两块电极板,通过导线与直流电源相连。请回答以下问题: (1)若X 、Y 都是惰性电极,a 是饱和NaCl 溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X 极上的电极反应式为 。在X 极附近观察到的实验现象是 。
②Y 电极上的电极反应式为 。检验该电极反应产物的方法是 。