
《无机化学》教学大纲
课程编码课程名称:无机化学
学分:学时: 144
说明
一、课程的地位、作用及目的
无机化学是高等院校化学系各专业的第一门必修基础课程。它对于学
生的专业课程学习起着承先启后的作用。该课程的讲授内容,既要立足于
中学化学知识,又要为化学各专业后继课程准备必需的基础知识。
本课程的目的,是通过理论教学和实践教学,使学生掌握无机化学的
基础知识,了解研究无机化学的一般方法和学科发展的动态,培养学生基
本的实验技能和建立科学的思维方法。
二、课程教学的基本要求
本课程的教学环节包括课堂讲授,学生自学,讨论课、实验、习题、
答疑和期中、期末考试。通过本课程的学习使学生掌握物质结构、元素周
期律、化学热力学、化学平衡(酸碱平衡、沉淀溶解平衡、?氧化还原平衡,配合离解平衡)和化学反应速率等基本概念和基本理论知识;理解和掌握重
要元素及其化合物的结构、性质、反应规律和用途,训练和培养学生科学
思维能力和分析问题解决问题的能力,指导学生掌握正确的学习方法和初
步的科学研究方法,帮助学生树立辨证唯物主义观点;为后继课程的学习
打下坚实的基础。
三、教学方法、手段的建议
教师要运用启发式教学方法,注重在教学中实践“以学生为主体,以
教师为主导”的素质教育指导思想,充分运用多媒体教学、网络教学等多
元化、全方位的教学手段,努力提高教学质量。
四、考核方式
本课程分两学期讲授,第一学期讲授化学基础理论,第二学期讲授元素化学,每学期考核一次,考核成绩由平时成绩20%+期末考试(闭卷)成绩80%组成。
五、建议学时分配(共计144学时)
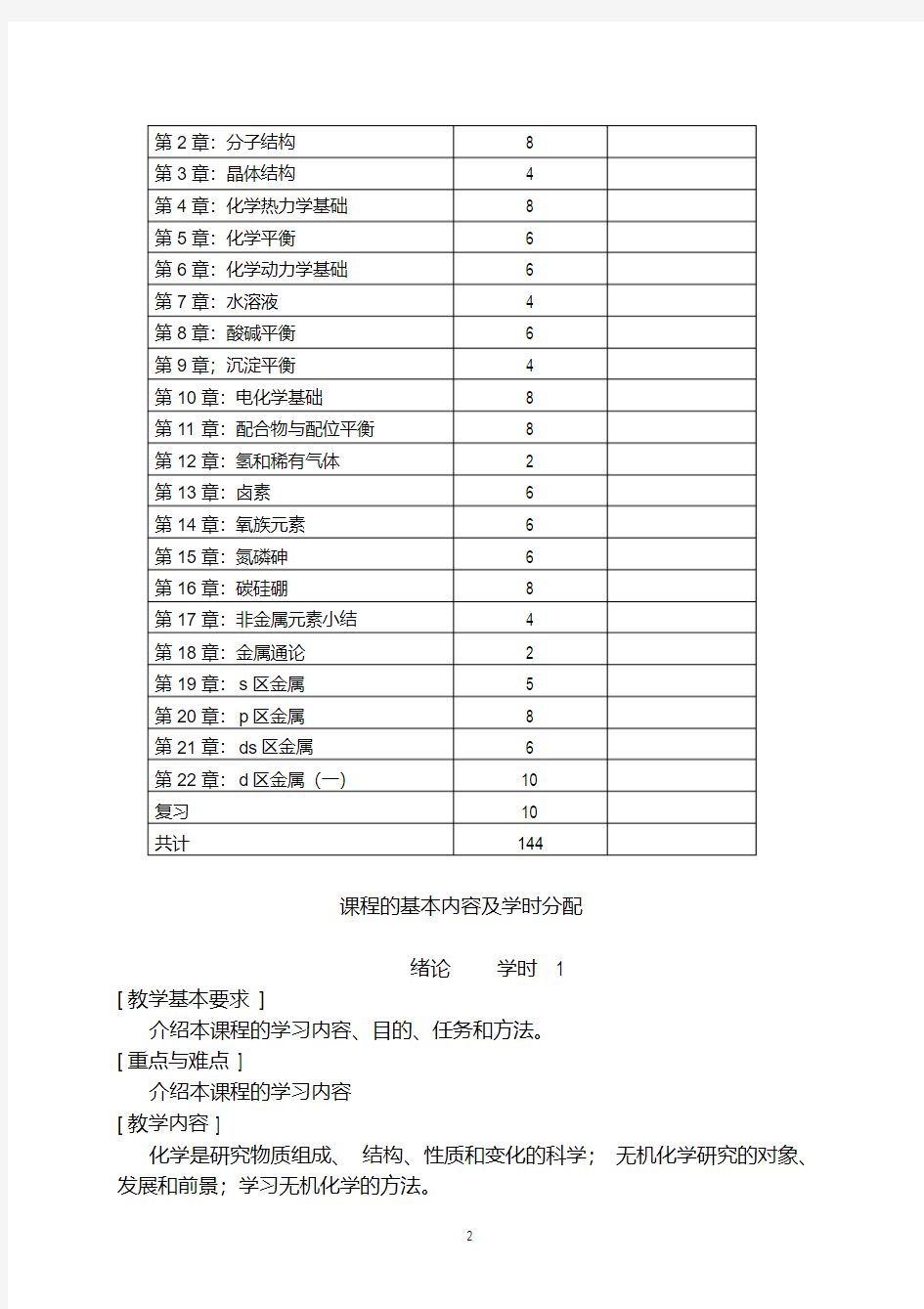
教学内容讲课学时备注
绪论 1
第1章:原子结构与元素周期系8
第2章:分子结构8
第3章:晶体结构 4
第4章:化学热力学基础8
第5章:化学平衡 6
第6章:化学动力学基础 6
第7章:水溶液 4
第8章:酸碱平衡 6
第9章;沉淀平衡 4
第10章:电化学基础8
第11章:配合物与配位平衡8
第12章:氢和稀有气体 2
第13章:卤素 6
第14章:氧族元素 6
第15章:氮磷砷 6
第16章:碳硅硼8
第17章:非金属元素小结 4
第18章:金属通论 2
第19章:s区金属 5
第20章:p区金属8
第21章:ds区金属 6
第22章:d区金属(一)10
复习10
共计144
课程的基本内容及学时分配
绪论学时 1
[教学基本要求]
介绍本课程的学习内容、目的、任务和方法。
[重点与难点]
介绍本课程的学习内容
[教学内容]
化学是研究物质组成、结构、性质和变化的科学;无机化学研究的对象、发展和前景;学习无机化学的方法。
第1章原子结构和元素周期律学时 8
[教学基本要求]
掌握氢原子光谱,玻尔原子模型;了解核外电子运动的特殊性,理解
波函数和电子云图形;掌握电子层、电子亚层、能级、能级组、电子云、
原子轨道等概念,理解四个量子数的量子化条件及其物理意义;掌握近似
能级图,按照核外电子排布原理,写出一般元素的原子电子构型;理解原
子结构与元素周期律间的关系;掌握各类元素电子构型的特征;掌握电离
能、电子亲合能、电负性等概念,了解它们与原子结构的关系;通过了解
人类对原子结构的认识历史,培养科学的思维方法。
[重点与难点]
重点:波函数和原子轨道,四个量子数,波函数的径向分布图和角度分
布图,几率密度和电子云,电子云角度分布图。
难点:波函数的径向分布图和角度分布图,几率密度和电子云,电子云
角度分布图。
[教学内容]
元素、原子序数和元素符号,核素、同位素;相对原子质量:原子质量
和平均原子质量,相对原子质量测定方法;相对分子质量和式量;电子发
现、卢瑟福原子模型、爱因斯坦光子学说、核外电子运动的量子化特征;
氢原子光谱,玻尔理论,能级概念;核外电子运动的波粒二象性,德布罗
意关系式,海森堡测不准原理;核外电子运动状态的描述:薜定谔方程(只简单介绍公式),波函数和原子轨道,四个量子数,波函数的径向分布图和
角度分布图,几率密度和电子云,电子云角度分布图和几率径向分布图;
基态原子电子组态:屏蔽效应,钻穿效应,近似能级图,电子层与电子亚
层,构造原理;原子核外电子排布规律;原子结构与元素周期系的关系:
元素性质的周期性;元素周期表:长周期与短周期、主族与副族,原子的
电子构型与元素的区分;元素性质及其变化的周期性:原子半径、电离能、
电子亲合能、电负性、氧化态;元素的金属性和非金属性变化规律。
第2章分子结构学时 8
[教学基本要求]
掌握离子键和共价键理论的基本内容;理解物质性质与其分子结构的关系;定性了解同核双原子分子的分子轨道理论;掌握化学键、分子间力和
氢键的概念、特征,搞清价键力、分子间力和氢键的区别。
[重点与难点]
重点:共价键理论,杂化轨道理论。
难点:杂化轨道理论,共轭大π键。
[教学内容]
离子键理论:离子键的形成及其能量变化,离子键的特征与本质,晶格能,单键的离子性百分数;共价键理论:经典共价键理论(电子配对法),路易斯结构式;现代价键理论:共价键的饱和性和方向性;σ键和π键;
价层电子互斥模型(VSEPR);杂化轨道理论要点;SP、Sp2、sp3杂化;等性杂化和不等性杂化;共轭大π键;等电子体原理;分子轨道理论:分子轨
道的含义,分子轨道的形成,组成分子轨道三原则(对称性原则,最大重叠原则和能量近似原则),成键轨道和反键轨道,简单双原子分子轨道能级图,分子轨道中的电子排布,键级;化学键类型;化学键参数:键能、键长、
键角、键的性质;分子的性质:极性分子和非极性分子;分子偶极矩,分
子的磁性;分子间力和氢键:范德华力(取向力、诱导力、色散力)及其特点;氢键的形成与本质,氢键的方向性和饱和性;分子间力和氢键对物质
性质的影响。
第3章晶体结构学时 4
[教学基本要求]
掌握各类晶体的特征;掌握晶体类型与物质性质的关系;掌握晶格能
和原子化热的概念及有关应用;理解离子极化概念及其应用;了解原子半
径、离子半径的定义及其对化合物性质的影响。
[重点与难点]
重点:晶胞基本特征,离子晶体及结构模型。
难点:离子的极化作用和变形性,离子的极化率,金属晶体的紧密堆积模
型。
[教学内容]
晶体特征:晶体、晶系、晶格(简单立方、面心立方、体心立方)、晶胞,晶体的各向异性,晶胞中原子的坐标与计数,素晶胞与复晶胞;离子
晶体:离子晶体的特征,离子晶体结构模型(NaCl型、CsCl型、ZnS型、CaF2型TiO2型);离子半径,晶格中离子配位数与离子半径比之间的关系;离子
电荷与构型,离子的极化作用与变形性,离子的极化率,离子极化对化合
物键型和化合物性质的影响;分子晶体(干冰和水);原子晶体(金刚石和石墨);同质多晶现象和类质同晶现象;金属键和过渡键型:金属原子化热,
金属键的形成和特征,自由电子,能带理论;金属晶体:金属晶体的特征,
金属晶体的堆积模型(面心、体心、?六方堆积);原子半径(范德华半径、共价半径、金属半径)。
第4章化学热力学基础学时 8
[教学基本要求]
掌握状态和状态函数,焓和焓变的概念,自由能和熵及它们的变化的
初步概念。会应用盖斯定律进行计算。会从物质的热力学函数表中查Δf H0、Δf G0和S0,并用于计算在标准状态时反应的焓变、自由能变和熵变;初步
学会用自由能变化来判断化学反应的方向;理解化学反应等温式的含义,
会应用其求算Δr G和平衡常数K;根据吉布斯-亥姆霍兹公式理解ΔG与ΔH及ΔS的关系,会判断反应方向并能分析温度对化学反应自发性的影响。
[重点与难点]
重点:热力学第一定律和热化学:焓、焓变、反应热、恒容和恒压反应
热;热化学方程式,盖斯定律及其应用;吉布斯-亥姆霍兹公式:ΔG=ΔH - TΔS公式,化学反应等温式。
难点:热化学方程式,盖斯定律及其应用;熵、自由能;吉布斯-亥姆
霍兹公式:ΔG=ΔH - TΔS公式。
[教学内容]
热力学常用术语:系统(体系)与环境、系统的性质和状态函数;物
质的量;摩尔和摩尔质量;浓度(物质的量浓度、质量分数、体积分数、
质量浓度等)及其换算;气体:气体状态方程,分压定律和扩散定律;气
态物质分子量的测定;液体的蒸气压、沸点,克劳修斯-克拉贝龙方程;热力学第一定律和热化学:焓、焓变、反应热、恒容和恒压反应热;热化学
方程式,盖斯定律及其应用;标准状态,生成热,溶解热,水合热及其应
用;化学反应的方向:反应的自发性;混乱度和熵,熵变,标准熵;吉布
斯自由能,自由能变和标准生成自由能;化学反应等温式;吉布斯-亥姆
霍兹公式;?温度对自由能变化影响的分析;热力学分解温度。
第5章化学平衡学时 6
[教学基本要求]
掌握化学平衡的概念,理解平衡常数的意义;掌握有关化学平衡的计
算;熟悉有关化学平衡移动原理及其应用。
[重点与难点]
重点:化学平衡常数
难点:有关化学平衡常数的计算
[教学内容]
可逆反应和化学平衡,化学平衡的意义;标准平衡常数和实验平衡常
数;化学平衡定律,K c与K p的关系,多重平衡规则;化学平衡的移动:浓度、压力、温度对化学平衡的影响;勒夏特里原理。
第6章化学动力学基础学时 6
[教学基本要求]
掌握化学反应速率的概念及反应速率的实验测定;了解基元反应、复
杂反应、反应级数、反应分子数的概念;掌握浓度、温度及催化剂对反应
速率的影响;了解速率方程的实验测定和阿累尼乌斯公式的有关计算;初
步了解活化能的概念及其与反应速率的关系。
[重点与难点]
重点:速率方程和速率常数,反应级数及其测定;反应机理,基元反应
和复杂反应,反应分子数;质量作用定律,反应速率规律与反应机理的关
系。
难点:速率方程和速率常数,反应级数及其测定;阿累尼乌斯公式的有
关计算。
[教学内容]
化学反应速率的表示法,平均速率和瞬时速率;化学反应速率的实验
测定;反应进度;浓度对化学反应速率的影响:速率方程和速率常数,反
应级数及其测定;反应机理,基元反应和复杂反应,反应分子数;质量作
用定律;由反应机理推导实验速率方程;温度对化学反应速率的影响:阿
累尼乌斯公式,活化能和活化分子;碰撞理论和过渡态理论;催化剂对化
学反应速率的影响。
第7章水溶液学时 4
[教学基本要求]
熟练掌握溶液的浓度和溶解度的概念和有关计算,理解非电解质稀溶液
通性并掌握有关计算,了解表观电离度,活度系数、离子强度及相互关系。[重点与难点]
重点:溶液的浓度和溶解度,非电解质稀溶液通性。
难点:溶液的渗透压及有关计算
[教学内容]
溶液的浓度和溶解度,相似相溶原理;非电解质稀溶液通性:溶液的
蒸气压下降—拉乌尔定律,溶液的凝固点下降,溶液的沸点上升,溶液的
渗透压,稀溶液的依数性;阿累尼乌斯的电离理论,强电解质溶液,表观
电离度,活度系数、离子强度及相互关系。
第8章酸碱平衡学时 8
[教学基本要求]
了解酸碱理论发展的概况,掌握酸碱的质子理论;掌握溶液酸度的概
念和pH值的意义,熟悉pH与氢离子浓度的相互换算。了解溶液pH的近似测定。了解拉平效应和区分效应;能应用化学平衡原理分析水、弱酸、弱
碱的电离平衡;掌握同离子效应、盐效应等影响电离平衡移动的因素;熟
练掌握有关离子浓度的计算;理解缓冲溶液的组成;缓冲作用原理;缓冲
溶液的性质。掌握缓冲溶液pH值的计算;了解各种盐类水解平衡的情况和
盐溶液pH值的计算;
[重点与难点]
重点:一元弱酸弱碱的电离平衡,缓冲溶液,
难点:一元弱酸弱碱的电离平衡,缓冲溶液
[教学内容]
布朗斯特的酸碱质子理论,路易斯的电子论;溶液酸碱性:水的电离及
离子积常数,溶液的酸度,pH值;电解质的电离:一元弱酸弱碱的电离平衡,电离常数,解离度,稀释公式;拉平效应和区分效应;多元弱酸和多
元碱的电离;同离子效应;缓冲溶液及其pH值的计算方法,缓冲溶液的选择与配制,生物体内的缓冲作用;盐类水解:水解常数和水解度,盐溶液
pH值的计算,多元弱酸盐和多元弱碱盐的水解(分步水解),盐类水解的实质和影响水解平衡的因素;
第9章沉淀平衡学时 4
[教学基本要求]
掌握K sp的意义及溶度积规则;掌握沉淀生成,溶解或转化的条件;?熟悉有关溶度积常数的计算。
[重点与难点]
重点:沉淀的生成与溶解
难点:溶度积规则及应用
[教学内容]
沉淀溶解平衡:溶度积常数,溶度积和溶解度,溶度积原理(规则),同离子效应和盐效应;沉淀的生成;沉淀的溶解;分步沉淀;沉淀的转化;
有关溶度积一些应用和计算。
第10章电化学基础学时 8
[教学基本要求]
牢固掌握氧化还原反应的基本概念,熟练掌握氧化还原反应的配平方
法;理解电极电势的意义,能运用标准电极电势来判断氧化剂和还原剂的
强弱,氧化还原反应的方向和计算平衡常数;会用能斯特方程式来讨论离
子浓度改变时对电极电势和氧化还原反应的影响,以及介质的酸度对氧化
还原反应的影响,并能进行简单的计算;了解电能和化学能互变的规律,
掌握有关电池和电解池的一些概念(?正极,负极,阴极,阳极),?认识原电池和电解池的作用机理及电解产物析出的一般规律。
[重点与难点]
重点:氧化还原反应方程式的配平,标准电极电势。
难点:能斯特方程的应用,pH电势图及其应用。
[教学内容]
氧化还原反应的基本概念:氧化还原反应,氧化和还原,氧化剂和还
原剂;氧化数(氧化值、氧化态),氧化还原半反应式,氧化还原反应方程
式的配平(氧化数法,离子电子法);原电池和电极电势:原电池(组成、电极反应、电池反应、表示方法),电极电势(形成机理、影响因素);标准电极电势:标准氢电极,标准电极电势;标准电极电势的应用(?判断氧化剂和还原剂的强弱,判断氧化还原反应的方向,计算平衡常数,标准电极电
势应用的条件);电动势;影响电极电势的因素:能斯特方程,能斯特方程
的应用(离子浓度和介质的酸度对电极电势及氧化还原反应的影响等);pH 电势图、元素电势图及其应用;化学电源和电解:化学电源(干电池,燃料电池,铅蓄电池)简单介绍;原电池和电解池,电解原理。
第11章配合物与配位平衡学时 8
[教学基本要求]
掌握配合物的基本概念和配位键的本质;能应用配合物价键理论解释一
些实例;了解螯合物的特征;掌握配合物稳定常数的意义和应用,能熟练
进行有关计算;了解配合物形成时的性质变化。
[重点与难点]
重点:配合物的基本概念,配合物的稳定性。
难点:有关稳定常数的计算。
[教学内容]
配合物的基本概念:定义、组成、配位数、命名;配合物的异构现象
(结构异构、几何异构、对映异构);配合物的价键理论:价键理论(配位键的本质,?中心原子的杂化轨道和配离子的空间构型,高自旋和低自旋配
合物,离域π键,电中性原理),?价键理论的应用和局限性;配合物的晶
体场理论:中心离子 d 轨道分裂(八面体场、四面体场),分裂能及其影响因素;晶体场稳定化能;晶体场理论对配合物颜色、磁性、水合热等变化
规律的解释;配合物的稳定性:稳定常数,逐级稳定常数;稳定常数的应用(判断反应的方向,计算配位平衡体系各物质的浓度,讨论难溶盐的生成和
溶解的可能性);影响配合物在溶液中的稳定性的因素;配合物形成时物质
性质的变化:颜色、溶解度、电极电势、酸碱性等变化;螯合剂──乙二
胺、EDTA等;配合物的重要应用;生命元素。
第12章氢希有气体学时 2
[教学基本要求]
掌握氢的物理性质和化学性质;了解希有气体发现史;了解希有气体
的性质,用途,存在以及从液态空气中分离它们的方法;了解希有气体化
合物的性质和结构特点。
[重点与难点]
重点:氢化物,希有气体化合物的性质和结构。
难点:希有气体化合物的性质和结构
[教学内容]
氢:氢的发现、存在与物理性质;氢的同位素(11H, 21H, 31H),?正氢和仲氢;氢的化学性质,氢化物(共价型、离子型、金属型);氢能源;希有气体:希有气体发现史;希有气体原子结构,性质和用途,希有气体的存
在和从空气分离它们的方法;稀有气体化合物;
第13章卤素学时 6
[教学基本要求]
掌握卤素及其重要化合物的结构、性质、制备和用途,卤素的通性和
特性;熟悉卤素单质和次卤酸及其盐发生歧化反应的条件和递变规律;能
较熟练地用元素电势图判断卤素及其化合物各氧化态间的转化关系;了解
拟卤素,多卤化物和卤素互化物。
[重点与难点]
重点:氢卤酸,卤素含氧酸盐。
难点:含氧酸盐的氧化性、稳定性、酸性等变化规律
[教学内容]
卤素通性:卤素的存在,原子结构特点,成键特征,氧化态;卤素单质:物理性质,化学性质,制备和用途;卤化氢和氢卤酸:制备、性质和用途;
氟化氢的特殊性;卤化物,卤素互化物,多卤化物;卤素元素电势图;歧
化反应;卤素的含氧化合物:卤素的氧化物,卤素的含氧酸(次卤酸、?亚卤酸、卤酸、高卤酸)及其盐的氧化性、稳定性、酸性及其变化规律;卤素
含氧酸根离子的结构;拟卤素:拟卤素和卤素性质的对比;氰、氢氰酸和
氰化物;硫氰和硫氰酸盐。
第14章氧族元素学时 6
[教学基本要求]
熟悉氧化物的分类;掌握氧、臭氧、氧化物及过氧化物的结构和性质;
掌握硫的氢化物、氧化物、重要的含氧酸及其盐的结构、性质、制备和用
途;一般了解硒和碲。
[重点与难点]
重点:过氧化氢,硫的含氧酸及其盐。
难点:硫的含氧酸及其盐的结构和性质
[教学内容]
氧族元素的通性,氧族存在,氧族元素的电势图;氧和臭氧:氧的成
键特征和价键结构;单线态氧及其性质;氧化物(?酸碱性和两性);臭氧(存在、结构、性质和在自然界中的作用);过氧化氢:结构、制备、性质和用途;硫及其化合物:硫的同素异形体,硫化物和多硫化物,硫的含氧化合
物(二氧化硫、亚硫酸及其盐、三氧化硫、硫酸及其盐、硫代硫酸钠、?连二亚硫酸钠、焦硫酸及其盐、过硫酸及其盐、连多硫酸);硫的其它化合物(二氯化二硫、卤磺酸);硒和碲:硒和碲的同素异形体,氢化物,氧化物
和含氧酸及其盐。
第15章氮磷砷学时 6
[教学基本要求]
熟悉氮在本族元素中的特殊性;掌握氮、磷以及它们的氢化物,含氧
酸及其盐的结构、性质、制备和用途;熟悉本族元素及其化合物的主要氧
化态间的转化关系及递变规律。
[重点与难点]
重点:氨、铵盐、氨的衍生物;氮含氧酸及其盐。磷的含氧酸盐
难点:氮、磷各氧化态的氧化还原性
[教学内容]
氮族元素的通性:原子结构特点,成键特征,氧化态,氮磷砷的电势
图;氮及其化合物:氮的存在,氮气的结构、性质、制备和用途;氮的固
定;氮的氢化物(氨、铵盐、氨的衍生物);氮的含氧化合物(氧化物、?含氧酸及其盐);磷及其化合物:单质磷(存在、结构、性质、同素异形体、制备和用途),磷的化合物(氢化物、卤化物、硫化物、氧化物、含氧酸及
其盐);砷:单质、氢化物、卤化物,氧化物及其水合物,硫化物和硫代酸盐。
第16章碳硅硼学时 8
[教学基本要求]
掌握碳、硅、硼的单质、氢化物、卤化物、氧化物、含氧酸及其盐的
结构和性质;通过硼及其化合物的结构和性质,熟悉硼的缺电子性以及它
的成键特征;认识碳、硅、硼之间的相似性和差异性;了解硅酸和硅酸盐
的结构与特性。
[重点与难点]
重点:碳酸盐的溶解性、水解性和热稳定性,硅烷,硼烷,硼的含氧酸
及其盐。
难点:硼化合物的结构
[教学内容]
碳、硅、硼的存在,原子结构,成键特征,氧化态;碳及其化合物:
碳的同素异形体(金刚石、石墨、无定形碳、C60),碳的性质和用途,活性炭的吸附和脱色作用;碳的化合物(一氧化碳、二氧化碳、碳酸及其盐、碳的硫化物和卤化物);硅及其化合物:单质硅的性质、制备和用途;硅烷、
硅的卤化物和氟硅酸盐、硅的含氧化合物(二氧化硅、硅酸、硅胶和硅酸盐,分子筛);硼及其化合物:单质硼的存在、结构、性质、制备和用途;硼的
化合物(?乙硼烷、硼氢配合物、卤化硼、氟硼酸、三氧化二硼、硼酸及其盐);三中心二电子键;硼、硅的性质相似性;碳化物、硅化物、硼化物:
离子型化合物、金属型化合物、共价型化合物。
第17章非金属元素小结学时 4
[教学基本要求]
根据元素在周期表中的位置及原子结构的特点,理解和掌握非金属元
素单质及其重要化合物的结构、性质及其变化规律;培养学生归纳、演绎、
综合、概括的科学思维能力和分析解决问题的能力。
[重点与难点]
重点:氢氧化物的酸碱性及其规律;含氧阴离子的结构及其规律;含氧
酸的强度及其规律,非金属含氧酸盐的溶解性、水解性、热稳定性、氧化
还原性及其规律。
难点:含氧酸的强度及其规律,含氧酸盐的溶解性、水解性、热稳定性、
氧化还原性及其规律。
[教学内容]
非金属单质的结构和性质;分子型氢化物性质(热稳定性、还原性、
水溶液酸碱性和无氧酸的强度);非金属含氧酸:氢氧化物的酸碱性及其规律;含氧阴离子的结构及其规律;含氧酸的强度及其规律;非金属含氧酸
盐的溶解性、水解性、热稳定性、氧化还原性及其规律;P区元素的次级周期性。
第18章金属通论学时 2
[教学基本要求]
了解金属结构和性质;掌握一般的金属冶炼及精练方法,并能用热力
学函数Δf G°判断金属从其化合物中被还原的可能性和难易程度;了解合金的基本类型和性质。
[重点与难点]
重点:金属的物理性质,化学性质,提炼方法。
难点:用热力学函数Δf G°判断金属从其化合物中被还原的可能性和难易
程度。
[教学内容]
金属元素概述;金属的物理性质:金属光泽,导电导热性,延展性,
密度,硬度,熔点;金属的化学性质:与非金属反应,与水、酸、碱、配
位体反应,金属活泼顺序;金属的提炼:提炼方法(热分解法,热还原法,
电解法);金属还原过程的热力学;金属精炼的方法(电解精炼,气相精炼,区域熔炼);合金:低共熔物,金属固溶体,金属化合物。
第19章 s区金属学时 5
[教学基本要求]
掌握碱金属和碱土金属的存在、单质的性质、制备、用途;掌握碱金
属和碱土金属氧化物的类型、结构、性质和用途;掌握碱金属和碱土金属
氢化物、氢氧化物、盐类的溶解性、酸碱性、热稳定性、氧化还原性等的
变化规律;通过对比锂、镁的相似性等了解对角线规则。
[重点与难点]
重点:碱金属和碱土金属的冶炼方法,单质及重要化合物的结构和性质。
难点:氧化物的结构和性质
[教学内容]
碱金属和碱土金属的通性:原子结构,原子半径和离子半径,电离能,
水化能,氧化态等;碱金属和碱土金属单质:存在和制备(电解熔盐法,热还原法,?金属置换法,热分解法);单质的物理和化学性质;碱金属和碱
土金属的化合物:氧化物(普通氧化物、过氧化物、超氧化物);氢氧化物(溶解性、碱性);氢化物(制备、还原性以及应用);盐类的性质(溶解性、焰色反应、形成结晶水合物、形成复盐、热稳定性),常见重要盐(氯化物、硫化物、碳酸盐、硝酸盐、硫酸盐);配位化合物;对角线规则(Li-Mg, Be-Al, B-Si)。
第20章 p区金属学时 8
[教学基本要求]
掌握铝、锡、铅、锑、铋单质及其重要化合物的性质和用途;了解化
合物性质变化规律;理解铝的冶炼原理和方法;了解p区金属6s2电子的稳定性。
[重点与难点]
重点:铝和氢氧化铝,铝盐和铝酸盐,金属铝的冶炼,锡、铅、锑、铋
重要化合物。
难点:锗分族、砷分族元素及其化合物性质变化规律
[教学内容]
元素的自然存在和基本性质;铝镓分族元素:铝的冶炼原理;铝的性
质(亲氧性、两性);氧化铝和氢氧化铝;铝盐和铝酸盐;铝的卤化物和硫
酸盐(AlCl3,?硫酸铝和明矾);铝和铍的相似性;锗分族:锗、锡、铅的冶炼、性质和用途;氧化物和氢氧化物(溶解性、酸碱性和氧化还原性);卤化物、硫化物、铅的含氧酸盐(溶解性、水解性、酸碱性和氧化还原性)。砷分族:锑、铋的存在、冶炼、性质和用途;氢化物、氧化物及其水合物
(酸碱性和氧化还原性);卤化物、硫化物(颜色、溶解性、水解性、酸碱
性和氧化还原性);p区金属6s2电子的稳定性。
第21章 ds区金属学时 6
[教学基本要求]
掌握铜、银、锌、汞单质的性质和用途;掌握铜、银、锌、汞的氧化物、
氢氧化物及其重要盐类的性质;掌握Cu(Ⅰ)、Cu(Ⅱ);Hg(Ⅰ)、Hg(Ⅱ)之间的相互转化;掌握ⅠA和ⅠB;ⅡA和ⅡB族元素的性质对比。
[重点与难点]
重点:铜化合物、银的化合物、Hg22+和Hg2+的相互转化;锌族配合物。
难点:Cu(Ⅰ)、Cu(Ⅱ);Hg(Ⅰ)、Hg(Ⅱ)之间的相互转化。
[教学内容]
铜族元素的通性:单质的冶炼、性质和用途;铜化合物(+1价态化合物──氧化物、卤化物、硫化物、配合物,+2价态化合物──氧化铜和氢氧化铜、卤化铜、硫酸铜、硝酸铜、?硫化铜,配合物),Cu(Ⅰ)和Cu(Ⅱ)的相互转化;银的化合物(氧化银、硝酸银、卤化银、配合物);三氯化金;IB族元素和IA族元素的性质对比;锌族元素的通性:单质的存在和冶炼、
性质和用途;锌族元素主要化合物:氧化物和氢氧化物,硫化物,氯化物;
Hg22+和Hg2+的相互转化;配合物;含镉、汞废水的处理;IIB族元素与IIA 族元素的性质对比。
第22章 d区金属(一)学时 10
[教学基本要求]
掌握过渡元素的结构特点;掌握重要过渡元素钛、钒、铬、锰、铁的单
质及重要化合物的性质和用途;了解重要金属的冶炼原理。
[重点与难点]
重点:过渡元素的通性、第一过渡系元素的含氧酸盐和配合物性质。
难点:铁、钴、镍的配合物
[教学内容]
过渡元素的通性:金属性质(价电子构型,氧化态,原子和离子半径,
电离能,电负性,原子化焓);单质的性质,氧化物及水合物的酸碱性,各
元素不同氧化态化合物氧化还原稳定性,配位性,水合离子和含氧酸根的
颜色,磁性及催化性;第一过渡系重要金属存在、发现、冶炼、性质、用
途;钛(Ⅳ)化合物(?二氧化钛、四氯化钛、); ?钛(Ⅲ)化合物(三氯化钛、硫酸钛);钛的鉴定;存在、冶炼、性质、用途;钒化合物的颜色,五氧化
二钒,钒酸盐与多钒酸盐;钒的鉴定;存在、性质、用途;铬概述,铬(Ⅲ)、(Ⅵ)的化合物(?氧化物和氢氧化物、铬酸盐、亚铬酸盐和重铬酸盐);锰概述,锰的自由能-氧化态图;锰(Ⅱ)、(Ⅳ)、(Ⅵ)、(Ⅶ)化合物(氧化物和氢氧化物,锰(Ⅱ)盐、?二氧化锰、锰酸盐和高锰酸盐);铁系元素的基本性质,铁、钴、镍的重要化合物(氧化物和氢氧化物,硫酸盐,卤化物,
配合物等)。
教材及主要参考书
[1] 北师大等校编.无机化学(上、下册).高等教育出版社.2003年第四版
[2] 武汉大学等校编.无机化学(上、下册).高等教育出版社.1994年第三版
[3] 金若水等.现代化学原理(上、下).高等教育出版社.2003年8月
[4] 大连理工大学无机教研室.无机化学.高等教育出版社.2001年第四版
[5] 唐宗薰.中级无机化学.高等教育出版社.2003年5月
[6] 庞锡涛.无机化学(上、下册).高等教育出版社.1995年5月
[7] 杨德壬.无机化学(上、下册).高等教育出版社.1989年1月
[8] 赵继周.高等无机化学.北京师范大学出版社.1987年7月
[9] 华东师范大学.无机化学.华东师范大学出版社.1992年6月
[10] 王志林等.无机化学学习指导.科学出版社.2002年5月
[11] 刘新锦等.无机元素化学.科学出版社.2005年1月
[12] 北京大学.大学基础化学.高等教育出版社.2003年6月
[13] 徐家宁.无机化学例题与习题.高等教育出版社.2000年3月
[14] 陈寿椿.重要无机化学反应.上海科学出版社.1982年7月
[15]关鲁雄.高等无机化学. 高等教育出版社.2004年
[16]Gary L.Miessler and Donald A.Tarr《Inorganic Chemistry》 Third Edition, Pearson Education Asia Limited and Higher Education Press(2004).
主要网络教学资源:
吉林大学无机化学精品课程网站:
https://www.doczj.com/doc/db15669742.html,/eclass/zyjck/inorchem/about.htm
北京大学无机化学教学网站:https://www.doczj.com/doc/db15669742.html,/wuji/
《中药学》课程教学大纲 (供中医专业五年制使用) 课程名称:中药学 学时:108(90/18) 学分:6 一、课程的性质与目的 中药学是研究中药的基本理论和临床应用的学科。本课程授课对象为中医学专业五年制学生。本课程是中医药各专业的专业基础课,通过本课程的教学,使学生掌握中药的基本理论和常用中药的性能、功效、应用等理论知识及技能,为学习方剂学及中医药各专业课奠定基础。 学习本课程的理论知识和技能要求如下: (1)掌握“中药”、“本草”、“中药学”的含义,性味、归经、升降浮沉、毒性、炮制目的、配伍关系、用药禁忌等中药学基本理论知识。 熟悉本学科的发展概况、主要的炮制方法、用量、用法。 了解中药的起源、产地、采集及其它炮制方法。 (2)掌握133种常用中药的分类、药性特点、功效、主治、配伍(指基本配伍规律和特殊意义者)及某些特殊方法;了解其来源(指同一药味因品种来源不同而效用有异者);某些特殊的炮制意义、用量、用法及使用注意。 熟悉93种常用药物的分类、功效和主要应用、某些特殊用法及使用注意。 了解97种常用药物的功效、特殊用法及使用注意事项。 余药仅作参考,学生以课外自学为主。附药视具体情况由任课教师作具体要求。 (3)具备识别常用中药饮片的一般知识。 二、教学的内容与要求
总论 第一章中药的起源和中药学的发展(2学时) 掌握中药学的概念;了解中药的起源和中药学的发展概况,其中重点了解各个时期学术发展特点及主要本草著作。 重点:历代本草代表作的书名、作者、成书年代、载药数目、分类、主要内容及学术价值。 第二章中药的产地与采集(1学时) 了解中药的产地与药效的关系,以及在保证药效的前提下如何发展道地药材生产以适应临床用药的需要;了解植物药采集季节与药效的关系,以及不同药用部位的一般采收原则。 重点:形成道地药材的原因,如何正确理解道地药材的涵义。 第三章中药的炮制(1学时) 掌握中药炮制的目的;熟悉常用或特殊的炮制方法;了解其余的炮制方法。 重点:中药炮制的目的,现代常用炮制法分类。 第四章药性理论(5学时) 掌握中药药性理论的概念及中药治病的基本原理;掌握四气的概念,所表示药物的作用,及其对临床的指导意义;掌握五味的概念,所表示药物的作用,气与味的综合效应;掌握升降浮沉的概念,升浮与沉降的不同作用,升降浮沉与药物性味的关系,影响升降浮沉的因素,及其对临床用药的指导意义;掌握归经的概念,归经理论对临床用药的指导意义;掌握为什么必须把四气、五味、升降浮沉、归经结合起来全面分析,才能准确地掌握药性;掌握毒性的概念,引起中毒的原因及解救方法,应用有毒药物的注意事项。 第五章中药的配伍(1学时) 掌握中药配伍的目的,药物“七情”及各种配伍关系的含义,配伍用药原则。
《无机化学实验》教学大纲(本科) 一、课程目标 无机化学实验是师范本科学院化学专业学生必修的基础课程。 通过教学,应使学生: 1、熟悉无机化学实验的基本知识,掌握无机化学基本操作技能(见后); 2、掌握常见元素的单质和化合物的性质、制备和分离提纯方法,学会某些常数的测定方法; 3、培养学生正确观察、记录、分析总结、归纳实验现象,合理处理数据,绘制仪器装置图和撰写实验报告,查阅手册,设计和改进简单实验以及处理实验室一般事故等的能力。 4、培养学生辩证唯物主义世界观,实事求是的科学态度和严谨的作风,使学生的知识、能力、素质得到全面提高,为后续实验课程打好基础,为学生终身发展奠基。 二、教材、参考书 教材: 《无机化学实验》(第三版)北京师范大学化学系无机化学教研室编,高等教育出版社,1999年。 参考书:
1、《化学实验规范》北京师范大学1985年。 2、《实验无机化学》王致勇,连祥珍编著,清华大学出版社,1987 年。 3、《实验无机化学》沈君朴主编,天津大学出版社,1992年。 4、《无机化学实验》(第二版),中山大学等校,高等教育出版社 5、《重要无机化学反应》(第二版),陈寿椿,上海科技技术出版社,1982年。 三、教学时数及分配 本课程共108学时,可如下分配 综合设计实验8个24学时 考试6学时 其中: 基本操作实验10个29.5 % 基本理论方面实验8个23.5% 无机制备及性质实验8个23.5% 综合设计实验8个23.5% 四、大纲内容
实验一仪器的认领和洗涤、安全教育 1、明确无机化学实验的目的和要求。 2、认领无机化学实验常用仪器,熟悉其名称、规格,了解 使用注意事项。 3、练习常用仪器的洗涤和干燥方法。 4、了解实验室的规章制度、安全操作和常见事故的处理方法。 实验二灯的使用和玻璃管的简单加工 1、了解酒精喷灯的构造和原理,掌握正确的使用方法,了解正常火焰各部分的温度。 2、初步练习玻璃管、棒的截、拉、弯曲、拉制、熔烧等操作。 实验三台秤和分析天平的使用 1、了解台秤和分析天平的基本结构,学习正确的称量方法。 2、掌握使用天平的规则。 1、了解有效数字的概念。 实验四溶液的配制 1、掌握一般的配制方法和基本操作。
《Ubuntu Linux操作系统》课程教学大纲 学分: 4 学时:48 适用专业: 高职高专类计算机专业 一、课程的性质与任务 课程的性质: 本课程是为计算机专业学生开设的课程。课程安排在第学期。 课程的任务: 通过本课程的学习,使学生熟悉Linux操作系统的基本操作,掌握Linux操作系统的配置管理、软件使用和编程环境部署。本课程将紧密结合实际,以首选的Linux桌面系统Ubuntu 为例讲解操作系统的使用和配置,为学生今后进行系统管理运维、软件开发和部署奠定基础。整个课程按照从基础到应用,从基本功能到高级功能的逻辑进行讲授,要求学生通过动手实践来掌握相关的技术操作技能。 前导课程: 《计算机原理》、《Windows操作系统》。 后续课程: 《Linux应用开发》 二、教学基本要求 理论上,要求学生掌握Ubuntu Linux操作系统的基础知识,包括配置管理、桌面应用、编程和软件开发环境。 技能上,要求学生能掌握Ubuntu Linux操作系统的配置方法和使用技能,涵盖系统安装和基本使用、图形界面与命令行、用户与组管理、文件与目录管理、磁盘存储管理、软件包管理、系统高级管理、桌面应用、Shell编程、C/C++编程、Java与Android应用开发、LAMP 平台与PHP、Python、Node.js开发环境部署,以及Ubuntu服务器安装与管理。 培养的IEET核心能力: ?具备系统管理方向的系统工程师的工程能力:掌握Linux配置管理和运维,包括用 户与组管理、文件与目录管理、磁盘存储管理、软件包管理、系统高级管理、服务器安装与管理。 ?具备应用开发工程师的开发环境部署能力,包括Shell编程、C/C++编程、Java与 Android应用开发、LAMP平台与PHP、Python、Node.js开发环境的部署和流程。 ?基本职业素养:具有良好的文化修养、职业道德、服务意识和敬业精神;接受企业 的文化;具有较强的语言文字表达、团结协作和社会活动等基本能力;具有基本的英语文档阅读能力,能较熟练地阅读理解Ubuntu Linux的相关英文资料。
无机化学课程教学大纲 课程名称: 无机化学 课程编码:0730011 英文名称: Inorganic Chemistry 学 时: 96 其中实验学时:32 学 分: 5 开课学期: 1 适用专业: 化学工程与工艺 课程类别: 必修 课程性质: 专业基础课 先修课程: 一、课程性质及任务 无机化学是材料与化工学院各专业的第一门化学基础课,在培养学生的化学素质中起着承前启后的作用。无机化学是在中学化学的基础上授以学生无机化学的知识与理论,并为后续专业课程的学习打下良好的基础。 要求掌握化学反应的一般原理(包括化学反应热效应ΔrHm的计算,化学反应方向的判断,化学反应的ΔrGm和ΔrSm的计算,化学平衡及其移动原理,Kθ与T的关系,影响化学反应速率的因素,质量作用定律,反应速率理论,活化能的概念,K与T的关系等)。 要求掌握酸碱的电离理论、质子理论、电子理论及无机化学四大平衡原理(缓冲溶液、溶度积规则、配合物的概念、原电池、电极电势及其应用等) 初步掌握原子结构、分子结构和晶体结构理论(包括微观粒子运动特性、量子数、原子轨道、电子云、核外电子排布规则、元素周期系及原子性质的周期性规律,VB理论、MO理论、键参数、杂化轨道理论、晶体类型、分子间作用力、晶格能、离子极化作用);掌握主族元素和过渡元素及其化合物的通性和特性,并能用无机化学基本知识和理论加以解释。 二、课程的教学要求 1. 理论部分 (1)化学反应速率 了解化学反应速率方程(质量作用定律)和反应级数的概念。能用活化能和活化分子概念说明浓度、分压、温度、催化剂。对均相反应速率的影响。了解影响多相反应速率的因素。 (2)化学平衡 掌握化学平衡概念及平衡移动规律,理解反应速率和化学平衡在实际应用中需综合考虑的必要性。掌握弱电解质的解离度、稀释定律、溶液的酸碱性和pH值、解离平衡、盐的水解、同离子效应、缓冲溶液、溶解-沉淀平衡、溶度积规则、氧化还原平衡和电极电势、配位平衡等内容,并能分析多重平衡系统中的成分及其相互影响。能用平衡常数(kθ)进行有关计算。能计算一元弱酸、一元弱碱的解离平衡组成以及同离子效应和缓冲溶液的pH值。能用溶度积规则判断沉淀的产生、溶解。能用氧化值法、离子电子法配平氧化还原反应方程式;能通过能斯特方程式计算说明浓度(含酸度)、分压对电极电势的影响;会用电极电势判断氧化剂、还原剂的相对强弱和氧化还原反应的方向;会应用元素标准电势图讨论元素的有关性质。能计算配体过量时配位平衡的组成。 (3)化学反应中的能量关系 能用Δf Hm计算化学反应的反应热效应。学习用ΔrGm判断化学反应的方向。 1
无机化学实验I课程教学大纲 课程编号:15030031 课程名称:无机化学实验Ⅰ 学时与学分: 64 /2.0 先修课程:中学化学 适应专业:化工与制药类 教材及参考书: 关鲁雄主编,《化学基本操作与物质制备实验》,中南大学出版社,2002年 黄可龙主编,无机化学,科学出版社,2007年 一、课程的性质和任务 无机化学实验I是化工与制药大类(化学工程与工艺专业、制药工程专业、应用化学专业)等理工科类专业本科生的必修专业基础课,在高素质的化学工程和应用型人才培养中发挥着重要的作用。本课程将化学基本操作、实验研究方法和现代分析手段等进行有机融合,呈现给学生一个比较完整的化学实验基本知识体系。通过加强学生基本操作的训练、掌握常用仪器的使用方法、观察解释实验现象和对实验数据的测定和处理,让学生对无机化学实验技术知识有整体的了解,培养学生的实验操作能力、分析问题和解决问题的能力,同时加深他们对无机化学原理的理解,为今后进一步深造和开展实际工作或进行化学相关科学研究奠定良好的实验基础。通过综合性、设计性实验以及课外的研究创新实验,加强学生化学素养与创新能力的培养,使其形成理论联系实际、实事求是的科学态度,主动研究的探索精神和严谨的工作作风。 二、课程基本要求 本课程主要是基本操作实验,涉及包括:化学实验基本知识,如实验 室规则, 实验安全知识,预习、记录、实验报告的格式与要求,实验考核与考试办法;化学实验玻璃仪器的识别、洗涤、干燥和保养,衡量仪器的使用方法,化学试剂等级规格及取用方法,加热仪器与加热方法。分离和纯化方法,如常压过滤、蒸发结晶、结晶洗涤、减压过滤、重结晶和离子交换的原理和操作方法以及生物显微
《计算机系统结构》教学大纲 (参考学时:约48学时) 1.课程的性质、目的和意义 计算机系统结构是计算机科学与技术专业(本科)必修的一门专业技术课。计算机系统结构是计算学科的重要分支之一。计算机的发展历史说明,计算机性能的不断提高主要依靠器件的变革和系统结构的改进。今天,在器件潜力几乎达到极限的情况下,计算机系统结构的改进尤为重要。 本课程是从外部来研究计算机系统, 即使用者所看到的物理计算机的抽象;编写出能够在机器上正确运行的程序所必须了解到的计算机的属性;软硬件功能分配及分界面的确定。 通过本课程的学习,使学生建立计算机系统的完整概念;掌握计算机系统结构的基本概念、基本原理、基本结构和基本分析方法,为学生熟悉现代计算机系统特别是微型计算机系统的开发、应用和发展打下良好的基础。本课程应该注重培养学生对系统结构的分析能力,掌握系统结构设计的基本原则。即如何最合理地利用新器件,最大限度地发挥其潜力,设计并构成综合性能指标最佳的计算机系统。 本课程为计算机专业(本科)高年级课程,需要综合几乎所有计算机专业基础和相关的前继专业课程知识。主要有:计算机组成原理、汇编语言程序设计、高级语言程序设计、数据结构、操作系统、编译原理等课程。本课程的新内容为超标量处理机、超流水线处理机、向量处理机、并行处理机、线程级并行、多核处理器、多处理器系统及其并行计算等。 1.教学内容 本课程知识结构图如图1所示。
第一部分计算机系统结构的基础 1.教学内容 2.计算机的发展及其分类; 3.计算机系统多级层次结构和计算机系统结构的基本概念; 4.计算机系统设计的评价标准和定量原理; 5.软件、器件、应用对计算机系统结构的影响; 6.计算机系统的分类。 2.教学基本要求 1.熟练掌握内容: 计算机系统层次结构,计算机系统结构定义,计算机组成定义,计算 机实现定义,系统结构、组成与实现的三者关系,透明性,计算机系统设计的定量分析原理(Amdahl定律,CPU性能公式,并行性原理,局部性原理),MIPS定义,MFLOPS 定义。 2.掌握内容: 弗林分类法,冯·诺依曼计算机特征,计算机系统结构的演变,软件、器 件、应用对计算机系统结构的影响,模拟与仿真。 3.了解内容: 计算机系统结构的发展,计算机的分类,计算机系统设计的主要方法。 3.重点和难点 重点: 1.计算机系统结构,计算机组成和计算机实现是三个不同的概念; 2.计算机系统设计的定量分析原理(Amdahl定律,CPU性能公式,并行性原理,局部性 原理); 3.系统结构的评价标准; 4.计算机系统结构的分类。 难点: 1.计算机系统设计的定量分析原理。 第二部分计算机指令系统 1. 教学内容 1.数据类型; 2.寻址技术; 3.指令系统的设计; 4.指令系统的改进。 2.教学基本要求 1.熟练掌握内容:数据表示和数据结构,自定义数据表示,大端存储和小端存储,寻址 方式,指令格式的优化(Huffman编码法、扩展编码法),RISC的定义与特点,减少指令平均执行周期数方法。
《中药学》教学大纲 前言 【开设目的】 中药学是研究中药理论和临床应用的学科。本课程是中医药各专业的专业基础课。通过本课程的教学,使学生掌握中药基本理论和常用中药的性能,应用理论知识及技能,为学习方剂学及中医药各专业课奠定基础。【教学要求】 1.学习本课程的理论知识和技能要求 (1)掌握中药、中药学和本草学的含义,性味、归经、升降浮沉、毒性、炮制目的、配伍关系、用药禁忌等中药学基本理论知识。 熟悉本学科的发展概况、主要炮制方法、用量、用法等。 了解中药的起源、产地、采集及其他炮制方法。 (2)掌握121种常用中药的分类、药性特点、功效、主治、配伍(指基本规律和特殊意义者)及某些特殊用法;并了解其来源(指一味药因品种来源不同而效用有异者);某些特殊的炮制意义、用量、用法及使用注意。 熟悉86种常用药物的分类、功效和主要应用、某些特殊用法及使用注意。了解87种药物的功效、特殊用法及使用注意。 (3)具备识别常用中药饮片的一般知识。 2.对本课程授课要求 中药学是中医学不可分割的一部分,因而讲授中药学必须以中医药的理论为指导,突出辨证用药的特点,使学生能正确掌握药性和应用。 中药的理论和功效主治是本课程教学的重点,教学时要求讲清楚功效的概念,运用中医药理论分析功效,以功效联系主治、用法,有机地将几方面内容结合起来,并突出要点。故教学时要做到明确共性突出个性,注意前后有关内容的联系,加强系统性;对于功效近似的药物,采用归纳比较的方法进行讲授,在教学中要有重点地说明某些药物通过配伍后性能的变化,治疗范围的扩大及各类药物之间的配伍规律。 鉴于中药数量较多,并且一药有多种功效,内容比较复杂。以课堂教学为主,并可采用观看药材标本,布置作业,组织讨论,部分章节采用自学为主,教师适当辅导以培养学生分析问题、解决问题的能力。要注意运用启发式教学法,内容要结合学生的实际水平,由浅入深,循序渐进。 加强对学生的辅导,指导学习方法,注意学生所学知识的反复巩固,既抓好平时教学,又要重视单元复习及总复习。 教学目的要求、内容和方法 第一章中药的起源和中药学的发展 【目的要求】 明确中药学、中药的概念,了解中药的起源和中药学的发展,其中着重了解各个时期学术发展特点及主要本草著作。 【教学内容】 中药的起源和中药学的发展。 【教学方式】
《无机化学实验》课程教学大纲 2009年制订,2013年修订 课程名称:《无机化学实验》 课程类别:专业实验课 开课单位:化学与化学工程系无机与化学教研室 开课对象:化学专业 课时:36学时 选定教材:《无机化学实验》,丁明玉编著,北京,化学工业出版社,2006 参考书: 课程概述 无机化学实验是化学本科专业第一门必修实验课,通过实验使学生加深对无机化学基本概念的认识和理解,掌握常见元素的重要单质和化合物的典型性质,熟悉实验室中某些无机物质的一般制备方法和某些常数的测定方法。通过实验使学生学会准确、细致地观察、记录实验现象和作出正确的结论,并不断地提高学生的实验技能、技巧和分析问题、解决问题的能力,培养学生辨证唯物主义世界观,实事求是的科学态度和良好的实验习惯。 教学目的 1.加强基本操作训练:需要熟练掌握的基本操作集中叙述后,要分散反复训练,这样既有理论叙述又有实际训练,做到学用结合。利用图解说明和电化教学做到实验操作规范化。全面地培养学生的基本技能,对误差处理和有效数字的使用、作图、查阅手册以及绘制仪器装置图、实验报告的书写等方面都须有一定的要求并在有关实验中训练。 2.完善教学内容和教学方法的改革:在保持一定稳定性和基本性的同时,要补充具有学科发展特点的先进内容,联系实际的内容,并注意有趣性、可研究性相结合。减少验证性实验,增加综合性、探索性实验,运用计算机辅助教学、仪器操作竞赛、课外兴趣实验、外出参观、专题讲座等多种形式,把全面提高学生的能力作为主要目标。 3.规范实验教学的三环节:抓好学生预习、实验、实验报告三个环节,注意培养学生创造性的思维能力,良好的清洁习惯,科学、完整、规范地表达实验过程及结果的能力,培养学生对实验的浓厚兴趣,为学习后续课程做必要的
GDOU-B-11-213 《操作系统》课程教学大纲 课程简介 课程简介: 本课程主要讲述操作系统的原理,使学生不仅能够从系统内部了解操作系统的工作原理,而且可以学到软件设计的思想方法和技术方法。主要内容 包括:操作系统的概论;操作系统的作业管理;操作系统的文件管理原理; 操作系统的进程概念、进程调度和控制、进程互斥和同步等;操作系统的各 种存储管理方式以及存储保护和共享;操作系统的设备管理一般原理。其次 在实验环节介绍实例操作系统的若干实现技术,如:Windows操作系统、Linux 操作系统等。 课程大纲 一、课程的性质与任务: 本课程计算机学科的软件工程专业中是一门专业方向课,也可以面向计算机类的其它专业。其任务是讲授操作系统的原理,从系统内部了解操作系统的工作原理以级软件设计的思想方法和技术方法;同时介绍实例操作系统的若干实现技术。 二、课程的目的与基本要求: 通过本课程的教学使学生能够从操作系统内部获知操作系统的工作原理,理解操作系统几大管理模块的分工和管理思想,学习设计系统软件的思想方法,通过实验环节掌握操作系统实例的若干实现技术,如:Windows操作系统、Linux操作系统等。 三、面向专业: 软件工程、计算机类 四、先修课程: 计算系统基础,C/C++语言程序设计,计算机组成结构,数据结构。 五、本课程与其它课程的联系:
本课程以计算系统基础,C/C++语言程序设计,计算机组成结构,数据结构等为先修课程,在学习本课程之前要求学生掌握先修课程的知识,在学习本课程的过程中能将数据结构、计算机组成结构等课程的知识融入到本课程之中。 六、教学内容安排、要求、学时分配及作业: 第一章:操作系统概论(2学时) 第一节:操作系统的地位及作用 操作系统的地位(A);操作系统的作用(A)。 第二节:操作系统的功能 单道系统与多道系统(B);操作系统的功能(A)。 第三节:操作系统的分类 批处理操作系统(B);分时操作系统(B);实时操作系统(B)。 第二章:作业管理(2学时) 第一节:作业的组织 作业与作业步(B);作业的分类(B);作业的状态(B);作业控制块(B)。 第二节:操作系统的用户接口 程序级接口(A);作业控制级接口(A)。 第三节:作业调度 作业调度程序的功能(B);作业调度策略(B);作业调度算法(B)。 第四节:作业控制 脱机控制方式(A);联机控制方式(A)。 第三章:文件管理(8学时) 第一节:文件与文件系统(1学时) 文件(B);文件的种类(B);文件系统及其功能(A)。 第二节:文件的组织结构(1学时) 文件的逻辑结构(A);文件的物理结构(A)。 第三节:文件目录结构(1学时) 文件说明(B);文件目录的结构(A);当前目录和目录文件(B)。 第四节:文件存取与操作(1学时) 文件的存取方法(A);文件存储设备(C);活动文件(B);文件操作(A)。 第五节:文件存储空间的管理(2学时) 空闲块表(A);空闲区表(A);空闲块链(A);位示图(A)。 第六节:文件的共享和保护(2学时)
无机化学课程教学大纲 一、课程说明 (一)课程名称、所属专业、课程性质、学分 课程名称:无机化学 所属专业:材料化学 课程性质:必修课 学分:4学分(72学时) (二)课程简介、目标与任务 课程简介:无机化学主要研究各种元素及其化合物在自然界的存在、人工制取、性质和反应,以及各种现象之间的内在联系和解释的科学。是理科相关专业本科生化学教学中的第一门主干基础课,是后续化学课程的基础,也是理科各专业人才整体知识结构及能力结构的重要组成部分。 目标与任务:通过本课程的教学,使学生比较系统、全面地学习无机化学的基本原理,掌握热力学原理及四大平衡的关系。掌握原子结构及其对元素性质的影响,以及元素性质的变化规律。掌握离子键理论、共价键理论、金属键理论对分子形成及其结构的解释。在理论部分的基础上,讨论重要元素及其化合物的组成、结构、性质以及变化规律。 (三)先修课程要求,与先修课与后续相关课程之间的逻辑关系和内容衔接 先修课程要求:已完成高中化学课程 后续相关课程:有机化学,分析化学,物理化学,结构化学 本科阶段的无机化学课程是在中学基础上的逐步深化和提高,同时又为后续课程打下必要和扎实的基础,因此它具有承前启后的作用。在内容上,删减了与中学化学重复内容,着重强化了化学理论中规律性的知识,从更完善的理论角度重新认识化学物质结构及化学变化规律,加强了对微观结构的描述和重要理论的阐述,同时细化了重要元素及典型化合物的讨论,适当增加了某些化合物新用途的介绍。这些内容为后续相关课程的开展奠定必要的基础。 (四)教材与主要参考书 教材:《无机化学》(第五版),大连理工大学无机化学教研室编,高等教育出版社,2006年5月。 参考书: [1] 《基础无机化学》(上、下册,第四版),张淑民编著,唐瑜修订,兰州大学 出版社,2011年6月 [2] 《无机化学》,宋天佑等主编,高等教育出版社
《操作系统》课程教学大纲 一、课程基本信息课程名称:《操作系统》总学时与学分:72学时 4学分 课程性质:专业必修课授课对象:计算机科学与技术专业 二、课程教学目标与任务 操作系统原理是一门专业基础课程,是涉及考研等进一步进修的重要课程,是计算机 体系中必不可少的组成部分。本课程的目的和任务是使学生通过本课程的学习,理解操作 系统的基本概念和主要功能,掌握操作系统的使用和一般的管理方法,从而为学生以后的 学习和工作打下基础。 三、学时安排 课程内容与学时分配表 章 节 内 容学 时 第一章 操作系统引论5第二章 进程管理12第三章 处理机调度与死锁12第四章 存储管理12第五章 设备管理10第六章 文件管理8第七章 操作系统接口4第八章 网络操作系统3第九章 系统安全性3第十章 UNIX 操作系统3四、课程教学内容与基本要求 第一章 操作系统引论 教学目标:通过本章的学习,使学生掌握操作系统的概念,操作系统的作用和发展过 程,知道操作系统是配置在计算机硬件上的第一层软件,是对计算机系统的首次扩充,是 现代计算机系统必须配置的软件。 基本要求:掌握操作系统的目标和作用、发展过程、基本特征及主要功能;了解操作 系统的结构设计 本章重点:操作系统的概念、作用,操作系统的基本特征以及操作系统的主要功能。 本章难点:操作系统基本特征的理解,操作系统主要功能的体现。 教学方法:讲授与演示相结合、管路敷设技术通过管线不仅可以解决吊顶层配置不规范高中资料试卷问题,而且可保障各类管路习题到位。在管路敷设过程中,要加强看护关于管路高中资料试卷连接管口处理高中资料试卷弯扁度固定盒位置保护层防腐跨接地线弯曲半径标高等,要求技术交底。管线敷设技术包含线槽、管架等多项方式,为解决高中语文电气课件中管壁薄、接口不严等问题,合理利用管线敷设技术。线缆敷设原则:在分线盒处,当不同电压回路交、电气课件中调试试卷相互作用与相互关系,根据生产工艺高中资料试卷要求,对电气设备进行空载与带负荷下高中资料试卷调控试验;对设备进行调整使其在正常工况下与过度工作下都可以正常工作;对于继电保护进行整核对定值,审核与校对图纸,编写复杂设备与装置高中资料试卷调试方案,编写重要设备高中资料试卷试验方案以及系统启动方案;对整套启动过程中高中资料试卷电气设备进行调试工作并且进行过关运行高中资料试卷技术指导。对于调试过程中高中资料试卷、电气设备调试高中资料试卷技术电力保护装置调试技术,电力保护高中资料试卷配置技术是指机组在进行继电保护高中资料试卷总体配置时,需要在最大限度内来确保机组高中资料试卷安全,并且尽可能地缩小故障高中资料试卷破坏范围,或者对某些异常高中资料试卷工况进行自动处理,尤其要避免错误高中资料试卷保护装置动作,并且拒绝动作,来避免不必要高中资料试卷突然停机。因此,电力高中资料试卷保护装置调试技术,要求电力保护装置做到准确灵活。对于差动保护装置高中资料试
中药学教学大纲 (中药学、市场营销专业本科使用) 中药学教研室 中药学教学大纲 (供中药学、市场营销专业本科使用) 学分数: 4."5周学时:5课程性质: 中药学专业本科生必修课程,市场营销专业本科生A类选修。 教学目的与要求: 通过本课程的教学,要求学生掌握中药的性能(四气五味、升降浮沉、归经、毒性)、中药的配伍及用药禁忌等基本理论;掌握或了解约350种常用中药的分类、性能、功效、临床应用及用法用量;了解药材采集及炮制知识;为学习方剂学及其他学科打下基础。 基本内容: 教学内容分为总论、各论两部分。总论以讲授药性理论为重点,并简要介绍中药的起源和发展概况、产地、采集、炮制、配伍、用药禁忌、用量用法等基本知识。各论则收载药物538种左右,按中药功效的不同分为二十一大类,课堂讲授约350种,其余药物供学生参考。 教学方式: 教学的具体方式以课堂讲授为主,引入多媒体技术及计算机辅助教学课件。同时采用观看药材标本、布置作业、组织讨论,或以个别章节进行自学为主,教师适当辅导的方法培养学生分析、解决问题的能力。注意实施启发式教学法,内容可结合学生的实际水平、自浅入深,循序渐进。 教学内容:
总论系统地介绍了中药学基本理论,包括中药、中药学的含义,中药的起源和发展,其中重点阐述各个历史时期中药学发展的特点及主要本草著作;中药的产地与采集,介绍产地、采集与药效的关系,道地药材的含义,以及在保证药效的前提下如何发展道地药材生产和适时采集中药的一般知识;中药炮制介绍炮制的含义、目的与方法;药性理论是总论的核心,主要阐明四气、五味、升降浮沉、归经、毒性等的含义及中药治病的基本原理;中药的配伍阐明中药配伍应用的目的、原则和药物“七情”的含义、中药配伍应用规律;用药禁忌着重介绍证候禁忌、配伍禁忌、妊娠用药禁忌、服药时的饮食禁忌的含义及主要内容;用药剂量与用法介绍剂量与疗效的关系,确定剂量的依据及中药煎服法等内容。 各论共收载全国各地常用中药538味,按主要功效分列为二十一章介绍。 每章先列概说,介绍该章药物的含义、药性特点、功效、适用范围、分类、配伍方法、使用注意等内容。然后依次介绍每味药物的药性、功效、应用,其中功效和应用是各论的重点,在运用中医药基本理论概括出功效、主治病证的同时,着重说明辨证用药的理法特色。 教学用书: 高学敏主编,《中药学》(第一版),中国中医药出版社,2002年。 教学参考书: 雷载权,张廷模主编,《中华临床中药学》(第一版),人民卫生出版社,1998年。 开课学期: 春季。中药学教学时数分配 顺序910 11 12
《无机化学》课程教学大纲 适用专业:化学教育专业(三年制专科) 课程类别:必修 一、本课程的地位、性质、任务 无机化学是化学教育(专科)专业必修的第一门化学基础课。它既与中学化学内容相衔接,又要为后继课的学习打下基础,对学生学习起承前启后的作用。 本课程的教学任务和目的是: 1.使学生初步掌握元素周期律、近代物质结构、化学热力学、化学动力学、化学平衡以及氧化还原、配合离解和沉淀溶解等基本理论; 2.培养学生运用上述原理去理解和掌握重要元素及其化合物的性质、结构、变化规律和用途等基本知识。并且具有对一般无机化学问题进行理论分析和计算的能力; 3.帮助学生树立初步的辩证唯物主义和历史唯物主义的观点,注意使学生在科学思维能力上得到训练和培养;培养学生自学和利用参考资料等方面的能力。 4.强化学生的专业思想,激发学生学习化学的兴趣,全面提高学生的综合素质; 5.适当介绍现代化学的新发展、特点及研究新方法,拓宽学生视野。 二、主要教材与主要参考书及相当学习网站 1、教材: 北师大等院校编《无机化学》(第4版)高等教育出版社2002年8月 2、主要参考书: ①《无机化学》武汉大学主编高等教育出版社 ②《无机化学》庞锡涛主编高等教育出版社 ③《无机化学学习指导书》庞锡涛主编 ④《现代化学基础》华东师大编华东师大出版社1999年 ⑤《无机化学例题与习题》徐家宁高等教育出版社2000年 ⑥《无机化学答疑》黄孟键高等教育出版社 ⑦《无机化学——要点·例题·习题》张祖德等中国科学技术大学出版社 ⑧《大学化学》杂志 3、相关学习网站 ①. ②. ③. ④. 三、教学重点、难点 重点:元素及化合物性质的周期性变化及其理论解释 难点:原子结构、化学键理论 四、教学方式、考核方式及成绩构成 教学方式:以教师讲授与课堂讨论为主 本课程的成绩由平时考核和期末考核成绩构成。平时考核内容有平时测验、习作讨论、
《无机化学实验》(下)课程教学大纲 (适用于化学专业) 课程编码:B10012022 学时:48 学分:1.5 开课学期:第二学期 课程类型:专业基础课 先修课程:无 教学手段:讲述、演示,再由学生自己操作,教师巡回指导 一、教学目的与任务: 通过本课程的实验训练,学生可直接获得大量化学事实,有利于《无机化学》 理论课的学习,并能灵活运用所学理论知识指导实验。利用严格的实验训练,培 养学生规范地掌握基本操作与基本技能。结合研究性实验与设计实验,培养学生 具有自我获取知识、提出问题、分析问题、解决问题的独立工作能力,具有一定 的创新意识与创新能力。同时注意培养学生实事求是的科学态度、勤俭节约的优 良作风、认真细致的工作作风、相互协作的团队精神,为学习后续课程、参加实 际工作和开展科学研究打下良好的基础。 二、课程的基本内容: 实验一去离子水的制备(3学时) 实验目的和要求 1、掌握用离子交换法制备去离子水的原理和操作方法,熟悉离子交换树脂的再生处理,学会使用电导率仪,掌握水中杂质离子的检验方法。 重点和难点 离子交换法制备去离子水的原理和操作方法,电导率仪的使用,水中杂质离子的检验方法 实验内容 1、去离子水的制备 2、水质检验 3、离子交换树脂的再生 主要教学环节的组织 课堂讲解、实验教学。 思考题 1、离子交换法制备去离子水的基本原理是什么? 2、装柱时为什么要赶净柱中的气泡? 3、为什么可用测量水样的电导率来检查水质的纯度?
实验二、三硫酸亚铁铵的制备及其铁含量的制备(6学时) 实验目的和要求 学习复盐的一般特性及硫酸亚铁铵的制备方法,掌握高锰酸钾法滴定测定铁(Ⅱ)的方法,并巩固产品中杂质Fe3+的定量分析,熟悉无机制备中的水浴加热、蒸发、结晶和减压过滤等基本操作。 重点和难点 制备硫酸亚铁铵原理,纯度检验 实验内容 1、铁与稀硫酸作用,使生成硫酸亚铁,在硫酸亚铁溶液中加入等摩尔的硫酸铵后,得硫酸亚铁铵溶液。此溶液经过蒸发、浓缩后,制得浅绿色硫酸亚铁铵晶体。 2、产品的质量鉴定可以用高锰酸钾滴定法确定有效成分的含量。 主要教学环节的组织 课堂讲解、实验教学。 思考题 为什么用废铁屑制备硫酸亚铁铵时所得产品常常带有灰褐色? 实验四碱金属与碱土金属(3学时) 实验目的和要求 了解K、Na、Mg的活泼性,Mg、Ca、Ba盐类的难溶性,练习焰色反应。重点和难点 K、Na、Mg的活泼性的验证,Mg、Ca、Ba盐类的难溶性。 实验内容 金属与水的反应,过氧化钠的性质,碱土金属氢氧化物生成和性质,碱金属的微溶盐的生成,碱土金属的难溶盐,焰色反应。 主要教学环节的组织 课堂讲解、实验教学。 思考题 取用K、Na、Hg时应注意哪些安全措施?制备Na-Hg齐时,取Hg时若带进水,将对实验有何影响? 实验五P区重要非金属及其化合物的性质(1) ——卤素(3学时) 实验目的和要求 掌握X2的氧化性,X-的还原性,Cl2和次氯酸盐的制备方法,了解Cl2、Br2、HF和KClO3的安全操作。
《操作系统课程设计》大纲 一、设计目的和要求 目的:本课程设计是为配合计算机相关专业的重要专业课《操作系统》而开设的,其主要内容是让学生实际进行操作系统功能模块的设计和编程实现。通过本课程设计的实施,使学生能将操作系统的概念具体化,并从整体和动态的角度去理解和把握操作系统,以巩固和补充操作系统的原理教学,提高学生解决操作系统设计及实现过程中的具体问题的能力。 要求:通过本课程设计的实施,要求培养学生以下能力: (1)培养学生在模拟条件下与实际环境中实现功能模块和系统的能力:课程设计要求学生实际进行操作系统功能模块的设计和编程实现,具体包括:基于线程的多任务调度系统的设计与实现;一个简单文件系统的设计与实现。 (2)培养学生设计和实施工程实验的能力,合理分析试验结果的能力:学生在完成项目的过程中,需要进行实验设计、程序调试、错误分析,从而熟悉实验设计方法及实验结果的分析方法。 (3)培养学生综合运用理论和技术手段设计系统和过程的能力:学生需根据设计项目的功能要求及操作系统原理的相关理论提出自己的解决方案,需考虑项目实现的软硬件环境,设计相关数据结构及算法,在实现过程中发现解决方案的问题并进行分析改进。 (4)培养学生分析并清楚阐述设计合理性的能力:要求学生在项目上机验收和实验报告中分析阐述设计思路的合理性和正确性。 (5)培养学生的组织管理能力、人际交往能力、团队协作能力:课程设计分小组进行,每个小组有一个组长,负责组织本组成员的分工及合作。 二、设计学时和学分 学时:32 ;学分:1 三、设计的主要内容 以下三个题目中:1、2中选做一题,第3题必做。 1、基于线程的多任务调度系统的设计与实现 (1)线程的创建、撤消和CPU切换。 掌握线程的定义和特征,线程的基本状态,线程的私有堆栈,线程控制块TCB,理解线程与进程的区别,实现线程的创建、撤消和CPU切换。 (2)时间片轮转调度 理解各种调度算法、调度的原因,完成时钟中断的截取,具体实现调度程序。 (3)最高优先权优先调度 理解优先权的概念,并实现最高优先权优先调度策略。 (4)利用记录型信号量实现线程的同步
普通高等教育全日制五年本科 《中医基础理论》课程教学大纲 (供中医类五年制专业用) 前言 中医基础理论课程属于中医学的专业基础课。通过对该课程的学习,要求学生掌握本课程中有关中医学的基本理论、基本知识和基本思维方法,包括中医学的哲学基础(精气、阴阳、五行学说)、中医学对人体生理的认识(藏象、精气血津液神、经络、体质)、中医学对疾病及其防治的认识(病因、发病、病机、防治原则),为继续学习中医诊断学、中药学、方剂学、中医经典著作和临床各科打好基础。 本课程以课堂讲授为主,结合多媒体教学和课堂讨论等方法,以增强学生对中医基础理论知识的认知能力,使学生在掌握基本知识和基本技能的同时,掌握学习方法,锻炼培养思维和科研能力,培养学生的运用知识、发现问题、解决问题的能力以及创新意识,以适应素质教育的要求。 本课程的教学,教师语言应规范通俗,由浅入深,循序渐进,突出重点,讲清难点并交代疑点,既要充分考虑大学一年级学生的认知能力和在学习方法方面的适应能力,又要充分体现中医基础理论的继承、发展和创新,反映中医现代化的要求。 正文 绪论 【目的要求】 1.掌握中医学理论体系的主要特点。 2.了解中医学、中医基础理论、中医学理论体系的概念,中医学的学科属性,中医学理论体系的形成和发展概况。 【教学内容】 一、中医学的基本概念和学科属性 二、中医学理论体系的概念、形成与发展 (一)中医学理论体系的概念 (二)中医学理论体系的形成与发展 (三)中医学理论的继承与创新 三、中医学理论体系的主要特点
(一)整体观念:人体是一个有机整体;人与自然环境的统一性;人与社会环境的统一性;整体观与现代医学模式。 (二)辨证论治:病、证、症的基本概念;辨证论治的概念;同病异治与异病同治;辨证与辨病相结合。 四、中医基础理论课程的主要内容 【课时与方法】 总课时6主要特点4 其他2 授课方法课堂讲授结合多媒体教学 第一章中医学的哲学基础 【目的要求】 1.了解古代哲学精、气的概念、精气学说的内容及精气学说在中医学中的应用。 2.掌握阴阳的概念和阴阳学说的内容。 3.掌握五行的概念和五行学说的内容。 4.掌握阴阳学说和五行学说在中医学中的应用。 5.了解中医学思维方法的特点。 【教学内容】 第一节精气学说 一、古代哲学精与气的概念 (一)精的概念 (二)气的概念 二、精气学说的内容 (一)精气是构成宇宙的本原 (二)精气的运动与变化 (三)精气是天地万物相互联系的中介 (四)天地精气化生为人 三、精气学说在中医学中的应用 第二节阴阳学说 一、阴阳的概念及属性 (一)阴阳的概念 (二)阴阳的属性 (三)阴阳属性的绝对性和相对性 二、阴阳学说的内容 (一)阴阳对立制约:阴阳相反、阴阳相互抑制削弱。 (二)阴阳互根互用:阴阳相互依存、阴阳相互促进化生。
《无机化学》理论教学大纲 英文名称:Inorganic Chemistry 课程编号:090201 学时数: 54 学分:3.5 课程类型:必修课 适用专业:药学、医学检验 先修课程:无 考核方式:闭卷考试 一、课程的性质、地位和作用 无机化学是药学、医学检验专业的重要基础课,也是第一门化学课。它是培养专业技术人才的整体知识结构和能力结构的重要组成部分,同时也是后继化学课程打下牢固的基础。 通过本课程的学习,使学生获得物质结构的基础理论、化学反应的基本原理、元素化学的基本知识和实验的基本技能。培养学生具有分析处理一般无机化学问题的初步能力,独立进行无机化学试验和自学一般无机化学书刊,以获取新知识的能力。 本课程的教学应该运用辩论唯物主义观点和科学方法,阐明化学的基本原理和元素及化合物性质的变化规律,以促进学生辩证唯物主义世界观的形成。根据我院教学中实际特制订本大纲,供药学、医学检验专业使用。 二、教学基本内容及基本要求 一绪论1课时 【教学内容】 无机化学与药学、无机化学与医学检验关系。无机化学课程的性质、地位和作用。无机化学的主要内容和学习方法。 【基本要求】 明确什么是无机化学。了解无机化学与药学、无机化学与医学检验的关系。了解无机化学课程主要内容和学习方法。 二溶液3课时 【教学内容】 溶液的浓度:质量分数、摩尔分数、质量摩尔浓度、质量浓度、物质的量浓度。稀溶液的依数性:溶液的蒸汽压下降、溶液的沸点上升、溶液的凝固点降低、溶液的渗透压。电解质在水溶液中的存在状况。活度、活度系数、离子强度。 【基本要求】 掌握溶液浓度的含义。掌握质量分数、摩尔分数、质量摩尔浓度、质量浓度、物质的量浓度的含义及有关计算。 理解稀溶液的依数性。熟悉渗透压及在医学上的应用。 了解强电解质在水溶液中的状况。了解活度、活度系数、离子强度的概念。 三化学反应速率4课时 【教学内容】
无机化学实验教学大纲 (适用于化学、应用化学、材料化学、化学生物学专业) 大纲编写依据 参照1998年4月《国家教育委员会面向21世纪教学内容和课程体系改革》:无机化学实验教学基本要求,结合化学教育专业和应用化学专业的特点以及我校教学实际课时安排和近年来的实验教学改革经验而编写。 课程教学目的和任务 本课程是化学、应用化学、材料化学、化学生物学专业的专业必修课之一。化学是一门实验科学,基础化学实验课(一)是化学、应用化学、材料化学、化学生物学专业学生所学的第一门基础实验课,是以实验为手段,研究无机化学中的重要理论、典型元素及其化合物的变化,以及相关仪器、装置、基本操作和有关原理的一门课程。通过本课程的学习,要求学生正确掌握化学实验的基本操作方法和技能技巧,进一步加深对基础化学理论的理解,培养学生独立准备和进行实验的能力,细致地观察和记录现象,归纳、综合、正确处理数据的能力,分析实验和用语言表达实验结果的能力以及一定的组织实验、研究实验的能力,同时培养学生严谨、认真、实事求是的科学态度,养成良好的科学习惯,掌握科学的思维方法,为学生进一步学习后继化学课程和实验,将来从事化学教学及科研工作打下坚实的基础.
教学方法 根据基础化学实验课的自身特点,采用启发式教学。要求学生课前预习。实验前可结合课堂提问、示范操作或观看教学录像讲解实验原理、操作要点、注意事项等,培养严谨、事实求是的科学态度。实验中以督促、指导为主,对出现的问题及时指出并加以纠正,结束时可采取课堂讨论的形式进行总结.课后要求独立完成实验报告,并对实验结果加以分析。 相关课程及主要参考书 无机化学、《无机化学实验》(北京师范大学无机化学教研室编,高等教育出版社,第三版)、《无机化学实验》(华东化工学院编,高等教育出版社,第三版)等. 考试方式及评分标准 考试方式分为笔试(闭卷)和操作两部分。其中笔试占总评成绩的40%,操作考试占总评成绩的40%,平时成绩占总评成绩的20%。 总学时及学时分配建议表 总学时90学时,其中第一学期54学时,第二学期36学时。大纲列出的实验项目数38个,其中必修实验项目数18个,选修实验项目数20个。