
元素 本课题包括元素、元素符号和元素周期表简介三部分内容。此前学生把元素当成组成物质的基本成分,现在他们已经学习了原子结构,就应该从微观结构的角度对元素下一个比较确切的定义,从而把对物质的宏观组成与微观结构的认识统一起来。 元素概念是教学难点,因为它比较抽象,而且对于“具有相同核电荷数的一类原子的总称”中的“一类原子”这一定义,在没有同位素知识准备时,学生难以理解。理解元素概念的困难还在于在实际使用中容易跟原子概念混淆。学生不明白在分析物质宏观组成时要用“元素”,在研究物质微观结构时要用“原子”。这是学生初学化学时普遍存在的问题。随着知识的积累,他们是会豁然开朗的。 元素符号是国际通用的化学用语,是学习化学的重要工具,因此也是教学重点。要求学生了解元素符号的意义,对于一些常见元素的符号和名称,必须会写、会读、会用。 学生在学本单元内容之前,并没学过多少元素,因此难以理解元素周期律。本课题编写“元素周期表简介”,目的在于让学生比较早地学会使用元素周期表这个工具。根据学生的知识基础,他们可以从原子序数查找某一元素的名称、符号、核外电子数、相对原子质量及确认该元素是金属、非金属还是稀有气体元素等信息,为他们以后的学习提供方便。 【课时安排】 2课时 【教学目标】 1.知识与技能 (1)了解元素的概念,将对物质的宏观组成与微观结构的认识统一起来; (2)了解元素符号所表示的意义,学会元素符号的正确写法,逐步记住一些常见的元素符号; (3)初步认识元素周期表,利用周期表查取一些简单信息。 2.过程与方法 通过对元素知识的探究学习,联系生活和地壳中元素含量,让学生体验探究过程,培养归纳总结的能力。 3.情感态度与价值观 通过合作学习,学会与人相处。通过对生活中一些物质所含元素含量的确定,养成更加关心社会,关心自然的好习惯。
各种化学元素的相对原子质量 本表数据源自2005年IUPAC元素周期表 (IUPAC2005standardatomicweights),以12C=12为标准。 本表方括号内的原子质量为放射性元素的半衰期最长的同位素质量数。 相对原子质量末位数的不确定度加注在其后的括号内。1氢H1.00794(7) 2氦He4.002602(2) 3锂Li6.941(2) 4铍Be9.012182(3) 5硼B10.811(7) 6碳C12.017(8) 7氮N14.0067(2) 8氧O15.9994(3) 9氟F18.9984032(5) 10氖Ne20.1797(6) 11钠Na22.98976928(2) 12镁Mg24.3050(6) 13铝Al26.9815386(8) 14硅Si28.0855(3) 15磷P30.973762(2) 16硫S32.065(5) 17氯Cl35.453(2) 18氩Ar39.948(1) 19钾K39.0983(1) 20钙Ca40.078(4) 21钪Sc44.955912(6) 22钛Ti47.867(1) 23钒V50.9415(1) 24铬Cr51.9961(6) 25锰Mn54.938045(5) 26铁Fe55.845(2) 27钴Co58.933195(5) 28镍Ni58.6934(2) 29铜Cu63.546(3) 30锌Zn65.409(4) 31镓Ga69.723(1)
33砷As74.92160(2) 34硒Se78.96(3) 35溴Br79.904(1) 36氪Kr83.798(2) 37铷Rb85.4678(3) 38锶Sr87.62(1) 39钇Y88.90585(2) 40锆Zr91.224(2) 41铌Nb92.90638(2) 42钼Mo95.94(2) 43锝Tc[97.9072] 44钌Ru101.07(2) 45铑Rh102.90550(2)46钯Pd106.42(1) 47银Ag107.8682(2) 48镉Cd112.411(8) 49铟In114.818(3) 50锡Sn118.710(7) 51锑Sb121.760(1) 52碲Te127.60(3) 53碘I126.90447(3) 54氙Xe131.293(6) 55铯Cs132.9054519(2)56钡Ba137.327(7) 57镧La138.90547(7)58铈Ce140.116(1) 59镨Pr140.90765(2)60钕Nd144.242(3) 61钷Pm[145] 62钐Sm150.36(2) 63铕Eu151.964(1) 64钆Gd157.25(3) 65铽Tb158.92535(2)66镝Dy162.500(1) 67钬Ho164.93032(2)68铒Er167.259(3) 69铥Tm168.93421(2)
一、初中化学课堂教学设计 1.开启化学之门----多彩的化学 〔知识目标〕 1.认识化学所研究的对象; 2.初步理解物理变化和化学变化的概念及本质区别,并能运用概念来判断一些 典型的物理变化和化学变化; 3.初步了解物质的物理性质和化学性质; 4.通过演示实验培养学生观察、描述实验、启发学生学习化学的兴趣,激发学 生学习化学的自觉性和积极性。 〔科学素养目标〕 通过物质是客观存在的、是不可灭的,只能在一定的条件下相互转化的道理,对学生进行辩证唯物主义教育,应用科学改造自然造福人类的教育。 〔教学重点〕物理变化和化学变化的概念及其应用 〔课型〕实验探究、总结、应用课 〔教学用时〕1课时 〔实验器材〕试管,铁架台,玻璃片,研钵和杵,酒精灯,坩埚钳,镊子,石棉网,单孔橡皮塞,导管,玻璃棒,烧杯,药匙,棉手帕,火柴等; 氢氧化钠溶液,酚酞试液,高锰酸钾,浓硫酸,70%的酒精溶液,胆矾,水,镁带,碱式碳酸铜,澄清石灰水等。 〔教学过程〕 表演魔术,引入新课:(魔术操作)1.“顿变鲜血”(氢氧化钠能使无色的酚酞变成红色);2.“魔棒点灯”;3.“烧不坏的手帕” 学生对此会感到神秘、奇怪,然后引导学生去看书上提出的几个为什么。讲述:我们会在生活中发现许多类似的问题,而这些有关物质及变化的问题在化学课里可以得到初步的解释,因为化学是一门研究物质的组成、结构、性质以及变化规律的基础自然科学。
强调:做以下实验时注意三个方面的观察:1.变化前的物质 2.变化时发生的现象 3.变化后产生的物质。 演示实验1:水的沸腾 讲解:水变成水蒸气只是存在状态的不同,并没有生成其它物质。 演示实验2:胆矾的粉碎边演示时边介绍仪器名称、使用方法等。 讲解:蓝色块状的胆矾研碎后变成蓝色粉末状的胆矾。 演示实验3:镁带的燃烧 讲解:镁带的颜色、状态,燃烧时发生的主要现象:放出大量的热,同时发出耀眼的白光。 演示实验4:加热碱式碳酸铜 讲解:碱式碳酸铜由绿色逐渐变黑,试管壁上有水珠,有能使石灰水变浑浊的无色气体产生。 引导学生得出结论: 从以上可以看出,实验1、2有一个共同的特征:就是物质的形态发生了变化,但没有生成其它物质。我们把这种没有生成其它物质的变化叫物理变化。 叫学生举例日常生活中的一些物理变化; 实验3、4有一个共同特征是变化时都生成了其它的物质,这种变化叫做化学变化。 在化学变化中除了生成其它物质外,还伴随发生一些现象,如发热、发光、变色放出气体、生成沉淀等等。 学生举出日常生活中的一些常见的化学变化。 小结:采取提问的方式引导学生小结物理变化、化学变化的概念,本质区别讲解:这两种变化唯一的区别是是否的新的物质生成,那么这两种变化有没有联系呢? 小结:在化学变化过程中会同时发生物理变化。例如点燃蜡烛时,石蜡受热熔化是物理变化,同时石蜡燃烧生成二氧化碳和水却是化学变化。 讲解:镁带能燃烧说明镁带具有可燃性,碱式碳酸铜受热由一种物质转化成三种新物质,说明碱式碳酸铜在加热条件下不稳定。而物质的颜色、状态、气味等不需要发生化学变化就能表现出来。
高中数学课件数学教案数学试卷数学化学资料 1.2 原子结构和相对原子质量 第1课时 原子结构 同位素 一.教学目标 1.知识与技能 (1)知道原子结构、质量数和XAZ式的含义; (2)知道构成原子的粒子间的关系; (3)知道同位素的概念和相对原子质量的含义。 2.过程与方法 (1)通过学习原子结构和同位素概念,明白科学概念的完善过程。 (2)通过学习人类对相对原子质量概念认识方法,明白人类认识的发展过程。 3.情感态度与价值观 通过原子中不同电性粒子间的关系,懂得原子是一个矛盾的对立统一体。 二.教学重点和难点 1.重点 构成原子的粒子间的关系,同位素的概念与相对原子质量。
2.难点 同位素的概念,有关相对原子质量的计算。 三.教学用品 多媒体 四.教学流程 1.设计思想 本节课内容有两部分:一是原子结构;二是同位素。新教材先讲述原子结构,再明确质量数的概念,最后在原子核结构的基础上提出了同位素的概念。内容这样安排使学生思路清晰、流畅。 本节教学内容无演示实验,理论性较强,学生对此处的内容容易产生枯燥感。为此,采用了旧中引新、设问激疑的方法,对学生进行精心的引导,并结合形象的比喻,多媒体视频,让学生亲自参与到学习新知识的过程中来,最后通过对所学知识的应用——练习,使本节课的知识得以巩固。 高中数学课件数学教案数学试卷数学化学资料 在设计方案过程中尽量调动激活学生的思维。层层设问,学生不时产生认知冲突。 在强化训练书写时可以通过“自主、合作训练”增强趣味性,让学生体验自主、合作探究及训练后获得成功的喜悦。2.流程图
3.流程图说明 (1)引言:可以复习原子结构的行星模型,通过设问激起学生的探究欲望。 (2)视频:原子的构成。从中学生可看出质子、中子与电子,并讨论比较这三种粒子。构成原子的粒子中,中子不带电,质子带正电,电子带负电,并理解原子作为一个整体不显电性的原因。 (3)教师提示电子质量很小,原子的质量主要集中在原子核上,从而引出质量数的概念。 (4)学生根据质量数的概念和原子是电中性的,归纳出两个重要的关系式: 核电荷数(Z)=核内质子数=核外电子数,质量数(A)=质子数(Z)+中子数(N) (5)用符号AZX来表示一个质量数为A,质子数为Z的具体的X原子。 多媒 原子的结构 体演示: 讨论完成表1.1
初中化学教学案例—— 创设问题情境,调动学生积极参与学习与探究 一、背景 陶行知先生说:“先生的责任不在教,而在教学,而在教学生学”,“授人一鱼,供其一饭之需,教人一渔,则其终生受用无穷。”怎样才能使学生主动发现问题,并能通过实验分析、推理、归纳而获得知识呢?我想,对初学者而言,应从任务或问题出发,通过创设情境,引发学生心理上的认知冲突,放权给学生,让他们自主实验,让他们经历科学探究的过程,体验科学探究的方法,从中获得知识和技能,获得情感体验,使学生感到化学是重要而有趣的课程。 二、教学方案 [师]下面,我想请在座的各位同学尝试解决一个问题:设计一个实验,粗略地测定空气中氧气的体积分数,学习小组先相互讨论,4分钟后,请同学们发表自己的看法和意见。 (学生4人一组围在一起讨论,情绪高涨) [生1]取一定体积的空气(一个集气瓶),把火柴点燃伸入集气瓶中,熄灭后,用原来的总体积减去后来剩余的体积,即为氧气的体积,再通过计算,便可求出氧气的体积分数。 [师]我认为,这个同学抓住了关键——利用物质在空气中燃烧消耗氧气来测定空气中氧气的体积,真是难能可贵,其他同学有什么看法?有没有需要改进的地方? [生2]按他的方案,我觉得气体的减少量无法测定。 [师]我同意。那么,如何解决这个问题?谁来帮帮他? [生3]我能不能上来画? [师]当然可以! [生3](边画边讲)先将一支长的蜡烛放在水槽底部,向水槽中加水,使水面低于蜡烛,将一个集气瓶倒罩在蜡烛上方,当蜡烛熄灭后,由于集气瓶中的氧气被消耗,所以瓶内压强减小,外界大气压就会将水压入集气瓶中,那么,水面上升多少就表明氧气的体积是多少。 [师]这个方案怎么样? (学生议论,纷纷表示同意该方案) [师]我也很欣赏这位同学的方案,他巧妙地运用物理学知识,利用倒吸入水的体积,明确地计算出被消耗掉的氧气的体积,从而测出一定体积的空气中所含氧气的体积,很有创意,那么,还有没有需要完善的地方? (学生你望望我,我望望你,没人回答,一时安静无声) [师]既然没有,我们就请同学们自己实验一下,看看你们的结果与科学家的结论是否一致? [生]学生实验,发现水面上升的高度是集气瓶体积的1/10。 [师]科学家的结论是氧气约占空气体积的1/5,而大家的实验结果是占空气体积的1/10,为什么? [生4]蜡烛燃烧放热,使剩余气体膨胀,所以液面上升的体积数偏少。 [师]也就是说,我们要等到装置完全冷却到原来的温度后再观察(约2分钟后,观察结果仍然偏小)
第六单元碳和碳的氧化物 课题3《二氧化碳和一氧化碳》 (第一课时)
《二氧化碳的性质》 一、教材分析 (一)教材的地位和作用 课题3《二氧化碳和一氧化碳》中的二氧化碳是继学习了空气、氧气、碳单质的知识之后的又一种物质,本节课的内容是初中化学重要的基础知识,它对于“如何学习有关元素及化合物知识”起到一个很好的巩固作用,同时为后面学习“燃料”、“酸碱盐”等知识作好准备,起着承上启下的作用。 (二)教学目标 在新课程理念“一切为了每一位学生的发展”的指导下,结合对教材的分析,我拟定如下教学目标: 1、知识与技能:了解二氧化碳的性质及用途,简单了解自然界中碳的循环,知道温室效应的概念。 2.过程和方法:通过分组实验的方式,提高学生的实验操作能力,并进一步掌握科学探究的一般过程和方法。 3.情感、态度与价值观:了解二氧化碳对生活和环境的影响,理解温室效应的利与弊,树立“关注社会,爱护环境”的意识。 (三)教学重点、难点 教学重点:通过探究实验认识二氧化碳性质,形成性质决定用途的化学思想。 教学难点:二氧化碳与水的化学反应原理及科学探究能力的培养。 二、学情分析 根据最近发展区,我对学生做出了以下分析: (1)知识状况: 对如何学习物质的性质已有一定的知识基础; (2)能力状况: 初步掌握了简单的化学实验基本操作技能,而对化学探 究学习方法的了解尚处于启蒙阶段。 (3)心理状况: 思维活跃、探究欲强,对化学实验充满好奇心。 三、教法和学法 根据学生的这些特点,在教学中我采用了多种教法和学法。 教法:情境引入法、问题教学法、实验演示法、科学探究法; 学法:分组实验法、分析归纳法、讨论法。
初中化学教学案例 张丽 初中化学教学案例随着新课程改革的进行,化学课程中新增了实验内容,加大了学生探究活动的内容,把以学生为主体的教育理念体现得淋漓尽致,学生真正成了课堂的主人。课堂应是鲜活的,变化的,是师生共同成长的生命历程。然而,鲜活的课堂必定给我们老师带来前所未有的挑战,即不可避免地遭遇一次又一次的“意外”。如何处理这些突如其来的“意外”呢?则是新课改下课堂教学的关键点。 案例背景: 本案例是第六章课题一“二氧化碳的制取”的内容。在课堂上由于教师的失误,演示实验出现了意外;在老师提出问题时,学生的回答与教师的预设发生了矛盾。这些意外的发生,就要求教师从容、适时、合理的解决。 案例描述: 在“实验室制取二氧化碳”这一节课的教学中,本想通过此实验让学生得出选择制取二氧化碳的所需要的药品。而此时意想不到的事情发生了:实验时,碳酸钙和稀硫酸也是反应速率适中这一意外的发生,我的头“轰”的一下大了起来。有的学生也骚动起来(提前已预习)我该怎么办呢?把结论强加给学生,还是……。我冷静了一下,面对实验的失误,我向同学们承认了自己在实验中存在的问题,这时我因势利导,组织学生共同探究失误的原因,学生的热情又高涨起来,纷纷献计献策:硫酸的浓度的用量再稀一些;使用的大理石块再大一些或者在小一些等等;课堂气氛达到了高潮。我们得
出了最终的正确结论,同时也提高了探究问题,设计实验的能力。既解决了意外事件的处理,也促进了师生的共同成长。 为了巩固对实验室制备气体的操作,我接着安排了实验,“要学生们自己设计实验步骤以及注意事项?”李碧玉同学马上站起来回答:“用实验室制取氧气的步骤”,王凯然同学说:“不行药品的状态不同,反应的条件也不一样的”两位同学的意见说出来之后全班同学都不出声音了,当时很是尴尬,我想可能是因为实验室制取氧气已经学过很久了,大家的印象不是很清楚了,我不应该直接把问题抛给他们,后来在我及时的引导下,学生一点一点的清楚了发生装置和收集装置如何确认。 讨论实验过后,我又组织同学们亲自动手实验,”在实验过程中大家也遇到一些小小的意外,不过都及时解决了,通过学生亲自动手实验,大家对化学的学习兴趣又的得到了提高,在小结是同学们各抒己见纷纷谈论了自己的收获。 案例评析: 在这节课中出现了两个意外事件,一是教师演示实验的失败,一是学生的回答与老师预想的回答发生矛盾。这两个事件的发生是我预先没有想到的,但在处理上觉得是恰当的,并收到了意想不到的效果。演示实验失败后我没有强调客观原因掩饰实验的失误,而是面对失败承认了错误,并组织了学生探究了失败的原因,引导学生从药品用量、反应条件、装置的改进等方面提出改进的方法。既培养了学生尊重客观事实的科学态度,又提高了学生探究问题、设计实验的能力。体现了在课堂中,教师是平等中的首席;在教学过程中,教师与学生共同成长的新理念。而面对学生的回答与我
1.我们知道,原子的体积和质量都很小,那么我们怎么计算才能保证数字的有效程度呢? 构成物质的微粒体积很小,质量也很小。如 10-26Kg。
1、已知一个碳-12原子的质量为1.993×10-26Kg,一个铁原子的质量为9.288×10-26Kg,则铁的相对原子质量为56 ;氧原子的相对原子质量是16,则1个氧原子的质量是3.19×10-25 Kg;银的相对原子质量是碳的相对原子质量的9倍,则银的相对原子质量是108 。 2、晶碱(Na2CO3·10H20)的相对分子质量是286 ,晶碱中结晶水的质量分数为62.9% 。 3、已知XgR2O中含有YgR,则表示R的相对原子质量的代数式为( B A、(X-Y)/16 B、8Y/(X-Y) C、16/(X-Y) D、(X- 4、原子中决定相对原子质量大小的主要微粒 ..是( D A、质子 B、质子数 C、质子和中子 D、质子数和中子数 5、下列物质中,铁元素的质量分数最大的是( B ) A、Fe2O3 B、FeO C、FeS D、Fe3O4 6、质量相等的CO和CO2中,氧元素的质量比为( B ) A、1:1 B、11:14 C、1:2 D、2:1 7、某含氮氧化物中氮与氧的质量比为7:4,该氧化中氮元素的化合价为(D ) A、+1价 B、+2价 C、+3价 D、+4价 E、+5价 8、某元素的相对原子质量为27,其硝酸盐的相对分子质量为213,则该金属元素的化合价为( A ) A、+3价 B、+2价 C、+1价 D、-1价 9、铀─235是制造原子弹的一种原料,这种铀原子的相对原子质量为235,核电荷数为92,其核内中子数为143 ,核外电子数为92 。 10、绿矾(FeSO4·7H2O)中,氧元素的质量分数为63.3% ,H2O的质量分数为45.3% 。 1、元素
初中化学教学案例分析 初中化学教学案例随着新课程改革的进行,化学课程中新增了实验内容,加大了学生探究活动的内容,把以学生为主体的教育理念体现得淋漓尽致,学生真正成了课堂的主人。课堂应是鲜活的,变化的,是师生共同成长的生命历程。然而,鲜活的课堂必定给我们老师带来前所未有的挑战,即不可避免地遭遇一次又一次的“意外”。如何处理这些突如其来的“意外”呢?则是新课改下课堂教学的关键点。因此,改变教育观念,提高控制课堂的能力,合理处理意外事件的发生等都成为教师接受挑战的新课题。下面是我处理课堂意外事件的一个教学案例: 一、案例主题 在课堂中,教师是平等的首席,学生是课堂的主人,是实验的参与者和探究者;在教学过程中,师生共同成长。 二、案例背景 本案例是第七章课题一“燃烧与灭火”的内容。在课堂上由于教师的失误,演示实验出现了意外;在老师提出问题时,学生的回答与教师的预设发生了矛盾。这些意外的发生,就要求教师从容、适时、合理的解决。三、案例描述 在“燃烧与灭火”这一节课的教学中,我结合生活中的燃烧现象,并出示了几张图片,开门见山的引入了课题,此时学生们也表现出了很强的求知欲望。接下来我着手进行演示实验7-1,本想通过此实验让学生得出燃烧所需要的条件。而此时意想不到的事情发生了:实验时,铜片上的白磷剧烈地燃烧起来(此时,红磷没有燃烧),但是,白磷燃烧的火花溅落在红磷上,红磷也燃烧起来了。这一意外的发生,我的头“轰”的一下大了起来。有的学生也骚动起来(提前已预习)我该怎么办呢?把结论强加给学生,还是……。我冷静了一下,面对实验的失误,我向同学们承认了自己在实验中存在的问题,并指着还在燃烧的红磷说:“城门失火,殃及池鱼。”同学们都笑了起来,随即又安静下来,等着老师往下进行。这时我因势利导,组织学生共同探究失误的原因,学生的热情又高涨起来,纷纷献计献策:白磷的用量再少一些;使用更大的烧杯,白磷与红磷的距离远一些;白磷燃烧后,立即用小烧杯将红磷罩上;课堂气氛达到了高潮。我们得出了燃烧条件的正确结论,同时也提高了探究问题,设计实验的能力。既解决了意外事件的处理,也促进了师生的共同成长。 为了巩固对燃烧条件的认识,我接着安排了下一个探究实验,“要使热水中的白磷也燃烧起来该怎么办?”王振同学马上站起来回答:“向水中吹气。”我一听,问题又来了:吹气主要是二氧化碳,二氧化碳不支持燃烧,白磷怎么会燃烧起来?这最起码的知识都不懂,还乱说!”可一想,老师刚才都犯错了,怎能怪学生呢!于是我笑着说:“王振同学,你上来试一试吧!”上来用导气管向水中的白磷吹气,白磷没有燃烧起来,他又使劲地吹了一大口,白磷还是没有燃烧起来,于是他有些懊丧地下去了,并趴在桌子上。见此情景,我肯定了这位同学的勇气,并要求其他同学一起来解决问题。又有学生说;“老师,应该向水中通氧气。”我说:“化学是实验的科学,只有实验才是最高法庭。你的想法是否正确,得用实验来加以证实。”并拿出事先收集好氧气的气囊,向水中通入氧气,只见水中出现因白磷燃烧而产生的火花,非常有趣。学生们非常激动,情不自禁地鼓起了掌,课堂教学又一次达到了高潮。 实验过后,我又组织同学们尝试了向水中的白磷通入空气的实验,也获得了成功。进而,我又提出问题:“通过导气管用嘴向水中吹气,为什么不能使白磷燃烧?”仍然请王振同学回答,他在老师的引导和同学的提示下找到了原因,答道“从嘴里吹出的气体大部分是二氧化碳,它不能支持白磷燃烧。这一知识点是我们前面探究过的。”我接着说:“好,请座下。我非常高兴地看到了你的进步。”大家不约而同地鼓起掌来。我注意到这位同学的表情,他的眼中又充满了自信。我的心也随之平静下来。 四、案例评析 在这节课中出现了两个意外事件,一是教师演示实验的失败,一是学生的回答与老师预想的回答发生矛盾。
解析过程: 本题答案为A ,解本题只需从相对原子质量的定义出发即可,(以一种碳原子质量的1/12作为标准,其他原子的质量与这一基准的比,称为这种原子的相对原子质量。)故A 原子的相对原子质量为:n/(m ×1/12) 规律方法: 解本题关键是:对相对原子质量的定义内涵的领悟。 相对原子质量如何计算 ? [ 初三化学] ? 题型:简答题 相对原子质量如何计算? 问题症结:找不到突破口,请老师帮我理一下思路 考查知识点: 原子中的质量关系 难度:中 解析过程: 解析:相对原子质量根据周期表查表即可,一般需要记忆,不需要计算。 如氢为1号元素,相对原子质量为1;钠为11号元素,相对原子质量为23; 氯为17号元素,相对原子质量为35.5;氧为8号元素,相对原子质量为16。等等 如果计算,也可以这样算,如果你知道一种元素的原子的质子数和中子数 则质子数+中子数=相对原子质量 如氢质子为1,中子为0,故相对原子质量为1; 氧质子为8,中子为8,故相对原子质量为16. 原子量:国际上以一种碳原子质量的 作为标准,其它原子的质量与这个标准的值比较所得的数值就是原子量 计算就是利用这个方法,如:某原子的质量为ag , C 的原子的质量为bg ,则某原子的相对原子质量为多少 根据定义:标准值为 b ×121,相对原子质量为: b a b a 1212 = 若有疑问,可以直接留言,我会及时回复,谢谢你的配合祝你学习进步! 规律方法: 根据相对原子质量的计算方法分析 知识点:相对原子质量和元素 所属知识点: [物质的组成和构成] 包含次级知识点: 原子中的质量关系、 常见元素的名称、 元素的概念、 元素符号的书写和意义、 元素的分类 知识点总结
初中化学教学案例 ——《探究空气中氧气的含量》 东宁县第二中学张伟 初中化学教学案例: 《探究空气中氧气的含量》
【案例摘要】实验教学是化学教学的重要组成部分,化学教学离不开实验。课程改进以来,化学实验在化学教学中的地位日益突出,也越来越受到化学教师的重视。“黑板上画实验”、“纸上谈实验”的现象在中学里已逐渐减少。在实验教学中必须坚持实事求是,以实验事实为依据,尊重客观事实。实验中应真实地反映和记录实验现象及数据。当观察到的实验现象与课本的叙述不一致时,不能违背事实来复述课本中有关对实验的描述。这都是我们教师在教学中对学生的要求,也是我们每个人必须遵守的原则。 【主题词】化学探究氧气含量 【案例中出现的问题】在这次实验课教学中,学生实验过程中出现了红磷燃烧完成后,进入集气瓶内水的体积超出五分之一的情况,经过反复多次实验,情况并没有好转,导致备课过程中的少于五分之一等应对无功而返,形成矛盾。 【原因及解决方案】在以往的教学过程中,这个实验的操作从来没有出现过类似的情况,我思考良久,反复试验得出这样一个原因:因为前一节课刚做了该实验,到这个班实验时,倒掉1/5的水,就开始实验,空气没有迅速地充满集气瓶,导致进水接近2/5,为避免这种情况再次出现,特提出以下注意事项: 1、如有连着上的不同班级,在上完第一个班后应及时倒掉瓶内的水,并取下塞子,让空气充分进入集气瓶。 2、把装有燃烧着红磷的燃烧匙伸入瓶中时动作要迅速,尽量减少瓶内空气的逸出,塞紧后还要用水密封瓶口,保证装置不漏气。
【案例教学过程(节选)】 【导入】通过刚才的学习,我们已经知道了空气是一种成分复杂的混合物,也知道了其中一些气体成分的含量,那么,同学吗,我们如何设计一个实验来检验一下空气中氧气的含量呢? 生:思考 师:我提示一下,想要检验氧气含量,首先要解决什么问题? 生:(分小组讨论)需要将氧气从空气中分离 师:下面开始实验,请同学们仔细观察 在做实验中,我首先让学生认真观察现象,同时观察学生的反应并了解学生在此过程中的兴趣所在。开始学生看到燃烧后冒出浓浓的白烟,表现出感兴趣的样子,但不是很强烈。但当打开弹簧夹水从烧杯沿导管进入集气瓶时,他们吃惊了,不停地小声说:“水被吸进管里了!水进入集气瓶里了!水是咋进去的呀?”课堂气氛骤然上升,学生表现出了强烈的兴趣。 “接近1/5了??到1/5了”。一切都在我的预料当中,“呀,超过1/5了”,我一看,已超过1/5标刻线的液面还在不断上升,等它停下来时液面都快接近2/5了,
课题 教学 第2课时离子与相对原子质量 离子与相对原子质量课型新授课 1.了解离子的形成,初步认识离子是构成物质的一种粒子。 知识与 2.初步了解相对原子质量的概念,并会查相对原子质量表。 技能 3.了解原子结构示意图的含义及原子最外层电子数与元素性质的 关系。 1.通过想象、猜想——探索证明——归纳原子核外电子的排 布。 备课笔记 目标过程与 方法 2.观察1~18号元素的原子结构示意图,归纳原子最外层电子 数与元素性质的关系。 3.探究分析NaCl的形成过程,了解离子的形成,初步认识离 子是构成物质的一种粒子。 情感、态度 1.逐步培养学生的微观想象能力和推导思维的方法。 与价值观 2.唤起学生对科学的好奇与向往。 教学 重点 教学 难点 教具 准备 1.离子的形成过程。 2.相对原子质量的意义。 1.核外电子运动的特点,离子的形成过程,初步认识离子是构成物质的一种粒子。 2.相对原子质量概念的形成。 多媒体课件。 1.带电的原子或原子团叫做离子,带正电的原子叫阳离子,带负电的原子叫阴离 子。 2.离子符号的意义: 课前 3Ca2+表示1个钙离子带2个单位的正电荷 预习3表示3个钙离子 1 3.相对原子质量:国际上以一种碳原子质量的为标准,其他原子的质量 12 跟它相比较所得的比值,就是该种原子的相对原子质量。
2 [引入]我们已经知道,原子是由原子核和核外电子构成的。原子核的体积 新课 仅占原子体积的几千亿分之一,相对来讲,原子核外空间很大,电子在这个空间 导入 里作高速运动。那么,电子的运动有什么规律呢?这就是这节课研究的重点。 备课笔记 进 行 新 课 知识点一、离子的形成 [阅读]请学生阅读课本 P 55“离子的形成”一段内容,同时思考问题。 (1)什么叫离子?什么叫阳离子和阴离子? (2)如何来表示离子的符号呢? (3)讲述 NaCl 的形成过程。 (4)离子与原子有什么区别与联系? [学生阅读,思考并讨论交流] [回答]问题 (1)带电的原子或原子团。带正电荷的原子叫做阳离子,带负电荷的原子 叫做阴离子。 [补充]在化学反应中,由于金属元素最外层电子数少于4,容易失去电子, 而非金属元素最外层电子数多于 4,容易得到电子,从而使参加反应的原子带上 电荷。失去电子带的是正电荷,得到电子带的是负电荷,原子失去几个电子就带 几个单位的正电荷,得到几个电子就带几个单位的负电荷。 [回答]问题(2):离子符号表示式为 X n+或 X n-,X 表示元素符号或原子团的 化学式,X 右上角的“+”或“-”表示离子带的是正电荷还是负电荷,“n”表示 带 n 个单位的电荷。例如,Al 3+表示 1 个带 3 个单位正电荷的铝离子;3 s o 2 表示 4 3 个带两个单位负电荷的硫酸根离子。 离子的写法:先写出元素符号,再在右上角标明该离子带的电荷数,注意“+、 -”在数字后面,离子带 1 个单位的正电荷或 1 个单位的负电荷时,“1”省略不 写。如:①阳离子:Na +,Mg 2+,Al 3+,NH 4+等;②阴离子:Cl -, so 4 等。③3 个硫 酸根离子:3 so 2 ;两个镁离子:2Mg 2+。 4 [回答]问题(3):钠与氯气反应时,钠原子的最外层只有 1 个电子容易失
课题1 原子的构成 【教学目标】 知识目标:1、了解原子的构成; 2、知道原子不显电性的原因; 3、初步了解相对原子质量的概念。 能力目标:1、初步学会分析、比较、归纳等方法去探究客观规律; 2、学会查相对原子质量表。 情感目标:1、进行世界的物质性、物质的可分性的辩证唯物主义观点教育; 2、通过了解我国在测定相对原子质量方面的成绩培养民族自豪感。【教学重点】原子的构成和相对原子质量的概念 【教学难点】原子的构成 【教学准备】课前准备与教材相关的课件 【教学过程】 一、导入: 教师播放课件展示电解水的过程。设计意图:使学生通过课件知道在化学变化中分子可分,原子是不可分的。 二、教学新知 1、原子的发现史 教师播放课件展示原子发现史。设计意图:让学生了解科学家研究微观粒子的想象过程及实验验证。学生能通过卢瑟福的散射实验知道原子内有一个很大的空间,并能够知道原子内有一个核心。 2、原子的构成 活动一、教师播放课件展示原子结构示意图 教师提出问题:1、原子是由什么构成的? 2、你能否用语言简单的描述一下? 目的:学生看到了微观的原子结构,能形象、直观的知道原子是一个什么样的构成。
活动二、教师播放课件展示教材中的表格4-1 教师提出问题: 1、原子核和核外电子是什么关系? 2、构成原子的粒子他们的电性怎样? 3、构成原子的粒子质量是什么样的呢? 4、原子的质量主要是由谁决定的呢? 目的:学生通过观察、分析、总结并用语言描述出原子的构成。 电子(-)质子质量的1/1836 原子质子(+) 1.6726 ×10-27 原子核 中子(不显电性) 1.6749 ×10-27 原子的质量主要决定于质子和中子 活动三、教师播放课件展示教材中表格4-2 教师提出问题: 1、原子种类不同那么就什么不同? 2、质子数和什么数相等,与什么不等? 3、所有的原子都有中子吗? 目的:学生进行分析总结能够得出原子结构中出现的一些规律。 1、原子种类不同,质子数也不同 2、核电荷数=质子数=核外电子数 3、氢原子中没有中子(即并不是所有的原子都含有中子) 活动四、教师播放课件展示原子与地球的体积比 目的:让学生感受原子体积的小及原子核更小。并转换问题引出原子的质量。活动五、教师播放课件展示氢原子、氧原子的实际质量 老师让学生到黑板把氢原子和氧原子的实际质量用科学记数法转换小数表示法目的:让学生感受原子质量在使用和书写时的不方面,科学家们便引用了相对原子质量的概念。 3、相对原子质量概念 活动六、教师播放课件展示相对原子质量概念
义务教育教科书 化学 人教版九年级上册第六单元碳和碳的氧化物 课题3《二氧化碳和一氧化碳》 (第一课时)
《二氧化碳的性质》 一、教材分析 (一)教材的地位和作用 课题3《二氧化碳和一氧化碳》中的二氧化碳是继学习了空气、氧气、碳单 质的知识之后的又一种物质,本节课的内容是初中化学重要的基础知识,它对于“如何学习有关元素及化合物知识”起到一个很好的巩固作用,同时为后面学习“燃料”、“酸碱盐”等知识作好准备,起着承上启下的作用。 (二)教学目标 在新课程理念“一切为了每一位学生的发展”的指导下,结合对教材的分析,我拟定如下教学目标: 1.知识与技能:了解二氧化碳的性质及用途,简单了解自然界中碳的循环,知道温室效应的概念。 2.过程和方法:通过分组实验的方式,提高学生的实验操作能力,并进一步掌握科学探究的一般过程和方法。 3.情感、态度与价值观:了解二氧化碳对生活和环境的影响,理解温室效应的利与弊,树立“关注社会,爱护环境”的意识。 (三)教学重点、难点 教学重点:通过探究实验认识二氧化碳性质,形成性质决定用途的化学思想。教学难点:二氧化碳与水的化学反应原理及科学探究能力的培养。 二、学情分析 根据最近发展区,我对学生做出了以下分析: (1)知识状况:对如何学习物质的性质已有一定的知识基础; (2)能力状况:初步掌握了简单的化学实验基本操作技能,而对化学探 究学习方法的了解尚处于启蒙阶段。 (3)心理状况:思维活跃、探究欲强,对化学实验充满好奇心。 三、教法和学法 根据学生的这些特点,在教学中我采用了多种教法和学法。 教法:情境引入法、问题教学法、实验演示法、科学探究法; 学法:分组实验法、分析归纳法、讨论法。
原子序数元素名称元素符号相对原子质量 1 氢 H 1.007 94(7) 2 氦 He 4.002 602(2) 3 锂 Li 6.941(2) 4 铍 Be 9.012 182(3) 5 硼 B 10.811(7) 6 碳 C 12.017(8) 7 氮 N 14.006 7(2) 8 氧 O 15.999 4(3) 9 氟 F 18.998 403 2(5) 10 氖 Ne 20.179 7(6) 11 钠 Na 22.989 769 28(2) 12 镁 Mg 24.305 0(6) 13 铝 Al 26.981 538 6(8) 14 硅 Si 28.085 5(3) 15 磷 P 30.973 762(2) 16 硫 S 32.065(5) 17 氯 Cl 35.453(2) 18 氩 Ar 39.948(1) 19 钾 K 39.098 3(1) 20 钙 Ca 40.078(4) 21 钪 Sc 44.955 912(6) 22 钛 Ti 47.867(1) 23 钒 V 50.941 5(1) 24 铬 Cr 51.996 1(6) 25 锰 Mn 54.938 045(5) 26 铁 Fe 55.845(2) 27 钴 Co 58.933 195(5) 28 镍 Ni 58.693 4(2) 29 铜 Cu 63.546(3) 30 锌 Zn 65.409(4) 31 镓 Ga 69.723(1) 32 锗 Ge 72.64(1) 33 砷 As 74.921 60(2) 34 硒 Se 78.96(3) 35 溴 Br 79.904(1) 36 氪 Kr 83.798(2) 37 铷 Rb 85.467 8(3) 38 锶 Sr 87.62(1) 39 钇 Y 88.905 85(2) 40 锆 Zr 91.224(2) 41 铌 Nb 92.906 38(2) 42 钼 Mo 95.94(2) 43 锝 Tc [97.9072]
初中化学教学设计与案例分析 结合近几年的教学体会,将自己对教学设计的理解总结如下,希望能与大家进行交流、改进,再提高。 一、分析教材(备教材) 备好课的前提是理解教材,理解教材的编写意图,这就是我们教师要备课,要常备课,常备常新的原因。正确理解教材主要包括以下几个方面。 1. 抓住重点 (1)初中化学知识点 根据中学化学《课标》,从基础知识和基本技能的角度大致划分为 基本概念、基础理论、元素化合物知识、化学用语、化学计算和化学实验 (2)知识点的作用 把握教材内容的核心所在,就是要确定教学的重点。所谓教学重点是指教材中最重要的、最基本的中心内容。核心内容具有后延续性,对后续的学习具有承前启后的作用,但不一定是考点,有可能渗透在考点之中。 例如:原子的结构决定离子的形成,离子的形成决定化合价。 氧气的化学性质决定分析物质化学性质的方法,决定测定空气中氧气含量的测定时药品的取用原则。 2. 领悟教材的教学价值 挖掘教材内容的教学价值,就是要分析和挖掘这部分内容在教材中的地位和作用,以及对学生后续学习的影响,对学生认知结构、技能、 [案例] “第六单元二氧化碳”的教学 主要体现在以下几个方面: 1.一种元素多种物质
本单元中涉及含碳元素的一系列物质,如碳的多种单质、氧化物及碳酸、碳酸钙等,一方面是物质组成与分类、物质多样性的具体体现。另一方面,碳的多种单质,一氧化碳与二氧化碳等内容,反映了同一种元素可以组成不同的单质,相同两种元素可以组成不同化合物的化学观念,加深了对物质的组成与结构、物质的多样性的认识。 2.初步形成结构决定性质的化学学科思想 通过一氧化碳与二氧化碳的性质比较,初步建立物质的组成与结构特点决定物质的性质,物质的性质是结构特点的反映;物质的性质影响用途,物质的用途反映出物质的一定性质等化学学科思想。 3.建立实验室制取气体思路 初步学习运用简单的装置和方法制取某些气体,是初中化学学习的基本实验技能。二氧化碳制取的探究,是在氧气制取的基础上的拓展和加深。 4.学会“对比”科学方法 本单元教材内容的编排思路,蕴含着“对比”这一科学方法的学习。如碳跟氧气的反应,实验条件不同,反应产物也不同。通过对照、比较,可以找出不同物质性质的共同点和不同点。寻找共性可以建立物质之间的必然联系;而发现特性是为了不同物质之间的区别,从而理解物质的鉴别方法以及不同物质在一定条件下相互转化的原理。 5.认识知识与社会生活实际以及工农业生产的联系 碳元素与人类关系密切,一氧化碳、二氧化碳、碳酸钙是生活中常见的物质;一氧化碳有损健康,二氧化碳对环境有影响等。这些内容的学习,可以有意识地引导学生从多个角度对有关的问题做出价值判断。 6.建立物质转化观 知识,从化学角度认识某一具体物质的一般在此之前 ,学生通过学习氧气o 2 思路已有了初步了解。本单元的重点是引领学生从单一物质的学习向含有同一元素的多种物质的学习迈进,帮助学生初步把握物质间的联系,找寻物质间的转化规律初步建立物质的转化观。 二、分析学生(备学生) 1、学生已有的知识经验
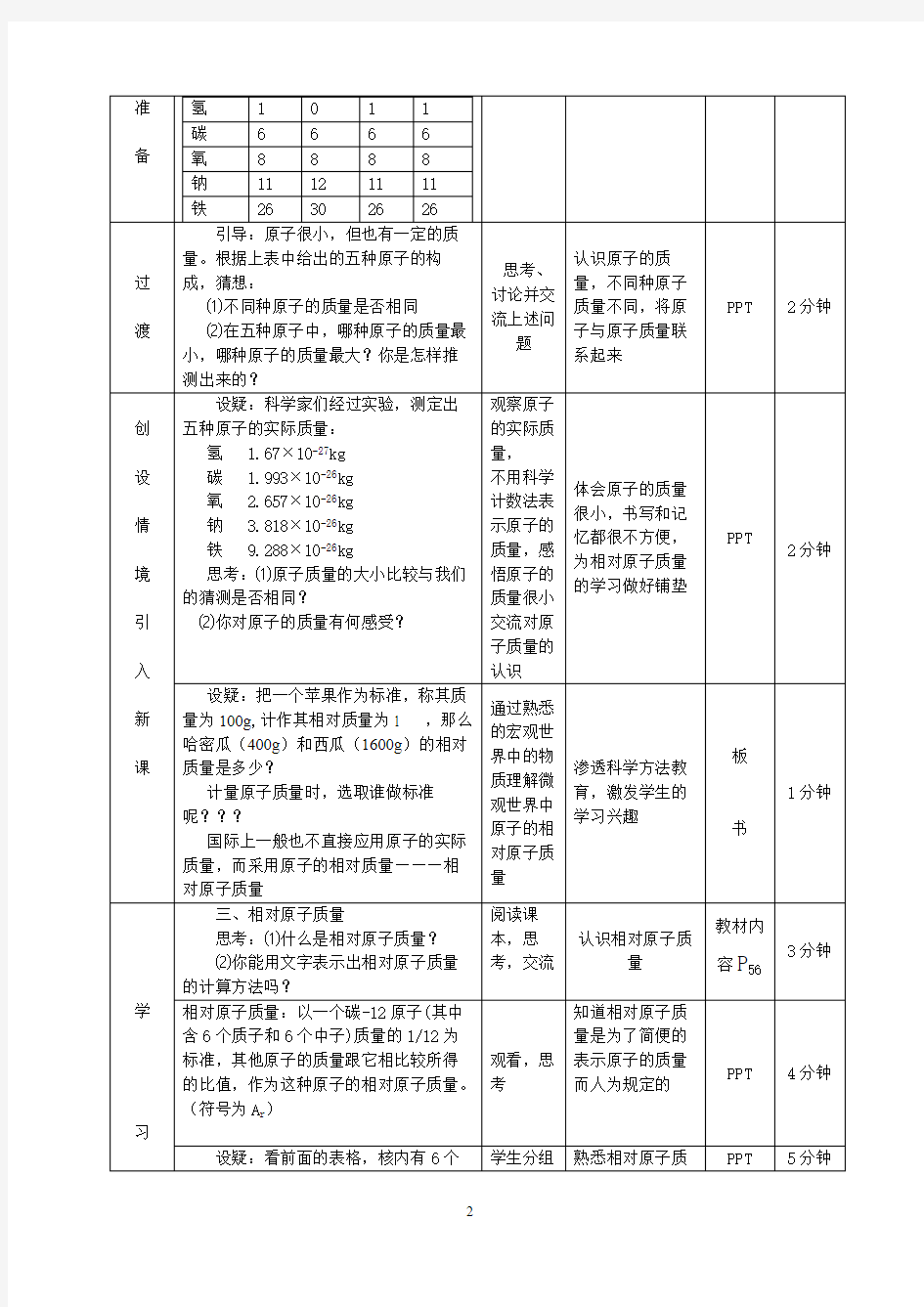
《相对原子质量》教学设计 【核心素养】 通过对相对原子质量的学习,培养学生科学的计量观念和计量意识。 【教学内容分析】 《相对原子质量》是人教2011课标版九年级化学上册第三单元《物质构成的奥秘》课题2《原子的结构》中第三课时的内容。本课时内容是原子结构的一部分,它使原子的知识体系更加完整。本课时是从量的角度,继续构建微观与宏观的联系,继续形成微粒观。同时,对相对原子质量的深刻理解也是后续的定量研究化学物质和化学反应的基础。通过学习相对原子质量,让学生体会衡量原子质量的大小,要用特定的标准,简化用宏观的单位进行计量带来的复杂,进而感悟科学计量的重要性,形成科学的计量观念和计量意识。 【学情分析】 通过前面的学习,学生在水分子的引领下进入了物质的微观世界,已经建立了分子、原子的微观概念,认识了原子的结构,并且知道原子质量很小,这是本课时的知识基础。在前面的学习中,学生已经形成了“原子质量到底有多小”、“怎么表示这么小的质量”、“用常见的方法行不行”等潜在疑问,这是本课时的生发点。学生之前并没有接触微观粒子的计量,而相对原子质量又比较抽象,对一般学生来讲理解起来有一定困难。 【教学设计思想】 1.科学创设问题情境,增强学习的针对性。从学生已有的原子结构的知识入手,引领学生根据原子结构分析、猜测原子质量的大小,再根据原子的实际质量比较原子质量的大小,最后通过相对原子质量比较原子质量的大小。通过几次有针对性的比较,让学生建立起原子、原子质量与相对原子质量之间的联系,突破本节课的难点。 2.重视科学观念的形成。通过学习相对原子质量,让学生把原子与原子质量、相对原子质量联系起来,体会衡量原子质量的大小,要用特定的标准,从而简化用宏观的单位进行计量带来的复杂,进而感悟科学计量的重要性,形成科学的计量观念和计量意识。
初中化学教学案例 《水的组成》教学案例及反思 河北中学李建辉 一、教学背景与定位: 教学起点分析:在上节中学生已经了解到在物理变化中分子本身没变,本节继续采用学生熟悉的水做知识载体,通过对水分解产生氢气和氧气的微观过程的描述,使学生认识到分子在化学变化中分解成原子,原子再重新组合形成新的分子,从而理解化学反应的实质。教学的起点定位于引导学生从观察宏观现象到用微观观点分析化学反应的实质。 教学主要方式:实验探究,信息技术与学科整合。 二、教学资源与设备: 仪器与药品:水电解器 13套(玻璃管中注满了 10%~15% 的 NaOH 溶液),启普发生器一套,锌,稀硫酸,火柴,烧杯,橡皮导管,尖嘴玻璃导管 多媒体材料:课件:( 1 )水的电解示意图( 2 )电解水实验的指导 三、教学过程: (一)提出问题导入 我们已经知道,水在加热时变成水蒸气。水的三态变化,只是水分子间隔改变。而“每个水分子由两个氢原子和一个氧原子构成”,这一事实始终没变。那么,如果在水中插入电极,通以直流电,情形是否有所不同呢? (二)解决方法: 用实验验证 (三)学生分组实验(共 13个小组,每组 4 人,实验时学生只需插上电源即可) 展示多媒体指导实验 同学们在实验中要学会合作学习运用观察法,仔细观察实验现象 ( 1 )两个电极,两支玻璃内液面有什么变化: 两个电极产生气泡,并且与正极连接产生的气泡慢,负极连接产生的气泡快。通电一段时间后,两极玻璃上部汇集的气体体积比大约是 V 正极: V 负极 =1 : 2 。 ( 2 )用燃着的火柴接近液面下降较快的玻璃管尖嘴处,慢慢打开活塞,观察所发生的现象。 管中的气体被点燃 ( 3 )用带火星的木条,接近液面下降较慢的玻璃管尖嘴处,慢慢打开活塞,观察所发生的现象。