
小型合成氨节能技术
摘要:随着我国社会的发展对能源的需求量在不断加大,合成氨对我国的工农业的发展有着举足轻重的作用,目前我国有很多小型的合成氨企业,对于如何提高合这些成氨过程的能量利用率是一个有待于慢慢解决的问题。本论文就有关小型合成氨过程的能量做了小部分的分析,搜集了相关资料并对小型合成氨节能方面提出了一些方法。
关键字:能源合成氨利用率节能分析
一、合成氨的生产方法
氨的合成,首先必须制备合格的氢、氮原料气。氢气一般常用含有烃类的各种燃料,即通过用焦炭,无烟煤,天然气,重油等为原料与水蒸气作用的方法来制取,氮气可将空气液化分离而得,或使空气通过燃烧将生成的CO、CO2 除去而制得。合成氨的生产过程,主要包括以下三个步骤:
(1)造气:即制备含有氢、氮的原料气;
(2)净化:无论采用何种方法造气,原料气中都含有对合成氨有害的各种杂质,必须采取适当的方法除去这些杂质。
(3)压缩和合成:将合格的氮、氢混合气体压缩到高压,在铁催化剂的存在下合成氨。
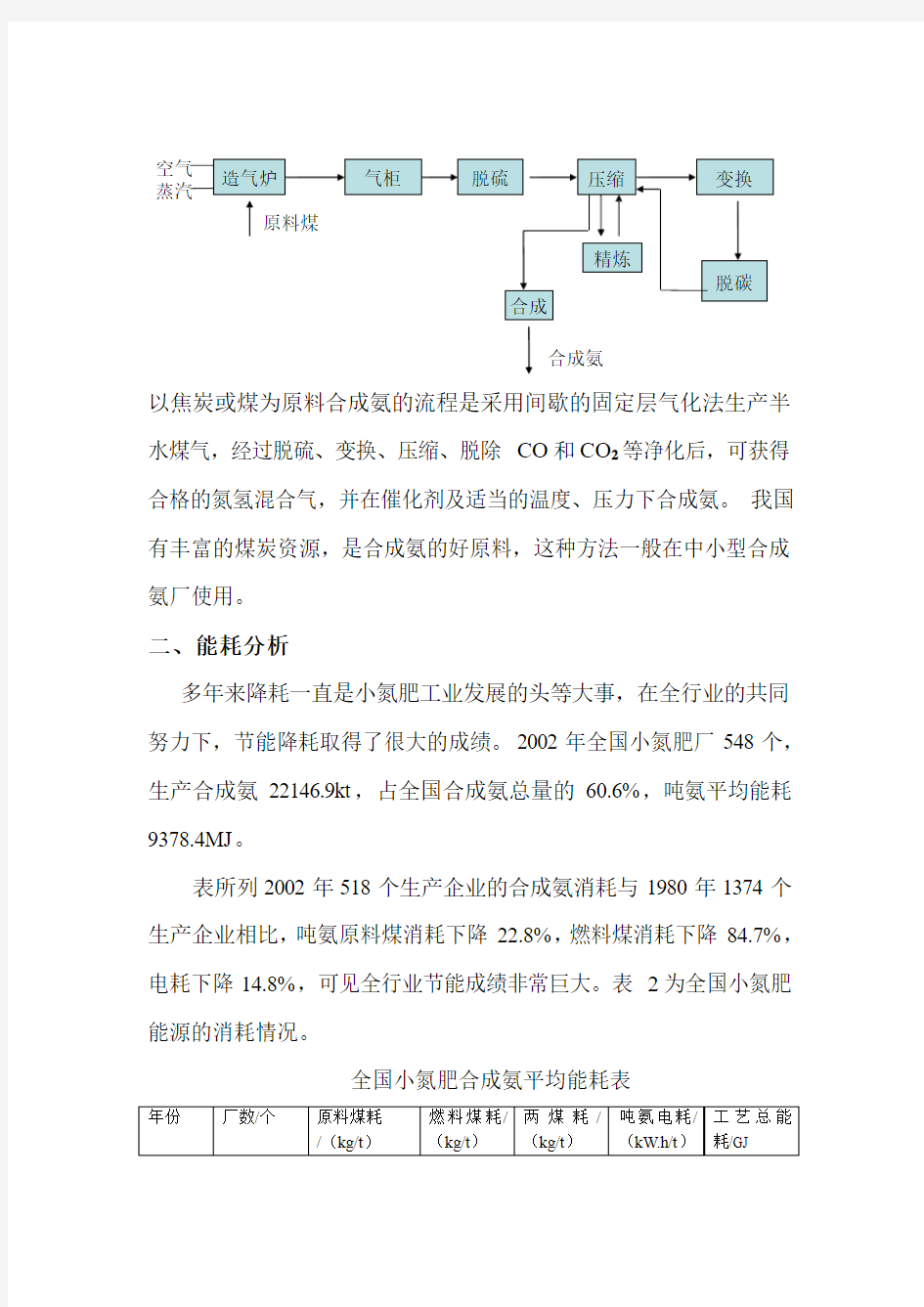
小型合成氨厂多以焦炭或煤为原料制成合成氨其原则流程图如图所示:
空气
蒸汽造气炉
原料煤气柜脱硫压缩变换
精炼
合成
合成氨
脱碳
以焦炭或煤为原料合成氨的流程是采用间歇的固定层气化法生产半水煤气,经过脱硫、变换、压缩、脱除CO 和CO 2等净化后,可获得合格的氮氢混合气,并在催化剂及适当的温度、压力下合成氨。我国有丰富的煤炭资源,是合成氨的好原料,这种方法一般在中小型合成氨厂使用。
二、能耗分析
多年来降耗一直是小氮肥工业发展的头等大事,在全行业的共同努力下,节能降耗取得了很大的成绩。2002年全国小氮肥厂548个,生产合成氨22146.9kt ,占全国合成氨总量的60.6%,吨氨平均能耗9378.4MJ 。
表所列2002年518个生产企业的合成氨消耗与1980年1374个生产企业相比,吨氨原料煤消耗下降22.8%,燃料煤消耗下降84.7%,电耗下降14.8%,可见全行业节能成绩非常巨大。表2为全国小氮肥能源的消耗情况。
全国小氮肥合成氨平均能耗表 年份 厂数/个 原料煤耗
/(kg/t ) 燃料煤耗/(kg/t ) 两煤耗/(kg/t ) 吨氨电耗/(kW.h/t ) 工艺总能耗/GJ
1980 1374 1463 931 2394 1506 88.55 2002 518 1130 142 1272 1283 52.46
全国小氮肥能源消耗表
生产1t合成氨理论上需要消耗1588kg蒸汽,小氮肥厂一般1t 合成氨造气工段需2—3t蒸汽,变换需用800kg左右蒸汽,精炼需用500kg左右蒸汽,所需蒸汽由自备锅炉供给。自1978年以来,行业大力推广节能降耗十项措施,尤其是20世纪80年代中期,原化工部将“两煤变一煤”列为科技攻关项目,组织力量开发造气、变换、铜洗、合成工段热能的回收分级利用。在稳定生产、多产氨的前提下,减少蒸汽消耗量,充分回收各工段余热,按质用能,按需供能,实现低位能和高位能各尽其用,并用严格的管理来确保生产处于最佳运行状况,不仅做到了合成氨蒸汽自给,而且有适量的外供热水和蒸汽,大大降低了合成氨的能耗。
20世纪90年代以来,以低温变换技术、新型氨合成塔内件、新型氨合成催化技术及循环流化床燃渣锅炉技术为重点,经过多年试验,进一步改进,在合成氨生产蒸汽自给的基础上,继续发展到有超过1.6t富裕蒸汽可供小氮肥厂和其他化工产品用汽。
但是,目前行业内吨氨能耗高低相差还很悬殊,据统计,行业中消耗低的前20个企业,吨氨平均两煤耗900kg,平均896KW.h而行业中能耗高的后100个企业平均两煤耗1723kg,高于消耗低的企业近一倍,可见,这些企业节能消耗潜力还很大。
小氮肥行业正对以下重大节能项目进行积极开发工作,并取得一
定的成果。
1、以煤为原料的合成氨生产中,存在造气气化压力低,致使高耗能现象。如果利用粉煤使造气的气化技术由目前的间歇气化实现连续气化、从常压气化实现加压气化、从固定床变化到流动床,将会大幅度降低合成氨的能耗。
2、氨的合成是在高压下进行,必然消耗大量的动力,如果降低氨合成的压力,将会大幅度降低合成氨的电耗。
3、合成氨—尿素生产实现蒸汽自给的推广应用可大幅度降低能耗。
4合成氨及小尿素装置全流程中各工序的过程优化及计算机控制。
三、节能技术
1、推广低温变换工艺技术
1)一氧化碳低硫低温变换工艺技术采用二段中变,二段低变催化反应的工艺技术。第二中变和第一低变在较高温度下反应,具有速度快的动力学的优势。第二低变在低温下工作,具有低温段反应平衡CO浓度低的热力学优势。该工艺能满足各种传统合成氨流程对变换的要求,适应性强。实践证明,在设计负荷下装置阻力一般在0.05MPa 左右,吨氨蒸汽消耗一般在200—350kg。
2)中低低变换工艺技术采用一段中变、二段低变催化反应的工艺技术,并以饱和热水塔为中心构成了优化的热回收系统,其效果是可在0.35-0.45的低汽气比条件下,维持较快的反应速率和高变换率,
由于汽气比低、热回收率高,出热水塔的变换气温度可降至45-60℃可取消传统的第二水加热器,吨氨变换蒸汽消耗可降至150-250kg,变换系统内的设备更为高效、紧凑,降低了设备投资。对变换中串低系统改造,可使生产能力提高50%-120%。
3)全低变工艺技术采用三段Co-Mo低温变换催化剂的变换工艺技术是使变换反应在低温状态下进行,有利于反应趋向适宜操作曲线,可以大幅度降低蒸汽消耗,吨氨变换耗气可降至250-300kg。利用原中串低变换系统主要设备改造为低温变换工艺时,可使原变换系统生产能力增加50%-100%,并有利于有机硫的转化,使出口有机硫降至2mg/m3.
2、进一步优化的合成氨蒸汽自给技术
近年来,合成氨蒸汽自给技术又有了突破性进展:上、下行煤气余热等中回收器、D型风机、重风燃烧炉的开发应用,提高了第一热力网络的技术水平;低温变换工艺和氨合成节能流程的推广应用,更加优化了第二热力网络的工艺。循环流化床燃渣锅炉的应用,在推广小尿素“六改十”“四改十”技术,即采用预分离、预蒸馏等十项技术措施,使装置生产能力有大幅度提高,使产品氨耗、气耗明显下降。将合成氨和尿素生产工艺余热合理回收和利用,组成新型热力网络实现合成氨-尿素生产蒸汽自给。
3、全燃渣循环流化床锅炉技术
全燃渣循环流化床锅炉是采用水冷漩涡内分离器技术,在炉膛内布置水冷漩涡内分离器。由于该分离器为炉膛的延伸,本身为受热面,故
允许飞灰残炭在其中继续燃烧,使燃烧时间大大延长,燃烧效率大幅度提高,而结焦的可能性很小。另外在尾部竖两级省煤器间加设中高温高效多管旋风预分离器,并在U行阀将分离物送回炉膛循环燃烧。采用壁厚管为埋管并加铁铝磁防磨护瓦及其填充料,在不影响传热的情况下,防止埋管磨损,延长埋管寿命。
对于合成氨在节能技术上还可以有很大的改进空间,在我们渐渐对这个工艺不断地了解,会有更多的节能技术被提出来应用于生产的改进,从而产生良好的经济效益。
参考文献:化工节能技术手册中国化工节能技术协会编北京:化学工业出版社,2005,12
化学工艺学浙江大学编北京:高等教育出版社,2001,7
化学工艺学米镇涛主编北京:化学工业出版社,2006,3
化工热力学答案_课后总习题答案详解 第二章习题解答 一、问答题: 2-1为什么要研究流体的pVT 关系? 【参考答案】:流体p-V-T 关系是化工热力学的基石,是化工过程开发和设计、安全操作和科学研究必不可少的基础数据。(1)流体的PVT 关系可以直接用于设计。(2)利用可测的热力学性质(T ,P ,V 等)计算不可测的热力学性质(H ,S ,G ,等)。只要有了p-V-T 关系加上理想气体的id p C ,可以解决化工热力学的大多数问题。 2-2在p -V 图上指出超临界萃取技术所处的区域,以及该区域的特征;同时指出其它重要的点、线、面以及它们的特征。 【参考答案】:1)超临界流体区的特征是:T >T c 、p >p c 。 2)临界点C 的数学特征: 3)饱和液相线是不同压力下产生第一个气泡的那个点的连线; 4)饱和汽相线是不同压力下产生第一个液滴点(或露点)那个点的连线。 5)过冷液体区的特征:给定压力下液体的温度低于该压力下的泡点温度。 6)过热蒸气区的特征:给定压力下蒸气的温度高于该压力下的露点温度。 7)汽液共存区:在此区域温度压力保持不变,只有体积在变化。 2-3 要满足什么条件,气体才能液化? 【参考答案】:气体只有在低于T c 条件下才能被液化。 2-4 不同气体在相同温度压力下,偏离理想气体的程度是否相同?你认为哪些是决定偏离理想气体程度的最本质因素? 【参考答案】:不同。真实气体偏离理想气体程度不仅与T 、p 有关,而且与每个气体的临界特性有 ()() () () 点在点在C V P C V P T T 00 2 2 ==?? ?
关,即最本质的因素是对比温度、对比压力以及偏心因子r T ,r P 和ω。 2-5 偏心因子的概念是什么?为什么要提出这个概念?它可以直接测量吗? 【参考答案】:偏心因子ω为两个分子间的相互作用力偏离分子中心之间的作用力的程度。其物理意义为:一般流体与球形非极性简单流体(氩,氪、氙)在形状和极性方面的偏心度。为了提高计算复杂分子压缩因子的准确度。 偏心因子不可以直接测量。偏心因子ω的定义为:000.1)p lg(7.0T s r r --==ω , ω由测定的对比温度为0.7时的对比饱和压力的数据计算而得,并不能直接测量。 2-6 什么是状态方程的普遍化方法?普遍化方法有哪些类型? 【参考答案】:所谓状态方程的普遍化方法是指方程中不含有物性常数a ,b ,而是以对比参数作为独立变量;普遍化状态方程可用于任何流体、任意条件下的PVT 性质的计算。普遍化方法有两种类型:(1)以压缩因子的多项式表示的普遍化关系式 (普遍化压缩因子图法);(2)以两项virial 方程表示的普遍化第二virial 系数关系式(普遍化virial 系数法) 2-7简述三参数对应状态原理与两参数对应状态原理的区别。 【参考答案】:三参数对应状态原理与两参数对应状态原理的区别在于为了提高对比态原理的精度,引入了第三参数如偏心因子ω。三参数对应态原理为:在相同的 r T 和r p 下,具有相同ω值的所有 流体具有相同的压缩因子Z ,因此它们偏离理想气体的程度相同,即),P ,T (f Z r r ω=。而两参数对应状态原理为:在相同对比温度r T 、对比压力 r p 下,不同气体的对比摩尔体积r V (或压缩因子z ) 是近似相等的,即(,) r r Z T P =。三参数对应状态原理比两参数对应状态原理精度高得多。 2-8总结纯气体和纯液体pVT 计算的异同。 【参考答案】: 由于范德华方程(vdW 方程)最 大突破在于能同时计算汽、液两相性质,因此,理论上讲,采用基于vdW 方程的立方型状态方程能同时将纯气体和纯液体的性质计算出来(最小值是饱和液体摩尔体积、最大值是饱和气体摩尔体积),但事实上计算的纯气体性质误差较小,而纯液体的误差较大。因此,液体的p-V-T 关系往往采用专门计算液体体积的公式计算,如修正Rackett 方程,它与立方型状态方程相比,既简单精度又高。 2-9如何理解混合规则?为什么要提出这个概念?有哪些类型的混合规则? 【参考答案】:对于混合气体,只要把混合物看成一个虚拟的纯物质,算出虚拟的特征参数,如Tr ,
第一章绪论 (1)明确化工热力学的主要任务是应用经典热力学原理,推算物质的平衡性质,从而解决实际问题,所以物性计算是化工热力学的主要任务。 (2)掌握热力学性质计算的一般方法 (3)热力学性质计算与系统有关。大家必须明确不同系统的热力学性质计算与其热力学原理的对应关系,这一点对于理解本课程的框架结构十分重要。 第二章流体的P-V-T关系 (1)应该理解状态方程不仅可以计算流体的p-V-T性质,而且在推算热力学性质中状态方程是系统特征的重要模型。 (2)熟悉纯物质的P-V-T相图及其相图上的重要概念,如三相点、临界点、汽化线、熔化线、升华线、等温线、等压线等容线、单相区、两相共存区、超临界流 体区等。能在p-v图和p-T图中定性表达出有关热力学过程和热力学循环。 (3)掌握由纯物质的临界点的数学特征约束状态方程常数的方法。 (4)理解以p为显函数和以V为显函数的状态方程的形式,以及它们在性质计算中的区别。 (5)能借助于软件用PR和SRK方程进行p-V-T性质计算,清楚计算时所需要输入的物性常数及其来源。对于均相混合物性质的计算,需要应用混合法则,了解 相互作用参数的含义和取值。 (6)理解对应态原理的概念,掌握用图表和三参数对应态原理计算物性的方法,了解偏心因子对应态原理。 (7)能够通过查寻有关手册,估算蒸汽压、饱和气液相摩尔体积、汽化焓等物性,清楚它们之间的关系。 第三章流体热力学性质间的关系 (1)均相封闭系统的热力学原理给出了热力学性质之间的普遍化依赖关系,结合表达系统特征的模型就能获得不同热力学性质之间的具体表达式。在物性推算中 应该明确需要给定的独立变量,需要计算的从属变量,以及从属变量与独立变 量之间的关系式。另外,还必须输入有关模型参数,结合一定的数学方法,才 能完成物性推算。 (2)清楚剩余性质的含义,能用剩余性质和理性气体热容表达状态函数的变化。能够用给定的状态方程推导出剩余性质表达式。 (3)掌握状态方程计算纯物质饱和热力学性质饿原理,这是属于非均相系统性质计算,在计算时需要将状态方程与相平衡准则结合起来。 (4)掌握纯物质的压焓图和温熵图的特征以及相图上的重要的点、线、面。运用压焓图和温熵图定性表达热力学状态、过程和定量计算热力学性质。了解压焓图、 温熵图以及p-V-T相图之间的相互对应关系。 (5)熟练掌握并能运用水的性质表。 (6)了解用热力学性质解析计算方法来制作热力学性质图、表的基本原理。 第四章化工过程的能量分析 (1)稳定流动系统的热力学第一定律与封闭系统是不一样的,常用焓值进行热量衡算,若使用热力学性质图,常使用温熵图和压焓图。 (2)能量的可利用程度或品质高低由有效能来衡量。通过有效能来计算过程的能量
化工热力学课程论文 专业班级:10级核化101班 姓名:高超 学号:20104150120 任课老师:阳鹏飞 日期:2012年12月28日
空气分离 -----热力学第二定律在空分中的应用 摘要:热力学第二定律作为判定与热现象有关的物理过程进行方向的定律,本文分析了热力学第二定律的涵义以及意义,并阐述了它在在空分中的应用。 关键字:空分制冷 Abstract: the second law of thermodynamics as a judge and thermal phenomena related to the physical process of the direction of the law, this paper analyses the meaning and significance of the second law of thermodynamics, and expounds its application in air separation. Keywords: air separation refrigeration 引言 空气中的主要成分是氧和氮,它们分别以分子状态存在,均匀地混合在一起,通常要将它们分离出来比较困难,目前工业上主要有3种实现空气分离方法:吸附法、膜分离法和深冷法(也称低温法)。深冷法是目前工业上应用最广泛的空气分离方法。 其基本过程是先将混合物空气通过压缩、膨胀和降温,直至空气液化,然后利用氧、氮汽化温度(沸点)的不同进行精馏分离。流程可分为:空气过滤系统、空气压缩机系统、空气预冷系统、空气净化系统、空气压缩膨胀制冷系统、空气分离系统。其中空气压缩膨胀制冷系统对整个空气分离过程来说至关重要。 制冷按照制冷温度大小,分为三类:普通制冷:t>-120℃;深度制冷:-120℃>t>-253℃;超低温制冷:t<-253℃。空气的液化技术属于深度制冷。 工业制冷主要方法之一为气体膨胀制冷:将高压气体做绝热膨胀,使其压力、温度下降,利用降温后的气体来吸取被冷却物体的热量从而制冷。 0.制冷的原理
化学化工学院《化工热力学》课程考试试题(A 卷) 2013-2014学年 第一学期 班级 时量120分钟 总分100分 考试形式:闭卷 一、填空题(24分,每空1.5分) 1、写出热力学基本方程式dU= ;dA = 。 2、几个重要的定义公式: A= ; H= ;G=__________。 3、对理想溶液,ΔH=_______,ΔS=________。 4、热力学第一定律的公式表述(用微分形式): 。 5、等温、等压下的二元液体混合物的活度系数之间的关系_________+0ln 11=γd x 。 6、化工热力学研究的主要方法包括: 、 、 。 7、以压缩因子表示的三参数对应态原理的关系式: 。 8、朗肯循环的改进的方法: 、 、 。 二、选择题(每个2分,共22分,每题只一个选择项是正确答案) 1、纯物质的第二virial 系数( ) A 、仅是温度的函数 B 、是温度和压力的函数 C 、 是温度和体积的函数 D 、是任何两强度性质的函数 2、泡点的轨迹称为( ) A 、饱和汽相线 B 、汽液共存线 C 、饱和液相线 3、等温等压下,在A 和B 组成的均相体系中,若A 的偏摩尔体积随A 浓度的减小而减小,则B 的偏摩尔体积将随A 浓度的减小而( ) A 、增加 B 、减小 C 、不变 D 、不一定 4、关于活度和活度系数的下列说法中不正确的是 ( ) A 、活度是相对逸度,校正浓度,有效浓度; B 、理想溶液活度等于其浓度。 C 、活度系数表示实际溶液与理想溶液的偏差。 D 、γi 是G E /RT 的偏摩尔量。 5、在一定的温度和压力下二组分体系汽液平衡的条件是( )。 为混合物的逸度)) (; ; ; L2V1V2L1L2 L1V2122f f f D f f f f C f f f f B f f f f A V L V L V L V (????).(????)(????).(=======11 6、关于偏摩尔性质,下面说法中不正确的是( ) A 、纯物质无偏摩尔量。 B 、T 与P 一定,偏摩尔性质就一定。
化工热力学课后答案 第1章 绪言 一、是否题 1. 封闭体系的体积为一常数。(错) 2. 封闭体系中有两个相βα, 。在尚未达到平衡时,βα,两个相都是均相敞开体系; 达到平衡时,则βα,两个相都等价于均相封闭体系。(对) 3. 理想气体的焓和热容仅是温度的函数。(对) 4. 理想气体的熵和吉氏函数仅是温度的函数。(错。还与压力或摩尔体积有关。) 5. 封闭体系的1mol 气体进行了某一过程,其体积总是变化着的,但是初态和终态的体积相 等,初态和终态的温度分别为T 1和T 2,则该过程的? =2 1 T T V dT C U ?;同样,对于初、终态 压力相等的过程有? =2 1 T T P dT C H ?。(对。状态函数的变化仅决定于初、终态与途径无关。) 二、填空题 1. 状态函数的特点是:状态函数的变化与途径无关,仅决定于初、终态 。 2. 封闭体系中,温度是T 的1mol 理想气体从(P i ,V i )等温可逆地膨胀到(P f ,V f ),则所做的 功为() f i rev V V RT W ln =(以V 表示)或() i f rev P P RT W ln = (以P 表示)。 3. 封闭体系中的1mol 理想气体(已知ig P C ),按下列途径由T 1、P 1和V 1可逆地变化至P 2,则 A 等容过程的 W = 0 ,Q =() 1121T P P R C ig P ??? ? ??--, U =( )11 2 1T P P R C ig P ??? ? ? ?--,H = 112 1T P P C ig P ??? ? ??-。 B 等温过程的 W =21ln P P RT -,Q =2 1ln P P RT ,U = 0 ,H = 0 。 C 绝热过程的 W =( ) ???? ????? ? -???? ??--112 11ig P C R ig P P P R V P R C ,Q = 0 ,U = ( ) ??????????-???? ??-11211ig P C R ig P P P R V P R C ,H =1121T P P C ig P C R ig P ??????????-???? ??。
化工热力学复习总结
第一章、绪论 一、化工热力学的目的和任务 通过一定的理论方法,从容易测量的性质推测难测量的性质、从有限的实验数据获得更系统的物性的信息具有重要的理论和实际意义。 化工热力学就是运用经典热力学的原理,结合反映系统特征的模型,解决工业过程(特别是化工过程)中热力学性质的计算和预测、相平衡和化学平衡计算、能量的有效利用等实际问题。 二、1-2化工热力学与物理化学的关系 化工热力学与物理化学关系密切,物理化学的热力学部分已经介绍了经典热力学的基本原理和理想系统(如理想气体和理想溶液等)的模型,化工热力学将在此基础上,将重点转移到更接近实际的系统。 三、热力学性质计算的一般方法 (1)基于相律分析系统的独立变量和从属变量; (2)由经典热力学原理得到普遍化关系式。特别是将热力学性质与能容易测量的p、V、T及组成性质和理想气体等压热容联系起来; (3)引入表达系统特性的模型,如状态方程或活度系数; (4)数学求解。 第2章流体的P-V-T关系 1.掌握状态方程式和用三参数对应态原理计算PVT性质的方法。 2.了解偏心因子的概念,掌握有关图表及计算方法。 1.状态方程:在题意要求时使用该法。 ①范德华方程:常用于公式证明和推导中。
②R—K 方程: ③维里方程: 2.普遍化法:使用条件:在不清楚用何种状态方程的情况下使用。 三参数法: ①普遍化压缩因子法 ②普遍化第二维里系数法 3、Redlich-Kwong(RK)方程 3、Soave(SRK)方程 4、Peng-Robinson(PR)方程 () 22 a0.45724c r c R T T P α =0.0778c c RT b P = §2-5高次型状态方程 5、virial方程 virial方程分为密度型: 和压力型: 第3章纯物质的热力学性质 1、热力学性质间的关系
气体p-V-T关系的编程计算 摘要 本文运用c语言编程的方法,解决化工热力学中的气体p-V-T关系的计算。 在化热力学气体p-V-T关系的计算过程中,有很多复杂的计算,有些需要进行复杂的小数计算,还有谢问题需要通过反复迭代才能得到结果。在解决这些问题时通过编程计算成为大家选择的最佳途径之一。本文系统的对这些程序做了汇集、汇编、整理,得到了可以直接应用的程序。 本程序充分考虑了人机语言转换的障碍,在人机交流的过程中会自动提示使用者进行操作:在输入数据时,会有输入格式说明等提示;在结果输出时,会把运算公式、计算迭代过程以及运算结果一并输出,方便使用者解决问题。 程序中使用的是C语言做计算,程序中使用了if,for,switch语句等基础函数语句和函数调用的基本方法,函数之间结合比较简单,使用者也可以按自己的需求自行改动函数语句。 本程序的主函数部分如下: #include
中国石油大学(北京)远程教育学院 期 末 考 核 《 化工热力学 》 一、请学生运用所学的化工热力学知识,从以下给定的题目中选择至少选择2个题目进行论述:(总分100分) 1.教材中给出了众多的状态方程,请根据本人的工作或者生活选择一个体系、选择一个状态方程、对其PVT 关系的计算准确度进行分析,并提出改进的方向和意见。 丙烯的PVT 状态分析 近期我正在中海石油中捷石化甲醇车间进行培训,在甲醇净化工段丙烯为利用最多的制冷剂,在学习丙烯压缩工段的同时对丙烯的物化性质也有了深入了解。 丙烯的理化学性质:丙烯是一种无色略带甜味的易燃气体,分子式为CH 3CH=CH 2,分子量为42.08,沸点-47.7℃,熔点为-185.25℃,其密度为空气的 1.46倍,临界温度为91.8℃,临界压力为4.6Mpa ,爆炸极限为 2.0~11%(vol ),闪点为-108℃。(因此,丙烯在贮藏时要特别小心,如果发生泄漏,因为它比空气重,积聚在低洼处及地沟中,如在流动过程中遇到火星,则极易引起爆炸,酿成严重后果。) 选择用R-K 状态方程计算对液态丙烯的PVT 关系计算准确度进行分析,从《化工热力学、陈光进等编著》中查得丙烯的临界数据为Tc=364.9K;p c =46.0*10-1 MPa, 下面是中海石油中捷石化给定的丙烯性质数据。 温度 (℃) -40 -30 -20 -10 0 10 20 30 40 50
为了计算方便,用excel 换算和简单计算得到新的数据如下: R-K 方程:() b v v T a b v RT p +--=5.0 () 2 5.0665 .25.223409.16106.49.3643146.842748.042748.0-???=???==mol K Pa m p T R a c c () 1356107145.5106.49.3643146.808664.008664.0--??=???==mol m p RT b c c 由上表又知道摩尔体积v ,故根据R-K 方程,用excel 可分别计算得到各温度下的压力值P 1: 压力 (atm ) 1.401 2.097 3.023 4.257 5.772 7.685 10.046 12.911 1 6.307 20.299 体积 (mL/g ) 12966 6404 4639 3423 2569 1957 1510 1510 1177 922 温度 (℃) -40 -30 -20 -10 0 10 20 30 40 50 温度(K ) 233 243 253 263 273 283 293 303 313 323 压力P (1*10-1MPa ) 1.4196 2.1248 3.0631 4.3134 5.8485 7.7868 10.1791 13.0821 1 6.5231 20.5680 摩尔体积v (1*10-5m 3/mol) 54560.928 26948.032 19520.912 14403.984 10810.352 8235.056 6354.080 6354.080 4952.816 3879.776 温度 (℃) -40 -30 -20 -10 0 10 20 30 40 50 压力P (1*10-1MPa ) 1.4196 2.1248 3.0631 4.3134 5.8485 7.7868 10.1791 13.0821 1 6.5231 20.5680 计算压力 P 1(1*10-1MPa) 1.0288 2.1706 3.1182 4.3903 6.0679 8.2505 11.0602 11.4412 15.1467 19.9288
为什么要研究流体的pVT 关系? 答:在化工过程的分析、研究与设计中,流体的压力p 、体积V 和温度T 是流体最基本的性质之一,并且是可以通过实验直接测量的。而许多其它的热力学性质如内能U 、熵S 、Gibbs 自由能G 等都不方便直接测量,它们需要利用流体的p –V –T 数据和热力学基本关系式进行推算;此外,还有一些概念如逸度等也通过p –V –T 数据和热力学基本关系式进行计算。因此,流体的p –V –T 关系的研究是一项重要的基础工作。 理想气体的特征是什么? 答:假定分子的大小如同几何点一样,分子间不存在相互作用力,由这样的分子组成的气体叫做理想气体。严格地说,理想气体是不存在的,在极低的压力下,真实气体是非常接近理想气体的,可以当作理想气体处理,以便简化问题。 理想气体状态方程是最简单的状态方程: RT pV = 偏心因子的概念是什么?为什么要提出这个概念?它可以直接测量吗? 答:纯物质的偏心因子ω是根据物质的蒸气压来定义的。实验发现,纯态流体对比饱和蒸气压的对数与对比温度的倒数呈近似直线关系,即符合: ??? ? ??-=r s r T p 11log α 其中,c s s r p p p = 对于不同的流体,α具有不同的值。但Pitzer 发现,简单流体(氩、氪、氙)的所有蒸气 压数据落在了同一条直线上,而且该直线通过r T =0.7,1log -=s r p 这一点。对于给定流体 对比蒸气压曲线的位置,能够用在r T =0.7的流体与氩、氪、氙(简单球形分子)的s r p log 值之差来表征。 Pitzer 把这一差值定义为偏心因子ω,即 )7.0(00.1log =--=r s r T p ω 任何流体的ω值都不是直接测量的,均由该流体的临界温度c T 、临界压力c p 值及r T =0.7时的饱和蒸气压s p 来确定。 纯物质的饱和液体的摩尔体积随着温度升高而增大,饱和蒸气的摩尔体积随着温度的升高而 减小吗? 答:正确。由纯物质的p –V 图上的饱和蒸气和饱和液体曲线可知。 同一温度下,纯物质的饱和液体与饱和蒸气的热力学性质均不同吗? 答:同一温度下,纯物质的饱和液体与饱和蒸气的Gibbs 自由能是相同的,这是纯物质气液平衡准则。气他的热力学性质均不同。 常用的三参数的对应状态原理有哪几种? 答:常用的三参数对比态原理有两种,一种是以临界压缩因子Zc 为第三参数;另外一种是
模拟题一 一.单项选择题(每题1分,共20分) T 温度下的纯物质,当压力低于该温度下的饱和蒸汽压时,则气体的状态为( ) 饱和蒸汽 超临界流体 过热蒸汽 T 温度下的过冷纯液体的压力P ( ) >()T P s <()T P s = ()T P s T 温度下的过热纯蒸汽的压力P ( ) >() T P s <() T P s =() T P s 纯物质的第二virial 系数B ( ) A 仅是T 的函数 B 是T 和P 的函数 C 是T 和V 的函数 D 是任何两强度性质的函数 能表达流体在临界点的P-V 等温线的正确趋势的virial 方程,必须至少用到( ) 第三virial 系数 第二virial 系数 无穷项 只需要理想气体方程 液化石油气的主要成分是( ) 丙烷、丁烷和少量的戊烷 甲烷、乙烷 正己烷 立方型状态方程计算V 时如果出现三个根,则最大的根表示( ) 饱和液摩尔体积 饱和汽摩尔体积 无物理意义 偏心因子的定义式( ) 0.7lg()1s r Tr P ω==-- 0.8lg()1 s r Tr P ω==-- 1.0 lg()s r Tr P ω==- 设Z 为x ,y 的连续函数,,根据欧拉连锁式,有( ) A. 1x y z Z Z x x y y ???? ?????=- ? ? ?????????? B. 1y x Z Z x y x y Z ?????????=- ? ? ?????????? C. 1y x Z Z x y x y Z ????????? = ? ? ?????????? D. 1y Z x Z y y x x Z ????????? =- ? ? ?????????? 关于偏离函数MR ,理想性质M*,下列公式正确的是( ) A. *R M M M =+ B. *2R M M M =- C. * R M M M =- D. *R M M M =+ 下面的说法中不正确的是 ( ) (A )纯物质无偏摩尔量 。 (B )任何偏摩尔性质都是T ,P 的函数。 (C )偏摩尔性质是强度性质。(D )强度性质无偏摩尔量 。 关于逸度的下列说法中不正确的是 ( ) (A )逸度可称为“校正压力” 。 (B )逸度可称为“有效压力” 。 (C )逸度表达了真实气体对理想气体的偏差 。 (D )逸度可代替压力,使真实气体的状态方程变为fv=nRT 。 (E )逸度就是物质从系统中逃逸趋势的量度。 二元溶液,T, P 一定时,Gibbs —Duhem 方程的正确形式是 ( ). a. X1dln γ1/dX 1+ X2dln γ2/dX2 = 0 b. X1dln γ1/dX 2+ X2 dln γ2/dX1 = 0 c. X1dln γ1/dX 1+ X2dln γ2/dX1 = 0 d. X1dln γ1/dX 1– X2 dln γ2/dX1 = 0 关于化学势的下列说法中不正确的是( ) A. 系统的偏摩尔量就是化学势 B. 化学势是系统的强度性质 C. 系统中的任一物质都有化学势 D. 化学势大小决定物质迁移的方向 15.关于活度和活度系数的下列说法中不正确的是 ( ) (A )活度是相对逸度,校正浓度,有效浓度;(B) 理想溶液活度等于其浓度。 (C )活度系数表示实际溶液与理想溶液的偏差。(D )任何纯物质的活度均为1。 (E )的偏摩尔量。 16 组成的均相体系中,若A 的偏摩尔体积随浓度的改变而增加,则B 的偏摩尔体积将:( ) A. 增加 B. 减小 C. 不变 D. 不一定 17.下列各式中,化学位的定义式是 ( ) 18.混合物中组分i 的逸度的完整定义式是 。 j j j j n nS T i i n T P i i n nS nV i i n nS P i i n nU d n nA c n nG b n nH a ,,,,,,,,]) ([.)([.])([.)([.??≡??≡??≡??≡μμμμ
化工热力学 一、重点 1、临界点定义及表达式:维持气液平衡的最高温度和压力点。 c 0T T p V =??? = ? ???、220c T T p V =???= ????。 2、Virial 方程 体积表达式:231pV B C D Z RT V V V = =++++ 压力表达式:231pV Z B p C p D p RT '''==++++ 3、偏心因子的定义及表达式:各种物质在0.7r T =时,纯态流体对比蒸汽压对数值与Ar ,Kr ,Xe 的值的偏差,即() 0.7 lg 1.00r s r T p ω==--。 物理意义:偏心因子表征物质的偏心度,即非球型分子偏离球对称的程度。 4、普遍化Virial 系数 普遍化Virial 系数与普遍化压缩因子适用范围 5、Prausnitz 混合规则 6、熵的表达式的推导 第一dS 方程 当(),S S T V =时,则有 因 V V V V Q TdS S C T T T T ???????? === ? ? ?????????? 得 V V C S T T ???= ???? 又 T V S p V T ?????? = ? ??????? 所以 V V dT p dS C dV T T ???=+ ???? 积分得到
第二dS 方程 当(),S S T p =时,则有 因 p p C S T T ???= ???? p T S V p T ?????? =- ? ??????? 所以 p p dT V dS C dp T T ??? =- ???? 积分得到 第三dS 方程 当(),S S p V =时,则有 因为 积分得到 7、焓的表达式推导 利用刚刚导出的三个dS 方程来得到三个dH 方程。 dH TdS Vdp =+ (1) 将第一dS 方程代入(1)式并注意得到 得到第一dH 方程 积分得到 第二dH 方程 积分得到 第三dH 方程 积分得到 8、剩余性质的定义:所谓剩余性质,是气体在真实状态下的热力学性质与在同一温度、压力下当气体处于理想状态下的热力学性质之间的差额。 式中M 与M*分别为在相同温度和压力下,真实气体与理想气体的某一广度热力学性质的摩尔值,如V 、U 、H 、S 和G 等。 9、普遍化Virial 系数计算剩余熵和焓 10、逸度及逸度系数的定义 对于真实气体,定义逸度i f 。
北京化工大学2016——2017学年第一学期 《化工热力学》期末考试试卷 班级: 姓名: 学号: 任课教师: 分数: 一、(2?8=16分)正误题(正确的画√,错误的画×,标在[ ]中) [√]剩余性质法计算热力学性质的方便之处在于利用了理想气体的性质。 [×]Virial 方程中12B 反映了不同分子间的相互作用力的大小,因此120B =的气体混合物,必定是理想气体混合物。 [√]在二元体系中,如果在某浓度范围内Henry 定律适用于组分1,则在相同的浓度范围内,Lewis-Randall 规则必然适用于组分2。 [×]某绝热的房间内有一个冰箱,通电后若打开冰箱门,则房间内温度将逐渐下降。 [×]溶液的超额性质数值越大,则溶液的非理想性越大。 [×]水蒸汽为加热介质时,只要传质推动力满足要求,应尽量采用较低压力。 [×]通过热力学一致性检验,可以判断汽液平衡数据是否正确。 [×]如果一个系统经历某过程后熵值没有变化,则该过程可逆且绝热。 二、(第1空2分,其它每空1分,共18分)填空题 (1)某气体符合/()p RT V b =-的状态方程,从 1V 等温可逆膨胀至 2V ,则体系的 S ? 为 21ln V b R V b --。 (2)写出下列偏摩尔量的关系式:,,(/)j i E i T p n nG RT n ≠?? ?=?? ???ln i γ,
,,(/)j i R i T p n nG RT n ≠???=??????ln i ?, ,,(/)j i i T p n nG RT n ≠?? ?=?? ???i μ。 (3)对于温度为T ,压力为P 以及组成为{x}的理想溶液,E V =__0__,E H = __0__,/E G RT =__0__,ln i γ=__0__,?i f =__i f __。 (4)Rankine 循环的四个过程是:等温加热(蒸发),绝热膨胀(做功), 等压(冷凝)冷却,绝热压缩。 (5)纯物质的临界点关系满足0p V ??? = ????, 220p V ???= ???? ,van der Waals 方程的临界压缩因子是__0.375__,常见流体的临界压缩因子的范围是_0.2-0.3_。 二、(5?6=30分)简答题(简明扼要,写在以下空白处) (1)简述如何通过水蒸汽表计算某一状态下水蒸汽的剩余焓和逸度(假定该温度条件下表中最低压力的蒸汽为理想气体)。 剩余焓: ①通过线性插值,从过热水蒸汽表中查出给定状态下的焓值; ②从饱和蒸汽表中查得标准状态时的蒸发焓vap H ?(饱和液体的焓-饱和蒸汽的焓); ③通过00()T ig ig ig p p T H C dT C T T ?=≈-? 计算理想气体的焓变; ④通过R ig vap H H H H ?=-?-?得到剩余焓。 逸度: ①通过线性插值,从过热水蒸汽表中查出给定状态下的焓和熵并根据 G H TS =-得到Gibbs 自由能(,)G T p ; ②从过热蒸汽表中查得最低压力时的焓和熵,计算得到Gibbs 自由能 0(,)ig G T p ;
化工热力学第二章作业解答 2.1试用下述三种方法计算673K ,4.053MPa 下甲烷气体的摩尔体积,(1)用理想气体方程;(2)用R-K 方程;(3)用普遍化关系式 解 (1)用理想气体方程(2-4) V = RT P =68.3146734.05310 ??=1.381×10-3m 3·mol -1 (2)用R-K 方程(2-6) 从附录二查的甲烷的临界参数和偏心因子为 Tc =190.6K ,Pc =4.600Mpa ,ω=0.008 将Tc ,Pc 值代入式(2-7a )式(2-7b ) 2 2.50.42748c c R T a p ==2 2.56 0.42748(8.314)(190.6)4.610???=3.224Pa ·m 6·K 0.5·mol -2 0.0867c c RT b p = =6 0.08678.314190.64.610 ???=2.987×10-5 m 3·mol -1 将有关的已知值代入式(2-6) 4.053×106 = 5 8.314673 2.98710 V -?-?-0.553.224(673)( 2.98710)V V -+? 迭代解得 V =1.390×10-3 m 3·mol -1 (注:用式2-22和式2-25迭代得Z 然后用PV=ZRT 求V 也可) (3)用普遍化关系式 673 3.53190.6 r T T Tc === 664.053100.8814.610r P P Pc ?===? 因为该状态点落在图2-9曲线上方,故采用普遍化第二维里系数法。 由式(2-44a )、式(2-44b )求出B 0和B 1 B 0=0.083-0.422/Tr 1.6=0.083-0.422/(3.53)1.6 =0.0269 B 1=0.139-0.172/Tr 4.2=0.139-0.172/(3.53)4.2 =0.138 代入式(2-43) 010.02690.0080.1380.0281BPc B B RTc ω=+=+?= 由式(2-42)得 Pr 0.881110.0281 1.0073.53BPc Z RTc Tr ???? =+=+?= ??? ???? V =1.390×10-3 m 3 ·mol -1 2.2试分别用(1)Van der Waals,(2)R-K ,(3)S-R-K 方程计算27 3.15K 时将CO 2压缩到比体积为550.1cm 3 ·mol -1 所需要的压力。实验值为3.090MPa 。 解: 从附录二查得CO 2得临界参数和偏心因子为 Tc =304.2K Pc =7.376MPa ω=0.225
化工热力学考试重点终 极 GE GROUP system office room 【GEIHUA16H-GEIHUA GEIHUA8Q8-
化工热力学 一、重点 、临界点定义及表达式:维持气液平衡的最高温度和压力点。 、220c T T p V =?? ?= ????。 、Virial 方程 积表达式:231pV B C D Z RT V V V = =+++ + 力表达式:231pV Z B p C p D p RT '''= =+++ + 、偏心因子的定义及表达式:各种物质在0.7r T =时,纯态流体对比蒸汽压对数值与Ar ,Kr ,Xe 的值的偏差,即()0.7lg 1.00r s r T p ω==--。 理意义:偏心因子表征物质的偏心度,即非球型分子偏离球对称的程度。
、普遍化Virial 系数 遍化Virial 系数与普遍化压缩因子适用范围 、Prausnitz 混合规则 、熵的表达式的推导 一dS 方程 (),S S T V =时,则有 V V V V Q TdS S C T T T T ???????? === ? ? ?????????? V V C S T T ???= ????
T V S p V T ?????? = ? ??????? 以 V V dT p dS C dV T T ???=+ ???? 分得到 二dS 方程 (),S S T p =时,则有 p p C S T T ???= ???? p T S V p T ?????? =- ? ??????? 以 p p dT V dS C dp T T ??? =- ???? 分得到
一、 单项选择题(每题1分,共30分): 1.关于化工热力学研究特点的下列说法中不正确的是( ) A. 研究体系为实际状态。 B. 解释微观本质及其产生某种现象的内部原因。 C. 处理方法为以理想态为标准态加上校正。 D. 获取数据的方法为少量实验数据加半经验模型。 E. 应用领域是解决工厂中的能量利用和平衡问题。 2.Pitzer 提出的由偏心因子ω计算第二维里系数的普遍化关系式是( )。 A .B = B 0ωB 1 B .B = B 0 ω + B 1 C .BP C /(RT C )= B 0 +ωB 1 D .B = B 0 + ωB 1 3.下列关于G E 关系式正确的是( )。 A. G E = RT ∑X i ln X i B. G E = RT ∑X i ln a i C. G E = RT ∑X i ln γi D. G E = R ∑X i ln X i 4.下列偏摩尔自由焓表达式中,错误的为( )。 A. i i G μ=- B. dT S dP V G d i i i - ---=;C. ()i j n P T i i n nG G ≠? ???????=-,, D. ()i j n nV T i i n nG G ≠? ???????=-,, 5.下述说法哪一个正确? 某物质在临界点的性质( ) (A )与外界温度有关 (B) 与外界压力有关 (C) 与外界物质有关 (D) 是该物质本身的特性。 6.泡点的轨迹称为( ),露点的轨迹称为( ),饱和汽、液相线与三相线所包围的区域称为( )。 A. 饱和汽相线,饱和液相线,汽液共存区 B.汽液共存线,饱和汽相线,饱和液相区 C. 饱和液相线,饱和汽相线,汽液共存区 7.关于逸度的下列说法中不正确的是 ( ) (A )逸度可称为“校正压力” 。 (B )逸度可称为“有效压力” 。 (C )逸度表达了真实气体对理想气体的偏差 。 (D )逸度可代替压力,使真实气体的状态方程 变为fv=nRT 。 (E )逸度就是物质从系统中逃逸趋势的量度。 8.范德华方程与R -K 方程均是常见的立方型方程,对于摩尔体积V 存在三个实根或者一个实根,当存在三个实根时,最大的V 值是 。 A 、饱和液体体积 B 、饱和蒸汽体积 C 、无物理意义 D 、饱和液体与饱和蒸汽的混合体积 9.可以通过测量直接得到数值的状态参数是 。 A 、焓 B 、内能 C 、温度 D 、 熵
第二章 流体的压力、体积、浓度关系:状态方程式 2-1 试分别用下述方法求出400℃、下甲烷气体的摩尔体积。(1) 理想气体方程;(2) RK 方程;(3)PR 方程;(4) 维里截断式(2-7)。其中B 用Pitzer 的普遍化关联法计算。 [解] (1) 根据理想气体状态方程,可求出甲烷气体在理想情 况下的摩尔体积id V 为 33168.314(400273.15) 1.381104.05310id RT V m mol p --?+= ==??? (2) 用RK 方程求摩尔体积 将RK 方程稍加变形,可写为 0.5()()RT a V b V b p T pV V b -=+-+ (E1) 其中 2 2.50.427480.08664c c c c R T a p RT b p == 从附表1查得甲烷的临界温度和压力分别为c T =, c p =,将它们代入 a, b 表达式得
2 2.5 6-20.560.427488.314190.6 3.2217m Pa mol K 4.6010 a ??==???? 53160.086648.314190.6 2.9846104.6010 b m mol --??==??? 以理想气体状态方程求得的id V 为初值,代入式(E1)中迭代求解,第一次迭代得到1V 值为 5168.314673.15 2.9846104.05310 V -?=+?? 350.563353.2217(1.38110 2.984610)673.15 4.05310 1.38110(1.38110 2.984610) -----??-?-??????+? 355331 1.38110 2.984610 2.1246101.389610m mol -----=?+?-?=?? 第二次迭代得2V 为 3535 20.56335355 331 3.2217(1.389610 2.984610)1.38110 2.984610673.15 4.05310 1.389610(1.389610 2.984610)1.38110 2.984610 2.1120101.389710V m mol ------------??-?=?+?-??????+?=?+?-?=??1V 和2V 已经相差很小,可终止迭代。故用RK 方程求得的摩尔体积近 似为 3311.39010V m mol --=?? (3)用PR 方程求摩尔体积 将PR 方程稍加变形,可写为 ()()()RT a V b V b p pV V b pb V b -=+-++-
北京化工大学 课程论文 课程名称:高等化工热力学 任课教师:密建国 专业:化学工程与技术 班级: 姓名: 学号:
活性炭吸附储氢过程的热力学分析 摘要 储氢过程中热效应的不利影响是氢气吸附储存应用于新能源汽车需要解决的关键问题之一。文章首先介绍了活性炭吸附储氢过程的热力学分析模型,包括吸附等温线模型,吸附热的热力学计算以及气体状态方程。对吸附等温线模型的研究意义及选取、吸附过程中产生吸附热的数值确定方法、不同储氢条件下气体状态方程的适用性及选取进行了探讨。 关键词:活性炭;吸附;储氢;热力学 第一章绪论 1.1研究背景及意义 1.1.1研究背景 氢能,因其具有众多优异的特性而被誉为21世纪的绿色新能源。首先,氢能具有很高的热值,燃烧1kg氢气可产生1.25x106 kJ的热量,相当于3kg汽油或4.5kg焦炭完全燃烧所产生的热量;其次,氢燃烧释能后的产物是水,对环境友好无污染,是绿色清洁能源;此外,氢是宇宙中最丰富的元素,来源广泛,可通过太阳能、风能、地热能等自然能分解水而产生,为可再生能源,不会枯竭。当前,世界上许多国家都在加紧部署实施氢能战略,迎接氢经济时代的到来,如美国针对规模制氢的FutureGen计划,日本的NewSunshine和欧洲的Framework计划等。 持久的城市空气污染、对较低或零废气排放的交通工具的需求、减少对外国石油进口的需要、二氧化碳排放和全球气候变化、储存可再生电能供应的需求等多种因素的汇合增加了氢能经济的吸引力[1]。 目前,氢能的利用己经有了长足的进步。液氢发动机的成功研制使氢气的应用进入到航空领域,氢能的众多优点使得氢燃料驱动的铁路机车及一般汽车的研制也相当活跃。宝马氢能7系的氢动力汽车已经实现了量产,不过这种技术目前还难以普及,其主要瓶颈在于氢的存储和运输。氢是非常活跃的,以现有技术很难让其安稳长久的保存在储气罐中,如果氢动力汽车一个月不开,里面的氢就会挥发殆尽[2]。此外,氢还是一种易燃易爆的气体,在使用中必须保证安全,因此,一种安全、高能量密度(包括体积能量密度和重量能量密度)、低成本、使用寿命长的氢储、运输技术的应用需求已越来越迫切[3]。 传统的氢气存储方式主要有气态和液态两种。气态方式较为简单方便,也是目前储存压力低于70MPa氢气的常用方法,但体积密度较小是该方法严重的技术缺陷,而且气态氢在运输和使用过程中也存在易爆炸的极大安全隐患。液态储氢方法的体积密度(70kg/m3)高,但氢气的液化需要冷却到20K的超低温下才能实现,此过程消耗的能量约占所储存氢能的25%一45%。而且液态氢使用条件苛刻,对储罐绝热性能要求高,目前只限于在航天技术领域应用。利用储氢材料与氢气反应生成固溶体和氢化物的固体储氢方式,能有效克服气液两种储存方式的不足,而且储氢体积密度大、安全度高、运输便利。根据技术发展趋势,今后储氢研究的重点是在新型高性能大规模储氢材料上,目前研究比较广泛和深入的主要是多孔