
复方丹参片检验原始记录
编号:ZYBJB-03020101-00 页号:
品名复方丹参片批号G4A021 来源永生药店规格0.32g/ 片
取样量实训室检验依据2010 版中国药典一部检验项目质量分析
【性状】本品为糖衣片或薄膜衣片,除去包衣后显棕色至棕褐色;气芳香,味微苦。(应为糖衣片或薄膜
衣片,除去包衣后显棕色至棕褐色;气芳香,味微苦)
。
结论:符合规定
【鉴别】
(1)取本品,置显微镜下观察:有树脂道碎片,有黄色分泌物。(树脂道碎片含黄色分泌物三七)。
结论:符合规定
(2)丹参、冰片的薄层色谱鉴别: 取本品 5 片〔规格(1)和规格(3)〕或2 片〔规格(2)〕,糖衣片除去糖衣,研碎,加乙醚10ml, 超声处理 5 分钟,滤过,药渣备用,滤液挥干,残渣加乙酸乙酯2ml 使溶解,作为供试品溶液。另取丹参酮Ⅱ A 对照品、冰片对照品,分别加乙酸乙酯制成每lml 含0.5mg 的溶液,作为对照品溶液。照薄层色谱法(附录YI B)试验,吸取上述三种溶液各 4 μl ,分别点于同一硅胶G 薄层板上,以苯-乙酸乙酯(19:1)为展开剂,展开,取出,晾干。供试品色谱中,在与丹参酮ⅡA对照品色谱相
应的位置上,显相同颜色的斑点;喷以1% 香草醛硫酸溶液,在110℃加热数分钟,在与冰片对照品色谱
相应的位置上,显相同颜色的斑点。
结果见附页
结论:符合规定
(3)三七的薄层色谱鉴别:取〔鉴别〕(2)项下的备用药渣,加甲醇25ml, 加热回流15 分钟,放冷,滤过,滤液蒸干,残渣加水25ml ,微热使溶解,用水饱和的正丁醇25ml 振摇提取,取正丁醇提取液,用氨试液25ml 洗涤,再用正丁醇饱和的水洗涤 2 次,每次25ml ,正丁醇液浓缩至干,残渣加甲醇lml 使溶解,作
为供试品溶液。另取三七对照药材0.5g, 同法制成对照药材溶液。再取三七皂苷对照品及人参皂苷Rb, 对照品、人参皂苷R g l 对照品,分别加甲醇制成每lml 含lmg 的溶液,作为对照品溶液。照薄层色谱法(附录W B) 试验,吸取上述五种溶液各
lμl ,分别点于同一硅胶G 薄层板上,以三氯甲烷-甲醇-水(13:7 :2)10℃以下放置分层的下层溶液为展
开剂,展开,取出,晾干,喷以硫酸乙醇溶液( 1 →10),在110 ℃加热至斑点显色清晰。供试品色谱中,在
与对照药材色谱和对照品色谱相应的位置上,显相同颜色的斑点。
结果见附页
结论:符合规定
【检查】
(1)重量差异:
检查法:取供试品20 片,精密称定总重量,求得平均片重后,再分别精密称定每片的重量,每片重量与
标示片重相比较(无标示片重的片剂,与平均片重比较)
(注:按表中的规定,超出重量差异限度的不得多于 2 片,并不得有 1 片超出限度 1 倍)。
标示片重或平均片重重量差异限度
0. 3g 以下±7.5 %
0. 3g 及0 . 3g 以上±5 %
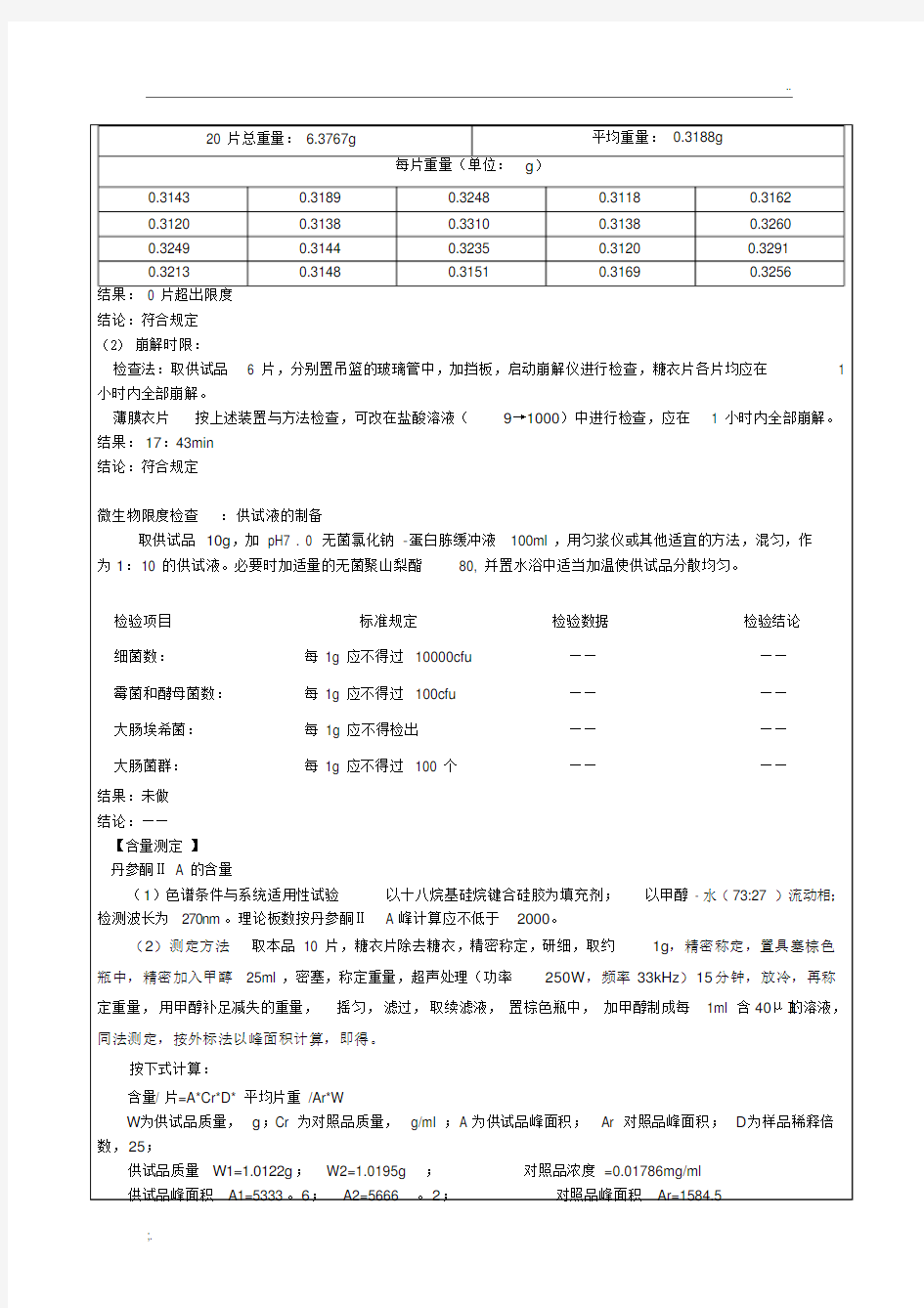
20 片总重量:6.3767g
平均重量:0.3188g
每片重量(单位:g)
0.3143 0.3189 0.3248 0.3118 0.3162
0.3120 0.3138 0.3310 0.3138 0.3260
0.3249 0.3144 0.3235 0.3120 0.3291
0.3213 0.3148 0.3151 0.3169 0.3256
结果:0 片超出限度
结论:符合规定
(2)崩解时限:
检查法:取供试品 6 片,分别置吊篮的玻璃管中,加挡板,启动崩解仪进行检查,糖衣片各片均应在 1 小时内全部崩解。
薄膜衣片按上述装置与方法检查,可改在盐酸溶液(9→1000)中进行检查,应在 1 小时内全部崩解。结果:17:43min
结论:符合规定
微生物限度检查:供试液的制备
取供试品10g,加pH7 . 0 无菌氯化钠-蛋白胨缓冲液100ml ,用匀浆仪或其他适宜的方法,混匀,作
为1:10 的供试液。必要时加适量的无菌聚山梨酯80, 并置水浴中适当加温使供试品分散均匀。
检验项目标准规定检验数据检验结论细菌数:每1g 应不得过10000cfu ————
霉菌和酵母菌数:每1g 应不得过100cfu ————
大肠埃希菌:每1g 应不得检出————
大肠菌群:每1g 应不得过100 个————
结果:未做
结论:——
【含量测定】
丹参酮Ⅱ A 的含量
(1)色谱条件与系统适用性试验以十八烷基硅烷键合硅胶为填充剂;以甲醇- 水(73:27 )流动相;检测波长为270nm。理论板数按丹参酮Ⅱ A 峰计算应不低于2000。
(2)测定方法取本品10 片,糖衣片除去糖衣,精密称定,研细,取约1g,精密称定,置具塞棕色瓶中,精密加入甲醇25ml ,密塞,称定重量,超声处理(功率250W ,频率33kHz)15 分钟,放冷,再称定重量,用甲醇补足减失的重量,摇匀,滤过,取续滤液,置棕色瓶中,加甲醇制成每1ml 含40μl的溶液,同法测定,按外标法以峰面积计算,即得。
按下式计算:
含量/ 片=A*Cr*D* 平均片重/Ar*W
W为供试品质量,g;Cr 为对照品质量,g/ml ;A 为供试品峰面积;Ar 对照品峰面积;D为样品稀释倍数,25;
供试品质量W1=1.0122g;W2=1.0195g ;对照品浓度=0.01786mg/ml
供试品峰面积A1=5333。6;A2=5666 。2;对照品峰面积Ar=1584.5
样品1:含量/ 片=4.73 ;样品2:含量/ 片=4.71
平均值= 4.72 [ 本品每片含丹参酮ⅡA,规格(1)、规格(3)不得少于0.20mg;规格(2)不得少于0.60mg]
相对偏差=0.2 (应不得过 3.0%)
结论:不符合
丹酚酸 B 的含量
(1)色谱条件与系统适用性试验以十八烷基硅烷键合硅胶为填充剂;以乙腈-甲醇-甲酸-水(10:3 0:1:59)为流动相;检测波长为286nm 。理论板数按丹酚酸 B 峰计算应不低于4000 。
(2)测定方法取本品10 片,糖衣片除去糖衣,精密称定,研细,取0.15g, 精密称定,置50ml 量瓶中,加水适量,超声处理(功率300W ,频率50kHz)30 分钟,放冷,加水至刻度,摇匀,离心,取
上清液。精密量取20μl注入液相色谱仪,记录色谱图。另取丹酚酸 B 对照品适量,精密称定,加水制成每
1ml 含60μg的溶液,同法测定,按外标法以峰面积计算,即得。
按下式计算:
含量/ 片=A*Cr*D* 平均片重/Ar*W
W为供试品质量,g;Cr 为对照品质量,g/ml ; A 为供试品峰面积;Ar 对照品峰面积; D 为样品稀释倍数,50;
供试品质量W1=0.1506g;W2=0.1513g ;对照品浓度=0.06mg/ml
供试品峰面积A1=130.6 ;样品1:含量/ 片=11.56 ;A2=127.8 ;
样品2:含量/ 片=11.26
对照品峰面积Ar=71
平均值=11.41mg [ 本品每片含丹参以丹酚酸 B 计,规格(1)、规格(3)不得少于0.50mg;规格(2)不得少于15.0mg]
相对偏差=1.314%(应不得过 3.0%)
结论:符合规定
结论:符合规定
检验人:日期:2015.01.15 复核人日期:2015.01.19
鉴别项目
1、丹参、冰片的薄层鉴别
样冰IIA 样+冰样+IIA 2、三七的薄层鉴别
检查1、重量差异
2、崩解时限
出厂检验原始记录 化验:审批: 产品名称样品数量抽样基数 规格型号抽样地点生产日期 检验依据 检验项目实测数据检测仪器 酒精度,%(V/V) GB/T10345.3酒精计法 总酸(以乙酸计),g/L GB/T10345.4 总酯(以乙酸乙酯计),g/L GB/T10345.5 第一法 固形物/(g/L) 感官取100mL酒样经蒸馏后定容至100mL备用。 测定值: 测定温度:℃ 吸取50.00ml样液进行测定。 样品测定消耗氢氧化钠标液(ml):V= V’= 氢氧化钠标液的浓度:c= mol/L = ? ? = 0. 50 60 V c X ()() 0. 50 60 ? ? = = X ()() 2 + = 上述样品加入25.00ml氢氧化钠标准溶液,在100℃水浴锅上回流1h,用 盐酸标准溶液滴至终点 测定时,消耗硫酸标液的体积(ml):V= V’= 硫酸标液的浓度:c= mol/L () 0. 50 88 V c ? - ? = V X= X ()() 2 + = 取50mL酒样注入恒重100mL瓷蒸发皿,置于水浴至干,在将蒸发皿放 入103℃干燥箱直至恒重。 1000 0. 50 1 ? - = m m X X1= X 2= 色泽和外观: 香气: 口味: 风格: 酒精计 电子天平
出厂检验报告 化验: 审批: 产品名称 抽样人员 生产日期 抽样数量 检验日期 报告日期 检验依据 项 目 检验标准值 检验结果 判定 感 官 色泽和外观 无色或微黄,清亮透明,无悬浮物, 无沉淀; 香气 香气自然纯正清雅; 口味 酒体醇和、甘冽净爽; 风格 具有本品的典型风格。 酒精度/%vol 41-68 总酸/(g/L ) ≥0.3 总酯/(g/L ) ≥0.5 固形物/(g/L ) ≤0.5 甲醇/(g/L ) ≤0.6 结论 该批产品 □符合 □不符合 要求。 日期:
大米出厂检验报告Q/HQ R-8.2.4-1-01 Q/HQ R-8.2.4-1-01
大米检验原始记录 1、色泽、气味、口味 2、加工精度 3、杂质检验(分样量M0:200g) 糠粉(W1)第一次:g 含量A(%)=W1/M0×100= 第二次:g 含量A(%)= W1/M0×100= 矿物质(W2)第一次:g 含量B(%)=W2/M0×100= 第二次:g 含量B(%)= W2/M0×100= 稻谷粒、带壳稗粒、其它杂质(W3)第一次:g 含量C(%)=W3/M0×100= 第二次:g 含量C(%)=W3/M0×100= 杂质总量=A+B+C= 4、稻谷粒和稗粒检验(分样量M1:500g ) 稻谷粒第一次:检出粒含量:粒/Kg 第二次:检出粒含量:粒/Kg 带壳稗粒第一次:检出粒含量:粒/Kg 第二次:检出粒含量:粒/Kg 5、水份单位:g
资料 赠送以下资料 2016优秀教师个人述职报告 范文1:一年以来,勤勤恳恳,默默奉献,对工作尽职尽责。对教学不断研究,不断创新,对自身不断完善,努力提高政治思想觉悟,文化专业知识水平,刻意培养教育教学能力。现总结三大点:一、重视自身建设,努力提高业务水平。“学高为师,身正为范”,教师职业要成个人永久职业,人必须永远保持“学高”这一范畴。“逆水行舟不进则退”。“再学习”“终身教育”就成了它的注解。可以说,思想是主宰人类行动的将帅。
因此要让自己为人民服务,献身于教育事业。首先必须端正思想,明确人生目标,不断地从各方面提高自身素质,完善自我,不断创新,努力培养适应时代需要,为社会作贡献的有用人才,有了这样的明确目标后,我们就不会再为环境,为条件而懊恼不已了。在农村中学工作近三十个春秋,虽讲台摇摇欲倒,我依然操起教鞭;由教师到教导主任,由教导主任到校长,由校长到教学管理者参与者和实践者。虽工作几经周折,我依然毫无怨言。有人说,一个教师应该具备半个演讲家的口才,半个作家的文才,半个演员的表演艺术……拙于言词的我深知自己师范毕业在专业知识和教学艺术上远远不能适应时代前进的脚步,我抓住各种机会提高自己的业务水平,先后完成了专科函授和校长培训。工作之余,学电脑、钻教研,先后承担国家级、省级教科研课题和创造教育课题。参加黄冈数学新题库的编写,发表论文十多篇。其中,XX年在《中学数学杂志》上发表题为《数学课课堂提问的艺术》的论文;XX年在湖北省《中小学实验室》刊物上发表《架起数学通往生活的桥梁》、《实验教学与学生能力培养》等论文并获得省级一等奖;XX年在湖北省教育技术装备处主办的论文评比中,我撰写的《加强实验室建设为提高实验教学质量服务》被评为省级一等奖;XX年我的论文《合作学习在课改中的认识与探究》在中央教科所组织的论文评比中获国家级一等奖。荣幸成为湖北省教育学会中学数学会员,作为中心学校数学学科带头人,我与同行相处融洽。大家团结一心,大力推进校本教研,研究农村中学中考复习的新思路新方法,确立了“立足新课程标准、着眼学法创
三、 检查 1. 水分 标准:取本品内容物,照水分测定法(药典2005二部附录Ⅷ M 第一法 A ),以 为溶剂,水分不得过 %。 仪器: 水分测定仪: 结果: 标定值: mg/ml RSD= % (附水分报告) 2.干燥失重 标准:照干燥失重法测定,于 ℃干燥至恒重,减失重量不得过 %。 仪器:烘箱: 恒温减压干燥箱: 真空泵: 电子天平: (感量0.1mg ) 方法:烘箱干燥法、恒温减压法、干燥器干燥法(分常压、减压两种) 干燥剂:硅胶(显蓝色)、五氧化二磷(粉未状)、无水氯化钙(块状) 结果: 批号: 单位:g 公式:干燥失重(%)=(W 0+W 1-W 3)/ W 1×100% 结论:符合规定
温度:湿度: 3.(重量)装量差异 标准:取本品20片(5瓶),按药典二部附录方法检查,限度为±%。 仪器:电子天平:感量0.1mg(适用于平均片重0.30g以下的片剂) 感量1mg(适用于平均片重0.30g或0.30g以上的片剂)结果: 重量差异(片剂)单位:g 公式:(重量)装量差异(%)=(W供- w平均)/ w平均× 100% 装量差异= - ~+ % 结论:符合规定 4.酸度(碱度) 标准:取供试品加水制成每1ml中含mg的溶液,依法测定。pH值应为~。仪器:酸度计:电子天平: 供试液:g ―→ml 结果:
温度:湿度: 5. 溶液的澄清度与颜色、pH值 标准: 仪器:澄明度检测仪:酸度计: 方法:取供试品5瓶, 分别按标示量加水制成每1ml 中含mg的溶液,与浊度标准液及标准比色液比较后,测定pH值。 供试液:每瓶加水ml 结果: 6. 不溶性微粒(例如) 标准:每1.0g样品中含10μm以上的微粒不得过6000粒,含25μm以上的微粒不得过600粒 方法:取本品3份,加微粒检查用水制成每1ml中含50mg的溶液,依法检查(中国药典2010年版二部附录IX C) 结论:符合规定不符合规定
干燥失重(水分)检验原始记录 生产日期: 检测项目检验方法水分含量(%) 样品名称及编号器号容器重 m3(g) [容器+样品 重]m1(g) 样品质量 m(g) 烘后[容器+样 品重]m2(g) 失水质量 (g) 测定 结果 平均值 备注: 计算公式:m1-m2 X1=————×100 m1-m3 式中:X1-样品中水份的含量,﹪m3-容器的质量,g m1-容器+样品重,g m2-烘后[容器+样品重],g 检验员审核人检验日期 长春XX食品厂 干燥失重(水分)检验原始记录 生产日期: 检测项目检验方法水分含量(%) 样品名称及编号器号容器重 m3(g) [容器+样品 重]m1(g) 样品质量 m(g) 烘后[容器+样 品重]m2(g) 失水质量 (g) 测定 结果 平均值 备注: 计算公式:m1-m2 X1=————×100 m1-m3 式中:X1-样品中水分的含量,﹪m3-容器的质量,g m1-容器+样品重,g m2-烘后[容器+样品重],g 检验员审核人检验日期
物资采购计划单 物资名称数量规格、型号申请部门批准人批准日期执行情况合同号 长春XX食品厂 物资采购计划单 物资名称数量规格、型号申请部门批准人批准日期执行情况合同号
成品入库记录 入库时间产品名称产品规格入库数量库存量库房总量交货人收货人备注
长春XX食品厂 成品出库记录 出库时间产品名称产品规格出库数量库存量库房总量发货人领货人发往地备注
长春XX食品厂 细菌总数检测原始记录 室温:℃湿度:% 第页共页检测依据接种时间 使用主要仪 器 报告时间 样号样品 名称 36+1 ℃培养 24~48h 稀释度报告数 cfu/ml(g) 空白 接种量ml 皿号 计数方式 菌落总数(个/皿) 皿号 计数方式 菌落总数(个/皿) 备注:1.√表示全皿计数,×表示多不可计数。2.选取菌落数在30-300之间的平皿作为菌落总数测定标准。参照GB/T4789.2-7.3.2稀释度的选择报告菌落数。3.菌落数在100以内时,按其实有数报告,大于100时,采用两位有效数字用10的指数来表示。 检验员:审核人:审核时间: 总大肠菌群检测证实试验记录 环境温度:℃环境湿度 % 第页共页 检测依据接种时间 使用主要仪 器 报告时间 样号样品 名称 培养温度、时间培养基名称结果判定报 告数 (MPN) /100ml(g) ℃ h乳糖发酵培养基 分析号 1 2 3 4 5 6 7 8 9 复发酵产酸、气 EMB分离培养 革兰氏染色 复发酵产酸、气 EMB分离培养 革兰氏染色 备注:乳糖发酵阳性管转种培养实验:1.复发酵:+/+表示产酸、产气为阳性;-/-表示不产酸、不产气为阴性;+/-表示产酸、不产气。接种量在1ml以上者,用双料发酵管;1ml以下者,用单料发酵管。2.在鉴别性琼脂平板EMB上36±1℃培养18~24h,观察菌落形态,具有大肠菌群其典型特征“+”表示,不具有大肠菌群其典型特征“-”表示3.做革兰氏染色,“⊕”表示阳性,“⊙”表示阴性 检验员:审核人:审核时间:
压片糖果检验记录 感官测定原始记录 干燥失重检测记录 检测依据:SB/T10347-2017 批号: 项 目 规 定 结 果 色 泽 符合品种应有的色泽 形 态 块形完整,大小基本一致,无裂缝,无明显变形 组 织 坚实、不松散、剖面紧密、不粘连 滋、气味 符合品种应有的滋味和气味,无异味 杂 质 无正常视力可见杂质 备 注 检验人: 复核人: 时间: 检测项目: 干燥失重 检测依据:SB/T10347-2017 标准规定:≤5.0% 计算公式:X= M1- M2 ×100 M1-M3 检测日期: 样品批号 称量瓶号 M3(g ) M3'(g ) M1(g ) M2(g ) M2'(g ) 计算 均值 Ⅰ Ⅱ 备 注 X :试样中水分的含量,单位为克每百克(g/100g ) M1:称量瓶和试样的质量,单位为克(g ) M2:称量瓶和试样干燥后的质量,单位为克(g ) M3:称量瓶的质量,单位为克(g ) 100:单位换算系数 检验人: 复核人:
净含量检验原始记录 检验人: 复核人: 微生物限度原始检验记录 检验人: 复核人: 批号 检验日期 标准净含量 允许短缺量 计量单位 检验依据 JJF1070-2005 检验方法 称重法 编号 1 2 3 4 5 6 7 8 9 10 总重(g ) 皮重(g ) 实际含量 偏差(%) 批 号 开检日期 菌 落 总 数 检验依据 GB17399-2016 标准规定 m=104,M=105 (n=5,c=2) 稀 释 10-2 10-3 10-4 菌 数 菌 检 室 小 时 48 48 48 位 置 48小时 1 1 左 2 中 平 均 2 1 右 2 空 白 对 照 平 均 3 1 小时 48 2 平 均 4 1 1 2 平 均 2 5 1 2 平 均 平 均 放入培养时间 月 日 时 取 出 时 间 月 日 时
温度:湿度: 检查 1. 水分 标准:取本品内容物,照水分测定法(药典2005二部附录ⅧM 第一法A),以为溶剂,水分不得过%。 仪器:水分测定仪: 2.干燥失重 标准:照干燥失重法测定,于℃干燥至恒重,减失重量不得过%。 仪器:烘箱:恒温减压干燥箱:真空泵: 电子天平:(感量) 方法:烘箱干燥法、恒温减压法、干燥器干燥法(分常压、减压两种) 干燥剂:硅胶(显蓝色)、五氧化二磷(粉未状)、无水氯化钙(块状) 公式:干燥失重(%)=(W0+W1-W3)/ W1×100% 结论:符合规定 温度:湿度: 3.(重量)装量差异 标准:取本品20片(5瓶),按药典二部附录方法检查,限度为±%。 仪器:电子天平:感量(适用于平均片重以下的片剂) 感量1mg(适用于平均片重或以上的片剂) 结果: 重量差异(片剂)单位:g
装量差异(粉针) 单位:g 公式:(重量)装量差异(%)=(W 供- w 平均)/ w 平均 × 100% 装量差异= - ~ + % 结论:符合规定 4.酸度 (碱度) 标准:取供试品加水制成每1ml 中含 mg 的溶液,依法测定。pH 值应为 ~ 。 仪器: 酸度计: 电子天平: 供试液: g ―→ ml 结果: 结论: 温度: 湿度: 5. 溶液的澄清度与颜色、pH 值 标准: 仪器:澄明度检测仪: 酸度计: 方法:取供试品 5瓶, 分别按标示量加水制成每1ml 中含 mg 的溶液 ,与浊度标准液及标准比色液比较后,测定pH 值。 供试液:每瓶加水 ml 结果: 6. 不溶性微粒 (例如)
标准:每1.0g样品中含10μm以上的微粒不得过6000粒,含25μm以上的微粒不得过600粒 方法:取本品3份,加微粒检查用水制成每1ml中含50mg的溶液,依法检查(中国药典2010年版二部附录IX C) 仪器:微粒分析仪GWF-8JC 结论:符合规定不符合规定 温度:湿度: 7. 可见异物 仪器:澄明度检测仪: 方法:灯检法、光散射法(深色透明容器或大于7号颜色) 结果判定:5份供试品在静置一定时间后轻轻旋转时均不得检出烟雾状微粒柱,且不得检出金属屑、玻璃屑、长度或最大粒径超过2mm纤维和块状物等明显可见异物。如检出微细可见异物(如点状物、2mm以下的短纤维和块状物等),除另有规定外,其数量应符合下表规定;如仅有1支(瓶)或以上供试品不符合规定,另取10份同法复试,均应符合规定。 操作方法:取本品5支(瓶),除去容器标签,擦净容器外壁,在层流净化台内操作,分别加入不溶性微粒检查用水溶解,依法检查(中国药典2010年版二部附录Ⅸ H) 结论:
长春XX食品厂 净含量及感官检验原始记录 编号生产日 期及 班次 检验 日期 产品 名称规格 生产 数量 净含量感观检验 员 总重 (克) 皮重 (克) 净含量 (克) 标明净含 量(克) 偏差形态色泽滋味和 气味 组织杂质 + -
长春XX食品厂 配料记录 生产日期产品名称配方共配料数配料员备注
采购验证记录 产品名称型号规格 供应/生产单位进货日期 进货数量验证数量 验收方式 验证项目标准要求验证结果合格/不合格 验证结论: 检验员:日期:年月日 不合格处置:退货()让步接收()选用()报废()批准人:日期:年月日 采购验证记录 产品名称型号规格 供应/生产单位进货日期 进货数量验证数量 验收方式 验证项目标准要求验证结果合格/不合格 验证结论: 检验员:日期:年月日 不合格处置:退货()让步接收()选用()报废()批准人:日期:年月日
长春XX食品厂 出厂检验报告单 产品名称规格检验类别出厂检验 抽样数量抽样方式随机抽样基数 生产日期抽样地点 检验依据 检验项目单位技术要求检验结果判定 一.感官 1.形态 2.色泽 3.滋味和气味 4.组织 5.杂质 二.净含量g ﹪ 三.干燥失重 (水份) 四.卫生指标 1.细菌总数(个/克) 2.大肠菌群(MPN/克) 检验结论 检验员:审核人:报告日期:年月日
长春XX食品厂 干燥失重(水分)检验原始记录 生产日期: 检测项目检验方法水分含量(%) 样品名称及编号器号容器重 m3(g) [容器+样品 重]m1(g) 样品质量 m(g) 烘后[容器+样 品重]m2(g) 失水质量 (g) 测定 结果 平均值 备注: 计算公式:m1-m2 X1=————×100 m1-m3 式中:X1-样品中水份的含量,﹪m3-容器的质量,g m1-容器+样品重,g m2-烘后[容器+样品重],g 检验员审核人检验日期 长春XX食品厂 干燥失重(水分)检验原始记录 生产日期: 检测项目检验方法水分含量(%) 样品名称及编号器号容器重 m3(g) [容器+样品 重]m1(g) 样品质量 m(g) 烘后[容器+样 品重]m2(g) 失水质量 (g) 测定 结果 平均值 备注: 计算公式:m1-m2 X1=————×100 m1-m3 式中:X1-样品中水分的含量,﹪m3-容器的质量,g m1-容器+样品重,g m2-烘后[容器+样品重],g 检验员审核人检验日期
资料收集于网络,如有侵权请联系网站删除只供学习与交流 只供学习与交流检验原始记录 实验环境:a、温度:℃b、干湿度:% 样品名称:样品编号:产品批号: 样品状态:状态完好,符合检验要求取样数量:执行标准:————————————————————————————————————————————————— 感官测定原始记录 检测依据:GB/T 14454.2 色泽:□正常□异常气味:□正常□异常 形态:□正常□异常滋味:□正常□异常 结论————————————————————————————————————————————————— 干燥失重测定原始记录 检测依据:GB/T 5009.3—2010 序号检验 方法 检验用仪器设 备 测试 温度 称量瓶质 量 称量瓶+ 样品质量 称量瓶+样品 干燥后的质量 检测结果 检测结果 平均值 报出值直接 干燥 法 分析天平、称 量瓶、恒温干 燥箱等 (℃)(g)(g)(g)(%)(%)(%) 1 2 ————————————————————————————————————————————————— 氯化物测定原始记录 检测依据:QB/T 1500—1992 硝酸银标准滴定溶液c[ 0.1 ]/(mol/L) 序号检验 方法 检验用仪器设 备 样品 质量 样品定容 总体积 测定用样 品溶液体 积 标准滴定溶液 消耗量 检测结果 检测结果 平均值 报出值 直接 沉淀 滴定 法 分析天平、酸 式滴定管等 (g)(ml)(ml)(ml)(g/100g) (g/100g ) (g/100 g) 1 2 空 白 mL ————————————————————————————————————————————————— 酸价测定原始记录 检测依据:GB/T 5009.37—2003 氢氧化钾标准滴定溶液c[ 0.050 ]/(mol/L) 序号检验 方法 检验用仪器设备样品质量 标准滴定溶液消 耗量 检测结果 检测结果平 均值 报出值 滴定 法 分析天平、碱式滴定管、 恒温水浴锅等 (g)(ml) (mgKOH/ 100g) (mgKOH/ 100g) (mgK OH/100 g) 1 2 —————————————————————————————————————————————————
干燥失重检测操作规程 (ISO13485-2016/YYT0287-2017) 1.0目的 规范待测物干燥失重检测方法,使其检测符合ChP2015规定。 2.0适用范围 适用于原辅料、中间产品、成品的干燥失重检测。 3.0引用/参考文件 ChP2015通则0831干燥失重测定法 药品检验操作规范 《检验数据修约管理规程》 《实验室仪器设备管理规程》 4.0职责 理化QC负责执行待测物干燥失重检测并填写相关记录,QA执行监督。 5.0程序 5.1仪器设备 扁形称量瓶、干燥器(普通)、分析天平(万分之一)、烘箱最高温度300℃,控温精度±1℃、剪刀、一号筛(10目)。 5.2试剂试液 变色硅胶 5.3检测方法 5.3.1样品处理 大颗粒或者大结晶,检测前用研钵研碎过一号筛,筛下物待用。SIS生物膜材
料应取多于1g 量,用剪刀剪碎,过一号筛,取筛下物1g 左右,待用。 5.3.2检测 取5.3.1处理的待测物1g 左右,置于105℃条件下干燥至恒重的称量瓶中,将称量瓶中待测物平铺成厚度不超过5mm 的薄层,疏松物质铺成不超过10mm 的薄层,精密称定。将称量瓶置于预先升温至105℃的烘箱中,瓶盖半盖于瓶上,烘干2h 后取出置于干燥器中30min ,放冷后精密称定。干燥失重在1.0%以下的品种不需要进行平行试验,干燥失重在1.0%以上的品种需要制备同法进行平行试验。SIS 生物膜材料技术要求干燥失重≤15%,故需要进行平行试验。 5.4记录与计算 5.4.1记录干燥时间、温度、称量及恒重数据等。该记录在原辅料、中间产品、成品的对应检测原始记录中包括干燥失重项目检测时,不需要填写;该记录仅在待测物无相关检测原始记录或者原始记录中无干燥失重项目检测时进行的干燥失重检测才需要填写。烘箱使用时应按照《实验室仪器设备管理规程》规定填写《实验室仪器设备使用记录》。 5.4.2计算公式 干燥失重%=0 121M M M M --×100% 式中:M0—恒重的称量瓶重量,g ; M1—干燥前样品+称量瓶重量,g ; M2—干燥后样品+称量瓶重量,g 。 5.6结果与判定 5.6.1计算结果按《检验数据修约管理规程》执行,使与标准中规定限度的有效数位一致。
温度: 湿度: 三、 检查 1. 水分 标准:取本品内容物,照水分测定法(药典2005二部附录Ⅷ M 第一法 A ),以 为溶剂,水分不得过 %。 仪器: 水分测定仪: 结果: 标定值: mg/ml RSD= % (附水分报告) 2.干燥失重 标准:照干燥失重法测定,于 ℃干燥至恒重,减失重量不得过 %。 仪器:烘箱: 恒温减压干燥箱: 真空泵: 电子天平: (感量0.1mg ) 方法:烘箱干燥法、恒温减压法、干燥器干燥法(分常压、减压两种) 干燥剂:硅胶(显蓝色)、五氧化二磷(粉未状)、无水氯化钙(块状) 结果: 批号: 单位:g 公式:干燥失重(%)=(W 0+W 1-W 3)/ W 1×100% 结论:符合规定
温度:湿度: 3.(重量)装量差异 标准:取本品20片(5瓶),按药典二部附录方法检查,限度为±%。 仪器:电子天平:感量0.1mg(适用于平均片重0.30g以下的片剂) 感量1mg(适用于平均片重0.30g或0.30g以上的片剂)结果: 重量差异(片剂)单位:g 公式:(重量)装量差异(%)=(W供- w平均)/ w平均× 100% 装量差异= - ~+ % 结论:符合规定 4.酸度(碱度) 标准:取供试品加水制成每1ml中含mg的溶液,依法测定。pH值应为~。仪器:酸度计:电子天平: 供试液:g ―→ml 结果:
温度:湿度: 5. 溶液的澄清度与颜色、pH值 标准: 仪器:澄明度检测仪:酸度计: 方法:取供试品5瓶, 分别按标示量加水制成每1ml 中含mg的溶液,与浊度标准液及标准比色液比较后,测定pH值。 供试液:每瓶加水ml 结果: 6. 不溶性微粒(例如) 标准:每1.0g样品中含10μm以上的微粒不得过6000粒,含25μm以上的微粒不得过600粒 方法:取本品3份,加微粒检查用水制成每1ml中含50mg的溶液,依法检查(中国药典2010年版二部附录IX C) 结论:符合规定不符合规定
附件2 医疗器械生产企业日常监督检查表 企业名称: 条款检查内容及要求检查方式检查情况备注 生产企业许可证有效性1.生产企业许可证有效性 查看生产现场,核对企业工商营业执照与生产企业 许可证内企业名称、注册地址、生产地址一致性。 2.所生产产品是否与许可证核发 的产品范围相符合 查看企业生产现场,成品库房、销售台帐、与企业 许可证核定范围进行核对。 3.企业生产、质量管理人员有无 变化 查看企业人员名单,核对企业工商营业执照和生产 企业许可证内法人代表与负责人姓名的一致性。 4.企业管理层人员是否经过医疗 器械法规的培训 查看培训证书(各级食品药品监督管理部门或企业 内部培训)。 5.三类医疗器械生产企业是否有 内审员 查看证书。 生产条件的符合性检查1.生产、组装能力是否具备,设 备能否正常工作,维护保养是否 在有效期内 查看生产现场,看是否配备完成该工艺的生产设 备,核对企业工艺要求及设备维护保养记录。2.生产现场是否管理有序 查看现场及企业是否按产品注册标准的要求进行 生产,并查看是否制定了生产过程控制和管理文 件。 3.生产场地环境、照明是否与其 生产的产品及规模相适应 查看生产现场环境与照明情况,并查看环境监测记 录,查看生产面积是否拥挤。注:一次性无菌医疗 器械生产现场应符合《无菌医疗器具生产管理规
范》(YY0033)的要求。 医疗器械生产企业日常监督检查表 条款检查内容及要求检查方式检查情况备注 4.《生产实施细则》执行情况;有专项要求的,是否符合相应的《生产实施细则》的要求查看生产现场与生产记录是否符合相应的实施细则。尤其是生产输液器、注射器等一次性使用无菌医疗器械是否符合《一次性使用无菌医疗器械产品(注、输器具)生产实施细则》;生产外科植入物的是否符合《外科植入物的生产实施细则》。 5.原材料、外协件和外购件等采购产品是否符合规定要求检查企业供方的评审记录。原材料、外协件和外购件的采购检验记录,采购合同/技术协议是否符合该产品的质量要求,检查物资供应方的资质证明,尤其是原材料必须是有医疗器械注册证的(如义齿等),要注意检查相关资质证明。 6.生产过程的控制,在产品形成过程中,是否有清晰的状态标识和可追溯标识检查企业生产工艺的验证报告(或记录)。检查生产过程的记录,按生产批号能否追溯到产品原材料的批号、每批产品关键工序及特殊过程的控制情况、每批产品生产过程中有关设备、人员情况和质量记录。 出厂检验记录1.检验设备的配置是否能够覆盖 标准中所规定的出厂检验项目。检 验人员是否经过培训持证上岗 查看检验现场,检验设备清单,查验出厂检验报告 (与注册产品标准的要求核对)查看检验人员的上 岗证及相关的证明培训记录。 2.企业是否对检验设备(含计量器 具)的管理建立制度 查检验设备管理制度,应包括采购、入库、首次检 定、使用保养、周期检定及停用报废等内容。 3.检验设备的精度是否符合检验 要求,检验记录是否真实有效,出 查看(技术监督局)检定合格证是否在有效期内, 查看检验设备上的检定标签是否在有效期内,查看
样品名称:样品规格: 抽样数量:样品状态: 生产日期:年月日检验日期:年月日 检测项目标准 要求检验过程检验值判定 感官符合 色泽□表面色泽均匀,□具有该品种应有的色泽。 形态 □外形整齐,□底部平整,□无霉变,□无变形,□具 有该品种应有的形态特征。 组织 □无不规则大空洞。□无糖粒、□无粒块。□带馅类饼 皮厚薄均匀,□皮、馅比例适当,□馅料分布均匀□, 馅料细腻,□具有该品种应有的组织特征。 滋味与口感□味纯正,□无异味,□具有该品种应有的口感和风味。 杂质□无可见杂质 干燥失重 % 试样和称 量皿烘前 质量m1(g) 称量皿质量m3(g) 试样和称量皿 烘后质量m2 (g) 计算公式 (m1- m2)/(m1–m3) ×100 菌落 总数Cfu/g □≤1500 □≤10000 稀释度10-110-210-3 平行试验 大肠 菌群Mpn/100g □≤30 □≤300 稀释度1m l×30.1m l×30.01m l×3 平行试验 净含量 g 试样总重(g)试样包装袋重量(g)单件净重(g) 取平均 备注:感观项目检验过程中在“□”中打“√”表示符合,打“×”表示不符合,打“/”表示没有此项要求。
样品名称:样品规格: 抽样数量:样品状态 生产日期:年月日检验日期:年月日 检测项目标准 要求检验过程检验值判定 感官符合 色泽□表面色泽均匀,□具有该品种应有的色泽特征。 形态 □外形整齐,□表面油润,□挂浆类有除特殊要求外不应 返砂,□炸酥类层次分明,□具有该品种应有的形态特征。 组织 □组织疏松,□无糖粒,□不干心,□不夹生,□具有该 品种应有的组织特征。 滋味与口感□味纯正,□无异味,□具有该品种应有的口感和风味。 杂质□无可见杂质 干燥失重 % 试样和称量皿 烘前质量m1 (g) 称量皿质量m3(g) 试样和称量皿 烘后质量m2 (g) 计算公式 (m1- m2)/(m1–m3)× 100 菌落总数Cfu/g □≤1500 □≤10000 稀释度10-110-210-3 平行试验 大肠 菌群Mpn/100g □≤30 □≤300 稀释度1m l×30.1m l×30.01m l×3 平行试验 净含量 g 试样总重(g) 试样包装袋重 量(g) 单件净重(g) 取平均 备注:感观项目检验过程中在“□”中打“√”表示符合,打“×”表示不符合,打“/”表示没有此项要求。 检验人:
温度: 湿度: 三、 检查 1. 水分 标准:取本品内容物,照水分测定法(药典2005二部附录Ⅷ M 第一法 A ),以 为溶剂,水分不得过 %。 仪器: 水分测定仪: 结果: 标定值: mg/ml RSD= % (附水分报告) 2.干燥失重 标准:照干燥失重法测定,于 ℃干燥至恒重,减失重量不得过 %。 仪器:烘箱: 恒温减压干燥箱: 真空泵: 电子天平: (感量) 方法:烘箱干燥法、恒温减压法、干燥器干燥法(分常压、减压两种) 干燥剂:硅胶(显蓝色)、五氧化二磷(粉未状)、无水氯化钙(块状) 结果: 批号: 单位:g
公式:干燥失重(%)=(W0+W1-W3)/ W1×100% 结论:符合规定 温度:湿度:3.(重量)装量差异 标准:取本品20片(5瓶),按药典二部附录方法检查,限度为± %。 仪器:电子天平:感量(适用于平均片重以下的片剂) 感量1mg(适用于平均片重或以上的片剂)结果: 重量差异(片剂)单位:g 公式:(重量)装量差异(%)=(W供- w平均)/ w平均× 100% 装量差异= - ~ + % 结论:符合规定 4.酸度(碱度)
标准:取供试品加水制成每1ml中含 mg的溶液,依法测定。pH值应为~。仪器:酸度计:电子天平: 供试液: g ―→ ml 结果: 温度:湿度: 5. 溶液的澄清度与颜色、pH值 标准: 仪器:澄明度检测仪:酸度计: 方法:取供试品 5瓶, 分别按标示量加水制成每1ml 中含 mg的溶液,与浊度标准液及标准比色液比较后,测定pH值。 供试液:每瓶加水 ml 结果:
6. 不溶性微粒(例如) 标准:每1.0g样品中含10μm以上的微粒不得过6000粒,含25μm以上的微粒不得过600粒 方法:取本品3份,加微粒检查用水制成每1ml中含50mg的溶液,依法检查(中国药典2010年版二部附录IX C) 结论:符合规定不符合规定 温度:湿度: 7. 可见异物 仪器:澄明度检测仪: 方法:灯检法、光散射法(深色透明容器或大于7号颜色) 结果判定:5份供试品在静置一定时间后轻轻旋转时均不得检出烟雾状微粒柱,且不得检出金属屑、玻璃屑、长度或最大粒径超过2mm纤维和块状物等明显可见异物。如检出微细可见异物(如点状物、2mm 以下的短纤维和块状物等),除另有规定外,其数量应符合下表规定;如仅有1支(瓶)或以上供试品不符合规定,另取10份同法复试,均应符合规定。