
《国家基本药物目录》要点 说明 《国家基本药物》目录是国家药品监督管理局根据世界卫生组织的建议,按照临床治疗必需、疗效好的原则制定的,用于指导临床医生合理用药,引导药品生产企业生产方向的药品目录。 基本药物是适应基本医疗卫生需求,剂型适宜,价格合理,能够保障供应,公众可公平获得的药品。国家基本药物目录是各级医疗卫生机构配备使用药品的依据。 一、目录的构成 目录中的药品包括化学药品和生物制品、中成药和中药饮片3 部分。 二、目录的编排 化学药品和生物制品、中成药分别按药品品种编号,有“注释”的除外。不同剂型同一主要化学成分或处方组成的编一个号,重复出现时标注“*”号。药品编号的先后次序无特别涵义。 三、目录的分类 化学药品和生物制品主要依据临床药理学分类,共417 个品种;中成药主要依据功能分类,共 268个品种;中药饮片不列具体品种,用文字表述。
四、品种的名称 化学药品和生物制品名称采用中文通用名称和英文国际非专利药名称(INN)中表达的化学成分的部分,剂型单列,有“注释”的药品除外;未标明酸根或盐基的药品,其主要化学成分相同而酸根或盐基不同的均为目录的药品;酯类衍生物的药品单独标明。中成药采用药品通用名称。 五、品种的剂型 目录收录口服剂型、注射剂型、外用剂型和其他剂型。 六、品种的规格 品种的规格主要依据2015 年版《中华人民共和国药典》。 七、对“注释”的说明 (一)化学药品和生物制品 (二)中成药 八、目录中的中药饮片 第一部分化学药品和生物制品 一、抗微生物药 (一)青霉素类 1青霉素/(钾盐)注射用无菌粉末:0.25g(40万单位)、0.5g(80 万单位)(钠盐)注射用无菌粉末:0.24g(40万单位)、0.48g(80 万单位)、0.96g(160万单位)
国家基本药物目录(2012年版)相关政策问答 一、为什么要调整国家基本药物目录?实施国家基本药物目录(2012年版)的意义是什么? 2009年8月,经卫生部、人力资源社会保障部、发展改革委等10部门组成的国家基本药物工作委员会审定,由卫生部发布了2009年版国家基本药物目录(基层部分)(以下简称2009年版目录)。2009年版目录药品的配备使用结合零差率销售政策的实施,对于促进合理用药、减轻群众用药负担、建立基层运行新机制发挥了重要作用。 国家基本药物目录(2012年版)(以下简称2012年版目录)是对2009年版目录的调整和完善。例如,增加了品种数量,优化了目录结构,增加了特殊人群适宜品种和剂型等。这是全面贯彻党的十八大精神的具体实践,将有利于进一步深化医改,巩固基本药物制度;有利于深化公立医院改革,促进医保、医药、医疗“三医”互联互动;有利于保基本、强基层、建机制;有利于常见病、多发病、慢性病特别是重大疾病防治;有利于减轻群众用药负担,满足基本用药;有利于树立正确的导向,促进药品企业优化升级;有利于推动医药科技创新。 二、制定2012年版目录开展了哪些工作?
根据国务院“十二五”医改规划和2012年医改工作安排,同时按照国家基本药物目录实行动态管理,每3年调整一次的相关规定,2012年初,卫生部着手2012年版目录的制订工作。通过对2009年版目录三年实施情况进行深入调研,总结分析各地药品配备使用情况,对照梳理增补药品,探索规范基本药物剂型、规格的路径和方法,整理积累了大量基础数据。 7月上旬,国家基本药物工作委员会召开全体会议,审议通过了工作方案,并建立健全了部门协调工作机制。随后,卫生部组织了3100余名医药和临床专家,对选入目录的基本药物安全性、有效性和经济性进行了研究论证。同时,充分听取和吸收采纳各方面意见,整个目录制定工作平稳,进展顺利。11月下旬,国家基本药物工作委员会再次召开全体会议,审议通过2012年版目录,并及时向国务院医改领导小组汇报。经各部门会签同意,专门向国务院书面报告了制定情况。 三、2012年版目录有哪些特点? 2012年版目录分为化学药品和生物制品、中成药、中药饮片三个部分,其中,化学药品和生物制品317种,中成药203种,共计520种。2012年版目录具有以下特点:一是增加了品种数量,能够更好地服务基层医疗卫生机构,推动各级各类医疗卫生机构全面配备、优先使用基本药物。二是优
国家基本药物目录(2018年版)解读 发布时间:2018-10-25 来源: 一、2018年版国家基本药物目录有哪些特点? 2018年版目录主要是在2012年版目录基础上进行调整完善。总体来看,2018年版目录具有以下特点:一是增加了品种数量,由原来的520种增加到685种,其中西药417种、中成药268种(含民族药),能够更好地服务各级各类医疗卫生机构,推动全面配备、优先使用基本药物。二是优化了结构,突出常见病、慢性病以及负担重、危害大疾病和公共卫生等方面的基本用药需求,注重儿童等特殊人群用药,新增品种包括了肿瘤用药12种、临床急需儿童用药22种等。三是进一步规范剂型、规格,685种药品涉及剂型1110余个、规格1810余个,这对于指导基本药物生产流通、招标采购、合理用药、支付报销、全程监管等将具有重要意义。四是继续坚持中西药并重,增加了功能主治范围,覆盖更多中医临床症候。五是强化了临床必需,这次目录调整新增的药品品种中,有11个药品为非医保药品,主要是临床必需、疗效确切的药品,比如直接抗病毒药物索磷布韦维帕他韦,专家一致认为可以治愈丙肝,疗效确切。 新版目录发布实施后,将能够覆盖临床主要疾病病种,更好适应基本医疗卫生需求,为进一步完善基本药物制度提供基础支撑,高质量满足人民群众疾病防治基本用药需求。 二、如何发挥基本药物和基本医保联动作用? 基本药物与医保药品既有共性,也存在差异。两者在安全有效、成本效益比方面无明显差别,基本药物在“防治必需、保障供应、优先使用”方面属性更强。一是基本药物不仅兼顾临床必需,还考虑公共卫生必需,包括免疫规划疫苗、抗艾滋病和结核病等药品。二是基本药物需采取多种方式保障有效供给,确保不断供,政府通过定点、储备等方式保障生产供应,通过财政专项经费或纳入医保基金予以高水平保障,提高患者对基本药物的可负担性。三是基本药物是临床首选、优先使用的一线药品,随着按病种付费、总额预付等医保支付方式改革不断深入,从保证供应、指导临床合理用药角度,基本药物目录的指导性作用只会加强、不会被淡化。 在基本药物和基本医保联动方面,《意见》提出,一是完善医保支付政策,医保部门按程序将符合条件的基本药物目录内的治疗性药品优先纳入医保目录范围或调整甲
化学药品和治疗用生物制品上市后研究技术指导手册 1. 背景 在上市前研究数据基础之上,上市后研究要求和上市后风险控制是审评审批决策的要素;上市后研究更是药品全生命周期监管的重要环节。我国的药品注册法规体系对上市后研究有明确的要求,如在《药品注册管理办法》(2007版)中规定,以下新药应进行上市后研究(Ⅳ期临床试验):化药属于注册分类1和2类;生物制品新药等。虽然有上述规定,但由于各种原因,长期以来,我国未能形成完善的药品上市后研究和评价体系,未能形成上市前、上市后研究和评价的良好衔接和全链路管理。严重影响了对上市后药品的动态评估和全生命周期监管。为尽快弥补这一不足,药品审评中心起草制定了《化学药品和治疗用生物制品上市后研究管理规范(草案)》,为使该规范能够良好实施,作为这一文件的配套文件,特制定本手册。本技术指导手册主要从技术角度为申办人提供指导。 2. 研究目的 基于不同的药物研发和监管历史,在对于药品安全、有效、质量可控的基本认识相同的情况下,不同的国家,对药品注册上市基本条件尺度的把握上会有所不同。现实情况下,我国上市前临床研究的水平和质量相对薄弱,而临床对突破性治疗的需求非常强烈,这在一定程度上都影响到新药上市前证据的强度。因而,者要求我们的上市后研究在关注安全性问题之外,可能要求更加丰富的临床药理学研究,可能要求增加随机对照临床试验以强化有效性数据等。因而,对目前我国的上市后研究的目的应有以下内容:评估药物在普通或特殊人群中使用的获益与风险 评价药物广泛使用条件下的有效性 评估已知与药物使用有关的严重风险 评估与药物使用有关的严重风险信号 当数据提示存在严重风险的可能性时,鉴定其是否为非预期的严重风险 进一步完善药物上市前的有效性数据 完善临床药理学信息
化学药品和治疗用生物制品上市后研究管理规范 1. 背景 研究药物上市前和上市后的整个生命周期,是有效性和安全性数据不断积累的过程,也是一个动态评估与决策的过程。药物上市申请的审评审批决策,是药物整个生命周期过程中的里程碑阶段。药品上市前,虽然对其质量、安全性、有效性和风险/获益进行了充分评估,满足了上市的基本要求,但由于上市前非临床和临床研究的局限性,不能充分反映临床实际应用条件下的有效性和安全性,仍会有一些研究留待上市后继续完善;药品上市后,在临床实践中,也可能会发现新问题,需要新的数据以帮助分析、判断,对其安全性和获益/风险进行再评价。因而在上市前研究数据基础之上,上市后研究要求和上市后风险控制也是审评审批决策的要素,同时上市后研究又是上市前研究的重要延续,是药品全生命周期监管的重要环节。 回顾我国的药物研发和监管历程,一直存在着重上市前、轻上市后的情况。企业的药物研发不以满足患者的临床需求为中心,而是以市场为导向,以药品的注册上市为目标,研究工作围绕注册要求进行,而忽视上市后研究;长期的“仿制药”监管理念束缚了监管者的行动,未能形成完善的药品上市后研究和评价体系,未能形成上市前、上市后研究和评价的良好衔接和全链路管理。特别是当前我国的创新药物研发日益蓬勃发展,而除了上市前研究本身的局限性外,我国临床研究的水平和质量也相对薄弱,一些临床急需的突破性治疗上市前临床研究还会简化。因而,我国的上市后研究除了关注安全性以外,也特别需要临床有效性数据的补充。从临床实践角度,新的临床治疗也需要不断得到循证医学证据的更新。综上,目前我国药品上市后研究和评价的不足日显突出,药品的上市后研究在我国的药品监管体系中也已经日益重要,急需建立一个完整的药品上市后研究和评价体系。 本规范旨在立足国内药物研发与监管实际,借鉴国际先进监管机构经验,制定我国药品上市后研究的管理与技术规范,初步明确为什么要做上市后研究,由谁来做上市后研究,如何做上市后研究,上市后研究的管理,上市后研究结果的评价和使用等问题。 2. 管理规程 2.1 研究目的 药品注册监管机构,在分析上市前研究数据的基础上,结合上市后研究要求和上市
国家基本药物目录 2018 年版 中华人民共和国国家卫生健康委员会
说明 基本药物是适应基本医疗卫生需求,剂型适宜,价格合理,能够保障供应,公众可公平获得的药品。国家基本药物目录是各级医疗卫生机构配备使用药品的依据。 一、目录的构成 目录中的药品包括化学药品和生物制品、中成药和中药饮片 3 部分。目录后附有索引。化学药品和生物制品为中文笔画索引、中文拼音索引和英文索引;中成药为中文笔画索引、中文拼音索引。 二、目录的编排 化学药品和生物制品、中成药分别按药品品种编号,有“注释”的除外。不同剂型同一主要化学成分或处方组成的编一个号,重复出现时标注“*”号。药品编号的先后次序无特别涵义。 “备注”栏内标注“△”号表示药品应在具备相应处方资质的医师或在专科医师指导下使用,并加强使用监测和评价。目录中的抗菌药物应按照抗菌药物临床应用管理相关规定执行。 三、目录的分类 化学药品和生物制品主要依据临床药理学分类,共417 个品种;中成药主要依据功能分类,共268 个品种;中药饮片不列具体品种,用文字表述。药品的使用不受目录分类类别的限制,但应遵照有关规定。 四、品种的名称 化学药品和生物制品名称采用中文通用名称和英文国际非专利药名称 ? 1 ?
说明 (International Nonproprietary Names,INN)中表达的化学成分的部分,剂型单列,有“注释”的药品除外;未标明酸根或盐基的药品,其主要化学成分相同而酸根或盐基不同的均为目录的药品;酯类衍生物的药品单独标明。 中成药采用药品通用名称。 五、品种的剂型 品种的剂型主要依据2015 年版《中华人民共和国药典》“制剂通则”等有关规定进行归类处理,未归类的剂型以目录中标注的为准。 目录收录口服剂型、注射剂型、外用剂型和其他剂型。口服剂型包括片剂(即普通片)、分散片、咀嚼片、肠溶片、缓释(含控释) 片、口腔崩解片、胶囊(即硬胶囊)、软胶囊、肠溶胶囊、肠溶软胶囊、缓释(含控释)胶囊、颗粒剂、缓释(含控释)颗粒、混悬液、干混悬剂、口服溶液剂、合剂(含口服液)、糖浆剂、散剂、粉剂、滴丸剂、丸剂、酊剂、煎膏剂(含膏滋)、酒剂。 注射剂型包括注射液、注射用无菌粉末(含冻干粉针剂)。外用剂型包括软膏剂、乳膏剂、凝胶剂、外用溶液剂、胶浆剂、贴膏剂、橡 胶膏剂、膏药、酊剂、洗剂、涂剂、散剂、冻干粉。其他剂型包括气雾剂、雾化溶液剂、吸入溶液剂、吸入粉雾剂、喷雾剂、鼻 喷雾剂、灌肠剂、滴眼剂、眼膏剂、滴剂、滴鼻剂、滴耳剂、栓剂、阴道片、阴道泡腾片、阴道软胶囊。 六、品种的规格 品种的规格主要依据2015 年版《中华人民共和国药典》。同一品种剂量相同但表述方式不同的暂视为同一规格;未标注具体规格的,其剂型对应的规格暂以国家药品管理部门批准的规格为准。 七、对“注释”的说明 (一)化学药品和生物制品 注释1:第39 号“耐多药肺结核用药”是指按规定列入《耐多药肺结核防治管理工作方案》中的耐多药肺结核治疗药品。 ? 2 ?
怎样区别生物制品与生化药品生物制品一般是用微生物(细菌,病毒,主克次体)、微生物和动物毒素、人和动物的血液及组织等所制成的作为预防、治疗、诊断用的制品。根据生物制品的性质和用法不同有菌苗(死、活)、疫苗(死、活)、类毒素、免疫血清诊断用品等。 生化药品一般是利用生物体组织、器官等为原料,通过化学方法进行提取、精制或者用化工合成方法制成的生物活性成分,如ATP、辅酶、抗生素、激素、氨基酸等。从中药材中提取的药物一般都归类于中药制剂。现行药品注册管理办法(试行)《药品注册管理办法(试行)》以及《关于药品注册管理的补充规定》,生化药品和生物制品本身就有者密切的关系,在两者之间划分出一个绝对的界限是不现实的。在实际工作操作中,区分产品就可以看批准文号:生物制品会是国药准字S开头。而生化药品归属于化学药品,批准文号以国药准字H开头。在新药申报时按上述定义仍不知道如何区分时就麻烦了,因为生物制品的申报要比化学药品复杂,而企业如有机会申报成化学药品就轻松很多。 广义上来讲生物制品是个大范畴,包括生化药品;狭义上我们现在一般把疫苗、菌苗、灭活毒菌株、血液制品等归为生物制品,生化药品则指的是治疗类药物,如基因工程药物、提取的蛋白类药物、多糖及核酸类药物等等。
生物制品是指以微生物、寄生虫、动物毒素、生物组织作为起始材料,采用生物学工艺或分离纯化技术制备,并以生物学技术和分析技术控制中间产物和成品质量制成的生物活性制剂,包括菌苗,疫苗,毒素,类毒素,免疫血清,血液制品,免疫球蛋白,抗原,变态反应原,细胞因子,激素,酶,发酵产品,单克隆抗体, DNA重组产品,体外免疫诊断制品等。生物制品仍具有生物活性,一般需低温储存、运输,药品批准文号以大写S开头。 生化药品系指动物,植物和微生物等生物体中经分离提取、生物合成、生物-化学合成 DNA重组等生物技术获得的一类防病、治病的药物。主要包括:氨基酸、核苷、核苷酸及其衍生物、多肽、蛋白质、酶、辅酶、脂质及多糖类等生化物质。批准文号以大写H开头,属于化学药品的一种。
新版国家基本药物目录公布药品扩至520种2013年03月15日18:50 本文转自:卫生部网站 导读:2013年3月15日,卫生部网站公布《国家基本药物目录》(2012年版),新版目录已经于2012年9月21日经卫生部部务会议讨论通过,将于2013年5月1日起施行。2009年8月18日发布的中华人民共和国卫生部令第69号同时废止。 新版基本药物目录全文下载 2012年版国家基本药物目录(以下简称2012年版目录)已经发布。目录分为化学药品和生物制品、中成药、中药饮片三个部分,其中,化学药品和生物制品317种,中成药203种,共计520种(2009年旧版目录中化药和生物药共205个品种,中成药102个品种,共计307个品种)。目录中的化学药品和生物制品数量与世界卫生组织现行推荐的基本药物数量相近,并坚持中西药并重。 2009年8月,国家基本药物制度正式启动实施。2009年版目录药品的配备使用结合零差率政策的实施,对于促进合理用药、减轻群众基本用药负担和建立基层运行新机制,发挥了重要作用。但是,由于2009年版目录主要针对基层医疗卫生机构,在实施中存在一定的局限性:品种较少,基层普遍反映不够用,较大医院很少使用;缺少妇儿、肿瘤等专科用药,地方增补药品不规范;药品剂型规格宽泛,不利于招标带量采购。2012年版目录是以2009年的目录为基础,坚持“保基本、强基层、建机制”,在数量上与目前基层实际使用数量相衔接,参考WHO基本药物示范目录,充分考虑我国现阶段基本国情和基本医疗保障能力。 2012年版目录具有以下特点:一是增加了品种,能够更好地服务基层医疗卫生机构,推动各级各类医疗卫生机构全面配备、优先使用基本药物。二是优化了结构,补充抗肿瘤和血液病用药,注重与常见病、多发病特别是重大疾病以及妇女、儿童用药的衔接。三是规范了剂型、规格,初步实现标准化。尽管品种数量增加,但剂型、规格的数量减少,有利于基本药物招标采购,保障供应,落实基本药物全程监管。四是注重与医保(新农合)支付能力相适应,确保基本药物较高的比例报销。 国家基本药物目录原则上3年调整一次。根据国务院“十二五”医改规划和2012年医改工作安排,卫生部制定公布2012年版国家基本药物目录。遴选过程严格按照“防治必需、安全有效、价格合理、使用方便、中西药并重”的原则,结合我国疾病谱,突出常见病、多发病防治需要,进一步优化结构,保持合理的品种、剂型和规格,充分兼顾重大公共卫生服务项目、重大疾病保障、中西医临床路径实施、重大新药创制科技专项等相关政策要求,促进医保、医药、医疗互联互动,推动公立医院改革,确保基本药物安全可及,逐步满足群众基本用药需求。2012年初,卫生部着手2012年版目录的制订工作。7月上旬,基本药物工作委员会召开全体会议,审议通过工作方案,并建立健全部门协调工作机制。卫生部组织3100余名医药和临床专家,对选入目录的基本药物安全性、有效性和经济性进行研究论证,同时,在国务院医改办和相关部门大力支持下,充分听取和吸收采纳了各方面意见。11月下旬,基本药物工作委员会再次召开全体会议,审议通过2012年版目录,并及时向国务院医改领导小组汇报。经各部门会签同意,专门向国务院书面报告了目录制定情况。 国家基本药物目录是实施基本药物制度的基础和龙头。2012年版目录发布后,还将继续完善相关政策。主要是按照“十二五”医改规划部署要求,落实《国务院办公厅关于巩固完善基本药物制度和基层运行新
________________________________________________________________________________________________________ ______ 国家基本药物目录 2018 年版 精品资料
中华人民共和国国家卫生健康委员会
________________________________________________________________________________________________________ ______ 精品资料
______________________________________________________________________________________________________________ 说明 基本药物是适应基本医疗卫生需求,剂型适宜,价格合理,能够保障供应,公众可公平获得的药品。国家基本药物目录是各级医疗卫生机构配备使用药品的依据。 一、目录的构成 目录中的药品包括化学药品和生物制品、中成药和中药饮片 3 部分。目录后附有索引。化学药品和生物制品为中文笔画索引、中文拼音索引和英文索引;中成药为中文笔画索引、中文拼音索引。 二、目录的编排 化学药品和生物制品、中成药分别按药品品种编号,有“注释”的除外。不同剂型同一主要化学成分或处方组成的编一个号,重复出现时标注“*”号。药品编号的先后次序无特别涵义。 “备注”栏内标注“△”号表示药品应在具备相应处方资质的医师或在专科医师指导下使用,并加强使用监测和评价。目录中的抗菌药物应按照抗菌药物临床应用管理相关规定执行。 三、目录的分类 化学药品和生物制品主要依据临床药理学分类,共417 个品种;中成药主要依据功能分类,共268 个品种;中药饮片不列具体品种,用文字表述。药品的使用不受目录分类类别的限制,但应遵照有关规定。 四、品种的名称 化学药品和生物制品名称采用中文通用名称和英文国际非专利药名称 精品资料
怎样区别生物制品与生化药品 生物制品一般是用微生物(细菌,病毒,立克次体)、微生物和动物毒素、人和动物的血液及组织等所制成的作为预防、治疗、诊断用的制品。根据生物制品的性质和用法不同有菌苗(死、活)、疫苗(死、活)、类毒素、免疫血清诊断用品等。 生化药品一般是利用生物体组织、器官等为原料,通过化学方法进行提取 精制或者用化工合成方法制成的生物活性成分,如A TP、辅酶、抗生素、激素、氨基酸等。从中药材中提取的药物一般都归为中药制剂 现行药品注册管理办法(试行)《药品注册管理办法(试行)以及《关于药品注册管理的补充规定,》生化药品和生物制品本身有着密切的的关系,在两者之间划分出一个绝对的界限是不现实的,在实际工作操作中,区分产品就可以看批准文号;生物制品是国药准字S开头。而生化药品归属于化学药品,批准文号以国药准字H开头。在新药申报时按上述定义仍不知道如何区分时就麻烦了,因为生物制品的申报要比化学药品复杂,而企业如有机会申报成化学药品就轻松很多。 广义上来讲生物制品是个大范畴,包括生化药品;狭义上我们现在一般把疫苗、菌苗、灭活毒菌株、血液制品等归为生物制品,生化药品则指的是治疗类药物,如基因工程药物,提取的蛋白类药物、多糖及核算类药物等等。 生物制品是指以微生物、寄生虫、动物毒素、生物组织作为起始材料,采用生物学工艺或分离纯化技术制备,并以生物学技术和分析技术控制中间产物和成品质量制成的生物活性制剂,包括菌苗、疫苗、毒素、类毒素、免疫血清、血液制品、免疫球蛋白、抗原、变态反应原、细胞因子、激素、酶、发酵产品、单克隆抗体、DNA重组产品、体外免疫诊断制品等。生物制品仍具有生物活性,一般需低温储存、运输药品批准文号以大写S开头生化药品系指动物、植物、和微生物等生物体中经分离提取、生物合成 生物-化学合成重组等生物技术获得的一类防病、治病的药物。主要包括:氨基酸、核苷、核苷酸及其衍生物、多肽、蛋白质、酶、辅酶脂质及多糖类等生化物质。批准文号以大写H 开头,属于化学药品的一种。
《国家基本药物目录(基层医疗卫生机构配备使用部分)》(2009版) 国家基本药物目录化学药品和生物制品部分 序号品种名称英文名称剂型备注 一、抗微生物药 (一)青霉素类 1 青霉素Benzylpenicillin 注射剂 2 苯唑西林Oxacillin 注射剂 3 氨苄西林Ampicillin 注射剂 4 哌拉西林Piperacillin 注射剂 5 阿莫西林Amoxicillin 口服常释剂型 6 阿莫西林克拉维酸钾Amoxicillin and Clavulanate Potassium 口服常释剂型 (二)头孢菌素类 7 头孢唑林Cefazolin 注射剂 8 头孢氨苄Cefalexin 口服常释剂型、颗粒剂 9 头孢呋辛Cefuroxime 口服常释剂型、注射剂注释1 10 头孢曲松Ceftriaxone 注射剂 (三)氨基糖苷类 11 阿米卡星Amikacin 注射剂 12 庆大霉素Gentamycin 注射剂 (四)大环内酯类 13 红霉素Erythromycin 口服常释剂型、注射剂 14 阿奇霉素Azithromycin 口服常释剂型、颗粒剂 (五)其他抗生素 15 克林霉素Clindamycin 口服常释剂型、注射剂 16 磷霉素Fosfomycin 注射剂 (六)磺胺类 17 复方磺胺甲噁唑Compound Sulfamethoxazole 口服常释剂型 (七)喹诺酮类 18 诺氟沙星Norfloxacin 口服常释剂型 19 环丙沙星Ciprofloxacin 口服常释剂型、注射剂 20 左氧氟沙星Levofloxacin 口服常释剂型、注射剂 (八)硝基呋喃类 21 呋喃妥因Nitrofurantoin 口服常释剂型 (九)抗结核病药 22 异烟肼Isoniazid 口服常释剂型、注射剂 23 利福平Rifampicin 口服常释剂型 24 吡嗪酰胺Pyrazinamide 口服常释剂型 25 乙胺丁醇Ethambutol 口服常释剂型 26 链霉素Streptomycin 注射剂 27 对氨基水杨酸钠Sodium Aminosalicylate 口服常释剂型、注射剂 (十)抗麻风病药 28 氨苯砜Dapsone 口服常释剂型 (十一)抗真菌药 29 氟康唑Fluconazole 口服常释剂型
本文章来源于《中国药师论坛》。生化药品系指动物、植物和微生物等生物体中经分离提取、生物合成、生物-化学合成、DNA重组等生物技术获得的一类防病、治病的药物。主要包括:氨基酸、核苷、核苷酸及其衍生物、多肽、蛋白质、酶、辅酶、脂质及多糖类等生化物质。批准文号一般为“国药准字H”开头,如胰岛素、18种氨基酸注射液等。 根据《中国生物制品规程》,生物制品系指以微生物、寄生虫、动物毒素、生物组织作为起始材料,采用生物学工艺或分离纯化技术制备,并以生物学技术和分析技术控制中间产物和成品质量制成的生物活性制剂,包括菌苗,疫苗,毒素,类毒素,免疫血清,血液制品,免疫球蛋白,抗原,变态反应原,细胞因子,激素,酶,发酵产品,单克隆抗体,DNA重组产品,体外免疫诊断制品等。体现在批准文号上,为“国药准字S”开头,如乙肝疫苗、人血白蛋白等; 医药行业所说的“生物制剂”其实是指“免疫生物制剂”,是指用微生物(细菌、立克次体、病毒等)及其代谢产物有效抗原成分、动物毒素、人或动物的血液或组织等加工而成作为预防、治疗、诊断相应传染病或其他有关疾病的生物制品。从定义上看,它比生物制品的范畴要窄一些; 胰岛素类 国药准字H开头的:胰岛素注射液、精蛋白锌胰岛素注射液、注射用三磷酸腺苷辅酶胰岛素 国药准字S开头的:重组人胰岛素注射液、精蛋白重组人胰岛素注射液、胰岛素放射免疫分析药盒 广义上来讲生物制品是个大范畴,包括生化药品;狭义上我们现在一般把疫苗、菌苗、灭活毒菌株、血液制品等归为生物制品,生化药品则指的是治疗类药物,如基因工程药物、提取的蛋白类药物、多糖及核酸类药物等等。 根据《中国生物制品规程》,生物制品系指以微生物、寄生虫、动物毒素、生物组织作为起始材料,采用生物学工艺或分离纯化技术制备,并以生物学技术和分析技术控制中间产物和成品质量制成的生物活性制剂,包括菌苗,疫苗,毒素,类毒素,免疫血清,血液制品,免疫球蛋白,抗原,变态反应原,细胞因子,激素,酶,发酵产品,单克隆抗体,DNA重组产品,体外免疫诊断制品等。体现在批准文号上,为“国药准字S”开头,如乙肝疫苗、人血白蛋白等; 谢谢楼主,现在能肯定说出来了。 生物制品一般是用微生物(细菌,病毒,主克次体)、微生物和动物毒素、人和动物的血液及组织等所制成的作为预防、治疗、诊断用的制品。根据生物制品的性质和用法不同有菌苗(死、活)、疫苗(死、活)、类毒素、免疫血清诊断用品等。 生化药品一般是利用生物体组织、器官等为原料,通过化学方法进行提取、精制或者用化工合成方法制成的生物活性成分,如ATP、辅酶、抗生素、激素、氨基酸等。从中药材中提取的药物一般都归类于中药制剂。
国家基本药物目录第一部分化学药品和生物制品 序号品种名称英文名称剂型备注一、抗微生物药 (一)青霉素类 1青霉素Benzylpenicillin 注射剂 2苯唑西林Oxacillin注射剂 3氨苄西林Ampicillin 注射剂 4哌拉西林Piperacillin 注射剂 5阿莫西林Amoxicillin 口服常释剂型 6阿莫西林 克拉维酸 钾 Amoxicillin and Clavulanate Potassium 口服常释剂型 (二)头孢菌素类 7头孢唑林Cefazolin注射剂 8头孢氨苄Cefalexin 口服常释剂型、颗粒剂 9头孢呋辛Cefuroxime口服常释剂型、注射剂注释1 10头孢曲松Ceftriaxone注射剂 (三)氨基糖苷类 11阿米卡星Amikacin 注射剂 12庆大霉素Gentamycin 注射剂 (四)大环内酯类 13红霉素Erythromycin口服常释剂型、注射剂 14阿奇霉素Azithromycin口服常释剂型、颗粒剂(五)其他抗生素 15克林霉素Clindamycin口服常释剂型、注射剂 16磷霉素Fosfomycin注射剂 (六)磺胺类 17复方磺胺 甲噁唑 Compound Sulfamethoxazole 口服常释剂型 (七)喹诺酮类
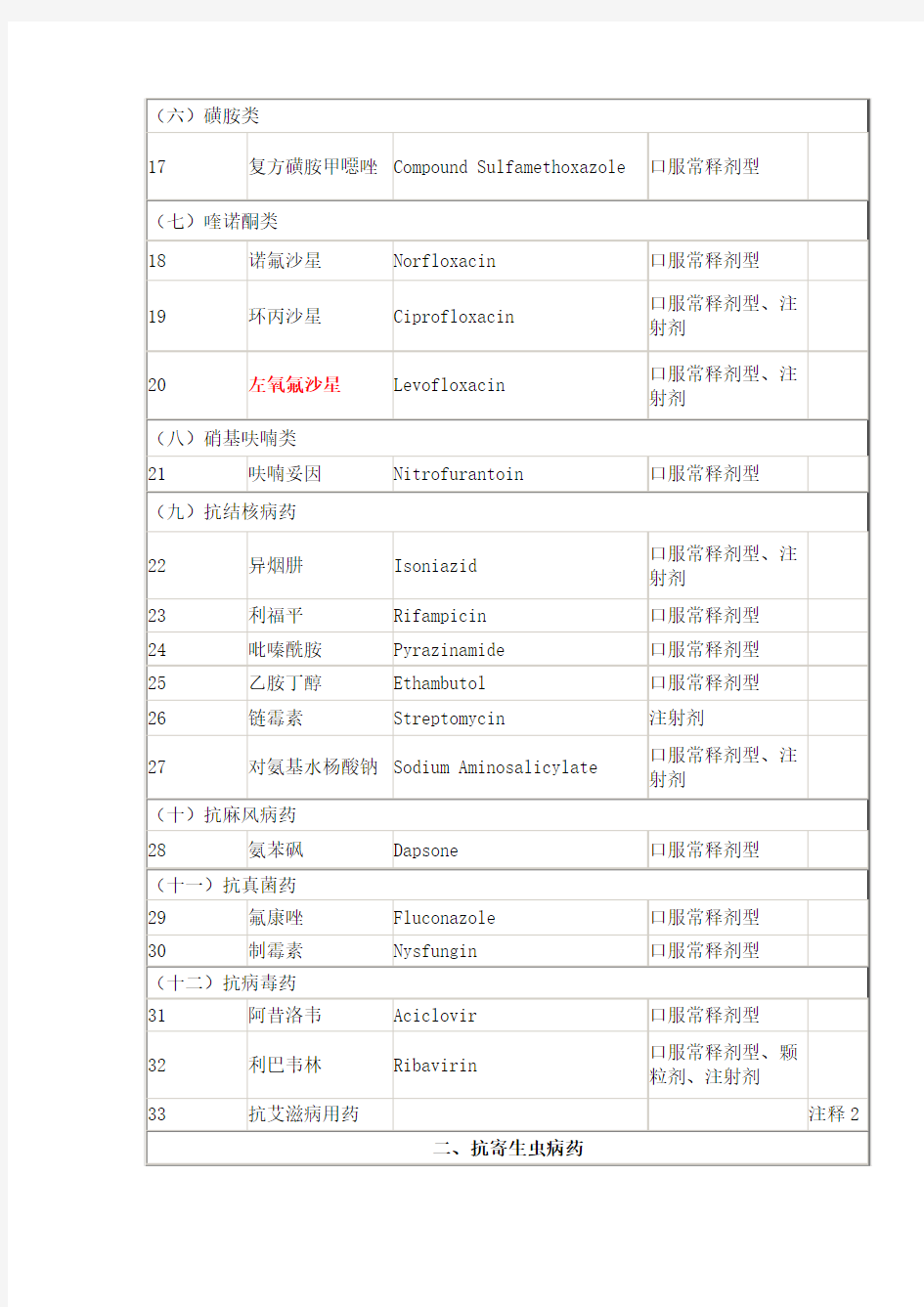
18诺氟沙星Norfloxacin 口服常释剂型 19环丙沙星Ciprofloxacin 口服常释剂型、注射剂 20左氧氟沙 星 Levofloxacin口服常释剂型、注射剂 (八)硝基呋喃类 21呋喃妥因Nitrofurantoin口服常释剂型 (九)抗结核病药 22异烟肼Isoniazid口服常释剂型、注射剂 23利福平Rifampicin口服常释剂型 24吡嗪酰胺Pyrazinamide口服常释剂型 25乙胺丁醇Ethambutol口服常释剂型 26链霉素Streptomycin注射剂 27对氨基水 杨酸钠 Sodium Aminosalicylate 口服常释剂型、注射剂 (十)抗麻风病药 28氨苯砜Dapsone口服常释剂型(十一)抗真菌药 29氟康唑Fluconazole口服常释剂型30制霉素Nysfungin口服常释剂型(十二)抗病毒药 31阿昔洛韦Aciclovir口服常释剂型 32利巴韦林Ribavirin 口服常释剂型、颗粒剂、注射剂 33抗艾滋病 用药 注释2 二、抗寄生虫病药 (一)抗疟药 34氯喹Chloroquine口服常释剂型、注射剂35伯氨喹Primaquine口服常释剂型 36青蒿素类 药物 注释3
化学药物和生物制品临床试验的生物统计学 技术指导原则 (第二稿) 二OO四年三月一日 目录 一、概述 二、整个临床试验需考虑的问题 ㈠、探索性试验和确证性试验 ㈡、观察指标 ㈢、偏倚的控制 三、试验设计中需考虑的问题 ㈠、试验设计的类型 ㈡、多中心试验 ㈢、比较的类型 ㈣、样本含量 ㈤、资料的搜集 四、试验进行中需考虑的问题 ㈠、试验的监查 ㈡、期中分析
㈢、试验方案的修改 五、数据管理 六、统计分析 ㈠、统计分析计划书 ㈡、统计分析集 ㈢、缺失值及离群值 ㈣、数据变换 ㈤、统计分析方法 ㈥、安全性评价 七、统计分析报告 八、名词解释 九、参考文献 十、附录 十一、起草说明 ㈠.探索性试验和确证性试验㈡. 观察指标与变量 ㈢.观察指标的内容 ㈣.关于主要指标 ㈤.关于临床研究中的盲法
㈥.关于多中心临床研究中各中心的需完成的病例数 .33 ㈦.关于样本量的问题 ㈧.关于期中分析 ㈨.关于统计分析集 ㈩.关于安全性评价 十二、著者 一、概述 新药的上市经临床前的各项基础研究后,其有效性和安全性的评价需要由临床试验加以确认。由于临床试验通常是根据研究的目的,通过样本来研究药物对疾病进程、预后等方面的作用,因此,临床研究设计必须应用统计学原理对试验相关的因素做出合理的、有效的安排,并最大限度地控制试验误差,提高试验质量,对试验结果进行科学合理的分析,在保证试验结果科学、可信的同时,尽可能做到高效、快速、经济。因此,统计学在临床试验中有着不可缺少的重要作用。 2002年,国家药品监督管理局颁布了新的《药品注册管理办法(试行)》,其中,对药物临床研究的分期赋予了新的内涵,使我国对药物临床研究的要求更符合新药临床研究的基本规律,更趋于科学、合理。因此,本次指导原则修订的指导思想是保持原版指导原则的先进性的同时,充分考虑了法规的变化以及我国药物临床研究的现状,参考了ICH E9文件以及美国、欧盟、日本等国的现行指导原则,力求符合中国国情,并使之具有充分的可操作性。 本指导原则以临床试验的基本要求和统计学原理为重点,包含了对临床试验的总体考虑以及试验设计时、试验过程及结果分析时的统计学问题,旨在为药物注册申请人和临床试验的研究者在整个临床试验中如何进行设计、实施、分析和评价提供指导,以期保证药物临床试验的科学性、严谨性和规范性。 本指导原则主要适用于临床试验的后期(确证性试验),但尽可能用于临床试验的各个阶段。
附件 生物制品注册分类及申报资料要求 生物制品是指以微生物、细胞、动物或人源组织和体液等为起始原材料,用生物学技术制成,用于预防、治疗和诊断人类疾病的制剂。为规范生物制品注册申报和管理,将生物制品分为预防用生物制品、治疗用生物制品和按生物制品管理的体外诊断试剂。 预防用生物制品是指为预防、控制疾病的发生、流行,用于人体免疫接种的疫苗类生物制品,包括免疫规划疫苗和非免疫规划疫苗。 治疗用生物制品是指用于人类疾病治疗的生物制品,如采用不同表达系统的工程细胞(如细菌、酵母、昆虫、植物和哺乳动物细胞)所制备的蛋白质、多肽及其衍生物;细胞治疗和基因治疗产品;变态反应原制品;微生态制品;人或者动物组织或者体液提取或者通过发酵制备的具有生物活性的制品等。生物制品类体内诊断试剂按照治疗用生物制品管理。 按照生物制品管理的体外诊断试剂包括用于血源筛查的体外诊断试剂、采用放射性核素标记的体外诊断试剂等。 药品注册分类在提出上市申请时确定,审评过程中不因其他药品在境内外上市而变更。 —1 —
第一部分预防用生物制品 一、注册分类 1类:创新型疫苗:境内外均未上市的疫苗: 1.1无有效预防手段疾病的疫苗。 1.2在已上市疫苗基础上开发的新抗原形式,如新基因重组疫苗、新核酸疫苗、已上市多糖疫苗基础上制备的新的结合疫苗等。 1.3含新佐剂或新佐剂系统的疫苗。 1.4含新抗原或新抗原形式的多联/多价疫苗。 2类:改良型疫苗:对境内或境外已上市疫苗产品进行改良,使新产品的安全性、有效性、质量可控性有改进,且具有明显优势的疫苗,包括: 2.1在境内或境外已上市产品基础上改变抗原谱或型别,且具有明显临床优势的疫苗。 2.2具有重大技术改进的疫苗,包括对疫苗菌毒种/细胞基质/生产工艺/剂型等的改进。(如更换为其他表达体系或细胞基质的疫苗;更换菌毒株或对已上市菌毒株进行改造;对已上市细胞基质或目的基因进行改造;非纯化疫苗改进为纯化疫苗;全细胞疫苗改进为组分疫苗等) 2.3已有同类产品上市的疫苗组成的新的多联/多价疫苗。 2.4改变给药途径,且具有明显临床优势的疫苗。 2.5改变免疫剂量或免疫程序,且新免疫剂量或免疫程序具有明显临床优势的疫苗。 —2 —
二〇二一年二月
一、概述 (1) 二、临床变更分类 (1) (一)重大变更 (1) (二)中等变更 (4) (三)微小变更 (5) 三、临床变更程序 (6) (一)补充申请 (6) (二)备案管理 (7) (三)年度报告 (7) (四)其它 (7) 四、临床变更技术要求 (8) (一)变更研究技术考虑 (8) (二)变更申报资料要求 (9) 参考文献 (11) 著者 (12)
一、概述 已上市药品临床变更是指,药品获准上市后,药品上市许可持有人出于临床安全有效使用药品的需要,对药品的适应症、适用人群范围、用法用量、药品说明书安全性信息、药物警戒计划等事项进行的变更。药品上市后临床变更管理属于药品全生命周期管理的重要组成部分。 本指导原则明确了药品在中国获准上市后的临床变更事项,并基于变更大小及其对药品临床安全有效使用可能产生的影响及风险程度进行了分类,细化了不同分类对应的申报程序及技术要求等,旨在为药品上市许可持有人开展药品上市后临床变更研究,药品监督管理部门进行变更分类管理等提供有益的技术指导和参考。 本指导原则适用于化学药品、预防用生物制品和治疗用生物制品。对于已上市药品增加境内未批准的新适应症、改变给药途径等,需按照药物临床试验和上市许可申请通道进行申报和审评审批。 二、临床变更分类 根据变更对药品安全性、有效性及对临床安全有效使用产生的影响程度和风险高低,将临床相关变更分为重大变更、中等变更和微小变更三种类型,具体如下: (一)重大变更 药品安全性和有效性信息的变更,以及药品说明书安全
性相关信息的变更均属于临床重大变更。根据重大变更的复杂程度及其需要开展的研究情况,将重大变更分为A类和B 类。 1. 重大变更A类 药品安全性和有效性信息的变更,属于重大变更A类,是指与用药人群、有效性、安全性、给药剂量和给药方法相关的变更,例如:用药人群变更,给药剂量超过或低于已批准的用法用量范围,药物相互作用信息的变更等。 此类变更主要涉及药品使用人群或剂量范围的扩大或缩小等有效性信息的变更,将直接影响药品的临床使用,应有临床试验数据和/或相关非临床研究数据的支持,需要提交补充申请并经过审评、审批后执行。此类变更应同时对药品说明书和/或包装标签进行相应修订。 重大变更A类主要包括以下情形: (1)已批准适应症的变更 ①适用人群的变更,例如:在成人的基础上扩展至儿童等适用人群年龄范围扩大的情形。 ②基于临床研究证实有效性证据不足或风险大于获益的,需要对适应症加以限定或删除等。 (2)用法用量的变更,包括推荐用药剂量和/或给药方案的变更等,变更后的给药剂量超过或低于已批准的用法用量范围。
指导原则编号:【H】G C L 4-1 化学药物和生物制品临床试验的生物统计学 技术指导原则 二○○五年三月
目 录 一、概述 (1) 二、整个临床试验的基本考虑 (1) (一)探索性试验和确证性试验 (1) (二)观察指标 (2) (三)偏倚的控制 (4) 三、试验设计中的基本考虑 (8) (一)试验设计的类型 (8) (二)多中心试验 (10) (三)比较的类型 (10) (四)样本量 (11) (五)资料的收集 (12) 四、试验进行中的基本考虑 (12) (一)期中分析 (12) (二)试验方案的修改 (13) 五、数据管理 (13) 六、统计分析 (15) (一)统计分析计划书 (15) (二)统计分析集 (15) (三)缺失值及离群值 (16) (四)数据变换 (17) (五)统计分析方法 (17)
(六)安全性评价 (18) 七、统计分析报告 (19) 八、名词解释 (20) 九、参考文献 (23) 十、附录 (23) 十一、著者 (23)
化学药物和生物制品临床试验的生物统计学 技术指导原则 一、概述 新药经临床前研究后,其有效性和安全性的评价需要由临床试验加以确认。由于临床试验通常是根据研究的目的,通过足够数量的受试者(样本)来研究药物对疾病进程、预后等方面的作用,因此,临床试验设计必须应用统计学原理对试验相关的因素做出合理的、有效的安排,并最大限度地控制试验误差、提高试验质量以及对试验结果进行科学合理的分析,在保证试验结果科学、可信的同时,尽可能做到高效、快速、经济。因此,统计学在临床试验中有着不可缺少的重要作用。 本指导原则以临床试验的基本要求和统计学原理为重点,包含了对临床试验的总体考虑以及试验设计、试验过程和结果分析时的统计学问题,旨在为药品注册申请人和临床试验的研究者在整个临床试验中如何进行设计、实施、分析和评价提供指导,以期保证药物临床试验科学、严谨和规范。 本指导原则主要适用于临床试验的后期(确证性试验),但应尽可能用于临床试验的各个阶段。 二、整个临床试验的基本考虑 (一)探索性试验和确证性试验 药物临床试验的主要目标是寻找是否存在其风险/效益比可接受的安全有效的药物,同时也要确定可能由该药受益的特定对象、使用适应症及
国家基本药物目录(2018年版) 国家基本药物目录xx 年版中华人民共和国国家卫生健康委员会说明基本药物是适应基本医疗卫生需求,剂型适宜,价格合理,能够保障供应,公众可公平获得的药品。国家基本药物目录是各级医疗卫生机构配备使用药品的依据。 一.目录的构成目录中的药品包括化学药品和生物制品.中成药和中药饮片3 部分。 目录后附有索引。化学药品和生物制品为中文笔画索引.中文拼音索引和英文索引;中成药为中文笔画索引.中文拼音索引。 二.目录的编排化学药品和生物制品.中成药分别按药品品种编号,有“注释”的除外。不同剂型同一主要化学成分或处方组成的编一个号,重复出现时标注“*”号。药品编号的先后次序无特别涵义。 “备注”栏内标注“△”号表示药品应在具备相应处方资质的医师或在专科医师指导下使用,并加强使用监测和评价。目录中的抗菌药物应按照抗菌药物临床应用管理相关规定执行。 三.目录的分类化学药品和生物制品主要依据临床药理学分类,共417 个品种;中成药主要依据功能分类,共268 个品种;中药饮片不列具体品种,用文字表述。药品的使用不受目录分类类别的限制,但应遵照有关规定。
四.品种的名称化学药品和生物制品名称采用中文通用名称和英文国际非专利药名称?1 ?(International Nonproprietary Names,INN)中表达的化学成分的部分,剂型单列,有“注释”的药品除外;未标明酸根或盐基的药品,其主要化学成分相同而酸根或盐基不同的均为目录的药品;酯类衍生物的药品单独标明。 中成药采用药品通用名称。 五.品种的剂型品种的剂型主要依据xx 年版《中华人民共和国药典》“制剂通则”等有关规定进行归类处理,未归类的剂型以目录中标注的为准。 目录收录口服剂型.注射剂型.外用剂型和其他剂型。 口服剂型包括片剂(即普通片).分散片.咀嚼片.肠溶片.缓释(含控释)片.口腔崩解片.胶囊(即硬胶囊).软胶囊.肠溶胶囊.肠溶软胶囊.缓释(含控释)胶囊.颗粒剂.缓释(含控释)颗粒.混悬液.干混悬剂.口服溶液剂. 合剂(含口服液).糖浆剂.散剂.粉剂.滴丸剂.丸剂.酊剂.煎膏剂(含膏滋).酒剂。 注射剂型包括注射液.注射用无菌粉末(含冻干粉针剂)。 外用剂型包括软膏剂.乳膏剂.凝胶剂.外用溶液剂.胶浆剂.贴膏剂.橡胶膏剂.膏药.酊剂.洗剂.涂剂.散剂.冻干粉。 其他剂型包括气雾剂.雾化溶液剂.吸入溶液剂.吸入粉雾剂.喷雾剂.鼻喷雾剂.灌肠剂.滴眼剂.眼膏剂.滴剂.滴鼻剂.滴耳剂.栓剂.阴道片.阴道泡腾片.阴道软胶囊。