
毒理学作业
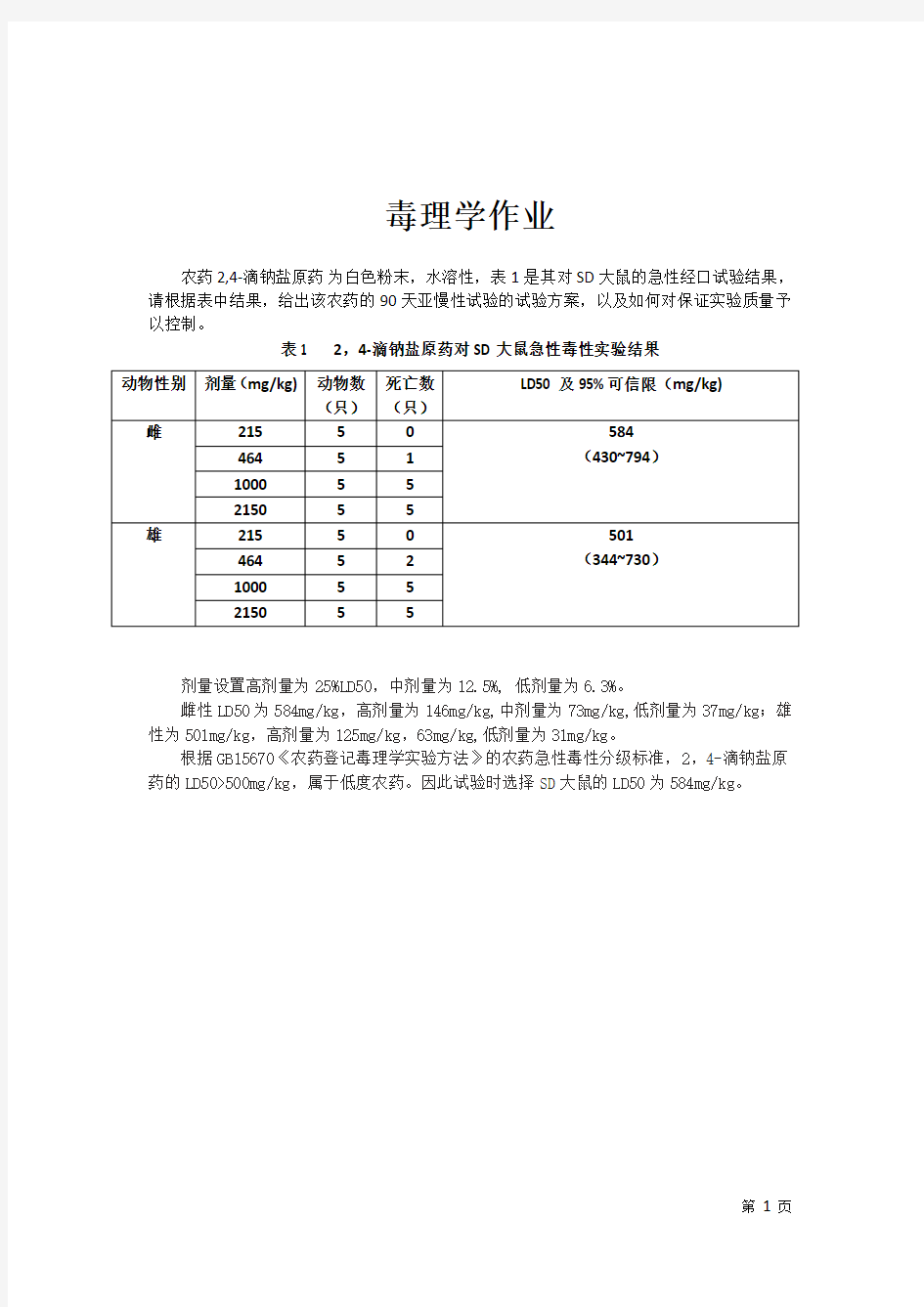
农药2,4-滴钠盐原药为白色粉末,水溶性,表1是其对SD大鼠的急性经口试验结果,请根据表中结果,给出该农药的90天亚慢性试验的试验方案,以及如何对保证实验质量予以控制。
表1 2,4-滴钠盐原药对SD大鼠急性毒性实验结果
剂量设置高剂量为25%LD50,中剂量为12.5%, 低剂量为6.3%。
雌性LD50为584mg/kg,高剂量为146mg/kg,中剂量为73mg/kg,低剂量为37mg/kg;雄性为501mg/kg,高剂量为125mg/kg,63mg/kg,低剂量为31mg/kg。
根据GB15670《农药登记毒理学实验方法》的农药急性毒性分级标准,2,4-滴钠盐原药的LD50>500mg/kg,属于低度农药。因此试验时选择SD大鼠的LD50为584mg/kg。
农药2,4-滴钠盐原药SD大鼠亚慢性毒性试验
目的;研究喂饲农药2,4-滴钠盐原药对大鼠的亚慢性毒性。
方法:取初断乳 SD大鼠80只,雌雄各半按照体重随机分为4组。将2,4-滴钠盐原药按146、73、37mg/kg mg/kg剂量分别拌入饲料内经口喂饲染毒90d。
观察:大鼠外观体征、体质量、进食情况等。在实验中期和末期采血检测检测血液学。试验末期检测血生化指标以及尿常规检查。实验结束时处死实验动物,计算脏器指数,并对主要脏器进行病理组织学观察。
1 材料和方法
1.1 受试物
农药2,4-滴钠盐原药,白色粉末,水溶性,由某地某农药公司提供。SPF级初断乳大鼠80只,雌雄各半,体质量50~100 g,由XXX实验动物研究所繁育场提供,动物合格证号为医动字第XX-XXXX号。
1.2 饲养与管理
SPF 环境条件下,同组同性别两只一笼喂养,自由进食和饮水。环境温度 21~25℃,相对湿度 40%~60%。严格控制昼夜交替。
1.3实验方法
试验前将雌、雄大鼠各半按体重随机分为3个剂量组和1个对照组,每组20只,将2,4-滴钠盐原药按146、73、37mg/kg mg/kg剂量分别均匀混入饲料中制成颗粒饲料辐照灭菌后分别供高、中、低剂量组动物食用,连续每日一次喂养90d;对照组给予不加受试物的正常饲料。
1.4 观察指标
1.4.1一般情况
试验期间观察动物的一般情况包括外观体征和行为活动、粪便性状、食物摄入量及体重变化等。
1.4.2血常规
在实验中期和末期按常规方法测定血液学指标
1.4.3血液生化指标
试验末期检测血液生化指标
1.4.5尿常规检查
尿常规测定颜色、 pH值、比重(SG)、尿糖(GLU)、尿蛋白,将尿液离心,并对尿中沉淀物进行镜检。
1.4.6脏器病理
解剖动物,取心、肝、脾、肺、肾、胃肠、肾上腺、胸腺、脑和卵巢、睾丸等脏器,观察大体变化并称重(胃肠除外),计算脏器指数[脏器质量/体重)×100%]。
将解剖取得的脏器福尔马林固定,常规制片,HE 染色,光学显微镜进行病理组织学检查。
1.5 统计学分析
亚慢性毒性试验结果经正态性检验后,符合正态的指标采用SPSS13.0统计软件进行单因素方差分析,否则经变换后分析。
2结果
2.1 一般状况
2.2 体重变化见表2
2.3 血常规检验结果见表3
2.4 血生化检测结果见表4
2.5 尿常规检查
2.5 脏器指数见表5
2.6 病理组织学检查
表2 2,4滴原药大鼠90 d亚慢性毒性试验体质量变化情况
性别剂量
(mg/kg)
染毒周数
0 2 5 8 10 13
雌0
37
73
146
雄0
37
73
146
表3 2,4-滴钠盐原药大鼠90 d亚慢性毒性试验血液常规检验
性别剂量
(mg/kg) RBC/(×1012·
L-1)
Hb/(g·L-1)WBC/(×109·L-1)GRA/%LYM/%
雌性试验前0 37 73 146
雄性试验前0 37 73 146
雌性试验后0 37 73 146
雄性试验后0 37 73 146
表4 2,4-滴钠盐原药大鼠90 d亚慢性毒性试验血生化检测结果
性别剂量
(mg/k
g) AST/(U·L-1)ALT/(U·L-1)ALP/(U·L-1)BUN/(mmol ·L-1
)
TP/(g ·L-1)ALB/(g ·L-1)
雌0
37
73
146
雄0
37
73
146
表5 脏器指数%
性别剂量
(mg
/kg)
大脑肝脏脾脏心脏肺脏胸腺肾脏肾上腺睾丸(卵巢)
雌0
37
73
146
雄0
37
73
146
3.讨论
控制实验质量
1 大鼠毒理学实验中实验技术因素的质量控制
1. 1 动物临床观察指标的质量控制
在药品临床前大鼠毒理学实验研究过程中 , 其临床观察指标主要包括行为活动、体质量、
增质量、饲料生物利用度等,而体质量、增质量、饲料生物利用度指标均为需要统计分
析的客观指标。因其贯穿于整个实验周期 ,数据的客观性与实验环境、给药过程中动物感
受是否舒适、动物密度、动物健康状况等因素相关。在动物临床指标统计分析前控制体
系中 , 实验环境应选择 S P F级动物实验室 ;每笼 2只 ;体质量在实验前应适应环境周期
≥1周 ; 计算饲料摄入量每日应称质量 , 每周给药完毕即计算大鼠的饲料生物利用度 ,
比较分析各组动物饲料生物利用度的统计学意义 ; 分析产生差异的原因 ,讨论差异是否与
动物自发性疾病 ( 如大鼠自发性糖尿病会引起大鼠饲料生物利用度明显增大 ) 有关 , 同
时应排除营养因素或给药途径对动物的损伤因素 ; 在动物行为活动指标观察中应在每日投药过程中重点观察大鼠投药部位是否发生充血、水肿、呕血 ,是否发生动物争斗外伤、皮毛稀疏竖散、粪便性状改变等变化 ,并及时处理与药物因素无关的改变 ,并详细记录 ,认真分析。
1. 2 血液学样本的质量控制
大鼠慢性毒理学实验中血液学常规的检测项目主要有红细胞计数 ( R B C ) 、血红
蛋白定量 ( H b ) 、白细胞计数及其分类计数 ( WB C+D C ) 、血小板计数 ( P T ) 、凝血时间 ( C T ) ; 血清生物化学检测项目主要有天门冬氨酸氨基转移酶 ( A S T ) 、丙氨酸氨基转移酶 ( A L T ) 、碱性磷酸酶 ( A L P ) 、总蛋白 ( T P ) 、清蛋白 ( A L B ) 、总胆固醇 ( T -C H O ) 、总胆红素 ( T - B I L ) 、空腹血糖 ( G L U ) 、尿素氮 ( B U N ) 、肌酐 ( C r ) 。选择合适的血样采集法,不仅对动物损伤小、样本溶血率低、可重复采样等优势 ,而且使大鼠慢性毒理实验中分阶段检测药物对造血系统、生化系统的影响成为可能。
1. 3 动物病理组织标本分析前的质量控制
组织病理学检查对于判断实验动物的毒性靶器官或靶组织具有重要意义。在长期毒理学实验中有重要地位 , 是评价药物毒性的重要依据。组织病理学检查对判断动物的毒性靶器官或靶组织具有重要意义。实践中使用的组织学检测前优质标本取材流程可以为 : ①根据实验取材项目设计表格 ,需要取得脏器系数的器官或组织和其他器官或组织分别标示于一个完整的记录单元中 ; ②使用 250 m L广口瓶贮存新鲜配制的 10%甲醛溶液 180 ~200 m L 备用 ; ③对拟取材的大鼠进行解剖分组顺序编号 ; ④大鼠麻醉状态下 ,股动脉放血致死→胸腔组织 ( 胸腺、心、肺 ) →腹腔组织 ( 胃、十二指肠、空肠、回肠、盲肠、直肠、肝、脾、胰腺、肾上腺、肾、卵巢、子宫、膀胱、前列腺、睾丸、附睾 ) →颈、脑部组织 ( 甲状腺、脑、垂体、脊髓 ) 。其中胸腺、胰腺、肾上腺、卵巢、甲状腺、垂体、脊髓等腺体组织或微小组织应使用擦镜纸或纱布非挤压式包裹置于 3. 6% ~ 4. 0%甲醛。这样使浸泡于甲醛溶液中的易混淆脏器在进行石蜡包埋时容易分辨 ,同时保证病理组织学检查中组织样本数目完整 ; 其他组织除大体观察有明显病灶的组织外 ,要求动物组织样本均取自该组织的代表区。
1. 4 动物实验中的给药途径不同而引起的取材质量控制
因临床给药途径不同 , 在大鼠慢性毒理实验项目中存在不同的给药方式 , 主要给途径有主要给药途径有灌胃、直肠、舌下、腹腔注射、肌内注射、皮肤涂抹等。在毒理学研究中可能通过对直接接触药物部位的检测结果分析药物慢性刺激对直接刺激局部组织的影响 ,还可以分析药物吸收和给药技能合理与否。
2 影响大鼠毒理学实验结果的环境、动物福利、误差控制
2. 1 毒理学实验中的环境控制
在不同环境中进行动物实验的大鼠 ,对照组和药物组动物均不同程度地存在因环境所致的炎性细胞浸润或间质性肺炎等病理变化 ,这些变化与实验环境级别及日常消毒措施合理与否息息相关。样本固定前的大体解剖观察处理与组织学检查结果具有直接关系 ,取样以肉眼能观察到病灶的肺叶和表面观察正常的肺叶各取一为原则 ,在同一个受试动物肺组织中不可单一地单纯选择大体观察异常的小叶或大体观察正常的小叶样本。
2. 2 毒理学实验中的动物福利控制
动物在毒理学研究过程中,会产生紧张、疼痛、呼吸困难、痉挛、颤抖、腹泻、孔道出血、瘫痪、休克 , 甚至死亡的情况。因此 ,它们在遇到恐惧或恶劣环境时 ,生理和心理都可能患病。控制原则为实验人员投药过程时间宜短不宜长 , 抓取动物轻拿轻放 , 血清采样宜快不宜慢 ,尽量提供人为因素影响小的实验环境,要求实验研究人员具备爱护动物之心和熟练的动物实验技能并贯穿于整个实验周期。
2. 3 毒理学实验中的误差质量控制
在大鼠慢性毒理学实验中系统误差主要与样本的随机性、实验操作的一致性、流程的恒定性有关。①抽样误差 : 一般情况下 ,慢性毒性实验中每个实验组应使用相等数量的雌、雄动物。每组动物大鼠至少 20只。差异应不超过平均体质量的 20%。②系统误差。包括下列两类情况。实验技术熟练因素造成的误差 : 在毒理学实验研究中 ,为了真实反映外来化合物的毒性 ,除了要统一各种实验条件外 , 每日的给药时间应一致。一是可比性强 ,二是为了避免错误而影响其他药理实验甚至临床用药。因此 , 应将实验人员的技术熟练因素以一定的模式贯穿于各实验组中 ,在整个给药期中给药人员每天应互换给药的组别 ,同时应保证给药时间的准确性和一致性;流程造成的误差控制 : 系统误差可因分析方法、仪器校正错误、试剂纯度不够、检测者的感观、环境因素改变等因素造成 ;随机可能因动物实验过程中各种随机因素的共同作用等因素造成。如实验过程的温度波动 - 电压变化- 仪器故障 - 操作技术差别等 ; 过失误差可因工作人员不负责任( 器皿不净、加样错误、计算错误 ) 而造成。这些误差因素与实验结果判断有直接关系。在药物安全性评价中 ,系统误差与动物是否接受了足够的药物及其在动物体的代谢时间相关。比如空腹抽血与进食后抽血 ,对临床患者的 T G 、C K 、C h o 、G L U等有明显影响。因此每个实验期进行动物抽样时 ,就要求严格按照同等的禁食时间对大鼠禁食。因此要特别注意各组实验大鼠采样的随机性与均一性。
亚慢性毒性试验 2.3.9.1 目的 (1)检测消毒剂较长期染毒对实验动物的毒性作用及其靶器官,并确定其最大未观察到有害作用剂量。 (2)为慢性毒性和致癌试验的剂量设计提供依据。 2.3.9.2 实验动物 一般用啮齿类动物,首选大鼠。所用大鼠应为 4周~6 周龄者。全部试验至少需用 80 只动物。 2.3.9.3 试验分组 将实验动物随机分为4组(3个剂量组和1个对照组),每组20只动物,雌雄各半。选择受试物剂量时,高剂量组应出现明显的毒性反应,但不引起死亡,如果出现动物死亡应不超过 10%;中间剂量组应可观察到轻微的毒性效应;低剂量组应不引起任何毒性效应(属未观察到有害作用剂量)。至于具体的剂量选择,可考虑高剂量为LD50的1/20~1/5,高、中、低3个剂量间的组距以3倍~5倍为宜,最低不小于2倍。另以受试物溶剂代替受试物进行试验,作为阴性对照组。 2.3.9.4 操作程序 (1)采用灌胃方式或将受试物掺入饲料经口染毒。 (2)灌胃法每天灌胃1次,每周称体重,并按体重调整受试物给予量。如受试物掺入饲料时,应定期称饲料消耗量,计算消毒剂摄入量。
(3)试验期为3个月(90d),末次染毒后24h检测各项观察指标,然后处死实验动物,做病理学检查。 2.3.9.5 观察指标 观察指标,可因消毒剂毒理作用不同而异,一般至少包含以下方面。 (1)临床观察:观察动物中毒表现,每周称量体重1次,食物消耗量至少1次~2次。 (2)血液学检查:包括血红蛋白含量、红细胞数、白细胞及其分类计数、血小板数、网织红细胞数等。 (3)血液生物化学检查:例如天冬氨酸氨基转移酶、丙氨酸氨基转移酶、碱性磷酸酶、尿素氮、肌酐、血清总蛋白和白蛋白、总胆固醇、总胆红素等。必要时,可根据所观察到的受试物毒性效应,或与受试物化学结构相似物质的毒性作用,选择其他一些生化指标。 (4)脏器重量:测量主要脏器(如肝、肾、肾上腺、睾丸等)的脏器重量和脏器系数。 (5)病理学检查:实验结束时,处死所有动物,进行系统解剖和肉眼观察,并将主要器官和组织(如心、肺、肝、肾、脾、脑、肾上腺、睾丸、卵巢、胃肠和系统解剖时发现的异常组织等)固定、保存。当各剂量组动物尸检未发现明显病变时,先进行高剂量组和阴性对照组动物肝、肾、胃、肠及其它重要的和可能受损的脏器的组织病理学检查。如发现病变,还应对中、低剂量组动物相应的器官进行组织病理学检查。 2.3.9.6 评价规定
毒理学作业 农药2,4-滴钠盐原药为白色粉末,水溶性,表1是其对SD大鼠的急性经口试验结果,请根据表中结果,给出该农药的90天亚慢性试验的试验方案,以及如何对保证实验质量予以控制。 表1 2,4-滴钠盐原药对SD大鼠急性毒性实验结果 剂量设置高剂量为25%LD50,中剂量为12.5%, 低剂量为6.3%。 雌性LD50为584mg/kg,高剂量为146mg/kg,中剂量为73mg/kg,低剂量为37mg/kg;雄性为501mg/kg,高剂量为125mg/kg,63mg/kg,低剂量为31mg/kg。 根据GB15670《农药登记毒理学实验方法》的农药急性毒性分级标准,2,4-滴钠盐原药的LD50>500mg/kg,属于低度农药。因此试验时选择SD大鼠的LD50为584mg/kg。
农药2,4-滴钠盐原药SD大鼠亚慢性毒性试验 目的;研究喂饲农药2,4-滴钠盐原药对大鼠的亚慢性毒性。 方法:取初断乳SD大鼠80只,雌雄各半按照体重随机分为4组。将2,4-滴钠盐原药按146、73、37mg/kg mg/kg剂量分别拌入饲料经口喂饲染毒90d。 观察:大鼠外观体征、体质量、进食情况等。在实验中期和末期采血检测检测血液学。试验末期检测血生化指标以及尿常规检查。实验结束时处死实验动物,计算脏器指数,并对主要脏器进行病理组织学观察。 1 材料和方法 1.1 受试物 农药2,4-滴钠盐原药,白色粉末,水溶性,由某地某农药公司提供。SPF级初断乳大鼠80只,雌雄各半,体质量50~100 g,由XXX实验动物研究所繁育场提供,动物合格证号为医动字第XX-XXXX号。 1.2 饲养与管理 SPF 环境条件下,同组同性别两只一笼喂养,自由进食和饮水。环境温度21~25℃,相对湿度40%~60%。严格控制昼夜交替。 1.3实验方法 试验前将雌、雄大鼠各半按体重随机分为3个剂量组和1个对照组,每组20只,将2,4-滴钠盐原药按146、73、37mg/kg mg/kg剂量分别均匀混入饲料中制成颗粒饲料辐照灭菌后分别供高、中、低剂量组动物食用,连续每日一次喂养90d;对照组给予不加受试物的正常饲料。 1.4 观察指标 1.4.1一般情况 试验期间观察动物的一般情况包括外观体征和行为活动、粪便性状、食物摄入量及体重变化等。 1.4.2血常规 在实验中期和末期按常规方法测定血液学指标 1.4.3血液生化指标 试验末期检测血液生化指标 1.4.5尿常规检查 尿常规测定颜色、pH值、比重(SG)、尿糖(GLU)、尿蛋白,将尿液离心,并对尿中沉淀物进行镜检。 1.4.6脏器病理 解剖动物,取心、肝、脾、肺、肾、胃肠、肾上腺、胸腺、脑和卵巢、睾丸等脏器,观察大体变化并称重(胃肠除外),计算脏器指数[脏器质量/体重)×100%]。 将解剖取得的脏器福尔马林固定,常规制片,HE 染色,光学显微镜进行病理组织学检查。
第三节慢性毒性作用及其试验方法 一、概念和试验目的 (一) 慢性毒性概念 慢性毒性是指以低剂量外来化合物长期给予实验动物接触,观察其对实验动物所产生的毒性效应。 (二) 试验目的 慢性毒性试验是确定外来化合物的毒性下限,即长期接触该化合物可以引起机体危害的阈剂量和无作用剂量。为进行该化合物的危险性评价与制定人接触该化合物的安全限量标准提供毒理学依据,如最高容许浓度和每日容许摄入量等。 二、慢性毒性试验设计 (一)慢性毒性试验期限 一般认为工业毒理学慢性试验动物染毒6个月或更长时间;而环境毒理学与食品毒理学则要求实验动物染毒1年以上或2年。也有学者主张动物终生接触外来化合物才能全面反映外来化合物的慢性毒性效应,以及求出阈剂量或无作用剂量。 但是,也有学者认为大鼠为进行慢性毒性试验动物,接触受试化合物1年以上不一定必要。多次经验证明延长接触1年以上,大鼠也不再出现新的毒性效应(致癌试验除外)。例如有报道在122种化合物中,大鼠连续接触3个月之后才出现毒性效应的只有3种(占2.46%),其它化合物均在3个月内已出现毒性效应。因此认为以大鼠为试验对象时连续接触外来化合物90天,即可确定受试化合物的长期无作用水平。但是,这种观点还存有争论。因此在食品及环境毒理学中进行慢性毒性试验,接触外来化合物的时间仍以2年为好。 (二)实验动物与饲养环境 1、实验动物 慢性毒性试验选择实验动物的条件与亚慢性毒性试验相同。但实验动物最好为纯系甚至同窝动物均匀分布于各剂量组。 实验动物年龄应较小,大鼠和小鼠应为初断奶者,即小鼠出生后3周,体重 10~12g;大鼠出生后3~4周,体重50~70g。性别要雌雄各半。 2、动物饲养环境
急性毒性试验 (-)经典的急性致死性毒性试验 通过试验得到化合物引起动物死亡的剂量一反应关系并求得LD50 ( LC50) 1、实验动物 常用的实验动物是小鼠或大鼠。一般受试动物应是雌、雄各半;若雌、雄动物对待测化学物毒性的敏感程度有明差异,则应分别求出各自的LD50;如果试验是为畸形试验做剂量准备,也可仅做雌性动物的LD50试验。小动物每组10只,狗等大动物可每组6只。 2、染毒剂量设计 首先要了解化学毒物的结构式、分子量、常温常压下的状态、纯度、杂质成分与含量、溶解度、挥发度、PH等理化性质。对于新的受试化学物,找出与受试化学毒物结构与理化性质近似的化学物的毒性资料,并以文献资料中相同的动物种系和相同接触途径所测得的LD50(LC50)值作为受试化学物的预期毒性中值,先用少量动物,以较大的剂量间隔(一般按几何级数)染毒,找出找出10%、90% (或0%~100%)的致死剂量范围,然后在这个剂量范围内设几个剂量组。改良寇氏法最好设5个剂量组,每组10只动物,雌雄各半,剂量组要求以等比级数设置。根据以下公式计算出剂量分组: i=(lgLD90-lgLD10) / (n-1)或:i=(lgLD100-lgLD0)/ (n-1) 式中i为组距(相邻的两个剂量组对数剂量之差); n为设计的剂量组数。 有的毒性较小,此时可不再求其LD50,而应进行限量试验。在用大鼠或小鼠进行试验时,一般用20只动物,雌雄各半。单次染毒剂量一般限定为5g/kg (体重),对于食品毒理学试验,限量要求为15g/kg (体重)。如果实验动物无死亡或仅有个别动物死亡(死亡率低于50%), 则可得出LD50大于限量的结论。 3、观察 染毒后一般要求观察14天,依据14天内动物的总死亡情况计算LD50o在实际工作中,依据受试物有关测试规程要求确定观察期的长短。 观察内容包括: (1)动物死亡情况:包括动物死亡数及各自的死亡时间。 (2)动物体重:于染毒前、染毒后每周和死亡时测定体重。 (3)中毒反应症状:临床观察每天至少一次,观察皮肤、被毛、眼睛和粘膜改变,呼吸、 循环、自主和中枢神经系统以及四肢活动和行为方式的变化等,特别要注意有无震颤、 惊厥、腹泻、嗜睡等现象。神经毒性:惊厥、共济失调和死亡。植物神经兴奋:腹泻或 竖毛。 (4)病理学检查:解剖进行尸检,观察各器官有无改变,对肉眼观察有变化的脏器需进 行组织病理学检查。 4、LD50计算 (1)霍恩氏法 (2)简化寇氏法 M=X - i (S p - 0. 5) 式中:m―logLD50, X—最高剂量组剂量对数值,
?综述? 慢性毒性试验最新研究进展△ 黎运西1,2,金小宝2,曾爱华2,苏小茹3,朱家勇2 (11佛山市顺德第一人民医院检验科,广东佛山528300;21广东药学院基础学院病原生物研究所,广东广州510006; 31广州中医药大学实验动物中心,广东广州510006) 摘要:为了优化慢性毒性试验的研究方法与方案,更好地评价临床新药安全性,提高慢性毒性试验结果与临床试验的符合率,本文就实验模型动物的选择、检测方法、结果评价等方面的最新研究进展以及应该注意的问题进行综述,以总结如何提高实验可靠性和效率的方法与方案,使慢性毒性试验的研究结果更加符合药物的临床试验结果。 关键词:慢性毒性试验;药物研究;临床前研究学科分类代码:350 中图分类号:R96512 文献标识码:A 文章编号:1004-5775(2009)08-0583-04 △基金项目:广东省产业技术研究与开发项目, 2008B080703065 作者简介:黎运西,男,汉族,副主任检验师,病原 生物学硕士研究生。 The Latest Advancement of Chronic Toxicity Tests LI Y un -xi ,J I N X iao -bao ,ZE NG Ai -hua ,et al 1 (Department of Clinical L aboratory ,The First People ’s Hospital of S hunde of Fushan City ,Fushan 528300,China )Abstract :This paper reviews the chronic toxicity tests in viv o and provides several Approaches to im proving concordance between animal toxicity test and clinical trial to av oid the error 1F or exam ple ,the animals should be reas onablely chosen in toxicological study 1M oreover ,the suitable methods and techniques for animal toxicity tests were als o should be cho 2sen 1At last ,the results of animal toxicity tests should be correctly avaluated 1Through these m othods ,the accordance between the chronic tests and clinical trials could be maintained 1K ey w ords :Chronic toxicity test ;Drug study ;Preclinical study 慢性毒性试验等体内毒性试验已经被广泛应用于新药开发领域,但还存在很多问题,如动物的浪费严重、动物模型之间的差异;一些毒理学试验方法的不完善之处;在毒理学结果的安全性评价中,分不清有害效应和非有害效应;由于动物与人类的基因差异性所致的对毒性反应的差异而造成的错误评价等。这些问题影响了动物毒性试验的准确率与效率。因此,必须应用一系列的技术去克服这些问题。本文综述了慢性毒性试验的一些方法,并提出如何应用新技术提高慢性毒性试验的准确率与效率,使其更加符合临床试验的结果并提高动物的利用率。 首先,是在慢性毒性试验中选择合适类型和数量的动物;其次,是选择合适的检测方法及技巧;最后,对毒理学动物实验结果进行合理而科学的综合性安全评价。通过这些方法,提高慢性毒性试验的可靠性与效率。1 实验动物类型及其数量的确定更加严格111 动物数量的确定 随着欧盟号召取消短期的动物体内毒性试验,为了更符合人道主义和减少动物浪费,应尽更大的 努力去减少实验动物的数量〔1〕 。但要用体外试验取代动物毒性试验,目前尚未成熟。本文认为,发展完善地取代动物试验的毒理学试验技术,才是根本的出路。而弄清毒性作用的靶点的细胞或分子机制,才能做到有的放矢。但目前还要用有限的动物试验去证实体外试验的可行性。当前,可以改进的是在许可的情况下减少动物使用数量。例如,借 鉴急性毒性试验的方法〔2〕 ,先用1个剂量受试物去试,再根据这个剂量的结果增或减剂量做其它剂量组。因为这样可减少动物方面的研究开支。112 选择符合实验要求的遗传背景一致的动物 由于对化合物的耐受性不同,因而从相同剂量耐受性分析可以显示不同的个体对化合物的敏感 性不同〔3〕 。另外,测试动物基因型会影响代谢、生物利用率和靶器官的敏感性;株或表型则会决定免
急性慢性和亚慢性毒性实 验 The Standardization Office was revised on the afternoon of December 13, 2020
急性毒性试验 (一)经典的急性致死性毒性试验 通过试验得到化合物引起动物死亡的剂量—反应关系并求得LD50(LC50) 1、实验动物 常用的实验动物是小鼠或大鼠。一般受试动物应是雌、雄各半;若雌、雄动物对待测化学物毒性的敏感程度有明差异,则应分别求出各自的LD50;如果试验是为畸形试验做剂量准备,也可仅做雌性动物的LD50试验。小动物每组10只,狗等大动物可每组6只。 2、染毒剂量设计 首先要了解化学毒物的结构式、分子量、常温常压下的状态、纯度、杂质成分与含量、溶解度、挥发度、PH等理化性质。对于新的受试化学物,找出与受试化学毒物结构与理化性质近似的化学物的毒性资料,并以文献资料中相同的动物种系和相同接触途径所测得的LD50(LC50)值作为受试化学物的预期毒性中值,先用少量动物,以较大的剂量间隔(一般按几何级数)染毒,找出找出10%~90%(或0%~100%)的致死剂量范围,然后在这个剂量范围内设几个剂量组。改良寇氏法最好设5个剂量组,每组10只动物,雌雄各半,剂量组要求以等比级数设置。根据以下公式计算出剂量分组: i=(lgLD90-lgLD10)/(n-1) 或:i=(lgLD100-lgLD0)/(n-1) 式中i为组距(相邻的两个剂量组对数剂量之差); n为设计的剂量组数。 有的毒性较小,此时可不再求其LD50,而应进行限量试验。在用大鼠或小鼠进行试验时,一般用20只动物,雌雄各半。单次染毒剂量一般限定为5g/kg(体
实验室最危险的17种物质慢性毒性,最易忽视~身体是革命的本钱呐!!!!!!!!!!!!!! 分享分享是一种美德关闭 各位兄弟姐妹们务必小心 1.DMSO: DMSO是二甲基亚砜,用途广泛。用作乙炔、芳烃、二氧化硫及其他气体的溶剂以及腈纶纤维纺丝溶剂。是一种即溶于水又溶于有机溶剂的极为重要的非质子极性溶剂。对皮肤有极强的渗透性,有助于药物向人体渗透。也可作为农药的添加剂。也是一种十分重要的化学试剂。 DMSO也是一种渗透性保护剂,能够降低细胞冰点,减少冰晶的形成,减轻自由基对细胞损害,改变生物膜对电解质、药物、毒物和代谢产物的通透性。 但是研究表明,DMSO存在严重的毒性作用,与蛋白质疏水集团发生作用,导致蛋白质变性,具有血管毒性和肝肾毒性。 DMSO是毒性比较强的东西,用的时候要避免其挥发,要准备1%-5%的氨水备用,皮肤沾上之后要用大量的水洗以及稀氨水洗涤. 最为常见的为恶心、呕吐、皮疹及在皮肤、和呼出的气体中发出大蒜、洋葱、牡蛎味。 吸入:高挥发浓度可能导致头痛,晕眩和镇静。 皮肤:能够灼伤皮肤并使皮肤有刺痛感,如同所见的皮疹及水泡一样。若二甲基亚砜与含水的皮肤接触会产生热反应。要避免接触含有毒性原料或物质的二甲基亚砜溶液,因其毒性不为人所知,而二甲基亚砜却可能会渗入肌肤,在一定条件下会将有毒物质代入肌肤。 吸收:吸收危险性很低。 2.EB:EB(Ethidium bromide,溴化乙锭) 溴化乙锭是一种高度灵敏的荧光染色剂,用于观察琼脂糖和聚丙烯酰胺凝胶中的DNA。溴化乙锭用标准302nm 紫外光透射仪激发并放射出橙红色信号,观察琼脂糖凝胶中DNA最常用的方法是利用荧光染料溴化乙锭进行染色,溴化乙锭含有一个可以嵌入DNA堆积碱基之间的一个三环平面基团。它与DNA的结合几乎没有碱基序列特异性。在高离子强度的饱和溶液中,大约每2.5个碱基插入一个溴化乙锭分子。当染料分子插入后,其平面基团与螺旋的轴线垂直并通过范德华力与上下碱基相互作用。这个基团的固定位置及其与碱基的密切接近,导致与DNA结合的染料呈现荧光,其荧光产率比游离溶液中染料有所增加。DNA吸收254nm处的紫外辐射并传递给染料,而被结合的染料本身吸收302nm和366nm的光辐射。这两种情况下,被吸收的能量在可见光谱红橙区的590nm处重新发射出来。由于溴化乙锭-DNA复合物的荧光产率比没有结合DNA的染料高出20-30倍,所以当凝胶中含有游离的溴化乙锭(0.5ug/ml)时,可以检测到少至10ng的NDA条带。溴化乙锭可以嵌入碱基分子中,导致错配。溴化乙锭是强诱变剂,具有高致癌性!会在60-70度是蒸发(所以最好不要在胶太热的时候加,或者
硫酸铜亚慢性经口毒性实验设计 一、实验目的 通过该实验不仅可获得一定时期内反复接触受试物后引起的健康效应、受试物作用靶器官和受试物体内蓄积能力资料,并可估计接触的无有害作用水平,后者可用于选择和确定慢性实验的接触水平和初步计算人群接触的安全性水平。 二、实验原理 1.亚慢性毒性实验:是指在实验动物部分生存期内,每日反复经口接触受试物后所引起的不良反应。 2.无有害作用水平(No-adverse-effect level):是指在实验中不引起任何有害作用的最大染毒剂量,可用每日单位动物体重接触受试物的重量(mg/kg)表示。 三、实验仪器及试剂 实验试剂:3%-5%苦味酸、0.5%酸性品红、蒸馏水、无水硫酸铜、水、动物饲料 实验动物:健康、6-8周大鼠(80只) 实验仪器:灌胃针(16号)、电子天平、动物体重秤、饲养室、烧杯、容量瓶、吸量管、吸耳球、胶头滴管、手术剪、托盘、镊子、药匙等 四、实验步骤 1. 实验动物的选择:选择80只6-8周,体重在50-100g的健康大鼠,大鼠体重相差不超过10%(±5-10g)。 2. 实验管理:实验前动物先适应环境和饲料5天。适应期间和实验期间雌雄分笼饲养,所有动物通过灌胃的方式进行染毒,每周染毒7天,连续染毒90天。 3. 实验条件:饲养室温度控制在22±4℃,相对湿度在40%-70%之间,无对流风,昼夜各半。实验期间正常饲料喂养,饮水不限。 4. 实验动物染色和分组 1)抓取大鼠:抓取大鼠前最好戴上防护手套。进行染色时,可采取左手固定法,只是用拇指和食指捏住鼠耳,余下三指紧捏大鼠背部皮肤,这样便可进行各种简单的实验操作;也可以用左手食指和中指放在颈背部的两侧,拇指和无名指放在胸前,分别用手指夹住左右前肢抓起来。 Tips:辨认大鼠的雌雄:观察生殖器与肛之问的距离,雌性较雄性近具沟;观察生殖突起,雄性较大、较圆,雌性较小具裂缝;仰卧观察乳头,雄性不明显,雌性明显。 2)染色编号:用黄色3%-5%苦味酸0.5%酸性品红对动物进行染色标记,黄色和红色分别代表个位和十位。大鼠分为左、中、右三区,左上区、左中部和左下肢分别表示1、2、3或者10、20、30,如图1。
兽药慢性毒性和致癌试验指导原则 一、概述 (一)定义与目的 慢性毒性和致癌试验是预测药物在临床应用中诱发癌症危险性的评价方法。在动物的大部分生命期间,经过反复给予受试药物后观察其呈现的慢性毒性作用及其剂量-反应关系,尤其是进行性和不可逆毒性作用及肿瘤疾患。确定受试药物的无作用剂量(NOEL),作为最终评定受试药物能否应用于动物尤其是食品动物的依据。 为了确保慢性毒性和致癌试验结果的真实性、可靠性和可追溯性,根据新兽药研究的规律,结合国内兽药毒理学评价的实际情况制定了本指导原则。(二)适用范围 本指导原则适用于评价兽用化学药品、中兽药、消毒剂及饲料药物添加剂对动物的慢性毒性和/或致癌性的测定。 长期毒性试验发现有可疑肿瘤发生,某些器官组织细胞异常、药物结果与已知致癌物有关或代谢物与已知致癌物有关、作用机制为细胞毒类等情况下,要求进行致癌试验。 二、试验设计 (一)材料与方法 1.实验动物 (1)实验动物种类选择 一般要求选用两个种属的实验动物,即啮齿类和非啮齿类,目前已掌握大白鼠和小白鼠各品系的特点及诱发肿瘤的敏感性,故可优先将其用于慢性毒性和致癌试验。对活性不明的受试药物,则应选用两种性别的啮齿类和非啮齿类动物。 (2)动物的起始周龄和体重
慢性毒性试验期长,故一般用刚断乳的大鼠或小鼠。大鼠50~70g(出生3~4周),小鼠10~15g(出生3周)。动物个体体重的变动范围不超出各性别平均体重的20%。 (3)动物的性别和数量 每个剂量组的动物数应满足试验结束时进行统计学处理的要求,如大鼠40~60只(小鼠数应据此适当增加),一般雌雄各半,雌鼠应为非经产鼠、非孕鼠。如果将慢性毒性试验与致癌试验结合进行,每组雌雄动物数均应在50只以上。如计划在试验过程中定期剖杀动物,则动物数应相应增加。 (4)肿瘤自发率 实验动物的自然肿瘤发生率原则是控制到越低越好,但试验结果评价时主要是以在相同条件下观察对照组与各剂量组的肿瘤发生率及其剂量-反应关系作为判定依据。 2.受试药物 应与其他做非临床和临床试验的兽药为同批次产品。 3.仪器设备 一般生理生化和剖检仪器。 (二)试验步骤 1.剂量组设计 设3~5剂量组和一个对照组。高剂量组根据90天喂养试验确定,一般应引起一些毒性表现或损害作用,但不引起太多动物死亡;低剂量组不引起任何毒性作用;在高剂量和低剂量之间再设1~3剂量组,剂量可按几何级数或其他规律划分。对照组除了不给予受试药物外,其他各方面都应与试验组相同。如果受试药物使用了某种毒性不明的介质,则应同时设未处理对照和介质对照。 2.给药方法 经口给药,可加入饲料、饮水中或灌胃。如果受试药物是灌胃给药,应每周称体重两次,根据体重计算给予受试药物的量。 3.受试药物的配制及存放 (1)一般用蒸馏水作溶剂,如受试药物不溶于水,可用食用植物油、医用淀粉、羧甲基纤维素等配成乳浊液或悬浊液。受试药物应于灌胃前新鲜配制,除非有资料表明以溶液(或乳浊液、悬浊液)保存具有稳定性。同时应考虑使用的
急性毒性试验 (一)经典的急性致死性毒性试验 通过试验得到化合物引起动物死亡的剂量一反应关系并求得LD50 ( LC50) 1、实验动物 常用的实验动物是小鼠或大鼠。一般受试动物应是雌、雄各半;若雌、雄动物对待测化学物 毒性的敏感程度有明差异,则应分别求出各自的LD50;如果试验是为畸形试验做剂量准备, 也可仅做雌性动物的LD50试验。小动物每组10只,狗等大动物可每组6只。 2、染毒剂量设计 首先要了解化学毒物的结构式、分子量、常温常压下的状态、纯度、杂质成分与含量、溶解 度、挥发度、PH等理化性质。对于新的受试化学物,找出与受试化学毒物结构与理化性质 近似的化学物的毒性资料,并以文献资料中相同的动物种系和相同接触途径所测得的 LD50(LC50)值作为受试化学物的预期毒性中值,先用少量动物,以较大的剂量间隔(一般按 几何级数)染毒,找出找出10%~90%(或0% ~100%)的致死剂量范围,然后在这个剂量范 围内设几个剂量组。改良寇氏法最好设5个剂量组,每组10只动物,雌雄各半,剂量组要 求以等比级数设置。根据以下公式计算出剂量分组: i=(lgLD90-lgLD10) / (n-1) 或:i=(lgLD100-lgLD0) / (n-1) 式中i为组距(相邻的两个剂量组对数剂量之差); n 为设计的剂量组数。 有的毒性较小,此时可不再求其LD50,而应进行限量试验。在用大鼠或小鼠进行试验时, 一般用20只动物,雌雄各半。单次染毒剂量一般限定为5g/kg (体重),对于食品毒理学试验,限量要求为15g/kg (体重)。如果实验动物无死亡或仅有个别动物死亡(死亡率低于50%), 则可得出LD50大于限量的结论。 3、观察 染毒后一般要求观察14天,依据14天内动物的总死亡情况计算LD50。在实际工作中,依据受试物有关测试规程要求确定观察期的长短。 观察内容包括: (1)动物死亡情况:包括动物死亡数及各自的死亡时间。 (2)动物体重:于染毒前、染毒后每周和死亡时测定体重。 (3)中毒反应症状:临床观察每天至少一次,观察皮肤、被毛、眼睛和粘膜改变,呼吸、循环、 自主和中枢神经系统以及四肢活动和行为方式的变化等,特别要注意有无震颤、惊厥、腹 泻、嗜睡等现象。神经毒性:惊厥、共济失调和死亡。植物神经兴奋:腹泻或竖毛。 (4)病理学检查:解剖进行尸检,观察各器官有无改变,对肉眼观察有变化的脏器需进 行组织病理学检查。 4、LD50计算 (1)霍恩氏法 (2)简化寇氏法 M = X - i(工p - 0.5) 式中:m —log LD50, X —最高剂量组剂量对数值, p —死亡率(用小数表示), 工p—死亡率总和, i —相邻两组剂量对数之差。
亚慢性毒性作用及其试验方法 一、概念和试验目的 (一)概念 亚慢性毒性是指实验动物连续多日接触较大剂量的外来化合物所出现的中毒效应。所谓较大剂量,是指小于急性LD50的剂量。 (二)试验目的 亚慢性毒性试验的目的,主要是探讨亚慢性毒性的阈剂量或阈浓度和在亚慢性试验期间未观察到毒效应的剂量水平,且为慢性试验寻找接触剂量及观察指标。 二、亚慢性毒性试验设计 (一)亚慢性试验期限 亚慢性毒性试验的期限“多日”的确切天数,至今尚无完全统一的认识。一般认为在环境毒理学与食品毒理学中所要求的连续接触为3~6个月,而在工业毒理学中认为1~3月即可。这是考虑到人类接触大气、水和食品污染物的持续时间一般较久,而在工业生产过程中接触化合物仅限于人一生中的工作年龄阶段,且每日工作不超过8小时之故。 现有学者主张进行实验动物90天喂饲试验为亚慢性毒性试验,即将受试物混合物饲料或饮水中,动物自然摄取连续90天。这是由于有研究报道认为动物连续接触外来化合物3个月,其毒性效应往往与再延长接触时间所表现的毒性效应基本相同,故不必再延长接触期限。相应地主张呼吸道接触可进行30天或90天试验,每天6小时,每周5天。经皮肤试验进行30天。 (二)实验动物和染毒途径 1、实验动物的选择 亚慢性毒性作用研究一般要求选拔两种实验动物,一种为啮齿类,另一种为非啮齿类,如大鼠和狗,以便全面了解受试物的毒性阿特征。
由于亚慢性毒性试验期较长,所以选择被动物的体重(年龄)应较小,如小鼠应为15g左右,大鼠100g左右。 2、染毒途径 亚慢性毒性试验接触外来化合物途径的选择,应考虑两点: 一是尽量模拟人类在环境中接触该化合物的途径或方式,二是应与预期进行慢性毒性试验的接触途径相一致。具体接触途径主要有经口、经呼吸道和经皮肤三种。 (三)剂量选择与剂量分组 亚慢性试验的上限剂量,需控制在实验动物接触受试化合物的整个过程中,不发生死亡或仅有个别动物死亡,但有明显的中毒效应,或靶器官出现典型的损伤。 此剂量的确定可参考两个数值,一是以急性毒性的阈剂量为亚慢性试验的最高剂量;一是以此化合物LD50的为最高剂量。 化合物亚慢性毒性试验应求出其剂量-反应关系,只有求出剂量-反应关系才能阐明受试化合物的亚慢性毒作用特征,并为慢性毒性试验打下基础。为此,亚慢性试验至少应设计三个染毒剂量组及一个正常动物对照组,必要时再加一个受试化合物的溶剂对照组。最低剂量组的剂量应相当于亚慢性的阈剂量水平或未观察到作用水平,中间剂量组动物以出现轻微中毒效应为度。组内动物个体体重相差应不超过平均体重的10%,组间平均体重相差不超过5%。小动物每组不应少于20只,大动物不少于6~8只。 (四)观察指标 1、一般性指标 1).一般综合性观察指标这类指标是非特异性观察指标,它是外来化合物对机体毒性作用的综合性总体反映。 ①动物体重实验动物在亚慢性方式接触外来化合物过程中,有多种因素均可影响动物体重的增长,包括食欲变化、消化功能变化、代谢和能量消耗变化
2.亚慢性毒性试验设计 概念 亚慢性毒性是指实验动物连续多日接触较大剂量的外来化合物所出现的中毒效应。所谓较大剂量,是指小于急性LD50的剂量。 试验目的 亚慢性毒性试验的目的,主要是探讨亚慢性毒性的阈剂量或阈浓度和在亚慢性试验期间未观察到毒效应的剂量水平,且为慢性试验寻找接触剂量及观察指标。 亚慢性试验期限 亚慢性毒性试验的期限“多日”的确切天数,至今尚无完全统一的认识。一般认为在环境毒理学与食品毒理学中所要求的连续接触为3~6个月,而在工业毒理学中认为1~3月即可。这是考虑到人类接触大气、水和食品污染物的持续时间一般较久,而在工业生产过程中接触化合物仅限于人一生中的工作年龄阶段,且每日工作不超过8小时之故。 现有学者主张进行实验动物90天喂饲试验为亚慢性毒性试验,即将受试物混合物饲料或饮水中,动物自然摄取连续90天。这是由于有研究报道认为动物连续接触外来化合物3个月,其毒性效应往往与再延长接触时间所表现的毒性效应基本相同,故不必再延长接触期限。相应地主张呼吸道接触可进行30天或90天试验,每天6小时,每周5天。经皮肤试验进行30天。 实验动物和染毒途径 1、实验动物的选择 亚慢性毒性作用研究一般要求选拔两种实验动物,一种为啮齿类,另一种为非啮齿类,如大鼠和狗,以便全面了解受试物的毒性特征。 由于亚慢性毒性试验期较长,所以选择被动物的体重(年龄)应较小,如小鼠应为15g左右,大鼠100g左右。 2、染毒途径 亚慢性毒性试验接触外来化合物途径的选择,应考虑两点:一是尽量模拟人类在环境中接触该化合物的途径或方式,二是应与预期进行慢性毒性试验的接触途径相一致。具体接触途径主要有经口、经呼吸道和经皮肤三种。
急性毒性试验(一)经典的急性致死性毒性试验通过试验得到化合物引起动物死亡的剂量—反应关系并求得LD50( LC50) 1、实验动物常用的实验动物是小鼠或大鼠。一般受试动物应是雌、雄各半;若雌、雄动物对待测化学物毒性的敏感程度有明差异,则应分别求出各自的LD50;如果试验是为畸形试验做剂量准备, 也可仅做雌性动物的 LD50 试验。小动物每组 10 只,狗等大动物可每组 6 只。 2、染毒剂量设计首先要了解化学毒物的结构式、分子量、常温常压下的状态、纯度、杂质成分与含量、溶解度、挥发度、PH 等理化性质。对于新的受试化学物,找出与受试化学毒物结构与理化性质近似的化学物的毒性资料,并以文献资料中相同的动物种系和相同接触途径所测得的 LD50(LC50)值作为受试化学物的预期毒性中值,先用少量动物,以较大的剂量间隔(一般按 几何级数)染毒,找出找出10%~90%(或 0%~100%)的致死剂量范围,然后在这个剂量范 围内设几个剂量组。改良寇氏法最好设 5 个剂量组,每组 10 只动物,雌雄各半,剂量组要求以等比级数设置。根据以下公式计算出剂量分组: i=(lgLD90-lgLD10)/(n-1)或: i=(lgLD100-lgLD0)/(n-1)式中 i 为组距(相邻的两个剂量组对数剂量之差); n 为设计的剂量组数。 有的毒性较小,此时可不再求其LD50,而应进行限量试验。在用大鼠或小鼠进行试验时, 一般用 20只动物,雌雄各半。单次染毒剂量一般限定为5g/kg (体重),对于食品毒理学试验,限量要求为15g/kg(体重)。如果实验动物无死亡或仅有个别动物死亡(死亡率低于50%),则可得出LD50大于限量的结论。 3、观察 染毒后一般要求观察 14天,依据14天内动物的总死亡情况计算LD50。在实际工作中,依 据受试物有关测试规程要求确定观察期的长短。 观察内容包括: (1)动物死亡情况:包括动物死亡数及各自的死亡时间。 ( 2)动物体重:于染毒前、染毒后每周和死亡时测定体重。 (3)中毒反应症状:临床观察每天至少一次,观察皮肤、被毛、眼睛和粘膜改变,呼吸、循环、自主和中枢神经系统以及四肢活动和行为方式的变化等,特别要注意有无震颤、惊厥、腹泻、嗜睡等现象。神经毒性:惊厥、共济失调和死亡。植物神经兴奋:腹泻或竖毛。 (4)病理学检查:解剖进行尸检,观察各器官有无改变,对肉眼观察有变化的脏器需进行组织病理学检查。 4、LD50计算 ( 1 )霍恩氏法( 2)简化寇氏法 M = X - i(工 p - 0.5) 式中 : m — log LD50, X —最高剂量组剂量对数值 , p —死亡率(用小数表示), 工p—死亡率总和, i —相邻两组剂量对数之差。 ( 3 )直接回归法: 死亡频率呈正态分布,则变化曲线为典型的“钟罩”型;死亡频率化为累积死亡频率,反应曲线呈S 形;累积死亡频率化为概率单位时,反应曲线呈直线。 (二)急性毒性试验的其他方法 1. 固定计量法
第六章一般毒性作用及其试验与评价方法 一般毒性作用:是指毒物对动物机体产生的综合毒性效应,也称基本毒性作用根据接触毒物的时间长短可将产生的毒性作用分为急性毒性、亚慢性毒性和慢性毒性。 第一节急性毒性作用及其试验与评价方法 一、急性毒性试验的概念 急性毒性试验是指动物机体一次或24h内多次接触受试物后在短期内所产牛的毒性效应及反应。 观察内容一般包括行为变化、外观改变以及致死效应。 观察时间一般为7d,观察范围可为7~28d(迟发毒性效应)。 凡经口或经注射给毒,“一次”的含义是指瞬间将受试物输入试验动物体内;若经呼吸或皮肤给毒,“一次”则指在一个特定的时间内,使试验动物持续接受受试物的过程。 “24h内多次接触受试物”的概念是指当受试物毒性很低,一次接触还不能达到充分了解该受试物的毒性作用,或一次不能导入设计剂量的受试物时,需在24h内分次染毒。二、急性毒性试验的目的 (1)测定和计算出受试物的致死量及其他急性毒试参数,主要获得受试物对某种实验动物以某种接触途径的LD50值; (2)了解受试物对动物机体的急性毒性特征,靶器官和剂量一反应关系; (3)研究受试物在动物体内的动力学变化规律; (4)为下一步的亚慢性、慢性毒性试验及其他毒理学试验的剂量设计和观察指标选择提供依据。 三、急性毒性试验方法 1.实验动物的选择和要求 (1)品种、品系的选择 实验动物选择的原则是以哺乳动物为主,选择两种或两种以上的动物,包括啮齿类(rodentspecies)和非啮齿类(nonrodenl species),其中至少有一种非啮齿类动物。啮齿类多选用小鼠和大鼠,非啮齿类常选用犬或猴。 (2)性别和年龄或体重的要求 对于实验动物的性别一般要求雌雄(早6)各半。如果试验仅为某些特殊试验研究目标,也可选用单一性别。如致畸试验可仅选雌性动物,对精子毒性试验可仅选雄性动物。 急性毒性试验通常要求刚成年的动物。 一般按体重选购,通常要求小鼠18~25g、大鼠180~240g、豚鼠.200~250g、家兔2~2.5kg、猫1.5~2kg、犬4~6kg(犬一般为1岁左右)。 同次试验小鼠体重相差不超过4g、大鼠体重相差不超过10g。一般来说,同一批次实验
第三节慢性毒性作用及其试验方法一、概念和试验目的 (一) 慢性毒性概念 慢性毒性是指以低剂量外来化合物长期给予实验动物接触,观察其对实验动物所产生的毒性效应。 (二) 试验目的 慢性毒性试验是确定外来化合物的毒性下限,即长期接触该化合物可以引起机体危害的阈剂量和无作用剂量。为进行该化合物的危险性评价与制定人接触该化合物的安全限量标准提供毒理学依据,如最高容许浓度和每日容许摄入量等。二、慢性毒性试验设计 (一)慢性毒性试验期限 一般认为工业毒理学慢性试验动物染毒6个月或更长时间;而环境毒理学与食品毒理学则要求实验动物染毒1年以上或2年。也有学者主张动物终生接触外来化合物才能全面反映外来化合物的慢性毒性效应,以及求出阈剂量或无作用剂量。
但是,也有学者认为大鼠为进行慢性毒性试验动物,接触受试化合物1年以上不一定必要。多次经验证明延长接触1年以上,大鼠也不再出现新的毒性效应(致癌试验除外)。例如有报道在122种化合物中,大鼠连续接触3个月之后才出现毒性效应的只有3种(占2.46%),其它化合物均在3个月内已出现毒性效应。因此认为以大鼠为试验对象时连续接触外来化合物90天,即可确定受试化合物的长期无作用水平。但是,这种观点还存有争论。因此在食品及环境毒理学中进行慢性毒性试验,接触外来化合物的时间仍以2年为好。 (二)实验动物与饲养环境 1、实验动物 慢性毒性试验选择实验动物的条件与亚慢性毒性试验相同。但实验动物最好为纯系甚至同窝动物均匀分布于各剂量组。 实验动物年龄应较小,大鼠和小鼠应为初断奶者,即小鼠出生后3周,体重 10~12g;大鼠出生后3~4周,体重50~70g。性别要雌雄各半。 2、动物饲养环境 慢性毒性试验实验动物的饲养条件和饲养环境与亚慢性毒性试验相同。(三)接触途径
急性毒性试验 (一)经典的急性致死性毒性试验 通过试验得到化合物引起动物死亡的剂量—反应关系并求得LD50(LC50) 1、实验动物 常用的实验动物是小鼠或大鼠。一般受试动物应是雌、雄各半;若雌、雄动物对待测化学物毒性的敏感程度有明差异,则应分别求出各自的LD50;如果试验是为畸形试验做剂量准备,也可仅做雌性动物的LD50试验。小动物每组10只,狗等大动物可每组6只。 2、染毒剂量设计 首先要了解化学毒物的结构式、分子量、常温常压下的状态、纯度、杂质成分与含量、溶解度、挥发度、PH等理化性质。对于新的受试化学物,找出与受试化学毒物结构与理化性质近似的化学物的毒性资料,并以文献资料中相同的动物种系和相同接触途径所测得的LD50(LC50)值作为受试化学物的预期毒性中值,先用少量动物,以较大的剂量间隔(一般按几何级数)染毒,找出找出10%~90%(或0%~100%)的致死剂量范围,然后在这个剂量范围内设几个剂量组。改良寇氏法最好设5个剂量组,每组10只动物,雌雄各半,剂量组要求以等比级数设置。根据以下公式计算出剂量分组: i=(lgLD90-lgLD10)/(n-1) 或:i=(lgLD100-lgLD0)/(n-1) 式中i为组距(相邻的两个剂量组对数剂量之差); n为设计的剂量组数。 有的毒性较小,此时可不再求其LD50,而应进行限量试验。在用大鼠或小鼠进行试验时,一般用20只动物,雌雄各半。单次染毒剂量一般限定为5g/kg(体重),对于食品毒理学试验,限量要求为15g/kg(体重)。如果实验动物无死亡或仅有个别动物死亡(死亡率低于50%),则可得出LD50大于限量的结论。 3、观察 染毒后一般要求观察14天,依据14天内动物的总死亡情况计算LD50。在实际工作中,依据受试物有关测试规程要求确定观察期的长短。 观察内容包括: (1)动物死亡情况:包括动物死亡数及各自的死亡时间。 (2)动物体重:于染毒前、染毒后每周和死亡时测定体重。 (3)中毒反应症状:临床观察每天至少一次,观察皮肤、被毛、眼睛和粘膜改变,呼吸、循环、自主和中枢神经系统以及四肢活动和行为方式的变化等,特别要注意有无震 颤、惊厥、腹泻、嗜睡等现象。神经毒性:惊厥、共济失调和死亡。植物神经兴奋:腹泻或竖毛。 (4)病理学检查:解剖进行尸检,观察各器官有无改变,对肉眼观察有变化的脏器需进行组织病理学检查。 4、LD50计算 (1)霍恩氏法 (2)简化寇氏法 M = X – i(Σp – 0.5) 式中: m— log LD50, X—最高剂量组剂量对数值, p—死亡率(用小数表示), Σp—死亡率总和, i—相邻两组剂量对数之差。 (3)直接回归法: