
§1-3 溶液
Solutions
一、一些基本概念(Some Basic Concepts)
1.分散系(Dispersion system)
(1) 一种或几种物质的质点分散在另一种物质的质点中所形成的体系,称为分散系。
分散系中又分为:
分散相(dispersion phase) :被分散的物质称为分散相
分散介质(dispersion medium):容纳分散相的物质称为分散介质
(2) 分类(Classification):
a.均匀分散系(homogeneous dispersion system)
b.不均匀分散系(heterogeneous dispersion system)
(3) 分散相直径:
d < 1nm 溶液, d = 1~100nm 溶胶, d > 100nm 悬浊液、乳浊
液。
2.溶液(Solutions)
(1) 溶液是均匀的分散系。它包括分散相─溶质(solute),分散介质─溶剂(solvent)。
(2) 溶液的种类(kinds of solution)
Table 1.1 Examples of Solutions
State of
State of Solvent State of Solute Example Solution
Gas Gas Gas Air
Liquid Liquid Gas O xygen in water
Liquid Liquid Liquid Alcohol in water
Liquid Liquid Solid Salt in water
Solid Solid Gas Hydrogen in palladium
Solid Solid Liquid Mercury in silver
Solid Solid Solid Silver in gold
3.溶解(Dissolve)
(1) 溶解过程是物理化学过程。固体盐的溶解常伴随热效应,两种液体之间的
混合常伴随体积变化,也伴随热效应。
(2) 溶解度(solubility)
a.溶解平衡是一个动态平衡(dynamic equilibrium)。
b.饱和溶液的浓度也可以认为是溶解度。溶解度除了用g/100g H2O表示,
还可用mol·dm 3, % 表示。
c.在室温下,s >10g/100g H2O称为易溶,s在1~10g/100g H2O称为可溶,s在
0.1g ~ 1g/100g H2O 称为微溶,s<0.1g/100g H2O称为难溶。绝对不溶的物
质是没有的。
d.影响溶解度的因素:
(i) 内因:“相似相溶”:H2O (polar solvent)-离子化合物(Ionic
compounds),水-极性分子(polar molecule)相溶较好
non-polar solvent –non-polar molecule 相溶较好
(ii) 外因:温度(temperature)和压强(pressure)
温度:Solid:温度升高,溶解度有增大,有不变,有减少;
Liquid :温度升高,溶解度增大。
∵ 温度升高液体分子间距增大, ∴ 分子易互溶
Gas :温度升高,溶解度减少。
压强:压强增大时,对固体、液体溶解度变化不大,但对气体的溶解度影响
很大。
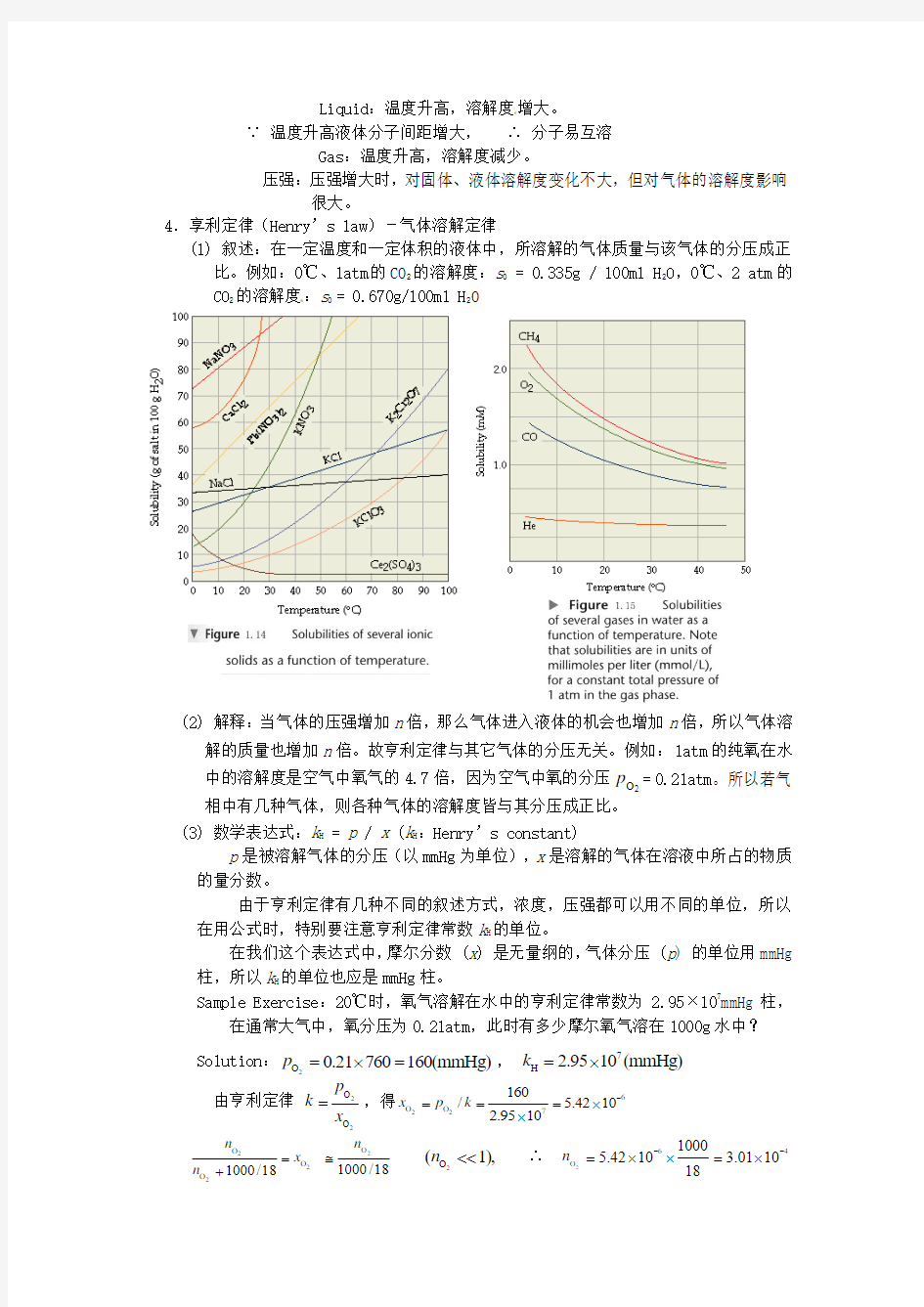
4.享利定律(Henry’s law)-气体溶解定律
(1) 叙述:在一定温度和一定体积的液体中,所溶解的气体质量与该气体的分压成正比。例如:0℃、1atm 的CO 2的溶解度:s 0 = 0.335g / 100ml H 2O ,0℃、2 atm 的CO 2的溶解度:s 0 = 0.670g/100ml H 2
O
(2) 解释:当气体的压强增加n 倍,那么气体进入液体的机会也增加n 倍,所以气体溶解的质量也增加n 倍。故亨利定律与其它气体的分压无关。例如:1atm 的纯氧在水中的溶解度是空气中氧气的4.7倍,因为空气中氧的分压2O p = 0.21atm 。所以若气相中有几种气体,则各种气体的溶解度皆与其分压成正比。
(3) 数学表达式:k H = p / x (k H :Henry’s constant)
p 是被溶解气体的分压(以mmHg 为单位),x 是溶解的气体在溶液中所占的物质的量分数。
由于亨利定律有几种不同的叙述方式,浓度,压强都可以用不同的单位,所以在用公式时,特别要注意亨利定律常数k H 的单位。
在我们这个表达式中,摩尔分数 (x ) 是无量纲的,气体分压 (p ) 的单位用mmHg 柱,所以k H 的单位也应是mmHg 柱。
Sample Exercise :20℃时,氧气溶解在水中的亨利定律常数为2.95×107
mmHg 柱,
在通常大气中,氧分压为0.21atm ,此时有多少摩尔氧气溶在1000g 水中? Solution :2O 0.21760160(mmHg)p =?=, 7
H 2.9510(mmHg)k =? 由亨利定律 2
2
O O
p k x =
,得226O O 7
160/ 5.42102.9510
x p k -==
=??
2
2
2O O O 1000/18
n x n =+2O 1000/18
n ?
2O (1),
n <<
∴ 2
6
4
O 10005.4210 3.011018
n --=??
=?
无机化学计算题 化学热力学: 1.高价金属的氧化物在高温下容易分解为低价氧化物。以氧化铜分解为氧化亚铜为例,估算反应分解的温度。该反应的自发性是焓驱动的还是熵驱动的?温度升高对反应自发性的影响如何? 解:4CuO===2Cu2O+O2 △r Hθm(298 K)=2△f Hθm(298 K,Cu2O)+△f Hθm(O2)-4△f Hθm(298 K,CuO) =2×(-169)+0-4×(-157.3)=291.2 kJ·mol-1 △r Sθm(298 K)=2Sθm(298 K,Cu2O)+Sθm(298 K,O2)-4Sθm(298 K,CuO) =2×93.3+205.138-4×42.7=220.94 J·mol-1·K-1 分解时:△r Gθm≤0 即△r Hθm(298 K) - T△r Sθm(298 K)≤0 ∴T≥△r Hθm(298 K)/△r Sθm(298 K)=1318 K 在此反应中,△r Hθm(298 K)>0,△r Sθm(298 K)>0,故该反应的自发性是熵驱动的。温度升高,此反应更易朝着正反应方向进行。 2. 银器与硫化物反应表面变黑是生活中的常见现象。 (1)设空气中H2S气和H2气“物质的量”都只达10-6 mol,问在常温下银和硫化氢能否反应生成氢气?温度达到多高,银器表面才不会因上述反应而变黑? (2)如果考虑空气中的氧气加入反应,使反应改为2 Ag(s) + H2S(g) + 1/2O2(g)== Ag2S(s) + H2O(l),该反应是否比银单独和硫化氢反应放出氢气更容易发生?通过计算来回答。温度对该反应自发性的影响如何? 附:298 K下Ag2S的标准生成焓和标准熵分别为-31.8 kJ·mol-1和146 J·mol-1·K-1 解:(1)2Ag(s) + H2S(g) == Ag2S(s) + H2(g) 298K时,△r H mθ=△f Hθm(Ag2S)- △f Hθm(H2S) =-31.8-(-20.63) kJ·mol-1 =-11.17 kJ·mol-1 △r S mθ=130.684+146-205.79--2×42.55 J·K-1·mol-1 =-14.206 J·K-1·mol-1 △r G mθ=△r H mθ- T△r S mθ=-6.94 kJ·mol-1 △r G m=△r G mθ+ RT ln[(p(H2)/pθ)/(p(H2S)/pθ)]= △r G mθ=-6.94 kJ·mol-1 要使反应不发生,则△r G mθ≥0 T≥△r H mθ/△r S mθ=787 K 即温度高于787 K银器表面才不会因上述反应而变。
2015年高中化学奥林匹克 北京地区预选赛试卷 (2015年4月19日上午9:00-11:00) ·姓名、准考证号和所属区、县、学校必须填写在答题纸指定位置,写在其他处者按废卷处理。 ·竞赛时间2小时。迟到超过30分钟者不得进场。开赛后1小时内不得离场。考试结束后,把试卷(背面向上)放在桌面上,立即离场。 ·竞赛答案全部写在答题纸指定位置上,使用黑色或蓝色圆珠笔、签字笔、钢笔答题,使用红色笔或铅笔答题者,试卷作废无效。 ·允许使用非编程计算器及直尺等文具。 ·试卷按密封线封装。 可能用到的元素相对原子质量如下: 第1题 选择题(30分)(单选或多选,每题5分) (1)一瓶失去标签的溶液,可能是NH 4Cl 、Na 2SO 4、(NH 4)2SO 4和KCl 中的一种,为确认 此溶液,可选用的一种试剂是 。 A .NaOH B .Na 2CO 3 C .Ba(OH)2 D .BaCl 2 (2)已知反应:6FeBr 2 + 3Cl 2 = 2FeCl 3 + 4FeBr 3,判断下列说法不正确... 的是 。 A .Cl 2不能氧化Br ? B .Br 2的氧化性强于Fe 3+ C .Fe 2+的还原性强于Br ? D .反应发生的条件是FeBr 2要过量 (3)红磷和黑磷互为同素异形体,磷的存在形式与 温度(T )和压力(p )有关,如右图所示(图 中的曲线表示两相平衡共存的区域)。下列说法 不正确... 的是: A .红磷在一定温度压力下可以升华 B .红磷和黑磷的熔点都随压力的增加而降低 C .红磷、黑磷和液态磷可以在一定温度和压力下共存 D .在1000 K 、1×106 Pa 下,磷的稳定存在形式是气态
初赛基本要求 1.有效数字在化学计算和化学实验中正确使用有效数字。定量仪器(天平、量筒、移液 管、滴定管、容量瓶等等)测量数据的有效数字。数字运算的约化规则和运算结果的有效数字。实验方法对有效数字的制约。 2.气体理想气体标准状况(态)。理想气体状态方程。气体常量R。体系标准压力。分 压定律。气体相对分子质量测定原理。气体溶解度(亨利定律)。 3.溶液溶液浓度。溶解度。浓度与溶解度的单位与换算。溶液配制(仪器的选择)。重 结晶的方法及溶质/溶剂相对量的估算。过滤与洗涤(洗涤液选择、洗涤方式选择)。重结晶和洗涤溶剂(包括混合溶剂)的选择。胶体。分散相和连续相。胶体的形成和破坏。 胶体的分类。胶体的基本结构。 4.容量分析被测物、基准物质、标准溶液、指示剂、滴定反应等基本概念。酸碱滴定曲 线(酸碱强度、浓度、溶剂极性对滴定突跃影响的定性关系)。酸碱滴定指示剂的选择。 以高锰酸钾、重铬酸钾、硫代硫酸钠、EDTA为标准溶液的基本滴定反应。分析结果的计算。分析结果的准确度和精密度。 5. 原子结构核外电子运动状态: 用s、p、d等来表示基态构型(包括中性原子、正离子 和负离子)核外电子排布。电离能、电子亲合能、电负性。 6.元素周期律与元素周期系周期。1—18族。主族与副族。过渡元素。主、副族同族元 素从上到下性质变化一般规律;同周期元素从左到右性质变化一般规律。原子半径和离子半径。s、p、d、ds区元素的基本化学性质和原子的电子构型。元素在周期表中的位置与核外电子结构(电子层数、价电子层与价电子数)的关系。最高氧化态与族序数的关系。对角线规则。金属与非金属在周期表中的位置。半金属(类金属)。主、副族的重要而常见元素的名称、符号及在周期表中的位置、常见氧化态及主要形态。铂系元素的概念。 7.分子结构路易斯结构式。价层电子对互斥模型。杂化轨道理论对简单分子(包括离子) 几何构型的解释。共价键。键长、键角、键能。σ键和π 键。离域π键。共轭(离域)体系的一般性质。等电子体的一般概念。键的极性和分子的极性。相似相溶规律。对称性基础(限旋转和旋转轴、反映和镜面、反演和对称中心)。 8.配合物路易斯酸碱。配位键。重要而常见的配合物的中心离子(原子)和重要而常见的配体(水、羟离子、卤离子、拟卤离子、氨分子、酸根离子、不饱和烃等)。螯合物及螯合效应。重要而常见的配合反应。配合反应与酸碱反应、沉淀反应、氧化还原反应的关系(定性说明)。配合物几何构型和异构现象基本概念和基本事实。配合物的杂化轨道理论。用杂化轨道理论说明配合物的磁性和稳定性。用八面体配合物的晶体场理论说明Ti(H2O)63+的颜色。软硬酸碱的基本概念和重要的软酸软碱和硬酸硬碱。 9.分子间作用力范德华力、氢键以及其他分子间作用力的能量及与物质性质的关系。 10.晶体结构分子晶体、原子晶体、离子晶体和金属晶体。晶胞(定义、晶胞参数和原子 坐标及以晶胞为基础的计算)。点阵(晶格)能。配位数。晶体的堆积与填隙模型。常见的晶体结构类型:NaCl、CsCl、闪锌矿(ZnS)、萤石(CaF2)、金刚石、石墨、硒、冰、干冰、金红石、二氧化硅、钙钛矿、钾、镁、铜等。 11.化学平衡平衡常数与转化率。弱酸、弱碱的电离常数。溶度积。利用平衡常数的计算。 熵(混乱度)的初步概念及与自发反应方向的关系。 12.离子方程式的正确书写。
第一章物质存在的状态………………………………………………………………2 一、气体 .......................................................................................................... 2 二、液体 .......................................................................................................... 3 ①溶液与蒸汽压 ................................................................................................ 3 ②溶液的沸点升高和凝固点的下降 ................................................................... 3 ③渗透压 .......................................................................................................... 4 ④非电解质稀溶液的依数性 .............................................................................. 4 三、胶体 .......................................................................................................... 4 第二章 化学动力学初步……………………………………………………………5 一、化学反应速率 ............................................................................................ 5 二、化学反应速率理论 ..................................................................................... 6 三、影响化学反应速率的因素 .......................................................................... 6 2、温度 ............................................................................................................ 7 第三章 化学热力学初步……………………………………………………………8 一、热力学定律及基本定律 .............................................................................. 8 二、化学热力学四个重要的状态函数 ................................................................ 9 4、自由能 ....................................................................................................... 10 ①吉布斯自由能 .............................................................................................. 10 ②自由能G ——反应自发性的判据 .................................................................. 11 ③标准摩尔生成自由能θ m f G ? (11)
全国高中学生化学竞赛基本要求 说明: 1.本基本要求旨在明确全国初赛和决赛试题的知识水平,作为试题命题的根据。国家队选手选拔的要求本基本要求不涉及。 2.现行中学化学教学要求以及考试说明规定的内容均属初赛要求。初赛基本要求对某些化学原理的定量关系、物质结构、立体化学和有机化学上作适当补充,一般说来,补充的内容是中学化学内容的自然生长点。初赛要求的描述化学知识以达到国际化学竞赛大纲一级水平为准,该大纲的二、三级知识均不要求记忆。 3.决赛基本要求是在初赛基本要求的基础上作适当补充,描述化学知识原则上以达到国际化学竞赛二级知识水平为度,该大纲的三级知识均不要求掌握。 4.本基本要求若有必要作出调整,在2002年8月初通告。 初赛基本要求 1.有效数字的概念。在化学计算和化学实验中正确使用有效数字。定量仪器(天平、量筒、移液管、滴定管、容量瓶等)的精度与测量数据有效数字。运算结果的有效数字。2.理想气体标准状态。理想气体状态方程。气体密度。气体相对分子质量测定。气体溶解度。 3.溶液浓度与固体溶解度及其计算。溶液配制(浓度的不同精确度要求对仪器的选择)。重结晶估量。过滤与洗涤操作、洗涤液选择、洗涤方式选择。溶剂(包括混合溶剂)与溶质的相似相溶规律。 4.容量分析的基本概念——被测物、基准物质、标准溶液、指示剂、滴定反应等。分析结果的准确度和精密度。滴定曲线与突跃(酸碱强度、浓度、溶剂极性对滴定突跃影响的定性关系)。酸碱滴定指示剂的选择。高锰酸钾、重铬酸钾、硫代硫酸钠、EDTA 为标准溶液的滴定基本反应与分析结果计算。 5.原子结构。核外电子运动状态。用s、p、d等来表示基态构型(包括中性原子、正离子和负离子),核外电子排布(构造个、原理)。电离能和电负性。 6.元素周期律与元素周期系。主族与副族。主、副族同族元素从上到下的性质变化一般规律;同周期元素从左到右的性质变化一般规律;s、d、ds、p、f-区。元素在周期表中的位置与核外电子结构(电子层数、价电子层与价电子数)的关系。最高化合价与族序数的关系。对角线规则。金属性、非金属性与周期表位置的关系。金属与非金属在周期表中的位置。半金属。主、副族重要而常见元素的名称、符号及在周期表中的位置、常见化合价及主要形态。过渡元素、铂系元素的概念。 7.分子结构:路易斯结构式(电子式)。价层电子互斥模型对简单分子(包括离子)立体结构的预测。杂化轨道理论对简单分子(包括离子)立体结构的解释。共价键。 键和键。大键。共轭(离域)的一般概念。等电子体的一般概念。8.配合物。配合物与配离子的基本概念。路易斯酸碱的概念。重要而常见的配离子的中心离子(原子)和重要而常见的配位体(水、羟基、卤离子、拟卤离子、氨分子、酸根离子等)、螯合物。重要而常见的配合剂及其重要而常见的配合反应。配合反应与酸碱反应、沉淀反应、氧化还原反应的联系(定性说明)。配合物空间结构和异构现象基
都是自然界的光学现象,也与胶体的知识有关“海市蜃楼”D.“雨后彩虹”与 2015年全国高中化学奥林匹克竞赛日,世界上第一条商业磁悬浮铁路在上海投入运营。 磁悬浮的核心技术12月3120025.年预赛试题为原料,经研磨烧结可合成一种高温超导物质BaCO和CuO是利用超导体的反磁性。以YO、323(mo1)的物质的量、YBaCuO。现欲合成0.5mol此高温超导物质,理论上需取YOBaCO和CuO32x233) 120分钟满分100分时间(。分别为( ) 1.0, 0.25, 0.17 A.0.50, 0.50, 0.50 B.0.50, 1.0, 1.5 C..D0.25, 1.0, 1.5 可能用到的相对原子质量:--S-32 Na-23 Mg-24 Al-27 N-14 H-1 C-12 O-16 —。根据该反应事实,可以得出的正确结6.HH离子可以跟NH反应:+NH+HNH 2323Ba-137 Ag-108 Cu-64 Cl-35.5 K-39 Fe-56 Zn-65 )。论是( —具有还原性A.NH H是很强的还原剂B.31个选项符合题意。多选错(本题包括18小题,每题2分,共36分,每题有~2一、选择题......该反应是属于置换反应 D .CH既是氧化产物又是还原产物2) 1分选不得分,有两个答案的只选一个且答对者得 的溶解度曲线,已知硫酸钠晶体Na7.右图为SO42麦金农,因为发现细胞膜水通道,以及对离子通··1.两位美国科学家彼得阿格雷和罗德里克时开始分解为无水硫酸钠。T K O)·(NaSO10H 在温度为3 242他们之所以获得诺贝尔化学奖年诺贝尔化学奖。道结构和机理研究作出的开创性贡献而获得2003K T K T的饱和硫酸钠溶液,当温度降为温度为现有142g1 2 。而不是生理学或医学奖是因为( )K T K(或升为T>TT)时析出晶体的质量相等,则温度为4 44 3.他们的研究和化学物质水有关A ( 的溶解度为SO时Na )。42.他们的研究有利于研制针对一些神经系统疾病和心血管疾病的药物B41g 40.8g D..40g B .A32.8g . C .他们的研究深入到分子、原子的层次C它8.目前,人们正在研究开发一种高能电池-钠硫电池,.他们的研究深入到细胞的层次D放电+。SNa x 2Na陶瓷作固体电解质,AlβNa是以熔融的钠、硫为两极,以导电的-O反应为:+S当(2.为了探索月球上是否有生命存在的痕迹,就要分析月球岩石中是否包藏有碳氢化合物x322充电溶液处理月球岩石样品,对收集的O)然这仅仅是探索的第一步)。科学家用氘盐酸(DCl)和重水(D2 ) 。以下说法正确的是( 气体加以分析,结果只发现有一些气体状态的碳氘化合物。这个实验不能用普通盐酸,其理由是A.放电时,钠作负极,硫作正极。( ) B.放电时,钠极发生还原反应B.普通盐酸具有挥发性A.普通盐酸的酸性太强.充电时钠极与外电源的正极相连,硫极与外电源负极相连C C.普通盐酸和月球岩石中的碳化物无法反应--22e—x.充电时,阳极发生的反应为:DS S x D.无法区别岩石中原来含有的是碳化物,还是碳氢化合物9.已知乙烯醇(CH=CH—OH)不稳定,可自动转化为乙醛。乙二醇在一定条件下发生脱水反2 3.下列与“神舟五号”载人飞船有关的说法不正确的是( )。...应,也有类似现象发生,所得产物的结构简式有人写出下列几种:
竞赛时间3小时。迟到超过半小时者不能进考场。开始考试后1小时内不得离场。时间到,把试卷(背面朝上)放在桌面上,立即起立撤离考场。 ●试卷装订成册,不得拆散。所有解答必须写在指定的方框内,不得用铅笔填 写。草稿纸在最后一页。不得持有任何其他纸张。 ●姓名、报名号和所属学校必须写在首页左侧指定位置,写在其他地方者按废 卷论处。 ●允许使用非编程计算器以及直尺等文具。 第一题 (17分) Cr及其化合物在现今工业上十分常用,Cr占地壳蹭的丰度为0.0083%,主要来源是铬铁矿、铬铅矿。最初Cr的提炼是用铬铁矿与焦炭共热生产的。 1.写出铬铁矿、铬铅矿的化学式,写出铬铁矿与焦炭共热的反应方程式。 。其水溶液可有三2.Cr常见的价态为+3和+6,常见的Cr(Ⅲ)化合物为CrCl 3 种不同的颜色,分别为紫色、蓝绿色和绿色,请分别画出这三种不同颜色的Cr (Ⅲ)化合物阳离子的立体结构。指出Cr的杂化方式 3.常见的Cr(Ⅵ)化合物是重铬酸钾,是由铬铁矿与碳酸钠混合在空气中煅烧后用水浸取过滤,然后加适量硫酸后加入氯化钾即可制得,写出涉及的反应方程式。 4.在钢铁分析中为排除Cr的干扰可加入NaCl和HClO 加热至冒烟来实现,写出 4 (CN)2被称为拟卤素,其性质与卤素单质既有相似点,也有一些不同。它可以由含有同一种元素的两种化合物一同制取得到。 1. 写出制取(CN)2的反应方程式。 2. (CN)2不稳定,它在水溶液中有2种水解方式,其中一种是生成HCN与HOCN。 请分别写出(CN)2的两种水解反应的方程式。 3. HCN在加热时与O2反应,反应比为8:3,写出该反应方程式。 4.液态的HCN不稳定,易聚合。其中,三聚体中包含有2种不同环境的C, 2 种不同环境的H与2种不同环境的N;而四聚体中H只有1种环境,C,N则各有2种不同环境。试画出两种聚合体的结构,并分别标明它们中所具有的 SmCo5是一种典型的AB5型金属化合物,可作为磁性材料,其结构如下 其中大球为Sm,小球为Co。而另一种永磁体材料X跟SmCo5的结构密切相关,他是将如图(a)层的1/3Sm原子用一对Co原子代替,并且这对Co原子不在(a)平面上而是出于该平面的上方和下方,其连线被(a)平面垂直平分。且相邻两(ABAB……型排列,三方晶胞则为ABCABC……型排列。
无机化学重点笔记Revised on November 25, 2020
第一章 物质的状态 理想气体:是设定气体分子本身不占空间、分子间也没有相互作用力的假想情况下的气体。 实际气体:处于高温(高于273 K )、低压(低于数百千帕)的条件下,由于气体分子间距离相当大,使得气体分子自身的体积与气体体积相比可以忽略不计,且分子间作用力非常小,可近似地将实际气体看成是理想气体。 pV = nRT (理想气体状态方程式) R 称为比例常数,也称为摩尔气体常数。 R = Pa·m3·mol-1·K-1 = kPa·L·mol-1·K-1 = ·mol-1·K-1(Pa·m3=N·m-2·m3=N·m = J ) 道尔顿理想气体分压定律 式中 xi 为某组分气体的摩尔分数。理想气体混合物中某组分气体的分压等于该组分气体的摩尔分数与总压力的乘积。 分体积定律 当几种气体混合时,起初每一种气体在各处的密度是不同的,气体总是从密度大的地方向密度小的地方迁移,直至密度达到完全相同的状态,这种现象称为扩散。 相同温度、相同压力下,某种气体的扩散速度与其密度的平方根成反比,这就是气体扩散定律。用u i 表示扩散速度,ρi 表示密度,则有: 式中u A 、u B 分别表示A 、B 两种气体的扩散速度,ρA 、ρB 分别表示A 、B 两种气体的密度。 同温同压下,气体的密度(ρ)与其摩尔质量(M )成正比,据此可以表示为:i i RT RT p p n n V V =∑=∑=i u A B u u A B u u
对理想气体状态方程进行修正 对n = 1 mol实际气体,其状态方程为: 气体分子运动论的主要内容包括以下几个假设: (1)气体由不停地作无规则运动的分子所组成; (2)气体分子本身不占体积,视为数学上的一个质点; (3)气体分子间相互作用力很小,可忽略; (4)气体分子之间及分子对容器壁的碰撞视为弹性碰撞,气体的压力是由于气体分子同容器壁产生碰撞的结果; (5)气体分子的平均动能与气体的温度成正比。 通常把蒸气压大的物质称为易挥发的物质,蒸气压小的物质称为难挥发的物质。 对同一液体来说,若温度高,则液体中动能大的分子数多,从液体中逸出的分子数就相应的多些,蒸气压就高;若温度低,则液体中动能大的分子数少,从液体中逸出的分子数就相应的少些,蒸气压就低。 克劳修斯-克拉贝龙(Clansius-Clapeyron)方程 沸点是指液体的饱和蒸气压等于外界大气压时的温度。在此温度下,气化在整个液体内部和表面同时进行(在低于该温度时气化仅在液体的表面上进行),称之为液体的沸腾。三氯甲烷、乙醇、水和醋酸的正常沸点依次分别为61.3℃, 78.4℃, 100℃和118.5℃。减压蒸馏的方法正是利用减压时液体沸点会降低的这一特征去实现分离和提纯物质的目的。这种方法适用于分离提纯沸点较高的物质以及那些在正常沸点易分解或易被空气氧化的物质。
第十五章 硼族元素 Chapter 15 The Boron Family Elements Boron (B) Aluminum (Al) Gallium (Ga) Indium (In) Thallium (Tl) Electron configuration :n s 2 n p 1 §15-1 硼及其化合物 Boron and its Compounds 一、General Properties 1.硼的化学性质与Si 有某些相似之处(对角线相似原则),通常硼呈现+3氧化态,负氧 化态的情况很少。硼与金属形成非化学计量的化合物(nonstoichiometric compounds ),M 4B 、M 2B 、MB 、M 3B 4、MB 2、MB 6等。 (1) B 2O 3与SiO 2都是固态酸性氧化物,Al 2O 3是两性,CO 2是气态酸性; (2) H 3BO 3与H 4SiO 4都是很好的酸; (3) 多硼酸盐与多硅酸盐结构相似; (4) 硼烷、硅烷可形成多种可燃性气态物质,而AlH 3是固态。 2.在自然界中,硼以硼砂(borax ):Na 2B 4O 7·10H 2O ,四水硼砂(kernite ): Na 2B 4O 7·4H 2O ,天然硼酸 ( sassolite ):H 3BO 3存在。 3.硼在自然界中丰度之所以低,是因为Li He B 7 3421 0105+→ +n ,所以硼材料可作为核反 应堆的减速剂和生物防护。 二、The Simple Substance 1.Boron has several allotropic forms. 无定形硼为棕色粉末, The crystals of boron are black. 高熔沸点(m.p. 2300℃,b.p. 2550℃) 单质硼有多种复杂的晶体结构,其中最普通的一种是α - 菱形硼,其 基本结构单元为正二十面体的对称几何构型,然后由B 12的这种二十面体的布起来组成六方晶系的α - 菱形硼。 2.Properties (1) 硼和硅一样在常温下较惰性,仅与F 2反应。对于单质硼的同素异构形体而 言,结晶状单质硼较惰性,无定形硼则比较活泼,在高温下: (2)单质硼作还原剂: 3SiO 2 + 4B 强热 3Si + 2B 2O 3 2B + 6H 2O(g)赤热 2B(OH)3 + 3H 2↑ (3) 与氧化性的酸反应,生成H 3BO 3 (4) 在有氧化剂存在时,与碱反应: B 2S 3 B BCl 3B 2O 3 BN O 2S Cl 2 N 2 Fig 15.1 Icosahedral arrangement of B 12
中国化学会第26届全国高中学生化学竞赛(省级赛区)试卷 2012年9月2日 第1题(7分) 1-1 向硫酸锌水溶液中滴加适当浓度的氨水至过量,发生两步主要反应。简述实验现象并写出两步主要反应的离子方程式。 1-2 化合物[Cu(Pydc)(amp)] ·3H2O]的组成为C11H14CuN4O7,热重分析曲线表明,该化合物受热分解发生两步失重,第一个失重峰在200~250℃,失重的质量分数为15.2%。第二个失重峰在400~500℃,失重后的固态残渣质量为原化合物质量的20.0%。Pydc和amp是含有芳环的有机配体。通过计算回答: (1)第一步失重失去的组分。 (2)第二步失重后的固态残渣是什么,解释理由。 第2题(7分) A和X是两种常见的非金属元素,其核外电子数之和为22,价电子数之和为10。在一定条件下可生成AX、AX3(常见的Lewis酸)、A2X4和A4X4,反应如下: A(s) + 3/2X2(g) → AX3(g) AX3(g)-[Hg, 放电]→ AX(g) +2X(g) 2Hg +2X(g) → Hg2X2(g) AX(g) +AX3(g) → A2X4(g) 4 AX(g) → A4X4(s) 2-1 指出A和X各是什么元素。 2-2 A4X4具有4个三重旋转轴,每个A原子周围都有4个原子,画出A4X4的结构示意图。 2-3 写出AX3与CH3MgBr按计量数比为1∶3反应的方程式。 2-4 写出A2X4与乙醇发生醇解反应的方程式。 第3题(10分) CuSO4溶液与K2C2O4溶液反应,得到一种蓝色晶体。通过下述实验确定该晶体的组成:(a)称取0.2073g样品,放入锥形瓶,加入40mL2mol·L-1的H2SO4,微热使样品溶解,加入30mL水,加热近沸,用0.02054 mol·L-1KMnO4溶液滴定至终点,消耗24.18mL。
智浪教育-普惠英才文库 高中化学竞赛辅导练习参考答案与解析 第一章元素与化合物 第一节卤素 一.1.IO3-十5I-+6CH3COOH===3I2+6CH3COO-+3H2O 2.KI在潮湿空气里,在阳光的作用下会被空气氧化而产生紫黑色固体(或紫色蒸气),而KIO3不被空气氧化。4I-+O2+2H2O===2I2+4OH-二.l.(1)主要反应:I2+2KClO3==2KIO3+C12↑ (2)可能的副反应:C12+H2O(冷)==HClO+HCl C12+H2O==2HCl+1/2O2 3C12+3H2O(热)==HClO3+5HCl I2+5Cl2+6H2O==2HIO3+10HCl 一步:I2+5H2O2? ?催化剂2HIO3+4H2O ?→ 二步:2HIO3+K2CO3==2KIO3+CO2↑+H2O 2.使氧化生成的I2再还原为碘化物 I2+2S2O32-==S4O62-+2I- 三.3I2+6OH-===IO3-+5I-+3H2O S2O32-+4I2+10OH-===2SO42-十8I-+5H2O S2O32-+2H+===SO2↑十S↓+H2O 4I-+O2+4H+===2I2+2H2O 四.加入过量KI生成I3-离子以减少I2挥发 1.在强酸性溶液中S2O32-遇酸分解,且I-易被空气氧化:(反应略);在碱性溶液中: S2O32-+4I2+10OH-===SO42-+8I-+5H2O 3I2+6OH-===IO3-+5I-+3H2O 上述到反应的发生,使定量反应难以准确. 2.前者,I2与S2O32-的反应速度大于I2与OH-的反应速度;后者,S2O32-与I2的反应速度大于S2O32-与H+的反应速度。 五.I2(反应略) 七.A CaF2 B H2SO4 C HF D NaF E NaHF2 九.紫2I-+CI2===I2+2CI- 棕紫2Br-+Cl2===Br2+2Cl- 棕红色I2+5Cl2+6H2O===2IO3-+5Cl-+12H+ 十.A AgNO3 B AgCl C [Ag(NH3)2]Cl D AgBr E Na3[Ag(S2O3)2] F Agl G Na[Ag(CN)2] H Ag2S (反应略) 十三.1.该固体一定含钠和碘,使煤气灯火焰显黄色表明钠的存在;不溶于NH3,而溶于强络合剂CN-或S2O32-的黄色银盐一定是碘化银。
无机化学(上) 知识点总结 第一章 物质存在的状态 一、气体 1、气体分子运动论的基本理论 ①气体由分子组成,分子之间的距离>>分子直径; ②气体分子处于永恒无规则运动状态; ③气体分子之间相互作用可忽略,除相互碰撞时; ④气体分子相互碰撞或对器壁的碰撞都是弹性碰撞。碰撞时总动能保持不变,没有能量损失。 ⑤分子的平均动能与热力学温度成正比。 2、理想气体状态方程 ①假定前提:a 、分子不占体积;b 、分子间作用力忽略 ②表达式:pV=nRT ;R ≈8.314kPa 2L 2mol 1-2K 1- ③适用条件:温度较高、压力较低使得稀薄气体 ④具体应用:a 、已知三个量,可求第四个; b 、测量气体的分子量:pV=M W RT (n=M W ) c 、已知气体的状态求其密度ρ:pV=M W RT →p=MV WRT →ρMV RT =p 3、混合气体的分压定律 ①混合气体的四个概念 a 、分压:相同温度下,某组分气体与混合气体具有相同体积时的压力; b 、分体积:相同温度下,某组分气体与混合气体具有相同压力时的体积 c 、体积分数:φ= 2 1 v v d 、摩尔分数:xi= 总 n n i ②混合气体的分压定律 a 、定律:混合气体总压力等于组分气体压力之和; 某组分气体压力的大小和它在混合气体中体积分数或摩尔数成正比 b 、适用范围:理想气体及可以看作理想气体的实际气体 c 、应用:已知分压求总压或由总压和体积分数或摩尔分数求分压、 4、气体扩散定律 ①定律:T 、p 相同时,各种不同气体的扩散速率与气体密度的平方根成反比: 2 1 u u =21p p =2 1 M M (p 表示密度) ②用途:a 、测定气体的相对分子质量;b 、同位素分离 二、液体
高中化学方程式大全 一、非金属单质(F2,Cl2, O2, S, N2, P, C, Si,H) 1. 氧化性: F2+H2===2HF (阴暗处爆炸) F2+Xe(过量)==XeF2 2F2(过量)+Xe==XeF4(XeF4是强氧化剂,能将Mn2+氧化为MnO4–) nF2+2M===2MFn(M表示大部分金属) 2F2+2H2O===4HF+O2 (水是还原剂) 2F2+2NaOH===2NaF+OF2+H2O F2+2NaCl===2NaF+Cl2 F2+2NaBr===2NaF+Br2 F2+2NaI===2NaF+I2 7F2(过量)+I2===2IF7 F2+Cl2(等体积)===2ClF (ClF属于类卤素:ClF+H2O==HF+HClO ) 3F2(过量)+Cl2===2ClF3 (ClF3+3H2O==3HF+HClO3 ) Cl2+H22HCl (将H2在Cl2点燃;混合点燃、加热、光照发生爆炸) 3Cl2+2P2PCl3Cl2+PCl3PCl5Cl2+2Na2NaCl 3Cl2+2Fe2FeCl3Cl2+Cu CuCl2 Cl2+2FeCl2===2FeCl3(在水溶液中:Cl2+2Fe2+===2Fe3++3Cl-) Cl2+2NaBr===2NaCl+Br2Cl2+2Br-=2Cl-+Br2 Cl2+2KI===2KCl+I2Cl2+2I-=2Cl-+I2 3Cl2(过量)+2KI+3H2O===6HCl+KIO3
3Cl2+I–+3H2O=6H++6Cl–+IO3– 5Cl2+I2+6H2O===2HIO3+10HCl 5Cl2+I2+6H2O=10Cl–+IO3–+12H+ Cl2+Na2S===2NaCl+S↓Cl2+S2–=2Cl–+S↓ Cl2+H2S===2HCl+S↓(水溶液中:Cl2+H2S=2H++2Cl–+S↓ Cl2+SO2+2H2O===H2SO4+2HCl Cl2+SO2+2H2O=4H++SO42–+2Cl– Cl2+H2O2===2HCl+O2Cl2+H2O2=2H++Cl–+O2 2O2+3Fe Fe3O4O2+K===KO2 S+H2H2S 2S+C CS2S+Zn ZnS S+Fe FeS (既能由单质制取,又能由离子制取) S+2Cu Cu2S (只能由单质制取,不能由离子制取) 3S+2Al Al2S3 (只能由单质制取,不能由离子制取) N2+3H2催化剂 2NH3N2+3Mg Mg3N2N2+3Ca Ca3N2高温高压 N2+3Ba Ba3N2N2+6Na2Na3N N2+6K2K3N N2+6Rb2Rb3N N2+2Al2AlN P4+6H24PH3P+3Na Na3P 2P+3Zn Zn3P2 H2+2Li2LiH 2、还原性 S+O2SO2S+H2SO4(浓)3SO2↑+2H2O S+6HNO3(浓)H2SO4+6NO2↑+2H2O S+4H++6==6NO2↑+2H2O+-2 SO 4
2015年全国高中化学竞赛(安徽赛区)初赛试题及参考答案
2015年全国中学生化学竞赛(安徽赛区)初赛试题注意:考试时间2.5小时,满分150分。请在答题卡上答题,允许使用非编程计算器。 一、本题包括15小题,每小题2分,共30分。每小 题仅有1个选项符合题意。 1.下列生活常识与化学原理有关,正确的选项是 ①福尔马林具有防腐杀菌的作用,是因为甲醛可 以使蛋白质变性 ②人体血液pH保持弱碱性(7.35-7.45),主要是血 液中存在H2CO3—HCO3-缓冲体系 ③硫酸亚铁补铁剂应与维生素C同服,是因为维 生素C可以防止Fe2+被氧化 ④油炸食品容易产生“哈喇”味而不能食用,是因 为被氧化产生过氧化物和醛类 A.①②③④B.①②③C.②③④ D.①③④
2.缺铁性贫血是世界上最普遍的营养性问题,一个简单的解决办法是生产铁强化酱油,即在酱油中加入易吸收的铁添加剂——Na2FeY,其中Y4-是乙二胺四乙酸(H4Y)的酸根形式,H4Y结构如下左图。生产铁强化酱油产生的废水可用绿色消毒剂X(如下右图)来杀菌。下列有关说法正确的是 A.从酸碱质子理论来说,H4Y只有酸性 B.X能够杀菌的原因是其水解可产生次氯酸 C.H4Y和X在一定条件下均能发生水解反应 D.可用萃取法从铁强化酱油中分离出Na2FeY 3.某未知溶液可能含Cl-、CO32-、Na+、SO42-、Al3+等离子中的一种或多种。将溶液滴在蓝色石蕊试纸上.试纸变红。取少量试液,滴加硝酸酸化的氯化钡溶液,有白色沉淀生成;在上层清液中滴加硝酸银溶液,产生白色沉淀。下列判断不合理 ...的是 A.一定有Cl-B.一定有SO42- C.一定有Al3+ D.一定没有CO32-
● 竞赛时间3小时。迟到超过半小时者不能进考场。开始考试后1小时内不得离场。时 间到,把试卷(背面朝上)放在桌面上,立即起立撤离考场。 ● 试卷装订成册,不得拆散。所有解答必须写在指定的方框内,不得用铅笔填写。草稿 纸在最后一页。不得持有任何其他纸张。 ● 姓名、报名号和所属学校必须写在首页左侧指定位置,写在其他地方者按废卷论处。 ● 允许使用非编程计算器以及直尺等文具。 1.008 Zr Nb Mo T c Ru Rh Pd Ag Cd In Sn Sb T e I Hf T a W Re Os Ir Pt Au Hg T l Pb Bi Po At Ac-Lr H Li Be B C N O F Na Mg Al Si P Cl S K Ca Sc T i V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Rb Cs Fr Sr Ba Ra Y La Lu -6.9419.01222.9924.31 39.1040.0885.4787.62132.9137.3[223][226]44.9647.8850.9452.0054.9455.8558.9363.5558.6965.3910.8126.9869.7212.0128.0972.61114.8204.4118.7207.2112.4200.6107.9197.0106.4195.1102.9192.2101.1190.298.91186.295.94183.992.91180.991.22178.588.9114.0116.0019.0030.9774.92121.8209.032.0778.96127.6[210][210][210]126.979.9035.454.003 20.18 39.9583.80 131.3 [222]He Ne Ar Kr Xe Rn 相对原子质量 Rf Db Sg Bh Hs Mt 第1题 形如MeX 3Y 2 (Me = centre atom; X, Y = ligands)的配合物中的配体存在很多种空间位置。 画出上述配合物的所有异构体的空间结构,包括可能出现的光学异构体。假设X 为小配体,Y 为大配体,指出最稳定的结构。 作为提示,给出如下多面体,是从中选择你需要的配位多面体。 第2题 化合物A 、B 和C 的水溶液含有同样化学成分, 并且溶液都是强酸性的。如果它们被干燥,一开始先生成化合物A (含23.2% S), 之后是化合物B (26.7% S) 。继续加热,产生含28.9% S 的化合物C 。如果C 在高温下加热,则获得白色晶体物质D 。D 的水溶液是中性的, 它气体火焰为黄色,含22.6% S 。在所有物质中,硫显出同样的氧化态。 1.确定化合物A 、B 、C 和D 。 2.解释为什么化合物A 、B 和C 的溶液有同样化学成分。在这种溶液中存在什么离子。如果他们在一些化学反应中形成, 写出这些反应的化学方程式。 3. 显示组成物质C 和D 的离子的几何形式。 姓名 学校赛场 报名号 赛区省市自治区
无机化学知识点归纳 一、常见物质的组成和结构 1、常见分子(或物质)的形状及键角 (1)形状:V型:H2O、H2S 直线型:CO2、CS2 、C2H2平面三角型:BF3、SO3 三角锥型:NH3正四面体型:CH4、CCl4、白磷、NH4+ 平面结构:C2H4、C6H6 (2)键角:H2O:104.5°;BF3、C2H4、C6H6、石墨:120°白磷:60° NH3:107°18′CH4、CCl4、NH4+、金刚石:109°28′ CO2、CS2、C2H2:180° 2、常见粒子的饱和结构: ①具有氦结构的粒子(2):H-、He、Li+、Be2+; ②具有氖结构的粒子(2、8):N3-、O2-、F-、Ne、Na+、Mg2+、Al3+; ③具有氩结构的粒子(2、8、8):S2-、Cl-、Ar、K+、Ca2+; ④核外电子总数为10的粒子: 阳离子:Na+、Mg2+、Al3+、NH4+、H3O+; 阴离子:N3-、O2-、F-、OH-、NH2-; 分子:Ne、HF、H2O、NH3、CH4 ⑤核外电子总数为18的粒子: 阳离子:K+、Ca 2+; 阴离子:P3-、S2-、HS-、Cl-; 分子:Ar、HCl、H2S、PH3、SiH4、F2、H2O2、C2H6、CH3OH、N2H4。 3、常见物质的构型: AB2型的化合物(化合价一般为+2、-1或+4、-2):CO2、NO2、SO2、SiO2、CS2、ClO2、CaC2、MgX2、CaX2、BeCl2、BaX2、KO2等 A2B2型的化合物:H2O2、Na2O2、C2H2等 A2B型的化合物:H2O、H2S、Na2O、Na2S、Li2O等 AB型的化合物:CO、NO、HX、NaX、MgO、CaO、MgS、CaS、SiC等 能形成A2B和A2B2型化合物的元素:H、Na与O,其中属于共价化合物(液体)的是H和O[H2O和H2O2];属于离子化合物(固体)的是Na和O[Na2O和Na2O2]。 4、常见分子的极性: 常见的非极性分子:CO2、CS2、BF3、CH4、CCl4、、SF6、C2H4、C2H2、C6H6等 常见的极性分子:双原子化合物分子、H2O、H2S、NH3、H2O2、CH3Cl、CH2Cl2、CHCl3等 5、一些物质的组成特征: (1)不含金属元素的离子化合物:铵盐 (2)含有金属元素的阴离子:MnO4-、AlO2-、Cr2O72-
高中化学竞赛用书推荐 常规/高考类: 化学岛 用户名: 密码:woaihuaxuedao 以下是另一个公邮 icholand. 密码:huaxuedaogongyou 提供公共邮箱的目的还是方便大家交流,如果遇到超出流量限制的问题,可以直接把邮件转发出去。 尽管以前有XX的Gbaopan。。但是貌似很多人并不清楚密码。。 附上: 部分优秀资料帖索引 《高中化学重难点手册》(华中师范大学出版社,王后雄老师主编);历年高考试题汇编(任何一种,最好有详细解析的,比如三年高考两年模拟);《高中化学读本》(很老的人民教育出版社甲种本化学教材,最近有更新版本);《高中化学研究性学习》(龙门书局,施华、盛焕华主编)南师大化科院创办的《化学教与学》每年的十套高考模拟题题型新颖质量比较高,可作为江苏预赛的模拟卷,不少5月份预赛原题就出自本套模拟题。 初赛类: 比较经典的有《化学高考到竞赛》(陕西师范大学出版社,李安主编,比较老);《高中化学奥林匹克初级本》(江苏教育出版社,段康宁主编);《高中化学竞赛初赛辅导》(陕西师范大学出版社,李安、苏建祥主编);《高中化学竞赛热点专题》(湖南师范大学出版社,肖鹏飞、苏建祥、周泽宇主编,版本比较老,但编排体系不错);最新奥林匹克竞赛试题评析·高中化学》(南京师范大学出版社,马宏佳主编,以历年真题详细解析为主,可作为课外指导);《最新竞赛试题选编及解析高中化学卷》(首都师范大学出版社);《化学竞赛教程》(华东师范大学出版社,三本,王祖浩、邓立新、施华等人编写,适合同步复习),还有一套西南师范大学出版社的《奥林匹克竞赛同步教材·高中化学》(分高一、高二和综合卷,综合卷由严先生、吴先生、曹先生等参加编写,绝对经典),还有浙江大学出版社《高中化学培优教程》AB教程、《金牌教程·高一/二化学》(邓立新主编,南京大学出版社)。江苏省化学夏令营使用的讲义是马宏佳主编的《全国高中化学竞赛标准教程》(东南大学出版社),简明扼要,但由于不同教授编写不同章节,参差不齐;春雨出版的《冲刺金牌·高中化学奥赛辅导》(任学宝主编,吉林教育出版社)、《冲刺金牌·高中化学奥赛解题指导》(孙夕礼主编,吉林教育出版社)。《赛前集训·高中化学竞赛专题辅导》(施华编著,体现他的竞赛培训思维,华东师范大学出版社) 比较新颖的包括浙江大学出版社的林肃浩主编的竞赛系列《高中化学竞赛实战演练》(高一、高二)、《高中化学竞赛解题方法》、《冲刺高中化学竞赛(省级预赛)》、《冲刺高中化学竞赛(省级赛区)》、《高中化学竞赛解题方法》、《决战四月:浙江省高中化学竞赛教程(通向金牌之路)》《金版奥赛化学教程》(高一、高二、·综合)都是近年来体系、选题新颖的竞赛资料,足见浙江省对化学竞赛的重视,端木非常推荐。南京教研室刘江田老师2010年5月份主编的《高中化学竞赛全解题库》(南京大学出版社)选择了近年来省级赛区真题和各地新颖的预赛题,解析详细,适合缺少老师指导的同学参考。 决赛类: 比较经典的有《高中化学奥林匹克高级本》(江苏教育出版社,段康宁主编,完全按照大学的思路);《金牌之路高中化学竞赛辅导》以及配套解题指导书(陕西师范大学出版社,李安主编);《高中化学竞赛决赛辅导》(陕西师范大学出版社,李安、苏建祥主编);《历届国际化学奥林匹克竞赛试题分析》(学苑出版社);《最新国际国内化学奥林匹克竞赛优化解题题典》(吉林教育出版社),还有浙江大学出版社的浙江大学出版社《高中化学培优教程》“专题讲座”,《高中化学奥赛一