
p53基因的30年
基英肽总部2009年11月4日摘自博客作者:riset
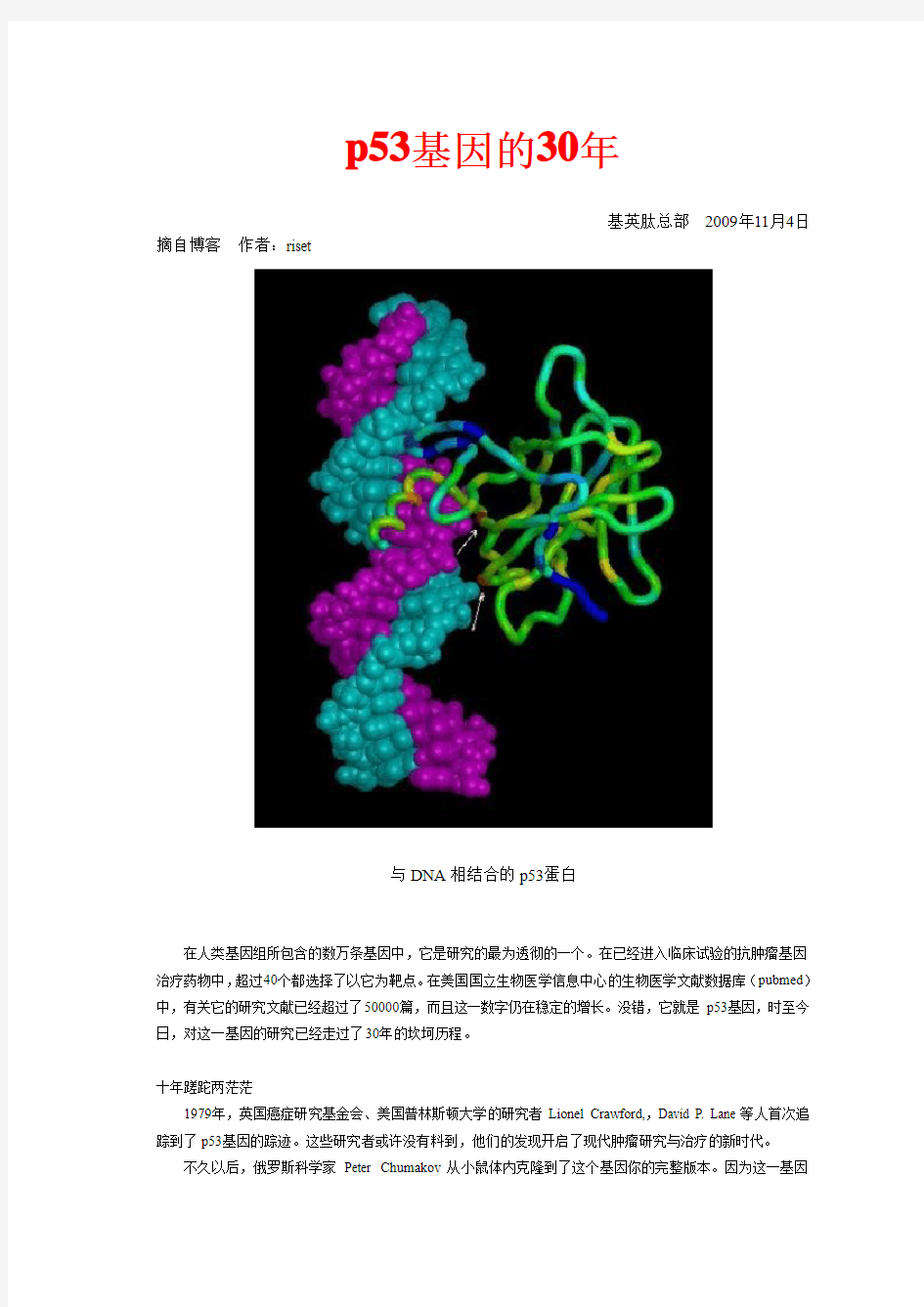
与DNA相结合的p53蛋白
在人类基因组所包含的数万条基因中,它是研究的最为透彻的一个。在已经进入临床试验的抗肿瘤基因治疗药物中,超过40个都选择了以它为靶点。在美国国立生物医学信息中心的生物医学文献数据库(pubmed)中,有关它的研究文献已经超过了50000篇,而且这一数字仍在稳定的增长。没错,它就是p53基因,时至今日,对这一基因的研究已经走过了30年的坎坷历程。
十年蹉跎两茫茫
1979年,英国癌症研究基金会、美国普林斯顿大学的研究者Lionel Crawford,,David P. Lane等人首次追踪到了p53基因的踪迹。这些研究者或许没有料到,他们的发现开启了现代肿瘤研究与治疗的新时代。
不久以后,俄罗斯科学家Peter Chumakov从小鼠体内克隆到了这个基因你的完整版本。因为这一基因
在细胞中翻译后产生的蛋白质(protein)的分子量为53千道尔顿,故而被命名为p53。
不过,在发现伊始,p53基因并未受到重视,甚至在最初的10年中,p53一直被视为能够诱发肿瘤产生的癌基因。导致这样南辕北辙认识的症结在于科学家在研究时并未找对p53基因的正确版本。众所周知,一条基因由一系列脱氧核糖核酸按照相应的顺序彼此串联而成,如果其中的某个或某些核苷酸发生改变就意味着这条基因发生了突变,而起初研究者拿到的基因就是p53的突变版本,按照这一版本翻译成的蛋白质自然就无法行使正常p53基因的功能。
蹉跎十年之后,美国约翰霍普金斯医学院的分子生物学家Bert V ogelstein最终找到了正确的p53基因,即野生型p53。不但如此,科学家的发现还为这一基因摘掉了癌基因的恶名:与此前认识恰恰相反的是,p53是一个在人体内发挥广泛作用的强有力的抑癌基因。
新桃换旧符
藉由p53真正功能的重新认识,科学家发现了一系列与肿瘤相关的基因。对这些基因的深入挖掘不但让人们对癌症的本质有了更新的了解,而且还为肿瘤的基因治疗奠定了基础。现在科学家已经公认,癌症发生的肇因是由于细胞增殖与凋亡、细胞的分化与抑制、免疫与逃避免疫、血管的生成与抑制以及转移与抑制转移之间的精细平衡被打破的缘故。这些平衡归根结底是癌基因与抑癌基因间的平衡。
然而,平衡的打破并非一蹴而就,因此癌症的发生发展是一个持续时间很长的过程。根据现有的统计数据,大约在50%以上的癌症中都发现有p53基因的突变,如果将癌症的发作比作一列倾倒中的多米诺骨牌,那么p53基因很有可能位居这列骨牌的前列。
在人体这个迄今为止最为复杂的系统中,倘若一个细胞想要改变其现有状态(如从静止到生长分化状态的改变),必须接收到一系列相关指令后,这一过程才能进行。在这其中,p53就扮演了“分子警察”的作用——通过对细胞周期的调控来控制细胞的增殖生长。
譬如,一旦细胞中的DNA发生了损伤,p53发觉后,就会亮出红灯,细胞的增殖过程即会停止,同时召唤出DNA的“修理工”,对受损DNA进行修复,以防不正确的遗传密码错误复制下去。如果DNA的损伤过于严重,无法复原,p53就会下达“死刑”执行令,诱导细胞进入凋亡状态(由基因控制的细胞自主的有序的死亡),提前将不正常的细胞从机体中清除出去。
另外,癌细胞具有增殖效率高、生长速度快的特点,因此在肿瘤实体的生长过程中,需要源源不断的氧气和养分的供应。这些成分的输送通道就是血管。这些血管如此重要,以至于任何一个细胞与其最近的毛细血管的距离不能超过100微米。这些发现促成美国哈佛大学医学院的科学家Judah Folkman提出了“抗血管生成治疗”的假说。巧合的是,科学家发现p53基因能够阻断一种血管生成基因的表达,来抑制肿瘤内部血管的形成。
在由抑癌基因组成的通路和网络中,p53的重要程度就如同大管家一般,因此科学家希望能够通过基因治疗的手段,向癌症患者体内导入正常版本的p53基因来实现抗肿瘤的目的。
自打1990 年,美国国立卫生研究院的Freuch Anderson博士启动了全球第一个真正意义上的基因治疗临床试验以来,已有1000余例基因治疗临床试验获批上马,其中大约70%是针对肿瘤,而p53基因更是成为其中不可或缺的靶点。在我国,深圳赛百诺基因技术有限公司从1998 年开始进行重组腺病毒——p53 抗癌注射液的临床试验,至2003 年完成了全部临床试验,于2004 年1 月获得我国SFDA 批准的新药生产批文,成为世界上第一例正式上市的基因治疗产品。
最熟悉的陌生人
自从p53基因被认定为一种重要的抑癌基因以来,它一直就是焦点中的焦点。1993年,p53还被《科学》
杂志评为当年的明星分子。直到如今,每隔一段时间,国际上就会召开一次以p53为主题的学术例会。有关p53的研究也逐渐从癌症领域发散开来,在其他疾病和生理过程中,也出现了p53长袖善舞的身影。这些发现使之成为分饰多角的最熟悉的陌生人。
例如2007年,美国先进研究所的科学家在《自然》杂志上报告称,他们在小鼠中观察到,一种特定类型的p53突变可能与雌鼠能否怀孕有关。对此新加坡医学生物学研究所的发育生物学家Colin Stewart不无戏谑的评论道:该研究结果意味着,以p53为靶点的抗癌药物可能会有“额外”的效果——“一些药物可能会通过提升p53在子宫中的作用成为有效的助孕剂,而另一些则可能通过阻碍p53发挥功能而成为避孕药。”另外据《自然·医学》杂志的报道,有研究者还发现p53在胰岛素抵抗(insulin resistance)的生理调控过程中发挥了重要作用。
回望p53研究走过的30年,正如美国科学学院院士、资深癌症研究者Arnold J. Levine在一篇有关p53基因的综述中谈到的那样:“p53的研究历史就是一个鲜活的例子,反映了认知的进步是以多么出人意料的方式前行的。科学潮流的变化以及方法学上的突破能够让同一样事物以截然不同的面貌呈现在世人面前。”
第九节P53基因
P53基因象Rb基因,是一种肿瘤抑制基因,例如它的活动终止肿瘤的形成,如果一个
从他(她)的父母那里遗传到P53的一个功能性拷贝,那么他们就易感染癌,并常在成熟
早期的各个组织中发展几个独立的肿瘤,但这条件是罕见的就如所知道Li-fraumeni综合症
那样,然而在大多数肿瘤类型中发现了P53突变,并有助于形成肿瘤的分子活动的复杂网络。
P53基因已被定位于染色体17,在细胞中P53蛋白结合DNA。它依次刺激另一个基因,结果产生细胞之间起分裂作用的P21蛋白——刺激蛋白(cdk2)。当P21和cdk2络合时,细
胞不能通过下一步细胞分裂,突变的P53不能以有效方式长久连结至DNA上,因此P21蛋
白质不会有效地为细胞分裂起到“停止信号“的作用,细胞分裂失控形成肿瘤。借助于小白
鼠为人类癌症阐明癌症生长的分子机理,已采用有力的”基因叩开“工艺。确存在P53所有
正常功能大量的信息量及它在人类癌症中的突变表达,大量反映它在人类癌症发病机制中起关键作用的信息。P53恰是一种达到肿瘤形成顶点的网络事件中的一种成分。
图示:在第17条染色体上P53基因表达
一.细胞的保护者
人体的细胞面临着种种危险,其中包括化学物质、病毒、以及电离辐射。如果细胞在某些对于他们来说敏感的地方遭受这些侵袭者带来的损害,后果将不堪设想。举例来说,如果某些重要的调节因子被损坏了,这将会阻遏对细胞生长的正常调节,细胞将会快速增殖而形成肿瘤。p53肿瘤抑制因子则是对付这些肿瘤形成的防护体系之一。p53肿瘤抑制因子的表达在平时处于较低水平,而当细胞感觉到DNA受到损伤时,p53的表达水平就会上升并采取保护措施。当p53结合在基因组中许多的调节位点上时就开始转录蛋白质,这种蛋白可以阻止细胞分裂直至DNA损伤被修复。或者,当损伤太严重时,p53就会启动程序性细胞死亡的过程(或细胞凋亡),这种过程可以使细胞自我消亡,永远的除去损伤。
局部的结构
p53肿瘤抑制因子是一个由四条相同蛋白质链构成的易变形的分子。这些易变形的分子是很难通过X射线晶体学的方法进行研究的,因为他们不形成结构有序的晶体,并且如果他们能形成晶体的话,实验得到的图像通常也是很模糊的。因此,p53常通过除去易变形的区域,形成部分稳定结构从而进行局部的研究。这些紧凑、球状的蛋白质中的三个被称为“域”的蛋白已经被研究了。位于p53中央的是一个四聚物化的域(蛋白质编号1olg),这个域把四条链连在了一起。在每条链上还有一个长而易变形的域可连接到第二个稳定的域:巨大的DNA结合域(蛋白质编号1tup),富含精氨酸残基并可与DNA相互作用。这个域可以识别DNA上特定的调节位点。第三个被研究的域是交换激活域(蛋白质编号1ycq),位于每一臂接近末端的位置,这个域可以激活DNA的阅读机制。
p53和癌症
正如你可能从他的名字猜测而知,p53肿瘤抑制因子在保护你的身体远离癌症方面起到了一个核心作用。癌细胞通常包括两种形式的变异:一种变异可导致细胞失控生长和增殖,另一种变异可阻遏用来抵制不正常生长的防御。p53就属于这第二种,并且在p53上的变异可导致将近半数的人类癌症。大多数的这些突变是错义突变,它可以改变DNA一个位点上的信息,导致细胞产生错误的p53基因,使蛋白质链上某位点被错误的氨基酸所替换。在这些突变中,p53的正常功能被阻遏了从而在受损细胞中蛋白质也不能停止复制。如果这个细胞还有其他导致失控增殖的突变,那么最终将导致肿瘤。
2006-7-21 12:10
回复
牌子→班尼路
2楼二.环抱 DNA
P53肿瘤抑制因子用它全部的四条臂与DNA结合。整个分子典型的连接位点由三部分组成:一个可与p53两个域结合的特殊结合位点,一个由0到13个碱基对组成的可变结构,和一个与p53另外两个域结合的第二个特殊结合位点。在这张展示的图片中(蛋白质编号1tup, 1olg and 1ycq)两个p53域与接近顶部的DNA链相结合,另两个与接近底部的相同位置结合。四聚物化的域位于螺旋的后面,将全部四个臂相接,而四个交换激活域沿着DNA螺旋延伸,准备激活相邻的蛋白质而参与读取DNA。将全部四条链相接的易变分子使p53可以与许多不同的结合位点结合,使他可以在基因组中的许多地方调节转录过程。
2006-7-21 12:12
回复
牌子→班尼路
3楼三.探索结构
大多数导致癌症的p53基因的变异存在于DNA结合域上。通过使用(蛋白质编号1tup)你可以看到其中最常见的变异。这个蛋白质编号中包括DNA结合域的三个拷贝;只有一个(文中所谓的B链)可以在这里看到。这些变异存在于蛋
0白质的DNA结合侧的内部或周围。这个最常见的变异改变了精氨酸248,这里被标成红色。请注意这个突变是怎样迂回地进入DNA(标记成蓝色和绿色)的小沟,从而形成强有力且稳定的相互作用。当变异发生在另一个氨基酸时,这种相互作用便消失了。其他主要的变异位点被标记为粉红色,包括精氨酸残基175,249,273,282和甘氨酸245。其中的一些氨基酸直接与DNA接触,剩余的氨基酸则参与定位其他的与DNA结合的氨基酸。
P53基因 人體抑癌基因。該基因編碼一種分子量為53kDa的蛋白質,命名為P53。p53基因的失活對腫瘤形成起重要作用。但是事物必然有它的兩個方面,p53是一個重要的抗癌基因使癌細胞自殺,防止癌變;還具有幫助細胞基因修復缺陷的功能。 這種功能對於受化療藥物作用而受傷的癌細胞,則起修復作用,而不是使癌細胞自殺。造成被修復的癌細胞在治療後成為新的腫瘤。 編碼53kDa的蛋白質 類型人體抑癌基因 功能防止癌變,修復缺陷 基因種類腫瘤抑制 1簡介編輯 p53是一種腫瘤抑制基因(tumor suppressor gene)。在所有惡性腫瘤中,50%以上會出現該基因的突變。由這種基因編碼的蛋白質(protein)是一種轉錄因數(transcriptional factor),其控制著細胞週期的啟動。許多有關細胞健康的信號向p53蛋白發送。關於是否開始細胞分裂就由這個蛋白決定。如果這個細胞受損,又不能得到修復,則p53蛋白將參與啟動過程,使這個細胞在細胞凋亡(apoptosis)中死去。有p53缺陷的細胞沒有這種控制,甚至在不利條件下繼續分裂。像所有其它腫瘤抑制因數一樣,p53基因在正常情況下對細胞分裂起著減慢或監視的作用。細胞中抑制癌變的基因“p53”會判斷DNA變異的程度,如果變異較小,這種基因就促使細胞自我修復,若DNA變異較大,“p53”就誘導細胞凋亡。 p53是重要的腫瘤抑制基因,自從該基因在1979年被首次報導以來,有關研究論文在Medline上可查到20000餘篇。人們最初認為p53基因是一種癌基因,但隨著近十年研究的深入,p53作為抑癌基因的功能逐漸被揭示出來。在人類50%以上的腫瘤組織中均發現了p53基因的突變,這是腫瘤中最常見的遺傳學改變,說明該基因的改變很可能是人類腫瘤產生的主要發病因素。 p53基因突變後,由於其空間構象發生改變,失去了對細胞生長、凋亡和DNA 修復的調控作用,p53基因由抑癌基因轉變為癌基因。 p53介導的細胞信號轉導途徑在調節細胞正常生命活動中起重要作用,它與細胞內其它信號轉導通路間的聯繫十分複雜,其中p53參與調控的基因已超過160種,因此,Levine 等學者提出了p53基因網路的概念: 他們認為不能孤立地觀察各個基因的生物學功能,而應該將它們組合起來看待。 p53蛋白主要分佈於細胞核漿,能與DNA特異結合,其活性受磷酸化、乙醯化、甲基化、泛素化等翻譯後修飾調控。正常p53的生物功能好似“基因組衛士(guardian of the genome)”,在G1期檢查DNA損傷點,監視基因組的完整性。如有損傷,p53蛋白阻止DNA複製,以提供足夠的時間使損傷DNA修復;
P53基因概述及应用实例 姓名;赵飞 1.P53基因概述 1.1 P53基因的发现 1979年,在大家都在研究SV40病毒的癌蛋白时,好几个科研小组都无意中分别独立发现了P53蛋白。当时在伦敦癌症研究所(London Research Institute)工作的David Lane和Lionel Crawford发现,用感染了SV40病毒的动物血清与SV40大T抗原发生免疫沉淀反应时能共沉淀下来一个分子量约为53kDa的宿主细胞蛋白。另外三个科研小组也都在1979年同时发表文章报道了同样的结论,他们分别是法国的Pierre May科研小组、美国纽约的Robert Carroll科研小组和英国的Alan Smith科研小组。 1.2P53基因的命名 在这个基因在发现之初,每一个发现它的实验室分别给这种分子量为53 kDa的蛋白质取了各自的名字,并且使用这些名字发表了很多论文,这样就造成极大的混乱。它的真正命名是在1983年在英国牛津举办的第一届国际P53蛋白研讨会上,来自各国的代表专门就这个蛋白的命名进行了讨论。经过一番激烈争论之后,大家一致认为,P53这个名字最为合适,自此被保留下来一直沿用至今。其实P53这个名字根本就不是一个名字,只是因为这个蛋白在SDS聚丙烯酰胺凝胶电泳试验中表现出的分子量大约为53 kDa才因此而得名。后来大家才发现,这个表观分子量其实也只是一个大概的估计,因为该蛋白富含脯氨酸,所以在SDS聚丙烯酰胺凝胶电泳试验中的迁移率偏慢,表现出来的分子量要比它实际的分子量大。该蛋白的实际分子量只有43.7 kDa,而小鼠体内P53蛋白的分子量会更小。 1.3P53 基因的功能 P53基因是因编码一种分子质量为53 kDa 的蛋白质而得名,是一种抗癌基因。其表达产物为基因调节蛋白( P53 蛋白) ,当DNA 受到损伤时表达产物急剧增加,可抑制细胞周期进一步运转。一旦P53 基因发生突变,P53 蛋白失活,细胞分裂失去节制,发生癌变,人类癌症中约有一半是由于该基因发生突变失活。因此说这个基因具有两面性。 1.4 P53基因三十年的发展史 最初10年里,P53一直被视为能够诱发肿瘤产生的癌基因。1979年,英国癌症研究基金会、美国普林斯顿大学的研究者Lionel·Crawford,David·P.·Lane等人首次追踪到了P53基因的踪迹,不久以后,俄罗斯科学家Petet·Chumakov从小鼠体内克隆到了这个基因的完整版本。但此时P53基因并未受到重视,甚至在最初的几年中,一直被视为能够诱发肿瘤产生的癌基因。导致这样南辕北辙认识的症结在于科学家在研究时并未找对P53基因的正确版本。十年之后,美国约翰霍普金斯医学院的分子生物学Bert·Vogelstein最终找到了正确的P53基因,即野生型P53。不但如此,科学家的发现还为这一基因摘掉了癌基因的恶名:与此前认识恰恰相反的是,P53是一个在人体内发挥广泛作用的强有力的抑癌基因。 第二个10年里,科学家发现P53蛋白实际上是一种转录因子,可以胁迫诱导。基于P53真正功能的重新认识,科学家发现了一系列与肿瘤相关的基因。对这些基因的深入挖掘不但
细胞生物学课程作业 聚焦P53基因,30年回顾前世今生P53基因的研究探索历程 学院: 姓名: 专业: 学号:
聚焦P53基因,30年回顾前世今生 ——P53基因的研究探索历程 P53基因是一种肿瘤抑制基因,又称人体抑癌基因。由于该基因编码一种分子量为53kDa的蛋白质,故命名为P53基因。由这种基因编码的蛋白质是一种转录因子控制着细胞周期的启动,许多有关细胞健康的信号向p53蛋白发送,因此p53基因的失活对肿瘤形成起重要作用。如果细胞受损,又不能得到修复,则p53蛋白将参与启动过程,使这个细胞在细胞凋亡中死去。有p53缺陷的细胞没有这种控制,甚至在不利条件下继续分裂。像所有其它肿瘤抑制因子一样,p53基因在正常情况下对细胞分裂起着减慢或监视的作用。细胞中抑制癌变的基因p53会判断DNA变异的程度,如果变异较小,这种基因就促使细胞自我修复,若DNA变异较大,p53就诱导细胞凋亡。 p53基因是迄今为止发现与人类肿瘤相关性最高的基因,在短短的三十多年里,人们对p53基因的认识经历了癌蛋白抗原,癌基因到抑癌基因的三个认识转变,时至今日,人们认识到p53蛋白是p53基因突变的产物,是一种肿瘤促进因子,并探究对其进行临床应用。本文将就P53基因的研究探索历程进行简单综述。 一、p53基因与癌蛋白抗原——10年发现历程 p53蛋白正式记载被发现于1979年。在上世纪70年代,大部分肿瘤研究工作者的注意力都集中在致癌病毒研究领域。联想到DNA病毒也会通过同样的方式(即从宿主细胞中“窃取”癌基因或者自己编码癌基因)致使人或动物患上肿瘤。研究者随即发现DNA致癌病毒也携带有癌基因,不过这些癌基因并不是宿主细胞来源的癌基因,并提出这些由病毒编码的病毒癌基因可以间接导致宿主细胞癌基因过表达,从而导致癌症发生。正是基于这种理论,p53蛋白才第一次被发现。但发现之初研究人员认为它是猴肾病毒40大T抗原的细胞伴侣,即p53蛋白为猴肾病毒的癌蛋白。在发现了p53蛋白后的最初10年里,大家把主要精力都放在了克隆p53基因上。随后,人们又发现其实p53蛋白并非癌蛋白,而是抑癌蛋白,只是在癌症患者体内的p53基因经常会发生突变而已。 二、p53基因与癌基因——10年探究历程 在对p53蛋白开展研究的第二个10年里,研究人员发现了p53蛋白的真正功能。如巴尔的摩发现肿瘤病毒与细胞遗传物质的相互作用,用新的分子生物学理论说明了肿
p53亚型?133p53β促进肿瘤干细胞潜能 摘要 肿瘤干细胞(CSC )是负责形成化疗耐药性和癌细胞转移的细胞。在这里,我们介绍了?133p53β,它是一种TP53基因的剪接变异体,在MCF-7乳腺癌细胞消耗减少的时候,?133p53β能增强MCF-7乳腺癌细胞中的干性。?133p53β刺激关键多能性因子SOX2、OCT3/ 4和NANOG 的表达。同时,在其他具有高转移性的乳腺癌细胞中,侵袭性与肿瘤干细胞潜能增强和TP53剪接体表达增加相关,并且在这些细胞中,SOX2,OCT3/4和NANOG 的表达也受到TP53剪接体的正向调控。利用抗肿瘤药物etoposide 处理MCF-7细胞能够促进肿瘤干细胞形成以及TP53剪接体依赖性的SOX2,OCT3/4和NANOG 表达增强,增加了癌症复发的潜在风险。这项研究表明TP53的一种剪接体能够促进肿瘤干细胞潜能,之前一直认为TP53主要作为肿瘤抑制因子发挥作用,而这项研究提示我们通过这种剪接体的作用,TP53也可以扮演癌基因的角色。 p53通过信号转导途径突变/摄动使得它在肿瘤细胞中的功能的改变以及p53活性的损失是癌症发展的前提。突变型p53被认为在促进入侵中发挥了举足轻重的作用,有利于癌细胞从肿瘤原发部位传播,并最终导致癌细胞转移。最近有报道指出p53在干细胞稳态和多能性的作用。野生型(WT )p53阻止体细胞重编程。而突变型p53能刺激诱导多能干细胞(iPS )的形成。P53的枯竭会显著提高细胞重编程的功效,并促进iPS 细胞的产生。因此,p53基因可能被视为基因组的守护者,对重编程也起到一样的作用。 所有这些功能都与全长p53基因(即,TAp53α亚型)相关。然而,TP53基因通过几个机制编码至少12个不同的生理亚型(TAp53[α,β和γ],?40p53[α,β和γ],?133p53[α,β和γ]和?160p53[α,β和γ]),这几种机制是:替代启动子(TA 和?133亚型)、替代 内含子剪接(内含子2:?40同种型和内含子9: γβα和,亚型)以及替代翻译起始位点(?40和?160亚型)。tap53α亚型是最好的描述并在经典文献中所提到p53一样。基本上,p53的同种型可被分为以下两组:(1)包含激活域的长同种型(TA 和?40);(2)没有激活域的短同种型(?133和?160)。此外,β和γ亚型不包含典型的C-末端寡聚化结构域,但具有未知功能的附加域。 p53同种型在许多过程中改变p53转录活性,如细胞周期进程,细胞程序性死亡,复制性衰老,细胞分化,病毒的复制,和血管生成。重要的是,P53亚型特别是在人类肿瘤中被解除管制。然而,在癌症干细胞(CSC )中p53同种型功能的动态平衡从未被探索。在这里,我们指出?133p53β亚型的确涉及促进癌细胞的干性。?133p53β在人类乳腺癌细胞系中过表达刺激乳腺球形成和关键多能性和干性调节因子的表达(SOX2、OCT3/ 4、NANOG 和CD24/ CD44),但不包括C-MYC 。此外,使用以MDA-MB-231为基础的细胞系进行试验,我们发现?133p53亚型表达的增加与癌细胞转移潜能的提高和非黏附性乳腺球群细胞(mammospheres )的形成有关。最后,将MCF-7和MDA-MB-231细胞与抗癌药物etoposide 利用?133p53依赖性的方法一起培养同样促进细胞干性。因此我们的结果表明,短p53同种型无论任何p53突变都正调节CSC 潜力。因此,野生型TP53,通常被认为是一种肿瘤抑制基因,也可以作为通过D133p53b 表达的癌基因。 结果 p53亚型表达的改变影响mammosphere 的形成
P53基因与癌症和衰老相关性的概述 摘要:p53基因抑制肿瘤是众所周知的,但可能也影响与肿瘤抑制无关的衰老过程。p53对各种应激做出反应,诱导细胞凋亡或阻滞细胞周期,以抑制肿瘤的发展。然而,在非癌衰老过程中p53的作用是复杂的。一方面,p53基因能诱导细胞衰老或凋亡来抑制癌症,但其后果就是加快了衰老。另一面,P53可以减缓生长和减少与生长有关的应激使细胞存活,最终延缓衰老。要想阐明其在衰老过程中的作用,并针对P53或P53转录靶点来治疗癌症和改善衰老,就必须更好地了解p53功能的多样化。 关键词:DNA损伤,细胞生长;细胞衰老;细胞凋亡,无氧酵解 引言:p53基因是一种转录因子,其在哺乳动物中抑制肿瘤的发生已经得到了广泛研究(1→3),但越来越多的证据表明,p53基因也影响衰老过程。但是,p53究竟是怎样影响衰老的还不是很清楚。p53调控大量有致癌作用的基因的转录,包括细胞周期阻滞(P21,GADD45,14-3-3s,RPRM),细胞凋亡(Scotin,killer,FAS,BBC3,PERP,53BP1,BAX,LRDD,PMAIP1),抑制有氧糖酵解(GLUT1,TIGAR,己糖激酶,磷酸甘油酸变位酶),促进氧化磷酸化(OXPHOS)(SCO2,AIF),细胞生长(PTEN,AMPK测试,TSC2,IGF-BP3)(4),以及蛋白质的翻译(sestrins)(5)。P53还具有与转录无关的其他作用,包括调节微RNA加工(6),DNA修复(7),线粒体蛋白存活(8)和核糖体合成(9,10)。因此,p53是维持基因组完整性,调节细胞生长和细胞增殖的关键,是抑制肿瘤的核心(11)。同时,p53通过一个非癌症相关
p53基因 科技名词定义 中文名称:p53基因 英文名称:p53 gene 定义:因编码一种分子质量为53 kDa的蛋白质而得名,是一种抗癌基因。其表达产物为 基因调节蛋白(P53蛋白),当DNA受到损伤时表达产物急剧增加,可抑制细胞周期进 一步运转。一旦p53基因发生突变,P53蛋白失活,细胞分裂失去节制,发生癌变,人 类癌症中约有一半是由于该基因发生突变失活。 人体抑癌基因该基因编码一种分子量为53kDa的蛋白质,命名为P53。p53基因的失活对肿瘤形成起重要作用。但是事物必然有它的两个方面,p53是一个重要的抗癌基因使癌细胞自杀,防止癌变;还具有帮助细胞基因修复缺陷的功能。这种功能对于受化疗药物作用而受伤的癌细胞,则起修复作用,而不是使癌细胞自杀。造成被修复的癌细胞在治疗后成为新的肿瘤。 简介 P53蛋白主要分布于细胞核浆,能与DNA特异结合,其活性受磷酸化、乙酰化、甲级化、泛素化等翻译后修饰调控。正常P53的生物功能好似“基因组卫士(guardian of the genome)”,在G1期检查DNA损伤点,监视基因组的完整性。如有损伤,P53蛋白阻止DNA复制,以提供足够的时间使损伤DNA修复;如果修复失败,P53蛋白则引发细胞凋亡;如果p53基因的两个拷贝都发生了突变,对细胞的增殖失去控制,导致细胞癌变。 P53基因是迄今发现与人类肿瘤相关性最高的基因,在短短的十多年里,人们对P53基因的认识经历了癌蛋白抗原,癌基因到抑癌基因的三个认识转变,现已认识到,引起肿瘤形成或细胞转化的P53蛋白是P53基因突变的产物,是一种肿瘤促进因子,它可以消除正常P53的功能,而野生型P53基因是一种抑癌基因,它的失活对肿瘤形成起重要作用。P53蛋白还分布于线粒体、核仁等结构,并且与细胞骨架有相互作用关系。 P53基因结构及表达 P53基因在人类、猴、鸡和鼠等动物中相继发现后,对其进行了基因定位,人类P53基因定位于17P13.1,鼠P53定位于11号染色体,并在14号染色体上发现无功能的假基因,进化程度迥异的动物中,P53有异常相似的基因结构,约20Kb长,都由
p53与肿瘤 基础医学院07级临床一班陈依然90701114 摘要 p53作为迄今为止发现的与人类肿瘤发生相关性最高的抑癌基因,其研究进展对肿瘤的发生机制研究和临床治疗有重要意义。本文简述了p53的生物特性,并重点介绍了p53与肿瘤发生和治疗的一些关联。 关键词:p53 肿瘤 Abstract p53, known as the most relative cancer suppressor gene today, is significant to mechanism of tumor development and its clinic therapy. In this article, I review the characteristics of tumor-associated gene p53 and its role in mechanism of tumor growth and cancer therapy. Key Words: p53 Tumor 正文 恶性肿瘤是一大类严重威胁人类健康的疾病。p53是迄今为止发现的与人类肿瘤发生相关性最高的抑癌基因,有报道称甚至有50%以上的肿瘤患者存在p53基因的改变。在细胞周期中,正常的p53在DNA损伤或缺氧时活化,使细胞周期停滞于G1/S点,进行DNA修复,如修复失败则活化下游基因使细胞凋亡。这两种功能均有助减少肿瘤发生的可能。 1.p53基因特征 人类p53基因位于17号染色体短臂1区3.1带(17q13.1),全长16-20kb,含11个外显子和10个内含子,分为野生型(wt-p53)和突变型(mt-p53)。wt-p53作为抑癌基因,其功能的改变或缺失与大量不同种类的人类肿瘤细胞有密切关系。wt-p53能整合各种不同的细胞紧急事件的信号,通过转录或非转录途径对这些信号做出包括细胞生长抑制或凋亡在内的不同反应,监视细胞基因组的完整性;mt-p53则不能完成这些功能,甚至成为原癌基因。 wt-p53蛋白是一种分子质量53kd的核内磷酸化蛋白,其半衰期较短。它是一种定位于细胞核中的转录因子,其活性形式为四聚体,自N端起依次为转录激活
p53基因的30年 基英肽总部2009年11月4日摘自博客作者:riset 与DNA相结合的p53蛋白 在人类基因组所包含的数万条基因中,它是研究的最为透彻的一个。在已经进入临床试验的抗肿瘤基因治疗药物中,超过40个都选择了以它为靶点。在美国国立生物医学信息中心的生物医学文献数据库(pubmed)中,有关它的研究文献已经超过了50000篇,而且这一数字仍在稳定的增长。没错,它就是p53基因,时至今日,对这一基因的研究已经走过了30年的坎坷历程。 十年蹉跎两茫茫 1979年,英国癌症研究基金会、美国普林斯顿大学的研究者Lionel Crawford,,David P. Lane等人首次追踪到了p53基因的踪迹。这些研究者或许没有料到,他们的发现开启了现代肿瘤研究与治疗的新时代。 不久以后,俄罗斯科学家Peter Chumakov从小鼠体内克隆到了这个基因你的完整版本。因为这一基因
在细胞中翻译后产生的蛋白质(protein)的分子量为53千道尔顿,故而被命名为p53。 不过,在发现伊始,p53基因并未受到重视,甚至在最初的10年中,p53一直被视为能够诱发肿瘤产生的癌基因。导致这样南辕北辙认识的症结在于科学家在研究时并未找对p53基因的正确版本。众所周知,一条基因由一系列脱氧核糖核酸按照相应的顺序彼此串联而成,如果其中的某个或某些核苷酸发生改变就意味着这条基因发生了突变,而起初研究者拿到的基因就是p53的突变版本,按照这一版本翻译成的蛋白质自然就无法行使正常p53基因的功能。 蹉跎十年之后,美国约翰霍普金斯医学院的分子生物学家Bert V ogelstein最终找到了正确的p53基因,即野生型p53。不但如此,科学家的发现还为这一基因摘掉了癌基因的恶名:与此前认识恰恰相反的是,p53是一个在人体内发挥广泛作用的强有力的抑癌基因。 新桃换旧符 藉由p53真正功能的重新认识,科学家发现了一系列与肿瘤相关的基因。对这些基因的深入挖掘不但让人们对癌症的本质有了更新的了解,而且还为肿瘤的基因治疗奠定了基础。现在科学家已经公认,癌症发生的肇因是由于细胞增殖与凋亡、细胞的分化与抑制、免疫与逃避免疫、血管的生成与抑制以及转移与抑制转移之间的精细平衡被打破的缘故。这些平衡归根结底是癌基因与抑癌基因间的平衡。 然而,平衡的打破并非一蹴而就,因此癌症的发生发展是一个持续时间很长的过程。根据现有的统计数据,大约在50%以上的癌症中都发现有p53基因的突变,如果将癌症的发作比作一列倾倒中的多米诺骨牌,那么p53基因很有可能位居这列骨牌的前列。 在人体这个迄今为止最为复杂的系统中,倘若一个细胞想要改变其现有状态(如从静止到生长分化状态的改变),必须接收到一系列相关指令后,这一过程才能进行。在这其中,p53就扮演了“分子警察”的作用——通过对细胞周期的调控来控制细胞的增殖生长。 譬如,一旦细胞中的DNA发生了损伤,p53发觉后,就会亮出红灯,细胞的增殖过程即会停止,同时召唤出DNA的“修理工”,对受损DNA进行修复,以防不正确的遗传密码错误复制下去。如果DNA的损伤过于严重,无法复原,p53就会下达“死刑”执行令,诱导细胞进入凋亡状态(由基因控制的细胞自主的有序的死亡),提前将不正常的细胞从机体中清除出去。 另外,癌细胞具有增殖效率高、生长速度快的特点,因此在肿瘤实体的生长过程中,需要源源不断的氧气和养分的供应。这些成分的输送通道就是血管。这些血管如此重要,以至于任何一个细胞与其最近的毛细血管的距离不能超过100微米。这些发现促成美国哈佛大学医学院的科学家Judah Folkman提出了“抗血管生成治疗”的假说。巧合的是,科学家发现p53基因能够阻断一种血管生成基因的表达,来抑制肿瘤内部血管的形成。 在由抑癌基因组成的通路和网络中,p53的重要程度就如同大管家一般,因此科学家希望能够通过基因治疗的手段,向癌症患者体内导入正常版本的p53基因来实现抗肿瘤的目的。 自打1990 年,美国国立卫生研究院的Freuch Anderson博士启动了全球第一个真正意义上的基因治疗临床试验以来,已有1000余例基因治疗临床试验获批上马,其中大约70%是针对肿瘤,而p53基因更是成为其中不可或缺的靶点。在我国,深圳赛百诺基因技术有限公司从1998 年开始进行重组腺病毒——p53 抗癌注射液的临床试验,至2003 年完成了全部临床试验,于2004 年1 月获得我国SFDA 批准的新药生产批文,成为世界上第一例正式上市的基因治疗产品。 最熟悉的陌生人 自从p53基因被认定为一种重要的抑癌基因以来,它一直就是焦点中的焦点。1993年,p53还被《科学》
P53的研究进展 摘要:转录调节因子p53作为一种抑癌基因,可诱导细胞生长阻滞,细胞凋亡,细胞分化以及DNA修复。但p53突变体可能会使野生型p53基因的抑癌功能失活,甚至发挥癌基因的功能。随着分子生物学技术的发展,人们对p53基因调控网络有很多新的认识。笔者就p53的调节通路以及在肿瘤治疗方面的新进展进行综述。 关键词: p53基因;肿瘤;细胞凋亡 Abstract:The tumor suppressor gene p53 is a transcription factor that mediates several cellular processesincluding growth arrest, apoptosis, differentiation, and DNA damage repair However, Mutant p53 maycauses wild-type p53 loss above functions With the development of molecular biology, there are some newresearche of p53 pathway The advance of research of p53 pathway and related gene therapy are reviewed Key words:p53 gene;cancer;apoptosis 前言:细胞凋亡是受一系列基因控制的程序化细胞死亡方式,它是通过外源性或内源性的凋亡信号,激活细胞内编码的自杀程序而促发的。早在1964年,就有学者提出程序性细胞死亡的概念,至1972年,这种细胞生理性自杀过程就被正式称为细胞凋亡。目前对细胞凋亡相关基因的研究已成为生命科学的前言和热点。p53 基因对防止细胞增生和保持DNA 受损基因组的完整性有重要作用。且能调控大量的细胞活动,其中p53 基因对细胞凋亡的调控是研究得较多的[1]。p53基因是迄今发现与人类肿瘤相关性最高的基因之一,是当前肿瘤分子生物学研究的热点。转录调节因子p53作为一种抑癌基因,可诱导细胞生长阻滞,细胞凋亡,细胞分化以及DNA修复。自1979年Lane等发现p53基因以来,人们对它的认识经历肿瘤抗原、癌基因、抑癌基因三个阶段。近年的研究已证明,野生型p53基因是一种抑癌基因,对细胞的生长、分化、增殖起调控作用。以下就p53的调控以及作用作一叙述【2】。 1p53的结构特性
P53基因的结构及表达 P53蛋白主要分布于细胞核浆,能与DNA特异结合,其活性受磷酸化、乙酰化、甲基化、泛素化等翻译后修饰调控。正常P53的生物功能好似“基因组卫士(guardian of the genome)”,在G1期检查DNA损伤点,监视基因组的完整性。如有损伤,P53蛋白阻止DNA复制,以提供足够的时间使损伤DNA修复;如果修复失败,P53蛋白则引发细胞凋亡;如果p53基因的两个拷贝都发生了突变,对细胞的增殖失去控制,导致细胞癌变。 P53基因是迄今发现与人类肿瘤相关性最高的基因,在短短的十多年里,人们对P53基因的认识经历了癌蛋白抗原,癌基因到抑癌基因的三个认识转变,现已认识到,引起肿瘤形成或细胞转化的P53蛋白是P53基因突变的产物,是一种肿瘤促进因子,它可以消除正常P53的功能,而野生型P53基因是一种抑癌基因,它的失活对肿瘤形成起重要作用。P53蛋白还分布于线粒体、核仁等结构,并且与细胞骨架有相互作用关系。 P53基因在人类、猴、鸡和鼠等动物中相继发现后,对其进行了基因定位,人类P53基因定位于17P13,鼠P53定位于11号染色体,并在14号染色体上发现无功能的假基因,进化程度迥异的动物中,P53有异常相似的基因结构,约20Kb长,都由11个外显子和10个内含子组成,第1个外显子不编码,外显子2、4、5、7、8、分别编码5 个进化上高度保守的结构域,P53基因5个高度保守区即第13~19、117~142、171~19 2、236~258、270~286编码区.P53基因转录成
2.5KbmRNA,编码393个氨基酸蛋白,分子量为4 3.7KD,P53基因的表达至少受转录及转录后二种水平的调控.在停止生长或非转化细胞 中P53mRNA水平很低,但刺激胞液后mRNA显著增加.持续生长的细胞,其mRNA 水平不随细胞周期而出现明显变化,但经诱导分化后mRNA 水平降低,部分是转录后调控.P53基因的转录由P1、P2二个启动子控制.P1启动子位于第一外显子上游100~250bp,P2位于第一内含子内,在启动子中包含1个NF1蛋白结合位点和一个转录因子AP1相关蛋白的结合位点,对正常P53基因的转录,不仅需要二个启动子的平衡作用,而且P53 基因内含子也起作用,如内含子中有正调控作用,其调控有组织特异性. P53 基因位于人类17号染色体含11 个外显子,其转录翻译编码的野生型P53 蛋白由393个氨基酸残基组成,包含多个功能域。N-末端的转录激活结构域(activtiondomain, AD)AD1,AD2位于氨基酸 1-50位,与通用转录因子TF11D 结合而发挥转录激活功能。TF11D 是由TBP(TATAbinding protain)和TAF(TBP associatedfactor)结合而成的复合物,P53与TF11D中的TAF结合,作用于下游基因启动子中的TATA box ,达到转录激活功能。P53基因生长抑制结构域位于氨基酸65-90 位,富含脯氨酸,含5重复的pxxp序列,可与含SH3 结构域的蛋白质相互作用,将P53与信息传递途径连接起来。 P53 基因还有:序列特异的DNA结合结构域,位于氨基酸100-300位间;核定位信号NLS位于氨基酸残基316-325;四聚体寡聚化结构域,定位于氨基酸残基334-356;C-末端非专一DNA调节结构域,同时在碰到DNA损伤时,P53 可能补充其它蛋白质到损伤部位,提供DNA损伤信号。P53 与DNA的结合能力并非特异性地与DNA 结合,参与核心区与DNA 结合的别构调节,同时在碰到DNA损伤时,P53可能补充其他蛋白质到损伤部位,提供DNA损伤信号。
2、试剂和耗材 QIAamp?DNA Blood Mini Kit(GIAGEN,德国) Platinum?Taq DNA Polymerase High Fidelity(Invitrogen,11304-102) Nuclease-Free Water(Promega,P1195) d NTP Mix(Promega,P151B) PCR引物:北京博迈德科技有限公司合成 DNA分子定量标准:DL10000 DNA Marker(TAKARA,大连宝生物) PCR产物回收纯化试剂盒(BioSpin GelExtraction kit,日本Bioer技术有限公司) 0.5~10 μl、2~20 μl、20~200 μl、200~1000 μl吸头(美国Axygen,公司) EP管 3、仪器 Tannon1600R凝胶成像系统分析仪(上海天龙公司); Eppendorf 5417R高速冷冻离心机(Eppendorf公司,德国) Allegra 6R离心机(Beckman-Coulter公司,美国) MVS-1型涡旋混合器(北京北德科学仪器厂) 移液器2 μl、10 μl、50 μl、200 μl、1000μl(Eppendorf公司,德国)Ⅱ级生物安全柜NU425-400E(NEWAIR公司,美国) X-15R高速冷冻离心机(BECKMAN COULTER公司,美国) Eppendorf Mastercycter PCR仪(Eppendorf 公司德国) 电泳仪:Universal 024BR(Bio-Rad公司,美国) 电热恒温水浴器(北京来亨科贸有限责任公司) 凝胶成像分析系统:Tocan240全自动凝胶成像系统(中国) 测序仪:GenomeLab CEQ/GeXP(BECKMAN COULTER公司,美国)20μl、200μl和1000μl加样器(吉尔森公司,法国) 旋涡震荡器(Scientific Industries公司,美国) 二、实验方法 1、样品采集,送检和保存
P53综述 刘仍允(2006年5月) 仅从90年代至今,关于p53作为肿瘤抑制因子的研究报道就有多于20000篇,是什么让p53得到科学界如此多的关注?在27年前(1979年),p53首次被发现。在上世纪80年代,TP53(p53的编码基因)被认为是一个原癌基因(proto-oncogene),直到90年代早期,TP53被广泛认为是一个肿瘤抑制基因,它处在细胞各种胁迫反应途径的十字路口上。p53在细胞周期捕获,DNA修复,细胞衰老、分化、调亡等过程中都起着重要的作用,它能修复损伤细胞,或者除去严重损伤的细胞从而避免这些细胞对机体的危害作用。由于p53的多功能性,在它的编码基因TP53上发现很多突变都会影响到p53的功能。在很多(75%)人的癌症中都存在p53的突变。有关p53的研究已经拓展到毒物学和治疗学领域。 P53基因是迄今发现与人类肿瘤相关性最高的基因。在短短的十多年里,人们对P53基因的认识经历了癌蛋白抗原,癌基因到抑癌基因的三个认识转变,现已认识到,引起肿瘤形成或细胞转化的P53蛋白是P53基因突变的产物,是一种肿瘤促进因子,它可以消除正常P53的功能,而野生型P53基因是一种抑癌基因,它的失活对肿瘤形成起重要作用。 一、P53基因结构及表达 P53基因在人类、猴、鸡和鼠等动物中相继发现后,对其进行了基因定位,人类P53基因定位于17P13.1,鼠P53定位于11号染色体,并在14号染色体上发现无功能的假基因,进化程度迥异的动物中,P53有异常相似的基因结构,约20Kb长,都由11个外显子和10个内含子组成,第1个外显子不编码,外显子2、4、5、7、8、分别编码5个进化上高度保守的结构域,P53基因5个高度保守区即第13~19、117~142、171~19 2、236~258、270~286编码区。P53基因转录成2.5KbmRNA,编码393个氨基酸蛋白,分子量为53KD,P53基因的表达至少受转录及转录后二种水平的调控。在停泊生长或非转化细胞中P53mRNA水平很低,但刺激胞液后mRNA显著增加.持续生长的细胞,其mRNA水平不随细胞周期而出现明显变化,但经诱导分化后mRNA水平降低,部分是转录后调控。P53基因的转录由P1、P2二个启动子控制.P1启动子位于第一外显子上游100~250bp,P2位于第一内含子内,在启动子中包含1个NF1蛋白结合位点和一个转录因子AP1相关蛋白的结合位点,对正常P53基因的转录,不仅需要二个启动子的平衡作用,而且P53基因内含子也起作用,如内含子中有正调控作用,其调控有组织特异性。 二、P53基因产物及功能 P53蛋白N一端为酸性区1~80位氨基酸残基,C-端为碱性区319~393位氨基酸残基,正常的P53蛋白在细胞中易水解,半衰期为20分钟,突变性P53蛋白半衰期为1.4~7小时不等,P53蛋白N端有一个与转录因子相似的酸性结构域,与GAL4的DNA结合区重组时,融合蛋白能激活GAL4操纵子转录,激活功能定位在P53第20~40位密码子,P53 细胞定位及反式激活功能提示,P53蛋白可能直接或通过与其他蛋白作用参与转录控制。 P53蛋白的DNA结合作用及反式激活作用还提示其参与细胞生长调控。通过流式细胞仪测定单个细胞的细胞周期中P53的表达,发现激活的淋巴细胞比未激活者有较多的P53表达,而且随细胞从G1至S期再到G2,M期而增加,提示P53表达与细胞生长的相关性比进入细胞周期或周期中特定时刻为高。以编码反义P53RNA的质粒转染非转化细胞导致细胞生长完全停止,P53抗体注入将进入生长周期的静止细胞。可抑制细胞入S 期,提示P53可能为Go/G1-S转换所必需,但P53抗体对细胞从分裂至S期无作用,G1期细胞有抑制作用的二丁酸钠也抑制P53合成,这些结果提示P53对细胞生长调控作用至少表现在从G0-G1,或G1-S,但其作用机理尚未弄清楚。目前认为,P53蛋白可通过调控Cipt基因表达而调控细胞生长,即P53蛋白可刺激Cipt基因产生分子量为21KD的蛋白,这种蛋白能够有效抑制某些促使细胞通过细胞周期进入有丝分裂的酶活性,从而抑制细胞生长,此外,