常见无机物的俗名
第三部分常见无机物及其应用 元素化合物的知识是化学基本概念、基本理论、化学实验、化学计算的载体和核心。将元素化合物的知识系统化、结构化是学习本部分内容的一个好方法;从多个角度来认识元素化合物能更全面更深刻地理解元素化合物。 异。了解Na+、K+离子的检验方法。 铝单质及其重要化能说出铝的重要化合物的物理性质;认识铝的主要 化学性质(与氧气、酸、强碱反应);认识氧化铝和 氢氧化铝的两性;认识氢氧化铝的制备原理及加热 分解的性质; 化学 第一、二、三节 一、知识整理 1.常见金属元素的位置和物理通性 (1)元素在周期表中的位置 (2)金属材料的物理通性 常用的金属材料主要有金属和合金两类,它们具有如下的物理通性:①金属具有金属光泽;②金属具有导电性;③金属具有导热性;④金属具有良好的延展性。
2.比较金属性强弱的方法 元素金属性的本质是指元素的原子失电子能力。它取决于金属的原子半径、核电荷数、最外层电子数等因素。可以从以下几个方面来比较元素金属性强弱: (1)根据金属的原子结构; (2)根据元素在周期表中的位置; (3)根据最高价氧化物对应水化物的碱性强弱; (4)根据与氧气反应的难易; (5)根据与水反应的条件难易; (6)根据与非氧化性酸反应的剧烈情况; (7)根据金属间发生的置换; (8)根据原电池反应,做负极的金属比做正极的金属活泼。 3.金属活动性顺序的应用 在金属的复习中,充分发挥金属活动性顺序表在金属及化合物知识整合方面的功能对提高复习的实效性极为有利。 金属与氧气反应 常温极易氧 化,燃烧产生过氧化物或超氧化物 常温形成氧膜,点燃剧烈反应 常温与氧气缓慢 反应,高温下Fe 可在纯氧中燃烧 铜加热与氧化合,余难反应Mg 加热反铁与水蒸气反应 二、重点知识解析 1.钠及其钠的化合物 (1)钠及其钠的化合物的知识体系
无机颜色表 含部分元素化合物常温下物态、颜色、形态等物理化学性质 卤族(英VIIA): Solid:I2 紫黑;ICl 暗红;IBr 暗灰;IF3 黄色;ICl3 橙;I2O5 白; I2O4 黄(离子晶体);I4O9 黄(离子晶体). Liquid:Br2 红棕;BrF3 浅黄绿;IBr3 棕;Cl2O6暗红;Cl2O7 无色油状;HClO4 无色粘稠状;(SCN)2 黄色油状. Gas:F2 浅黄;(CN)2无色;Cl2 黄绿;I2(g) 紫;BrF 红棕;BrCl 红;Cl2O 黄红;ClO2 黄色;Br2O 深棕;(SCN)n 砖红色固体. 氧族(英VIA): Solid:S 淡黄;Se 灰,褐;Te 无色金属光泽;Na2S,(NH4)2S,K2S,BaS 白,可溶;ZnS 白↓;MnS 肉红↓;FeS 黑↓;PbS 黑↓;CdS 黄↓;Sb2S3 橘红↓;SnS 褐色↓;HgS 黑(沉淀),红(朱砂);Ag2S 黑↓;Cu S 黑↓;Na2S2O3 白;Na2S2O4 白; SeO2 白,易挥发;SeBr2 红;SeBr4 黄;TeO2 白加热变黄;H2TeO3 白;TeBr2 棕;TeBr4 橙;TeI4 灰黑;PoO2 低温黄(面心立方),高温红(四方);SO3 无色;SeO3 无色易潮解;TeO3 橙色;H6TeO6 无色. Liquid:H2O 无色;纯H2O2 淡蓝色粘稠;CrO(O2)2(aq) 蓝;纯H2SO4 无色油状;SO32-(aq) 无色;SO4 2-(aq) 无色;SeO2(l) 橙;TeO2(l) 深红. Gas:O2 无色;O3 低浓度无色,高浓度淡蓝(鱼腥味);S2(g) 黄,上浅下深;H2S 无色;SO2 无色;H2Se 无色;H2Te 无色. 卤化硫(未注明者均为无色): Liquid:SF6;S2F10;SCl4 淡黄;SCl2 红籗2Cl2 无色;S2Br2 红. Gas:SF4;SF2;S2F2. 卤砜、卤化亚砜、卤磺酸: Liquid:SOCl2 白色透明;SO2Cl2 无色发烟. 氮族(英VA): Solid:铵盐无色晶体;氮化金属白;N2O3 蓝色(低温);N2O5 白;P 白,红,黑;P2O3 白;P2O5 白;P Br3 黄;PI3 红;PCl5 无色;P4Sx 黄;P2S3 灰黄;P2S5 淡黄;H4P2O7 无色玻璃状;H3PO2 白;As 灰;As2O3 白;As2O5 白;AsI3 红;As4S4 红(雄黄);As4S6 黄(雌黄);As2S5 淡黄;Sb 银白;Sb(OH)3 白↓;Sb2O3 白(锑白,颜料);Sb2O5 淡黄;SbX3(X<>I) 白;SbI3 红;Sb2S3 橘红↓;Sb2S5 橙黄;Bi 银白略显红;Bi2O3 淡黄;Bi2O5 红棕;BiF3 灰白;BiCl3 白;BiBr3 黄;BiI3 黑↓;Bi2S3 棕黑. Liquid:N2H4 无色;HN3 无色;NH2OH 无色;发烟硝酸红棕;NO3^-(l)无色;王水浅黄,氯气味;硝基苯黄色油状;氨合电子(液氨溶液) 蓝;PX3 无色;纯H3PO4 无色粘稠状;AsX3(X<>I) 无色;. Gas:N2 无色;NH3 无色;N2O 无色甜味;NO 无色;NO2 红棕;PH3 无色;P2H6 无色;AsH3 无色;SbH 3 无色;BiH3 无色. 卤化氮(未注明者均为无色): Solid:NBr3?(NH3)6 紫,爆炸性;NI3?(NH3)6 黑,爆炸性; Liquid:NCl3;无色 Gas:NF3;无色 碳族(英IVA): Solid:C(金刚石) 无色透明;C(石墨) 黑色金属光泽;Si 灰黑色金属光泽;Ge 灰白;Sn 银白;Pb 暗灰;SiO2 无色透明;H2SiO3 无色透明胶状↓;Na2SiF6 白晶;GeO 黑;GeO2 白;SnO 黑;SnO2 白;Sn(OH) 2 白↓;PbO黄或黄红;Pb2O3 橙;Pb3O4 红;PbO2 棕;CBr4 淡黄;CI4 淡红;GeI2 橙;GeBr2 黄;Ge
呋喃唑硐(痢特灵)盐酸吗啉呱(ABOB) 呋塞米(速尿)肾上腺色腺(安络血) 醋酸甲荼氢醌(K4)醋酸泼尼松(强的松) 甲巯咪唑(他巴唑)马来酸氯苯那敏(扑尔敏) 格列本脲(优降糖)苯丙氨酯(强筋松) 吡罗昔康(消痛喜康)普乐安(前列康) Vic B2(核黄素)复方磺胺甲恶唑(百炎净) 曲克芦丁(维脑路通)硝酸异山梨脂(消心痛) 普萘洛尔(心得安)螺内脂(安体舒通) 维拉帕米(异博定)氢氯噻嗪(双克) 双密达莫(潘生汀)硝苯地平(心痛定) 醋酸甲羚孕酮(黄体酮)吡拉西坦(脑复康) 昆明山海棠(火把花根)吲哚美辛(消炎痛) 维生素E(生育酚)三磷酸腺苷(ATP) 葡醛酸钠(肝太乐)盐酸吡硫醇(脑复新) 复方亚油乙酯(脉通)复方毛冬青氯贝酸铝(心脉宁) 复方吡啦西坦脑蛋白水解物(康脑灵)盐酸溴已新(必嗽平)枸椽酸他莫昔芬(三苯氧氨)枸椽酸氯米芬(克罗米芬) 已浠雌酚(卵巢素)硫酸沙丁胺醇(硫酸舒喘灵) 复方甘草浙贝氯化铵(刻停)鼠李铋镁(乐得胃) 庆大霉素普鲁卡因(胃炎)阿魏酸哌嗉(保肾康) 盐酸多西霉素(强力霉素)盐酸多塞平(多虑平) 米康甾醇(牙周宁)盐酸苯海索(安坦片) 氨甲苯酸(止血芬酸)曲安奈德(康宁克酮) 头孢唑林钠(先锋5)硫酸软骨素(康得灵) 羧甲司坦(化痰片)酚氨咖敏(咳感敏) 磷酸苯丙哌林片(咳快好)炔诺酮(妇康片) 复方乙酸水杨酸(APC)枸椽酸喷托维(咳必清) 炔诺酮滴(探亲避孕药)溴丙胺太林(普鲁苯辛) 复方氢氧化铝(胃舒平)复方铝酸铋(胃必治) 果胶铋(维敏)地高辛(强心素)
苯妥英钠(奇非宁)卡马西平(痛可灵) 舒必利(止呕灵)阿司匹林(巴米尔) 盐酸普罗帕酮片(心律平)丙酸氯倍他索软膏(恩肤霜) 复方磺胺氧化锌软膏(双氧膏)甲硝唑(灭滴灵) 人工牛黄甲硝唑(牙痛安)哈酴德乳膏(氧氟舒松) 茶碱麻黄碱片(息喘灵)固肠止泻丸(结肠炎丸) 酚酞片(果导片)联苯卡唑乳膏(治癣必妥) 甲硝唑芬布芬胶囊(牙周康)盐酸苯乙双胍片(降糖灵) 对乙酰氨基酚片(扑热息痛片)盐酸小檗碱片(黄连素片) 乳酸依沙吖啶溶液(利凡诺、黄药水)壬苯醇醚栓(妻之友) 莫匹罗星软膏(百多邦)双氯芬酸钠缓释胶囊(英太青) 苯海拉明(苯那君)维生素B2(核黄素) 三维B片(维乐生片)咽康含片(咽特佳) 复方氯已定含漱液(口泰)樟脑水含氯(牙痛水) 参阳胶囊(前德安)高锰酸钾(PP粉) 小儿复方磺胺嘧碇散(小儿安)盐酸特比荼芬乳膏(兰美抒) 硝酸益康唑软膏(癣敌)复方颠茄铋镁片(陈香露白露) 盐酸吗啉胍片(病毒灵)诺氟沙星胶囊(氟派酸、NFC) 阿司匹林(APC、乙酰水杨酸)异烟肼片(雷米封) 叶酸(维生素M)维生素B12(氯钴铵) 硫糖铝(胃溃宁)复方次哨酸铋(胃得乐、胃速乐、胃乐) 普萘洛尔-心得安阿替洛尔-胺酰心安硝酸异山梨酯-消心痛 硝苯地平-心痛定曲克芦丁-维脑路通氢氧化铝-胃舒平 沙丁胺醇-舒喘灵醋酸甲羟孕酮-安宫黄体酮甲氧氯普胺-胃复安(灭吐灵) 甲硝唑-灭滴灵去甲肾上腺素-正肾素肾上腺素-副肾素 15AA-肝安9AA-肾安消旋山莨菪碱-6542
江苏省苏州中学2009-2010学年度第一学期期中考试 高一物理 本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两卷,满分100分,考试时间90分钟。第Ⅰ卷将正确的选项填涂在答题卡相应位置上,第Ⅱ卷直接做在答案专页上。 第Ⅰ卷(选择题,共36分) 一.单项选择题(以下各题只有一个答案正确) 1.下列说法正确的是: A.加速度增大,速度一定增大B.速度变化量越大,加速度就越大 C.物体有加速度,速度就增大D.物体加速度很大,速度可能为零 2.小李讲了一个龟兔赛跑的故事:龟、免从同一地点出发,发令枪响后龟缓慢地向终点跑去,直至到达终点,兔自恃跑得快,让龟跑了一段时间后才开始跑,当它超过龟后便在路旁睡起觉来,醒来一看,龟已接近终点了,于是便奋力追去,但最终还是让龟先到达了终点,据此,我们可以将龟兔赛跑的运动过程用位移一时间图象来表示,在下图中正确的是 3.如图所示,物体相对静止在水平传送带上随传送带同向匀速运动。它受到的力是 A.重力、弹力、静摩擦力 B.重力、弹力 C.重力、弹力、滑动摩擦力 D.重力、滑动摩擦力 4.如图所示,质量为10kg的物体在水平面上向右运动,此时受到水平向右外力作用F=20N,物体与平面之间的动摩擦因数为,则物体受到的合力是(g=9.8m/s2) A.20N,水平向右 B.,水平向左 C.,水平向右 D.,水平向右 二.多项选择题(以下各题有两个或两个以上答案正确)5.下列情况中的物体,哪些可以看作质点 A.研究从北京开往上海的一列火车的运行速度 B.研究汽车后轮上一点运动情况 C.体育教练员研究百米赛跑运动员的起跑动作 D.研究地球公转时的地球v F
常用药品别名大全 普萘洛尔-心得安阿替洛尔-胺酰心安 硝酸异山梨酯-消心痛硝苯地平-心痛定 曲克芦丁-维脑路通沙丁胺醇-舒喘灵 醋酸甲羟孕酮-安宫黄酮甲氧氯普胺-胃复安(灭吐灵) 甲硝唑-灭滴灵肾上腺素-副肾素 消旋山莨菪碱-6542 喷托维林-咳必清 诺氟沙星-氟哌酸呋喃唑酮-痢特灵 洛贝林-山梗菜碱尼可刹米-可拉明 拉米夫定-贺普丁吲哚美辛-消炎痛 吡罗昔康-炎痛喜康复方氨基比林-安痛定 去痛片-索密痛酚氨咖敏-扑感敏 利巴韦林-病毒唑小檗碱-黄连素 乙酰谷酰胺-醋谷胺罗痛定-颅痛定 氨咖黄敏胶囊-速效伤风胶囊苯海索-安坦 苯妥英纳-大伦丁苯巴比妥钠-鲁米那 吡硫醇-脑复新吡拉西坦-脑复康 酚妥拉明-利其丁桂利嗪-脑益嗪 去乙酰毛花苷-西地兰D 普罗帕酮-心律平 倍他司汀-培他啶 卡托普利-巯甲丙脯酸 复方甘草合剂-棕色合剂 复方愈创木酚磺酸钾-非那根合剂 碳酸氢钠-小苏打 西咪替丁-甲氰咪胍 干酵母-食母生 多潘立酮-吗丁啉 酚酞-果导 葡醛内酯-肝泰乐 复方甘草酸单胺-强力宁 氢氯噻嗪-双克 呋塞米-速尿 螺内酯-安体舒通 缩宫素-催产素 肾上腺色综-安络血 氨甲苯酸-止血芳酸 酚磺乙胺-止血敏 亚硫酸氢纳甲萘醌-维生素K3 硫酸氢钠甲萘醌-维生素K4 叶绿醌-维生素K1 利血生-利可君 双嘧达莫-潘生丁 异丙嗪-非那根
氯苯那敏-扑尔敏 地塞米松-氟米松 泼尼松龙-强的松龙 泼尼松-强的松 氢化可的松-皮质醇 曲安奈德-康宁克通 丙酸睾丸素-丙酸睾酮 甲基睾丸素-甲睾酮 己烯雌酚-乙底酚(求偶素) 氯米芬-克罗米芬 格列本脲-优降糖 苯乙双胍-降糖灵 甲巯咪唑-他吧唑 丙基硫氧嘧啶-丙噻优 多柔比星-阿霉素 表柔比星-表阿霉素 他莫昔芬-三苯氧胺 地芬尼多-眩晕停 亚叶酸钙-甲酰四氢叶酸钙 维生素C-抗坏血酸 氯化钠-生理盐水(N.S) 葡萄糖-G.S 氯化钠葡萄糖-G.N.S 地西泮-安定 艾司唑仑-舒乐安定 氯硝西泮-氯硝安定 咪达唑仑-力月西(咪唑安定) 可待因-甲基吗啡 布桂嗪-强痛定 哌替啶-杜冷丁 汞溴红溶液-红药水 过氧化氢-双氧水 高锰酸钾粉-P.P粉 乙酰唑胺-醋氮酰胺 阿米卡星-丁胺卡那霉素 苄星青霉素-长效青霉素 头孢噻吩-先锋1号 头孢噻啶-先锋2号 头孢拉定-先锋6号 头孢氨苄-先锋4号 头孢唑林纳-先锋5号 头孢羟氨苄-先锋9号 头孢哌酮-先必锋 复方磺胺甲恶唑-复方新若明(SMZ)
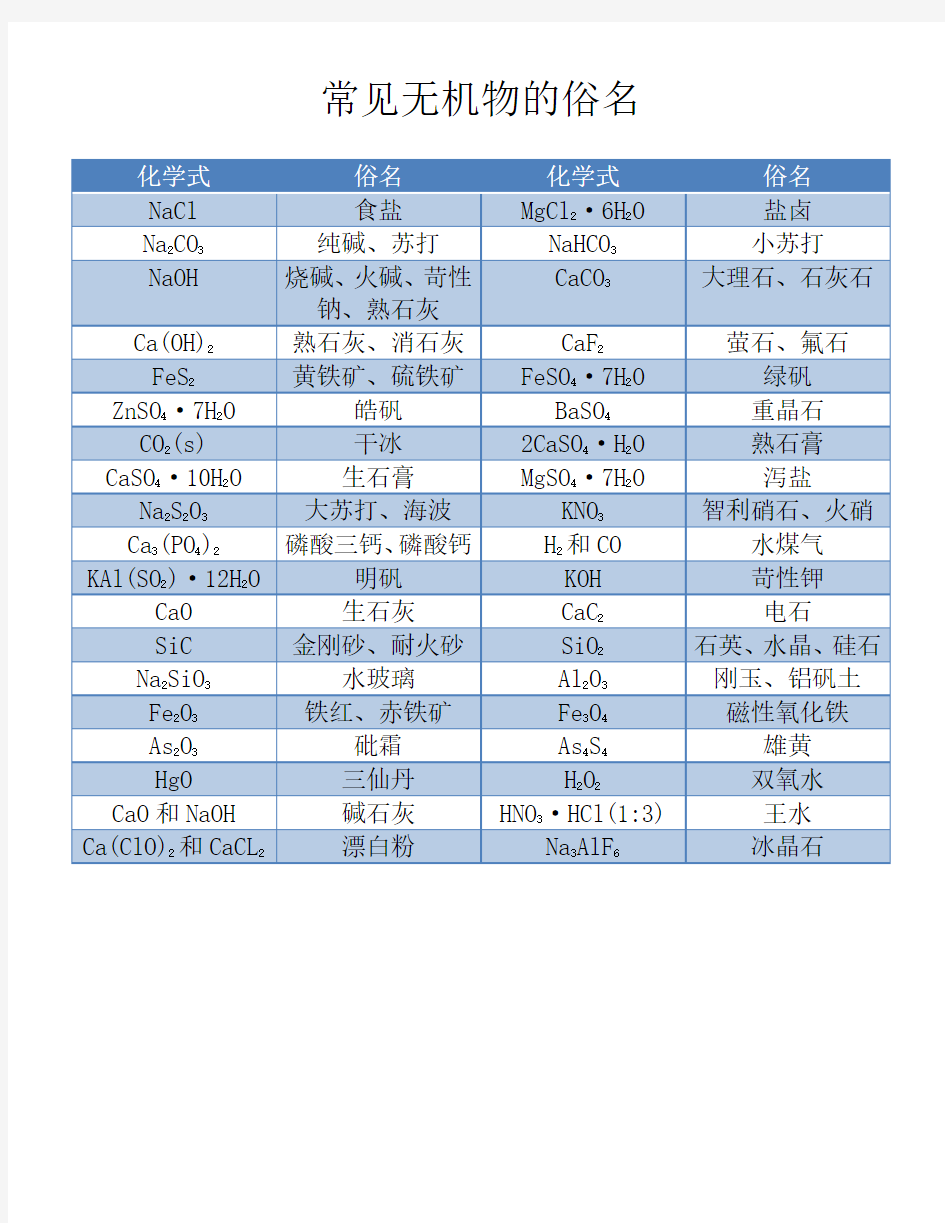
常见物质的俗名 生活中有许多东西其实在化学中都有学名,可能学化学的小伙伴知道学名或者知道俗名,但是学名和俗名就是对不上号。今天学科网小编就给大家整理了高三化学必修知识中要知道的化学式的俗名。无机部分纯碱、苏打、天然碱、口碱Na2CO3小苏打NaHCO3大苏打Na2S2O3石膏(生石膏)CaSO4.2H2O熟石膏2CaSO4-.H2O莹石CaF2重晶石BaSO4(无毒)碳铵NH4HCO3石灰石、大理石CaCO3生石灰CaO食盐NaCl熟石灰、消石灰Ca(OH)2芒硝Na2SO4-7H2O(缓泻剂)烧碱、火碱、苛性钠NaOH绿矾FaSO4-7H2O干冰CO2明矾KAl(SO4)2-12H2O漂白粉Ca(ClO)2、CaCl2(混和物)泻盐MgSO4-7H2O胆矾、蓝矾CuSO4-5H2O双氧水H2O2皓矾ZnSO4-7H2O硅石、石英SiO2刚玉Al2O3水玻璃、泡花碱、矿物胶Na2SiO3铁红、铁矿Fe2O3磁铁矿Fe3O4黄铁矿、硫铁矿FeS2铜绿、孔雀石Cu2(OH)2CO3菱铁矿FeCO3赤铜矿Cu2O波尔多液Ca(OH)2和CuSO4石硫合剂Ca(OH)2和S玻璃的主要成分Na2SiO3、CaSiO3、SiO2过磷酸钙(主要成分)Ca(H2PO4)2和CaSO4重过磷酸钙(主要成分)Ca(H2PO4)2天然气、沼气、坑气(主要成分)CH4水煤气CO和H2硫酸亚铁铵(淡蓝绿色)Fe(NH4)2(SO4)2溶于水后呈淡绿色光化学烟雾NO2在光照下产生的一种有毒气体王水浓HNO3与浓HCl按体积比13混合而成。铝热剂Al+Fe2O3或其它氧化物。尿素CO(NH2)2有机部分氯仿CHCl3电石CaC2电石气C2H2(乙炔)TNT三硝基甲苯酒精、乙醇C2H5OH氟氯烃是良好的制冷剂,有毒,但破坏O3层。醋酸冰醋酸、食醋CH3COOH裂解气成分(石油裂化)烯烃、烷烃、炔烃、H2S、CO2、CO等。甘油、丙三醇C3H8O3焦炉气成分(煤干馏)H2、CH4、乙烯、CO等。石炭酸苯酚蚁醛甲醛HCHO福
江苏省2013高考化学冲刺训练常见无机物及其应用 一、单项选择题 1.下列类比关系正确的是( ) 与过量NaOH溶液反应生成AlO2-,则与过量NH3·H2O反应也生成AlO2- 与CO2反应生成Na2CO3和O2,则与SO2反应可生成Na2SO3和O2 与Cl2反应生成FeCl3,则与I2反应可生成FeI3 与Fe2O3能发生铝热反应,则与MnO2也能发生铝热反应 2.(2011·福建高考)下表各选项中,不能利用置换反应通过Y得到W的一组化合物是( ) 3.(2011·山东高考)Al、Fe、Cu都是重要的金属元素。下列说法正确的是( ) A.三者对应的氧化物均为碱性氧化物 B.三者的单质放置在空气中只生成氧化物 C.制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法 D.电解AlCl3、FeCl3、CuCl2的混合溶液时阴极上依次析出Cu、Fe、Al 4.下列实验报告记录的实验现象正确的是( )
是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X,它们有如图所示的转化关系(部分产物及反应条件已略去)。下列判断正确的是 ( ) 元素可能为Al 元素可能为Si C.反应①和②互为可逆反应 D.反应①和②一定为氧化还原反应 二、不定项选择题 6.(2011·镇江模拟)A、B、C、D、E都是中学化学中常见物 质,它们均含有同一种短周期元素,在一定条件下可发生如 图所示的转化,其中A是单质,B在常温下是气态氢化物, C、D是氧化物,E是D和水反应的产物。下列判断中不合理的是( ) A.A可能是金属 B.由C生成D肯定发生了电子转移 C.A生成C肯定属于离子反应 D.B和E可能会发生反应生成一种盐
无机化合物颜色表(彩色版) 含部分元素化合物常温下物态、颜色、形态等物理化学性质 (字体颜色仅供参考和方便记忆,标准颜色还请参照实物。白色和无色均以标准字体表示,黑色表示为加粗体) 卤族(英VIIA): Solid:I2紫黑;ICl 暗红;IBr 暗灰;IF3 黄色;ICl3橙;I2O5白; I2O4黄(离子晶体); I 4O 9 黄(离子晶体). Liquid:Br2红棕;BrF3浅黄绿;IBr3棕;Cl2O6暗红;Cl2O7无色油状;HClO4无色粘稠状;(SCN) 2 黄色油状. Gas:F2浅黄;(CN)2无色;Cl2黄绿;I2(g) 紫;BrF 红棕;BrCl 红;Cl2O 黄红;ClO2黄 色;Br 2 O 深棕;(SCN)n 砖红色固体. 氧族(英VIA): Solid:S 淡黄;Se 灰,褐;Te 无色金属光泽;Na2S,(NH4)2S,K2S,BaS 白,可溶;ZnS 白↓; MnS 肉红↓;FeS 黑↓;PbS 黑↓;CdS 黄↓;Sb 2S 3 橘红↓;SnS 褐色↓;HgS 黑(沉淀), 红(朱砂);Ag 2S 黑↓;CuS 黑↓;Na 2 S 2 O 3 白;Na 2 S 2 O 4 白; SeO 2 白,易挥发;SeBr 2 红;SeBr 4 黄;TeO 2白加热变黄;H 2 TeO 3 白;TeBr 2 棕;TeBr 4 橙;TeI4 灰黑;PoO 2 低温黄(面心立 方),高温红(四方);SO 3无色;SeO 3 无色易潮解;TeO 3 橙色;H 6 TeO 6 无色. Liquid:H2O 无色;纯H2O2淡蓝色粘稠;CrO(O2)2(aq) 蓝;纯H2SO4无色油状;SO32-(aq) 无 色;SO 42-(aq) 无色;SeO 2 (l) 橙;TeO 2 (l) 深红. Gas:O2无色;O3低浓度无色,高浓度淡蓝(鱼腥味);S2(g) 黄,上浅下深;H2S 无色;SO2无 色;H 2Se 无色;H 2 Te 无色. 卤化硫(未注明者均为无色): Liquid:SF6;S2F10;SCl4淡黄;SCl2樱桃红;S2Cl2 金黄色;S2Br2红. Gas:SF4;SF2;S2F2. 卤砜、卤化亚砜、卤磺酸: Liquid:SOCl2白色透明;SO2Cl2无色发烟. 氮族(英VA): Solid:铵盐无色晶体;氮化金属白;N2O3蓝色(低温);N2O5白;P 白,红,黑;P2O3白; P 2O 5 白;PBr 3 黄;PI 3 红;PCl 5 无色;P 4 S x 黄;P 2 S 3 灰黄;P 2 S 5 淡黄;H 4 P 2 O 7 无色玻璃状; H 3PO 2 白;As 灰;As 2 O 3 白;As 2 O 5 白;AsI 3 红;As 4 S 4 红(雄黄);As 4 S 6 黄(雌黄);As 2 S 5 淡 黄;Sb 银白;Sb(OH) 3白↓;Sb 2 O 3 白(锑白,颜料);Sb 2 O 5 淡黄;SbX 3 (X<>I) 白;SbI 3 红; Sb 2S 3 橘红↓;Sb 2 S 5 橙黄;Bi 银白略显红;Bi 2 O 3 淡黄;Bi 2 O 5 红棕;BiF 3 灰白;BiCl 3 白; BiBr 3黄;BiI 3 黑↓;Bi 2 S 3 棕黑. Liquid:N2H4无色;HN3无色;NH2OH 无色;发烟硝酸红棕;NO3-无色;王水浅黄,氯气 味;硝基苯黄色油状;氨合电子(液氨溶液) 蓝;PX 3无色;纯H 3 PO 4 无色粘稠状;AsX 3 (X<>I) 无色;. Gas:N2无色;NH3无色;N2O 无色甜味;NO 无色;NO2红棕;PH3无色;P2H6无色;AsH3无 色;SbH 3无色;BiH 3 无色. 卤化氮(未注明者均为无色): Solid:NBr3?(NH3)6紫,爆炸性;NI3?(NH3)6黑,爆炸性; Liquid:NCl3;无色 Gas:NF3;无色 碳族(英IVA): Solid:C(金刚石) 无色透明;C(石墨) 黑色金属光泽;Si 灰黑色金属光泽;Ge 灰白;Sn 银
高中化学俗名大全 无机部分: 纯碱、苏打、天然碱、口碱:Na2CO3、小苏打:NaHCO3、大苏打:Na2S2O3、石膏(生石膏):CaSO4.2H2O、熟石膏:2CaSO4·H2O 莹石:CaF2;重晶石:BaSO4(无毒);碳铵:NH4HCO3;石灰石、大理石:CaCO3;生石灰:CaO;食盐:NaCl;熟石灰、消石灰:Ca(OH)2;芒硝:Na2SO4·7H2O(缓泻剂);烧碱、火碱、苛性钠:NaOH;绿矾:FaSO4·7H2O;干冰:CO2;明矾:KAl(SO4)2·12H2O;漂白粉:Ca(ClO)2、CaCl2(混和物);泻盐:MgSO4·7H2O;胆矾、蓝矾:CuSO4·5H2O;双氧水:H2O2;皓矾:ZnSO4·7H2O;硅石、石英:SiO2;刚玉:Al2O3;水玻璃、泡花碱、矿物胶:Na2SiO3;铁红、铁矿:Fe2O3;磁铁矿:Fe3O4;黄铁矿、硫铁矿:FeS2;铜绿、孔雀石:Cu2(OH)2CO3;菱铁矿:FeCO3;赤铜矿:Cu2O;波尔多液:Ca(OH)2和CuSO4;石硫合剂:Ca(OH)2和S玻璃的主要成分:Na2SiO3、CaSiO3、SiO2;过磷酸钙(主要成分):Ca(H2PO4)2和CaSO4重过磷酸钙(主要成分):Ca(H2PO4)2;天然气、沼气、坑气(主要成分):CH4;水煤气:CO和H2;硫酸亚铁铵(淡蓝绿色):Fe(NH4)2(SO4)2溶于水后呈淡绿色。 光化学烟雾:NO2在光照下产生的一种有毒气体。
铝热剂:Al+Fe2O3或其它氧化物。 尿素:CO(NH2)2 有机部分: 氯仿:CHCl3;电石:CaC2;电石气:C2H2;(乙炔)TNT:三硝基甲苯、酒精、乙醇:C2H5OH 氟氯烃:是良好的制冷剂,有毒,但破坏O3层。醋酸:冰醋酸、食醋CH3COOH 裂解气成分(石油裂化):烯烃、烷烃、炔烃、H2S、CO2、CO 等。甘油、丙三醇:C3H8O3 焦炉气成分(煤干馏):H2、CH4、乙烯、CO等。石炭酸:苯酚蚁醛:甲醛HCHO 福尔马林:35%—40%的甲醛水溶液蚁酸:甲酸HCOOH 葡萄糖:C6H12O6;果糖:C6H12O6;蔗糖:C12H22O11;麦芽糖:C12H22O11;淀粉:(C6H10O5)n 硬脂酸:C17H35COOH;油酸:C17H33COOH;软脂酸:C15H31COOH 草酸:乙二酸:HOOC—COOH;使蓝墨水褪色,强酸性,受热分解成CO2和水,使KMnO4酸性溶液褪色。 文章来源网络整理,请自行参考编辑使用
常见物质的俗名 一、无机部分: 纯碱、苏打、天然碱、口碱:Na2CO3小苏打:NaHCO3大苏打:Na2S2O3石膏(生石膏):CaSO4.2H2O 熟石膏:2CaSO4·.H2O 莹石:CaF2重晶石:BaSO4(无毒)碳铵:NH4HCO3石灰石、大理石:CaCO3生石灰:CaO 食盐:NaCl 熟石灰、消石灰:Ca(OH)2芒硝:Na2SO4·7H2O (缓泻剂) 烧碱、火碱、苛性钠:NaOH 绿矾:FaSO4·7H2O 干冰:CO2明矾:KAl (SO4) 2·12H2O 漂白粉:Ca (ClO) 2、CaCl2(混和物)泻盐:MgSO4·7H2O 胆矾、蓝矾:CuSO4·5H2O 双氧水:H2O2皓矾:ZnSO4·7H2O 硅石、石英:SiO2刚玉:Al2O3水玻璃、泡花碱、矿物胶:Na2SiO3铁红、铁矿:Fe2O3磁铁矿:Fe3O4黄铁矿、硫铁矿:FeS2铜绿、孔雀石:Cu2 (OH) 2CO3菱铁矿:FeCO3赤铜矿:Cu2O 波尔多液:Ca (OH) 2和CuSO4石硫合剂:Ca (OH) 2和S 玻璃的主要成分:Na2SiO3、CaSiO3、SiO2过磷酸钙(主要成分):Ca (H2PO4) 2和CaSO4重过磷酸钙(主要成分):Ca (H2PO4) 2天然气、沼气、坑气(主要成分):CH4水煤气:CO 和H2硫酸亚铁铵(淡蓝绿色):Fe (NH4) 2(SO4) 2溶于水后呈淡绿色光化学烟雾:NO2在光照下产生的一种有毒气体王水:浓HNO3:浓HCl按体积比1:3混合而成。铝热剂:Al + Fe2O3或其它氧化物。尿素:CO(NH2)2 二、有机部分: 氯仿:CHCl3电石:CaC2电石气:C2H4 (乙炔) TNT:三硝基甲苯氟氯烃:是良好的制冷剂,有毒,但破坏O3层。酒精、乙醇:C2H5OH 裂解气成分(石油裂化):烯烃、烷烃、炔烃、H2S、CO2、CO等。焦炉气成分(煤干馏):H2、CH4、乙烯、CO等。醋酸:CH3COOH 甘油、三醇:C3H8O3石炭酸:苯酚蚁醛:甲醛CH2O 福尔马林:35%—40%的甲醛水溶液蚁酸:甲酸HCOOH 葡萄糖:C6H12O6果糖:C6H12O6蔗糖:C12H22O11麦芽糖:C12H22O11淀粉:(C6H10O5)n 硬脂酸:C17H35COOH 油酸:C17H33COOH 软脂酸: C15H31COOH 草酸:乙二酸HOOC—COOH (能使蓝墨水褪色,呈强酸性,受热分解成CO2和水,能使KMnO4酸性溶液褪色)。
第二章 常见无机物及其应用 第四节 碳、硅及其化合物 【考纲扫描】 了解碳、硅及其化合物的主要性质及应用 【考纲解读】 以新材料、新技术为背景考查碳,硅及其重要化合物的性质及应用是高考考查本部分知识的一个重要内容。 【知识梳理】 一、知识网络 二、碳及其化合物 1.碳在自然界中的存在 (1 (2)具体形式:以存在于大气中。 2.碳的单质 主要有 4.碳酸盐
(1)水溶性 ①含碱金属阳离子(Li +除外)、NH 4+的碳酸正盐 水;酸式盐均 溶于水。 ②一般地,在相同温度下,难溶性正盐的溶解度 CaCO Ca(HCO 3)2;可溶性正盐的溶解度 Na 2CO 3。 (2)热稳定性 ①一般地,热稳定性顺序为: 如Na 2CO H 2CO 3。 ②可溶性正盐K 2CO CaCO (3)与强酸反应 碳酸的正盐、酸式盐、碱式盐均能与强酸反应产生如 : (4)与强碱反应 ①酸式盐均能与强碱反应,如:NaHCO 3与NaOH ②可溶性正盐均能与含Ba 2+、Ca 2+的碱反应,如:Na 2CO 3与Ca(OH)2反应的化学方程式: (5)与盐反应 三、硅及其化合物 1.硅在自然界中的存在 (1 (2)具体形式:以其在地壳中的含量仅次于 居第二位。 2.硅的单质 (1)结构及物理性质 单质硅有晶体硅和无定形硅两种,晶体硅与金刚石结构相似,熔点硬度 (2)主要用途:可作 (3)化学性质 Si 与其它元素主要形成 化学性质不活泼,加热条件下与O 反应,方程 F 2、HF 、NaOH (43.二氧化硅 (1)存在形态有结晶形和无定形两大类,统称包括水晶和玛瑙等。 (2)二氧化碳和二氧化硅的性质比较
2017年-高考化学常见无机物及化合物专题复习
2017年高考化学常见无机物及化合物专题复习 【考情快报】 在高考中该部分知识的主要题型是直接考查常见无机物性质及其应用的选择题、框图推断题和以常见无机物的知识作为载体综合考查有关概念、理论、实验和计算的非选择题。 (1)金属元素及其重要化合物中侧重考查铁、铝、钠、铜的单质、氧化物、氢氧化物和盐的性质及其应用。(2)非金属元素及其重要化合物中侧重考查SO2、NO、NO2、CO、Cl2、HNO3、H2SO4、碳酸盐等物质的性质及其应用。 【基础回顾】 一、金属及其化合物
对于Na、Al、Fe、Cu等元素的单质及其化合物,其中:1.能与冷水剧烈反应的单质是___,反应的离子方程式为__________________________。能用作供氧剂的是______。 2.能与NaOH溶液反应的单质是Al,反应的离子方程式为____________________________;能与NaOH溶液反应的氧化物是Al2O3,反应的离子方程式为_______________________;属于两性氢氧化物的是_______。 3.以上元素形成的氢氧化物中,易被空气中的氧气氧化的是Fe(OH)2,反应的化学方程式为_____________。 4.四种元素形成的金属阳离子共有__种,其中氧化性最强
的是Fe3+。它与单质铜反应的离子方程式为______。 二、非金属单质及其化合物 1.对于H、C、N、O、Si、S、Cl等元素形成的单质中(1)属于空气主要构成成分的是______,它们相互反应的化学方程式为_________________; (2)能用于自来水消毒的是____,它与NaOH溶液反应的离子方程式为_______________________,实验室中制备该气体的化学方程式为_____________________________________; (3)属于半导体材料的是___,其工业制取方法为_____________ _________。 2.在CO、CO2、SO2、NO、NO2、SiO2等氧化物中 (1)能用做工业炼铁还原剂的是______。 (2)能使品红溶液褪色的是_____。 (3)能与水反应生成强酸的是NO2,反应的化学方程式为____________________。 (4)属于普通玻璃构成成分的是_____,它与氢氟酸反应的化学方程式为_______________________。 3.在浓硝酸、稀硝酸、浓硫酸、稀硫酸中 (1)常温时能使Fe、Al钝化的是_______________。 (2)清洗试管内壁上的单质铜通常选用_______,反应的离子方程式为_________________________________。(3)见光易分解的是_______,反应的化学方程式为
常见无机物质的颜色表 卤族(VIIA): Solid:I2 紫黑;ICl 暗红;ICl3 橙;I2O5 白;IBr 暗灰;IF3 黄色;I2O4 黄;I4O9 黄. Liquid:Br2 红棕;BrF3 浅黄绿;IBr3 棕;Cl2O6暗红;Cl2O7 无色油状;HClO4 无色粘稠状;(SCN)2 黄色油状;(SCN)n 砖红色固体.Gas:F2 浅黄;Cl2 黄绿;I2(g) 紫;BrF 红棕;BrCl 红;Cl2O 黄红;ClO2 黄色;Br2O 深棕. 氧族(VIA): Solid:S 淡黄;Se 灰,褐;Te 无色金属光泽;Na2S,(NH4)2S,K2S,BaS 白,可溶;ZnS 白↓;MnS 肉红↓;FeS 黑↓;PbS 黑↓;CdS 黄↓;Sb2S3 橘红↓;SnS 褐色↓;HgS 黑(沉淀),红(朱砂);Ag2S 黑↓;CuS 黑↓;Na2S2O3 白;Na2S2O4 白;SeO2 白,易挥发;SeBr2 红;SeBr4 黄;TeO2 白加热变黄;H2TeO3 白;TeBr2 棕;TeBr4 橙;TeI4 灰黑;PoO2 低温黄(面心立方),高温红(四方);SO3 无色;SeO3 无色易潮解;TeO3 橙色;H6TeO6 无色. Liquid:H2O 无色;纯H2O2 淡蓝色粘稠;CrO(O2)2(aq) 蓝;纯H2SO4 无色油状;SO4^2-(aq) 无色;SeO2(l) 橙;TeO2(l) 深红. Gas:O2 无色;O3 低浓度无色,高浓度淡蓝;S2(g) 黄,上浅下深;H2S 无色;
SO2 无色;H2Se 无色;H2Te 无色. .卤化硫(未注明者均为无色): Liquid:SF6;S2F10;SCl4 淡黄;SCl2 红;S2Cl2;S2Br2 红. Gas:SF4;SF2;S2F2. 卤砜、卤化亚砜、卤磺酸: Liquid:SOCl2 白色透明;SO2Cl2 无色发烟. 氮族(VA): Solid:铵盐无色晶体;氮化金属白;N2O3 蓝色(低温);N2O5 白;P 白,红,黑;P2O3 白;P2O5 白;PBr3 黄;PI3 红;PCl5 无色;P4Sx 黄;P2S3 灰黄;P2S5 淡黄;H4P2O7 无色玻璃状;H3PO2 白;As 灰;As2O3 白;As2O5 白;AsI3 红;As4S4 红(雄黄);As4S6 黄(雌黄);As2S5 淡黄;Sb 银白;Sb(OH)3 白↓;Sb2O3 白(锑白,颜料);Sb2O5 淡黄;SbX3(X<>I) 白;SbI3 红;Sb2S3 黑↓;Sb2S5 橙黄;Bi 银白略显红;Bi2O3 淡黄;Bi2O5 红棕;BiF3 灰白;BiCl3 白;BiBr3 黄;BiI3 黑↓;Bi2S3 棕黑. Liquid:N2H4 无色;HN3 无色;NH2OH 无色;发烟硝酸红棕;NO3^-(l)无色;王水浅黄,氯气味;硝基苯黄色油状;氨合电子(液氨溶液) 蓝;PX3 无色;纯H3PO4 无色粘稠状;AsX3(X<>I) 无色;. Gas:N2 无色;NH3 无色;N2O 无色甜味;NO 无色;NO2 红棕;PH3 无色;P2H6 无色;AsH3 无色;SbH3 无色;BiH3 无色. 卤化氮(未注明者均为无色):
第三部分 常见无机物及其应用 一、知识整理 1.常见金属元素的位置和物理通性 (1)元素在周期表中的位置 (2)金属材料的物理通性 常用的金属材料主要有金属和合金两类,它们具有如下的物理通性:①金属具有金属光泽;②金属具有导电性;③金属具有导热性;④金属具有良好的延展性。 2.比较金属性强弱的方法 元素金属性的本质是指元素的原子失电子能力。它取决于金属的原子半径、核电荷数、最外层电子数等因素。可以从以下几个方面来比较元素金属性强弱: (1)根据金属的原子结构; (2)根据元素在周期表中的位置; (3)根据最高价氧化物对应水化物的碱性强弱; (4)根据与氧气反应的难易; (5)根据与水反应的条件难易;(6)根据与非氧化性酸反应的剧烈情况; (7)根据金属间发生的置换; (8)根据原电池反应,做负极的金属比做正极的金属活泼。 3.金属活动性顺序的应用。 二、重点知识解析 1.钠及其钠的化合物 (1)钠及其钠的化合物的知识体系
2 2 2 O O 2 O O 22 (4)碳酸钠与碳酸氢钠 3 HCl NaCl HCl NaCl 2HCl2NaCl NaOH 2 NaHCO 3 重要的化工原料,用于玻璃、造纸、 食品工业,泡沫灭火剂等2.铝及其铝的化合物 (1)铝及其铝的化合物的知识体系
(2)铝 ①铝在周期表中的位置和物理性质 铝在周期表中第三周期ⅢA族,是一种银白色轻金属,具有良好的导电性、导热性和延展性。它可应用于制导线、电缆、炊具,铝箔常用于食品和饮料的包装,铝还可以用于制造铝合金。 ②化学性质 2Al 2 2 6HCl Al O 3 (3)氧化铝 ①是一种白色难溶的固体,不溶于水。是冶炼铝的原料,是一种比较好的耐火材料。 ②氧化铝是两性氧化物。 与酸反应:Al2O3+6HCl2AlCl3+3H2O 与碱反应:Al2O3+2NaOH2NaAlO2+H2O 既能与强酸反应,又能与强碱反应的物质:Al、Al2O3、Al(OH)3、弱酸的酸式盐(NaHCO3、NaHSO3)、弱酸的铵盐[(NH4)2CO3、(NH4)2SO3]、氨基酸等。 O Al 3HCl NaOH 3 (5)Al3+、- AlO、Al(OH)3间的相互转化关系 2 Al3+Al(OH)3- AlO 2 在AlCl3溶液中逐滴加入NaOH溶液的现象:先出现白色沉淀,NaOH溶液过量白色沉淀又逐渐消失。 AlCl3+3NaOH=Al(OH)3↓+3NaCl;Al(OH)3+NaOH=NaAlO2+2H2O (两瓶无色的溶液其中一瓶是AlCl3溶液,另一瓶是NaOH溶液,采用互滴法可以对这两瓶无色溶液进行鉴别) 在NaAlO2溶液中逐滴加入盐酸的现象:先出现白色沉淀,盐酸过量白色沉淀又逐渐消失。 NaAlO2+HCl+H2O Al(OH)3↓+NaCl;Al(OH)3+3HCl AlCl3+3H2O 3.铁及其铁的化合物 (1)铁及其铁的化合物的知识体系
无机物俗名大全 无机部分: 纯碱、苏打、天然碱、口碱白碱:Na2CO3小苏打:NaHCO3大苏打:Na2S2O3石膏(生石膏):CaSO4.2H2O 熟石膏:2CaSO4·.H2O 莹石:CaF2重晶石:BaSO4(无毒)碳铵:NH4HCO3 石灰石、大理石(主要成分):CaCO3生石灰:CaO 食盐:NaCl 熟石灰、消石灰:Ca(OH)2芒硝:Na2SO4·7H2O (缓泻剂) 烧碱、火碱、苛性钠:NaOH 绿矾:FaSO4·7H2O 干冰:CO2明矾: KAl (SO4)2·12H2O 漂白粉:Ca (ClO)2、CaCl2(混和物)泻盐:MgSO4·7H2O 胆矾、蓝矾:CuSO4·5H2O 双氧水:H2O2皓矾:ZnSO4·7H2O 硅石、石英:SiO2刚玉:Al2O3 水玻璃、泡花碱、矿物胶:Na2SiO3铁红、铁矿铁锈(主要成分):Fe2O3磁铁矿:Fe3O4黄铁矿、硫铁矿:FeS2铜绿、孔雀石:Cu2(OH)2CO3菱铁矿:FeCO3赤铜矿:Cu2O 波尔多液:Ca (OH)2和CuSO4石硫合剂:Ca (OH)2和S 玻璃的主要成分:Na2SiO3、CaSiO3、SiO2过磷酸钙(主要成分):Ca (H2PO4)2和CaSO4重过磷酸钙(主要成分):Ca (H2PO4)2天然气、沼气、坑气(主要成分):CH4水煤气:CO和H2硫酸亚铁铵(淡蓝绿色): Fe (NH4)2 (SO4)2溶于水后呈淡绿色 光化学烟雾:NO2在光照下产生的一种有毒气体王水:浓HNO3与浓HCl按体积比1:3混合而成。 铝热剂:Al + Fe2O3或其它氧化物。尿素:CO(NH2) 2
2021年高中化学二轮专题卷——常见无机物及其应用 一、单选题 1.下列有关物质用途不正确的是( ) A .Al 2O 3可用作耐高温材料 B .Na 2CO 3可用于治疗胃酸过多 C .氯气可用于自来水消毒 D .FeCl 3可用作蚀刻铜电路板 2.有一种铁的“氧化物”样品,用5 mol/L 盐酸140 mL 完全溶解,所得溶液还能吸收标况下0.56 L 氯气,恰好使其中Fe 2+全部化成Fe 3+,该样品可能的化学式是 A .Fe 2O 3 B .Fe 3O 4 C .Fe 4O 5 D .Fe 5O 7 3.在铁的氧化物和氧化铝组成的混合物中,加入2 mol/L 硫酸65 mL ,恰好完全反应,所得溶液中Fe 2+能被标准状况下112 mL 的Cl 2氧化, 则原混合物中金属元素和氧元素的原子个数之比为 A .5:7 B .4:3 C .3:4 D .9:13 4.下列离子方程式正确的是( ) A .Na 与CuSO 4水溶液反应:2Na+Cu 2+=Cu+2Na + B .澄清石灰水中通入过量的CO 2:CO 2+OH -=-3HCO C .氢氧化钡溶液中加入稀硫酸:Ba 2++OH -+H ++2-4SO =BaSO 4↓+H 2O D .向Fe(OH)3悬浊液中加入醋酸:Fe(OH)3+3H +=Fe 3++3H 2O 5.下列生产、生活中的变化涉及氧化还原反应的是( ) A .泡沫灭火器的使用 B .手机充电 C .明矾净水 D .侯氏制碱 6.某些物质的制备原理在工业上和实验室中不一定相同,下列各物质的工业生产过程不正确... 的是 A .N 22H ??→NH 3?????????→饱和NaCl 溶液2CO ???→NaHCO 3Δ??→纯碱 B .NaCl 电解????→Cl 2????????→澄清石灰水漂白粉
无机化合物颜色大全 ?? 化合物的溶度积常数表 ?? 化合物性质的查询 ?? 较全的物质的颜色 无机颜色表(含部分元素化合物常温下物态、颜色、形态等物理化学性质)卤族(英VIIA): Solid:I 2 紫黑;ICl 暗红;IBr 暗灰;IF 3 黄色;ICl 3 橙;I 2 O 5 白; I 2O 4 黄(离子晶体);I 4 O 9 黄(离子晶体). Liquid:Br 2 红棕;BrF 3 浅黄绿;IBr 3 棕;Cl 2 O 6 暗红;Cl 2 O 7 无色油状; HClO 4 无色粘稠状;(SCN) 2 黄色油状. Gas:F 2 浅黄;(CN) 2 无色;Cl 2 黄绿;I 2 (g) 紫;BrF 红棕;BrCl 红; Cl 2O 黄红;ClO 2 黄色;Br 2 O 深棕;(SCN) n 砖红色固体. 氧族(英VIA): Solid:S 淡黄;Se 灰,褐;Te 无色 金属光泽; Na 2S,(NH 4 ) 2 S,K 2 S,BaS 白,可溶;ZnS 白↓;MnS 肉红↓;FeS 黑↓;PbS 黑↓;CdS 黄↓;Sb 2S 3 橘红 ↓;SnS 褐色↓;HgS 黑(沉淀),红(朱砂);Ag 2S 黑↓;CuS 黑↓;Na 2 S 2 O 3 白; Na 2S 2 O 4 白; SeO 2 白,易挥发;SeBr 2 红;SeBr 4 黄;TeO 2 白(加热变黄);H 2 TeO 3 白;TeBr 2 棕;TeBr 4 橙;TeI 4 灰黑;PoO 2 低温黄(面心立方),高温红(四方);S O 3 无色;SeO 3 无色易潮解;TeO 3 橙色;H 6 TeO 6 无色. Liquid:H2O 无色;纯H 2 O 2 淡蓝色粘稠;CrO(O 2 ) 2 (aq) 蓝;纯H 2 SO 4 无色 油状;SO 32-(aq) 无色;SO 4 2-(aq) 无色;SeO 2 (l) 橙;TeO 2 (l) 深红. Gas:O 2 无色;O 3 低浓度无色,高浓度淡蓝(鱼腥味);S 2 (g) 黄,上浅下 深;H 2S 无色;SO 2 无色;H 2 Se 无色;H 2 Te 无色. 卤化硫(未注明者均为无色): Liquid:SF 6,S 2 F 10, SCl 4 淡黄;SCl 2 红 ;S 2 Cl 2 无色;S 2 Br 2 红. Gas: SF 4 ; SF 2 ; S 2 F 2 . Liquid:SOCl 2 白色透明;SO 2 Cl 2 无色发烟. 氮族(英VA): Solid:铵盐 无色晶体;氮化金属 白;N 2O 3 蓝色(低温);N 2 O 5 白;P 白, 红,黑;P 2O 3 白;P 2 O 5 白;PBr 3 黄;PI 3 红;PCl 5 无色;P 4 S x 黄;P 2 S 3 灰黄;P 2 S 5 淡黄;H 4 P 2 O 7 无色玻璃状;H 3 PO 2 白;As 灰;As 2 O 3 白;As 2 O 5 白;AsI 3 红;As 4S 4 红(雄黄);As 4 S 6 黄(雌黄);As 2 S 5 淡黄;Sb 银白;Sb(OH) 3 白↓;Sb 2 O 3 白(锑 白,颜料);Sb 2O 5 淡黄;SbX 3 (X<>I) 白;SbI 3 红;Sb 2 S 3 橘红↓;Sb 2 S 5 橙黄;B i 银白略显红;Bi 2O 3 淡黄;Bi 2 O 5 红棕;BiF 3 灰白;BiCl 3 白;BiBr 3 黄;BiI 3 黑↓;Bi 2S 3 棕黑. Liquid:N 2H 4 无色;HN 3 无色;NH 2 OH 无色;发烟硝酸 红棕;NO 3 -(l) 无色;王水 浅黄,氯气味;硝基苯 黄色油状;氨合电子(液氨溶液) 蓝;PX 3 无 色;纯H 3PO 4 无色粘稠状;AsX 3 (X<>I) 无色;.