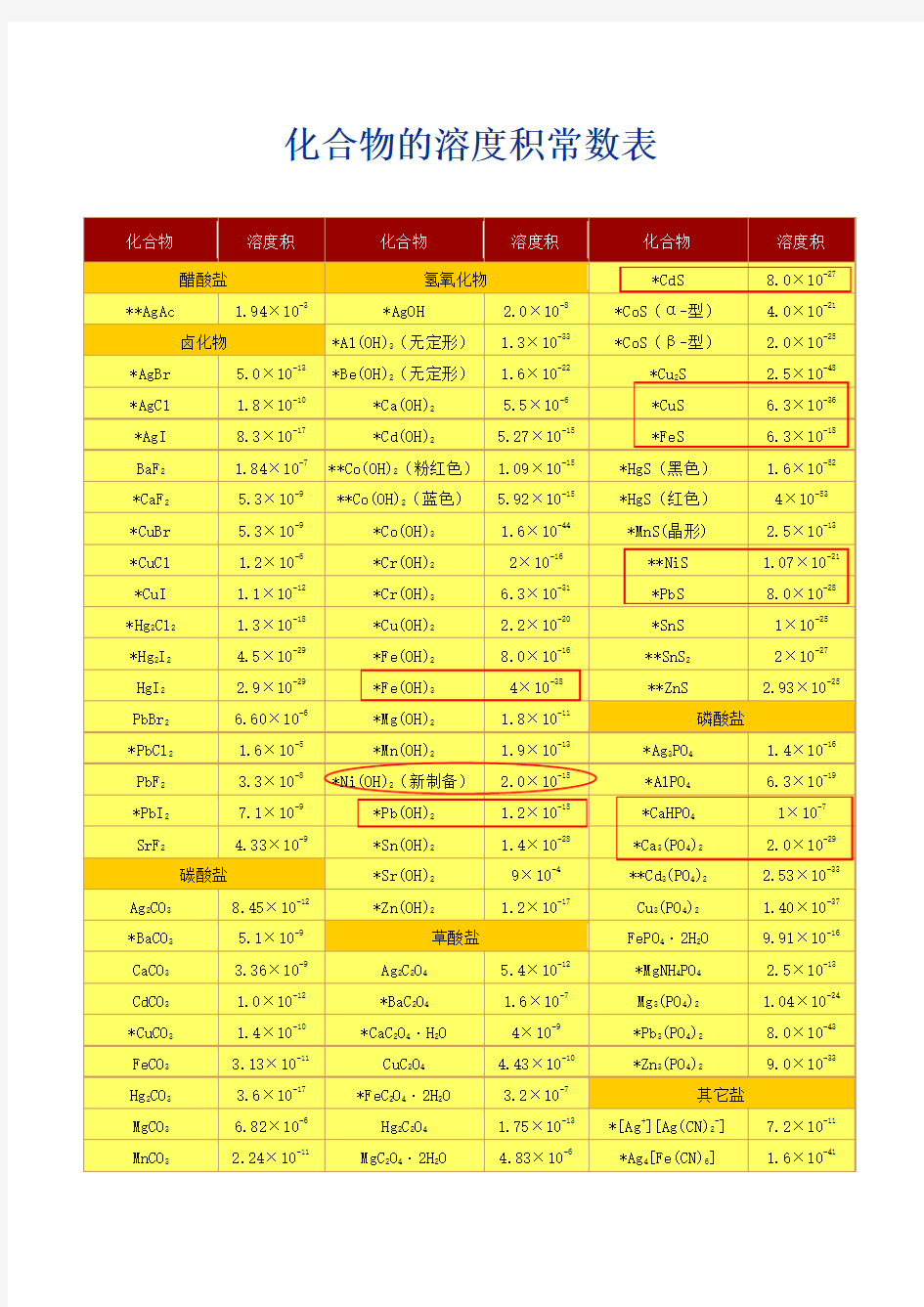
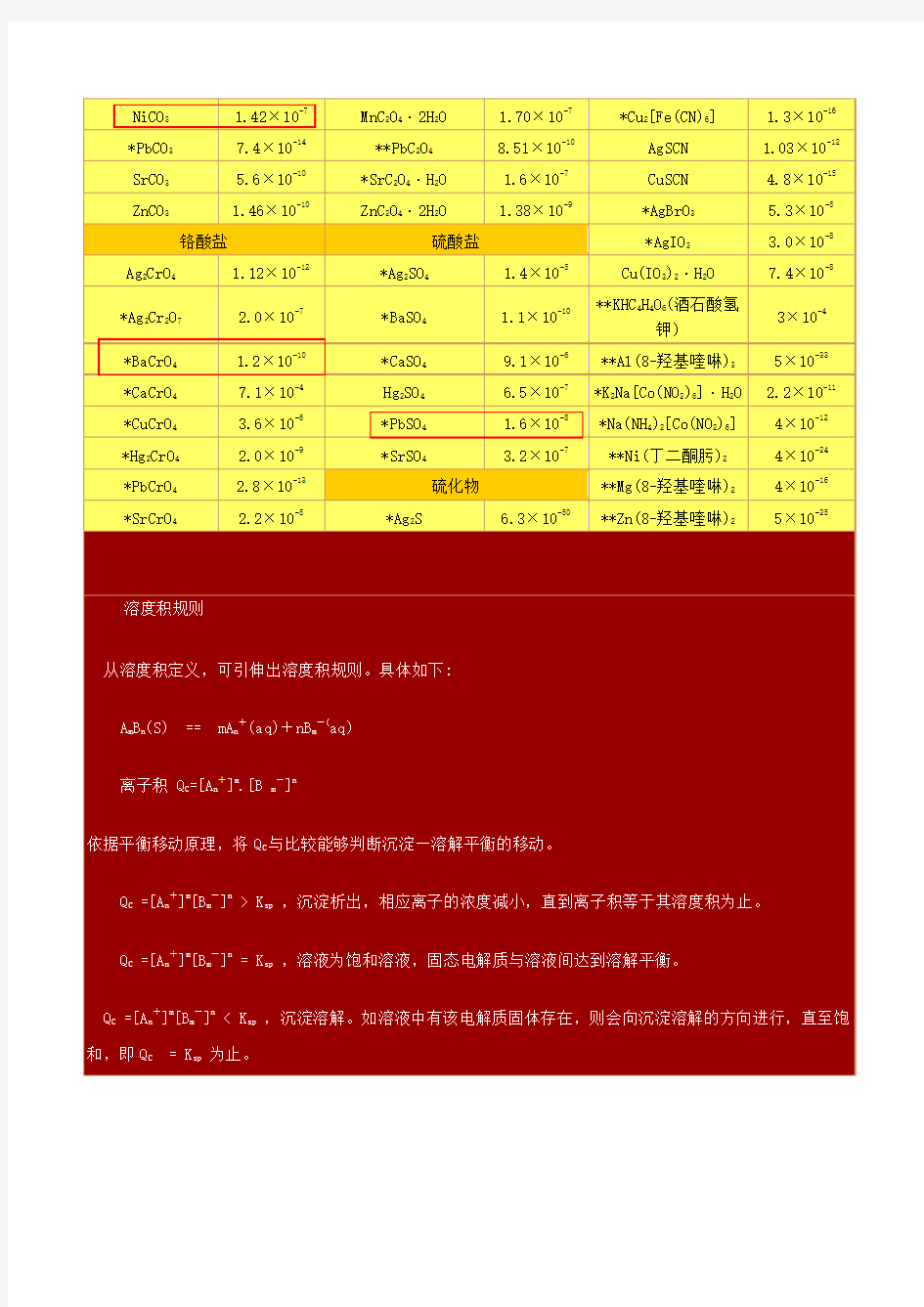
化合物的溶度积常数表
学习情景五硫酸钡溶度积常数的测定 学习要点 1、溶度积与溶解度 2、溶度积规则 3、影响多相离子平衡移动的因素 4、分步沉淀与沉淀分离法 链接 沉淀反应是一类广泛存在的反应,常用于对混合物的分离,在日常生活及生物技术的研究中有着重要作用。沉淀现象在工业生产中常用来提取物料,得到产品;在生物工程中常用于对发酵液的分离提纯,以得到生物制品。沉淀在日常保健中也有应用,如利用沉淀- 溶解平衡原理可通过使用含氟牙膏来预防龋齿。 必备知识点一溶度积规则 极性溶剂水分子和固体表面粒子相互作用,使溶质粒子脱离固体表面成为水合离子进入溶液的过程叫溶解。 溶液中水合离子在运动中相互碰撞重新结合成晶体从而成为固体状态并从溶液中析出的过程叫沉淀。 溶解和沉淀两个相互矛盾的过程使一对可逆反应在某一时刻(溶解与沉淀速率相等)达平衡状态,此平衡称为沉淀溶解平衡。 一、难溶电解质的溶度积常数 1、难溶电解质 在水中溶解度小于0.01g/100g的电解质称为?。 如AgCl 的沉淀溶解平衡可表示为: AgCl (s) Ag (aq) Cl (aq) 平衡常数 K Ag Cl 2、溶度积 对于一般难溶电解质
一定温度下难溶电解质的饱和溶液中各组分离子浓度系数次幕的乘积为一 常数,称为溶度积常数,简称溶度积;符号为K sp 。 沉淀溶解平衡是在未溶解固体与溶液中离子间建立的, 溶液中离子是由已溶 解的固体电离形成的。由于溶解的部分很少,故可以认为溶解部分可完全电离。 3、K sp 的物理意义 (1) K sp 的大小只与反应温度有关,而与难溶电解质的质量无关; (2) 表达式中的浓度是平衡时离子的浓度,此时的溶液是饱和溶液; (3) 由K sp 可以比较同种类型难溶电解质的溶解度的大小; 不同类型的难溶电解质不能用 K sp 比较溶解度的大小。 对于AB 型难溶电解质: 定温度下饱和溶液的浓度,也就是该溶质在此温度下的溶解度。 ^B n s ? mA n aq nB m aq 溶解度s 的单位均为mol/L ,计算时注意单位换算,g/L=mol/L*g/mol 例 1:已知 2K Q p 时,[并&2陽04的溶解度是nS.2\o nS /foOgnC 求S m p (Ag 2CrO 4)。 解: 2 Ag 2CrO 4 ? 2Ag CrO 4 2s s 离子积:某难溶电解质的溶液中任一状态下有关离子浓度的乘积,用 J 表示。 J i 与K sp 的区别:K sp 是J i 的一个特例 1、溶度积规则: 当J>K sp 时,过饱和溶液,将生成沉淀,直至溶液饱和为止。 当J=K sp 时,饱和溶液,处于沉淀溶解平衡状态。 平衡常数 AmBm(s) K sp [A n ]m [B m ]n mA n (aq) nB m (aq) 溶度积与溶解度都可' 力、 e 3 质 的 K ° ,但它们是既有区别又有联系的 不同概念。 三、溶度积规则 4 喙聾 3]2 4[噓打° 332 4S 3 12 1.1 10 12 对于A 2B 或AB 2
常用物理常数表 光速 101099792458.2?=c cm sec -1 万有引力常数 81067259.6-?=G dyn cm -2 g -2 普朗克常数 27106260.6-?=h erg sec 271005457266.12/-?==πh η erg sec 玻尔兹曼常数 1610380662.1-?=k erg deg –1 里德堡常量 312.109737/2342==∞ch e m R e π cm -1 斯特藩—玻尔兹曼常数 51066956.5-?=σ erg cm -2 deg -4 sec -1 电子电量 101080325.4-?=e esu 1910602192.1-?= coulomb 电子质量 281010956.9-?=e m g 原子质量单位 2410660531.1-?=amu g 精细结构常数 0360.1372//12==e hc πα 第一玻尔轨道半径 82220105291775.04/-?==e m h a e π cm 经典电子半径 1322108179380.2/-?==c m e r e e cm 质子质量 2410672661.1-?=p m g 007276470.1= amu 中子质量 241067492.1-?=n m g 00866.1= amu 电子静止能量 5110034.02=c m e meV 常用天文常数表 地球质量 2710976.5?=⊕M g 地球赤道半径 164.6378=⊕R km 地球表面重力 665.980=⊕g cm sec -2 天文单位 810495979.1?=AU km 1光年 ly = 9.460×1012 km 1秒差距 pc= 3.084×1013 km=3.262ly 千秒差距 kpc=1000pc 地月距离 3.8×105 km 太阳到冥王星的平均距离 5.91×109km 最近的恒星(除太阳)的距离 4×1013km =1.31pc= 4.3ly
高中化学复习知识点:溶度积规则及其应用 一、单选题 1.T℃时,分别向10mL浓度均为0.1mol·L-1的CuCl2和ZnCl2溶液中滴加0.1mol·L -1的Na2S溶液,滴加过程中-lgc(Cu2+)和-lgc(Zn2+)与Na2S溶液体积(V)的关系如图所示[已知:K sp(ZnS)>K sp(CuS),lg3≈0.5]。下列有关说法错误的是( )。 A.a~b~d为滴定ZnCl2溶液的曲线 B.对应溶液pH:a<b<e C.a点对应的CuCl2溶液中:c(Cl-)<2[c(Cu2+)+c(H+)] D.d点纵坐标约为33.9 2.25 ℃时有关物质的颜色和溶度积(K sp)如下表: 下列叙述中不正确的是() A.向AgCl的白色悬浊液中加入0.1 mol/L KI溶液,有黄色沉淀产生 B.25 ℃时,利用表中的溶度积(K sp),可以计算AgCl、AgBr、AgI、Ag2S饱和水溶液中Ag+的浓度 C.25 ℃,AgCl固体分别在等物质的量浓度NaCl、CaCl2溶液中溶解达到平衡,两溶液中,c(Ag+)和溶度积均相同 D.在5 mL 1.8×10-6 mol/L NaCl溶液中,加入1滴(20滴约为1 mL)1×10-3 mol/L AgNO3溶液,不能产生白色沉淀 3.下列实验中根据现象得出的结论错误的是()
A.A B.B C.C D.D 4.下列有关化学实验操作,现象和结论均为正确的是 A.A B.B C.C D.D
5.一定温度下,向含有AgCl(s)的饱和AgCl溶液中加水,下列叙述正确的是()A.AgCl的溶解度增大B.AgCl的溶解度增大,K sp不变 C.c(Ag+)增大D.AgCl的溶解度、K sp均不变 6.下表是三种难溶金属硫化物的溶度积常数(25℃): 下列有关说法中正确的是 A.25℃时,CuS的溶解度大于MnS的溶解度 B.除去某溶液中的Cu2+,可以选用FeS作沉淀剂 C.因为H2SO4是强酸,所以反应CuSO4+H2S = CuS↓+H2SO4不能发生 D.25℃时,饱和CuS溶液中,Cu2+的浓度为1.3×10-36mol·L-1 7.某温度下,向10mL0.1mol/L CuCl2溶液中滴加0.1mol/L的Na2S溶液,滴加过程中溶液中-lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示,下列有关说法不正确 的是 (已知:K sp(ZnS)=3×10-25mol2/L2) A.a、b、c三点中,水的电离程度最大的为b点 B.Na2S溶液中:2c(S2-)+2c(HS-)+2c(H2S)=c(Na+) C.该温度下K sp(CuS)=10-35.4mol2/L2 D.向100mL Zn2+、Cu2+浓度均为10-5mol/L的混合溶液中逐滴加入10-4mol/L的Na2S溶液,Cu2+先沉淀 8.已知25℃时,K sp(AgCl)=1.8×10-10,K sp(AgI)=8.3×10-17,将AgCl与AgI的饱和溶液 等体积混合,再向混合液中加入足量的浓硝酸银溶液,充分反应,下列说法正确的是()A.混合液中只有AgI沉淀生成 B.常温下,AgCl在NaCl溶液中的溶解度与在纯水中的溶解度相同 C.混合液中生成AgCl沉淀物质的量多于AgI沉淀
溶解度与溶度积 联系:溶度积与溶解度均可表示难溶电解质的溶解性,两者之间可以相互换算。区别:溶度积是一个标准平衡常数,只与温度有关。而溶解度不仅与温度有关,还与系统的组成、 pH 值的改变及配合物的生成等因素有关。 在溶度积的计算中,离子浓度必须是物质的量的浓度,其单位为 而溶解度的单位有 g/100g 水, g·L-1, mol·L-1。计算时一般要先将难溶电解质的溶解度 S 的单位换算为 mol·L-1。对于难溶物质饱和溶液浓度极稀,可作近似处理: (xg/100gH2O)×10/M mol ·L-1。 几种类型的难溶物质溶度积、溶解度比较 物质类型难溶物质溶度积 Ksp 溶解度 /mol ·L-1 换算公式 AB AgCl 1.77 ×10-10 1.33 ×10-5 Ksp =S2 BaSO4 1.08 ×10-10 1.04 ×10-5 Ksp =S2 AB 2 CaF2 3.45 ×10-11 2.05 ×10-4 Ksp =4S3 A 2 B Ag 2CrO4 1.12 ×10-12 6.54 ×10-5 Ksp =4S3 对于同种类型化合物而言,Ksp , S 。 但对于不同种类型化合物之间,不能根据Ksp 来比较 S 的大小。 mol·L -1;
例 1、25℃时, AgCl 的溶解度为 1.92 ×10-3g ·L -1,求同温度下 AgCl 的溶度积。 例 2、25℃时,已知 Ksp(Ag 2 4 -12 4) -1 。 ×10 ,求同温度下 S(Ag 2 · CrO )=1.1 CrO /g L 例 3、查表知 PbI 2 的 Ksp 为 1.4 ×10-8,估计其溶解度 S(单位以 g ·L -1 计)。 溶度积规则 在难溶电解质溶液中,有关离子浓度幂的乘积称为浓度积,用符号 Q C 表 示 ,它表示任一条件下离子浓度幂的乘积。 Q C 和 Ksp 的表达形式类似,但其 含义不同。 Ksp 表示难溶电解质的饱和溶液中离子浓度幂的乘积, 仅是 Q C 的一 个特例。 对某一溶液,当 (1)Q C = Ksp ,表示溶液是饱和的。 这时溶液中的沉淀与溶解达到动态平衡, 既无沉淀析出又无沉淀溶解。 (2)Q C < Ksp ,表示溶液是不饱和的。溶液无沉淀析出, 若加入难溶电解质,则会继续溶解。 (3)Q C > Ksp ,表示溶液处于过饱和状态。有沉淀析出。 以上的关系称溶度积规则 (溶度积原理 ),是平衡移动规律总结,也是判断沉淀生成和溶解的依据。 当判断两种溶液混合后能否生成沉淀时,可按下列步骤进行: (1)先计算出混合后与沉淀有关的离子浓度; (2) 计算出浓度积 Qc ; (3) 将 Qc 与 Ksp 进行比较,判断沉淀能否生成。 溶度积规则的应用 (1)判断是否有沉淀生成 原则上只要 Qc >Ksp 便应该有沉淀产生,但是只有当溶液中含约 10-5g ·L -1 固体时,人眼才能观察到混浊现象, 故实际观察到有沉淀产生所需的离子浓度往往要比理论计算稍高些。 (2)判断沉淀的完全程度 没有一种沉淀反应是绝对完全的,通常认为溶液中某离子的浓度小于 -5 -1
初中物理公式 物理量计算公式备注 速度v= s / t 1m / s = 3.6 Km / h 声速v= 340m / 光速C = 3×10^8 m /s 密度ρ= m / V 1 g / cm^3 = 103 Kg / m 合力 F = F1 - F2 (F1、F2在同一直线线上且方向相反) F = F1 + F2 (F1、F2在同一直线线上且方向相同 ) 压强 p = F / S 适用于固、液、气 p =ρg h 适用于竖直固体柱和液体 浮力①F浮= G – F ②漂浮、悬浮:F浮= G ③F浮= G排=ρ液g V排 物体浮沉条件 ①F浮>G(ρ液>ρ物)上浮至漂 浮 ②F浮=G(ρ液=ρ物)悬浮 ③F浮<G(ρ液<ρ物)下沉杠杆平衡条件F1 *L1 = F2 *L 2 杠杆平衡条件也叫杠杆原理 滑轮组 F = G / n ( 理想滑轮组) F =(G动+ G物)/ n (忽略轮轴间的摩擦) η=G/ nF(实际情况n:作用在动滑轮上绳子股数) 功W = F S = P t 1J = 1N?m = 1W?s 功率P = W / t = Fv 1KW = 10^3 W,1MW = 10^3KW 有用功W有用= G h(竖直提升)= F S(水平移动)= W总– W额=ηW总额外功W额= W总– W有= G动h(忽略轮轴间摩擦)= f L(斜面) 总功W总= W有用+ W额= F S = W有用/ η 机械效率η= W有用/ W总 热量Q=cm(t-t°) 电流I=U/R 电功W=UIt =Pt 电功率P=W/t=UI =I2R=U2/R 串联电路I=I1=I2 电流处处相等 U = U 1+ U 2 干路电压等于各支路电压之和 R=R1+R2 总电阻等于的电阻之和
难溶电解质的标准溶度积常数表 难溶电解质的标准溶度积常数(18,25?) 难溶电解质难溶电解质溶度积溶度积名称化学式名称化学式 -9-17氟化钙CaF 5.3×10 氢氧化锌Zn(OH) 1.2×10 22-9-14氟化锶SrF 2.5×10 氢氧化镉 Cd(OH)(新?) 2.5×10 22-6-31氟化钡BaF 1.0×10 氢氧化铬 Cr(OH) 6.3×10 23-5-13二氯化铅PbCl 1.6×10 氢氧化亚锰Mn(OH) 1.9×10 22-6-16 氯化亚铜CuCl 1.2×10 氢氧化亚铁Fe(OH) 1.8×10 2-10-38氯化银 AgCl 1.8×10 氢氧化铁Fe(OH) 4×10 3-18-9氯化亚汞HgCl 1.3×10 碳酸钡 BaCO 5.4×10 223-9-4二碘化铅PbI 7.1×10 铬酸钙CaCrO 7.1×10 24-9-5溴化亚铜CuBr 5.3×10 铬酸锶SrCrO 2.2×10 4-13-102)溴化银AgBr 5.0×10 铬酸钡BaCrO 1.6×10 4-23-13溴化亚汞HgBr5.6×10 铬酸铅PbCrO 2.8×10 22 4-5-12二溴化铅PbBr 4.0×10 铬酸银AgCrO 1.1×10 224-17-7碘化银AgI 8.3×10 重铬酸银AgCrO 2.0×10 227-122)-15碘化亚铜CuI 1.1×10 硫化亚锰 MnS 1.4×10 -29-44碘化亚汞HgI 4.5×10 氢氧化钴Co(OH) 1.6×10 223-28-16硫化铅PbS 8.0×10 Co(OH)(粉红) 2×10 2氢氧化亚钴 -25-15硫化亚锡 SnS 1.0×10 Co(OH)(新?) 1.6×10 2-22-312) 三硫化二砷AsS 2.1×10 氯化氧铋BiOCl 1.8×10 23-93-142)三硫化二锑SbS 1.5×10 碱式氯化铅PbOHCl 2.0×10 232)-97-15三硫化二铋BiS 1×10 氢氧化镍Ni(OH) 2.0×10 232-48-6硫化亚铜CuS 2.5×10 硫酸钙CaSO 9.1×10 24-36-8硫化铜CuS 6.3×10 硫酸锶 SrSO 4.0×10 4-50-10硫化银AgS 6.3×10 硫酸钡BaSO 1.1×10 24-24-8α-ZnS 1.6×10 硫酸铅PbSO 1.6×10 4硫化锌 -22-5β-ZnS 2.5×10 硫酸银 AgSO 1.4×10 24-27-14硫化镉CdS 8.0×10 亚硫酸银AgSO 1.5×10 23-53-7HgS(红) 4.0×10 硫酸亚汞HgSO 7.4×10 24硫化汞 -52-8HgS(黑) 1.6×10 碳酸镁 MgCO 3.5×10 3-18-9硫化亚铁FeS 6.3×10 碳酸钙CaCO 2.8×10 3-21-10α-CoS 4.0×10 碳酸锶SrCO 1.1×10 3硫化钴 -25-52)β-CoS 2.0×10 草酸镁 MgCO 8.6×10 24-19-9α-NiS 3.2×10 草酸钙CaCO?HO 2.6×10 242-24-7硫化镍β-NiS 1.0×10 草酸钡BaCO 1.6×10 24-252)-5 草酸锶SrCO?HO 2.2×10 2.0×10,-NiS 242-33-7氢氧化铝 Al(OH)(无定形) 1.3×10 草酸亚铁 FeCO?2HO 3.2×10 3242-11-10氢氧化镁Mg(OH) 1.8×10 草酸铅PbCO 4.8×10 224-6-41 氢氧化钙Ca(OH) 5.5×10 六氰合铁(?)酸铁Fe[Fe(CN)]3.3×10 2463 -14-16氢氧化亚铜CuOH 1.0×10 六氰合铁(?)酸铜Cu[Fe(CN)] 1.3×10 26铁(?) -20-8 氢氧化铜Cu(OH) 2.2×10 碘酸铜Cu(IO) 7.4×10 232(?) -8氢氧化银 AgOH 2.0×10
学习情景五 硫酸钡溶度积常数的测定 学习要点 1、溶度积与溶解度 2、溶度积规则 3、影响多相离子平衡移动的因素 4、分步沉淀与沉淀分离法 链接 沉淀反应是一类广泛存在的反应,常用于对混合物的分离,在日常生活及生物技术的研究中有着重要作用。沉淀现象在工业生产中常用来提取物料,得到产品;在生物工程中常用于对发酵液的分离提纯,以得到生物制品。沉淀在日常保健中也有应用,如利用沉淀-溶解平衡原理可通过使用含氟牙膏来预防龋齿。 必备知识点一 溶度积规则 极性溶剂水分子和固体表面粒子相互作用,使溶质粒子脱离固体表面成为水合离子进入溶液的过程叫溶解。 溶液中水合离子在运动中相互碰撞重新结合成晶体从而成为固体状态并从溶液中析出的过程叫沉淀。 溶解和沉淀两个相互矛盾的过程使一对可逆反应在某一时刻(溶解与沉淀速率相等)达平衡状态,此平衡称为沉淀溶解平衡。 一、难溶电解质的溶度积常数 1、难溶电解质 在水中溶解度小于0.01g/100g 的电解质称为~。 如AgCl 的沉淀溶解平衡可表示为: ) aq (Cl )aq (Ag )s (AgCl -++?→← 平衡常数 2、溶度积 对于一般难溶电解质 )aq (nB )aq (mA )AmBm(s m n -++?→← K Ag Cl +-????=?????
平衡常数 一定温度下难溶电解质的饱和溶液中各组分离子浓度系数次幂的乘积为一常数,称为溶度积常数,简称溶度积;符号为K sp 。 沉淀溶解平衡是在未溶解固体与溶液中离子间建立的,溶液中离子是由已溶解的固体电离形成的。由于溶解的部分很少,故可以认为溶解部分可完全电离。 3、K sp 的物理意义 (1)K sp 的大小只与反应温度有关,而与难溶电解质的质量无关; (2)表达式中的浓度是平衡时离子的浓度,此时的溶液是饱和溶液; (3)由K sp 可以比较同种类型难溶电解质的溶解度的大小; 不同类型的难溶电解质不能用K sp 比较溶解度的大小。 对于AB 型难溶电解质: 对于A 2B 或AB 2型难溶电解质: 不同概念。 一定温度下饱和溶液的浓度,也就是该溶质在此温度下的溶解度。 溶解度s 的单位均为mol/L ,计算时注意单位换算,g/L=mol/L*g/mol 例1:已知25℃时,Ag 2CrO 4的溶解度是2.2×10-3g /100g 水,求K sp (Ag 2CrO 4)。 解: 2s s 三、溶度积规则 离子积:某难溶电解质的溶液中任一状态下有关离子浓度的乘积,用J i 表示。 [][]n m m n sp K A B +-=?s =()3θ θsp 4K s c =?()2θ sp K s =s =22442Ag CrO Ag CrO +-+223 4[][]4sp K Ag CrO S +-=?=33312122.210444291.410 1.110332s ---???=?=??=? ??? ()()()n m m n A B s mA aq nB aq +-+()()[][]m n n m m n m n m n sp K A B mS nS m n S +-+=?=?=?
电导法测定PbSO 4的溶度积 张玉 吴玲 一、实验目的 (1)掌握电导法测定难溶盐溶解度的原理和方法; (2)掌握电导率仪的使用方法; (3)注意有毒物质的排放。 二、基本原理 难溶电解质在水中会建立一种特殊的动态平衡。尽管难溶电解质无法溶解, 但仍有一部分阴阳离子进入溶液, 当这两个过程的速率相等时, 难溶电解质的溶解就达到平衡状态, 这样的平衡状态叫沉淀溶解平衡, 其平衡常数叫溶度积。在一定温度下, 一种难溶电解质的饱和溶液中形成一种多相离子平衡, 可表示为: AmBn( s) ? nAm+ ( aq) + mBn- ( aq) K sp= αn (Am+ ) αm ( Bn- ) K sp 称为溶度积常数, 简称溶度积。若能测出难溶电解质的饱和溶液中相应离子浓度, 就可计算出溶度积。难溶盐的饱和溶液浓度很低,可以把浓度当做活度处理,即c ≈α,所以: K sp= cn (Am+ ) cm ( Bn- ) 难溶盐PbSO 4在其饱和溶液中存在如下溶解平衡: PbSO 4(s )?Pb 2+(aq )+ SO 42-(aq ) 其溶度积为: K sp= c (Pb 2+ ) c (SO 42-)=c (PbSO 4) 本实验采用电导法测定PbSO 4的溶度积,惠斯顿电桥 G K G A L L A G cell ?=?=?? =κκ 由电导率仪测出:O H pbso pbso 244κκκ-=溶液 由离子独立移动定律,查表计算:
)]2 1()21([2)(24244 - ∞+∞∞+=≈so pb pbso m m m pbso λλλλ 4 4)(3pbso pbso m m ol C λκ=?- 或 4 4 1000)(3pbso pbso dm mol C λκ?=?- 所以: K sp=c 2(mol.m -3) 因温度对溶液的电导有影响,本实验在恒温下测定。电导测定不仅可以用来测定硫酸铅、硫酸钡、氯化银、碘酸银等难溶盐的溶解度,还可以测定弱电解质的电离度和电离常数,盐的水解度等。 三、实验仪器与试剂 (1)仪器 电导率仪1台,恒温水浴装置1套,滤纸若干,洗瓶1只,烧杯若干,玻璃棒一根。 (2)试剂 KCl 标准溶液(0.1mol/L),硝酸铅固体试样,去离子水。 四、实验步骤 (1)将恒温水浴温度调至25℃。 (2)制备PbSO 4饱和溶液 准确称取PbSO 4固体试样0.0045g (最好稍微过量一点),放入250ml 烧杯中,用100ml 容量瓶取100ml 去离子水加入烧杯中,放入恒温槽中恒温并用玻璃棒搅拌溶解(由于PbSO 4很难溶解,必要时用电炉加热溶解)。 (3)测定电导池常数k cell 取适量配置好的0.1mol/L KCl 标准溶液,在恒温槽中恒温10分钟后,用电导率仪测其电导率,重复三次。 (4)测定电导水的的电导率 调节好电导率仪的电导池常数k cell ,将电极和电导池用电导水洗干净并擦干,然后测电导水的电导率,重复三次。 (5)测定PbSO 4饱和溶液的电导率
沉淀溶解平衡 沉淀溶解平衡 在一定温度下难溶电解质晶体与溶解在溶液中的离子之间存在溶解和结晶的平衡,称作多项离子平衡,也称为沉淀溶解平衡。 以AgCl为例,尽管AgCl在水中溶解度很小,但并不是完全不溶解。 从固体溶解平衡角度认识:AgCl在溶液中存在下属两个过程: ①在水分子作用下,少量Ag+和Cl-脱离AgCl表面溶入水中; ②溶液中的Ag+和Cl-受AgCl表面正负离子的吸引,回到AgCl表面,析出沉淀。 在一定温度下,当沉淀溶解和沉淀生成的速率相等时,得到AgCl的饱和溶液,即建立下列动态平衡: AgCl(s)<=> Ag+(aq)+ Cl-(aq) 溶解平衡的特点是动态平衡,即溶解速率等于结晶速率,且不等于零。 其平衡常数Ksp称为溶解平衡常数;它只是温度的函数,即一定温度下Ksp一定。溶解度和物质溶解性的划分 中学里介绍过把某温度下100克水里某物质溶解的最大克数叫溶解度.。习惯上把溶解度小于0.01g/100g 水的物质叫“难溶物”。其实,从相平衡的角度理解溶解度更确切,即在一定温度和压力下,固液达到平衡时的状态。这时把饱和溶液里的物质浓度称为“溶解度”,常用S(mol/L)表示. 极性溶剂水分子和固体表面粒子(离子或极性分子)相互作用,使溶质粒子脱离固体表面成为水合离子进入溶液的过程叫溶解。溶液中水合离子在运动中相互碰撞重新结合成晶体从而成为固体状态并从溶液中析出的过程叫沉淀。溶解、沉淀两个相互矛盾的过程是一对可逆反应,存在平衡状态,此平衡称为沉淀溶解平衡。 在科研和生产过程中,经常要利用沉淀反应制取难溶化合物或抑制生成难溶化合物,以鉴定或分离某些离子。究竟如何利用沉淀反应才能使沉淀能够生成并沉淀完全、或将沉淀溶解、转化,这些问题要涉及到难溶电解质的沉淀和溶解平衡。本节将对此进行讨论。
Fundamental Physical Constants—Complete Listing Relative std. Quantity Symbol Value Unit uncert.u r UNIVERSAL speed of light in vacuum c,c029*******m s?1(exact) magnetic constantμ04π×10?7N A?2 =12.566370614...×10?7N A?2(exact) electric constant1/μ0c2ε08.854187817...×10?12F m?1(exact) characteristic impedance of vacuum μ0/ 0=μ0c Z0376.730313461...?(exact) Newtonian constant of gravitation G6.673(10)×10?11m3kg?1s?21.5×10?3 G/ˉh c6.707(10)×10?39(GeV/c2)?21.5×10?3 Planck constant h6.62606876(52)×10?34J s7.8×10?8 in eV s4.13566727(16)×10?15eV s3.9×10?8 h/2πˉh1.054571596(82)×10?34J s7.8×10?8 in eV s6.58211889(26)×10?16eV s3.9×10?8 Planck mass(ˉh c/G)1/2m P2.1767(16)×10?8kg7.5×10?4 Planck lengthˉh/m P c=(ˉh G/c3)1/2l P1.6160(12)×10?35m7.5×10?4 Planck time l P/c=(ˉh G/c5)1/2t P5.3906(40)×10?44s7.5×10?4 ELECTROMAGNETIC elementary charge e1.602176462(63)×10?19C3.9×10?8 e/h2.417989491(95)×1014A J?13.9×10?8 magnetic?ux quantum h/2eΦ02.067833636(81)×10?15Wb3.9×10?8 conductance quantum2e2/h G07.748091696(28)×10?5S3.7×10?9 inverse of conductance quantum G?1012906.403786(47)?3.7×10?9 Josephson constant a2e/h K J483597.898(19)×109Hz V?13.9×10?8 von Klitzing constant b h/e2=μ0c/2αR K25812.807572(95)?3.7×10?9 Bohr magneton eˉh/2m eμB927.400899(37)×10?26J T?14.0×10?8 in eV T?15.788381749(43)×10?5eV T?17.3×10?9 μB/h13.99624624(56)×109Hz T?14.0×10?8 μB/hc46.6864521(19)m?1T?14.0×10?8 μB/k0.6717131(12)K T?11.7×10?6 nuclear magneton eˉh/2m pμN5.05078317(20)×10?27J T?14.0×10?8 in eV T?13.152451238(24)×10?8eV T?17.6×10?9 μN/h7.62259396(31)MHz T?14.0×10?8 μN/hc2.54262366(10)×10?2m?1T?14.0×10?8 μN/k3.6582638(64)×10?4K T?11.7×10?6 ATOMIC AND NUCLEAR General ?ne-structure constant e2/4π 0ˉh cα7.297352533(27)×10?33.7×10?9 inverse?ne-structure constantα?1137.03599976(50)3.7×10?9
第三章第四节难溶电解质的溶解平衡—难溶电解质的溶度积常数 【学习目标】1.正确理解和掌握溶度积K sp的概念,熟知溶度积常数的应用 2.能应用溶度积常数K sp进行相关的计算。 【学习重、难点】能应用溶度积常数K sp进行相关的计算。 【知识梳理】 一、难溶电解质的溶度积常数(K sp) 1.概念: 一定温度下,难溶电解质在溶液中达到沉淀溶解平衡状态时,各离子浓度保持不变,该沉淀溶解平衡的平衡常数称之为溶度积常数,简称,用表示。 2.表达式: 对于沉淀溶解平衡M m A n mM n+(aq)+nA m-(aq), 参照电离平衡原理得平衡常数:K sp = 3.影响因素: (1)K sp只与难溶电解质的性质和有关,而与沉淀的量和溶液中的离子浓度无关。并且溶液中的离子浓度的变化能使平衡移动,并不改变K sp。 (2)对于大部分溶解平衡,升高温度,平衡向移动,K sp,Ca(OH)2除外。4.意义: K sp反映了难溶电解质在水中的溶解能力,当化学式所表示的阴、阳离子个数比相同时,K sp越大的难溶电解质在水中的溶解能力相对越强,溶解度。但对化学式所表示的组成中阴、阳离子个数比不相同的电解质,则不能直接由它们的溶度积来比较溶解能力的大小,必须通过具体计算确定。下表是几种难溶电解质的溶度积以及溶解能力的比较: 沉淀溶解平衡K sp(18~25℃)溶解能力比较 AgCl(s)Cl-(aq)+Ag+(aq) 1.8×10 -10mol2. L-2 AgCl> AgBr > AgI AgBr(s)Br-(aq)+Ag+(aq) 5.0×10 -13mol2.L-2 AgI(s)I-(aq)+Ag+(aq)8.3×10 -17mol2.L-2 Mg(OH)2(s)Mg 2+(aq)+2OH-(aq)1.8×10-11mol3.L-3Mg(OH) 2 > Cu(OH)2 Cu(OH)2(s)Cu 2+(aq)+2OH-(aq)2.2×10 -20mol3.L-3 5.应用—溶度积规则: 比较K sp与溶液中有关离子浓度幂的乘积(离子积Q c)判断难溶电解质在给定条件下沉淀能否生成或溶解。 ①Qc>K sp:溶液过饱和,有析出;
溶度积表 溶度积表 化合物化学式温度K sp 来源 无水氢氧化铝Al(OH) 3 20°C 1.9×10–33L 无水氢氧化铝Al(OH) 325°C3×10–34w 1 三水合氢氧化铝Al(OH) 3 20°C4×10–13C 三水合氧化铝Al(OH) 3 25°C 3.7×10–13C 磷酸铝AlPO 425°C9.84×10–21w 1 溴酸钡Ba(BrO 3) 2 25°C 2.43×10–4w 1 碳酸钡BaCO 3 16°C7×10–9C,L 碳酸钡BaCO 3 25°C8.1×10–9C,L 铬酸钡BaCrO 4 28°C 2.4×10–10C,L 氟化钡BaF 2 25.8°C 1.73×10–6C,L 二水合碘酸钡Ba(IO 3) 2 25°C 6.5×10–10C,L 二水合草酸钡BaC 2O 4 18°C 1.2×10–7C,L 硫酸钡BaSO 4 18°C0.87×10–10C,L 硫酸钡BaSO 4 25°C 1.08×10–10C,L 硫酸钡BaSO 4 50°C 1.98×10–10C,L 氢氧化铍Be(OH) 225°C 6.92×10–22w 1 碳酸镉CdCO 325°C 1.0×10–12w 1 氢氧化镉Cd(OH) 225°C7.2×10–15w 1 三水合草酸镉CdC 2O 4 18°C 1.53×10–8C,L 磷酸镉Cd 3(PO 4 )225°C 2.53×10–33w 1 硫化镉CdS18°C 3.6×10–29C,L 碳酸钙(方解石)CaCO 3 15°C0.99×10–8C,L 碳酸钙(方解石)CaCO 3 25°C0.87×10–8C,L 碳酸钙(方解石)CaCO 3 18-25°C 4.8×10–9P 铬酸钙CaCrO 4 18°C 2.3×10–2L 氟化钙CaF 2 18°C 3.4×10–11C,L 氟化钙CaF 2 25°C 3.95×10–11C,L 氢氧化钙Ca(OH) 2 18°C-25°C8×10–6P 氢氧化钙Ca(OH) 225°C 5.02×10–6w 1
常用物理常数表 光速 101099792458.2×=c cm sec -1 万有引力常数 81067259.6?×=G dyn cm -2 g -2 普朗克常数 27106260.6?×=h erg sec 271005457266.12/?×==πh erg sec 玻尔兹曼常数 1610380662.1?×=k erg deg –1 里德堡常量 312.109737/2342==∞ch e m R e π cm -1 斯特藩—玻尔兹曼常数 51066956.5?×=σ erg cm -2 deg -4 sec -1 电子电量 101080325.4?×=e esu 1910602192.1?×= coulomb 电子质量 281010956.9?×=e m g 原子质量单位 2410660531.1?×=amu g 精细结构常数 0360.1372//12==e hc πα 第一玻尔轨道半径 82220105291775.04/?×==e m h a e π cm 经典电子半径 1322108179380.2/?×==c m e r e e cm 质子质量 2410672661.1?×=p m g 007276470.1= amu 中子质量 24 1067492.1?×=n m g 00866.1= amu 电子静止能量 5110034.02=c m e meV 常用天文常数表 地球质量 27 10976.5×=⊕M g 地球赤道半径 164.6378=⊕R km 地球表面重力 665.980=⊕g cm sec -2 天文单位 810495979.1×=AU km 1光年 ly = 9.460×1012 km 1秒差距 pc= 3.084×1013 km=3.262ly 千秒差距 kpc=1000pc 地月距离 3.8×105 km 太阳到冥王星的平均距离 5.91×109km 最近的恒星(除太阳)的距离 4×1013km =1.31pc= 4.3ly 太阳到银心的距离 2.4×1017km=8kpc 太阳质量 M ⊙ 3310989.1×= g 太阳半径 R ⊙10109599.6×=cm 太阳光度 L ⊙33 10826.3×= erg sec -1
溶度积与溶度积规则 一、溶度积定义:在一定条件下,难溶强电解质)(s B A n m 溶于水形成饱和溶液时,在溶液中达到沉淀溶解平衡状态(动态平衡),各离子浓度保持不变(或一定),其离子浓度幂的乘积为一个常数,这个常数称之为溶度积常数,简称溶度积,用K SP 表示。 二、溶度积表达式: ) (s B A n m )()(aq nB aq mA m n -++ n m m n sp B c A c K )()(-+?= (适用对象:饱和溶液) ① sp K 只与温度有关,而与沉淀的量和溶液中的离子的浓度无关。 ② 一般来说,对同种类型难溶电解质(如AgCl 、AgBr 、AgI 、4BaSO ),sp K 越小,其溶解度越小,越易转化为沉淀。不同类型难溶电解质,不能根据sp K 比较溶解度的大小。 三、溶度积规则—离子积 在一定条件下,对于难溶强电解质) (s B A n m )()(aq nB aq mA m n -++在任一时刻都有 n m m n c B c A c Q )()(-+?= (适用对象:任一时刻的溶液) 可通过比较溶度积与溶液中有关离子浓度幂的乘积----离子积(c Q )的相对大小判断难溶电解质在给定条件下的沉淀生成或溶解情况: sp c K Q >,溶液过饱和,有沉淀析出,直至溶液饱和,达到新的平衡; sp c K Q =,溶液为饱和溶液,沉淀与溶解处于平衡状态; sp c K Q <,溶液未饱和,向沉淀溶解的方向进行,无沉淀析出,若加入过量难溶电解质,难溶 电解质溶解直至溶液饱和。 化学上通常认为残留在溶液中的离子浓度小于L mol 5101-?时,沉淀就达完全 (2011年浙江)13、海水中含有丰富的镁资源。某同学设计了从模拟海水中制备MgO 的实验方案: 溶液 NaOH L mol mL 0.10.1 3 .8250.10 =pH C L 模拟海水 过滤 ① 滤液M 沉淀物X .11=pH NaOH 调到固体 加 过滤 ② 滤液N 沉淀物Y MgO
化合物的溶度积常数表化合物 醋酸盐 **AgAc *AgBr *AgCl *AgI BaF2*CaF2*CuBr *CuCl *CuI *Hg 2Cl2*Hg 2I2HgI2PbBr2*PbCl2PbF2*PbI2SrF2Ag 2CO3*BaCO3CaCO3CdCO3*CuCO3FeCO3Hg 2CO3MgCO3MnCO3NiCO3*PbCO 31.94 × 10-3 卤化物 1.8 × 10-10 8.3 × 10-17 1.84 × 10-7 溶度积化合物
氢氧化物 *AgOH 2.0 × 10-8 *Al(OH) 3(无定形) 1.3 × 10-33 *Ca(OH)2*Cd(OH) 25.5 × 10-6 5.27 × 10-15 溶度积化合物 *CdS *CoS(α-型) *CoS(β-型) *Cu 2S *CuS *FeS *HgS(黑色) *HgS(红色) *MnS(晶形 )**NiS *PbS *SnS **SnS2**ZnS 磷酸盐 *Ag 3PO4*AlPO4*CaHPO4*Ca
3(PO 4)2**Cd 3(PO 4)2Cu 3(PO 4)2FePO 4·2H 2O 5.4 × 10-12 1.6 × 10-7 4× 10-9 4.43 × 10-10 3.2 × 10-7 4.83 × 10 1.70 × 10-7 8.51 × 10-10-溶6度积8.0 × 10-27 4.0 × 10-21 2.0 × 10-25 2.5 × 10-48 6.3 × 10-36
6.3 × 10-18 1.6 × 10-524 × 10-53 2.5 × 10-13 1.07 × 10-21 8.0 × 10-281 × 10-252 × 10-27 2.93 × 10-25 1.4 × 10-16 6.3 × 10-191 × 10-7 2.0 × 10-29 2.53 × 10-33 1.40 × 10-37 9.91 × 10-16 2.5 × 10-13 1.04 × 10-24 8.0 × 10-43 9.0 × 10-33 7.2 × 10-11 1.6 × 10 1.3 × 10-16 1.03 × 10-12-41 5.0 × 10-13*Be(OH)
溶度积的计算
————————————————————————————————作者: ————————————————————————————————日期:
学习情景五 硫酸钡溶度积常数的测定 学习要点 1、溶度积与溶解度 2、溶度积规则 3、影响多相离子平衡移动的因素 4、分步沉淀与沉淀分离法 链接 沉淀反应是一类广泛存在的反应,常用于对混合物的分离,在日常生活及生物技术的研究中有着重要作用。沉淀现象在工业生产中常用来提取物料,得到产品;在生物工程中常用于对发酵液的分离提纯,以得到生物制品。沉淀在日常保健中也有应用,如利用沉淀-溶解平衡原理可通过使用含氟牙膏来预防龋齿。 必备知识点一 溶度积规则 极性溶剂水分子和固体表面粒子相互作用,使溶质粒子脱离固体表面成为水合离子进入溶液的过程叫溶解。 溶液中水合离子在运动中相互碰撞重新结合成晶体从而成为固体状态并从溶液中析出的过程叫沉淀。 溶解和沉淀两个相互矛盾的过程使一对可逆反应在某一时刻(溶解与沉淀速率相等)达平衡状态,此平衡称为沉淀溶解平衡。 一、难溶电解质的溶度积常数 1、难溶电解质 在水中溶解度小于0.01g/100g 的电解质称为~。 如A gCl 的沉淀溶解平衡可表示为: )aq (Cl )aq (Ag )s (AgCl -++?→← 平衡常数 2、溶度积 对于一般难溶电解质 K Ag Cl +-???? =?????
)aq (nB )aq (mA )AmBm(s m n -++?→← 平衡常数 一定温度下难溶电解质的饱和溶液中各组分离子浓度系数次幂的乘积为一常数,称为溶度积常数,简称溶度积;符号为K s p。 沉淀溶解平衡是在未溶解固体与溶液中离子间建立的,溶液中离子是由已溶解的固体电离形成的。由于溶解的部分很少,故可以认为溶解部分可完全电离。 3、K s p的物理意义 (1)K sp 的大小只与反应温度有关,而与难溶电解质的质量无关; (2)表达式中的浓度是平衡时离子的浓度,此时的溶液是饱和溶液; (3)由K sp 可以比较同种类型难溶电解质的溶解度的大小; 不同类型的难溶电解质不能用K sp 比较溶解度的大小。 对于AB 型难溶电解质: 对于A 2B 或AB 2型难溶电解质: 溶度积与溶解度都可以表示物质的溶解能力,但它们是既有区别又有联系的不同概念。 一定温度下饱和溶液的浓度,也就是该溶质在此温度下的溶解度。 溶解度s 的单位均为m ol/L,计算时注意单位换算,g /L=mol/L*g/mol 例1:已知25℃时,Ag 2C rO 4的溶解度是2.2×10-3g /100g 水,求K sp (A g2CrO 4)。 解: 2s s [][]n m m n sp K A B +-=?θ θ2 sp ()s K c =() 3 θ θsp 4K s c =?() 2 θ sp K s =θsp 3 4 K s = 2244 2Ag CrO Ag CrO +- +223 4[][]4sp K Ag CrO S +- =?=3 3 312122.210444291.410 1.110 332s ---???=?=??=? ??? ()()() n m m n A B s mA aq nB aq +-+()()[][]m n n m m n m n m n sp K A B mS nS m n S +-+=?=?=?